Method Article
Un saggio di colorazione nucleare differenziale automatizzato per una determinazione accurata della citotossicità mitocana
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Il protocollo descrive un saggio rapido, ad alta produttività, affidabile, economico e imparziale per determinare in modo efficiente la vitalità cellulare. Questo saggio è particolarmente utile quando i mitocondri delle cellule sono stati danneggiati, il che interferisce con altri saggi. Il saggio utilizza il conteggio automatizzato delle celle macchiate con due coloranti nucleari: Hoechst 33342 e propidium ioduro.
Abstract
Il contributo dei mitocondri alla trasformazione oncogenica è oggetto di ampio interesse e studio attivo. Man mano che il campo del metabolismo del cancro diventa più complesso, l'obiettivo di colpire i mitocondri usando vari composti che infliggono danni mitocondriali (i cosiddetti mitocani) sta diventando abbastanza popolare. Sfortunatamente, molti saggi di citotossicità esistenti, come quelli a base di sali di tetrazolio o resazurina richiedono enzimi mitocondriali funzionali per le loro prestazioni. Il danno inflitto dai composti che prendono di mira i mitocondri spesso compromette l'accuratezza di questi saggi. Qui descriviamo un protocollo modificato basato sulla colorazione differenziale con due coloranti fluorescenti, uno dei quali è permeante alle cellule (Hoechst 33342) e l'altro non lo è (ioduro di propidio). La differenza di colorazione consente di discriminare le cellule vive e morte. Il saggio è suscettibile alla microscopia automatizzata e all'analisi delle immagini, che aumenta la produttività e riduce la distorsione. Ciò consente anche di utilizzare il saggio in modo ad alta produttività utilizzando piastre a 96 pozzi, rendendolo un'opzione praticabile per gli sforzi di scoperta di farmaci, in particolare quando i farmaci in questione hanno un certo livello di mitotossicità. È importante sottolineare che i risultati ottenuti dal saggio di colorazione Hoechst/PI mostrano una maggiore consistenza, sia con i risultati dell'esclusione blu del tripano che tra le repliche biologiche quando il saggio viene confrontato con altri metodi.
Introduzione
Il primo passo per identificare trattamenti efficaci contro il cancro è la selezione di un test di citotossicità robusto e imparziale che può essere utilizzato per esaminare l'effetto del trattamento. Una scelta comune per esperimenti a bassa produttività è l'esclusione del colorante blu tripano dalle cellule viventi. Questo metodo è favorito perché consente un metodo relativamente imparziale per quantificare la sopravvivenza cellulare. trypan blue si diffonde passivamente in cellule le cui membrane sono compromesse, ma è effettivamente impedito di entrare nelle cellule sane1. Il quoziente delle cellule viventi e delle cellule totali rappresenta la vitalità percentuale, che indica l'efficacia del trattamento. Lo svantaggio più significativo del test blu del trypan è che è poco adatto per metodologie ad alta produttività. Ha un rapporto segnale-rumore relativamente basso e la colorazione prolungata può causare artefatti a causa della colorazione di cellule vitali. Di conseguenza, l'esclusione blu trypan è in genere, ma nonsempre 2, relegata al conteggio manuale. Questo lo rende troppo lento e introduce la forte possibilità di parzialità a causa del giudizio soggettivo del ricercatore (a meno che non vengano utilizzati conteggi accecante o indipendenti, che riducono ulteriormente la produttività del laboratorio). In generale, la produttività di questo saggio è insufficiente per la moderna scoperta di farmaci.
I test di fattibilità, che generalmente hanno una produttività molto più elevata, consentono ai ricercatori di aggirare questa limitazione, ma sono disponibili con avvertenze significative (vedi tabella 1). Questi metodi generalmente si suddividono in due gruppi. Un gruppo è composto da saggi colorimetrici basati sulla funzione degli enzimi redox cellulari. I substrati incolori o non fluorescenti vengono convertiti in prodotti vibranti quantificabili utilizzando uno spettrofotometro. Esempi classici includono sali di tetrazolio (MTT, WST-1, XTT, ecc.) e resazurina. Questa categoria include anche test luminescenti che utilizzano luciferina per valutare il livello ATP. Saggi di questo tipo hanno la limitazione sottostante che stanno misurando il metabolismo cellulare, che non è la vitalità cellulare di per sé. È abbastanza comune che le cellule diventino quiescenti in condizioni avverse, ma mantengano comunque la capacità didividere 3,4,5. Ad esempio, le cellule staminali tumorali sono spesso relativamente metabolicamente quiescenti6,7,8,9e sono probabilmente difficili da saggiare utilizzando queste tecniche. Anche l'efficacia dei trattamenti che danneggiano la funzione mitocondriale, come la maggior parte dei mitocani, è probabile che sia significativamente sopravvalutata.
Una metodologia alternativa sfrutta le proprietà chimiche di varie sostanze che consentono loro di attraversare o meno membrane biologiche. Un esempio sono le macchie nucleari come SYTOX o propidium iodide (PI). Questa categoria comprende anche saggi simili nel concetto ma diversi nella funzione, come il saggio lattato deidrogenasi (LDH), che misura il rilascio di LDH nell'ambiente extracellulare come indicatore della necrosi cellulare (Figura 1, Tabella 1). Questi test sono più in grado di distinguere tra cellule metabolicamente inattive e morte.
| Saggio/colorante | Tipi di morte cellulare rilevati | Attrezzature necessarie | Caratteristiche principali |
| MTT, CKK-8, Alamar Blue (resazurina) | Apoptosi/Necrosi | Spettrofotometro | Economico, rapido; test dell'endpoint; dipende dall'attività degli enzimi (esclusivamente mitocondriale in caso di MTT) e non discrimina tra i modi di morte cellulare1,10 |
| Versione LDH | Necrosi | Spettrofotometro | Rapido, indipendente dall'attività degli enzimi mitocondriali; costoso per i test ad alta produttività; rileva cellule necrotiche con membrana plasmatica compromessa11,12 |
| Trypan Blue (TB) | Apoptosi/Necrosi | Microscopio | Impermeente cellulare; non discrimina tra le modalità di morte cellulare; laborioso e non adatto per lo screening ad alta produttività; più difficile da usare con le cellule aderenti; soggetto a giudizio soggettivo dell'utente, ma è considerato il metodo standard di misurazione della vitalità cellulare13 |
| Arancia acridina (AO) | Apoptosi/Necrosi/ | Microscopio a fluorescenza | Un colorante acido nucleico con proprietà spettrali uniche, può distinguere tra apoptosi e necrosi/necrotosi14 |
| Necroptosi | |||
| Hoechst 33342 | Apoptosi | Microscopio a fluorescenza o citometro a flusso | Permeabile alle cellule; inappropriato da solo per monitorare la morte cellulare; utile per la co-colorazione; può essere usato per valutare la condensazione della cromatina e la frammentazione dei nuclei nell'apoptosi precoce; può essere abbinato allo ioduro di propidio per distinguere l'apoptosi dallanecrosi 15,16 |
| Ioduro di propidio (PI) | Apoptosi tardiva/Necrosi | Microscopio a fluorescenza o citometro a flusso | Intercalatore impermeante cellulare; rileva sia l'apoptosi tardiva che i modi di necrosi della mortecellulare 17. Tossico e permeabile dopo lunghe incubazioni per18 |
La tabella 1. Lista di test di citotossicità. I test di citotossicità, alcuni dei quali sono stati utilizzati in questo studio, elencati insieme alla breve descrizione delle loro caratteristiche chiave.
Recenti studi hanno dimostrato che il metabolismo mitocondriale è alterato in alcuni tumori19,20,21,22,23,24,25. Ad esempio, le leucemie mieloidi acute (AML) hanno dimostrato di aregolare la loro massa mitocondriale, il contenuto di MTDNA e la respirazione mitocondriale per soddisfare il loro fabbisognoenergetico 19,26,27. D'altra parte, alcuni tumori solidi sono caratterizzati da disfunzione mitocondriale, o meglio "riprogrammazione metabolica", come la deregolamentazione delle proteine mitocondriali coinvolte in OXPHOS o la diminuzione del contenuto di mtDNA, che è stata associata all'invasività tumorale, al potenziale metastatico e alla resistenza ai farmaci che inducono l'apoptosi28,29. Inoltre, recentemente, c'è stato un maggiore interesse nell'uso di composti meccanisticamente diversi che influenzano la funzione mitocondriale (generalmente chiamata mitocani30), come potenziali terapie per particolari tumori. Questi farmaci prendono di mira la sintesi di ATP, il DNA mitocondriale, OXPHOS e la produzione di ROS, nonché proteine pro-apoptotiche e anti-apoptotiche associate ai mitocondri30,31. Diversi studi hanno dimostrato che questo approccio ha una promessasignificativa 19,32,33,34. Tuttavia, queste deviazioni metaboliche nella biologia delle cellule tumorali o nei trattamenti mirati ai mitocondri possono influenzare significativamente i test di vitalità convenzionali basati sulla funzionalità mitocondriale.
Qui viene descritto un protocollo ottimizzato per un saggio differenziale di colorazione nucleare. Il protocollo consente una determinazione rapida e accurata della citotossicità dei mitocani o delle loro combinazioni con altri composti. Hoechst 33342 è un colorante nucleare permeante alle cellule che attraversa facilmente le membrane cellulari per macchiare il DNA, permettendo di ottenere il conteggio totale delle cellule. Co-colorazione con PI, che entra solo nei nuclei di cellule morte, la proporzione di cellule viventi (solo Hoechst) e morte (macchiate con entrambe) cellule può essere determinata con precisione. Questo protocollo affina il saggiopubblicato 35 aggiungendo un passo per l'ottimizzazione della concentrazione di colorante (incrociando i risultati con metodo blu trypan ortogonale) e la centrifugazione della piastra prima dell'imaging. Poiché molte linee cellulari sono semi-aderenti o sospese, la centrifugazione aumenta la proporzione di celle che vengono immagini e migliora fortemente la precisione. Il saggio ha diversi vantaggi, tra cui quella colorazione non richiede la rimozione dei supporti o il lavaggio. La miscela di coloranti è anche economica, facile da preparare e compatibile con i sistemi di pipettazione multicanale / robotica.
Dopo che le celle sono state macchiate, vengono immagini con un microscopio automatizzato. Questo ha l'ulteriore vantaggio di creare una registrazione permanente delle immagini che possono essere ri-analizzate in seguito e gli effetti di particolari composti possono essere rivalutazioneti mediante l'ispezione visiva delle immagini acquisite. Una volta ottenute le immagini, le celle possono essere conteggiate manualmente o utilizzando uno dei diversi pacchetti software, inclusi sia software gratuiti (ad esempio, ImageJ, CellProfiler, ecc.) che commerciali (ad esempio, Metamorph, Gen5, ecc.). Il conteggio automatico delle celle è generalmente preferibile poiché le pipeline automatizzate di conteggio delle celle adeguatamente sviluppate sono più accurate e meno distorte rispetto al conteggio manuale. Ignorano anche in modo più efficace i detriti cellulari o i complessi insolubili. Lo sviluppo di queste tubazioni è generalmente semplice ed è semplificato dall'efficienza delle macchie utilizzate. L'output è quantitativo poiché il numero effettivo di celle morte viene calcolato automaticamente rispetto al numero totale di celle e possono essere applicate soglie diverse per aumentare o diminuire il rigore delrilevamento 35. Per comodità, sono inclusi parametri ottimizzati per il conteggio delle celle che utilizzano il lettore multi-modalità Cytation 5 Cell Imaging compatibile con il software Gen5 v. 3.00.
Protocollo
1. Test di citotossicità: installazione
- Preparare soluzioni di composti di interesse alle concentrazioni desiderate nei mezzi appropriati (senza siero o 1, 2,5 o 5% FBS RPMI-1640).
- Per misurare la citotossicità di un singolo composto (ad esempio, per determinare dosi efficaci), preparare composti a concentrazione finale 2x.
- Per misurare la citotossicità delle combinazioni di composti, preparare composti a concentrazione finale 4x.
- Preparare controlli solo con solvente mescolando la stessa quantità di solvente con il mezzo appropriato. Ad esempio, se i composti di prova sciolti in DMSO e metanolo, effettuare un controllo solo con solvente per ogni solvente.
- Raccogliere le cellule dal piatto di coltura o dal pallone in un tubo conico da 15 ml.
- Trasferire 10 μL di sospensione cellulare in un tubo di microcentrifugo e macchiare con 10 μL 0,4% di trypan blu. Utilizzare un emocitometro per contare cellule vitali e non vitali per ogni sorgente cellulare.
- Celle a pellet a 200 g per 5 min. Aspirato o decantante supernatante.
- Resuspend cell pellet in mezzi appropriati per il dosaggio (senza siero o 1, 2,5, 5% FBS RPMI-1640) ad una densità cellulare di 3*105 celle/mL.
NOTA 1: La densità cellulare di 3*105 celle/mL fornisce una densità di semina di 15.000 cellule/pozzo. La densità di semina è un parametro importante e idealmente dovrebbe essere prede definita prima dell'esperimento. La densità di semina dovrebbe tenere conto di 1) dimensione cellulare - di solito le cellule più grandi vengono sementi a una densità inferiore; 2) durata del trattamento - le cellule sono tipicamente sementi a una densità inferiore per esperimenti che dureranno più a lungo; e 3) velocità di divisione cellulare - le cellule con un più alto tasso di divisione sono sementi ad una densità inferiore. Esempi specifici di densità di semina ottimizzate: cellule K562, più grandi, durata 24 ore - 10.000 cellule / pozzo; Cellule MOLM-13, dimensioni moderate, trattamento di 24 ore - 15.000 /pozzo; Cellule MOLM-13, trattamento di 48 ore – 8.000/pozzo; piccole cellule mononucleari sane del sangue periferico (PBPC), trattamento di 24 ore – 50.000/pozzo; cellule AML primarie, trattamento 24 ore su 24 - 15.000-20.000/pozzo.
NOTA 2: La presenza di FBS nei media può influenzare l'attività dei composti. Ridurre la concentrazione di FBS può semplificare l'interpretazione dei risultati dei test, ma riduce anche l'accuratezza fisiologica. - Seme 50 μL di sospensione cellulare dal passo 1.5 in ogni pozzo di una piastra da 96 potte utilizzando una pipetta multicanale.
- Aggiungere composti come segue:
- Per i test composti singoli, aggiungere 50 μL di soluzione composta 2x in ogni pozzo. Per i pozzi di controllo del solvente, aggiungere 50 μL di mezzi di prova contenenti il solvente alla concentrazione 2x.
- Per i test combinati, aggiungere 25 μL di ciascuno dei composti (soluzioni 4x) in ogni pozzo. Per i singoli pozzi di controllo composto, aggiungere 25 μL di soluzione composta 4x e 25 μL di mezzo di prova. Per i pozzi di controllo del solvente, aggiungere 50 μL di mezzo di prova o mezzo di prova contenente il solvente.
NOTA 1: La concentrazione finale di DMSO non deve superare lo 0,5%.
NOTA 2: Si consiglia di aggiungere il supporto contenente i composti con la pipetta che tocca la parete di ogni pozzo a causa del basso volume.
- Toccare delicatamente la piastra per garantire la miscelazione del contenuto dei pozzi.
- Incubare le piastre a 37 °C in un'atmosfera umidificata del 5% di CO2 per un tempo appropriato, ad esempio 24 ore su 24.
2. Test di citotossicità: colorazione con Hoechst 33342 e ioduro di propidio
- Preparare una soluzione di colorazione 10x. Questa soluzione deve essere preparata fresco prima di ogni esperimento, non può essere conservata. Le concentrazioni finali di colorante devono essere determinate prima dell'esperimento.
- Per le linee cellulari della leucemia e le cellule primarie di leucemia, 1 mL di tampone di colorazione 10x contiene 10 μL di 20 mM Hoechst 33342 e 50 μL di 1 mg/mL di propididio ioduro in PBS sterile (concentrazioni finali: Hoechst 33342 20 μM, PI 5 μg/mL).
- Per i PBBC sani, 1 mL di tampone di colorazione 10x contiene 10 μL di 20 mM Hoechst 33342 e 10 μL di 1 mg/mL di propididio ioduro in PBS sterile (concentrazioni finali: Hoechst 33342 20 μM, PI 1 μg/mL).
NOTA: La concentrazione finale di ioduro di propidio deve essere determinata prima degli esperimenti. Le cellule devono essere testate utilizzando una gamma di concentrazioni di PI (1, 2,5, 5 μg/mL), quindi la vitalità calcolata da Hoechst/PI deve essere confrontata con la vitalità misurata tramite tripano blu. Le concentrazioni pi sopra elencate sono state scelte in base alla vitalità delle cellule bersaglio nei pozzi di controllo dei supporti (superiore a ~ 90% per le linee cellulari di leucemia, superiore a ~ 70% per i PBPC sani).
ATTENZIONE: Hoechst 33342 e propidio ioduro sono potenziali cancerogeni. Indossare dispositivi di protezione individuale appropriati durante la loro manipolazione.
- Dopo l'incubazione, utilizzare una pipetta multicanale per aggiungere 10 μL di tampone di colorazione 10x a ciascun pozzo.
NOTA: Per evitare la contaminazione incrociata, assicurarsi che le punte delle pipette non tocchino il supporto. - Toccare delicatamente il piatto per mescolare e cancellare le bolle. Macchia a 37 °C per 15 min.
- Centrifugare la piastra a 200 g per 4 minuti per portare tutte le cellule sul fondo della piastra. Pulire con cura il fondo della piastra con un kimwipe umido per rimuovere fibre e / o detriti che interferiranno con l'imaging.
NOTA 1: La centrifugazione della piastra garantisce le maggiori possibilità che tutte le cellule siano catturate nell'immagine. Spesso le cellule morte si staccano e galleggiano, fornendo valori fuorvianti di citotossicità. La centrifugazione attenua questo effetto.
NOTA 2: La piastra deve essere stampata il più rapidamente possibile dopo la centrifugazione, idealmente, entro 15 minuti. La centrifugazione può ridurre la selettività della colorazione PI e può consentire alle cellule di accumulare lentamente ioduro di propidio. Il miglioramento della precisione ottenuto visualizzando le cellule morte supera il leggero aumento della colorazione PI. Si consiglia di completare l'imaging entro 1 h dalla centrifugazione.
3. Test di citotossicità: acquisizione dei dati
- Impostare il software per l'imager automatizzato microscopio/piastra per rilevare la fluorescenza sia per hoechst 33342 (eccitazione massima 350 nm, emissione massima 461 nm) che PI (eccitazione massima 493 nm, emissione massima 636 nm). Acquisire immagini per ogni pozzo in entrambi i canali.
- Utilizzando il software (come CellProfiler, uno studio di analisi delle immagini gratuito basato su MatLab http://cellprofiler.org/, ImageJ o software proprietario come Gen5) contare le celle in ogni pozzo in ogni canale.
NOTA: Poiché ogni cella deve essere macchiata con Hoechst 33342 e le celle morte devono essere macchiate con PI, il rapporto tra morti e tutti rappresenta la frazione di cellule morte. Ad esempio, se il conteggio automatico nel campione non trattato mostra 467 celle macchiate con PI (celle morte) e 2335 celle macchiate con Hoechst 33342 (celle totali), la frazione morta è dello 0,2 o 20%. Questo valore viene quindi confrontato con un campione gestito in modo identico in cui è stato utilizzato il trattamento. - Descrizione dettagliata dell'acquisizione dei dati Hoechst/PI utilizzando il lettore multimodale Cytation5 Cell Imaging e il software Gen5 v. 3.00:
- Impostare il lettore/imager a piastre multimodale Cytation5 su celle di immagine in basso piatto, piastre di plastica nera generiche da 96 pozzi.
- Impostare un protocollo di imaging per l'utilizzo dei set di filtri DAPI e Texas Red standard. Scatta immagini al centro del pozzo usando un obiettivo di ingrandimento 4x. Non utilizzare alcun offset (X/Y o Z). Utilizzare le seguenti impostazioni di imaging: DAPI - LED - 10, tempo di integrazione - 99, guadagno - 0; Texas Red - LED - 8, tempo di integrazione - 950, guadagno - 18. Eseguire la messa a fuoco automatica utilizzando il segnale DAPI; non ci dovrebbe essere alcun offset nella messa a fuoco tra i canali.
- Eseguire l'analisi delle immagini utilizzando il software Gen5 v 3.00. Nelle impostazioni software, definire le celle come forme tra 5 e 25 μm nelle loro dimensioni. Escludere gli oggetti bordo primario e dividere gli oggetti toccanti attivando l'opzione speciale "Dividi oggetti toccanti". Elaborare quindi l'immagine per rimuovere lo sfondo (sottrazione di sfondo scura), applicare una maschera nucleare (valore soglia DAPI >= 6000 UA) e contare gli oggetti. Eseguire un'analisi del sottopopolazione basata sulla colorazione PI (valore soglia Texas Red >= 5000 AU) e contare gli oggetti. La percentuale di vitalità delle celle è definita come (1 -
 .
.
Risultati
Il suddetto protocollo è stato sviluppato utilizzando cellule OCI-AML2, che sono state prese come una linea cellulare rappresentativa di leucemia mieloide acuta. L'AML è caratterizzato da una proliferazione anomala di cellule ematopoietiche indifferenziate e non funzionali nel midollo osseo26. Nonostante i recenti sviluppi nella terapia mirata AML, lo standard di cura è rimasto invariato per diversi decenni e consiste in terapia a induzione (tipicamente composta da tre giorni di antraciclina, ad esempio daunorubicina, idarubicina o mitoxantrone antracenedione e 7 giorni di citorabina) seguita da consolidamento (tipicamente composto da cicli di trattamento con citorabinaseguiti da periodi di recupero) 36.
Seguendo il protocollo delineato nella figura 1A, le cellule OCI-AML2 sono state sedotte in piastre a 96 pozzi e trattate con il disaccoppiatore mitocondriale carbonil cianuro m-clorofenil hydrazone (CCCP) o l'inibitore glicolitico 2-deossi-D-glucosio (2-DG) a una serie di concentrazioni. Le cellule sono state trattate per 24 ore a 37 °C in supporti RPMI-1640 senza siero, e quindi la vitalità è stata valutata utilizzando l'esclusione del tripano blu (TB) o uno dei quattro saggi di vitalità (colorazione nucleare differenziale Hoechst / PI, saggio di rilascio LDH, MTT o alamarBlue). Le immagini rappresentative delle celle macchiate con Hoechst/PI sono mostrate nella figura 2A. Diverse osservazioni importanti possono essere fatte immediatamente. In primo luogo, il numero totale di cellule (colorazione hoechst) è ragionevolmente elevato ed è notevolmente maggiore del numero di cellule morte (colorazione PI). Ciò suggerisce che le condizioni dei media non stanno innescando alti tassi di morte cellulare. In secondo luogo, poiché solo le cellule etichettate con Hoechst e PI sono conteggiate come morte (cellule viola nell'immagine unita), la probabilità di contare i detriti è molto bassa. Questa immagine mostra un buon esempio di celle correttamente macchiate.
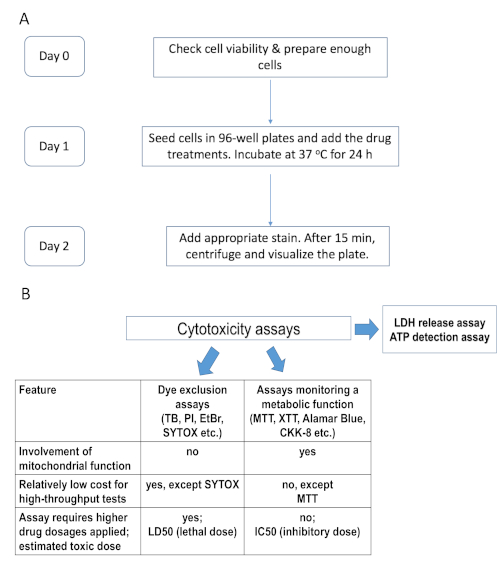
Figura 1. Sequenza temporale sperimentale e confronto dei test di citotossicità esistenti. (A) Diagramma di flusso che riassume la tempistica della procedura sperimentale, ad esempio colorazione Hoechst/PI. (B) Confronto dei saggi di citotossicità, alcuni dei quali sono stati utilizzati nel presente studio. I test di esclusione del colorante coinvolgono coloranti nucleari impermeabili che macchiano le cellule morte con membrana plasmatica compromessa: TB – tripano blu, PI – ioduro di propidio, EtBr – bromuro di etidio e SYTOX. Il secondo gruppo di saggi dipende dal metabolismo cellulare, ad esempio i sali di tetrazolium MTT, XTT e CKK-8 (WST-8), il reagente a base di resazurina alamarBlue, ecc. Fare clic qui per visualizzare una versione più grande di questa figura.
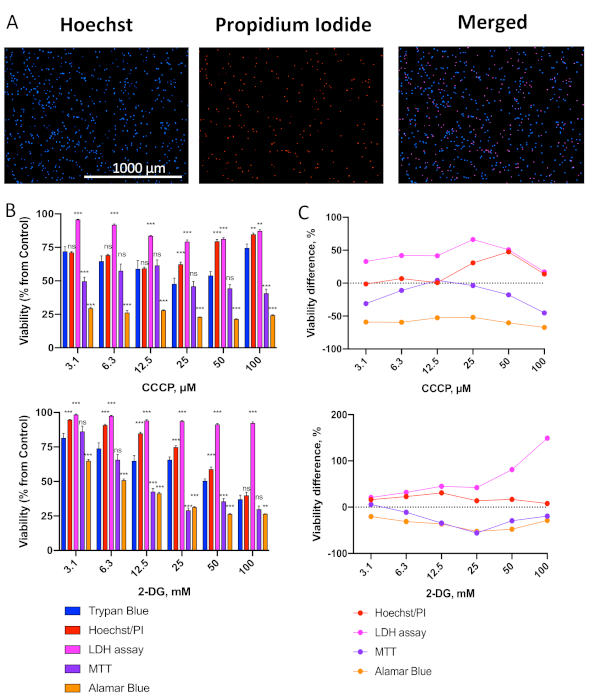
Figura 2. Confronto di un pannello di test di citotossicità con l'esclusione blu del tripano. (A) Immagini rappresentative delle cellule totali (Hoechst 33342) e morte (ioduro di propidio, PI) OCI-AML2 tramite colorazione Hoechst/PI. (B) Valutazione della vitalità delle cellule OCI-AML2 con metodi diversi dopo il trattamento con un gradiente di concentrazioni di CCCP (superiore)o2 DG (in basso). L'OCI-AML2 è stato trattato con CCCP o 2-DG in RPMI-1640 senza siero per 24 ore prima della determinazione della vitalità cellulare. Le barre di errore rappresentano SEM. C. Differenza nella vitalità cellulare tra i test di citotossicità nella colorazione blu (B ) vs trypan (vedi tabelle supplementari S1-2 per i numeri esatti e la differenza mediana). Le stelle indicano una differenza significativa rispetto a. colorazione blu trypan. ** p < 0,01, *** p < 0,001, ns – non significativo. Il confronto di gruppo è stato effettuato tramite t-test con correzione per più test di ipotesi. Sono state eseguite tre repliche biologiche indipendenti. Clicca qui per visualizzare una versione più grande di questa figura.
Come abbiamo recentemente riportato19, le leucemie sono molto sensibili ai trattamenti mitotossici, il che indica che le cellule hanno già danni mitocondriali sottostanti. Su questa base, abbiamo previsto che i saggi MTT e alamarBlue, che si basano sull'attività enzimatica mitocondriale, misurerebbero in modo impreciso la vitalità cellulare. Come previsto, questi saggi (in particolare alamarBlue) hanno mostrato una redditività significativamente inferiore rispetto all'esclusione blu del tripano, cfr. Ciò è coerente con il fatto che le dosi di questi composti necessarie per indurre apoptosi o necrosi sono superiori a quelle necessarie per compromettere la funzione mitocondriale.
Tra i test testati, la doppia colorazione con Hoechst 33342 e PI ha avuto la migliore combinazione di robustezza, sensibilità e coerenza con la colorazione TB, con la più piccola deviazione mediana dal metodo di esclusione della TBC dopo il trattamento CCCP o 2-DG(tabelle supplementari S1-2). È interessante notare che a dosi più elevate di vitalità CCCP (50 e 100 μM) stimata con Hoechst/PI o TB è stata aumentata rispetto a dosi più basse(Figura 2B, in alto). Ciò è probabilmente dovuto alla precipitazione del CCCP a dosi più elevate a causa della sua idrofobicità, riducendone l'effettiva concentrazione e impatto sulle cellule. Tuttavia, aumentando la dose di CCCP si è ulteriormente ridotta la vitalità media stimata di Hoechst/PI delle cellule OCI-AML2: 74% a 150 μM, 62% a 200 μM, 6% a 300 μM(dati non mostrati).
Il saggio Hoechst/PI è stato efficace anche nel determinare la vitalità cellulare dopo il trattamento con altre molecole che prendono di mira i mitocondri. Questi includevano il rotenone, un veleno che compromette il complesso I della catena di trasporto degli elettroni mitocondriali37, e il 3-bromopiruvato, un inibitore glicolitico e un agente alchilante che compromette la respirazione mitocondriale e il metabolismo mitocondriale38 (Figura 3A-D, Tabelle supplementari S3-4).
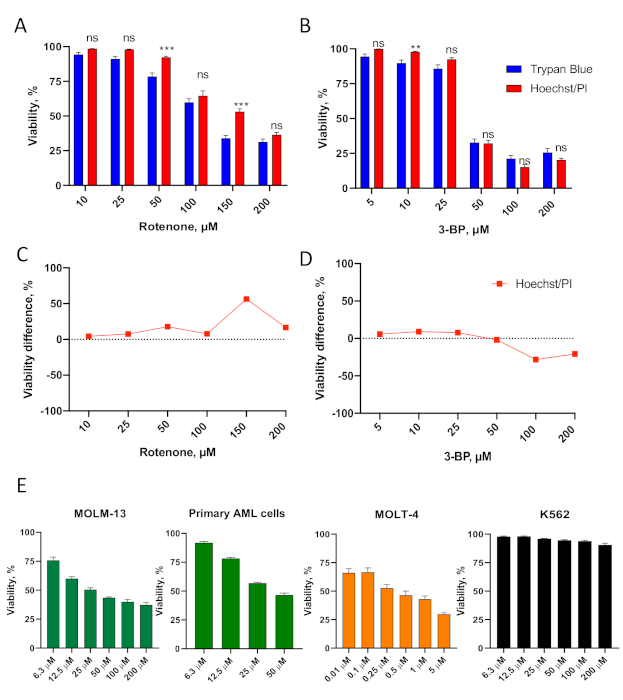
Figura 3. Convalida del test di citotossicità Hoechst/PI nelle cellule di leucemia. (A,B) Le cellule OCI-AML2 (AML) sono state trattate con diverse concentrazioni di rotenone (A) o 3-bromopiruvato, 3-BP (B) in mezzi RPMI-1640 senza siero per 24 ore, quindi è stata determinata la vitalità. È indicato con SEM. (C,D) Confronto tra il saggio Hoechst/PI e la colorazione blu tripano (per le celle in A-B, vedere tabelle supplementari S3-4 per la quantificazione). Le stelle indicano la significatività statistica rispetto alla colorazione blu trypan. ** p < 0,01, *** p < 0,001, ns – non significativo. Il confronto di gruppo è stato effettuato tramite t-test con correzione per più test di ipotesi. E.MOLM-13 (AML), le cellule primarie AML isolate da un paziente, le cellule MOLT-4 (ALL) e K562 (CML) sono state trattate con le concentrazioni indicate di rotenone in supporti RPMI-1640 senza siero per 24 ore, prima della determinazione della vitalità utilizzando la colorazione Hoechst/PI. Mostrato è cattivo con SEM. Sono state eseguite tre repliche biologiche indipendenti. Clicca qui per visualizzare una versione più grande di questa figura.
Il test di citotossicità Hoechst/PI è stato ulteriormente convalidato utilizzando un pannello di linee cellulari di leucemia che rappresentano più tipi di leucemia, così come le cellule primarie. Includevano MOLM-13 (una linea cellulare AML), cellule AML primarie derivate da un campione rappresentativo di pazienti, MOLT-4 (una linea cellulare di leucemia linfoblastica acuta, ALL) e K562 (una linea cellulare di leucemia mielogena cronica, CML)(Figura 3E, Figura supplementare S1). I risultati del saggio Hoechst/PI hanno mostrato che queste cellule avevano profonde differenze nella sensibilità al rotenone, che vanno da cellule molto sensibili (MOLT-4) a cellule resistenti (K562).
Per dimostrare la robustezza del saggio, le cellule OCI-AML2 sono state trattate con un gradiente di concentrazione di 3-bromopiruvato, come descritto nel protocollo precedente. I conteggi delle cellule sono stati raccolti per 6 pozzi ad ogni concentrazione e sono riportati(figura 4A,B). Questi conteggi sono stati utilizzati per calcolare la fattibilità e hanno dimostrato che solo 4 pozzi erano sufficienti per catturare con precisione il risultato del saggio (Figura 4C). Viene mostrata la curva dose-risposta risultante(figura 4D).

Figura 4. Riproducibilità della colorazione Hoechst/PI. Vitalità delle cellule OCI-AML2 dopo 24 ore di trattamento con diverse concentrazioni di 3-bromopiruvato (3-BP). (A) Numero totale di cellule contate tramite colorazione Hoechst 33342, (B) Numero di cellule morte contate mediante colorazione propidio ioduro. (C) Redditività (%) calcolato utilizzando (A-B). (D) Grafico rappresentativo della risposta alla dose. Mostrato è cattivo con SEM. Sono state eseguite tre repliche biologiche indipendenti. Clicca qui per visualizzare una versione più grande di questa figura.
Sebbene il saggio sia relativamente robusto, bisogna comunque fare attenzione. Prestazioni improprie del saggio possono comprometterne l'accuratezza. A scopo di risoluzione dei problemi vengono visualizzati diversi risultati compromessi (Figura 5). Il primo set di immagini mostra le conseguenze della colorazione eccessiva con PI, che possono derivare dalle seguenti fonti: utilizzo del colorante a concentrazione troppo elevata, colorazione per troppo tempo o utilizzo di intensità/tempo di integrazione LED troppo elevato nel canale rosso (Figura 5A). Questi errori genereranno un numero artificialmente gonfiato di cellule morte. La seconda questione nasce dall'abbandono della fase di centrifugazione. Spesso, le cellule morte iniziano a perdere il loro attaccamento dalla superficie del piatto. Di conseguenza, saranno sottorappresentati durante l'acquisizione di immagini, che generalmente si verifica vicino alla parte inferiore del pozzo (Figura 5B). Infine, la sovraesposizione nel canale Hoechst espande artificialmente le dimensioni delle cellule, riducendo significativamente il conteggio totale per pozzo e limitando la potenza di dosaggio (Figura 5C).
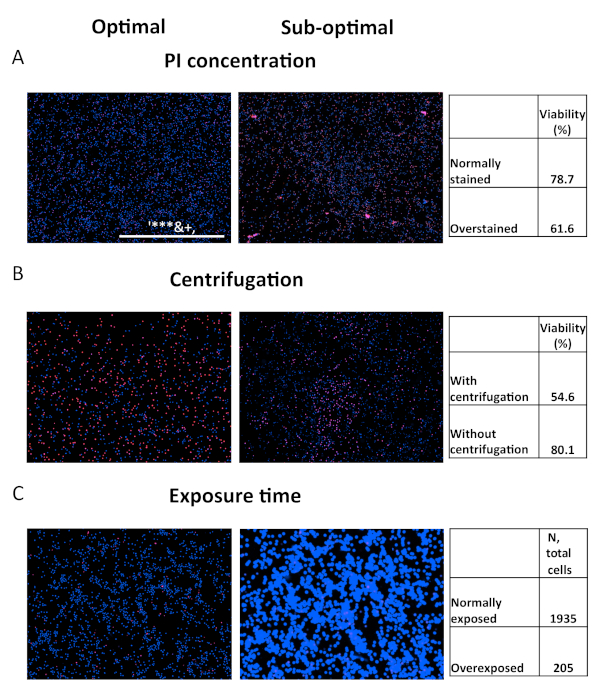
Figura 5. Confronto di parametri di dosaggio ottimali e non ottimali. Confronto dei risultati acquisiti tramite parametri ottimizzati (a sinistra) o parametri non ottimali (a destra). (A) I PBBC sani sono stati macchiati con ioduro di propidio a 1 μg/mL (a sinistra) o 5 μg/mL (a destra) per 15 minuti prima dell'imaging. (B) Immagini di cellule OCI-AML2 prelevate con (sinistra) o senza centrifugazione a piastre (destra). (C) Immagini di celle OCI-AML2 acquisite con un tempo di integrazione ottimale (sinistro) o eccessivo (a destra) per il canale Hoechst. Clicca qui per visualizzare una versione più grande di questa figura.
| Differenza con il metodo trypan blue, % | ||||
| CCCP, μM | Hoechst/PI | Saggio LDH | Mtt | Alamar Blu |
| 3.1 | -1.19 | 33.00 | -31.05 | -59.04 |
| 6.3 | 6.99 | 41.90 | -11.03 | -59.34 |
| 12.5 | 0.71 | 41.60 | 4.31 | -52.52 |
| 25 | 30.73 | 66.33 | -3.68 | -51.85 |
| 50 | 47.38 | 50.71 | -17.71 | -60.27 |
| 100 | 13.81 | 17.12 | -45.31 | -67.25 |
| Mediana | 10.40 | 41.75 | -14.37 | -59.19 |
Tabella complementare S1. Differenze di vitalità per un pannello di saggi nelle cellule OCI-AML2 dopo il trattamento CCCP. La valutazione della fattibilità è stata effettuata dopo 24 ore di trattamento con diverse concentrazioni di CCCP. Le differenze mediane di vitalità tra i test testati (Hoechst/PI, LDH, MTT o alamarBlue) e la colorazione blu del trypan con conteggio automatizzato sono state calcolate in base alle differenze di vitalità ad ogni concentrazione di farmaco.
| Differenza con il metodo trypan blue, % | ||||
| 2-DG, mM | Hoechst/PI | Saggio LDH | Mtt | Alamar Blu |
| 3.1 | 16.16 | 20.77 | 5.82 | -20.27 |
| 6.3 | 22.93 | 31.96 | -11.13 | -31.11 |
| 12.5 | 30.85 | 45.07 | -34.27 | -36.29 |
| 25 | 13.81 | 42.39 | -55.79 | -52.29 |
| 50 | 16.96 | 81.12 | -29.38 | -47.68 |
| 100 | 7.79 | 149.16 | -19.37 | -28.67 |
| Mediana | 16.56 | 43.73 | -24.38 | -33.70 |
Tabella complementare S2. Differenze di vitalità per un gruppo di saggi nelle cellule OCI-AML2 dopo il trattamento con 2 DG. La valutazione della redditività è stata effettuata dopo 24 ore di trattamento con diverse concentrazioni di 2-DG. Le differenze mediane di vitalità tra i test testati (Hoechst/PI, LDH, MTT o alamarBlue) e la colorazione blu del trypan con conteggio automatizzato sono state calcolate in base alle differenze di vitalità ad ogni concentrazione di farmaco.
| Rotenone | Differenza di redditività, % (Hoechst/PI-trypan blue) |
| 10 | 4.45 |
| 25 | 7.61 |
| 50 | 17.70 |
| 100 | 7.74 |
| 150 | 56.38 |
| 200 | 16.57 |
| Mediana | 12.15 |
Tabella complementare S3. Differenza di vitalità tra il metodo di esclusione Hoechst/PI e TB nelle cellule OCI-AML2 dopo il trattamento con rotenone. La valutazione della fattibilità è stata effettuata dopo 24 ore di trattamento con diverse concentrazioni di rotenone. La differenza mediana di vitalità tra Hoechst/PI e la colorazione blu del trypan con conteggio automatizzato è stata calcolata in base alle differenze di vitalità ad ogni concentrazione di farmaco.
| 3-BP, μM | Differenza di vitalità, % (blu Hoechst/PI-trypan) |
| 5 | 5.73 |
| 10 | 9.00 |
| 25 | 7.72 |
| 50 | -1.90 |
| 100 | -28.23 |
| 200 | -20.77 |
| Mediano | 1.91 |
Tabella complementare S4. Differenza di vitalità tra il metodo di esclusione hoechst/PI e TB nelle cellule OCI-AML2 dopo il trattamento con 3-bromopiruvato (3-BP). La valutazione della redditività è stata effettuata dopo 24 ore di trattamento con diverse concentrazioni di 3-BP.
Figura complementare S1. Immagini rappresentative di cellule macchiate di Hoechst/PI, con o senza trattamento rotenone a concentrazioni indicate in supporti RPMI-1640 senza siero per 24 h: A-B. AML: Linea cellulare MOLM-13 (A) e cellule AML primarie (B) derivate da un campione rappresentativo del paziente. C. La commissione per l' ALL: Linea cellulare MOLT-4. D. La commissione per l' CML: Linea cellulare K562. Clicca qui per scaricare questo file.
Discussione
Sebbene il protocollo per il test di citotossicità Hoechst/PI sia robusto e richieda relativamente poco tempo pratico, ci sono diversi dettagli sperimentali che sono molto importanti per garantire risultati accurati. In primo luogo, è essenziale assicurarsi che la concentrazione di DMSO rimanga al di sotto dello 0,5% (v/v). È generalmente riconosciuto che l'esposizione a dosi anche basse di DMSO può alterare sostanzialmente la morfologia e l'attaccamento delle cellule e ritardare significativamente la progressionedel ciclo cellulare 39,40.
In secondo luogo, la colorazione deve essere eseguita il prima possibile dopo il trattamento. Poiché non ci sono passaggi di lavaggio, il composto rimane nei pozzi e può continuare a infliggere danni alle cellule. Rispetto al precedente protocollo35, le celle sono state macchiate per soli 15 minuti. Ciò limita la possibilità che cellule vitali possano essere inavvertitamente macchiate di ioduro di propidio. Per questo motivo, suggeriamo trattamenti sconcertante e colorazione se verranno trattati più di due piatti. Ciò consente di immaginare il tempo tra le piastre e migliora la riproducibilità.
In terzo luogo, un'adeguata concentrazione di colorante dipende dal tipo di cella. È importante determinare empiricamente la concentrazione ottimizzata di ioduro di propidio, a partire dalle cellule non trattate, usando la colorazione blu tripano come riferimento ortogonale.
Infine, anche la fase di centrifugazione immediatamente prima della visualizzazione è fondamentale. Sulla base di questo protocollo, viene registrato un intervallo di 500-4.000 cellule (a seconda della densità di semina). Questo è un notevole miglioramento rispetto alle 100-400 celle per ben utilizzato in precedenza35. Considerando la variazione della popolazione di cellule tumorali (specialmente cellule primarie), avere più cellule per l'analisi è importante e può consentire un'analisi dei dati più robusta.
A causa della relativa semplicità del metodo, è possibile eseguire facilmente un'ampia varietà di modifiche. Ad esempio, molti altri coloranti impermeanti per cellule sono disponibili da un certo numero di venditori e possono essere sostituiti con ioduro di propidio. Mentre questa sostituzione ha relativamente poco valore da sola, l'aumento della tavolozza di colori significa che possono essere eseguiti esperimenti più complessi. Ad esempio, l'aggiunta di un terzo colore consentirà di valutare la sopravvivenza differenziale tra sottopopolazioni di cellule, come viene comunemente eseguita con la citometria del flusso.
Una modifica più sostanziale del protocollo è la visualizzazione delle celle precedente e l'utilizzo di uno spettrofotometro. Questo approccio ha il vantaggio di utilizzare un'apparecchiatura quasi onnipresente (uno spettrofotometro standard con un lettore di micropiatte) ed è il metodo più veloce per acquisire dati. Tuttavia, questo metodo è molto meno accurato. L'intensità della fluorescenza è rappresentativa della colorazione cellulare, ma le variazioni stocastiche nell'intensità di colorazione, combinate con l'area del campione relativamente più piccola, introducono una variabilità significativa. Mentre un'ulteriore ottimizzazione (come l'inclusione di una procedura di lavaggio fissante e aggiuntiva o un maggior numero di campioni) può risolvere questi problemi, la microscopia a fluorescenza è generalmente un approccio superiore.
In conclusione, il protocollo Hoechst/PI modificato è un saggio di citotossicità veloce, accurato, economico e ad alta produttività indipendente dalla funzione mitocondriale. Questo saggio ha un'utilità sostanziale per vagliare in modo efficiente composti o combinazioni composte che prendono di mira i mitocondri.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
NVK, uno studioso CPRIT in Ricerca sul Cancro, ringrazia il Cancer Prevention and Research Institute of Texas (CPRIT) per il suo generoso sostegno, la sovvenzione CPRIT RR150044. Questo lavoro è stato sostenuto anche dal Welch Foundation Research Grant C-1930 e dal National Institutes of Health R35 GM129294 assegnato alla NVK. I finanziatori non hanno avuto alcun ruolo nella progettazione dello studio, nella raccolta e nell'analisi dei dati, nella decisione di pubblicare o preparare il manoscritto.
Materiali
| Name | Company | Catalog Number | Comments |
| 2-Deoxy-D-glucose/2-DG | Chem-Impex | 50-519-067 | |
| 3-bromo-pyruvate | Alfa Aesar | 1113-59-3 | |
| 96-Well plates | Greiner Bio-One | 655090 | Black or clear flat-bottomed 96-well plates |
| Alamar blue HS cell viability reagent (100mL) | Thermo Fisher | A50101 | |
| Countess II automated cell counter | Thermo Fisher | ||
| Cytation 5 Cell Imaging Multi-Mode Reader | BioTek | ||
| Hoechst 33342 | Thermo Fisher | 62249 | 20 mM solution; final concentration 1:1,000 |
| HyClone fetal bovine serum | GE Healthcare | #25-514 | |
| m-chlorophenylhydrazone/CCCP | Sigma Aldrich | C2759 | |
| PBS tablets | Thermo Fisher | BP2944100 | 1 tablet + 200 mL of sterile water = 1x PBS solution |
| Penicillin-Streptomycin-Glutamine (100X) | Gibco | 10378016 | |
| Pierce LDH assay kit | Thermo Fisher | 50-103-5952 | |
| Propidium Iodide | Thermo Fisher | 50-596-072 | Dry powder; stock 1 mg/mL in PBS; final concentration 5 µg/mL (leukemia cells), 1 µg/mL (normal PBMCs) |
| Rotenone | Ark Pharm | AK115691 | |
| RPMI-1640 Medium With L-glutamine and sodium bicarbonate, liquid, sterile-filtered, suitable for cell culture | Sigma Aldrich | R8758-500ML | |
| Thiazolyl blue tetrazolium bromide | ACROS Organics | AC158990010 | |
| Trypan blue stain (0.4%) | Gibco | 15250-061 | |
| Cell lines | |||
| K562 | ATCC | CCL-243 | CML cell line |
| MOLM-13 | ATCC | AML cell line | |
| MOLT-4 | ATCC | CRL-1582 | ALL cell line |
| OCI-AML2 | ATCC | AML cell line |
Riferimenti
- Ramirez, C. N., Antczak, C., Djaballah, H. Cell viability assessment: toward content-rich platforms. Expert Opinion on Drug Discovery. 5 (3), 223-233 (2010).
- Melzer, S., et al. Trypan blue as an affordable marker for automated live-dead cell analysis in image cytometry. Scanning. 38 (6), 857-863 (2016).
- Sikora, E., Mosieniak, G., Sliwinska, M. A. Morphological and Functional Characteristic of Senescent Cancer Cells. Current Cancer Drug Targets. 17 (4), 377-387 (2016).
- Coppé, J. P., Desprez, P. Y., Krtolica, A., Campisi, J. The senescence-associated secretory phenotype: the dark side of tumor suppression. Annual Review of Pathology. 5, 99-118 (2010).
- Castro-Vega, L. J., et al. The senescent microenvironment promotes the emergence of heterogeneous cancer stem-like cells. Carcinogenesis. 36 (10), 1180-1192 (2015).
- Weihua, Z., Lin, Q., Ramoth, A. J., Fan, D., Fidler, I. J. Formation of solid tumors by a single multinucleated cancer cell. Cancer. 117 (17), 4092-4099 (2011).
- Osisami, M., Keller, E. T. Mechanisms of Metastatic Tumor Dormancy. Clinical Medicine. 2 (3), 136-150 (2013).
- Zhang, S., et al. Generation of cancer stem-like cells through the formation of polyploid giant cancer cells. Oncogene. 33 (1), 116-128 (2014).
- Mittal, K., et al. Multinucleated polyploidy drives resistance to Docetaxel chemotherapy in prostate cancer. British Journal of Cancer. 116 (9), 1186-1194 (2017).
- McKeague, A. L., Wilson, D. J., Nelson, J. Staurosporine-induced apoptosis and hydrogen peroxide-induced necrosis in two human breast cell lines. British Journal of Cancer. 88 (1), 125-131 (2003).
- Kaja, S., et al. An optimized lactate dehydrogenase release assay for screening of drug candidates in neuroscience. Journal of Pharmacological and Toxicological Methods. 73, 1-6 (2015).
- Chan, F. K., Moriwaki, K., De Rosa, M. J. Detection of necrosis by release of lactate dehydrogenase activity. Methods in Molecular Biology. 979, 65-70 (2013).
- Piccinini, F., Tesei, A., Arienti, C., Bevilacqua, A. Cell Counting and Viability Assessment of 2D and 3D Cell Cultures: Expected Reliability of the Trypan Blue Assay. Biological Procedures Online. 19, 8(2017).
- Plemel, J. R., et al. Unique spectral signatures of the nucleic acid dye acridine orange can distinguish cell death by apoptosis and necroptosis. Journal of Cell Biology. 216 (4), 1163-1181 (2017).
- Galluzzi, L., et al. Guidelines for the use and interpretation of assays for monitoring cell death in higher eukaryotes. Cell Death & Differentiation. 16 (8), 1093-1107 (2009).
- Cummings, B. S., Schnellmann, R. G. Measurement of cell death in mammalian cells. Current Protocols in Pharmacology. , Chapter 12, Unit 12.18 (2004).
- Brauchle, E., Thude, S., Brucker, S. Y., Schenke-Layland, K. Cell death stages in single apoptotic and necrotic cells monitored by Raman microspectroscopy. Scientific Reports. 4, 4698(2014).
- Chiaraviglio, L., Kirby, J. E. Evaluation of impermeant, DNA-binding dye fluorescence as a real-time readout of eukaryotic cell toxicity in a high throughput screening format. Assay and Drug Development Technologies. 12 (4), 219-228 (2014).
- Panina, S. B., Baran, N., Brasil da Costa, F. H., Konopleva, M., Kirienko, N. V. A mechanism for increased sensitivity of acute myeloid leukemia to mitotoxic drugs. Cell Death & Disease. 10 (8), 617(2019).
- Caro, P., et al. Metabolic signatures uncover distinct targets in molecular subsets of diffuse large B cell lymphoma. Cancer Cell. 22 (4), 547-560 (2012).
- Lagadinou, E. D., et al. BCL-2 inhibition targets oxidative phosphorylation and selectively eradicates quiescent human leukemia stem cells. Cell Stem Cell. 12 (3), 329-341 (2013).
- Senft, D., Ronai, Z. A. Regulators of mitochondrial dynamics in cancer. Current Opinion in Cell Biology. 39, 43-52 (2016).
- Vazquez, F., et al. PGC1α expression defines a subset of human melanoma tumors with increased mitochondrial capacity and resistance to oxidative stress. Cancer Cell. 23 (3), 287-301 (2013).
- Caino, M. C., Altieri, D. C. Cancer cells exploit adaptive mitochondrial dynamics to increase tumor cell invasion. Cell Cycle. 14 (20), 3242-3247 (2015).
- Ralph, S. J., Rodríguez-Enríquez, S., Neuzil, J., Saavedra, E., Moreno-Sánchez, R. The causes of cancer revisited: "mitochondrial malignancy" and ROS-induced oncogenic transformation - why mitochondria are targets for cancer therapy. Molecular Aspects of Medicine. 31 (2), 145-170 (2010).
- Kreitz, J., et al. Metabolic Plasticity of Acute Myeloid Leukemia. Cells. 8 (8), (2019).
- Sriskanthadevan, S., et al. AML cells have low spare reserve capacity in their respiratory chain that renders them susceptible to oxidative metabolic stress. Blood. 125 (13), 2120-2130 (2015).
- Guerra, F., et al. Mitochondrial Dysfunction: A Novel Potential Driver of Epithelial-to-Mesenchymal Transition in Cancer. Frontiers in Oncology. 7, 295(2017).
- Guerra, F., Arbini, A. A., Moro, L. Mitochondria and cancer chemoresistance. Biochimica et Biophysica Acta. 1858 (8), 686-699 (2017).
- Neuzil, J., Dong, L. F., Rohlena, J., Truksa, J., Ralph, S. J. Classification of mitocans, anti-cancer drugs acting on mitochondria. Mitochondrion. 13 (3), 199-208 (2013).
- Ubah, O. C., Wallace, H. M. Cancer therapy: Targeting mitochondria and other sub-cellular organelles. Current Pharmaceutical Design. 20 (2), 201-222 (2014).
- Yamaguchi, R., et al. Efficient elimination of cancer cells by deoxyglucose-ABT-263/737 combination therapy. PLoS One. 6 (9), 24102(2011).
- Hahn, T., et al. Use of anti-cancer drugs, mitocans, to enhance the immune responses against tumors. Current Pharmaceutical Biotechnology. 14 (3), 357-376 (2013).
- Panina, S. B., Pei, J., Baran, N., Konopleva, M., Kirienko, N. V. Utilizing Synergistic Potential of Mitochondria-Targeting Drugs for Leukemia Therapy. Frontiers in Oncology. 10, 435(2020).
- Lema, C., Varela-Ramirez, A., Aguilera, R. J. Differential nuclear staining assay for high-throughput screening to identify cytotoxic compounds. Current Cellular Biochemistry. 1 (1), 1-14 (2011).
- Döhner, H., et al. Diagnosis and management of acute myeloid leukemia in adults: recommendations from an international expert panel, on behalf of the European LeukemiaNet. Blood. 115 (3), 453-474 (2010).
- Heinz, S., et al. Mechanistic Investigations of the Mitochondrial Complex I Inhibitor Rotenone in the Context of Pharmacological and Safety Evaluation. Scientific Reports. 7, 45465(2017).
- Fan, T., et al. Tumor Energy Metabolism and Potential of 3-Bromopyruvate as an Inhibitor of Aerobic Glycolysis: Implications in Tumor Treatment. Cancers (Basel). 11 (3), (2019).
- Pal, R., Mamidi, M. K., Das, A. K., Bhonde, R. Diverse effects of dimethyl sulfoxide (DMSO) on the differentiation potential of human embryonic stem cells. Archives of Toxicology. 86 (4), 651-661 (2012).
- Tunçer, S., et al. Low dose dimethyl sulfoxide driven gross molecular changes have the potential to interfere with various cellular processes. Scientific Reports. 8 (1), 14828(2018).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon