Method Article
Migração, Quimio-Atração e Ensaios de Cocultura para Células Endoteliais derivadas de células-tronco humanas e neurônios gabaergicos
Neste Artigo
Resumo
Apresentamos três simples ensaios in vitro - o ensaio migratório de longa distância, o ensaio de migração de cocultura, e o ensaio de atração de quimioterapia - que avaliam coletivamente as funções das células-tronco humanas derivadas células endoteliais periventriculares e suas interação com interneurônios GABAergic.
Resumo
O papel da vasculatura cerebral no desenvolvimento do sistema nervoso e na etiquetação de distúrbios cerebrais está ganhando cada vez mais atenção. Nossos estudos recentes identificaram uma população especial de células vasculares, as células endoteliais periventriculares, que desempenham um papel crítico na migração e distribuição de interneurônios gabaergicos do cérebro anterior durante o desenvolvimento embrionário. Isso, juntamente com suas funções autônomas de células, alude a novos papéis de células endoteliais periventriculares na patologia de doenças neuropsiquiátricas como esquizofrenia, epilepsia e autismo. Aqui, descrevemos três ensaios in vitro diferentes que avaliam coletivamente as funções das células endoteliais periventriculares e sua interação com interneurônios gabaergicos. O uso desses ensaios, particularmente em um contexto humano, nos permitirá identificar a ligação entre células endoteliais periventriculares e distúrbios cerebrais. Esses ensaios são simples, de baixo custo e reprodutíveis, e podem ser facilmente adaptados a qualquer tipo de célula aderente.
Introdução
As células endoteliais formam o revestimento dos vasos sanguíneos e mediam funções importantes que incluem manutenção da permeabilidade da parede do vaso, regulação do fluxo sanguíneo, agregação de plaquetas e formação de novos vasos sanguíneos. No cérebro, as células endoteliais fazem parte de uma barreira cerebral-cérebro crítica que controla firmemente a troca de materiais entre o cérebro e a corrente sanguínea1. Nossos estudos na última década identificaram novos papéis neurogênicos de células endoteliais cerebrais que têm implicações significativas para o desenvolvimento e comportamento cerebral2,3,4,5. Mostramos que o cérebro embrionário do camundongo é vascularizado por dois subtipos distintos de vasos, os vasos pial e os vasos periventriculares, que diferem em anatomia, origem e perfil de desenvolvimento2. Células endoteliais que revestem esses dois subtipos de vasos mostram diferenças distintas em seus perfis de expressão genética. Enquanto as células endoteliais pial expressam principalmente genes relacionados à inflamação e à resposta imune, as células endoteliais periventriculares são enriquecidas exclusivamente na expressão de genes comumente associados à neurogênese, migração neuronal, quimiotaxe e orientação de axôon3. Células endoteliais periventriculares também abrigam um novo caminho de sinalização GABA que é distinto do tradicional caminho de sinalização neuronal GABA5. Concomitante com sua expressão genética, células endoteliais periventriculares foram encontradas para regular a migração e distribuição de interneurônios gabaergicos no neocórtex em desenvolvimento. Durante o desenvolvimento embrionário, as células endoteliais periventriculares sofrem migração de longa distância ao longo de um gradiente ventral-dorsal para estabelecer a rede vascular periventricular2,3. Esta rota migratória é espelhada um dia depois por interneurônios. Os interneurônios migratórios interagem fisicamente com a rede vascular periventricular pré-formada e a usam como um guia para chegar ao seu destino final no neocórtex. Além de atuarem como substrato físico, as células endoteliais periventriculares servem como fonte de sinais de navegação para neurônios migratórios. Gaba endotelicular endotelial de células periventriculares guia a migração interneurônios e regula seus padrões finais de distribuição4. Defeitos na migração e distribuição interneurônios estão associados a transtornos neuropsiquiátricos como autismo, epilepsia, esquizofrenia e depressão6,7,8,9,10. Portanto, o estudo das funções endoteliais endoteliais periventriculares e sua influência na migração interneurônio no contexto humano torna-se fundamental para abordar a patogênese desses transtornos.
Geramos células endoteliais periventriculares humanas a partir de células-tronco embrionárias humanas em nosso laboratório11, usando tecnologia de células-tronco pluripotentes induzidas (iPSC)12,13. Para validar se as células endoteliais periventriculares humanas imitam fielmente células endoteliais periventriculares do camundongo e para avaliar quantitativamente sua influência na migração interneurônios, desenvolvemos três ensaios in vitro: um ensaio migratório de longa distância, um ensaio migratório de cocultura e um ensaio de atração de quimioterapia. Aqui descrevemos protocolos para esses ensaios em detalhes. Todos os três ensaios são baseados no uso de pastilhas de cultura de silicone para criar um pequeno retangular de células (de dimensões fixas) cercadas por espaço livre de células. A distância migratória é avaliada medindo a distância entre as posições finais das células da fronteira do patch retangular que foi delineado no dia 0. No ensaio de migração de longa distância, as células endoteliais periventriculares humanas são semeadas como um remendo no centro de uma antena de 35 mm, e as distâncias percorridas pelas células ao longo de um longo período de tempo são calculadas. No ensaio de migração da cocultura, as células endoteliais periventriculares humanas são co-semeadas com interneurônios humanos como um remendo em um prato de 35 mm. Esta configuração permite examinar o efeito das interações físicas diretas desses dois tipos de células na taxa de migração de interneurônios. O ensaio quimio-atração mede a migração de interneurônios em resposta a pistas quimio-atraentes secretadas por células endoteliais periventriculares humanas. Os interneurônios são semeados como um remendo retangular, com células endoteliais periventriculares humanas e controlam células endoteliais não periventriculares semeadas como remendos de tamanho semelhante em ambos os lados. Cada uma das manchas de células são separadas por uma lacuna livre de células de 500 μm. A resposta dos interneurônios é avaliada por quantificar o número de células que migraram para células endoteliais periventriculares em comparação com o controle de células endoteliais não periventriculares.
Esses ensaios fornecem uma avaliação robusta das funções endoteliais eendteliculares humanas e sua influência na migração interneurônios. A nova configuração de ensaio saque de longa distância e ensaio de migração de co-cultura fornece espaço livre de células na faixa de centímetros (~1-1,5 cm) para permitir a detecção da migração de longa distância. Um resumo das características de nossos ensaios em comparação com outros ensaios populares é apresentado na Tabela 1. Coletivamente, os ensaios descritos aqui servirão como uma plataforma para avaliar células endoteliais endoteliais eendrâneos periventriculares "doentes" e interneurônios gerados a partir de iPSCs de distúrbios cerebrais como esquizofrenia, autismo ou epilepsia. Esses ensaios também podem ser usados para determinar como diferentes condições (por exemplo, inibidores, ligands, RNAi) afetam a migração celular. Finalmente, esses ensaios podem ser otimizados para outros tipos de células para medir a migração de longa distância, a atração de quimioterapia ou a migração mediada por células.
Protocolo
1. Cultura e Armazenamento de Células Endoteliais Periventriculares Humanas
- Mantenha células endoteliais periventriculares humanas na membrana do porão revestida saciada (ver Tabela de Materiais) placas de 6 poços em meio de células endoteliais periventriculares (médio E6 contendo 50 ng/mL VEGF-A, 100 ng/mL FGF2 e 5 μM GABA) a 37 °C e 5% CO2. Mude o meio todos os dias alternativos.
- Descongele a matriz de membrana do porão em 4 °C, e faça uma solução de 1:100 diluindo-a em meio DMEM/F12 frio. Cubra cada poço de uma placa de 6 poços com 1 mL de solução matricial. Incubar placas a 37 °C por pelo menos 1h antes do uso.
- Permitir que células endoteliais periventriculares humanas atinjam uma confluência de 80%-90%. Meio aspirado do poço. Lave os poços uma vez com 1 mL de PBS 1x estéreis por poço.
- Desagregando células adicionando 1 mL de solução de dissociação celular (ver Tabela de Materiais) por poço. Incubar a 37 °C por 5 min. Depois de 5 min, adicione 1 mL de meio celular endotelicular periventricular. Transfira a solução da célula para um tubo cônico de 15 mL.
NOTA: Usamos Accutase para dissociação celular aqui, ao contrário do TrypLE nas seções 3 e 4. - Células centrífugas a 500 x g por 5 min à temperatura ambiente, aspiram o supernatante e resuspendem a pelota celular em 1 mL de meio celular endotelial periventricular.
- Conte células vivas usando o método de exclusão azul trypan. Células de sementes em placas frescas revestidas de matriz a uma densidade de 1,2 x 105 células/cm2. Incubar a 37 °C e 5% de CO2.
- Armazenar células endoteliais periventriculares humanas por criopreservação em meio de congelamento (90% de média de células endoteliais periventriculares e 10% DMSO).
- Dissociar e coletar células seguindo as etapas 1.3 e 1,4 acima. Conte células na solução pelo método de exclusão azul trypan.
- Células centrífugas a 500 x g por 5 min em temperatura ambiente. Aspirar o supernatante e resuspender a pelota celular a 5 x 106 células/ mL de meio congelante.
- Dispense 1 mL de células médias congelantes mais por criovial. Coloque os frascos na câmara cheia de isopropanol e esfrie durante a noite em -80 °C a 1 °C/min. Transfira frascos para um tanque de nitrogênio líquido no dia seguinte para armazenamento a longo prazo.
2. Preparação de Células Endoteliais Periventriculares Humanas para Ensaio
- Permitir que as células endoteliais periventriculares humanas atinjam 70%-80% de confluência.
- Células dissociadas seguindo passos de 1,3 a 1,5 como descrito acima. Conte células usando o método de exclusão azul trypan.
3. Preparação de Interneurônios Gabaergicos Humanos para Ensaio
NOTA: Célula-tronco pluripotente induzida pelo homem (iPSC) neurônios gabaergicos derivados e o meio neuronal foram comprados comercialmente (ver Tabela de Materiais). Os neurônios são gerados diferenciando uma linha de iPSC derivada de fibroblasto humano seguindo um protocolo desenvolvido pelo fabricante. As células foram descongelados e cultivados de acordo com o protocolo do fabricante.
- Descongele interneurônios gabaergicos humanos e cultifique-os em placa de 12 poços por duas semanas para uma confluência de 70%-80%.
- No dia do ensaio, a solução de dissociação celular quente (ver Tabela de Materiais) e uma alíquota do meio neuronal a 37 °C por 10 min antes do uso.
- Aspirar o meio de cada poço que contém as células. Lave células com 1 mL de PBS estéreis 1x por poço.
- Desapego células adicionando 0,5 mL de solução de dissociação pré-aquecida por poço e incubam a 37 °C por 5 min. Adicione 1 mL de meio neuronal por poço. Transferir a solução celular para um tubo cônico de 15 mL. Triturar suavemente para dissociar aglomerados de células.
- Células centrífugas a 380 x g por 5 min à temperatura ambiente, aspiram o supernatante e resuspendem a pelota celular em 1 mL de meio neuronal. Conte células vivas usando o método de exclusão azul trypan.
4. Preparação do controle de células endoteliais humanas para ensaio
NOTA: Controle células endoteliais derivadas do IPSC e o meio celular endotelial foram comprados comercialmente (Tabela de Materiais). Essas células endoteliais são geradas por diferenciar uma linha de iPSC derivada de fibroblasto humano para destino endotelial seguindo um protocolo desenvolvido pelo fabricante. As células foram descongelados e cultivados no substrato fibronectina de acordo com o protocolo do fabricante. Placas revestidas de fibronectina foram preparadas seguindo o protocolo do fabricante.
- Descongelar controle células endoteliais humanas e as cultura em placa de 6 poços a uma confluência de 80%-90%.
- No dia do ensaio, a solução de dissociação celular quente (ver Tabela de Materiais) e uma alíquota do meio endotelial a 37 °C por 10 min antes do uso.
- Aspirar o meio de cada poço contendo as células. Lave células com 1 mL de PBS estéreis 1x por poço.
- Desagregando células adicionando 0,5 mL de solução de dissociação pré-aquecida por poço. Incubar à temperatura ambiente por 5 min. Adicione 1 mL de células endoteliais média por poço para neutralizar a solução de dissociação. Transferir a solução celular para um tubo cônico de 15 mL.
- Células centrífugas a 200 x g por 5 min em temperatura ambiente. Aspirante e resuspender a pelota celular em 1 mL de meio celular endotelial. Conte células vivas usando o método de exclusão azul trypan.
5. Preparação de inserções culturais de um poço
- Descongele 1 mg/mL solução de laminin a temperatura ambiente ou durante a noite a 4 °C.
- Cubra um número apropriado de pratos de 35 mm com 0,01% de solução poli-l-ornithine (1 mL por prato). Incubar os pratos em temperatura ambiente por pelo menos 1h.
- Diluir 1 mg/mL solução de laminin a 1:300 em água estéril para uma concentração final de 3,3 μg/mL imediatamente antes do uso.
- Poli-L-ornithine completamente aspirada de cada prato. Enxágüe cada prato completamente 3x com água estéril e aspira completamente para evitar toxicidade celular induzida por poli-L-ornithine.
- Adicione 1 mL de 3,3 μg/mL solução laminada a cada prato e incuba a 37 °C durante a noite ou pelo menos 1 h. Remova a solução laminada do prato imediatamente antes do uso.
NOTA: Alternativamente, guarde os pratos contendo lamina em 4 °C. Equilibre os pratos em uma incubadora de cultura celular de 37 °C antes do uso. - Corte três lados de um poço de uma inserção de cultura de silicone de dois poços (Figura 1A) usando uma lâmina estéril para gerar uma inserção de um poço(Figura 1B).
NOTA: Mantenha a inserção de dois poços firmemente ligada à superfície da embalagem original enquanto corta para garantir um corte suave e proteger a adesão da inserção. - Solução laminada aspirada dos pratos.
NOTA: Não lave os pratos com PBS estéreis ou água após incubação de laminin. Superfícies úmidas evitarão aadesão apertada da inserção da cultura. - Remova uma inserção de um poço com pinças estéreis e coloque-a no centro do prato revestido poli-L-ornithine/laminin. Pressione ao longo das bordas da inserção para corrigi-lo na superfície do prato.
- Gire cuidadosamente o prato de cabeça para baixo para verificar se a inserção é firmemente aderida.
- Mantenha o prato de cabeça para baixo e marque o limite do compartimento de inserção usando um marcador preto permanente com uma ponta ultra-fina (Figura 1C).
6. Ensaio migratório de longa distância
- Suspenda os interneurônios gabaergicos humanos a uma concentração de 3 x 104 células/70 μL de meio neuronal. Sementes 70 μL de solução celular dentro de cada inserção de cultura de um poço.
NOTA: A densidade de semeade dos interneurônios é conforme recomendação do fabricante. - Suspender células endoteliais periventriculares humanas a uma concentração de 3 x 104 células/70 μL de meio celular endotelial periventricular. Sementes 70 μL de solução celular dentro de cada inserção de cultura de um poço.
NOTA: O número de células endoteliais periventriculares humanas semeadas a uma proporção de 1:1 com o número de neurônios semeados. - Adicione 1 mL de meio neuronal na antena do neurônio para preencher a área ao redor da inserção e evitar que o revestimento seque. Da mesma forma, adicione 1 mL de célula endotelicular periventricular em prato de célula endotelial periventricular.
NOTA: Adicione o meio lentamente ao longo da borda do prato para que a inserção não seja perturbada. - Verifique um microscópio para verificar se as células não estão vazando do compartimento de inserção.
- Incubam células por 24 h a 37 °C e 5% CO2. Após 24 h de incubação, verifique microscópio para verificar se as células se conectaram corretamente e não há vazamento noturno.
- Após 48 h de semeade, remova delicadamente a inserção usando uma pinça estéril. Verifique o microscópio para verificar se a camada celular permanece intacta (dia 0).
- Remova o meio da antena do neurônio e adicione 1 mL de meio neuronal fresco. Da mesma forma, remova o meio da antena celular endotelicular periventricular e adicione 1 mL de meio celular endotelial periventricular fresco.
NOTA: Reserve um número necessário de pratos e fixe com 4% de PFA para imagens do dia 0. - Incubam células por 5 dias a 37 °C e 5% de CO2. Após 5 dias, remova as células médias, fixe células com 4% de PFA por 10 min, e lave 3x com 1x PBS.
- Mancham neurônios com β-tubulina anti-humana ou anticorpo MAP2 anti-humano, e células endoteliais com anticorpo CD31 anti-humano. No final da imunocoloração, adicione 1 mL de montagem antifumada média a cada prato.
7. Ensaio de Migração cocultura
- Co-suspender 3 x 104 interneurônios GABAergic e 3 x 104 células endoteliais periventriculares humanas em 70 μL de meio de cocultura (50% de manutenção periventricular sem GABA e 50% de meio neuronal). Semente esta solução celular dentro do compartimento de inserção de um poço. Prepare um número apropriado de pratos de ensaio.
NOTA: O GABA não foi adicionado no meio da cocultura para excluir o efeito do EXógeno GABA na migração. - Verifique um microscópio para verificar se as células não estão vazando do compartimento de inserção.
- Adicione lentamente 1 mL de meio de cocultura ao longo do lado do prato para evitar que o revestimento seque.
NOTA: Adicione o meio lentamente ao longo da borda do prato para que a inserção não seja perturbada. - Como primeiro controle, sementes 3 x 104 interneurônios gabaergicos humanos apenas em 70 μL de meio de cocultura por inserção de um poço. Prepare um número apropriado desses pratos.
- Como segundo controle, co-sementes 3 x 104 neurônios humanos GABAergic com 3 x 104 controlam células endoteliais humanas em 70 μL de meio de cocultura por inserção de um poço. Prepare um número apropriado de pratos.
- Incubar os pratos por 24 h a 37 °C e 5% DE CO2. Após 24 h de incubação, verifique um microscópio para verificar se as células se conectaram corretamente e não há vazamento.
- Após 48 h de semeade, remova delicadamente a inserção usando uma pinça estéril. Verifique o microscópio para verificar se a camada celular não está perturbada (dia 0).
- Remova o meio e adicione 1 mL de meio de cocultura fresco.
NOTA: Reserve um número apropriado de pratos para aquisição de imagens do dia 0. - Incubam células por 5 dias a 37 °C e 5% de CO2.
- Após 5 dias, remova as células médias, fixe células com 4% de PFA por 10 min, e lave 3x com 1x PBS.
- Mancha com β-tubulina anti-humana ou anticorpo MAP2 anti-humano para rotular os neurônios. No final da imunocoloração, adicione 1 mL de montagem antifumada média a cada prato.
8. Ensaio de atração de quimioterapia
- Coloque uma inserção de cultura de três poços no centro de um prato poli-l-ornithine/laminin revestido de 35 mm usando pinças estéreis.
- Vire o prato de cabeça para baixo. Marque o limite ao redor do compartimento médio da inserção usando um marcador preto permanente com ponta ultra-fina.
- Sementes 3 x 104 interneurônios gabaergicos humanos no compartimento médio em 70 μL de meio neuronal (Figura 3A).
- Sementes 104 células endoteliais periventriculares humanas em 70 μL de média de células endoteliais periventriculares e 104 células endoteliais de controle em 70 μL de meio de célulaendotelal de controle nos dois compartimentos externos respectivamente(Figura 3A).
- Adicione 1 mL de meio de cocultura (50% de manutenção periventricular média sem GABA e 50% de meio neuronal) ao longo da lateral do prato para evitar que o revestimento no prato seque.
- Verifique o microscópio para verificar se as células não estão vazando do compartimento de inserção.
- Incubam células por 24 h a 37 °C e 5% CO2. Após 24 h de incubação, verifique um microscópio para verificar se as células se conectaram corretamente e não há vazamento.
- Após 48 h de semeade, remova delicadamente a inserção usando uma pinça estéril. Verifique o microscópio para verificar se a camada celular não está perturbada (dia 0).
- Remova o meio e adicione 1 mL de meio de cocultura fresco.
NOTA: Reserve o número necessário de pratos para imagens do dia 0. - Incubam células por 36 h a 37 °C e 5% CO2. Após 36 h, meio aspirado, fixe células com 4% de PFA por 10 min, e lave 3x com 1x PBS.
- Mancha os interneurônios gabaergicos humanos com β-tubulina anti-humana ou anticorpo MAP2 anti-humano. No final do procedimento de coloração, adicione 1 mL de montagem de antifídeo em cada prato.
9. Análise de Imagem e Dados
- Coloque o prato de ensaio imunomanchado um microscópio na ampliação 4X.
- Mantenha uma borda longa do limite retangular (feito na etapa 5.10 acima) no campo de visão. Tire imagens de células no espaço livre de células adjacente a esse limite. Adquirir imagens ao longo da borda longa direita e da borda esquerda do limite retangular(Figura 2B).
NOTA: As células posicionadas na diagonal em relação ao retângulo não são consideradas devido à ambiguidade na seleção da ponta curta ou longa como marca de partida. Além disso, o número de células migrando através da borda curta são muitas vezes significativamente menores (possivelmente devido ao menor número de células iniciais ao longo da borda curta) e não são considerados. - Abra as imagens no ImageJ. Calcule a distância entre cada célula e a marca de limite(Figura 2D) usando ImageJ.
- Para avaliar a migração em termos de número de células, estabeleça uma distância específica do limite na imagem adquirida no ImageJ. Conte o número de células que estão presentes a essa distância. Calcular número médio, desvio padrão e significância estatística usando software apropriado.
Resultados
Os passos para configurar uma inserção de cultura de um poço dentro de um prato de 35 mm são mostrados na Figura 1. Ensaio seleção de migração de longa distância e ensaio de migração de co-cultura usaram uma inserção de um poço para semear o número desejado de células no centro de uma antena poli-L-ornithine/laminin revestida de 35 mm. No dia 0, as células estavam presentes como um remendo retangular (Figura 2A,C). Nas imagens do dia 0, a linha dia 0 poderia ser facilmente identificada pela borda afiada da camada celular (linha pontilhada branca na Figura 2C). Por volta das 48 h, as células haviam migrado para o espaço livre de células (Figura 2B,D). Nas imagens pós-dia 0, a borda preta desenhada em torno da inserção (na parte de trás do prato) poderia ser claramente observada como uma lacuna preta. A borda da lacuna foi atribuída como a linha dia 0 (linha pontilhada branca na Figura 2D). Como mencionado na Etapa 9.2, apenas as células que caíram na área adjacente às bordas longas direitas e esquerda da camada celular (área amarela na Figura 2B) foram consideradas para análise de dados. A distância percorrida por uma célula foi medida pelo cálculo da distância entre a célula (seta branca na Figura 2D) e a linha dia 0. A coloração imunocitoquímica com anticorpo Caspase 3 antiativo, um marcador de apoptose, não mostrou nenhum sinal apoptótico nas células semeadas (Figura 2E). No ensaio de migração da cocultura, quando os interneurônios eram co-semeados com células endoteliais periventriculares humanas, os neurônios viajavam distâncias mais distantes em comparação com quando os interneurônios eram semeados sozinhos ou quando co-semeados com células endoteliais de controle(Figura 2F). Além disso, para a mesma faixa de distância, um número maior de interneurônios migrou quando co-semeado com células endoteliais periventriculares em comparação com os interneurônios nos outros dois grupos. Isso mostra que, como células endoteliais periventriculares de camundongos, células endoteliais periventriculares humanas promovem a migração do interneurônio humano.
No ensaio quimio-atração, usando inserções culturais de três poços, os interneurônios humanos foram semeados como um pequeno patch retangular em um prato de cultura revestida poli-L-ornithine/laminin de 35 mm. As células endoteliais periventriculares e controlam células endoteliais não periventriculares foram semeadas como manchas em ambos os lados do patch neuronal, com a diferença entre cada patch sendo de 500 μm(Figura 3A). O número de interneurônios que migraram para células endoteliais periventriculares versus células endoteliais de controle foi quantificado após 36 h. Um número significativamente maior de interneurônios migraram para células endoteliais periventriculares em comparação com células endoteliais de controle(Figura 3B,C),confirmando que os interneurônios gabaergicos respondem seletivamente a pistas quimio-atraentes secretadas por células endoteliais periventriculares humanas.
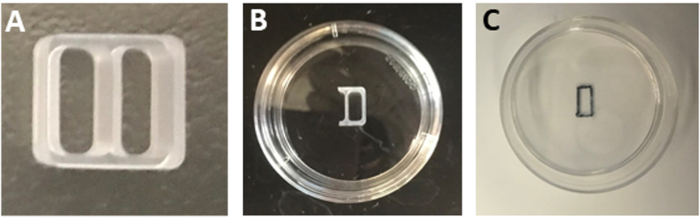
Figura 1: Preparação da inserção da cultura. (A)Uma inserção de cultura de dois poços. (B)Uma inserção de um poço fixada no centro de um prato de 35 mm. (C) O contorno do patch retangular como observado após a remoção da inserção. Clique aqui para ver uma versão maior deste valor.

Figura 2: Schema e resultado representativo do ensaio migratório. (A)Esquema da camada celular (retângulo vermelho) no dia 0. (B)Esquema de células migrando para o espaço livre de células. Os pontilhões vermelhos indicam células migratórias. A região amarela marca a área que é imaged para aquisição de dados. A caixa pontilhada em A e B corresponde à área mostrada nos painéis C e D. (C,D) Imagens fluorescentes representativas de anticorpos anti-β-tubulinos rotulados interneurônios no dia 0(C) e dia 2(D) do ensaio migratório. A linha pontilhada branca marca o dia 0. A linha amarela em D indica que a distância percorrida por uma célula (marcada por flecha branca) em 48 h. (E) Neurônios (no dia 0) são co-rotulados com anticorpos anti-β-tubulina (vermelho) e anti-ativos caspase 3 anti-ativos (verde), que marcam células apoptoticas. Núcleos estão manchados com DAPI (azul). As células apoptoticas não foram detectadas em células semeadas. (F) Gráfico do 5º dia do ensaio co-cultura, onde o número de interneurônios que migraram é traçado contra a distância percorrida. Em comparação com os interneurônios que foram semeados sozinhos ou co-semeados com células endoteliais de controle, os interneurônios co-semeados com células endoteliais periventriculares migraram em maior número, e também viajaram mais longe. Os dados representam ± S.D (n = 5; **p<0,01, ***p< 0,001, Teste de Estudante t). Barras de escala = 100 μm. IN = interneurônios; PV EC = células endoteliais periventriculares. Clique aqui para ver uma versão maior deste valor.

Figura 3: Ensaio de atração de quimioterapia. (A)Schema do ensaio quimio-atração. Usando uma inserção de cultura de três poços, os interneurônios (IN) foram semeados no meio (retângulo pontilhado verde), enquanto as células endoteliais periventriculares (ECs PV; retângulo pontilhado laranja) e células endoteliais de controle (ECs; retângulo pontilhado amarelo) foram semeadas em ambos os lados. (B)Imagens de interneurônios rotulados de β-Tubulin mostrando migração robusta para células endoteliais periventriculares, mas não para controlar células endoteliais. (C) Quantificação da resposta quimio-atraente dos interneurônios. Um número significativamente maior de neurônios migrou para células endoteliais periventriculares do que para controlar células endoteliais. Os dados representam ± S.D (n = 5; *p < 0,05, teste t do aluno). Barras de escala = 100 μm. Clique aqui para ver uma versão maior deste valor.
| Um | Vantagens | Limitações |
| Ensaio da câmara de Boyden16,17 | · Tecnicamente não exigente · Adequado para células aderentes e não aderentes · Pode ser modificado para estudar o efeito da sinalização paracrina ou atraindo quimio-atrativos na migração celular | · Ensaio de ponto final. Não é adequado para imagens em tempo real. · Não é adequado para o estudo do efeito da interação celular-célula direta na migração |
| Ensaio dearranhão 18 | · Ponto final ou cinético · Tecnicamente não exigente | · Ensaios comprimento de migração de algumas centenas de micrômetros. Não é adequado para estudo da migração de longa distância na faixa de 1-2 cm. · Não é adequado para células de suspensão · Variações na área de arranhões |
| Ensaio migratório de longa distância | · Ponto final ou cinético · Permite estudo da migração de longa distância entre 1,5 a 2 cm · Tecnicamente não exigente | · Não é adequado para células de suspensão |
| Ensaio de migração de co-cultura | · Ponto final ou cinético · Permite o estudo do efeito do contato direto celular-celular na migração · Permite tempo de migração de até 1,5 a 2 cm · Tecnicamente não exigente | · Não é adequado para células de suspensão |
| B | Vantagens | Limitações |
| Ensaio da câmara de Boyden | · Tecnicamente não exigente · Adequado para células aderentes e não aderentes | · Ensaio de ponto final. Não é adequado para imagens ao vivo. · Gradiente de concentração íngreme |
| Ensaio sub-agarose19 | · Tecnicamente não exigente · Dois ou mais sinais atraentes para quimioterapia podem ser ensaios em uma configuração | · Não é adequado para células aderentes. Restrito principalmente a glóbulos. · Difícil visualização de células em agarose |
| Ensaio de migração de câmara capilar20,21 | · Ponto final ou cinético · Adequado para celas aderentes ou suspensas | · Precisa de câmaras especiais |
| Dispositivo microfluido22 | · Gera gradiente de concentração controlável e estável · Permite resolução de nível unicelular | · Precisa de dispositivos e ferramentas sofisticadas · Tecnicamente exigente e íngreme curva de aprendizado · Análise complexa de imagem e dados |
| Ensaio de atração de quimioterapia | · Ponto final ou cinético · Gradiente gradual de concentração · Adequado para imagens em tempo real ou fluorescentes · Tecnicamente não exigente | · Não é adequado para células de suspensão |
Tabela 1: Comparação dos métodos de ensaio. (A)Comparação de ensaios comuns de migração in vitro com o ensaio e ensaio de migração de longa distância. (B)Comparação de ensaios comuns de quimioterapia com o ensaio quimio-atração.
Discussão
Aqui, descrevemos três ensaios in vitro que, juntos, fornecem avaliação quantitativa de propriedades específicas de células endoteliculares periventriculares humanas. Esses ensaios serão valiosos para obter insights mecanicistas sobre a interação de células endoteliais periventriculares humanas com interneurônios humanos. Experimentos usando ligands, inibidores ou células com knockdown ou superexpressão específicas de genes identificarão ou validarão jogadores moleculares que mediam a migração interneurônio guiada por células endoteliais ou propriedades migratórias de longa distância de células endoteliais periventriculares. Esses ensaios também podem ser modificados para realizar estudos de migração de lapso de tempo em tempo de células vivas. Além disso, há evidências de interação de células endoteliais com células diferentes dos interneurônios. Estudos do nosso grupo e outros têm aludido à influência de células endoteliais periventriculares na padronização de neurônios de projeção e proliferação de células precursoras neurais5,14,15. Seria de interesse testar essas possíveis interações usando nossas configurações de ensaio. Por fim, esses ensaios servirão como plataforma de avaliação de células endoteliais periventriculares doentes. Nosso trabalho estabeleceu novas ligações autônomas entre a rede vascular periventricular e a origem de transtornos neuropsiquiátricos como esquizofrenia, epilepsia, autismo e depressão grave3,5. Esses ensaios serão inestimáveis na identificação de potenciais defeitos na migração de longa distância, quimio-atração ou sinalização de juxtracrina de células endoteliais periventriculares doentes nessas condições de transtorno neuropsiquiátrico.
Esses ensaios são simples, reprodutíveis e de baixo custo, e podem ser modificados para medir a migração celular e os efeitos da cocultura ou da quimio-atraente pistas sobre a migração em vários tipos de células, exceto para células não aderentes. Existem alguns passos críticos que precisam ser seguidos para obter resultados precisos e reprodutíveis. Em primeiro lugar, é fundamental otimizar o número de células de semeade para cada ensaio. O número de células a serem semeadas em um único compartimento deve depender do tipo celular, do nível desejado de confluência e de fatores específicos de ensaio, como a razão da co-cultura. Em segundo lugar, é necessário otimizar o meio de cultura celular para cada ensaio. No ensaio de migração de cocultura e no ensaio quimio-atração, onde mais de um tipo de célula é semeado em um único prato, o meio de ensaio deve ser propício para todos os tipos de células. Em experimentos piloto, examinamos o efeito do meio de co-cultura sobre viabilidade (usando método de exclusão azul trypan) e morfologia (usando imunocitoquímica) de cada tipo de célula. Nós culturamos neurônios gabaergicos humanos com meio de cocultura por uma semana e não observamos diferença significativa na viabilidade e morfologia dos neurônios no meio da cocultura em comparação com neurônios cultivados em meio neuronal. Da mesma forma, as células endoteliais periventriculares e controlam células endoteliais, cultivadas em meio de cocultura para duas passagens, não apresentaram nenhuma variação significativa na sobrevivência celular e morfologia. Em terceiro lugar, uma vez que a taxa de migração varia entre diferentes tipos de células, é importante determinar o prazo para cada ensaio para o tipo celular(s) sendo estudado. Em quarto lugar, é fundamental lidar com as pastilhas culturais cuidadosamente. As pastilhas devem ser fixadas firmemente no prato pressionando suavemente com uma ponta de dedo. O prato deve ser virado de cabeça para baixo para verificar se a inserção não está se movendo. O cuidado também deve ser tomado ao remover a inserção para não perturbar a camada celular. Finalmente, recomenda-se aumentar o tamanho da amostra para reduzir a variabilidade experimental.
Em conclusão, esses ensaios expandirão significativamente nossa compreensão da biologia celular endotelicular humana e seu papel no desenvolvimento cerebral em condições normais e doentes.
Divulgações
Os autores não declaram conflito de interesses.
Agradecimentos
Este trabalho contou com o apoio de premiações do Instituto Nacional de Saúde Mental (R01MH1110438) e do Instituto Nacional de Distúrbios Neurológicos e Acidente Vascular Cerebral (R01NS100808) à AV.
Materiais
| Name | Company | Catalog Number | Comments |
| Accutase dissociation solution | Millipore Sigma | SCR005 | Cell dissociation solution (for periventricular endothelial cells, step 1.4) |
| Anti-human β-Tubulin antibody | Biolegend | 802001 | |
| Anti-human CD31 antibody | Millipore Sigma | CBL468 | |
| Anti- MAP2 antibody | Neuromics | CH22103 | |
| Anti-active Caspase 3 antibody | Millipore Sigma | AB3623 | |
| Control human endothelial cells | Cellular Dynamics | R1022 | |
| Control endothelial Cells Medium Supplement | Cellular Dynamics | M1019 | |
| Cryogenic vials | Fisher Scientific | 03-337-7Y | |
| DMEMF/12 medium | Thermofisher Scientific | 11320033 | |
| DMSO | Sigma-Aldrich | D2650 | |
| E6 medium | Thermofisher Scientific | A1516401 | |
| FGF2 | Thermofisher Scientific | PHG0261 | |
| Fibronectin | Thermofisher Scientific | 33016-015 | |
| Freezing Container | Thermofisher Scientific | 5100 | |
| GABA | Sigma-Aldrich | A2129 | |
| Hemacytometer | Sigma-Aldrich | Z359629 | |
| Human GABAergic neurons | Cellular Dynamics | R1013 | |
| Human GABAergic neurons base medium | Cellular Dynamics | M1010 | |
| Human GABAergic neuron Neural supplement | Cellular Dynamics | M1032 | |
| Laminin | Sigma | L2020 | |
| Matrigel | Corning | 356230 | Basement membrane matrix |
| Mounting Medium | Vector laboratories | H-1200 | |
| poly-L-ornithin | Sigma | p4957 | |
| PBS | Thermofisher Scientific | 14190 | |
| Trypan blue | Thermofisher Scientific | 15250061 | |
| TrypLE | Thermofisher Scientific | 12563011 | Cell dissociation solution (for GABAergic interneurons and endothelial cells, sections 3 and 4) |
| VEGF-A | Peprotech | 100-20 | |
| VascuLife VEGF Medium Complete Kit | Lifeline Cell Technologies | LL-0003 | Component of control human endothelial cell medium |
| 2-well silicone culture-Insert | ibidi | 80209 | |
| 3-well silicone culture-Insert | ibidi | 80369 | |
| 35 mm dish | Corning | 430165 | |
| 15-ml conical tube | Fisher Scientific | 07-200-886 | |
| 4% PFA solution | Fisher Scientific | AAJ19943K2 | |
| 6-well tissue culture plate | Fisher Scientific | 14-832-11 | |
| Inverted phase contrast microscope | Zeiss | Zeiss Axiovert 40C | |
| Fluorescent microscope | Olympus | FSX-100 |
Referências
- Sweeney, M. D., Zhao, Z., Montagne, A., Nelson, A. R., Zlokovic, B. V. Blood-Brain Barrier: From Physiology to Disease and Back. Physiological Reviews. 99 (1), 21-78 (2019).
- Vasudevan, A., Long, J. E., Crandall, J. E., Rubenstein, J. L., Bhide, P. G. Compartment-specific transcription factors orchestrate angiogenesis gradients in the embryonic brain. Nature Neuroscience. 11 (4), 429-439 (2008).
- Won, C., et al. Autonomous vascular networks synchronize GABA neuron migration in the embryonic forebrain. Nature Communications. 4, 2149(2013).
- Li, S., Haigh, K., Haigh, J. J., Vasudevan, A. Endothelial VEGF sculpts cortical cytoarchitecture. The Journal of Neuroscience. 33 (37), 14809-14815 (2013).
- Li, S., et al. Endothelial cell-derived GABA signaling modulates neuronal migration and postnatal behavior. Cell Research. 28 (2), 221-248 (2018).
- Lewis, D. A., Levitt, P. Schizophrenia as a disorder of neurodevelopment. Annual Review of Neuroscience. 25, 409-432 (2002).
- Lewis, D. A., Hashimoto, T., Volk, D. W. Cortical inhibitory neurons and schizophrenia. Nature Reviews Neuroscience. 6 (4), 312-324 (2005).
- Marin, O. Interneuron dysfunction in psychiatric disorders. Nature Reviews Neuroscience. 13 (2), 107-120 (2012).
- Levitt, P., Eagleson, K. L., Powell, E. M. Regulation of neocortical interneuron development and the implications for neurodevelopmental disorders. Trends in Neurosciences. 27 (7), 400-406 (2004).
- Treiman, D. M. GABAergic mechanisms in epilepsy. Epilepsia. 42 (3), 8-12 (2001).
- Datta, D., Subburaju, S., Kaye, S., Vasudevan, A. Human forebrain endothelial cells for cell-based therapy of neuropsychiatric disorders. Proceedings of 22nd Biennial Meeting of the International Society for Developmental Neuroscience. , Nara, Japan. (2018).
- Bellin, M., Marchetto, M. C., Gage, F. H., Mummery, C. L. Induced pluripotent stem cells: the new patient? Nature Reviews Molecular Cell Biology. 13 (11), 713-726 (2012).
- Ardhanareeswaran, K., Mariani, J., Coppola, G., Abyzov, A., Vaccarino, F. M. Human induced pluripotent stem cells for modelling neurodevelopmental disorders. Nature Reviews Neurology. 13 (5), 265-278 (2017).
- Stubbs, D., et al. Neurovascular congruence during cerebral cortical development. Cerebral Cortex. 19 (1), 32-41 (2009).
- Vissapragada, R., et al. Bidirectional crosstalk between periventricular endothelial cells and neural progenitor cells promotes the formation of a neurovascular unit. Brain Research. 1565, 8-17 (2014).
- JoVE Science Education Database. Cell Biology. The Transwell Migration Assay. Journal of Visualized Experiments. , Cambridge, MA. (2019).
- Renaud, J., Martinovic, M. G. Development of an insert co-culture system of two cellular types in the absence of cell-cell contact. Journal of Visualized Experiments. 113, e54356(2016).
- Guan, J. L. In vitro scratch assay: a convenient and inexpensive method for analysis of cell migration in vitro. Nature Protocols. 2 (2), 329-333 (2007).
- Nelson, R. D., Quie, P. G., Simmons, R. L. Chemotaxis under agarose: a new and simple method for measuring chemotaxis and spontaneous migration of human polymorphonuclear leukocytes and monocytes. The Journal of Immunology. 115 (6), 1650-1656 (1975).
- Zigmond, S. H. Ability of polymorphonuclear leukocytes to orient in gradients of chemotactic factors. Journal of Cell Biology. 75 (2), 606-616 (1977).
- Zicha, D., Dunn, G., Jones, G. Analyzing chemotaxis using the Dunn direct-viewing chamber. Methods in Molecular Biology. 75, 449-457 (1997).
- Kim, B. J., Wu, M. Microfluidics for mammalian cell chemotaxis. Annals of Biomedical Engineering. 40 (6), 1316-1327 (2012).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados