Method Article
Migración, Chemo-Atracción, y Co-Cultura Ensayos para Células Endoteliales Derivadas de Células Madre Humanas y Neuronas GABAérgicas
En este artículo
Resumen
Presentamos tres ensayos simples in vitro: el ensayo de migración de larga distancia, el ensayo de migración de cocultura y el ensayo de quimio-atracción, que evalúan colectivamente las funciones de las células endoteliales periventriculares derivadas de células madre humanas y sus interacción con las interneuronas GABAérgicas.
Resumen
Papel de la vasculatura cerebral en el desarrollo del sistema nervioso y etiología de los trastornos cerebrales está ganando cada vez más atención. Nuestros estudios recientes han identificado una población especial de células vasculares, las células endoteliales periventriculares, que desempeñan un papel crítico en la migración y distribución de las interneuronas GABAérgicas prefálico durante el desarrollo embrionario. Esto, junto con sus funciones celulares-autónomas, alude a nuevos roles de células endoteliales periventriculares en la patología de trastornos neuropsiquiátricos como la esquizofrenia, la epilepsia y el autismo. Aquí, hemos descrito tres diferentes ensayos in vitro que evalúan colectivamente las funciones de las células endoteliales periventriculares y su interacción con las interneuronas GABAérgicas. El uso de estos ensayos, particularmente en un contexto humano, nos permitirá identificar el vínculo entre las células endoteliales periventriculares y los trastornos cerebrales. Estos ensayos son simples, de bajo costo y reproducibles, y se pueden adaptar fácilmente a cualquier tipo de célula adherente.
Introducción
Las células endoteliales forman el revestimiento de los vasos sanguíneos y median funciones importantes que incluyen el mantenimiento de la permeabilidad de la pared de los vasos sanguíneos, la regulación del flujo sanguíneo, la agregación plaquetaria y la formación de nuevos vasos sanguíneos. En el cerebro, las células endoteliales forman parte de una barrera hematoencefálica crítica que controla estrechamente el intercambio de materiales entre el cerebro y el torrente sanguíneo1. Nuestros estudios en la última década han identificado nuevos roles neurogénicos de las células endoteliales cerebrales que tienen implicaciones significativas para el desarrollo y el comportamiento cerebral2,3,4,5. Hemos demostrado que el cerebro embrionario del ratón está vascularizado por dos subtipos distintos de vasos, los vasos piales y los vasos periventriculares, que difieren en anatomía, origen y perfil de desarrollo2. Las células endoteliales que recubren estos dos subtipos de recipientes muestran diferencias claras en sus perfiles de expresión génica. Mientras que las células endoteliales piales en su mayoría expresan genes relacionados con la inflamación y la respuesta inmune, las células endoteliales periventriculares se enriquecen de forma única en la expresión de genes comúnmente asociados con neurogénesis, migración neuronal, quimiotaxis y orientación de axón3. Células endoteliales periventriculares también albergan una novedosa vía de señalización GABA que es distinta de la vía de señalización GABA neuronal tradicional5. Concomitante con su expresión génica, se encontraron células endoteliales periventriculares para regular la migración y distribución de las interneuronas GABAérgicas en el neocórtex en desarrollo. Durante el desarrollo embrionario, las células endoteliales periventriculares se someten a migración a larga distancia a lo largo de un gradiente ventral-dorsal para establecer la red vascular periventricular2,3. Esta ruta migratoria es reflejada un día después por las interneuronas. Las interneuronas migratorias interactúan físicamente con la red vascular periventricular preformada y la utilizan como guía para llegar a su destino final en el neocórtex. Además de actuar como un sustrato físico, las células endoteliales periventriculares sirven como la fuente de señales de navegación para las neuronas migratorias. GABA secreto celular endotelial periventricular guía la migración interneurony regula sus patrones de distribución final4. Los defectos en la migración y distribución interneurona se asocian con trastornos neuropsiquiátricos como autismo, epilepsia, esquizofrenia y depresión6,7,8,9,10. Por lo tanto, el estudio de las funciones de las células endoteliales periventriculares y su influencia en la migración interneuronal en el contexto humano se vuelve fundamental para abordar la patogénesis de estos trastornos.
Hemos generado células endoteliales periventriculares humanas a partir de células madre embrionarias humanas en nuestro laboratorio11,utilizando la tecnología inducida de células madre pluripotentes (iPSC)12,13. Para validar si las células endoteliales periventriculares humanas imitan fielmente las células endoteliales periventriculares del ratón, y para evaluar cuantitativamente su influencia en la migración interneuronica, desarrollamos tres ensayos in vitro: un ensayo de migración a larga distancia, un ensayo de migración de cocultivo y un ensayo de quimio-atracción. Aquí describimos los protocolos para estos ensayos en detalle. Los tres ensayos se basan en el uso de inserciones de cultivo de silicona para crear un pequeño parche rectangular de celdas (de dimensiones fijas) rodeados de espacio libre de celdas. La distancia de migración se evalúa midiendo la distancia entre las posiciones finales de las celdas desde el borde del parche rectangular que se ha descrito el día 0. En el ensayo de migración de larga distancia, las células endoteliales periventriculares humanas se sembran como un parche en el centro de un plato de 35 mm, y se calculan las distancias recorridas por las células durante un largo rango de tiempo. En el ensayo de migración de cocultivo, las células endoteliales periventriculares humanas se co-sembran con interneuronas humanas como un parche en un plato de 35 mm. Esta configuración permite examinar el efecto de las interacciones físicas directas de estos dos tipos de células en la tasa de migración de las interneuronas. El ensayo de quimio-atracción mide la migración de las interneuronas en respuesta a las señales quimio-atractivas secretadas por las células endoteliales periventriculares humanas. Las interneuronas se sembran como un parche rectangular, con células endoteliales periventriculares humanas y controlar las células endoteliales no periventriculares sembradas como parches de tamaño similar a ambos lados. Cada uno de los parches celulares están separados por una brecha libre de células de 500 m. La respuesta de las interneuronas se evalúa cuantificando el número de células que han migrado hacia las células endoteliales periventriculares en comparación con el control de las células endoteliales no periventriculares.
Estos ensayos proporcionan una evaluación sólida de las funciones de las células endoteliales periventriculares humanas y su influencia en la migración interneuronal. La novedosa configuración del ensayo de larga distancia y el ensayo de migración de cocultura proporciona espacio libre de células en el rango de centímetros (1-1,5 cm) para permitir la detección de la migración de larga distancia. En la Tabla 1se presenta un resumen de las características de nuestros ensayos en comparación con otros ensayos populares. Colectivamente, los ensayos descritos aquí servirán como plataforma para evaluar las células endoteliales periventriculares "enfermas" y las interneuronas generadas a partir de iPSC s de trastornos cerebrales como la esquizofrenia, el autismo o la epilepsia. Estos ensayos también se pueden utilizar para determinar cómo diferentes condiciones (por ejemplo, inhibidores, ligandos, ARN) afectan la migración celular. Por último, estos ensayos se pueden optimizar para otros tipos de células para medir la migración a larga distancia, la quimioatracción o la migración mediada por células celulares.
Protocolo
1. Cultivo y almacenamiento de células endoteliales periventriculares humanas
- Mantener las células endoteliales periventriculares humanas en la matriz de membrana del sótano recubiertas (ver Tabla de Materiales) placas de 6 pocillos en medio de células endoteliales periventriculares (medio E6 que contiene 50 ng/mL VEGF-A, 100 ng/ml FGF2 y 5 oM GABA) a 37 oC y 5% deCO2. Cambie el medio cada día alterno.
- Descongelar la matriz de membrana del sótano en 4oC y hacer una solución de 1:100 diluyéndola en medio DMEM/F12 frío. Cubra cada pocal de una placa de 6 pocillos con 1 ml de solución de matriz. Incubar placas a 37oC durante al menos 1 h antes de su uso.
- Permita que las células endoteliales periventriculares humanas alcancen una confluencia del 80%-90%. Aspirar medio del pozo. Lave los pozos una vez con 1 ml de PBS estéril 1x por poca.
- Separe las celdas agregando 1 ml de solución de disociación celular (ver Tabla de materiales)por pozo. Incubar a 37oC durante 5 min. Después de 5 min, añadir 1 mL de medio de célula sendotelial periventricular. Transfiera la solución celular a un tubo cónico de 15 ml.
NOTA: Utilizamos Accutase para la disociación celular aquí, a diferencia de TrypLE en las secciones 3 y 4. - Células centrífugas a 500 x g durante 5 min a temperatura ambiente, aspirar el sobrenadante y resuspender el pellet celular en 1 ml de medio celular endotelial periventricular.
- Cuente las celdas vivas usando el método de exclusión azul trypan. Células de semillas en placas recubiertas con matriz fresca a una densidad de 1,2 x 105 celdas/cm2. Incubar a 37oC y 5% CO2.
- Almacenar células endoteliales periventriculares humanas mediante crioconservación en medio de congelación (90% medio de células endoteliales periventriculares y 10% DMSO).
- Disociar y recoger células siguiendo los pasos 1.3 y 1.4 anteriores. Cuente las celdas de la solución mediante el método de exclusión azul trypan.
- Células centrífugas a 500 x g durante 5 min a temperatura ambiente. Aspirar el sobrenadante y resuspender el pellet celular a 5 x 106 células / ml de medio de congelación.
- Dispensar 1 ml de células medianas de congelación más por criovial. Colocar los viales en una cámara llena de isopropanol y enfriar durante la noche en -80 oC a 1 oC/min. Transfiera los viales a un tanque de nitrógeno líquido al día siguiente para su almacenamiento a largo plazo.
2. Preparación de células endoteliales periventriculares humanas para el ensayo
- Permita que las células endoteliales periventriculares humanas alcancen una confluencia del 70%-80%.
- Disociar las células siguiendo los pasos 1.3 a 1.5 como se describió anteriormente. Cuente las celdas mediante el método de exclusión azul trypan.
3. Preparación de interneuronas GABAérgicas humanas para el ensayo
NOTA: Las interneuronas GABAérgicas derivadas de células madre pluripotentes inducidas por el hombre (iPSC) y el medio neuronal se compraron comercialmente (ver Tabla de Materiales). Las neuronas se generan diferenciando una línea iPSC derivada de fibroblastos humanos siguiendo un protocolo desarrollado por el fabricante. Las células fueron desconditadas y cultivadas de acuerdo con el protocolo del fabricante.
- Descongelar las interneuronas GABAérgicas humanas y cultivarlas en placa de 12 pocillos durante dos semanas a una confluencia de 70%-80%.
- El día del ensayo, solución de disociación de células calientes (ver Tabla de Materiales)y una alícuota de medio neuronal a 37oC durante 10 min antes de su uso.
- Aspirar el medio de cada pocal que contiene las células. Lavar las células con 1 ml de PBS estéril 1x por poca.
- Separar las células mediante la adición de 0,5 ml de solución de disociación precalentada por pozo e incubar a 37 oC durante 5 min. Añadir 1 mL de medio neuronal por poca. Transfiera la solución celular a un tubo cónico de 15 ml. Triturar suavemente para disociar los grumos celulares.
- Células centrífugas a 380 x g durante 5 min a temperatura ambiente, aspirar el sobrenadante y resuspender el pellet celular en 1 ml de medio neuronal. Cuente las celdas vivas usando el método de exclusión azul trypan.
4. Preparación de control de células endoteliales humanas para el ensayo
NOTA: El control de las células endoteliales derivadas de iPSC humanas y el medio celular endotelial se compraron comercialmente(Tabla de materiales). Estas células endoteliales se generan diferenciando una línea iPSC derivada de fibroblastos humanos al destino endotelial siguiendo un protocolo desarrollado por el fabricante. Las células fueron desconectadas y cultivadas en sustrato de fibronectina de acuerdo con el protocolo del fabricante. Las placas recubiertas de fibronectina se prepararon siguiendo el protocolo del fabricante.
- Descongelar las células endoteliales humanas y cultivarlas en placa de 6 pocillos a una confluencia de 80%-90%.
- El día del ensayo, solución de disociación de células calientes (ver Tabla de Materiales)y una alícuota de medio endotelial a 37oC durante 10 min antes de su uso.
- Aspirar el medio de cada pocal que contiene las células. Lavar las células con 1 ml de PBS estéril 1x por poca.
- Separe las células agregando 0,5 ml de solución de disociación precalentada por poca. Incubar a temperatura ambiente durante 5 min. Añadir 1 mL de medio celular endotelial por poca para neutralizar la solución de disociación. Transfiera la solución celular a un tubo cónico de 15 ml.
- Células centrífugas a 200 x g durante 5 min a temperatura ambiente. Aspirar sobrenadante y resuspender el pellet celular en 1 ml de medio celular endotelial. Cuente las celdas vivas usando el método de exclusión azul trypan.
5. Preparación de inserciones culturales de un solo pozo
- Descongelar 1 mg/ml de solución laminina a temperatura ambiente o durante la noche a 4oC.
- Cubra un número adecuado de platos de 35 mm con una solución de poli-ornitina al 0,01% (1 ml por plato). Incubar los platos a temperatura ambiente durante al menos 1 h.
- Diluir 1 mg/ml de solución de laminina 1:300 en agua estéril a una concentración final de 3,3 g/ml inmediatamente antes de su uso.
- Aspira completamente poli-L-ornitina de cada plato. Enjuague cada plato a fondo 3 veces con agua estéril y aspire completamente para evitar la toxicidad celular inducida por poli-L-ornitina.
- Añadir 1 ml de solución laminina de 3,3 g/ml a cada plato e incubar a 37 oC durante la noche o al menos 1 h. Retire la solución de laminina del plato inmediatamente antes de su uso.
NOTA: Alternativamente, guarde los platos que contienen laminina en 4 oC. Equilibrar los platos en una incubadora de cultivo celular de 37oC antes de su uso. - Corte tres lados de un pozo de un inserto de cultivo de silicona de dos pozos(Figura 1A) utilizando una cuchilla estéril para generar un inserto de un poca(Figura 1B).
NOTA: Mantenga el inserto de dos pozos firmemente unido a la superficie del embalaje original durante el corte para garantizar un corte suave y proteger la adherencia de la plaquita. - Aspirar solución laminina de los platos.
NOTA: No lave los platos con PBS estéril o agua después de la incubación de laminina. Las superficies húmedas evitarán una adhesión estrecha de la plaquita de cultivo. - Retire la plaquita de un pocto con pinzas estériles y colóquela en el centro del plato recubierto de poli-L-ornitina/laminina. Presione a lo largo de los bordes de la plaquita para fijarlo a la superficie del plato.
- Gire cuidadosamente el plato al revés para verificar que la plaquita esté firmemente adherida.
- Mantenga el plato boca abajo y marque el límite del compartimiento de la plaquita con un marcador negro permanente con una punta ultrafina(Figura 1C).
6. Ensayo de migración a larga distancia
- Suspenda las interneuronas GABAérgicas humanas a una concentración de 3 x 104 células/70 L de medio neuronal. Semilla de 70 l de solución celular dentro de cada plaquita de cultivo de un pozo.
NOTA: La densidad de sembración de las interneuronas es según la recomendación del fabricante. - Suspender las células endoteliales periventriculares humanas a una concentración de 3 x 104 células/70 l de medio de células endoteliales periventriculares. Semilla de 70 l de solución celular dentro de cada plaquita de cultivo de un pozo.
NOTA: El número de células endoteliales periventriculares humanas se sembraron en una proporción de 1:1 con el número de neuronas sembradas. - Añadir 1 ml de medio neuronal en el plato de la neurona para llenar el área alrededor de la plaquita y evitar que el recubrimiento se seque. Del mismo modo, añadir 1 ml de medio de células endoteliales periventriculares en la placa de células endoteliales periventriculares.
NOTA: Agregue el medio lentamente a lo largo del borde del plato para que la plaquita no se moleste. - Compruebe bajo un microscopio que las células no se filtren del compartimiento de la plaquita.
- Incubar células durante 24 h a 37oC y 5%CO2. Después de 24 h de incubación, compruebe bajo microscopio que las células se han conectado correctamente y no hay fugas durante la noche.
- Después de 48 h de sembración, retire suavemente el inserto con una pinza estéril. Compruebe bajo el microscopio que la capa celular permanezca intacta (día 0).
- Retire el medio del plato de neuronas y agregue 1 ml de medio neuronal fresco. Del mismo modo, extraer el medio de la placa de células endoteliales periventriculares y agregar 1 ml de medio de célula endotelial periventricular fresca.
NOTA: Reserva un número necesario de platos y fija con un 4% de PFA para imágenes de día 0. - Incubar células durante 5 días a 37oC y 5%CO2. Después de 5 días, retire el medio, fije las células con 4% de PFA durante 10 min y lave 3 veces con 1x PBS.
- Neuronas de mancha con anticuerpo map2 anti-humano o anti-humano, y células endoteliales con anticuerpo CD31 antihumano. Al final de la inmunomancha, añadir 1 ml de medio de montaje antidescolora a cada plato.
7. Ensayo de migración de cocultura
- Co-suspende 3 x 104 interneuronas GABAérgicas y 3 x 104 células endoteliales periventriculares humanas en 70 l de medio de cocultivo (50% medio de mantenimiento periventricular sin GABA y 50% medio neuronal). Selgue esta solución celular dentro del compartimiento de la plaquita de un solo poc. Prepare un número apropiado de platos de ensayo.
NOTA: GABA no se agregó en el medio de co-cultivo para excluir el efecto de GABA exógeno en la migración. - Compruebe bajo un microscopio que las células no se filtren del compartimiento de la plaquita.
- Añadir lentamente 1 ml de medio de cocultivo a lo largo del lado del plato para evitar que el recubrimiento se seque.
NOTA: Agregue el medio lentamente a lo largo del borde del plato para que la plaquita no se moleste. - Como primer control, semilla 3 x 104 interneuronas GABAérgicas humanas sólo en 70 l de medio de cocultivo por un solo inserción de pozo. Prepare un número apropiado de estos platos.
- Como segundo control, co-semilla 3 x 104 interneuronas humanas GABAérgicas con 3 x 104 controlar las células endoteliales humanas en 70 l de medio de cocultivo por un solo inserción de un pocbe. Prepare un número adecuado de platos.
- Incubar los platos durante 24 h a 37oC y 5% CO2. Después de 24 h de incubación, compruebe bajo un microscopio para verificar que las células se han conectado correctamente y no hay fugas.
- Después de 48 h de sembración, retire suavemente el inserto con una pinza estéril. Compruebe bajo el microscopio que compruebe que la capa celular no está perturbada (día 0).
- Retire el medio y agregue 1 ml de medio de cocultivo fresco.
NOTA: Reserva un número adecuado de platos para adquirir imágenes del día 0. - Incubar células durante 5 días a 37oC y 5%CO2.
- Después de 5 días, retire el medio, fije las células con 4% de PFA durante 10 min y lave 3 veces con 1x PBS.
- Mancha con anticuerpo anti-humano-Tubulino o anti-humano MAP2 para etiquetar las neuronas. Al final de la inmunomancha, añadir 1 ml de medio de montaje antidescolora a cada plato.
8. Ensayo de quimio-atracción
- Coloque un inserto de cultivo de tres polos en el centro de un plato recubierto de poli-L-ornitina/laminina utilizando pinzas estériles.
- Dale la vuelta al plato. Marque el límite alrededor del compartimiento central de la plaquita utilizando un marcador negro permanente con punta ultrafina.
- Semilla 3 x 104 interneuronas GABAérgicas humanas en el compartimento medio en 70 l de medio neuronal(Figura 3A).
- Semilla 104 células endoteliales periventriculares humanas en 70 l de medio de células endoteliales periventriculares y 104 células endoteliales de control en 70 ml de medio de células endoteliales de control en los dos compartimentos exteriores respectivamente(Figura 3A).
- Añadir 1 mL de medio de cocultivo (50% medio de mantenimiento periventricular sin GABA y 50% medio neuronal) a lo largo del lado del plato para evitar que el recubrimiento en el plato se seque.
- Compruebe bajo microscopio que las células no se filtren del compartimiento de la plaquita.
- Incubar células durante 24 h a 37oC y 5%CO2. Después de 24 h de incubación, compruebe bajo un microscopio para verificar que las células se han conectado correctamente y no hay fugas.
- Después de 48 h de sembración, retire suavemente el inserto con una pinza estéril. Compruebe bajo el microscopio que compruebe que la capa celular no está perturbada (día 0).
- Retire el medio y agregue 1 ml de medio de cocultivo fresco.
NOTA: Deje a un lado el número necesario de platos para las imágenes del día 0. - Incubar células durante 36 h a 37oC y 5%CO2. Después de 36 h, aspirar a medio, fijar las células con 4% PFA durante 10 min, y lavar 3x con 1x PBS.
- Interneuronas GABAérgicas de mancha con anticuerpo anti-humano-Tubulino o MAP2 antihumano. Al final del procedimiento de tinción, añadir 1 ml de medio de montaje antidescolora en cada plato.
9. Imágenes y análisis de datos
- Coloque el plato de ensayo inmunomanchado bajo un microscopio con un aumento 4X.
- Mantenga un borde largo del contorno rectangular (hecho en el paso 5.10 anterior) en el campo de visión. Tome imágenes de celdas en el espacio libre de celdas adyacente a ese límite. Adquirir imágenes a lo largo del borde largo derecho y el borde largo izquierdo del límite rectangular(Figura 2B).
NOTA: Las celdas colocadas diagonalmente con respecto al rectángulo no se tienen en cuenta debido a la ambiguedad en la selección del borde corto o largo como marca inicial. Además, el número de celdas que migra a través del borde corto a menudo es significativamente menor (posiblemente debido al menor número de celdas iniciales a lo largo del borde corto) y no se consideran. - Abra las imágenes en ImageJ. Calcule la distancia entre cada celda y la marca de límite(Figura 2D) utilizando ImageJ.
- Para evaluar la migración en términos de números de celda, establezca una distancia específica desde el límite de la imagen adquirida en ImageJ. Cuente el número de celdas que están presentes dentro de esta distancia. Calcule el número promedio, la desviación estándar y la significancia estadística utilizando el software adecuado.
Resultados
Los pasos para configurar una plaquita de cultivo de un solo pozo dentro de un plato de 35 mm se muestran en la Figura 1. El ensayo de migración de larga distancia y el ensayo de migración de cocultivo utilizaron un inserto de un solo pozo para sembrar el número deseado de células en el centro de un plato de 35 mm recubierto de poli-L-ornitina/laminina. En el día 0, las celdas estaban presentes como un parche rectangular(Figura 2A,C). En las imágenes del día 0, la línea del día 0 podría identificarse fácilmente por el borde afilado de la capa de celda (línea de puntos blanca en la Figura 2C). A las 48 h, las células habían migrado hacia el espacio libre de células(Figura 2B,D). En las imágenes del posdía 0, el borde negro dibujado alrededor de la plaquita (en la parte posterior del plato) se podía observar claramente como un hueco negro. El borde del hueco se asignó como la línea de día 0 (línea de puntos blanca en la Figura 2D). Como se mencionó en el paso 9.2, sólo se consideraron para el análisis de datos aquellas células que cayeron en el área adyacente a los bordes largos derecho e izquierdo de la capa celular (área amarilla en la Figura 2B). La distancia recorrida por una celda se midió calculando la distancia entre la celda (flecha blanca en la Figura 2D)y la línea del día 0. La tinción inmunocitoquímica con anticuerpo antiactivo Caspase 3, un marcador de apoptosis, no mostró señal apoptotica en las células sembradas(Figura 2E). En el ensayo de migración de cocultivo, cuando las interneuronas fueron co-sembradas con células endoteliales periventriculares humanas, las neuronas recorriste distancias más lejos en comparación con cuando las interneuronas se sembraban solas solas solas o cuando se cosembraban con células endoteliales de control(Figura 2F). Además, para el mismo rango de distancia, un mayor número de interneuronas migró cuando se co-sembrado con células endoteliales periventriculares en comparación con las interneuronas en los otros dos grupos. Esto muestra que, al igual que las células endoteliales periventriculares del ratón, las células endoteliales periventriculares humanas promueven la migración de las interneuronas humanas.
En el ensayo de quimio-atracción, utilizando inserciones de cultivo de tres polos, las interneuronas humanas se sembraron como un pequeño parche rectangular en un plato de cultivo recubierto de poli-L-ornitina/laminina de 35 mm. Las células endoteliales periventriculares y las células endoteliales no periventriculares se sembraron como parches a ambos lados del parche neuronal, con la brecha entre cada parche de 500 m(Figura 3A). El número de interneuronas que migró hacia las células endoteliales periventriculares frente a las células endoteliales de control se cuantificó después de 36 h. Un número significativamente mayor de interneuronas migradas hacia las células endoteliales periventriculares en comparación con las células endoteliales de control(Figura 3B,C),lo que confirma que las interneuronas GABAérgicas responden selectivamente a las señales quimio-atractivas secretadas por las células endoteliales periventriculares humanas.
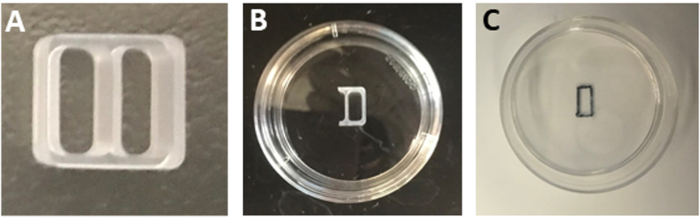
Figura 1: Preparación de la plaquita de referencia cultural. (A) Una plaquita de referencia cultural de dos pozos. (B) Un inserto de un poca fijo en el centro de un plato de 35 mm. (C) El contorno del parche rectangular como se observa después de retirar la plaquita. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Esquema y resultado representativo del ensayo de migración. (A) Esquema de la capa de celda (rectángulo rojo) en el día 0. (B) Esquema de las celdas que se migran hacia fuera en el espacio libre de celdas. Los puntos rojos indican la migración de celdas. La región amarilla marca el área que se imagee para la adquisición de datos. El cuadro punteado en A y B corresponde al área que se muestra en los paneles C y D. (C,D) Imágenes fluorescentes representativas de anticuerpos anti-Tubulina etiquetados como interneuronas el día 0 (C) y el día 2 (D) del ensayo de migración. La línea de puntos blanca marca el día 0. La línea amarilla en D indica la distancia recorrida por una célula (marcada por flecha blanca) en 48 h. (E) Las neuronas (en el día 0) están etiquetadas co-etiquetadas con anticuerpos anti-Tubulina (rojo) y anticuerpos anticasarios 3 antiactivos (verdes), que marcan las células apoptoticas. Los núcleos están manchados con DAPI (azul). Las células apoptoticas no se detectaron en células sembradas. (F) Gráfico del día 5 del ensayo de cocultura, donde el número de interneuronas que han migrado se traza contra la distancia recorrida. En comparación con las interneuronas que se sembraron solas solas o co-sembradas con células endoteliales de control, las interneuronas co-sembradas con células endoteliales periventriculares migraron en números más altos, y también viajaron más lejos. Los datos representan la media de S.D (n a 5; **p<0.01, ***p< 0.001, Student's t test). Barras de escala a 100 m. IN - interneuronas; CE FOTOVOLTAica: células endoteliales periventriculares. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Ensayo Chemo-atracción. (A) Esquema del ensayo de quimioatracción. Usando una plaquita de cultivo de tres pozos, las interneuronas (IN) se sembraron en el medio (rectángulo de puntoverde verde), mientras que las células endoteliales periventriculares (PV ECs; rectángulo de puntos naranja) y las células endoteliales de control (ECs; rectángulo de puntos amarillo) se sembraban a ambos lados. (B) Imágenes de las interneuronas etiquetadas por tubulina que muestran una migración robusta hacia las células endoteliales periventriculares, pero no hacia el control de las células endoteliales. (C) Cuantificación de la respuesta quimio-atractiva de las interneuronas. Un número significativamente mayor de neuronas migró hacia las células endoteliales periventriculares que hacia el control de las células endoteliales. Los datos representan la media de S.D (n a 5; *p < 0,05, prueba t del estudiante). Barras de escala a 100 m. Por favor, haga clic aquí para ver una versión más grande de esta figura.
| Un | Ventajas | Limitaciones |
| Ensayo de la cámara boyden16,17 | · Técnicamente no exigente · Adecuado para células adherentes y no adherentes · Se puede modificar para estudiar el efecto de la señalización paracrina o quimio-atractores en la migración celular | · Ensayo de punto final. No es adecuado para imágenes en tiempo real. · No es adecuado para el estudio del efecto de la interacción directa entre células celulares en la migración |
| Ensayo de arañazos18 | · Punto final o cinético · Técnicamente no exigente | · Ensayos de longitud de migración de unos pocos cientos de micrómetros. No es adecuado para el estudio de la migración de larga distancia en el rango de 1-2 cm. · No apto para células de suspensión · Variaciones en el área de rascar |
| Ensayo de migración a larga distancia | · Punto final o cinético · Permite estudiar la migración a larga distancia entre 1,5 y 2 cm · Técnicamente no exigente | · No apto para células de suspensión |
| Ensayo de migración de cocultura | · Punto final o cinético · Permite estudiar el efecto del contacto directo de células celulares en la migración · Permite una longitud de migración de hasta 1,5 a 2 cm · Técnicamente no exigente | · No apto para células de suspensión |
| B | Ventajas | Limitaciones |
| Ensayo de cámara de Boyden | · Técnicamente no exigente · Adecuado para células adherentes y no adherentes | · Ensayo de punto final. No es adecuado para imágenes en vivo. · Pendiente de concentración empinada |
| Ensayo subagarose19 | · Técnicamente no exigente · Dos o más señales quimioatractivas se pueden analizar en una sola | · No es adecuado para células adherentes. Restringido principalmente a las células sanguíneas. · Difícil visualización de células en agarosa |
| Ensayo de migración de la cámara capilar20,21 | · Punto final o cinético · Adecuado para células adherentes o de suspensión | · Necesita cámaras especiales |
| Dispositivo microfluídico22 | · Genera gradiente de concentración controlable y estable · Permite la resolución de nivel de una sola celda | · Necesita dispositivos y herramientas sofisticados · Curva de aprendizaje técnicamente exigente y empinada · Imágenes complejas y análisis de datos |
| Ensayo chemo-atracción | · Punto final o cinético · Gradiente de concentración gradual · Adecuado para imágenes fluorescentes o en tiempo real · Técnicamente no exigente | · No apto para células de suspensión |
Tabla 1: Comparación de métodos de ensayo. (A) Comparación de los ensayos comunes de migración in vitro con el ensayo de migración a larga distancia y el ensayo de cocultura. (B) Comparación de ensayos comunes de quimiotaxis con el ensayo de quimioatracción.
Discusión
Aquí, describimos tres ensayos in vitro que juntos proporcionan una evaluación cuantitativa de las propiedades específicas de las células endoteliales periventriculares humanas. Estos ensayos serán valiosos para obtener información mecanicista sobre la interacción de las células endoteliales periventriculares humanas con las interneuronas humanas. Los experimentos con ligandos, inhibidores o células con derribo o sobreexpresión específicos de genes identificarán o validarán jugadores moleculares que median la migración interneuronal guiada por células endoteliales o las propiedades migratorias de larga distancia de las células endoteliales periventriculares. Estos ensayos también se pueden modificar para realizar estudios de migración de lapso de tiempo de células vivas. Además, hay evidencia para la interacción de las células endoteliales con células distintas de las interneuronas. Estudios de nuestro grupo y otros han aludido a la influencia de las células endoteliales periventriculares en el patrón de las neuronas de proyección y la proliferación de células precursoras neuronales5,14,15. Sería de interés probar estas posibles interacciones utilizando nuestra configuración de ensayo. Por último, estos ensayos servirán como plataforma para la evaluación de células endoteliales periventriculares enfermas. Nuestro trabajo ha establecido nuevos vínculos autónomos entre la red vascular periventricular y el origen de trastornos neuropsiquiátricos como la esquizofrenia, la epilepsia, el autismo y la depresión mayor3,5. Estos ensayos serán invaluables en la identificación de posibles defectos en la migración de larga distancia, quimio-atracción, o señalización de juxtracrina de células endoteliales enfermas-periventriculares en estas condiciones de trastorno neuropsiquiátrico.
Estos ensayos son simples, reproducibles y de bajo costo, y se pueden modificar para medir la migración celular y los efectos del cocultivo o señales quimioatractivas en la migración en varios tipos de células, excepto en el caso de células no adherentes. Hay algunos pasos críticos que deben seguirse para obtener resultados precisos y reproducibles. En primer lugar, es fundamental optimizar el número de celda de sembrado para cada ensayo. El número de celdas que se van a sembrar en un solo compartimiento debe depender del tipo de celda, el nivel deseado de confluencia y factores específicos del ensayo, como la relación de cocultura. En segundo lugar, es necesario optimizar el medio de cultivo celular para cada ensayo. En el ensayo de migración de cocultura y el ensayo de quimio-atracción, donde se sembra más de un tipo de célula en un solo plato, el medio de ensayo debe ser propicio para todos los tipos de células. En experimentos piloto, examinamos el efecto del medio de cocultivo en la viabilidad (usando el método de exclusión azul trypan) y la morfología (usando inmunocitoquímica) de cada tipo de célula. Cultivamos neuronas GABAérgicas humanas con medio de cocultivo durante una semana y no observamos ninguna diferencia significativa en la viabilidad y morfología de las neuronas en el medio de cocultivo en comparación con las neuronas cultivadas en el medio neuronal. De manera similar, las células endoteliales periventriculares y las células endoteliales de control, cultivadas en un medio de cocultivo para dos pasajes, no mostraron ninguna variación significativa en la supervivencia celular y la morfología. En tercer lugar, dado que la tasa de migración varía entre diferentes tipos de celda, es importante determinar el período de tiempo para cada ensayo para los tipos de celda que se están estudiando. En cuarto lugar, es fundamental manejar cuidadosamente las inserciones de referencia cultural. Las plaquitas deben fijarse firmemente en el plato presionando suavemente con la yema del dedo. El plato debe girarse al revés para verificar que la plaquita no se está moviendo. También se debe tener cuidado al retirar el inserto para no molestar a la capa celular. Por último, se recomienda aumentar el tamaño de la muestra para reducir la variabilidad experimental.
En conclusión, estos ensayos ampliarán significativamente nuestra comprensión de la biología de las células endoteliales periventriculares humanas y su papel en el desarrollo cerebral en condiciones normales y enfermas.
Divulgaciones
Los autores no declaran conflicto de intereses.
Agradecimientos
Este trabajo fue apoyado por premios del Instituto Nacional de Salud Mental (R01MH110438) y el Instituto Nacional de Trastornos Neurológicos y Accidentes Cerebrovasculares (R01NS100808) a AV.
Materiales
| Name | Company | Catalog Number | Comments |
| Accutase dissociation solution | Millipore Sigma | SCR005 | Cell dissociation solution (for periventricular endothelial cells, step 1.4) |
| Anti-human β-Tubulin antibody | Biolegend | 802001 | |
| Anti-human CD31 antibody | Millipore Sigma | CBL468 | |
| Anti- MAP2 antibody | Neuromics | CH22103 | |
| Anti-active Caspase 3 antibody | Millipore Sigma | AB3623 | |
| Control human endothelial cells | Cellular Dynamics | R1022 | |
| Control endothelial Cells Medium Supplement | Cellular Dynamics | M1019 | |
| Cryogenic vials | Fisher Scientific | 03-337-7Y | |
| DMEMF/12 medium | Thermofisher Scientific | 11320033 | |
| DMSO | Sigma-Aldrich | D2650 | |
| E6 medium | Thermofisher Scientific | A1516401 | |
| FGF2 | Thermofisher Scientific | PHG0261 | |
| Fibronectin | Thermofisher Scientific | 33016-015 | |
| Freezing Container | Thermofisher Scientific | 5100 | |
| GABA | Sigma-Aldrich | A2129 | |
| Hemacytometer | Sigma-Aldrich | Z359629 | |
| Human GABAergic neurons | Cellular Dynamics | R1013 | |
| Human GABAergic neurons base medium | Cellular Dynamics | M1010 | |
| Human GABAergic neuron Neural supplement | Cellular Dynamics | M1032 | |
| Laminin | Sigma | L2020 | |
| Matrigel | Corning | 356230 | Basement membrane matrix |
| Mounting Medium | Vector laboratories | H-1200 | |
| poly-L-ornithin | Sigma | p4957 | |
| PBS | Thermofisher Scientific | 14190 | |
| Trypan blue | Thermofisher Scientific | 15250061 | |
| TrypLE | Thermofisher Scientific | 12563011 | Cell dissociation solution (for GABAergic interneurons and endothelial cells, sections 3 and 4) |
| VEGF-A | Peprotech | 100-20 | |
| VascuLife VEGF Medium Complete Kit | Lifeline Cell Technologies | LL-0003 | Component of control human endothelial cell medium |
| 2-well silicone culture-Insert | ibidi | 80209 | |
| 3-well silicone culture-Insert | ibidi | 80369 | |
| 35 mm dish | Corning | 430165 | |
| 15-ml conical tube | Fisher Scientific | 07-200-886 | |
| 4% PFA solution | Fisher Scientific | AAJ19943K2 | |
| 6-well tissue culture plate | Fisher Scientific | 14-832-11 | |
| Inverted phase contrast microscope | Zeiss | Zeiss Axiovert 40C | |
| Fluorescent microscope | Olympus | FSX-100 |
Referencias
- Sweeney, M. D., Zhao, Z., Montagne, A., Nelson, A. R., Zlokovic, B. V. Blood-Brain Barrier: From Physiology to Disease and Back. Physiological Reviews. 99 (1), 21-78 (2019).
- Vasudevan, A., Long, J. E., Crandall, J. E., Rubenstein, J. L., Bhide, P. G. Compartment-specific transcription factors orchestrate angiogenesis gradients in the embryonic brain. Nature Neuroscience. 11 (4), 429-439 (2008).
- Won, C., et al. Autonomous vascular networks synchronize GABA neuron migration in the embryonic forebrain. Nature Communications. 4, 2149(2013).
- Li, S., Haigh, K., Haigh, J. J., Vasudevan, A. Endothelial VEGF sculpts cortical cytoarchitecture. The Journal of Neuroscience. 33 (37), 14809-14815 (2013).
- Li, S., et al. Endothelial cell-derived GABA signaling modulates neuronal migration and postnatal behavior. Cell Research. 28 (2), 221-248 (2018).
- Lewis, D. A., Levitt, P. Schizophrenia as a disorder of neurodevelopment. Annual Review of Neuroscience. 25, 409-432 (2002).
- Lewis, D. A., Hashimoto, T., Volk, D. W. Cortical inhibitory neurons and schizophrenia. Nature Reviews Neuroscience. 6 (4), 312-324 (2005).
- Marin, O. Interneuron dysfunction in psychiatric disorders. Nature Reviews Neuroscience. 13 (2), 107-120 (2012).
- Levitt, P., Eagleson, K. L., Powell, E. M. Regulation of neocortical interneuron development and the implications for neurodevelopmental disorders. Trends in Neurosciences. 27 (7), 400-406 (2004).
- Treiman, D. M. GABAergic mechanisms in epilepsy. Epilepsia. 42 (3), 8-12 (2001).
- Datta, D., Subburaju, S., Kaye, S., Vasudevan, A. Human forebrain endothelial cells for cell-based therapy of neuropsychiatric disorders. Proceedings of 22nd Biennial Meeting of the International Society for Developmental Neuroscience. , Nara, Japan. (2018).
- Bellin, M., Marchetto, M. C., Gage, F. H., Mummery, C. L. Induced pluripotent stem cells: the new patient? Nature Reviews Molecular Cell Biology. 13 (11), 713-726 (2012).
- Ardhanareeswaran, K., Mariani, J., Coppola, G., Abyzov, A., Vaccarino, F. M. Human induced pluripotent stem cells for modelling neurodevelopmental disorders. Nature Reviews Neurology. 13 (5), 265-278 (2017).
- Stubbs, D., et al. Neurovascular congruence during cerebral cortical development. Cerebral Cortex. 19 (1), 32-41 (2009).
- Vissapragada, R., et al. Bidirectional crosstalk between periventricular endothelial cells and neural progenitor cells promotes the formation of a neurovascular unit. Brain Research. 1565, 8-17 (2014).
- JoVE Science Education Database. Cell Biology. The Transwell Migration Assay. Journal of Visualized Experiments. , Cambridge, MA. (2019).
- Renaud, J., Martinovic, M. G. Development of an insert co-culture system of two cellular types in the absence of cell-cell contact. Journal of Visualized Experiments. 113, e54356(2016).
- Guan, J. L. In vitro scratch assay: a convenient and inexpensive method for analysis of cell migration in vitro. Nature Protocols. 2 (2), 329-333 (2007).
- Nelson, R. D., Quie, P. G., Simmons, R. L. Chemotaxis under agarose: a new and simple method for measuring chemotaxis and spontaneous migration of human polymorphonuclear leukocytes and monocytes. The Journal of Immunology. 115 (6), 1650-1656 (1975).
- Zigmond, S. H. Ability of polymorphonuclear leukocytes to orient in gradients of chemotactic factors. Journal of Cell Biology. 75 (2), 606-616 (1977).
- Zicha, D., Dunn, G., Jones, G. Analyzing chemotaxis using the Dunn direct-viewing chamber. Methods in Molecular Biology. 75, 449-457 (1997).
- Kim, B. J., Wu, M. Microfluidics for mammalian cell chemotaxis. Annals of Biomedical Engineering. 40 (6), 1316-1327 (2012).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados