Method Article
ヒト幹細胞由来内皮細胞およびGABAergicニューロンの移動、化学誘引、共培養アッセイ
要約
我々は、3つの単純なインビトロアッセイ-長距離移動アッセイ、共培養移行アッセイ、および化学誘引アッセイ-それは、ヒト幹細胞由来の心室内皮細胞とその機能を一括して評価するGABAergic インターニューロンとの相互作用.
要約
神経系の発達と脳障害の病因における脳血管系の役割はますます注目を集めています。我々の最近の研究では、胚発生中の前脳GABAergicインターニューロンの移動と分布に重要な役割を果たす血管細胞、心室内皮細胞の特別な集団を同定しました。これは、細胞自律機能と相まって、統合失調症、てんかん、自閉症などの神経精神疾患の病理における心室内皮細胞の新しい役割を暗示している。ここでは、脳室外皮細胞の機能とGABAergicインターニューロンとの相互作用を一括して評価する3つの異なるインビトロアッセイについて説明した。これらのアッセイの使用は、特にヒトの文脈において、心室内皮細胞と脳疾患との間の関連を同定することを可能にする。これらのアッセイは、シンプルで低コストで再現性があり、あらゆる付着細胞タイプに容易に適合できます。
概要
内皮細胞は血管の内層を形成し、血管壁透過性の維持、血流の調節、血小板凝集、新しい血管の形成を含む重要な機能を仲介する。脳では、内皮細胞は脳と血流との間の物質交換を緊密に制御する重要な血液脳関門の一部を形成する1.過去10年間の我々の研究は、脳の発達と行動に重要な意味を持つ脳内皮細胞の新しい神経原性の役割を同定しました2,3,4,5.我々は、マウス胚前脳が、解剖学、起源、および発達プロファイルにおいて異なる2つの異なる血管、第二の血管、心血管および心室血管によって血管化されることを示した。これらの2つの血管サブタイプを裏打ちする内皮細胞は、それらの遺伝子発現プロファイルに明確な違いを示す。ピアリン内皮細胞は主に炎症や免疫応答に関連する遺伝子を発現するが、心室内皮細胞は神経新生、神経細胞移動、化学療法、および軸索誘導体に一般的に関連する遺伝子の発現において一意に富化される。心室外皮細胞はまた、従来の神経神経神経GABAシグナル経路5とは異なる新規GABAシグナル伝達経路を収容する。その遺伝子発現と共に、脳室内皮細胞は、発達中の新皮質におけるGABAergicインターニューロンの移動および分布を調節することが判明した。胚発生中、心室内皮細胞は腹側側側心筋勾配に沿って長距離移動を行い、心室血管ネットワーク2,3を確立する。この回遊経路は、インターニューロンによって1日後にミラーリングされます。移動インターニューロンは、事前に形成された心室血管ネットワークと物理的に相互作用し、新皮質の最終目的地に到達するためのガイドレールとしてそれを使用する。物理的な基質として作用することに加えて、心室内皮細胞は、ニューロンを移動するためのナビゲーションキューの源として機能する。心室内皮細胞分泌GABAガイドインターニューロン移動をガイドし、その最終的な分布パターンを調節する4.ニューロン間移動および分布の欠陥は、自閉症、てんかん、統合失調症およびうつ病6、7、8、9、10などの神経精神障害に関連付けられている。従って、人間の文脈における神経間移動に対する心室内皮細胞機能およびそれらの影響の研究は、これらの疾患の病態に対処するために重要となる。
我々は、人工多能性幹細胞(iPSC)技術12,13を用いて、ヒト胚性幹細胞からヒトの心室様内皮細胞を生成した。ヒト心室外皮細胞がマウスの心室内皮細胞を忠実に模倣しているかどうかを検証し、ニューロン間移動への影響を定量的に評価するために、遠隔移動アッセイ、共培養移行アッセイ、化学誘致アッセイの3つのインビトロアッセイを開発しました。ここでは、これらのアッセイのプロトコルについて詳しく説明します。3つのアッセイはすべて、シリコーン培養インサートの使用に基づいて、セルフリースペースで囲まれたセルの小さな長方形パッチ(固定寸法)を作成します。移動距離は、0日目に輪郭が描かれた矩形パッチの境界から細胞の最終的な位置間の距離を測定することによって評価される。長距離移動アッセイでは、ヒト心室内皮細胞を35mm皿の中心にパッチとして播種し、長い時間にわたって細胞が移動した距離を計算する。共培養移動アッセイでは、ヒト心室内皮細胞を35mm皿に1つのパッチとしてヒトインターニューロンと共播する。このセットアップは、インターニューロンの移動速度に対するこれら2つの細胞型の直接的な物理的相互作用の影響の検査を可能にする。ケモアチーバレンスアッセイは、ヒト心室内皮細胞によって分泌されるケモ魅力的な手がかりに応答して、ニューロン間の移動を測定する。インターニューロンは、ヒトの心室内皮細胞を有する長方形パッチとして播種され、両側に同様のサイズのパッチとして播種された非心室内皮細胞を制御する。各細胞パッチは、500μmの無細胞ギャップによって分離される。インターニューロンの応答は、非心室内皮細胞を制御することと比較して、心室内皮細胞に向かって移動した細胞の数を定量することによって評価される。
これらのアッセイは、ヒトの心室内皮細胞機能およびそれらのニューロン間移動への影響について、強固な評価を提供する。長距離アッセイと共培養移行アッセイの新しいセットアップは、長距離移動の検出を可能にするセンチメートル(約1〜1.5cm)の範囲で無細胞スペースを提供します。他の一般的なアッセイと比較したアッセイの特徴の要約を表1に示します。ここで説明するアッセイは、統合失調症、自閉症、てんかんなどの脳障害のiPSPsCから発生する「病気」の心室内皮細胞およびインターニューロンを評価するためのプラットフォームとして機能する。これらのアッセイは、異なる条件(例えば阻害剤、リガンド、RNAi)が細胞の遊入にどのように影響するかを決定するためにも使用することができる。最後に、これらのアッセイは、長距離移動、化学吸引、または細胞媒介性移動を測定するために、他の細胞タイプに最適化することができます。
プロトコル
1. ヒト心室外皮細胞の培養と保存
- 基下膜マトリックスコーティングされたヒト心室内皮細胞を維持する(材料表参照) 心室内皮細胞培地(50 ng/mL VEGF-A、100 ng/mL FGF2および5 μM GABAを含むE6培地)の6ウェルプレートを37°Cおよび5%CO2で行う。代替日ごとにメディアを変更します。
- 4°Cで基調膜マトリックスを解凍し、冷たいDMEM /F12培地でそれを希釈することによって1:100溶液を作ります。マトリックス溶液の1 mLで6ウェルプレートの各ウェルをコーティングします。使用前に少なくとも1時間、37°Cでプレートをインキュベートする。
- ヒトの心室内皮細胞が80%〜90%の合流に達することを許可する。井戸から吸引媒体。ウェルごとに1 mLの無菌1x PBSでウェルを1回洗います。
- ウェルごとに 1 mL のセル解離溶液 (材料表を参照) を加えて細胞を切り離します。37 °Cで5分間インキュベートします。5分後、心室内皮細胞培地の1 mLを加える。細胞溶液を15mL円錐形チューブに移します。
注: セクション 3 と 4 の TrypLE とは対照的に、ここではセルの解離にアキュクターゼを使用します。 - 遠心分離細胞は、室温で5分間500xgで、上清を吸引し、細胞ペレットを1mLの心室内皮細胞培地中に再懸濁する。
- トリパンブルーの除外方法を使用して、生細胞をカウントします。1.2 x 105セル/cm2の密度で新鮮なマトリックスコーティングされたプレートの種子細胞。37 °Cおよび5%のCO2でインキュベートする。
- 凍結培地(90%心室内皮細胞培地および10%DMSO)で凍結保存することによりヒト心室内皮細胞を貯蔵する。
- 上記の手順 1.3 と 1.4 に従って、細胞の関連付け解除と収集を行います。トリパンブルー除外法で溶液中の細胞をカウントします。
- 500 x gで遠心分離細胞を 5 分間室温で 5 分間.上清を吸引し、凍結培地の5 x 106細胞/mLで細胞ペレットを再懸濁する。
- 凍結培地と細胞の1 mLを凍結ごとに分配する。バイアルをイソプロパノールで満たされたチャンバーに入れ、1°C/分で-80°Cで一晩冷やします。
2. アッセイのためのヒト心室内皮細胞の調製
- ヒトの心室内皮細胞が70%〜80%の合流性に達することを許可する。
- 上記のように、手順1.3~1.5に従って細胞を解き分けさせる。トリパン ブルーの除外方法を使用してセルをカウントします。
3. アッセイのためのヒトGABAergicインターニューロンの調製
注:ヒト人工多能性幹細胞(iPSC)由来GABAergicインターニューロンおよびニューロン培地を商業的に購入しました(資料表参照)。ニューロンは、製造業者によって開発されたプロトコルに従ってヒト線維芽細胞由来iPSCラインを区別することによって生成される。細胞を解凍し、製造業者のプロトコルに従って培養した。
- ヒトGABAergicインターニューロンを解凍し、70%-80%の合所性に2週間12ウェルプレートでそれらを培養します。
- アッセイ当日、温細胞解離液(材料表参照)と、使用前に37°Cでの神経培地のアリコートを10分間行った。
- 細胞を含む各ウェルからの吸引培地。ウェル当たり1 mLの無菌1x PBSで細胞を洗浄する。
- ウェルあたり0.5 mLの予め温めた解離液を加えて細胞を切り離し、37°Cで5分間インキュベートします。細胞溶液を15mL円錐形チューブに移します。細胞の塊を解きそそります。
- 380 x gで細胞を室温で5分間遠心分離し、上清を吸引し、細胞ペレットをニューロン培地の1 mLに再懸濁する。トリパンブルーの除外方法を使用して、生細胞をカウントします。
4. アッセイのためのコントロールヒト内皮細胞の調製
注:コントロールヒトiPSC由来内皮細胞および内皮細胞培地を商業的に購入した(材料表)。これらの内皮細胞は、製造業者が開発したプロトコルに従ってヒト線維芽細胞由来iPSCラインを内皮の運命に分化することによって生成される。細胞を解凍し、製造業者のプロトコルに従ってフィブロネクチン基質で培養した。フィブロネクチンコートプレートは、製造業者のプロトコルに従って調製された。
- 解凍は、ヒト内皮細胞をコントロールし、それらを6ウェルプレートで80%〜90%の合流性に培養する。
- アッセイ当日、温細胞解離液(材料表参照)と、使用前に37°Cで内皮培地のアリコートを10分間使用した。
- 細胞を含む各ウェルから培地を吸引する。ウェル当たり1 mLの無菌1x PBSで細胞を洗浄する。
- ウェルごとに0.5 mLの予め温めた解離液を加えて細胞を切り離す。室温で5分間インキュベートし、溶離液を中和するために1mLの内皮細胞培地を1ウェルに加えます。細胞溶液を15mL円錐形チューブに移します。
- 200 x gでの遠心分離細胞を室温で 5 分間。吸引上皮を、内皮細胞培地の1mL中に細胞ペレットを再懸濁する。トリパンブルーの除外方法を使用して、生細胞をカウントします。
5. ワンウェルカルチャーインサートの調製
- 室温または4°Cで一晩で1mg/mLラミニン溶液を解凍する。
- 0.01%のポリL-オルニチン溶液(1皿あたり1 mL)で35ミリメートルの適切な数の料理をコーティングします。少なくとも1時間室温で料理をインキュベートします。
- 使用前に、滅菌水で1mg/mLラミニン溶液1:300を最終濃度3.3μg/mLに希釈します。
- 各皿からポリL-オルニチンを完全に吸引します。各皿を無菌水で3倍に十分に洗い流し、ポリL-オルニチン誘発細胞毒性を避けるために完全に吸引します。
- 各皿に3.3μg/mLラミニン溶液の1 mLを加え、37°Cで一晩または少なくとも1時間インキュベートします。
注:または、ラミニン含有食器を4°Cに保存してください。使用前に37°Cの細胞培養インキュベーターで食器を平衡化する。 - 無菌刃を用いて2ウェルシリコーン培養インサートの1ウェルの3つの側面を切り取り(図1A)、ワンウェルインサートを生成します(図1B)。
注:切断しながら元の包装の表面にしっかりと取り付けられた2ウェルインサートを保ち、滑らかなカットを確保し、インサートの接着性を保護します。 - 皿からラミニン溶液を吸引する。
注意:ラミニンインキュベーション後に、滅菌PBSや水で食器を洗わないで下さい。湿った表面は、培養インサートの密着性を防ぎます。 - 無菌ピンセットでワンウェルインサートを取り出し、ポリL-オルニチン/ラミニンコーティングされた皿の中央に置きます。チップの端に沿って押して、皿の表面に固定します。
- 慎重に皿をひっくり返して、挿入物がしっかりと付着していることを確認します。
- 皿を上下逆さまに保ち、超細かい先端を持つ永久的な黒いマーカーを使用して、挿入コンパートメントの境界をマークします(図1C)。
6. 長距離移行アッセイ
- ヒト GABAergic インターニューロンを 3 x 104細胞/70 μL のニューロン培地の濃度で中断する。各1ウェル培養インサート内の70μLの細胞溶液を播種した。
注: インターニューロンのシード密度は、製造元の推奨事項に従ってです。 - ヒト心室外皮細胞を3 x104細胞/70μLの心室内皮細胞培地の濃度で中断する。各1ウェル培養インサート内の70μLの細胞溶液を播種した。
注: 播種ニューロンの数と1:1の比率で播種されたヒトの心室内皮細胞の数。 - ニューロン皿にニューロン培地1 mLを加えて、挿入物の周囲を埋め、コーティングの乾燥を防ぎます。同様に、心室内皮細胞皿に1mLの心室内皮細胞培地を添加する。
注:挿入が妨げられないように、皿の端に沿ってゆっくりと媒体を追加します。 - 顕微鏡で、細胞がインサートコンパートメントから漏れていないことを確認します。
- 37 °Cおよび5%のCO2で24時間の細胞をインキュベートする。24時間インキュベーションした後、顕微鏡で細胞が適切に結合し、一晩漏れがないことを確認してください。
- 48時間の播種後、無菌のツイーザーを使用して挿入物を軽く取り除きます。顕微鏡下で、細胞層が乱れなき状態のままであることを確認します(0日目)。
- ニューロン皿から培地を取り出し、新鮮なニューロン培地を1 mL加えます。同様に、心室内皮細胞皿から培地を取り出し、新鮮な心室内皮細胞培地の1 mLを加える。
注:必要な数の料理を確保し、0日目の画像の4%PFAで固定してください。 - 37 °Cおよび5%のCO2で5日間細胞をインキュベートする。5日後、培地を取り出し、4%PFAで10分間PFAを固定し、1x PBSで3x洗浄します。
- 染色ニューロンは、抗ヒトβ-チューブリンまたは抗ヒトMAP2抗体を有する、および抗ヒトCD31抗体を有する内皮細胞を有する。免疫染色の終了時に、各ディッシュに1mLの抗フェード取付け培地を加えます。
7. 共文化移行アッセイ
- 共懸濁3 x 10 4 GABAergicインターニューロンおよび3 x 104ヒト経膣内皮細胞70 μLの共培養培地(GABAと50%神経培地を含まない50%の心室維持培地)。このセル溶液をワンウェルインサートコンパートメント内にシードします。そのようなアッセイ料理の適切な数を準備します。
注:GABAは、移行に対する外因性GABAの影響を排除するために共培養培地に添加されなかった。 - 顕微鏡で、細胞がインサートコンパートメントから漏れていないことを確認します。
- コーティングが乾燥するのを防ぐために、皿の側面に沿って1 mLの共培養培地をゆっくりと加えます。
注:挿入が妨げられないように、皿の端に沿ってゆっくりと媒体を追加します。 - 第1の対照として、種子3 x104ヒトGABAgicインターニューロンは、1ウェルインサート当たり70μLの共培養培地のみである。そのような料理の適切な数を準備します。
- 第2の対照として、3 x104 GABAergicヒトインターニューロンを共種に3 x104コントロールヒト内皮細胞を1ウェルインサート当たり70μLの共培養培地で制御する。適切な数の料理を準備します。
- 37 °Cおよび5%のCO2で24時間の料理をインキュベートする。24時間インキュベーションした後、顕微鏡で細胞が適切に結合し、漏れがないことを確認してください。
- 48時間の播種後、無菌のツイーザーを使用して挿入物を軽く取り除きます。顕微鏡下で細胞層が乱れていないことを確認します(0日目)。
- 培地を取り出し、1 mLの新鮮な共培養培地を加えます。
注:0日目の画像を取得するための適切な数の料理を確保してください。 - 37 °Cおよび5%のCO2で5日間細胞をインキュベートする。
- 5日後、培地を取り出し、4%PFAで10分間PFAを固定し、1x PBSで3x洗浄します。
- ニューロンを標識する抗ヒトβ-チューブリンまたは抗ヒトMAP2抗体を有する染色。免疫染色の終了時に、各ディッシュに1mLの抗フェード取付け培地を加えます。
8. ケモアトラクションアッセイ
- 滅菌ピンセットを使用して、ポリL-オルニチン/ラミニンコーティングされた35mm皿の中央に3ウェル培養インサートを置きます。
- 皿をひっくり返します。超細かい先端を持つ永久的な黒のマーカーを使用して、挿入物の中央のコンパートメントの周りの境界をマークします。
- 70μLのニューロン培地中の中間区画における種子3 x 104ヒトGABAergicインターニューロン(図3A)。
- 播種104ヒト心室内皮細胞は、それぞれ2つの外側区画内の70μLの心室内皮細胞培地の70μLおよび104コントロール内皮細胞の70μL中にそれぞれ2つの外側区画内の内皮細胞培地を制御する(図3A)。
- 皿の上のコーティングが乾燥するのを防ぐために、皿の側面に沿って1 mLの共培養培地(GABAを含まない50%の心室維持培地および50%の神経培地)を加える。
- 顕微鏡で、細胞がインサートコンパートメントから漏れていないことを確認してください。
- 37 °Cおよび5%のCO2で24時間の細胞をインキュベートする。24時間インキュベーションした後、顕微鏡で細胞が適切に結合し、漏れがないことを確認してください。
- 48時間の播種後、無菌のツイーザーを使用して挿入物を軽く取り除きます。顕微鏡下で細胞層が乱れていないことを確認します(0日目)。
- 培地を取り出し、1 mLの新鮮な共培養培地を加えます。
注:0日目の画像に必要な数の料理を確保してください。 - 37 °Cおよび5%のCO2で36時間の細胞をインキュベートする。36時間後、吸引培地、4%PFAで10分間固定し、1x PBSで3倍洗浄する。
- ヒトGABAergic染色体ニューロンを抗ヒトβ-チューブリンまたは抗ヒトMAP2抗体と共に染色する。染色手順の最後に、各皿に1 mLのアンチフェード取り付け媒体を加えます。
9. イメージングとデータ分析
- 免疫染色アッセイ皿を顕微鏡の下に4倍の倍率で置きます。
- 長方形の境界の 1 つの長いエッジ(上記の手順 5.10 で作成)を視野に保持します。その境界に隣接するセルフリースペース内のセルの画像を撮ります。長方形の境界の右長エッジと左の長辺に沿って画像を取得します(図2B)。
注: 長方形に対して斜めに配置されたセルは、開始マークとして短辺または長エッジを選択する際のあいまいさのため考慮されません。また、短辺を越えて移動するセルの数は、多くの場合、(おそらく短辺に沿った開始セルの数が少ないことが原因で) かなり少なく、考慮されません。 - イメージをイメージ J で開きます。ImageJ を使用して、各セルと境界マーク (図 2D)との間の距離を計算します。
- セル数に基して移行を評価するには、取得した画像の境界から特定の距離を ImageJ に設定します。この距離内に存在するセルの数をカウントします。適切なソフトウェアを使用して、平均数、標準偏差、および統計的有意性を計算します。
結果
35 mm 皿の内部にワンウェル カルチャ インサートを設定する手順を図 1に示します。長距離移行アッセイと共培養移行アッセイは、ワンウェルインサートを使用して、ポリL-オルニチン/ラミニンコーティングされた35mm皿の中央に所望の数の細胞を播種した。日目0に、細胞は矩形パッチとして存在していた(図2A、C)。0 日目の画像では、0 日目の線はセル層の鋭いエッジ (図 2Cの白い点線) で簡単に識別できます。48時間までに、細胞は無細胞領域に移行していた(図2B、D)。日後の0画像では、挿入物の周りに描かれた黒い境界線(皿の後ろ)は、黒いギャップとしてはっきりと見える可能性があります。ギャップの端は、0 日目の線 (図 2Dの白い点線) として割り当てられています。ステップ9.2で述べたように、データ解析のために、細胞層の左右の長い縁に隣接する領域(図2Bの黄色の領域)に落ちた細胞のみが考慮された。セルが移動する距離は、セル(図2Dの白い矢印)と0日目の線との間の距離を計算して測定した。抗活性カスパーゼ3抗体による免疫細胞化学的染色は、アポトーシスのマーカーであり、播種細胞にアポトーシスシグナルを示さなかった(図2E)。共培養移動アッセイでは、インターニューロンをヒト心室内皮細胞と共播した場合、ニューロンは、ニューロンが単独で播種されたとき、またはコントロール内皮細胞と共播したときと比較して、より遠くまで移動した(図2F)。また、同じ距離範囲について、他の2つの群の内臓内皮細胞と共播すると、より多くの数のインターニューロンが外へ移行した。これは、マウスの心室内皮細胞と同様に、ヒト心室内皮細胞がヒトのインターニューロン移動を促進することを示している。
ケモアトラクションアッセイでは、3ウェル培養インサートを用いて、ヒトインターニューロンを35mmポリL-オルニチン/ラミニンコーティング培養皿に小さな長方形パッチとして播種した。心室内皮細胞および非心室内皮細胞をコントロールし、ニューロンパッチの両側にパッチとして播種し、各パッチ間のギャップは500μmである(図3A)。制御内皮細胞に対して心室内皮細胞に向かって移行したインターニューロンの数を36時間後に定量した。コントロール内皮細胞(図3B,C)と比較して、心室内皮細胞に移行するニューロンの数が有意に多く、GABAergicインターニューロンがヒトの心室内皮細胞によって分泌されるケモ魅力的な手がかりに選択的に反応することを確認する。
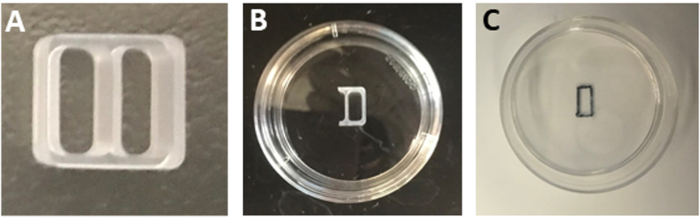
図1:培養インサートの調製。(A) 2 ウェルカルチャインサート。(B) 35mm皿の中央に固定されたワンウェルインサート。(C) 挿入を削除した後に観察された矩形パッチのアウトライン。この図の大きなバージョンを表示するには、ここをクリックしてください。

図2:移行アッセイのスキーマと代表的な結果(A) 0 日目のセル層のスキーマ (赤い四角形)(B) セルのない領域に移行するセルのスキーマ。赤い点は、移動中のセルを示します。黄色の領域は、データ取得用にイメージ化される領域を示します。AとBの点線ボックスは、パネルCとDに示されている領域に対応しています。(C,D)遊生アッセイの0日目(C)および2日目(D)に標識された抗β-チューブリン抗体の代表的な蛍光画像。白い点線は 0 日目を示します。Dの黄色い線は、48時間(E)ニューロン(0日目)の細胞(白い矢印で示される)が、抗β-チューブリン抗体(赤)と抗活性カスパーゼ3抗体(緑色)と共標識して移動する距離を示し、アポトーシス細胞を示す。核はDAPI(青)で染色される。アポトーシス細胞は、播種細胞では検出されなかった。(F)共培養アッセイの5日目からのグラフは、移動したニューロンの数が移動距離に対してプロットされたところである。単独で播種またはコントロール内皮細胞と共播したインターニューロンと比較して、心室内皮細胞と共播したインターニューロンは、より高い数で移動し、さらに遠くまで移動した。データは平均±S.Dを表します(n = 5; **p<0.01, ***p< 0.001, Studentのテストはありません)。スケールバー = 100 μm. IN = インターニューロン;PV EC = 心室内皮細胞。この図の大きなバージョンを表示するには、ここをクリックしてください。

図3:ケモアトラクションアッセイ(A) ケモアトラクションアッセイのスキーマ。3ウェル培養インサートを用いて、インターニューロン(IN)を中央(緑色の点線長方形)に播種し、心室内皮細胞(PVIC;オレンジ色の点線長方形)およびコントロール内皮細胞(IC;黄色の点線長方形)を両側に播種した。(B) β-チューブリン標識インターニューロンの画像は、心室内皮細胞の方への強い移動を示すが、内皮細胞の制御には向いていない。(C) インターニューロンのケモ魅力的な応答の定量化.内皮細胞の制御よりも、内膜外皮細胞の方に移動するニューロンの数が有意に多い。データは平均 ±S.D を表します(n = 5; *p < 0.05,Studentのテストはできません)。スケールバー = 100 μm.この図の大きいバージョンを表示するにはここをクリックしてください。
| A | 利点 | 制限 |
| ボイデン室アッセイ16,17 | ·技術的に非厳しい ·付着性細胞および非接着細胞に適しています ·パラクリンシグナル伝達またはケモ誘引物質が細胞移動に及ぼす影響を研究するために変更することができる | ·エンドポイントアッセイ。リアルタイムイメージングには適していません。 ·直接細胞間相互作用が移動に及ぼす影響の研究には適さない |
| スクラッチアッセイ18 | ·エンドポイントまたはキネティック ·技術的に非厳しい | ·アッセイの移行長さは数百マイクロメートルです。1-2 cmの範囲の長距離移動の研究のために適していない。 ·サスペンション細胞には適していません ·スクラッチ領域のバリエーション |
| 長距離移動アッセイ | ·終点または運動 ·1.5~2cmの長距離移動の研究が可能 ·技術的に非厳しい | ·サスペンション細胞には適していません |
| 共培養移行アッセイ | ·終点または運動 ·直接細胞接触が移動に及ぼす影響の研究が可能 ·最大1.5~2cmの移行長 ·技術的に非厳しい | ·サスペンション細胞には適していません |
| B | 利点 | 制限 |
| ボイデン・チャンバーアッセイ | ·技術的に非厳しい ·付着性細胞および非接着細胞に適しています | ·エンドポイントアッセイ。ライブイメージングには適していません。 ·急勾配勾配 |
| アンダーアガロースアッセイ19 | ·技術的に非厳しい ·2つ以上のケモ魅力的な信号は、1つのセットアップでアッセイすることができます | ·付着細胞には適さない。主に血液細胞に限定される。 ·アガロースの細胞の可視化が困難 |
| キャピラリーチャンバー移行アッセイ20,21 | ·エンドポイントまたはキネティック ·付着細胞または懸濁液細胞に適しています | ·特別な部屋を必要とする |
| マイクロ流体装置22 | ·制御可能で安定した濃度勾配を生成 ·単一セル レベルの解像度を許可 | ·高度なデバイスとツールが必要 ·技術的に要求が厳しく、急な学習曲線 ·複雑なイメージングとデータ解析 |
| ケモアトラクションアッセイ | ·終点または運動 ·漸入勾配 ·リアルタイムまたは蛍光イメージングに適しています ·技術的に非厳しい | ·サスペンション細胞には適していません |
表1:アッセイ法の比較(A)一般的なインビトロ移行アッセイと長距離移行アッセイおよび共培養アッセイの比較。(B) 共通の走論性アッセイとケモアテクティブアッセイの比較
ディスカッション
ここでは、ヒト心室内皮細胞特異的特性の定量的評価を提供する3つのインビトロアッセイについて説明した。これらのアッセイは、ヒト心室内皮細胞とヒトインターニューロンとの相互作用に関する機械論的洞察を得る上で貴重である。リガンド、インヒビター、または遺伝子特異的ノックダウンまたは過剰発現を有する細胞を用いた実験は、内皮細胞誘導ニューロン移動または遠心内皮細胞の長距離回遊性特性を媒介する分子作用器を同定または検証する。これらのアッセイは、生細胞タイムラプス移行試験を行うように改変することもできる。さらに、内皮細胞とインターニューロン以外の細胞との相互作用の証拠がある。我々のグループおよび他の人々からの研究は、投影ニューロンのパターン形成および神経前駆細胞の増殖に対する心室内皮細胞の影響をほのめかしている5,14,15.アッセイの設定を使用してこれらの可能な相互作用をテストすることは興味深いでしょう。最後に、これらのアッセイは、病気の心室内皮細胞の評価のためのプラットフォームとして機能します。私たちの研究は、心室血管ネットワークと統合失調症、てんかん、自閉症、および大うつ病3、5のような神経精神疾患の起源との間に新しい自律的なリンクを確立しました。これらのアッセイは、これらの神経精神疾患状態における疾患外室内皮細胞の長距離移動、化学引力、または四重分泌シグナル伝達における潜在的欠陥を同定する上で非常に重要である。
これらのアッセイは、シンプルで再現性が高く、低コストであり、非接着性細胞を除く様々な細胞タイプの移動に対する細胞移動および共培養または化学魅力的な手掛かりの効果を測定するために変更することができます。正確で再現可能な結果を得るためには、いくつかの重要な手順に従う必要があります。まず、各アッセイのシードセル番号を最適化することが重要です。単一の区画に播種される細胞の数は、細胞タイプ、所望のレベルの集結度、および共培養比のようなアッセイ特有の因子に依存する必要があります。第2に、各アッセイに対して細胞培養培地を最適化する必要がある。1つの皿に複数の細胞型が播種される共培養移行アッセイおよびケモアポイントアッセイでは、アッセイ培地はすべての細胞タイプに資するべきである。パイロット実験では、各細胞型の生存率(トリパンブルー排除法を用いた)と形態(免疫細胞化学を用いた)に対する共培養培地の効果を調べた。ヒトGABAergicニューロンを共培養培地で1週間培養し、神経培地で培養したニューロンと比較して、共培養培地におけるニューロンの生存率および形態に有意差を認めなかった。同様の方法で、心室内皮細胞および制御内皮細胞は、2つの通路について共培養培地で培養され、細胞生存および形態に有意な変動を示さなかった。第3に、移動速度は細胞タイプによって異なるため、研究対象の細胞型のアッセイごとに時間枠を決定することが重要です。第4に、カルチャの挿入物を慎重に処理することが重要です。インサートは、指先で軽く押して、皿にしっかりと固定する必要があります。チップが動かないことを確認するために、皿を上下に向ける必要があります。細胞層を乱さないように挿入物を取り外す間も注意が必要です。最後に、実験の変動性を減らすためにサンプルサイズを大きくすることをお勧めします。
結論として、これらのアッセイは、ヒトの心室内皮細胞生物学と正常および疾患状態における脳の発達に対するその役割に関する理解を大幅に拡大する。
開示事項
著者は利益相反を宣言しません。
謝辞
この研究は、国立精神衛生研究所(R01MH110438)と国立神経障害・脳卒中研究所(R01NS100808)からAVへの賞によって支えられた。
資料
| Name | Company | Catalog Number | Comments |
| Accutase dissociation solution | Millipore Sigma | SCR005 | Cell dissociation solution (for periventricular endothelial cells, step 1.4) |
| Anti-human β-Tubulin antibody | Biolegend | 802001 | |
| Anti-human CD31 antibody | Millipore Sigma | CBL468 | |
| Anti- MAP2 antibody | Neuromics | CH22103 | |
| Anti-active Caspase 3 antibody | Millipore Sigma | AB3623 | |
| Control human endothelial cells | Cellular Dynamics | R1022 | |
| Control endothelial Cells Medium Supplement | Cellular Dynamics | M1019 | |
| Cryogenic vials | Fisher Scientific | 03-337-7Y | |
| DMEMF/12 medium | Thermofisher Scientific | 11320033 | |
| DMSO | Sigma-Aldrich | D2650 | |
| E6 medium | Thermofisher Scientific | A1516401 | |
| FGF2 | Thermofisher Scientific | PHG0261 | |
| Fibronectin | Thermofisher Scientific | 33016-015 | |
| Freezing Container | Thermofisher Scientific | 5100 | |
| GABA | Sigma-Aldrich | A2129 | |
| Hemacytometer | Sigma-Aldrich | Z359629 | |
| Human GABAergic neurons | Cellular Dynamics | R1013 | |
| Human GABAergic neurons base medium | Cellular Dynamics | M1010 | |
| Human GABAergic neuron Neural supplement | Cellular Dynamics | M1032 | |
| Laminin | Sigma | L2020 | |
| Matrigel | Corning | 356230 | Basement membrane matrix |
| Mounting Medium | Vector laboratories | H-1200 | |
| poly-L-ornithin | Sigma | p4957 | |
| PBS | Thermofisher Scientific | 14190 | |
| Trypan blue | Thermofisher Scientific | 15250061 | |
| TrypLE | Thermofisher Scientific | 12563011 | Cell dissociation solution (for GABAergic interneurons and endothelial cells, sections 3 and 4) |
| VEGF-A | Peprotech | 100-20 | |
| VascuLife VEGF Medium Complete Kit | Lifeline Cell Technologies | LL-0003 | Component of control human endothelial cell medium |
| 2-well silicone culture-Insert | ibidi | 80209 | |
| 3-well silicone culture-Insert | ibidi | 80369 | |
| 35 mm dish | Corning | 430165 | |
| 15-ml conical tube | Fisher Scientific | 07-200-886 | |
| 4% PFA solution | Fisher Scientific | AAJ19943K2 | |
| 6-well tissue culture plate | Fisher Scientific | 14-832-11 | |
| Inverted phase contrast microscope | Zeiss | Zeiss Axiovert 40C | |
| Fluorescent microscope | Olympus | FSX-100 |
参考文献
- Sweeney, M. D., Zhao, Z., Montagne, A., Nelson, A. R., Zlokovic, B. V. Blood-Brain Barrier: From Physiology to Disease and Back. Physiological Reviews. 99 (1), 21-78 (2019).
- Vasudevan, A., Long, J. E., Crandall, J. E., Rubenstein, J. L., Bhide, P. G. Compartment-specific transcription factors orchestrate angiogenesis gradients in the embryonic brain. Nature Neuroscience. 11 (4), 429-439 (2008).
- Won, C., et al. Autonomous vascular networks synchronize GABA neuron migration in the embryonic forebrain. Nature Communications. 4, 2149(2013).
- Li, S., Haigh, K., Haigh, J. J., Vasudevan, A. Endothelial VEGF sculpts cortical cytoarchitecture. The Journal of Neuroscience. 33 (37), 14809-14815 (2013).
- Li, S., et al. Endothelial cell-derived GABA signaling modulates neuronal migration and postnatal behavior. Cell Research. 28 (2), 221-248 (2018).
- Lewis, D. A., Levitt, P. Schizophrenia as a disorder of neurodevelopment. Annual Review of Neuroscience. 25, 409-432 (2002).
- Lewis, D. A., Hashimoto, T., Volk, D. W. Cortical inhibitory neurons and schizophrenia. Nature Reviews Neuroscience. 6 (4), 312-324 (2005).
- Marin, O. Interneuron dysfunction in psychiatric disorders. Nature Reviews Neuroscience. 13 (2), 107-120 (2012).
- Levitt, P., Eagleson, K. L., Powell, E. M. Regulation of neocortical interneuron development and the implications for neurodevelopmental disorders. Trends in Neurosciences. 27 (7), 400-406 (2004).
- Treiman, D. M. GABAergic mechanisms in epilepsy. Epilepsia. 42 (3), 8-12 (2001).
- Datta, D., Subburaju, S., Kaye, S., Vasudevan, A. Human forebrain endothelial cells for cell-based therapy of neuropsychiatric disorders. Proceedings of 22nd Biennial Meeting of the International Society for Developmental Neuroscience. , Nara, Japan. (2018).
- Bellin, M., Marchetto, M. C., Gage, F. H., Mummery, C. L. Induced pluripotent stem cells: the new patient? Nature Reviews Molecular Cell Biology. 13 (11), 713-726 (2012).
- Ardhanareeswaran, K., Mariani, J., Coppola, G., Abyzov, A., Vaccarino, F. M. Human induced pluripotent stem cells for modelling neurodevelopmental disorders. Nature Reviews Neurology. 13 (5), 265-278 (2017).
- Stubbs, D., et al. Neurovascular congruence during cerebral cortical development. Cerebral Cortex. 19 (1), 32-41 (2009).
- Vissapragada, R., et al. Bidirectional crosstalk between periventricular endothelial cells and neural progenitor cells promotes the formation of a neurovascular unit. Brain Research. 1565, 8-17 (2014).
- JoVE Science Education Database. Cell Biology. The Transwell Migration Assay. Journal of Visualized Experiments. , Cambridge, MA. (2019).
- Renaud, J., Martinovic, M. G. Development of an insert co-culture system of two cellular types in the absence of cell-cell contact. Journal of Visualized Experiments. 113, e54356(2016).
- Guan, J. L. In vitro scratch assay: a convenient and inexpensive method for analysis of cell migration in vitro. Nature Protocols. 2 (2), 329-333 (2007).
- Nelson, R. D., Quie, P. G., Simmons, R. L. Chemotaxis under agarose: a new and simple method for measuring chemotaxis and spontaneous migration of human polymorphonuclear leukocytes and monocytes. The Journal of Immunology. 115 (6), 1650-1656 (1975).
- Zigmond, S. H. Ability of polymorphonuclear leukocytes to orient in gradients of chemotactic factors. Journal of Cell Biology. 75 (2), 606-616 (1977).
- Zicha, D., Dunn, G., Jones, G. Analyzing chemotaxis using the Dunn direct-viewing chamber. Methods in Molecular Biology. 75, 449-457 (1997).
- Kim, B. J., Wu, M. Microfluidics for mammalian cell chemotaxis. Annals of Biomedical Engineering. 40 (6), 1316-1327 (2012).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved