Method Article
人类干细胞衍生内皮细胞和GABAergic神经元的迁移、化学吸引和共培养测定
摘要
我们提出了三个简单的体外测定-远距离迁移测定,共培养迁移测定,和化学吸引力测定-共同评估人类干细胞衍生的腹膜内皮细胞的功能及其与GABAergic内神经的相互作用。
摘要
脑血管在神经系统发育和脑病病因中的作用日益受到重视。我们最近的研究已经确定了一种特殊的血管细胞群体,即腹膜内皮细胞,在胚胎发育期间前脑GABAergic内神经元的迁移和分布中起着关键作用。这,加上他们的细胞自主功能,暗示了前心室内皮细胞在神经精神病(如精神分裂症、癫痫和自闭症)的病理学中的新作用。在这里,我们描述了三种不同的体外测定,它们共同评估腹膜内皮细胞的功能及其与GABAergic内神经元的相互作用。使用这些检测方法,特别是在人类环境中,将使我们能够识别腹膜内皮细胞和大脑疾病之间的联系。这些测定简单、成本低、可重复,可轻松适应任何粘附细胞类型。
引言
内皮细胞形成血管的衬里,调节重要功能,包括维持血管壁渗透性、调节血流、血小板聚集和形成新血管。在大脑中,内皮细胞构成一个关键的血液-脑屏障的一部分,它严格控制大脑和血液之间的物质交换。我们在过去十年的研究已经确定了大脑内皮细胞的神经原发生新作用,这些作用对大脑发育和行为2、3、4、5有重要影响。我们已经表明,小鼠胚胎前脑是由两个不同的子类型的血管,皮面和腹周血管,在解剖学,起源和发育轮廓2不同。内皮细胞衬里这两个血管亚型显示其基因表达配置文件明显的差异。虽然皮叶细胞大多表达与炎症和免疫反应相关的基因,但腹腔内皮细胞在表达通常与神经发生、神经元迁移、化学和轴神指导3相关的基因时,具有独特的丰富性。外皮内皮细胞也拥有一种新的GABA信号通路,不同于传统的神经元GABA信号通路5。与其基因表达相伴,发现外膜内皮细胞调节发育中新皮质中GABAergic内神经元的迁移和分布。在胚胎发育过程中,腹腔内皮细胞沿腹膜-背梯度进行远距离迁移,以建立腹腔血管网络2、3。一天后,内神经内向反映了这种迁徙路线。迁移的内神经元与预先形成的外皮血管网络进行物理交互,并用作在新皮质到达最终目的地的指南。除了作为物理基质外,腹膜内皮细胞还充当迁移神经元的导航线索来源。前心内皮细胞分泌GABA指导内神经元迁移并调节其最终分布模式4。内神经元迁移和分布的缺陷与神经精神病有关,如自闭症、癫痫、精神分裂症和抑郁症6,7,8,9,10。因此,研究前心室内皮细胞功能及其对人类环境中的内神经元迁移的影响,对于解决这些疾病的发病机制至关重要。
我们利用诱导多能干细胞(iPSC)技术12、13,从人类胚胎干细胞中生成了人类造血干细胞。为了验证人类腹膜内皮细胞是否忠实地模仿小鼠腹膜内皮细胞,并定量评估它们对内神经元迁移的影响,我们开发了三种体外测定:远距离迁移测定、共培养迁移测定和化学吸引力测定。在这里,我们详细描述了这些检测的协议。所有三种检测都基于硅培养插件的使用,以创建一个小矩形的细胞补丁(固定尺寸),周围环绕着无细胞空间。迁移距离是通过测量单元格的最终位置与第 0 天已勾勒的矩形贴片边框之间的距离来评估的。在远距离迁移测定中,人类腹膜内皮细胞在35毫米盘的中心作为斑块播种,并计算细胞在长时间内所经过的距离。在共培养迁移测定中,人类腹膜内皮细胞与人类内膜细胞共同播种,作为35毫米盘中的一个斑块。此设置允许检查这两种细胞类型的直接物理相互作用对内神经元迁移速率的影响。化学吸引力测定测量内神经元的迁移,以响应人类腹膜内皮细胞分泌的化学吸引力线索。内侧神经元被播种为矩形斑块,与人腹膜内皮细胞和控制非外膜内皮细胞播种作为类似大小的补丁在两侧。每个细胞斑块都通过500μm的无细胞间隙分离。 与对照非外皮内皮细胞相比,通过量化向外皮内皮细胞迁移的细胞数量来评估内神经元的反应。
这些测定提供了对人腹膜内皮细胞功能及其对内神经元迁移的影响的有力评估。长距离测定和共培养迁移测定的新颖设置提供了厘米(±1-1.5 cm)范围内的无细胞空间,允许远距离迁移检测。表1概述了我们与其他常用检测相比的检测特征。总体而言,这里描述的测定将作为一个平台,用于评估"患病"的外室内皮细胞和由精神分裂症、自闭症或癫痫等脑疾病的iPSC产生的内神经元。这些测定也可用于确定不同条件(如抑制剂、配体、RNAi)如何影响细胞迁移。最后,这些测定可以针对其他细胞类型进行优化,以测量远距离迁移、化学吸引或细胞介导迁移。
研究方案
1. 人类前皮内皮细胞的培养与储存
- 在地下膜基质涂层(见材料表)6孔板(E6培养基包含50纳克/mL VEGF-A、100纳克/mL FGF2和5μM GABA)的表)中保持人体腹膜内皮细胞,温度为37°C和5%CO2。每隔一天更换媒体。
- 在4°C下解冻基底膜基质,在冷DMEM/F12介质中稀释,使其溶液达到1:100。用1 mL的基质溶液涂抹每口6孔板。在37°C下孵育板至少1小时,然后再使用。
- 允许人类腹膜内皮细胞达到80%-90%的汇合率。从井中吸气介质。用每口井1x PBS的1mL清洗一次井。
- 通过每孔添加1 mL细胞分离溶液(见材料表)分离细胞。在37°C孵育5分钟。5分钟后,加入1 mL的腹膜内皮细胞培养基。将细胞溶液转移到15 mL锥形管中。
注:我们在这里使用Accutase进行细胞解散,而不是第3节和第4节中的TrypLE。 - 在室温下,在500 x g下将离心机细胞吸出5分钟,吸出上清液,并在1 mL的腹膜内皮细胞培养基中重新悬浮细胞颗粒。
- 使用 trypan 蓝色排除方法对活细胞进行计数。种子细胞在新的基质涂层板的密度为1.2 x 105细胞/厘米2。在37°C和5%CO2下孵育。
- 通过在冷冻培养基(90%的腹膜内皮细胞培养基和10%DMSO)中冷冻保存来储存人类腹膜内皮细胞。
- 按照上述步骤 1.3 和 1.4 分离和收集细胞。通过 trypan 蓝色排除方法对溶液中的单元格进行计数。
- 在室温下,在500 x g下离心细胞5分钟。吸出上清液,在冷冻培养基的5 x 106细胞/mL处重新悬浮细胞颗粒。
- 每冷冻室分配1 mL的冷冻介质加细胞。将小瓶放入异丙醇填充室中,在-80°C中冷却过夜,温度为1°C/min。第二天将小瓶转移到液氮罐中,以便长期储存。
2. 制备人类前体内皮细胞,用于测定
- 允许人类腹膜内皮细胞达到70%-80%的汇合。
- 如上所述,按照步骤 1.3 到 1.5 分离细胞。使用锥盘蓝色排除方法对单元格进行计数。
3. 制备人类GABAerer内神经元的测定
注:人类诱导多能干细胞(iPSC)衍生的GABAergic内神经元和神经元培养基是商业购买的(见材料表)。神经元是通过根据制造商开发的协议区分人类成纤维细胞衍生的iPSC线而生成的。细胞根据制造商的协议进行解冻和培养。
- 解冻人类GABAergic内神经元,并在12孔盘中培养它们两周,以70%-80%的汇合。
- 在测定当天,热细胞解脱液(见材料表)和神经元介质的等分在37°C前10分钟使用。
- 从包含细胞的每个井中吸出培养基。每口井用1mL无菌1x PBS清洗细胞。
- 每口井加入0.5 mL的预加热解脱解溶液,在37°C孵育5分钟,每口加入1mL的神经元介质。将细胞溶液转移到15 mL锥形管中。轻轻三聚,以分离细胞团块。
- 在室温下,在380 x g下将离心机细胞吸出5分钟,吸出上清液,并在1mL的神经元培养基中重新悬浮细胞颗粒。使用 trypan 蓝色排除方法对活细胞进行计数。
4. 制备控制人类内皮细胞进行测定
注:控制人类iPSC衍生的内皮细胞和内皮细胞培养基是商业购买的(材料表)。这些内皮细胞是通过根据制造商开发的协议将人类成纤维细胞衍生的iPSC线与内皮命运区分为母细胞而生成的。根据制造商的协议,在Fibronectin基质上解冻和培养细胞。纤维内丁涂层板按照制造商的协议制备。
- 解冻控制人类内皮细胞,并在6孔板中培养它们,其汇合率达到80%-90%。
- 在测定当天,热细胞解脱液(见材料表)和内皮介质的等分在37°C前10分钟使用。
- 从包含细胞的每个井中吸出培养基。每口井用1mL无菌1x PBS清洗细胞。
- 通过每口井加入0.5 mL的预加热解散溶液分离细胞。在室温下孵育5分钟,每孔加入1mL的内皮细胞培养基,以中和解脱液。将细胞溶液转移到15 mL锥形管中。
- 在室温下,在200 x g下离心细胞5分钟。吸气上清液,在1 mL内皮细胞培养基中重新悬浮细胞颗粒。使用 trypan 蓝色排除方法对活细胞进行计数。
5. 准备单井文化插入
- 在室温下或在4°C下解冻1mg/mL层宁溶液。
- 用0.01%的聚L-硝化物溶液(每盘1 mL)涂上适当数量的35毫米菜肴。在室温下孵育菜肴至少1小时。
- 在无菌水中稀释1mg/mL层宁溶液1:300,在使用前将最终浓度稀释至3.3微克/mL。
- 从每道菜中完全吸出多L-欧尼辛。用无菌水彻底冲洗每道菜3x,并完全吸气,以避免多L-球基引起的细胞毒性。
- 将1 mL的3.3微克/mL层压素溶液加入每盘,在37°C孵育过夜或至少1小时。使用前立即从盘中取出层宁溶液。
注:或者,将含层宁的菜肴储存在4°C中。使用前在37°C细胞培养箱中平衡菜肴。 - 使用无菌刀片切割双井硅胶培养器的一个井的三面(图1A),以生成单井刀片(图1B)。
注:在切割时,保持双井刀片牢固地固定在原包装表面,以确保切割光滑,并保护刀片的粘合性。 - 从菜肴中吸气层宁溶液。
注意:在拉米宁孵育后,请勿用无菌PBS或水洗碗。潮湿的表面将防止培养物插入物的紧密粘附。 - 取出带无菌钳子的单井插入物,并将其放置在聚-L-ornithine/层宁涂层盘的中心。沿着刀片的边缘按压,将其固定在盘面上。
- 小心地将刀片倒置,以验证刀片是否牢固粘附。
- 保持盘子倒置,并使用带有超细尖端的永久黑色标记标记刀片隔间的边界(图1C)。
6. 长途迁移测定
- 以神经元介质的3 x 104细胞/70 μL的浓度暂停人类GABAergic内神经元。种子 70 μL 的细胞溶液内每个单孔培养插件。
注: 内神经元的种子密度根据制造商的建议。 - 以3 x 104细胞/70 μL的外皮内皮细胞培养基暂停人类腹膜内皮细胞。种子 70 μL 的细胞溶液内每个单孔培养插件。
注:人类腹膜内皮细胞的数量与种子神经元的数量比例为1:1。 - 在神经元培养皿中加入1mL的神经元介质,以填充插入物周围的区域,防止涂层干燥。同样,在腹膜内皮细胞盘中加入1 mL的腹膜内皮细胞培养基。
注:沿盘边缘缓慢添加介质,以免干扰刀片。 - 在显微镜下检查,确认电池是否从插入舱泄漏。
- 在37°C和5%CO2下孵育细胞24小时。24小时孵育后,在显微镜下检查,确认细胞是否正确附着,没有一夜泄漏。
- 播种 48 小时后,使用无菌钳子轻轻取出刀片。在显微镜下检查,确认细胞层是否不受干扰(第0天)。
- 从神经元培养皿中取出培养基,加入1 mL的新鲜神经元培养基。同样,从外皮内皮细胞盘中取出培养基,加入1 mL的新鲜腹膜内皮细胞培养基。
注:留出所需数量的盘子,并修复4%的PFA为第0天的图像。 - 在37°C和5%CO2下孵育细胞5天。5天后,取出培养基,用4%PFA修复细胞10分钟,用1xPBS清洗3次。
- 染色神经元与抗人类β-图布林或反人类MAP2抗体,和内皮细胞与抗人CD31抗体。在免疫染色结束时,在每个培养皿中加入1 mL的抗褪色安装介质。
7. 共同文化迁移统计
- 在70μL共培养培养基(50%的腹膜维持培养培养基(无GABA和50%神经元介质)中共悬浮3 x104 GABAergic内神经元和3 x 104人腹膜内皮细胞。在单孔插入舱内播种此细胞溶液。准备适当数量的如洗碗。
注: 在共培养媒介中未添加 GABA,以排除外源性 GABA 对移徙的影响。 - 在显微镜下检查,确认电池是否从插入舱泄漏。
- 沿着盘子的侧面缓慢添加1 mL的共培养基,以防止涂层干燥。
注:沿盘边缘缓慢添加介质,以免干扰刀片。 - 作为第一个控制,种子3 x 104人类GABAergic内神经元仅在70μL共培养介质每一井插入。准备适当数量的此类菜肴。
- 作为第二种控制,共种子 3 x 104 GABAergic 人类内神经细胞,3 x 104控制人类内皮细胞在 70 μL 共培养培养基中每一井插入。准备适当数量的菜肴。
- 在37°C和5%CO2下孵育24小时。24小时孵育后,在显微镜下检查,确认细胞是否正确附着,没有泄漏。
- 播种 48 小时后,使用无菌钳子轻轻取出刀片。在显微镜下检查,确认细胞层是否未受到干扰(第 0 天)。
- 去除介质,并添加1 mL的新鲜共培养基。
注:留出适当数量的盘子,以便获取第 0 天的图像。 - 在37°C和5%CO2下孵育细胞5天。
- 5天后,取出培养基,用4%PFA修复细胞10分钟,用1xPBS清洗3次。
- 染色与抗人类β-图布林或反人类MAP2抗体标记神经元。在免疫染色结束时,在每个培养皿中加入1 mL的抗褪色安装介质。
8. 化学吸引力测定
- 将三井培养插件放在聚L-ornithine/层宁涂层35毫米盘的中心,使用无菌钳子。
- 把盘子倒过来。使用带有超细尖端的永久黑色标记标记刀片中间隔间周围的边界。
- 种子 3 x 104人类 GABAergic 中室中 70 μL 的神经元介质 (图 3A)。
- 种子104人类外皮内皮细胞在70 μL的腹腔内皮细胞培养基和104控制内皮细胞在70 μL控制内皮细胞培养基分别在两个外舱(图3A)。
- 沿盘子侧面加入1 mL共培养基(50%的腹膜维护介质,不含GABA和50%神经元介质),以防止盘子上的涂层干燥。
- 在显微镜下检查,确认电池是否从插入舱泄漏。
- 在37°C和5%CO2下孵育细胞24小时。24小时孵育后,在显微镜下检查,确认细胞是否正确附着,没有泄漏。
- 播种 48 小时后,使用无菌钳子轻轻取出刀片。在显微镜下检查,确认细胞层是否未受到干扰(第 0 天)。
- 去除介质,并添加1 mL的新鲜共培养基。
注:为第 0 天图像留出所需数量的盘子。 - 在37°C下孵育细胞36小时,孵化5%CO2。36小时后,吸气培养基,用4%PFA固定细胞10分钟,用1xPBS洗涤3倍。
- 用抗人类β-图布林或反人类MAP2抗体染色人类GABAergic内神经元。在染色程序结束时,在每个培养皿中加入 1 mL 的防褪色安装介质。
9. 成像和数据分析
- 将免疫染色测定盘置于显微镜下,放大倍数为 4 倍。
- 在视野中保留矩形边界的一个长边(在上面的步骤 5.10 中制造)。拍摄该边界附近的无单元格空间中的单元格图像。沿矩形边界的右长边和左长边获取图像(图 2B)。
注: 由于选择短边或长边作为起始标记时模棱两可,因此不考虑相对于矩形对角定位的单元格。此外,跨短边迁移的细胞数量通常显著减少(可能是由于沿短边缘的起始单元数量较少),并且未考虑。 - 在 ImageJ 中打开图像。使用 ImageJ 计算每个单元格和边界标记之间的距离 (图 2D)。
- 要根据像元数评估迁移,在 ImageJ 中设置与获取图像的边界的特定距离。计算此距离内存在的单元格数。使用适当的软件计算平均数、标准偏差和统计显著性。
结果
在 35 mm 的培养皿内设置单井培养插件的步骤如图1所示。远距离迁移测定和共培养迁移测定使用单井插入物在聚L-Ornithine/拉米宁涂层35毫米盘的中心播种所需数量的细胞。第 0 天,单元格以矩形面片形式存在(图 2A,C)。在第 0 天图像中,可通过像元图层的锐边(图 2C中的白色虚线)轻松识别第 0 天线。到48小时,细胞已经迁移到无细胞空间(图2B,D)。在后天 0 图像中,在插入物周围绘制的黑色边框(在碟子背面)可以清楚地观察到为黑色间隙。间隙的边缘被指定为天0线(图2D中的白色虚线)。如步骤 9.2 所述,仅考虑那些落在与单元层左右长边相邻的区域的单元(图 2B中的黄色区域)进行数据分析。通过计算单元格(图 2D中的白色箭头)与第 0 天线之间的距离来测量单元格所经过的距离。免疫细胞化学染色与抗活性卡帕塞3抗体,凋亡的标志,显示种子细胞没有凋亡信号(图2E)。在共培养迁移测定中,当内神经元与人类腹膜内皮细胞共同播种时,神经元比单独播种或与对照内皮细胞共同播种时走得更远的距离(图2F)。此外,对于相同的距离范围,与其他两个组中的内神经元相比,在与腹膜内皮细胞共同播种时,迁移的内神经元数量较多。这表明,与小鼠腹膜内皮细胞一样,人腹内皮细胞促进人内神经迁移。
在化学吸引力测定中,使用三孔培养插件,将人类内膜作为小矩形贴片播种在35毫米聚L-Ornithine/拉米宁涂层培养盘中。外皮内皮细胞和控制非外皮细胞作为斑块在神经元斑块的两侧被播种,每个斑块之间的间隙为500μm(图3A)。迁移到舱前内皮细胞与对照内皮细胞的内神经元数量在36小时后被量化。与对照内皮细胞相比,迁移到外室细胞的内神经元数量明显增加(图3B,C),确认GABAergic内神经元对人类腹膜内皮细胞分泌的化学吸引力线索有选择性反应。
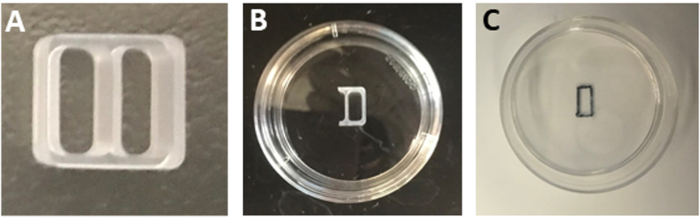
图 1:培养插件的准备。(A) 双井文化插入。(B) 固定在35毫米盘子中心的一口单井插入件。(C) 移除刀片后观察到的矩形贴片的轮廓。请点击此处查看此图的较大版本。

图 2:迁移测定的架构和代表性结果。(A) 第 0 天单元格层(红色矩形)的架构。(B) 迁移到无细胞空间的细胞的架构.红点表示迁移单元格。黄色区域标记用于数据采集的图像区域。A和B中的虚线框对应于面板C和D中显示的区域。(C,D)在迁移测定的第0天(C)和第2天(D)上标记内神经的抗β-图布林抗体的代表性荧光图像。白色虚线标记第 0 天。D中的黄线表示细胞(以白色箭头标记)在 48 h.(E)神经元(第 0 天)与抗β-Tubulin 抗体(红色)和抗活性 Caspase 3 抗体(绿色)共同标记的距离,这些抗体标记凋亡细胞。核被DAPI(蓝色)所污染。在种子细胞中未检测到凋亡细胞。(F) 从共区域性测定的第5天开始绘制图表,其中迁移的内神经元数量根据所游的距离绘制。与单独播种或与对照内皮细胞共同播种的内神经元相比,与腹膜内皮细胞共同播种的内神经元以更高的数量迁移出来,并且走得更远。数据表示平均值 = S.D (n = 5;=p<0.01, =p< 0.001, 学生不考试)。刻度条 = 100 μm. IN = 内神经元;PV EC = 外室内皮细胞。请点击此处查看此图的较大版本。

图3:化学吸引力测定。(A) 化学吸引力测定的架构.使用三孔培养插件,内神经元 (IN) 被播种在中间(绿色虚线矩形),而外膜内皮细胞 (PV EC;橙色虚线矩形) 和控制内皮细胞 (EC; 黄色虚线矩形) 播种在两侧。(B) β-Tubulin 标记的内神经元的图像显示向腹膜内皮细胞的强健迁移,但不向对照内皮细胞迁移。(C) 内神经内科的化疗-吸引力反应的量化.迁移到前心室内皮细胞的神经元数量明显高于对照内皮细胞。数据表示平均值 = S.D(n = 5;=p < 0.05,学生不考试)。比例尺 = 100 μm。请点击此处查看此图的较大版本。
| A | 优势 | 限制 |
| 博伊登室测定16,17 | ·技术上不苛刻 ·适用于粘附细胞和非粘附细胞 ·可修改以研究对细胞迁移的参数信号或化学吸引剂的影响 | ·端点测定。不适合实时成像。 ·不适合研究直接细胞-细胞相互作用对迁移的影响 |
| 划痕测定18 | ·端点或动力学 ·技术上不苛刻 | ·测量迁移长度为几百微米。不适合研究1-2厘米范围内的远距离迁移。 ·不适合悬架电池 ·划痕区域的变化 |
| 远距离迁移测定 | ·端点或动力学 ·允许研究 1.5 至 2 厘米之间的远距离迁移 ·技术上不苛刻 | ·不适合悬架电池 |
| 共区域性迁移测定 | ·端点或动力学 ·允许研究直接细胞-细胞接触对迁移的影响 ·允许长达 1.5 至 2 厘米的迁移长度 ·技术上不苛刻 | ·不适合悬架电池 |
| B | 优势 | 限制 |
| 博伊登室测定 | ·技术上不苛刻 ·适用于粘附细胞和非粘附细胞 | ·端点测定。不适合现场成像。 ·陡浓度梯度 |
| 亚甘蔗下测定19 | ·技术上不苛刻 ·两个或多个化学吸引力信号可以在一个设置中进行测定 | ·不适合粘附细胞。主要限于血细胞。 ·难以可视化的细胞在阿甘蔗 |
| 毛细管室迁移测定20,21 | ·端点或动力学 ·适用于粘附或悬浮细胞 | ·需要特殊室 |
| 微流体装置22 | ·产生可控且稳定的浓度梯度 ·允许单单元电平分辨率 | ·需要先进的设备和工具 ·技术要求高且陡峭的学习曲线 ·复杂成像和数据分析 |
| 切莫吸引力测定 | ·端点或动力学 ·逐渐浓度梯度 ·适用于实时或荧光成像 ·技术上不苛刻 | ·不适合悬架电池 |
表1:测定方法的比较。(A) 常见体外迁移测定与远距离迁移测定和共培养测定的比较。(B) 常见化学测定与化学吸引力测定的比较。
讨论
在这里,我们描述了三个体外测定,一起提供定量评估的人类腹膜内皮细胞特异性特性。这些测定对于获得人类外皮内皮细胞与人类内皮细胞相互作用的机械性见解将非常有价值。使用配体、抑制剂或具有基因特异性敲除或过度表达的细胞的实验将识别或验证介导内皮细胞引导的内神经元迁移或腹膜内皮细胞远距离迁移特性的分子。这些测定还可以修改以执行活细胞延时迁移研究。此外,还有证据表明内皮细胞与内神经外细胞以外的细胞相互作用。我们小组和其他的研究已经暗示了腹膜内皮细胞对投影神经元的图案和神经前体细胞5、14、15的增殖的影响。使用我们的测定设置测试这些可能的交互作用会很有趣。最后,这些测定将作为评估患病的腹膜内皮细胞的平台。我们的工作在腹膜血管网络与精神分裂症、癫痫、自闭症和严重抑郁症等神经精神病的起源之间建立了新的自主联系。这些测定在识别这些神经精神障碍条件下患病的腹膜内皮细胞的远距离迁移、化学吸引或并列信号的潜在缺陷方面将非常宝贵。
这些测定简单、可重复且成本低,可进行修改,以测量细胞迁移以及共培养或诱导性线索对不同细胞类型迁移的影响,非粘附细胞除外。需要遵循一些关键步骤才能获得准确且可重现的结果。首先,优化每个测定的种子细胞号至关重要。在单个隔间中播种的细胞数量应取决于细胞类型、所需的汇合水平以及与测定特定因素(如共培养比)而定。其次,有必要优化每次测定的细胞培养基。在共培养迁移测定和化学吸引力测定中,在单个培养皿中播种多个细胞类型,测定介质应有利于所有细胞类型。在试验实验中,我们研究了共培养基培养基对每种细胞类型(使用锥形蓝色排除法)和形态学(使用免疫细胞化学)的影响。我们用共培养培养基培养一周培养人类GABAergic神经元,观察到与神经元培养的神经元相比,共培养培养培养的神经元在生存力和形态上没有显著差异。同样,在两个通道的共培养培养基中培养的腹膜内皮细胞和控制内皮细胞在细胞存活率和形态方面没有出现任何显著变化。第三,由于不同细胞类型的迁移速率不同,因此确定所研究的细胞类型的每种测定的时间范围非常重要。第四,必须谨慎处理区域性插入。插入物应用指尖轻轻按压,牢固地固定在盘子上。应将刀片倒置以验证刀片是否未移动。拆卸刀片时也应小心,以免干扰细胞层。最后,建议增加样本量,以减少实验变异性。
总之,这些测定将大大扩展我们对人类腹膜内皮细胞生物学及其在正常和疾病条件下大脑发育的作用的理解。
披露声明
作者声明没有利益冲突。
致谢
这项工作得到了国家精神卫生研究所(R01MH110438)和国家神经疾病和中风研究所(R01NS100808)颁发的AV奖的支持。
材料
| Name | Company | Catalog Number | Comments |
| Accutase dissociation solution | Millipore Sigma | SCR005 | Cell dissociation solution (for periventricular endothelial cells, step 1.4) |
| Anti-human β-Tubulin antibody | Biolegend | 802001 | |
| Anti-human CD31 antibody | Millipore Sigma | CBL468 | |
| Anti- MAP2 antibody | Neuromics | CH22103 | |
| Anti-active Caspase 3 antibody | Millipore Sigma | AB3623 | |
| Control human endothelial cells | Cellular Dynamics | R1022 | |
| Control endothelial Cells Medium Supplement | Cellular Dynamics | M1019 | |
| Cryogenic vials | Fisher Scientific | 03-337-7Y | |
| DMEMF/12 medium | Thermofisher Scientific | 11320033 | |
| DMSO | Sigma-Aldrich | D2650 | |
| E6 medium | Thermofisher Scientific | A1516401 | |
| FGF2 | Thermofisher Scientific | PHG0261 | |
| Fibronectin | Thermofisher Scientific | 33016-015 | |
| Freezing Container | Thermofisher Scientific | 5100 | |
| GABA | Sigma-Aldrich | A2129 | |
| Hemacytometer | Sigma-Aldrich | Z359629 | |
| Human GABAergic neurons | Cellular Dynamics | R1013 | |
| Human GABAergic neurons base medium | Cellular Dynamics | M1010 | |
| Human GABAergic neuron Neural supplement | Cellular Dynamics | M1032 | |
| Laminin | Sigma | L2020 | |
| Matrigel | Corning | 356230 | Basement membrane matrix |
| Mounting Medium | Vector laboratories | H-1200 | |
| poly-L-ornithin | Sigma | p4957 | |
| PBS | Thermofisher Scientific | 14190 | |
| Trypan blue | Thermofisher Scientific | 15250061 | |
| TrypLE | Thermofisher Scientific | 12563011 | Cell dissociation solution (for GABAergic interneurons and endothelial cells, sections 3 and 4) |
| VEGF-A | Peprotech | 100-20 | |
| VascuLife VEGF Medium Complete Kit | Lifeline Cell Technologies | LL-0003 | Component of control human endothelial cell medium |
| 2-well silicone culture-Insert | ibidi | 80209 | |
| 3-well silicone culture-Insert | ibidi | 80369 | |
| 35 mm dish | Corning | 430165 | |
| 15-ml conical tube | Fisher Scientific | 07-200-886 | |
| 4% PFA solution | Fisher Scientific | AAJ19943K2 | |
| 6-well tissue culture plate | Fisher Scientific | 14-832-11 | |
| Inverted phase contrast microscope | Zeiss | Zeiss Axiovert 40C | |
| Fluorescent microscope | Olympus | FSX-100 |
参考文献
- Sweeney, M. D., Zhao, Z., Montagne, A., Nelson, A. R., Zlokovic, B. V. Blood-Brain Barrier: From Physiology to Disease and Back. Physiological Reviews. 99 (1), 21-78 (2019).
- Vasudevan, A., Long, J. E., Crandall, J. E., Rubenstein, J. L., Bhide, P. G. Compartment-specific transcription factors orchestrate angiogenesis gradients in the embryonic brain. Nature Neuroscience. 11 (4), 429-439 (2008).
- Won, C., et al. Autonomous vascular networks synchronize GABA neuron migration in the embryonic forebrain. Nature Communications. 4, 2149(2013).
- Li, S., Haigh, K., Haigh, J. J., Vasudevan, A. Endothelial VEGF sculpts cortical cytoarchitecture. The Journal of Neuroscience. 33 (37), 14809-14815 (2013).
- Li, S., et al. Endothelial cell-derived GABA signaling modulates neuronal migration and postnatal behavior. Cell Research. 28 (2), 221-248 (2018).
- Lewis, D. A., Levitt, P. Schizophrenia as a disorder of neurodevelopment. Annual Review of Neuroscience. 25, 409-432 (2002).
- Lewis, D. A., Hashimoto, T., Volk, D. W. Cortical inhibitory neurons and schizophrenia. Nature Reviews Neuroscience. 6 (4), 312-324 (2005).
- Marin, O. Interneuron dysfunction in psychiatric disorders. Nature Reviews Neuroscience. 13 (2), 107-120 (2012).
- Levitt, P., Eagleson, K. L., Powell, E. M. Regulation of neocortical interneuron development and the implications for neurodevelopmental disorders. Trends in Neurosciences. 27 (7), 400-406 (2004).
- Treiman, D. M. GABAergic mechanisms in epilepsy. Epilepsia. 42 (3), 8-12 (2001).
- Datta, D., Subburaju, S., Kaye, S., Vasudevan, A. Human forebrain endothelial cells for cell-based therapy of neuropsychiatric disorders. Proceedings of 22nd Biennial Meeting of the International Society for Developmental Neuroscience. , Nara, Japan. (2018).
- Bellin, M., Marchetto, M. C., Gage, F. H., Mummery, C. L. Induced pluripotent stem cells: the new patient? Nature Reviews Molecular Cell Biology. 13 (11), 713-726 (2012).
- Ardhanareeswaran, K., Mariani, J., Coppola, G., Abyzov, A., Vaccarino, F. M. Human induced pluripotent stem cells for modelling neurodevelopmental disorders. Nature Reviews Neurology. 13 (5), 265-278 (2017).
- Stubbs, D., et al. Neurovascular congruence during cerebral cortical development. Cerebral Cortex. 19 (1), 32-41 (2009).
- Vissapragada, R., et al. Bidirectional crosstalk between periventricular endothelial cells and neural progenitor cells promotes the formation of a neurovascular unit. Brain Research. 1565, 8-17 (2014).
- JoVE Science Education Database. Cell Biology. The Transwell Migration Assay. Journal of Visualized Experiments. , Cambridge, MA. (2019).
- Renaud, J., Martinovic, M. G. Development of an insert co-culture system of two cellular types in the absence of cell-cell contact. Journal of Visualized Experiments. 113, e54356(2016).
- Guan, J. L. In vitro scratch assay: a convenient and inexpensive method for analysis of cell migration in vitro. Nature Protocols. 2 (2), 329-333 (2007).
- Nelson, R. D., Quie, P. G., Simmons, R. L. Chemotaxis under agarose: a new and simple method for measuring chemotaxis and spontaneous migration of human polymorphonuclear leukocytes and monocytes. The Journal of Immunology. 115 (6), 1650-1656 (1975).
- Zigmond, S. H. Ability of polymorphonuclear leukocytes to orient in gradients of chemotactic factors. Journal of Cell Biology. 75 (2), 606-616 (1977).
- Zicha, D., Dunn, G., Jones, G. Analyzing chemotaxis using the Dunn direct-viewing chamber. Methods in Molecular Biology. 75, 449-457 (1997).
- Kim, B. J., Wu, M. Microfluidics for mammalian cell chemotaxis. Annals of Biomedical Engineering. 40 (6), 1316-1327 (2012).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。