Method Article
Migrations, Chemo-Attraction et Co-Culture Assays for Human Stem Cell-Derived Endothelial Cells and GABAergic Neurons (en anglais)
Dans cet article
Résumé
Nous présentons trois essais in vitro simples -l'analyse de migration à longue distance, l'analyse de migration de co-culture, et l'analyse de chimio-attraction--qui évaluent collectivement les fonctions des cellules souches humaines dérivées des cellules périventriculaires endothéliales et de leur interaction avec les interneurons GABAergic.
Résumé
Le rôle de la vascularisation du cerveau dans le développement du système nerveux et l'étiologie des troubles cérébraux attire de plus en plus l'attention. Nos études récentes ont identifié une population spéciale de cellules vasculaires, les cellules endothéliales periventriculaires, qui jouent un rôle critique dans la migration et la distribution des interneurones GABAergic avant-cerveau pendant le développement embryonnaire. Ceci, couplé avec leurs fonctions cellulaires-autonomes, fait allusion à de nouveaux rôles des cellules endothéliales periventriculaires dans la pathologie des désordres neuropsychiatriques comme la schizophrénie, l'épilepsie, et l'autisme. Ici, nous avons décrit trois essais in vitro différents qui évaluent collectivement les fonctions des cellules endothéliales periventriculaires et leur interaction avec les interneurons GABAergic. L'utilisation de ces tests, en particulier dans un contexte humain, nous permettra d'identifier le lien entre les cellules endothéliales periventriculaires et les troubles cérébraux. Ces essais sont simples, peu coûteux et reproductibles, et peuvent être facilement adaptés à n'importe quel type de cellule adhérente.
Introduction
Les cellules endothéliales forment la muqueuse des vaisseaux sanguins et les fonctions importantes de médiation qui incluent le maintien de la perméabilité de mur de vaisseau, la régulation du flux sanguin, l'agrégation de plaquette, et la formation de nouveaux vaisseaux sanguins. Dans le cerveau, les cellules endothéliales font partie d'une barrière hémato-encéphalique critique qui contrôle étroitement l'échange de matériaux entre le cerveau et la circulation sanguine1. Nos études dans la dernière décennie ont identifié de nouveaux rôles neurogènes des cellules endothéliales de cerveau qui ont des implications significatives pour le développement et le comportement de cerveau2,3,4,5. Nous avons montré que le cerveau embryonnaire de souris est vascularisé par deux sous-types distincts des navires, les vaisseaux pial et les vaisseaux périventriculaires, qui diffèrent dans l'anatomie, l'origine, et le profil développemental2. Les cellules endothéliales qui tapissent ces deux sous-types de vaisseaux présentent des différences distinctes dans leurs profils d'expression génique. Tandis que les cellules endothéliales piales expriment principalement des gènes liés à l'inflammation et à la réponse immunitaire, les cellules endothéliales periventriculaires sont uniquement enrichies dans l'expression des gènes généralement associés à la neurogenèse, à la migration neuronale, à la chimiotaxie, et au guidage d'axone3. Les cellules endothéliales periventriculaires abritent également une nouvelle voie de signalisation DE GABA qui est distincte de la voie neuronale traditionnelle de signalisation de GABA5. En même temps que son expression génique, des cellules endothéliales periventriculaires ont été trouvées pour réguler la migration et la distribution des interneurons GABAergic dans le néocortex en développement. Pendant le développement embryonnaire, les cellules endothéliales periventriculaires subissent la migration à longue distance le long d'un gradient ventral-dorsal pour établir le réseau vasculaire periventriculaire2,3. Cette route migratoire est reflétée un jour plus tard par des interneurones. Les interneurones migrateurs interagissent physiquement avec le réseau vasculaire périventriculaire préformé et l'utilisent comme guide pour atteindre leur destination finale dans le néocortex. En plus d'agir comme substrat physique, les cellules endothéliales périventriculaires servent de source de repères de navigation pour les neurones migrateurs. Periventricular endothelial cell-secreted GABA guide la migration interneuron et régule leurs modèles de distribution finale4. Les défauts dans la migration et la distribution interneuron sont associés aux désordres neuropsychiatriques tels que l'autisme, l'épilepsie, la schizophrénie et la dépression6,7,8,9,10. Par conséquent, l'étude des fonctions endothéliales periventriculaires de cellules et de leur influence sur la migration interneuron dans le contexte humain devient critique pour adresser la pathogénie de ces désordres.
Nous avons généré des cellules endothéliales periventriculaires humaines à partir de cellules souches embryonnaires humaines dans notre laboratoire11, en utilisant la technologie induite des cellules souches pluripotentes (iPSC)12,13. Pour valider si les cellules endothéliales periventriculaires humaines imitent fidèlement les cellules endothéliales periventriculaires de souris, et pour évaluer quantitativement leur influence sur la migration interneuron, nous avons développé trois essais in vitro : un essai de migration à longue distance, un essai de migration de co-culture, et un essai de chimio-attraction. Ici, nous décrivons les protocoles pour ces essais en détail. Les trois essais sont basés sur l'utilisation d'inserts de culture de silicone pour créer un petit patch rectangulaire de cellules (de dimensions fixes) entouré s'un de l'espace sans cellules. La distance de migration est évaluée en mesurant la distance entre les positions finales des cellules à partir de la bordure de la plaque rectangulaire qui a été décrite le jour 0. Dans l'essai de migration à longue distance, les cellules endothéliales periventriculaires humaines sont enseventées comme un patch au centre d'un plat de 35 mm, et les distances parcourues par les cellules sur une longue période de temps sont calculées. Dans l'essai de migration de co-culture, les cellules endothéliales periventriculaires humaines sont co-enseçantes avec des interneurons humains comme un patch dans un plat de 35 mm. Cette configuration permet d'examiner l'effet des interactions physiques directes de ces deux types de cellules sur le taux de migration des interneurones. L'exemple de chimio-attraction mesure la migration des interneurones en réponse aux indices chimio-attrayants sécrétés par les cellules endothéliales periventriculaires humaines. Les interneurones sont ensedus comme un patch rectangulaire, avec des cellules endothéliales periventriculaires humaines et contrôlent les cellules endothéliales non periventriculaires ensevulées comme des taches de taille similaire de chaque côté. Chacune des plaques cellulaires est séparée par un espace sans cellules de 500 m. La réponse des interneurones est évaluée en quantifiant le nombre de cellules qui ont migré vers les cellules endothéliales periventriculaires par rapport au contrôle des cellules endothéliales non perventriculaires.
Ces essais fournissent l'évaluation robuste des fonctions endothéliales periventriculaires humaines de cellules et de leur influence sur la migration interneuron. La nouvelle configuration de l'analyse longue distance et de l'analyse de la migration par co-culture fournit un espace libre de cellules dans la gamme de centimètres (1-1,5 cm) pour permettre la détection de la migration à longue distance. Un résumé des caractéristiques de nos essais par rapport à d'autres essais populaires est présenté dans le tableau 1. Collectivement, les essais décrits ici serviront de plate-forme pour évaluer les cellules endothéliales periventriculaires « malades » et les interneurons générés par les iPSC des désordres de cerveau comme la schizophrénie, l'autisme ou l'épilepsie. Ces essais peuvent également être utilisés pour déterminer comment différentes conditions (p. ex. inhibiteurs, ligands, ARNi) affectent la migration cellulaire. Enfin, ces tests peuvent être optimisés pour d'autres types de cellules afin de mesurer la migration à longue distance, la chimio-attraction ou la migration par mediated cellule-cell.
Protocole
1. Culture et stockage des cellules endothéliales periventriculaires humaines
- Maintenir les cellules endothéliales periventriculaires humaines sur la matrice de membrane du sous-sol (voir Tableau des matériaux)plaques de 6 puits dans le milieu cellulaire endothélial periventriculaire (milieu E6 contenant 50 ng/mL VEGF-A, 100 ng/mL FGF2 et 5 M GABA) à 37 oC et 5 % CO2. Changer de moyen tous les jours alternatifs.
- Décongeler la matrice de membrane du sous-sol en 4 oC et faire une solution 1:100 en la diluant dans un milieu DMEM/F12 froid. Enrober chaque puits d'une plaque de 6 puits avec 1 ml de solution de matrice. Incuber les plaques à 37 oC pendant au moins 1 h avant utilisation.
- Permettre aux cellules endothéliales periventriculaires humaines d'atteindre une confluence de 80%-90%. Aspirer le milieu du puits. Laver les puits une fois avec 1 ml de 1x PBS stérile par puits.
- Détachez les cellules en ajoutant 1 ml de solution de dissociation cellulaire (voir Tableau des matériaux) par puits. Incuber à 37 oC pendant 5 min. Après 5 min, ajouter 1 ml de milieu cellulaire endothélial périventriculaire. Transférer la solution cellulaire dans un tube conique de 15 ml.
REMARQUE: Nous utilisons Accutase pour la dissociation cellulaire ici, par opposition à TrypLE dans les sections 3 et 4. - Centrifugeuses cellules à 500 x g pendant 5 min à température ambiante, aspirer le supernatant et resuspendre la pastille cellulaire dans 1 ml de milieu cellulaire endothélial periventriculaire.
- Comptez les cellules vivantes à l'aide de la méthode d'exclusion bleue trypan. Cellules de graines dans des plaques fraîches recouvertes de matrice à une densité de 1,2 x 105 cellules/cm2. Incuber à 37 oC et 5 % de CO2.
- Stocker les cellules endothéliales periventriculaires humaines en cryoprétifiant dans le milieu de congélation (90% milieu endothélial periventriculaire et 10% DMSO).
- Dissocier et recueillir les cellules suivant les étapes 1.3 et 1.4 ci-dessus. Compter les cellules dans la solution par la méthode d'exclusion bleue trypan.
- Cellules centrifugeuses à 500 x g pendant 5 min à température ambiante. Aspirer le supernatant et resuspendre la pastille cellulaire à 5 x 106 cellules/mL de milieu de congélation.
- Distribuer 1 ml de milieu de congélation plus les cellules par cryovial. Placer les flacons dans une chambre remplie d'isopropanol et laisser refroidir toute la nuit dans un -80 oC à 1 oC/min. Transférer les flacons dans un réservoir d'azote liquide le lendemain pour le stockage à long terme.
2. Préparation des cellules endothéliales periventriculaires humaines pour les tests
- Permettre aux cellules endothéliales periventriculaires humaines d'atteindre 70%-80% de confluence.
- Dissocier les cellules suivant les étapes 1,3 à 1,5 comme décrit ci-dessus. Compter les cellules à l'aide de la méthode d'exclusion bleu trypan.
3. Préparation des Interneurons GABAergic humains pour l'essai
REMARQUE : Des interneurones GABAergiques dérivés de cellules souches pluripotentes induites par l'homme (iPSC) et le milieu neuronal ont été achetés commercialement (voir Tableau des matériaux). Les neurones sont générés par la différencié d'une lignée iPSC dérivée du fibroblaste humain suivant un protocole développé par le fabricant. Les cellules ont été décongelées et cultivées selon le protocole du fabricant.
- Décongeler les interneurones GABAergic humains et les culture dans la plaque de 12 puits pendant deux semaines à une confluence de 70%-80%.
- Le jour de l'essai, solution de dissociation cellulaire chaude (voir Tableau des matériaux) et un aliquot de milieu neuronal à 37 oC pendant 10 min avant utilisation.
- Aspirer le milieu de chaque puits contenant les cellules. Laver les cellules avec 1 ml de 1x PBS stérile par puits.
- Détachez les cellules en ajoutant 0,5 ml de solution de dissociation préchauffée par puits et incubez à 37 oC pendant 5 min. Ajouter 1 ml de milieu neuronal par puits. Transférer la solution cellulaire dans un tube conique de 15 ml. Triturate doucement pour dissocier les amas cellulaires.
- Centrifugeuses cellules à 380 x g pendant 5 min à température ambiante, aspirer le supernatant et resuspendre la pastille cellulaire dans 1 ml de milieu neuronal. Comptez les cellules vivantes à l'aide de la méthode d'exclusion bleue trypan.
4. Préparation de la commande des cellules endothéliales humaines pour l'essai
REMARQUE : Contrôler les cellules endothéliales humaines dérivées de l'iPSC et le milieu cellulaire endothélial ont été achetés commercialement(Tableau des matériaux). Ces cellules endothéliales sont générées par la différencié d'une lignée d'iPSC dérivée du fibroblaste humain au destin endothélial suivant un protocole développé par le fabricant. Les cellules ont été décongelées et cultivées sur le substrat de fibronectin selon le protocole du fabricant. Des plaques enduites de fibronectin ont été préparées suivant le protocole du fabricant.
- Le dégel contrôle les cellules endothéliales humaines et les culture dans une plaque de 6 puits à une confluence de 80%-90%.
- Le jour de l'essai, solution de dissociation cellulaire chaude (voir Tableau des matériaux) et un aliquot de milieu endothélial à 37 oC pendant 10 min avant utilisation.
- Aspirer le milieu de chaque puits contenant les cellules. Laver les cellules avec 1 ml de 1x PBS stérile par puits.
- Détachez les cellules en ajoutant 0,5 ml de solution de dissociation pré-chauffée par puits. Incuber à température ambiante pendant 5 min. Ajouter 1 ml de milieu cellulaire endothélial par puits pour neutraliser la solution de dissociation. Transférer la solution cellulaire dans un tube conique de 15 ml.
- Cellules centrifugeuses à 200 x g pendant 5 min à température ambiante. Aspirez supernatant et resuspend la pastille cellulaire dans 1 ml de milieu cellulaire endothélial. Comptez les cellules vivantes à l'aide de la méthode d'exclusion bleue trypan.
5. Préparation d'inserts de culture one-well
- Décongeler la solution de lamininàé de 1 mg/mL à température ambiante ou pendant la nuit à 4 oC.
- Enrober un nombre approprié de plats de 35 mm avec une solution poly-L-ornithine de 0,01 % (1 ml par plat). Incuber les plats à température ambiante pendant au moins 1 h.
- Diluer 1 mg/mL solution de laminin1:300 dans de l'eau stérile à une concentration finale de 3,3 g/mL immédiatement avant utilisation.
- Aspirer complètement la poly-L-ornithine de chaque plat. Rincer soigneusement chaque plat 3x avec de l'eau stérile et aspirer complètement pour éviter la toxicité cellulaire induite par la poly-L-ornithine.
- Ajouter 1 ml de solution de laminin de 3,3 g/mL à chaque plat et incuber à 37 oC pendant la nuit ou au moins 1 h. Retirer la solution de laminindu du plat immédiatement avant l'utilisation.
REMARQUE : Vous pouvez également conserver les plats contenant de lalaminin dans 4 oC. Équilibrez les plats dans un incubateur de culture cellulaire de 37 oC avant utilisation. - Couper trois côtés d'un puits d'un insert de culture en silicone à deux puits (Figure 1A) à l'aide d'une lame stérile pour générer un insert d'un puits (Figure 1B).
REMARQUE : Gardez l'insert à deux puits fermement fixé à la surface de l'emballage d'origine tout en coupant pour assurer une coupe lisse et protéger l'adhérence de l'insert. - Aspirate laminin solution des plats.
REMARQUE : Ne lavez pas la vaisselle avec du PBS stérile ou de l'eau après l'incubation de lalaminin. Les surfaces humides empêcheront l'adhérence serrée de l'insert de culture. - Retirez l'insert d'un puits à l'œil stérile et placez-le au centre du plat enrobé de poly-L-ornithine/laminin. Appuyez le long des bords de l'insert pour le fixer à la surface du plat.
- Tournez soigneusement le plat à l'envers pour vérifier que l'insert est fermement adhéré.
- Gardez le plat à l'envers et marquez la limite du compartiment d'insertion à l'aide d'un marqueur noir permanent avec une pointe ultra-fine (Figure 1C).
6. Etoiles migratoires à longue distance
- Suspendre les interneurones GABAergiques humains à une concentration de 3 x 104 cellules/70 l de milieu neuronal. Graine de 70 l de solution cellulaire à l'intérieur de chaque insert de culture d'un puits.
REMARQUE : La densité d'ensemencement des interneurones est selon la recommandation du fabricant. - Suspendre les cellules endothéliales periventriculaires humaines à une concentration de 3 x 104 cellules/70 L de milieu endothélial périventriculaire. Graine de 70 l de solution cellulaire à l'intérieur de chaque insert de culture d'un puits.
REMARQUE : Le nombre de cellules endothéliales periventriculaires humaines ensevut à un rapport de 1:1 avec le nombre de neurones enseçants. - Ajouter 1 ml de milieu neuronal dans la vaisselle neuronale pour remplir la zone autour de l'insert et empêcher le revêtement de sécher. De même, ajoutez 1 mL de milieu de cellules endothéliales periventriculaires dans le plat endothélial periventriculaire de cellules.
REMARQUE : Ajouter le milieu lentement le long du bord du plat de sorte que l'insert ne soit pas dérangé. - Vérifiez sous un microscope pour vérifier que les cellules ne fuient pas du compartiment d'insertion.
- Incuber les cellules pendant 24 h à 37 oC et 5 % de CO2. Après 24 h d'incubation, vérifiez au microscope que les cellules se sont fixées correctement et qu'il n'y a pas de fuite de nuit.
- Après 48 h d'ensemencement, retirez délicatement l'insert à l'aide d'une pince stérile. Vérifiez sous le microscope pour vérifier que la couche cellulaire reste intacte (jour 0).
- Retirer le milieu du plat neuronal et ajouter 1 ml de milieu neuronal frais. De même, retirer le milieu du plat périventriculaire de cellules endothéliales et ajouter 1 ml de milieu endothélial periventriculaire frais de cellules.
REMARQUE: Mettre de côté un nombre requis de plats et fixer avec 4% PFA pour les images du jour 0. - Incuber les cellules pendant 5 jours à 37 oC et 5 % de CO2. Après 5 jours, retirer le milieu, fixer les cellules avec 4% PFA pendant 10 min, et laver 3x avec 1x PBS.
- Taïreles avec anti-humain -Tubulin ou anticorps anti-humains MAP2, et cellules endothéliales avec anticorps anti-humains CD31. À la fin de l'immunostaining, ajouter 1 ml de milieu de montage antifade à chaque plat.
7. Co-culture Migration Assay
- Cosuspend3 x 104 interneurons GABAergic et 3 x 104 cellules endothéliales periventriculaires humaines dans 70 'L de milieu de co-culture (50% milieu d'entretien périventriculaire sans GABA et 50% milieu neuronal). Ensemencez cette solution cellulaire à l'intérieur du compartiment d'insertion d'un puits. Préparer un nombre approprié de tels plats d'astodonte.
REMARQUE : Le GABA n'a pas été ajouté dans le milieu de co-culture pour exclure l'effet du GABA exogène sur la migration. - Vérifiez sous un microscope pour vérifier que les cellules ne fuient pas du compartiment d'insertion.
- Ajouter lentement 1 ml de milieu de co-culture le long du côté du plat pour empêcher le revêtement de sécher.
REMARQUE : Ajouter le milieu lentement le long du bord du plat de sorte que l'insert ne soit pas dérangé. - Dans un premier contrôle, la graine 3 x 104 interneurons GABAergic humain seulement dans 70 'L de milieu de co-culture par insert d'un puits. Préparer un nombre approprié de ces plats.
- Comme deuxième contrôle, co-seed 3 x 104 interneurons humains GABAergic avec 3 x 104 contrôlent les cellules endothéliales humaines dans 70 'L de milieu de co-culture par insert d'un puits. Préparer un nombre approprié de plats.
- Incuber les plats pendant 24 h à 37 oC et 5 % de CO2. Après 24 h d'incubation, vérifiez au microscope que les cellules se sont fixées correctement et qu'il n'y a pas de fuite.
- Après 48 h d'ensemencement, retirez délicatement l'insert à l'aide d'une pince stérile. Vérifiez sous le microscope pour vérifier que la couche cellulaire n'est pas perturbée (jour 0).
- Retirer le milieu et ajouter 1 ml de milieu de co-culture frais.
REMARQUE : Réservez un nombre approprié de plats pour l'acquisition d'images du jour 0. - Incuber les cellules pendant 5 jours à 37 oC et 5 % de CO2.
- Après 5 jours, retirer le milieu, fixer les cellules avec 4% PFA pendant 10 min, et laver 3x avec 1x PBS.
- Tache avec anti-humain -Tubulin ou anticorps anti-humain MAP2 pour étiqueter les neurones. À la fin de l'immunostaining, ajouter 1 ml de milieu de montage antifade à chaque plat.
8. Assay de chemio-attraction
- Placez un insert de culture à trois puits au centre d'un plat de 35 mm enduit de poly-L-ornithine/laminin à l'aide d'une pince stérile.
- Tournez le plat à l'envers. Marquez la limite autour du compartiment central de l'insert à l'aide d'un marqueur noir permanent à pointe ultra fine.
- Graine 3 x 104 interneurones GABAergiques humains dans le compartiment central dans 70 'L du milieu neuronal (Figure 3A).
- Graine 104 cellules endothéliales periventriculaires humaines dans 70 l de milieu endothélial periventriculaire et 104 cellules endothéliales de contrôle dans 70 'L du milieu endothélial de contrôle dans les deux compartiments externes respectivement (figure 3A).
- Ajouter 1 ml de milieu de co-culture (50% de milieu d'entretien périventriculaire sans GABA et 50% de milieu neuronal) le long du côté du plat pour empêcher le revêtement sur le plat de sécher.
- Vérifiez au microscope que les cellules ne fuient pas du compartiment d'insertion.
- Incuber les cellules pendant 24 h à 37 oC et 5 % de CO2. Après 24 h d'incubation, vérifiez au microscope que les cellules se sont fixées correctement et qu'il n'y a pas de fuite.
- Après 48 h d'ensemencement, retirez délicatement l'insert à l'aide d'une pince stérile. Vérifiez sous le microscope pour vérifier que la couche cellulaire n'est pas perturbée (jour 0).
- Retirer le milieu et ajouter 1 ml de milieu de co-culture frais.
REMARQUE : Réservez le nombre requis de plats pour les images du jour 0. - Incuber les cellules pendant 36 h à 37 oC et 5 % de CO2. Après 36 h, aspirer à mi-moyen, fixer les cellules avec 4% de PFA pendant 10 min, et laver 3x avec 1x PBS.
- Tachez les interneurones GABAergiques humains avec des anticorps anti-humains ou anti-humains MAP2. À la fin de la procédure de coloration, ajouter 1 ml de milieu de montage antifade dans chaque plat.
9. Imagerie et analyse de données
- Placez le plat d'assay immuno-taché sous un microscope au grossissement 4X.
- Gardez un long bord de la limite rectangulaire (fait à l'étape 5.10 ci-dessus) dans le champ de vision. Prenez des images de cellules dans l'espace sans cellules adjacente à cette limite. Acquérir des images le long du bord long droit et du bord long gauche de la limite rectangulaire (figure 2B).
REMARQUE : Les cellules placées en diagonale par rapport au rectangle ne sont pas considérées en raison de l'ambiguïté dans la sélection de la marque de départ courte ou longue. En outre, le nombre de cellules qui migrent à travers le bord court sont souvent significativement moins nombreux (peut-être en raison d'un nombre moindre de cellules de départ le long du bord court) et ne sont pas pris en considération. - Ouvrez les images dans ImageJ. Calculer la distance entre chaque cellule et la marque limite (Figure 2D) à l'aide d'ImageJ.
- Pour évaluer la migration en termes de nombre de cellules, fixez une distance spécifique par rapport à la limite dans l'image acquise dans ImageJ. Comptez le nombre de cellules présentes à cette distance. Calculer le nombre moyen, l'écart type et l'importance statistique à l'aide d'un logiciel approprié.
Résultats
Les étapes pour mettre en place un insert de culture d'un puits à l'intérieur d'un plat de 35 mm sont indiquées dans la figure 1. L'assay de migration à longue distance et l'assay de migration de co-culture ont utilisé un insert d'un puits pour ensemencer le nombre désiré de cellules au centre d'un plat de 35 mm enduit de poly-L-ornithine/laminin. Le jour 0, les cellules étaient présentes sous forme de patch rectangulaire(figure 2A,C). Dans les images du jour 0, la ligne du jour 0 pouvait être facilement identifiée par le bord tranchant de la couche cellulaire (ligne pointillée blanche dans la figure 2C). À 48 h, les cellules avaient migré dans l'espace sans cellules(figure 2B,D). Dans les images de l'après-jour 0, la bordure noire dessinée autour de l'insert (à l'arrière du plat) pouvait être clairement observée comme un espace noir. Le bord de l'écart a été attribué comme la ligne du jour 0 (ligne pointillée blanche dans la figure 2D). Comme nous l'avons mentionné à l'étape 9.2, seules les cellules qui sont tombées dans la zone adjacente aux bords longs de droite et à gauche de la couche cellulaire (zone jaune à la figure 2B)ont été prises en considération pour l'analyse des données. La distance parcourue par une cellule a été mesurée en calculant la distance entre la cellule (flèche blanche à la figure 2D) et la ligne du jour 0. La coloration immunocytochimique avec l'anticorps anti-actif Caspase 3, un marqueur de l'apoptose, n'a montré aucun signal apoptotique dans les cellules ensedutes (Figure 2E). Dans l'exemple de migration de co-culture, quand les interneurons ont été co-enseçants avec les cellules endothéliales periventriculaires humaines, les neurones ont voyagé plus loin distances comparées à quand les interneurons ont été ensedus seuls ou quand co-enseçant avec les cellules endothéliales de contrôle (figure 2F). En outre, pour la même gamme de distance, un plus grand nombre d'interneurons ont migré dehors une fois co-enseçant avec des cellules endothéliales periventriculaires par rapport aux interneurons dans les deux autres groupes. Ceci montre que, comme les cellules endothéliales periventriculaires de souris, les cellules endothéliales periventriculaires humaines favorisent la migration interneuron humaine.
Dans l'essai de chimio-attraction, utilisant des inserts de culture de trois puits, les interneurons humains ont été ensedus comme un petit patch rectangulaire dans un plat de culture enduit de poly-L-ornithine/laminin de 35 mm. Les cellules endothéliales periventriculaires et le contrôle des cellules endothéliales non perventriculaires ont été enseventlés sous forme de timbres de chaque côté du patch neuronal, l'écart entre chaque timbre étant de 500 m (Figure 3A). Le nombre d'interneurons qui ont migré vers les cellules endothéliales periventriculaires contre les cellules endothéliales de contrôle a été quantifié après 36 h. Un nombre sensiblement plus élevé d'interneurons a migré vers les cellules endothéliales periventriculaires comparées aux cellules endothéliales de contrôle (figure 3B,C),confirmant que les interneurons GABAergic répondent sélectivement aux indices chimio-attrayants sécrétés par les cellules endothéliales periventriculaires humaines.
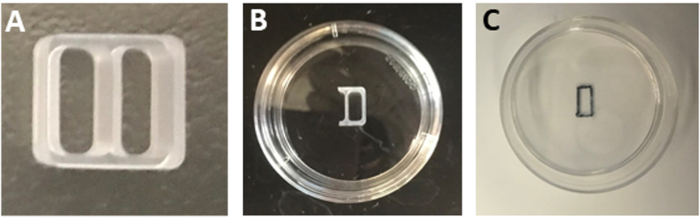
Figure 1 : Préparation de l'encart culturel. (A) Un encart culturel à deux puits. (B) Un insert d'un puits fixé au centre d'un plat de 35 mm. (C) Le contour de la tache rectangulaire telle qu'observée après avoir enlevé l'insert. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 2 : Schéma et résultat représentatif des résultats de la migration. (A) Schéma de couche cellulaire (rectangle rouge) le jour 0. (B) Schéma de cellules qui migrent dans l'espace sans cellules. Les points rouges indiquent les cellules migratrices. La région jaune marque la zone qui est représentée pour l'acquisition de données. La boîte pointillée en A et B correspond à la zone indiquée dans les panneaux C et D. (C,D) Images fluorescentes représentatives de l'anticorps anti-Tubulin étiqueté interneurons le jour 0 (C) et le jour 2 (D) de l'action de migration. La ligne pointillée blanche marque le jour 0. La ligne jaune en D indique la distance parcourue par une cellule (marquée par une flèche blanche) en 48 h. (E) Les neurones (le jour 0) sont co-étiquetés avec des anticorps anti-Tubulin (rouge) et anti-actifs Caspase 3 anticorps (vert), qui marquent les cellules apoptotiques. Les noyaux sont tachés de DAPI (bleu). Les cellules apoptotiques n'ont pas été détectées dans les cellules enseissées. (F) Graphique du jour 5 de l'analyse de co-culture, où le nombre d'interneurones qui ont migré est tracé contre la distance parcourue. En comparaison des interneurons qui ont été ensedus seuls ou co-enseçantavec des cellules endothéliales de contrôle, les interneurons co-ensemiens avec les cellules endothéliales periventriculaires ont migré dehors en plus grand nombre, et ont également voyagé plus loin. Les données représentent la moyenne de S.D (n '5;'p'lt;0.01,'p'lt; 0.001, Test t de l'étudiant). Barres d'échelle de 100 m. IN interneurons; PV EC - cellules endothéliales periventriculaires. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 3 : L'assay de la chimio-attraction. (A) Schéma de l'assay de chimio-attraction. À l'aide d'un encart de culture à trois puits, des interneurones (IN) ont été ensedus au milieu (rectangle pointillé vert), tandis que des cellules endothéliales périventriculaires (PV ECs; rectangle pointillé orange) et contrôlent les cellules endothéliales (ECs; rectangle pointillé jaune) ont été enseissées de chaque côté. (B) Images d'interneurons étiquetés a-Tubulin montrant une migration robuste vers les cellules endothéliales périventriculaires, mais pas vers le contrôle des cellules endothéliales. (C) Quantification de la réponse chimio-attrayante des interneurons. Un nombre significativement plus élevé de neurones ont migré vers les cellules endothéliales periventriculaires que vers le contrôle des cellules endothéliales. Les données représentent la moyenne de S.D (n 5;p 'lt; 0.05, Test t de l'étudiant). Barres d'échelle de 100 m. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
| Un | Avantages | Limitations |
| Boyden chambre d'astoid16,17 | · Techniquement non exigeant · Convient aux cellules adhérentes et non adhérentes · Peut être modifié pour étudier l'effet de la signalisation paracrine ou des chimio-attractants sur la migration cellulaire | · L'évaluation de point de terminaison. Ne convient pas à l'imagerie en temps réel. · Ne convient pas à l'étude de l'effet de l'interaction cellulaire directe sur la migration |
| Test de grattage18 | · Point final ou cinétique · Techniquement non exigeant | · Analyse la longueur de migration de quelques centaines de micromètres. Ne convient pas à l'étude de la migration à longue distance dans la gamme de 1-2 cm. · Ne convient pas aux cellules de suspension · Variations dans la zone de rayures |
| L'exemple de migration à longue distance | · Point final ou cinétique · Permet l'étude de la migration longue distance entre 1,5 et 2 cm · Techniquement non exigeant | · Ne convient pas aux cellules de suspension |
| L'exemple de la migration de co-culture | · Point final ou cinétique · Permet d'étudier l'effet du contact direct cellule-cellule sur la migration · Permet une longueur de migration allant jusqu'à 1,5 à 2 cm · Techniquement non exigeant | · Ne convient pas aux cellules de suspension |
| B | Avantages | Limitations |
| Boyden chambre d'assay | · Techniquement non exigeant · Convient aux cellules adhérentes et non adhérentes | · L'évaluation de point de terminaison. Ne convient pas à l'imagerie en direct. · Gradient de concentration raide |
| Exemple de sous-agarose19 | · Techniquement non exigeant · Deux ou plusieurs signaux chimio-attrayants peuvent être assieds dans un mis en place | · Ne convient pas aux cellules adhérentes. Limité principalement aux cellules sanguines. · Visualisation difficile des cellules dans l'agarose |
| L'exemple de migration de chambre capillaire20,21 | · Point final ou cinétique · Convient aux cellules adhérentes ou de suspension | · Besoins chambres spéciales |
| Dispositif microfluidique22 | · Génére un gradient de concentration contrôlable et stable · Permet une résolution de niveau unicellulaire | · Nécessite des appareils et des outils sophistiqués · Courbe d'apprentissage techniquement exigeante et raide · Imagerie complexe et analyse de données |
| L'exemple de la chimio-attraction | · Point final ou cinétique · Gradient de concentration graduel · Convient à l'imagerie en temps réel ou fluorescente · Techniquement non exigeant | · Ne convient pas aux cellules de suspension |
Tableau 1 : Comparaison des méthodes d'analyse. (A) Comparaison des tests courants de migration in vitro avec l'analyse de migration à longue distance et l'analyse de co-culture. (B) Comparaison des essais de chimiotaxis communs avec l'analyse de chimio-attraction.
Discussion
Ici, nous avons décrit trois essais in vitro qui fournissent ensemble l'évaluation quantitative des propriétés endothéliales endothéliales humaines de cellules-spécifiques. Ces essais seront utiles pour obtenir des connaissances mécanistes sur l'interaction des cellules endothéliales periventriculaires humaines avec les interneurones humains. Des expériences utilisant des ligands, des inhibiteurs ou des cellules présentant un renversement ou une surexpression spécifique au gène identifieront ou valideront des acteurs moléculaires qui assurent la médiation de la migration interneuron endothéliale à guidage cellulaire ou des propriétés migratoires à longue distance des cellules endothéliales endoticulaires. Ces essais peuvent également être modifiés pour effectuer des études de migration en temps-lapse en cellule vive. En outre, il existe des preuves pour l'interaction des cellules endothéliales avec des cellules autres que les interneurons. Des études de notre groupe et d'autres ont fait allusion à l'influence des cellules endothéliales periventriculaires sur le modelage des neurones de projection et la prolifération des cellules précurseurs neuronales5,14,15. Il serait intéressant de tester ces interactions possibles à l'aide de nos paramètres d'analyse. Enfin, ces essais serviront de plate-forme pour l'évaluation des cellules endothéliales périventriculaires malades. Nos travaux ont établi de nouveaux liens autonomes entre le réseau vasculaire périventriculaire et l'origine de troubles neuropsychiatriques comme la schizophrénie, l'épilepsie, l'autisme et la dépression majeure3,5. Ces essais seront inestimables en identifiant les défauts potentiels dans la migration à longue distance, la chimio-attraction, ou la signalisation de juxtracrine des cellules endothéliales malades-periventriculaires dans ces conditions neuropsychiatriques de désordre.
Ces essais sont simples, reproductibles et peu coûteux, et ils peuvent être modifiés pour mesurer la migration cellulaire et les effets de la co-culture ou des indices chimio-attrayants sur la migration dans divers types de cellules, à l'exception des cellules non adhérentes. Il y a quelques étapes critiques qui doivent être suivies pour obtenir des résultats précis et reproductibles. Tout d'abord, il est essentiel d'optimiser le numéro de cellule d'ensemencement pour chaque analyse. Le nombre de cellules à ensemencées dans un seul compartiment devrait dépendre du type de cellule, du niveau souhaité de confluence et des facteurs spécifiques à l'astodonte comme le ratio de co-culture. Deuxièmement, il est nécessaire d'optimiser le milieu de culture cellulaire pour chaque résultat. Dans l'exemple de migration de co-culture et l'assay de chimio-attraction, où plus d'un type de cellule est ensemencé dans un seul plat, le milieu d'assay devrait être propice à tous les types de cellules. Dans le cas d'expériences pilotes, nous avons examiné l'effet du milieu de co-culture sur la viabilité (à l'aide de la méthode d'exclusion bleue trypan) et la morphologie (en utilisant l'immunocytochimie) de chaque type de cellule. Nous avons cultivé les neurones GABAergic humains avec le milieu de co-culture pendant une semaine et n'avons observé aucune différence significative dans la viabilité et la morphologie des neurones dans le milieu de co-culture comparé aux neurones cultivés dans le milieu neuronal. De la même manière, les cellules endothéliales periventriculaires et les cellules endothéliales de contrôle, cultivées dans le milieu de co-culture pendant deux passages, n'ont montré aucune variation significative dans la survie et la morphologie de cellules. Troisièmement, puisque le taux de migration varie selon les types de cellules, il est important de déterminer le délai pour chaque test pour le type de cellule à l'étude. Quatrièmement, il est essentiel de gérer soigneusement les inserts de culture. Les inserts doivent être fixés fermement sur le plat en appuyant doucement avec le bout du doigt. Le plat doit être retourné à l'envers pour vérifier que l'insert ne bouge pas. Il faut également faire attention lors de l'enlèvement de l'insert afin de ne pas perturber la couche cellulaire. Enfin, il est recommandé d'augmenter la taille de l'échantillon pour réduire la variabilité expérimentale.
En conclusion, ces essais élargiront de manière significative notre compréhension de la biologie endothéliale endothéliale humaine de cellules et de son rôle sur le développement de cerveau dans les conditions normales et malades.
Déclarations de divulgation
Les auteurs ne déclarent aucun conflit d'intérêts.
Remerciements
Ce travail a été soutenu par des prix de l'Institut national de la santé mentale (R01MH110438) et national institut des troubles neurologiques et des accidents vasculaires cérébraux (R01NS100808) à AV.
matériels
| Name | Company | Catalog Number | Comments |
| Accutase dissociation solution | Millipore Sigma | SCR005 | Cell dissociation solution (for periventricular endothelial cells, step 1.4) |
| Anti-human β-Tubulin antibody | Biolegend | 802001 | |
| Anti-human CD31 antibody | Millipore Sigma | CBL468 | |
| Anti- MAP2 antibody | Neuromics | CH22103 | |
| Anti-active Caspase 3 antibody | Millipore Sigma | AB3623 | |
| Control human endothelial cells | Cellular Dynamics | R1022 | |
| Control endothelial Cells Medium Supplement | Cellular Dynamics | M1019 | |
| Cryogenic vials | Fisher Scientific | 03-337-7Y | |
| DMEMF/12 medium | Thermofisher Scientific | 11320033 | |
| DMSO | Sigma-Aldrich | D2650 | |
| E6 medium | Thermofisher Scientific | A1516401 | |
| FGF2 | Thermofisher Scientific | PHG0261 | |
| Fibronectin | Thermofisher Scientific | 33016-015 | |
| Freezing Container | Thermofisher Scientific | 5100 | |
| GABA | Sigma-Aldrich | A2129 | |
| Hemacytometer | Sigma-Aldrich | Z359629 | |
| Human GABAergic neurons | Cellular Dynamics | R1013 | |
| Human GABAergic neurons base medium | Cellular Dynamics | M1010 | |
| Human GABAergic neuron Neural supplement | Cellular Dynamics | M1032 | |
| Laminin | Sigma | L2020 | |
| Matrigel | Corning | 356230 | Basement membrane matrix |
| Mounting Medium | Vector laboratories | H-1200 | |
| poly-L-ornithin | Sigma | p4957 | |
| PBS | Thermofisher Scientific | 14190 | |
| Trypan blue | Thermofisher Scientific | 15250061 | |
| TrypLE | Thermofisher Scientific | 12563011 | Cell dissociation solution (for GABAergic interneurons and endothelial cells, sections 3 and 4) |
| VEGF-A | Peprotech | 100-20 | |
| VascuLife VEGF Medium Complete Kit | Lifeline Cell Technologies | LL-0003 | Component of control human endothelial cell medium |
| 2-well silicone culture-Insert | ibidi | 80209 | |
| 3-well silicone culture-Insert | ibidi | 80369 | |
| 35 mm dish | Corning | 430165 | |
| 15-ml conical tube | Fisher Scientific | 07-200-886 | |
| 4% PFA solution | Fisher Scientific | AAJ19943K2 | |
| 6-well tissue culture plate | Fisher Scientific | 14-832-11 | |
| Inverted phase contrast microscope | Zeiss | Zeiss Axiovert 40C | |
| Fluorescent microscope | Olympus | FSX-100 |
Références
- Sweeney, M. D., Zhao, Z., Montagne, A., Nelson, A. R., Zlokovic, B. V. Blood-Brain Barrier: From Physiology to Disease and Back. Physiological Reviews. 99 (1), 21-78 (2019).
- Vasudevan, A., Long, J. E., Crandall, J. E., Rubenstein, J. L., Bhide, P. G. Compartment-specific transcription factors orchestrate angiogenesis gradients in the embryonic brain. Nature Neuroscience. 11 (4), 429-439 (2008).
- Won, C., et al. Autonomous vascular networks synchronize GABA neuron migration in the embryonic forebrain. Nature Communications. 4, 2149(2013).
- Li, S., Haigh, K., Haigh, J. J., Vasudevan, A. Endothelial VEGF sculpts cortical cytoarchitecture. The Journal of Neuroscience. 33 (37), 14809-14815 (2013).
- Li, S., et al. Endothelial cell-derived GABA signaling modulates neuronal migration and postnatal behavior. Cell Research. 28 (2), 221-248 (2018).
- Lewis, D. A., Levitt, P. Schizophrenia as a disorder of neurodevelopment. Annual Review of Neuroscience. 25, 409-432 (2002).
- Lewis, D. A., Hashimoto, T., Volk, D. W. Cortical inhibitory neurons and schizophrenia. Nature Reviews Neuroscience. 6 (4), 312-324 (2005).
- Marin, O. Interneuron dysfunction in psychiatric disorders. Nature Reviews Neuroscience. 13 (2), 107-120 (2012).
- Levitt, P., Eagleson, K. L., Powell, E. M. Regulation of neocortical interneuron development and the implications for neurodevelopmental disorders. Trends in Neurosciences. 27 (7), 400-406 (2004).
- Treiman, D. M. GABAergic mechanisms in epilepsy. Epilepsia. 42 (3), 8-12 (2001).
- Datta, D., Subburaju, S., Kaye, S., Vasudevan, A. Human forebrain endothelial cells for cell-based therapy of neuropsychiatric disorders. Proceedings of 22nd Biennial Meeting of the International Society for Developmental Neuroscience. , Nara, Japan. (2018).
- Bellin, M., Marchetto, M. C., Gage, F. H., Mummery, C. L. Induced pluripotent stem cells: the new patient? Nature Reviews Molecular Cell Biology. 13 (11), 713-726 (2012).
- Ardhanareeswaran, K., Mariani, J., Coppola, G., Abyzov, A., Vaccarino, F. M. Human induced pluripotent stem cells for modelling neurodevelopmental disorders. Nature Reviews Neurology. 13 (5), 265-278 (2017).
- Stubbs, D., et al. Neurovascular congruence during cerebral cortical development. Cerebral Cortex. 19 (1), 32-41 (2009).
- Vissapragada, R., et al. Bidirectional crosstalk between periventricular endothelial cells and neural progenitor cells promotes the formation of a neurovascular unit. Brain Research. 1565, 8-17 (2014).
- JoVE Science Education Database. Cell Biology. The Transwell Migration Assay. Journal of Visualized Experiments. , Cambridge, MA. (2019).
- Renaud, J., Martinovic, M. G. Development of an insert co-culture system of two cellular types in the absence of cell-cell contact. Journal of Visualized Experiments. 113, e54356(2016).
- Guan, J. L. In vitro scratch assay: a convenient and inexpensive method for analysis of cell migration in vitro. Nature Protocols. 2 (2), 329-333 (2007).
- Nelson, R. D., Quie, P. G., Simmons, R. L. Chemotaxis under agarose: a new and simple method for measuring chemotaxis and spontaneous migration of human polymorphonuclear leukocytes and monocytes. The Journal of Immunology. 115 (6), 1650-1656 (1975).
- Zigmond, S. H. Ability of polymorphonuclear leukocytes to orient in gradients of chemotactic factors. Journal of Cell Biology. 75 (2), 606-616 (1977).
- Zicha, D., Dunn, G., Jones, G. Analyzing chemotaxis using the Dunn direct-viewing chamber. Methods in Molecular Biology. 75, 449-457 (1997).
- Kim, B. J., Wu, M. Microfluidics for mammalian cell chemotaxis. Annals of Biomedical Engineering. 40 (6), 1316-1327 (2012).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon