Method Article
Isolação e avaliação quantitativa de pilhas da escova dos Tracheas do rato
Neste Artigo
Resumo
As pilhas da escova são pilhas epithelial quimiosensoriais colinérgicos raras encontradas na traquéia ingênua do rato. Devido a seus números limitados, a avaliação ex vivo de seu papel funcional na imunidade e na remodelação da via aérea é desafiante. Nós descrevemos um método para a isolação de pilhas tracheal da escova pelo fluxo cytometry.
Resumo
Células da escova traqueal são células epiteliais quimiosensoriais colinérgicas pronta para transmitir sinais do lúmen das vias aéreas para os sistemas imunológico e nervoso. Eles são parte de uma família de células epiteliais quimiosensoriais que incluem células de tufo na mucosa intestinal, células de pincel na traquéia, e células quimiosensoriais e microvillous solitárias na mucosa nasal. As pilhas de chemosensory em compartimentos epithelial diferentes compartilham dos marcadores intracelular chaves e de uma assinatura transcricional do núcleo, mas igualmente para indicar a heterogeneidade transcricional significativa, reflexivo provável do ambiente local do tecido. A isolação de pilhas tracheal da escova das suspensões da única pilha é exigida para definir a função destas pilhas epithelial raras em detalhe, mas seu isolamento é desafiante, potencial devido à interação próxima entre pilhas da escova e terminações de nervo tracheal ou devido à composição da via aérea específica de junções apertadas e aderens. Aqui, nós descrevemos um procedimento para a isolação de pilhas da escova do epitélio tracheal do rato. O método é baseado em uma separação inicial do epitélio tracheal da submucosa, permitindo uma incubação mais curta subseqüente da folha epithelial com Papain. Este procedimento oferece uma solução rápida e conveniente para a classificação citométrica do fluxo e a análise funcional de pilhas tracheal viáveis da escova.
Introdução
As pilhas da escova pertencem a uma classe de pilhas epithelial quimiossensorial caracterizadas pela expressão de receptores amargos do gosto e da maquinaria do transdução do receptor do gosto encontradas em pilhas do botão do gosto. Ao contrário das pilhas do botão do gosto, as pilhas epithelial quimiossensorial são dispersadas em superfícies epithelial e são referidas como pilhas quimiossensorial solitárias (SCCs) e pilhas microvillous no epitélio nasal1,2, pilhas da escova na traqueia 3,4e células de tufo no intestino5,6. Células epiteliais que expressam receptores de paladar amargo e a máquina de transdução de paladar amargo também são encontradas na uretra7,8 e no tubo auditivo9. As pilhas da escova da via aérea têm funções originais em respostas neurogênica e imunes da via aérea. Eles são células quimiosensoriais produtoras de acetilcolina que evocam reflexos respiratórios protetores após a ativação com compostos amargos e metabólitos bacterianos como substâncias que detectam quorum10. As pilhas da escova da via aérea são igualmente a fonte epithelial dominante da via aérea de IL-25, que regula o tipo aeroalergeno-eliciado-2 inflamação nas vias aéreas3.
A caracterização do transcriptoma completo de células de escova de vias aéreas inferiores e sua resposta a estímulos ambientais tem sido limitada por seus baixos números no epitélio traqueal e números muito limitados além dos grandes brônquios10. As técnicas usadas para o isolamento de células quimiosensoriais do epitélio intestinal não produziram números proporcionalmente altos da traquéia, possivelmente por causa dos contatos íntimos de células da escova traqueal com terminações nervosas10 ou outras fatores tecido-específicos na mucosa respiratória tais como a composição de aderens e de proteínas apertadas da junção. Os relatórios recentes da isolação bem sucedida de pilhas tracheal da escova em números mais elevados para a análise de sequenciamento do RNA da única pilha empregou uma incubação de 2 h com papaína ou uma incubação de 18 h com soros11,12. Uma vez que incubações mais longas com enzimas digestivas podem diminuir a viabilidade celular e alterar o perfil transcricional das células dos tecidos digeridos13, isso poderia viés de análise comparativa com outras populações epiteliais quimiosensoriais.
Aqui, nós relatamos um método para a isolação de pilhas tracheal da escova para arranjar em seqüência3do RNA. O tratamento da traquéia com Dispase da elevado-dose separa o epitélio da submucosa. A digestão subseqüente da folha epithelial com papaína permite a recuperação excelente desta pilha estrutural.
Protocolo
Antes de realizar os seguintes experimentos, assegure-se de que todos os protocolos e uso de cuidados com animais sejam aprovados pelo Comitê institucional de cuidado e uso de animais (IACUC) e realizado de acordo com o "guia para o cuidado e uso de Animais de laboratório "(8ª edição, 2011) e as orientações chegam. Todos os procedimentos descritos abaixo foram revisados e aprovados pelo Comitê institucional de cuidado e uso de animais do hospital Brigham e Women ' s.
1. preparação de reagentes
- Prepare a solução de digestão Dispase, que é uma solução de PBS contendo 16 U/mL de Dispase e 20 μg/mL de DNase I. Certifique-se de que o pó Dispase está totalmente dissolvido antes de aquecer a solução num banho de água a 37 ° c.
- Adicione 5% de soro bovino fetal inativado por calor (FBS) ao meio de águia de Dulbecco Modified (DMEM) para fazer uma solução de parada.
- Prepare o tampão de Tyrode I: Adicione 26 U/mL de papaína (20 μL/mL de 48 U/mg de solução de papaína) e 10 μL/mL de L-cisteína ao tampão de HEPES-Tyrode sem cálcio.
- Prepare o tampão de Tyrode II: Adicione 2 μL/mL de leupeptina (5 mg/mL) ao tampão de HEPES-Tyrode com cálcio.
- Prepare o tampão do FACS: Use a solução de sal equilibrada de Hanks (HBSS) sem cálcio, magnésio & o vermelho do phenol, suplementado com o ácido ethylenediaminetetraacético de 2 milímetros (EDTA) e adicione 2% FBS.
2. dissecção da traquéia do rato
Nota: Os ratos usados neste protocolo são bate-papo(BAC)-EGFP (B6. CG-TG (RP23-268L19-EGFP) 2Mik/J), 3-6 meses de idade de ambos os sexos. Minimize a exposição do tecido para direcionar a luz para reduzir o fotobranqueamento de eGFP.
- Eutanizar o rato com 100 mg/kg solução de eutanásia pentobarbital injetada intraperitonealmente ou usando protocolos padrão aprovados pelo IACUC.
- Fixe o rato em uma placa cirúrgica na posição supina com as 21 agulhas de G com extremidades superiores e mais baixas estendidas. Pulverize a pele com 70% de EtOH para higienizar a área.
- Usando fórceps reto, levante a pele e o pêlo do abdômen e faça uma incisão no centro com tesouras de dissecação (tesoura reta, 3 cm). Usando a tesoura, separe a pele do tecido subcutâneo do abdômen para a mandibula. Enquanto segurando o tecido subcutâneo com o fórceps, faça uma pequena incisão com a tesoura no centro da parede abdominal.
- Abra o peritônio com uma incisão em forma de V. Usando o fórceps, mova suavemente o intestino delgado para o lado, localize a aorta abdominal e a veia cava e faça uma incisão com a tesoura de dissecação para permitir a exsanguagem rápida.
- Localize o diafragma. Usando uma agulha de 18 G, faça uma abertura no diafragma logo abaixo do esterno para esvaziar os pulmões. Separe cuidadosamente o diafragma da caixa torácica usando uma tesoura de dissecação reta afiada para cortar ao longo da base das costelas.
- Usando o fórceps, levante a extremidade exposta do esterno e corte o esterno longitudinalmente da base da caixa torácica até o pescoço. Faça uma incisão cervical central com tesouras retas curtas (2 cm) e separe os dois lóbulos da glândula submandibular.
- Retire cuidadosamente o tecido conjuntivo circundante e o Timo sobrejacente a Carina com um par de fórceps de alta precisão de ponto fino.
- Dissecar a traquéia livre primeiramente separando a extremidade proximal a nível do epiglote e então dissecando a extremidade longe do ponto de origem a nível da bifurcação da traquéia.
- Localize a epiglote e corte a traquéia longitudinalmente da epiglote para a Carina.
3. digestão epitelial traqueal
- Coloque a traqueia em um tubo de 1,5 mL contendo 750 μL de solução de digestão de Dispase pré-aquecido (a 37 ° c). Incubar em uma coqueteleira a 200 rpm por 40 min à temperatura ambiente. Cubra o tubo com folha de alumínio para reduzir a exposição à luz direta.
- Adicionar 750 μL de DMEM a frio com 5% de FBS para interromper a reacção. Coloque no gelo.
- Transfira a traqueia para uma placa de Petri (100 mm x 15 mm) e coloque-a um microscópio de dissecação. Oriente a traquéia com o lado epitelial virado para cima. A traqueia longitudinalmente dissecada tem uma forma semicilíndrica mantida pelos anéis cartilaginosos. O epitélio está na superfície côncava.
- Tether a área do epiglote da traquéia com o fórceps reto ao prato de Petri e usando um bisturi descartável do tamanho 22, raspe o epitélio fora da traqueia. A camada epitelial separa-se como uma folha translúcida.
- Mince o epitélio com o bisturi. Transfira a camada epitelial para um tubo de 2 mL.
- Enxague a placa de Petri com 750 μL de tampão Tyrode I e transfira para o tubo de 2 mL que contém a camada epitelial.
- Incubar a camada epitelial traqueal em tampão Tyrode I durante 30 min a 37 ° c em uma coqueteleira a 200 rpm. Cubra o tubo com folha de alumínio para reduzir a exposição à luz direta.
- Adicionar 750 μL de tampão Tyrode II a frio. Vórtice o tecido digerido vigorosamente para 20-30 s. triturar o homogeneato com uma seringa presa a uma agulha de 18 G 10 vezes. Mudar para uma agulha calibre 21 G e triturar mais 10-20 vezes.
- Filtre as células através de um filtro de 100 μm em um tubo cônico de 50 mL. Adicionar 30:1 Vol/Vol de buffer FACS frio.
- Girar em 350 x g por 10 min a 4 ° c e descartar o sobrenadante. Ressuscita o pellet em tampão FACS frio e transfere a suspensão para um tubo de poliestireno de 12 mm x 75 mm (5 mL). Gire novamente em 350 x g por 10 min a 4 ° c e descarte o sobrenadante.
- Resuspenda o pellet em 100 μL de tampão FACS.
- Adicionar 1 μL de anticorpo CD16/32 de bloqueio do rato para bloquear a ligação não específica e incubar durante 15 min no gelo. Não lave.
- Adicione os seguintes anticorpos e os respectivos controles de isotipo: Pacific Blue anti-mouse CD45 ou Rat IgG2a, k (0,25 μg/106 Cells in 100 μl volume) e aloficocianina (APC) anti-mouse epcam ou Rat IgG2b, k (0,5 μg/106 células em 100 μl de volume) anticorpos monoclonais. Incubar por 45 min no gelo protegido da luz direta. Adicionar 4,5 mL de tampão FACS frio, misturar e girar a 350 x g durante 10 min a 4 ° c. Descarte o tampão FACS e resuspenda o pellet em 300 μL de tampão FACS frio.
- Adicionar iodeto de propiídio (PI) (5 μg/mL) imediatamente antes da triagem citométrica do fluxo.
Nota: As células de pincel têm uma forma irregular com vários processos que podem potencialmente aumentar sua aderência aos filtros (Figura 3C). Comparamos os filtros de 30 mm a 70 mm e 100 mm e descobrimos que os maiores filtros de poros garantiram melhores rendimentos. Além, o trituration completo da suspensão da pilha após a digestão do papaína melhora significativamente os rendimentos da pilha da escova. Recomendamos a utilização de uma agulha de 18G para a trituração inicial seguida de um furo menor (agulha de 21 ou 23 G) para uma dissociação mais fina das células.
4. estratégia de gating do fluxo da citometria
- Identifique as células dos detritos por ângulo de dispersão de avanço e lado. Exclua os doublets usando a altura de dispersão para frente e largura e altura de dispersão lateral e largura. Os doublets seriam as células que têm valores de largura alta.
- Dentro das células individuais, identifique as células ao vivo como a população que é PI negativa.
- Dentro das células individuais ao vivo, identifique o CD45 baixo para células negativas com base no controle do isotipo.
- Dentro das CD45 células baixas/negativas, identifique as células EpCAM positivas que também são eGFP positivo (no canal FITC). Esta é a população de células de pincel (Figura 2a).
Resultados
Este procedimento foi implementado com sucesso para isolar as células da escova traqueal para sequenciamento de RNA3. Após isolamento da traquéia e digestão do tecido com protocolo de 2 etapas (Figura 1), as células foram coletadas e CORADAS com CD45 e epcam com rótulo fluorescently após exclusão das células mortas com PI. Após o gating para fora doublets baseado em características da dispersão da frente e do lado, nós definimos pilhas da escova como baixo/negativo para CD45, positivo para EpCAM e positivo para o eGFP (Figura 2A). As células da escova representaram ~ 0,16-0,42% das células CD45baixas/neg por citometria de fluxo e representavam 250-600 células por traquéia (Figura 2B). Nós comparamos estas contagens a uma estimativa do número de pilhas positivas do bate-papo-eGFP em montagens tracheal inteiras dos ratos do bate-papo(BAC)-EGFP baseados em nossa avaliação immunohistológica extensiva publicada de pilhas de escova tracheal3 e ilustrado aqui ( Figura 3). Nossos estudos precedentes de pilhas tracheal da escova no tipo selvagem, bate-papo(BAC)-ratos de EGFP e Il25F25/F25 camundongos sugeriram que as pilhas colinérgicos da escova são 90% que sobrepõem com DCLK1+ e Il25+ Cells e conta para 600-1000 células de pincel por traquéia3. Notavelmente, esse número é menor do que o número de células de pincel colinérgicos relatados por outros grupos10. Como os números de células quimiosensoriais são alterados pela exposição a metabólitos microbianos e protozoários5,14, esses números podem refletir uma variabilidade na microbiota interinstitucional. Conseqüentemente, nós sugeriríamos estimar o número de pilhas da escova pela microscopia de fluorescência para medir o número esperado de pilhas isoladas da escova pela classificação cytometric do do fluxo.
Ao estabelecer nosso protocolo, foram tentados vários métodos previamente publicados de isolamento de células quimiosensoriais (Figura 4). Quando incubadas traquéia picada com 650 u/ml de colagenase IV e 1,84 u/ml Dispase suplementado com DNase I para 45 min, uma combinação freqüentemente usada para obter suspensões de células únicas de homogeneatos pulmonares15, conseguimos uma única suspensão de células células epiteliais, mas recuperamos apenas poucas células de pincel (Figura 4A). As células do tufo no intestino foram isoladas com sucesso usando 2,5 mM EDTA e 0,75 mM Dithiothreitol (DTT) com DNase I por 20 min para desalojar as células epiteliais seguidas de digestão das células epiteliais liberadas com 0, 1 U/mL Dispase com DNaseI por 10 min 6. em nossas mãos, usar este procedimento igualmente conduziu à recuperação tracheal suboptimal da pilha da escova (Figura 4B). Um protocolo para a isolação bem sucedida de pilhas tracheal da escova para a análise do RNA foi descrito por Krasteva et al.10. Seguindo este protocolo, nós incubadas a traquéia picada com o papaína de 35 U/ml no amortecedor de Tyrode por 45 minutos e não alcanguei a boa recuperação da pilha da escova (Figura 4C). Rock et al. descreveram um método de digestão do epitélio traqueal para isolamento de células basais com duas etapas: separação do epitélio da camada mesenquimais com Dispase de dose elevada (16 U/mL) à temperatura ambiente seguida de incubação do epitélio descascado com 0,1% de tripsina e 1,6 mM de EDTA por 30 min a 37 ° c16. Seguindo estas etapas conduziu a uma recuperação melhor de pilhas da escova, mas os números conseguidos por o rato eram insuficientes para em análises funcionais da profundidade (Figura 4D). Para otimizar o protocolo, decidimos combinar as duas últimas abordagens. Separando o epitélio tracheal com Dispase elevado da dose, nós visamos permitir o melhor acesso do papaína às pilhas tracheal da escova. Assim, usando 16 U/mL de Dispase à temperatura ambiente na traquéia inteira para separar o epitélio e posterior incubação do epitélio com 26 U/mL de papaína no tampão de Tyrode conduziu à melhor recuperação da pilha da escova (Figura 4e).

Figura 1 : Esquema de etapas propor para a isolação de pilhas tracheal da escova. O protocolo inclui 2 etapas principais: após a dissecção, a traquéia inteira é incubada em uma solução da Dispase da elevado-dose para separar o epitélio; Isto é seguido pela digestão da folha epithelial com o papaína no cálcio que contem o amortecedor de Tyrode (Tyrode I) e a mancha do anticorpo. Por favor clique aqui para ver uma versão maior desta figura.

Figura 2 : Análise citométrica de fluxo representativo de células da escova traqueal. (A). representação esquemática da estratégia de gating de citometria de fluxo. As únicas pilhas foram gated baseadas em suas características da dispersão da frente e do lado e as pilhas vivos foram escolhidas baseadas na exclusão do iodeto de propidium. CD45 células baixas/negativas foram escolhidas com base no controle do isotipo e avaliadas quanto à sua expressão de EpCAM. As pilhas positivas de EpCAM foram consideradas pilhas da escova se expressaram o eGFP fluorescente no canal de FITC. (B). número de células colinérgicas da escova traqueal por traquéia do rato e frequência apresentada como por cento de todas as CD45baixas/ células e como um percentual de CD45baixa/-epcam+ células. Cada ponto representa um mouse separado. Os dados são de 3 experimentos separados com 2-3 camundongos cada. (C). ausência de células de escova positivas do EGFP em um sumário epithelial tracheal de um rato selvagem do tipo manchado para CD45 e epcam. Por favor clique aqui para ver uma versão maior desta figura.
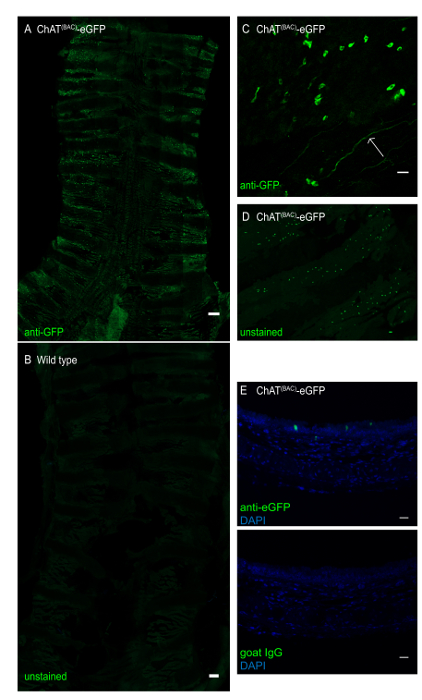
Figura 3 : Montagem inteira da traquéia do mouse de um bate-papo(BAC)-mouse EGFP. A traquéia foi aberta longitudinalmente e corada com anticorpo anti-GFP para melhorar o sinal de fluorescência verde do eGFP. (A) montagem traqueal inteira de bate-papo(BAC)-rato EGFP, células fluorescentes intensamente verdes representam células de pincel; barra de escala 1 mm; (B) montagem traqueal inteira de um rato tipo selvagem demonstrando ausência de células de pincel; Barra de escala = 1 mm; (C) ampliação da camada epitelial demonstrando células de pincel irregularmente moldadas (células verdes) como poços como um nervo colinérgico terminando (seta); (D) montagem traqueal inteira de uma traquéia de um bate-papo(BAC)-EGFP imaged para GFP sem anticorpo-realce do sinal da fluorescência; (E) secção transversal de uma traquéia de rato embebido em parafina de um rato de ChAT(BAC)-EGFP manchado com anti-GFP (verde) ou controlo de IgG de cabra e DAPI (azul); Barras de escala = 20 μm (C-E). Por favor clique aqui para ver uma versão maior desta figura.

Figura 4 : Comparação de diferentes protocolos de digestão traqueal. (A) a traquéia foi picada e incubada com 650 u/ml de colagenase IV e 1,84 u/ml Dispase suplementada com DNase I por 45 min. Este experimento foi repetido 2 vezes. (B) toda a traquéia foi incubada com 2,5 mm de EDTA e 0,75 mm DTT suplementado com DNase I por 20 min; as células epiteliais foram desalojadas e ainda digeridas com 0, 1 U/mL Dispase e DNase I durante 10 min. Este experimento foi repetido 2 vezes. (C) a traquéia foi picada e incubada com 35 U/ml de papaína em tampão de Tyrode I por 45 min; a atividade residual do papaína foi inibida com leupeptina. Este experimento foi realizado uma vez. (D) toda a traquéia foi incubada com Dispase de dose elevada (16 U/ml) por 30 min para separar a folha epitelial, seguida de incubação da folha epitelial com tripsina 0,1% e EDTA de 1,6 mm por 30 min. Este experimento foi repetido 2 vezes. (E). toda a traquéia foi incubada com Dispase de dose elevada (16 u/ml) por 30 min seguida de digestão da folha epitelial com 26 u/ml de papaína em tampão de Tyrode por 30 min. A atividade de papaína residual foi inibida com leupeptina e alta diluição do volume. Por favor clique aqui para ver uma versão maior desta figura.
Discussão
Nós encontramos que uma combinação de tratamento do Dispase da elevado-dose para o minuto 40 seguido por um tratamento curto do papaína (30 minutos) fornece um protocolo óptimo para a digestão tracheal e a isolação da pilha da escova. Esta combinação evita a digestão extensiva e produz o rendimento o mais elevado de pilhas da escova, comparado aos protocolos alternativos.
Enquanto a digestão pulmonar para extrair células hematopoiéticas classicamente se baseou em enzimas digestivas leves como a colagenase IV15, o isolamento das células epiteliais requer protocolos mais complexos. As suspensões da única pilha de pilhas epithelial são mais difíceis de conseguir por causa das junções apertadas e dos aderens que ligam os a se e a membrana do porão e por causa da fragilidade das pilhas elas mesmas. A maioria de protocolos para a digestão epithelial da pilha envolvem duas etapas-um primeiro passo é a separação do epitélio da membrana do porão seguida por etapas subseqüentes para perturbar as junções e os desmossomos apertados que aderem as pilhas epithelial a se 16 anos de , a 17.
Vários grupos têm isolado com sucesso células de tufo quimiosensorial do intestino usando diferentes modificações de um protocolo de 2 etapas para isolamento de células epiteliais: o primeiro passo usa EDTA e DTT para liberar células epiteliais da submucosa seguida por digestão das folhas epiteliais com Dispase. Howitt et al. utilizaram uma mistura de EDTA de 5 mM + 1 mM DTT seguida de digestão com 0,5 unidades/mL Dispase II e DNase14. Gerbe et al. utilizou a concentração elevada de 30 mM de EDTA isoladamente para separar a fração epitelial e posteriormente incubada com Dispase suplementada com DNaseI18. Von Moltke et al. utilizaram 2,5 mM de EDTA, 0,75 mM DTT e DNaseI seguidos por digestão Dispase6. Nós encontramos que estas técnicas permitem a isolação de pilhas epithelial viáveis na traqueia mas a porcentagem de pilhas tracheal da escova era extremamente baixa (Figura 4B) e nao consistente com nossa expectativa do isolamento de 600-800 pilhas da escova por traquéia com base na nossa avaliação histológica.
Os protocolos de isolação epithelial da pilha tracheal foram desenvolvidos por diversos grupos para estudar pilhas epithelial básicas. As principais diferenças entre esses protocolos e as empregadas no intestino estão na sequência de enzimas digestivas. O primeiro passo é a separação do epitélio traqueal através da incubação com alta concentração de Dispase (16 U/mL) à temperatura ambiente16. Isto permite que o epitélio separe como uma única folha da camada mesenquimais19. O processamento subseqüente do epitélio tracheal usa uma combinação de tripsina e de EDTA, um dos métodos enzimáticos os mais freqüentemente usados do destacamento da pilha, para conseguir uma única suspensão da pilha. Trypsin Cleaves peptídeos no lado C-terminal de resíduos de aminoácidos de lisina e arginina, enquanto o EDTA é usado como um quelante de cálcio para interações célula-célula e matriz celular20. Usando essa técnica, rock et al. têm sido bem-sucedidos na recuperação de células epiteliais básicas para o perfilamento transcricional16. Um protocolo similar foi usado recentemente para isolar o receptor amargo do gosto que expressa pilhas de um repórter Tas2r143-CreERT2 conduzido de EGFP e de B6. Il25Flare25/Flare25 para estudos de sequenciamento de RNA5,8. Em nossa experiência, a digestão da folha epithelial com tripsina e o EDTA conduziram à recuperação epithelial excelente da pilha mas aos números insuficientes de pilhas tracheal colinérgicos da escova para a análise funcional ou transcricional a menos que os ratos múltiplos estiveram agrupados para cada amostra (Figura 4C).
Papaína é uma potente planta endolítica de cisteína protease derivada de látex de mamão, e é conhecido por Cleave ligações peptídicas envolvendo aminoácidos básicos, particularmente arginina, lisina e resíduos após fenilalanina21. A isolação tracheal da pilha da escova usando o papaína dos ratos do bate-papo(BAC)-EGFP foi relatada primeiramente por Krasteva e outros10. A digestão do Papain foi usada igualmente recentemente para dissociar pilhas epithelial da via aérea para o seqüenciamento do RNA da única pilha onde as pilhas da escova/Tuft compreenderam uma fração pequena de pilhas epithelial11. Papaína é também a enzima mais comumente utilizada para a digestão do tecido cerebral para isolamento de neurônios viáveis22. A dissociação do tecido cerebral com papaína por 30 min resulta em rendimentos marcadamente mais elevados, sobrevivência neuronal e integridade em comparação com a digestão de tripsina23. Desde que algumas pilhas da escova são entrelaçadas firmemente com terminações nervosas3,10, o uso do papaína pôde ser crítico para o clivagem bem sucedido de junções da pilha da escova aos neurônios. Entretanto, nós encontramos que uma digestão 45 min com papaína em uma concentração de 35-40 U/ml reduziu dramàtica a viabilidade epithelial da pilha, conduzindo à baixa recuperação da pilha da escova (Figura 4D).
Nós usamos 3 métodos para reduzir a toxicidade do papaína e para aumentar nossos rendimentos celulares. Primeiramente, separando a folha epithelial com Dispase, nós reduzimos o tempo subseqüente da incubação do papaína de 45 a 30 minutos. Em segundo lugar, inibirmos imediatamente a atividade da papaína com leupeptina, um inibidor da cisteína proteases24. Notavelmente, a leupeptina é altamente instável a 4 ° c e deve ser alicitada e congelada a-20 ° c. Em terceiro lugar, descobrimos que a diluição do tecido digerido enzimaticamente em um grande volume de PBS frio também ajuda a preservar a viabilidade das células digeridas. Outro passo que é crítico para aumentar o rendimento celular é a trituração rigorosa10. Desde que o vortexing prolongado poderia igualmente diminuir a viabilidade, nós substituiu-o parcialmente com o trituration. Nós recomendamos a trituração com uma agulha 18G para dissociar os aglomerados celulares maiores seguidos pelo trituration adicional com uma agulha de 21 G. Finalmente, descobrimos que o eGFP é altamente sensível à luz e a proteção contra a exposição direta à luz em qualquer etapa é útil. Essas modificações permitiram a recuperação robusta de células da escova traqueal viáveis (Figura 4E).
As principais limitações do protocolo proposto aqui são o procedimento de 2 etapas e o uso de papaína, uma potente protease de cisteína. Alguns grupos substituíram recentemente liberase para Dispase5 ao isolar pilhas quimiossensorial. Além disso, a digestão liberase foi usada recentemente para isolar células epiteliais quimiosensoriais (pincel) de pólipos nasais25,26. Nós não comparamos diretamente a digestão do liberase a nosso protocolo da digestão do Dispase/Papain de duas etapas. A papaína é uma potente protease de cisteína que pode ativar o receptor de protease ativado PAR2 em células epiteliais27 levando à ativação de células de pincel propriamente ditas ou à geração de mediadores por outras células respiratórias que poderiam por sua vez ativar o células de pincel. Por fim, a papaína pode modular a expressão do receptor através da clivagem dos receptores de superfície, dificultando a validação da expressão do receptor de células de pincel por citometria de fluxo28,29.
Em resumo, fornecemos um protocolo de isolamento de células de pincel colinérgicos traqueais de ratos de repórter de ChAT-eGFP que permite a recuperação robusta de células da escova traqueal viáveis. Este protocolo foi usado com sucesso para a isolação e a análise transcricional de pilhas da escova pelo sequenciamento do RNA3.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Agradecemos a Adam Chicoine no núcleo de fluxo do centro de Imunologia humana da Brigham e da mulher por sua ajuda com a triagem citométrica de fluxo. Este trabalho foi apoiado pelos institutos nacionais de bolsas de saúde R01 HL120952 (N.A.B.), R01 AI134989 (N. A. B), U19 AI095219 (N.A.B., L. G. B), e K08 AI132723 (L. G. B), e pela Academia Americana de alergia, asma e Imunologia (AAAAI)/pulmão americano alérgico Prêmio de doença respiratória (N.A.B.), pelo prêmio de desenvolvimento de professores da Fundação AAAAI (L.G.B.), pelo prêmio Steven e Judy Kaye Young Innovators (N.A.B.), pelo JoYcElYn C. Austen Fund for desenvolvimento de carreira de cientistas de médicos de mulheres (L.G.B.), e por um doação generosa pela família Vinik (L.G.B.).
Materiais
| Name | Company | Catalog Number | Comments |
| Antibodies | |||
| Anti-GFP (Polyclonal goat Ig) | Abcam | cat# ab5450 | |
| APC anti-mouse CD326 (EpCAM) (G8.8) | Biolegend | cat#118214 | |
| APC Rat IgG2a, k isotype control | Biolegend | cat#400511 | |
| DAPI | Biolegend | cat#422801 | |
| Donkey anti-goat IgG (H+L) Highly Cross-Adsorbed Secondary Antibody, Alexa Fluor 488 | Life Technologies/Molecular Probes | cat#A-11055 | |
| Normal Goat IgG | R&D Systems | cat#AB-108-C | |
| Pacific Blue anti-mouse CD45 (30F-11) | Biolegend | cat#103126 | |
| Pacific Blue Rat IgG2b, k isotype control | Biolegend | cat#400627 | |
| TruStain FcX (anti-mouse CD16/32) Antibody | Biolegend | cat#101320 | |
| Chemicals, Peptides, and Recombinant Proteins | |||
| Dispase | Gibco | cat# 17105041 | |
| DNase I | Sigma | cat# 10104159001 | |
| HEPES-Tyrode’s Buffer Without Calcium (10 mM HEPES, 135 mM NaCl, 2.8 mM KCl, 1 mM MgCl2, 12 mM NaHCO3, 0.4 mM NaH2PO4, 0.25% BSA, 5.5 mM Glucose. Prepared in 18.2 megohms water and filtered through 0.22 µm filter | Boston BioProducts | cat# PY-912 | |
| Tyrode’s Solution (HEPES-Buffered) 140 mM NaCl, 5 mM KCl, 25 mM HEPES, 2 mM CaCl2, 2 mM MgCl2 and 10 mM glucose. Prepared in 18.2 megohms water and filtered through 0.22 µm filter. ) | Boston BioProducts | cat# BSS-355 | |
| L-Cysteine | Sigma | cat# C7352 | |
| Leupeptin trifluoroacetate salt | Sigma | cat# L2023 | |
| Papain from papaya latex | Sigma | cat# P3125 | |
| Propidium iodide | Sigma | cat# P4170 | |
| Experimental Models: Organisms/Strains | |||
| ChATBAC-eGFP (B6.Cg-Tg(RP23-268L19-EGFP)2Mik/J) | The Jackson Laboratory | 7902 | |
| Equipment | |||
| LSM 800 with Airyscan confocal system on a Zeiss Axio Observer Z1 Inverted Microscope | Zeiss | ||
| LSRFortessa | BD | 647465 | |
| Disposable equipment | |||
| 1.5 mL sterile tubes | Thomas Scientific | 1157C86 | |
| 5 mL Poysterene Round-bottom Tube, 12 mm x 75 mm style | Falcon | 14-959-1A | |
| 50 mL Polypropylene conical tube, 30 mm x 115 mm style | Falcon | 352098 | |
| Feather Disposable Scalpel no.12 | Fisher Scientific | NC9999403 | |
| Petri dish, 100 mm x 15 mm Style | Falcon | 351029 | |
| Sterile cell strainer, 100 μm | Fisherbrand | cat#22363549 |
Referências
- Tizzano, M., et al. Nasal chemosensory cells use bitter taste signaling to detect irritants and bacterial signals. Proceedings of the National Academy of Sciences of the United States of America. 107 (7), 3210-3215 (2010).
- Genovese, F., Tizzano, M. Microvillous cells in the olfactory epithelium express elements of the solitary chemosensory cell transduction signaling cascade. PLoS One. 13 (9), 0202754(2018).
- Bankova, L. G., et al. The cysteinyl leukotriene 3 receptor regulates expansion of IL-25-producing airway brush cells leading to type 2 inflammation. Science Immunology. 3 (28), (2018).
- Krasteva, G., Canning, B. J., Papadakis, T., Kummer, W. Cholinergic brush cells in the trachea mediate respiratory responses to quorum sensing molecules. Life Sciences. 91 (21-22), 992-996 (2012).
- Nadjsombati, M. S., et al. Detection of Succinate by Intestinal Tuft Cells Triggers a Type 2 Innate Immune Circuit. Immunity. 49 (1), 33-41 (2018).
- von Moltke, J., Ji, M., Liang, H. E., Locksley, R. M. Tuft-cell-derived IL-25 regulates an intestinal ILC2-epithelial response circuit. Nature. 529 (7585), 221-225 (2016).
- Deckmann, K., et al. Bitter triggers acetylcholine release from polymodal urethral chemosensory cells and bladder reflexes. Proceedings of the National Academy of Sciences of the United States of America. 111 (22), 8287-8292 (2014).
- Liu, S., et al. Members of Bitter Taste Receptor Cluster Tas2r143/Tas2r135/Tas2r126 Are Expressed in the Epithelium of Murine Airways and Other Non-gustatory Tissues. Frontiers in Physiology. 8, 849(2017).
- Krasteva, G., et al. Cholinergic chemosensory cells in the auditory tube. Histochemistry and Cell Biology. 137 (4), 483-497 (2012).
- Krasteva, G., et al. Cholinergic chemosensory cells in the trachea regulate breathing. Proceedings of the National Academy of Sciences of the United States of America. 108 (23), 9478-9483 (2011).
- Montoro, D. T., et al. A revised airway epithelial hierarchy includes CFTR-expressing ionocytes. Nature. 560 (7718), 319-324 (2018).
- Plasschaert, L. W., et al. A single-cell atlas of the airway epithelium reveals the CFTR-rich pulmonary ionocyte. Nature. 560 (7718), 377-381 (2018).
- Dwyer, D. F., Barrett, N. A., Austen, K. F. Immunological Genome Project, C. Expression profiling of constitutive mast cells reveals a unique identity within the immune system. Nature Immunology. 17 (7), 878-887 (2016).
- Howitt, M. R., et al. Tuft cells, taste-chemosensory cells, orchestrate parasite type 2 immunity in the gut. Science. 351 (6279), 1329-1333 (2016).
- Bankova, L. G., Dwyer, D. F., Liu, A. Y., Austen, K. F., Gurish, M. F. Maturation of mast cell progenitors to mucosal mast cells during allergic pulmonary inflammation in mice. Mucosal Immunology. 8 (3), 596-606 (2015).
- Rock, J. R., et al. Basal cells as stem cells of the mouse trachea and human airway epithelium. Proceedings of the National Academy of Sciences of the United States of America. 106 (31), 12771-12775 (2009).
- Rock, J. R., et al. Multiple stromal populations contribute to pulmonary fibrosis without evidence for epithelial to mesenchymal transition. Proceedings of the National Academy of Sciences of the United States of America. 108 (52), 1475-1483 (2011).
- Gerbe, F., et al. Intestinal epithelial tuft cells initiate type 2 mucosal immunity to helminth parasites. Nature. 529 (7585), 226-230 (2016).
- Rock, J. R., et al. Transmembrane protein 16A (TMEM16A) is a Ca2+-regulated Cl- secretory channel in mouse airways. Journal of Biological Chemistry. 284 (22), 14875-14880 (2009).
- Olsen, J. V., Ong, S. E., Mann, M. Trypsin cleaves exclusively C-terminal to arginine and lysine residues. Molecular and Cellular Proteomics. 3 (6), 608-614 (2004).
- Verma, S., Dixit, R., Pandey, K. C. Cysteine Proteases: Modes of Activation and Future Prospects as Pharmacological Targets. Frontiers in Pharmacology. 7, 107(2016).
- Huettner, J. E., Baughman, R. W. Primary culture of identified neurons from the visual cortex of postnatal rats. Journal of Neuroscience. 6 (10), 3044-3060 (1986).
- Kaiser, O., et al. Dissociated neurons and glial cells derived from rat inferior colliculi after digestion with papain. PLoS One. 8 (12), 80490(2013).
- Aoyagi, T., Takeuchi, T., Matsuzaki, A., Kawamura, K., Kondo, S. Leupeptins, new protease inhibitors from Actinomycetes. Journal of Antibiotics (Tokyo). 22 (6), 283-286 (1969).
- Kohanski, M. A., et al. Solitary chemosensory cells are a primary epithelial source of IL-25 in patients with chronic rhinosinusitis with nasal polyps. The Journal of Allergy and Clinical Immunology. 142 (2), 460-469 (2018).
- Patel, N. N., et al. Solitary chemosensory cells producing interleukin-25 and group-2 innate lymphoid cells are enriched in chronic rhinosinusitis with nasal polyps. International Forum of Allergy & Rhinology. , (2018).
- Kouzaki, H., O'Grady, S. M., Lawrence, C. B., Kita, H. Proteases induce production of thymic stromal lymphopoietin by airway epithelial cells through protease-activated receptor-2. The Journal of Immunology. 183 (2), 1427-1434 (2009).
- Cambier, J. C., Vitetta, E. S., Kettman, J. R., Wetzel, G. M., Uhr, J. W. B-cell tolerance. III. Effect of papain-mediated cleavage of cell surface IgD on tolerance susceptibility of murine B cells. The Journal of Experimental Medicine. 146 (1), 107-117 (1977).
- Nishikado, H., et al. Cysteine protease antigens cleave CD123, the alpha subunit of murine IL-3 receptor, on basophils and suppress IL-3-mediated basophil expansion. Biochemical and Biophysical Research Communications. 460 (2), 261-266 (2015).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados