Method Article
マウス気管からのブラシ細胞の単離と定量的評価
要約
ブラシ細胞は、ナイーブマウス気管に見られる稀なコリン作動性化学感覚上皮細胞である。その限られた数のために、気道免疫および改造におけるその機能的役割のex vivo評価は困難である。フローサイトメトリーによる気管ブラシ細胞の単離方法について述べた。
要約
気管ブラシ細胞は、気道内腔から免疫系および神経系に信号を伝達する準備ができているコリン作動性化学感覚上皮細胞である。それらは、腸粘膜のタフト細胞、気管のブラシ細胞、鼻粘膜の孤独な化学感覚および微小絨毛細胞を含む化学感覚上皮細胞のファミリーの一部である。異なる上皮区画の化学感覚細胞は、主要な細胞内マーカーとコア転写部特質を共有するが、局所組織環境を反映する可能性が高い重要な転写不均一性も示す。単一細胞懸濁液からの気管ブラシ細胞の単離は、これらのまれな上皮細胞の機能を詳細に定義する必要があるが、それらの分離は、気管ブラシ細胞と神経終末との間の密接な相互作用のために、潜在的に困難である。またはタイトで接着接点の気道固有の組成物に起因する。ここでは、マウス気管上皮からブラシ細胞を単離する手順について説明する。この方法は、管下上皮の初期分離に基づいており、パパインを用いて上皮シートのその後の短いインキュベーションを可能にする。この手順は、生存可能な気管ブラシ細胞のフローサイトメトリックソートおよび機能解析のための迅速かつ便利なソリューションを提供します。
概要
ブラシ細胞は、苦味受容体および味覚芽細胞に見られる味覚受容体伝達機構の発現を特徴とする化学感覚上皮細胞のクラスに属する。味覚芽細胞とは異なり、化学感覚上皮細胞は上皮表面に散乱し、鼻上皮1、2、気管内のブラシ細胞中の孤独な化学感覚細胞(SCC)および微小絨毛細胞と呼ばれる。腸内の3、4、およびタフト細胞5、6.苦味受容体および苦味伝達機構を発現する上皮細胞は、尿道7、8および聴覚管9にも見出される。気道ブラシ細胞は、神経原性および免疫気道応答にユニークな機能を有する。彼らは、苦い化合物とクォーラム感知物質のような細菌代謝物で活性化時に保護呼吸反射を呼び起こすアセチルコリン産生化学感覚細胞です 10.気道ブラシ細胞はまた、気道3のエアロアレルゲン引き出された2型炎症を調節するIL-25の支配的な気道上皮源である。
下部気道ブラシ細胞の完全な転写物の特徴付けおよび環境刺激への応答は、気管上皮の低い数および大きな気管支10を超える非常に限られた数によって制限されている。腸上皮からの化学感覚細胞の単離に使用される技術は、おそらく神経終末10または他の気管ブラシ細胞の親密な接触のために、気管から比例して高い数を得ていない付着物およびタイトジャンクションタンパク質の組成のような呼吸粘膜における組織特異的因子。単一細胞RNAシーケンシング分析のためのより高い数で気管ブラシ細胞の分離に成功した最近の報告は、パパインとの2時間インキュベーションまたはプロナス11、12との18時間インキュベーションのいずれかを採用した。消化酵素を用いたより長いインキュベーションは細胞の生存率を低下させ、消化された組織13からの細胞の転写プロファイルを変化させることができるので、これは他の化学感覚上皮集団との比較分析に偏りを与える可能性がある。
ここでは、RNAシーケンシング3に対する気管ブラシ細胞の単離方法を報告する。高用量ジスパーゼによる気管の治療は、上皮を粘膜下から分離する。パパインとの上皮シートのその後の消化は、この構造細胞の優れた回復を可能にする。
プロトコル
以下の実験を行う前に、すべての動物ケアの使用とプロトコルが機関動物ケアおよび使用委員会(IACUC)によって承認され、国家研究評議会の「ケアと使用に関するガイド」に従って実施されることを確認してください。実験動物」( 第8版、2011年)とARRIVEガイドライン。以下に説明するすべての手順は、ブリガム・アンド・ウィメンズ病院の施設動物ケア・使用委員会によって審査され、承認されています。
1. 試薬の調製
- 16 Μ/mLディスパーゼと20 μg/mL DNase I.を含むPBS溶液であるジスパーゼ消化液を調べ、37°Cの水浴で溶液を温める前に、ディスパーゼ粉末が完全に溶解していることを確認してください。
- 5%熱不活性化胎児ウシ血清(FBS)をダルベッコ改変イーグルミディアム(DMEM)に加えて停止液を作ります。
- タイロードIバッファーを準備する:カルシウムなしでHEPES-Tyrodeのバッファーに26 U/mLパパイン(48 U/mgパパイン溶液の20 μL/mL)と10 μL/mL L-システインを追加します。
- タイロードIIバッファーを準備する:カルシウムを含むHEPES-Tyrodeのバッファーに2 μL/mLルペプチン(5mg/mL)を追加します。
- FACSバッファーを準備する:カルシウム、マグネシウム&フェノールレッドを含まないハンクスのバランス塩溶液(HBSS)を使用し、2mMエチレンディアミンテトラセチン酸(EDTA)を補充し、2%FBSを追加します。
2. マウス気管の解剖
注:このプロトコルで使用されるマウスは、ChAT(BAC)-eGFP(B6)である。Cg-Tg(RP23- 268L19-EGFP)2Mik/J、男女ともに生後3~6ヶ月。eGFPの光漂白を減らすために直接光への組織の露出を最小にする。
- 100 mg/kg のペントバルビタール安楽死溶液を経内に注入するか、IACUC によって承認された標準プロトコルを使用してマウスを安楽死させます。
- 上下の四肢を拡張した21G針で、外科用ボード上のマウスを固定します。70%のEtOHで毛皮をスプレーし、地域を消毒します。
- まっすぐな鉗子を使用して、腹部の皮膚と毛皮を持ち上げ、解剖はさみで中央に切開を行います(まっすぐなはさみ、3センチメートル)。はさみを使用して、皮下組織から腹部からマンディブラに皮膚を分離する。皮下組織を鉗子で持ち上げながら、腹壁の中央にはさみで小さな切開を行う。
- V字型切開で下膜を開きます。鉗子を使用して、小腸を横にそっと動かし、腹部大動脈と静脈カバを見つけ、解剖はさみで切開を行い、急速な排泄を可能にする。
- ダイヤフラムを見つけます。18Gの針を使用して、肺を脱脂するために胸骨のすぐ下の横隔膜に開口部を作る。鋭い尖ったまっすぐな解剖はさみを使用して肋骨のケージから慎重にダイヤフラムを分離し、リブの基部に沿って切断します。
- 鉗子を使用して、胸骨の露出した端を持ち上げ、胸骨を肋骨ケージの基部から首まで縦方向に切ります。短いまっすぐなはさみ(2 cm)で中央頸部切開を行い、顎下腺の2つの葉を分離する。
- 周囲の結合組織と胸腺を慎重に取り除き、高精度鉗子のペアでカリーナを覆います。
- 気管を最初に喉頭蓋のレベルで分離し、次に気管の分岐のレベルで遠位端を解剖することによって、気管を自由に解剖する。
- 喉頭蓋を見つけ、気管を喉頭蓋からカリーナまで縦方向に切る。
3. 気管上皮消化
- 気管を予温めた750 μL(37°C)の消化液を含む1.5mLチューブに入れます。200rpmでシェーカーで40分間、室温でインキュベートします。直接光への露出を減らすためにアルミ箔でチューブをカバーします。
- 反応を止めるために5%FBSで750 μLの冷たいDMEMを加えます。氷の上に置け
- 気管をペトリ皿(100mm x 15mm)に移し、解剖顕微鏡の下に置きます。上皮側を上向きにして気管の向きをします。縦方向に解剖された気管は、軟骨リングによって維持される半円筒形を有する。上皮は凹面にある。
- ペトリ皿にまっすぐな鉗子と気管の喉頭蓋領域をテザーし、サイズ22使い捨てメスを使用して、気管から上皮を掻き取る。上皮層は半透明シートとして分離する。
- メスで上皮をミンチします。上皮層を2mLチューブに移します。
- 750 μLのタイロデIバッファーでペトリ皿をすすいで、上皮層を含む2mLチューブに移します。
- タイロードIの気管上皮層を200rpmでシェーカーで37°Cで30分間緩衝する。直接光への露出を減らすためにアルミ箔でチューブをカバーします。
- コールドタイロデIIバッファの750 μLを追加します。消化された組織を20~30秒間激しく渦にし、18G針に10回取り付けた注射器で同質をトリビュートする。 21 Gゲージ針に切り替え、さらに10~20回トリビュートします。
- 100 μm のストレーナーを通して 50 mL 円錐管にセルをろ過します。コールド FACS バッファーの 30:1 vol/vol を追加します。
- 350 x gで4°Cで10分間スピンし、上清を廃棄します。冷たいFACSバッファーでペレットを再懸濁し、12 mm x 75 mm (5 mL) ポリスチレンチューブにサスペンションを移します。4°Cで10分間350 x gで再び回転し、上清を廃棄します。
- FACSバッファーの100 μLでペレットを再中断します。
- 抗マウスCD16/32ブロッキング抗体を1μL添加して非特異的結合を遮断し、氷上で15分間インキュベートします。洗わなく。
- 次の抗体とそれぞれのアイソタイプコントロールを追加: 太平洋青色の抗マウス CD45 またはラット IgG2a, k (0.25 μg/106細胞 100 μL 容積) とアロフィコシアニン (APC) 抗マウス EpCAM またはラット IgG2b, k (0.5 μg/106細胞 100 μL ボリューム)モノクローナル抗体。直接光から保護された氷の上で45分間インキュベートします。冷たいFACSバッファーの4.5 mLを追加し、4°Cで10分間350 x gで混合し、スピンします。FACSバッファを破棄し、低温FACSバッファの300 μLでペレットを再中断します。
- フローサイトメトリックソートの直前にヨウ化プロピジウム(PI)(5 μg/mL)を加えます。
注:ブラシセルは、フィルタへの付着性を高める可能性のあるいくつかのプロセスを持つ不規則な形状を持っています (図 3C)。私たちは、30ミリメートル70ミリメートルと100ミリメートルフィルタを比較し、より大きな細孔フィルタは、より良い収率を確保することを発見しました。また、パパイン消化後の細胞懸濁液の完全なトリチュレーションは、ブラシ細胞収率を有意に向上させる。初期トリチュレーションには18G針を使用し、その後、細胞の細かい解離のために小さなボア(21または23Gの針)を使用することをお勧めします。
4. フローサイトメトリーゲーティング戦略
- 前方および側面散乱角度によって破片から細胞を識別します。前方散布の高さと幅、側面散布の高さと幅を使用して、二重線を除外します。doublet は、幅の高い値を持つセルです。
- 単一のセル内で、PI 陰性の母集団として生細胞を識別します。
- 生きている単一細胞内で、アイソタイプコントロールに基づいて低から負の細胞にCD45を同定する。
- CD45の低/負の細胞内で、eGFP陽性であるEpCAM陽性細胞を同定する(FITCチャネル内)。これはブラシセルの集団です(図2A)。
結果
この手順は、RNA シーケンシング3の気管ブラシ 細胞を分離するために正常に実装されています。2段階プロトコル(図1)で気管を単離し、組織を消化した後、細胞を収集し、PIで死んだ細胞を排除した後に蛍光標識CD45およびEpCAMで染色した。前方および側面散乱特性に基づいて二重化を行った後、ブラシセルをCD45の場合は低/負、EpCAMでは正、eGFPでは陽性(図2A)と定義した。ブラシ細胞は、流量細胞メトリーによりCD45低/ネグ細胞の約0.16〜0.42%を表し、気管当たり250〜600細胞を占めた(図2B)。これらのカウントを、ChAT(BAC)-eGFPマウスからの気管マウント全体におけるChAT-eGFP陽性細胞数の推定値と比較し、我々が公表した気管ブラシ細胞3の広範な免疫組織学的評価に基づいて、ここに示した(図3)野生型の気管ブラシ細胞、ChAT(BAC)-eGFPマウスおよびIl25F25/F25マウスの以前の研究は、コリン作動性ブラシ細胞がDCLK1+およびIL25+細胞およびアカウントと90%重複していることを示唆した。 気管3あたり600-1000ブラシ細胞用。特に、この数は、他の群10によって報告されたコリン作動性ブラシ細胞の数よりも低い。化学感覚細胞数は、微生物代謝産物および原生動物5、14への曝露によって変化するにつれて、これらの数値は、組織間微生物叢における変動性を反映する可能性がある。そこで、蛍光顕微鏡でブラシ細胞の数を推定し、フローサイトメトリックソートにより、単離されたブラシ細胞の予想数を測定することを提案する。
我々のプロトコルを確立しながら、我々は化学感覚細胞の単離のいくつかの以前に公開された方法を試みた(図4)。650 U/mLコラゲナーゼIVと1.84 U/mLディスパーゼをDNase Iで45分間インキュベートした場合、肺均質化体15から単一細胞懸濁液を得るために頻繁に使用される組み合わせにより、単細胞懸濁液を達成しました。上皮細胞は、少数のブラシ細胞しか回収したが(図4A)。腸内のタフト細胞は、2.5mM EDTAと0.75 mMジチオスレイトール(DTT)をDNase Iで20分間単離し、続いて0.01 U/mLジパセをDNaseで放出した上皮細胞を消化することに成功した。6.我々の手の中で、この手順を使用すると、最適でない気管ブラシ細胞の回復にもつながりました(図4B)。RNA分析のための気管ブラシ細胞の正常な単離のためのプロトコルは、Krastevaら10によって説明された。このプロトコルに続いて、チロデバッファで35U/mLパパインで細分化した気管を45分間インキュベートし、良好なブラシ細胞回収を達成しなかった(図4C)。Rock et al. は、基底細胞単離に対する気管上皮の消化方法を2つのステップで説明した:高用量ジスパーゼ(16U/mL)を室温で上皮層から分離し、続いて剥離された上皮のインキュベーションを行う。0.1% トリプシンと 1.6 mM EDTA 37 °C16で 30 分 .これらの手順に従ってブラシ細胞の回復が改善されましたが、マウスあたりの達成数は多層機能解析では不十分でした(図4D)。プロトコルを最適化するために、最後の 2 つのアプローチを組み合わせることにしました。気管上皮を高用量のジスパーゼで分離することにより、気管ブラシ細胞へのパパインのより良いアクセスを可能にすることを目指しました。したがって、気管全体の室温で16 U/mLのジスパーゼを用いて上皮をチロデバッファー内の26 U/mLパパインで上皮およびその後のインキュベーションを分離し、最高のブラシ細胞回収につながった(図4E)。

図 1: 気管ブラシ細胞の単離のための提案されたステップのスキーマ。プロトコルは2つの主要なステップを含んでいる:解剖後、気管全体を上皮を分離するために高用量ジスパーゼ溶液でインキュベートされる。これに続いて、チロデバッファー(チロデI)および抗体染色を含むカルシウム中のパパインを有する上皮シートの消化が続く。この図のより大きなバージョンを表示するには、ここをクリックしてください。

図 2: 気管ブラシ細胞の代表的なフローサイトメトリー分析(A) フローサイトメトリーゲーティング戦略の概略表現。単一細胞は、その前方および側散乱特性に基づいてゲートされ、生細胞はヨウ化プロピジウムの除外に基づいて選択された。CD45低/負細胞をアイソタイプコントロールに基づいて選択し、EpCAMの発現について評価した。EpCAM陽性細胞は、FITCチャネルでeGFP蛍光を発現した場合にブラシ細胞と考えた。(B) マウス気管あたりのコリン作動性気管ブラシ細胞数および周波数は、全CD45低/-細胞のパーセントとして、およびCD45低/-EpCAM+細胞のパーセントとして提示される。各ドットは、別々のマウスを表します。データは、それぞれ2〜3匹のマウスを用いる3つの別々の実験から来ている。(C)CD45およびEpCAM用に染色された野生型マウスからの気管上皮ダイジェスト中のeGFP陽性ブラシ細胞の不在。この図のより大きなバージョンを表示するには、ここをクリックしてください。
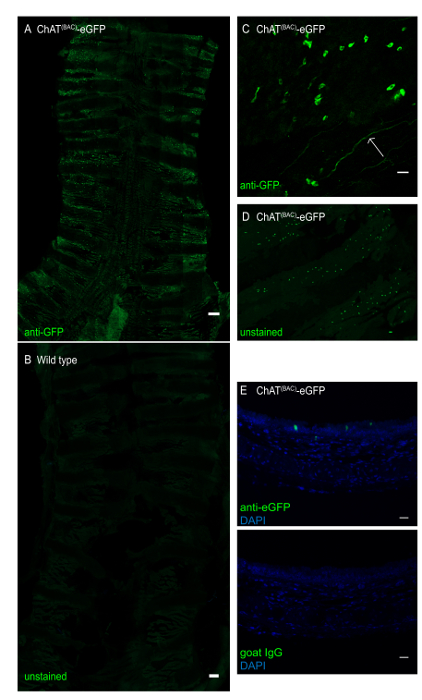
図 3:ChAT(BAC)-eGFPマウスのマウス気管の全マウント。気管を縦方向に開き、eGFP緑色蛍光シグナルを増強するために抗GFP抗体で染色した。(A) ChAT(BAC)-eGFPマウスの全気管マウントは、強烈な緑色蛍光細胞がブラシ細胞を表す。スケールバー1ミリメートル。(B) ブラシ細胞の不在を示す野生型マウスの全気管マウント;スケールバー = 1ミリメートル。(C) 不規則な形のブラシ細胞(緑色細胞)を示す上皮層の拡大は、コリン作動性神経終末(矢印)として同様にウェルスを示す。(D) 蛍光シグナルの抗体増強なしにGFP用に画像化されたChAT(BAC)-eGFPの気管の全気管マウント;(E) ChAT(BAC)-eGFPマウスのパラフィン埋め込みマウス気管の断面は、抗GFP(緑色)またはヤギIgG制御およびDAPI(青)で染色された。スケールバー = 20 μm (C-E)。この図のより大きなバージョンを表示するには、ここをクリックしてください。

図 4: 異なる気管消化プロトコルの比較。(A) 気管を細かく分け、650 U/mLコラゲナーゼIV及び1.84 U/mLディスパーゼをDNase Iを45分間補充した。この実験を2回繰り返した。(B) 気管全体を2.5mM EDTAでインキュベートし、0.75mM DTTをDNase Iで20分間補充した。上皮細胞を取り外し、さらに0.01 U/mLディスパーゼとDNase Iで10分間消化した。この実験を2回繰り返した。(C) 気管を細かく刻み、チロデIバッファーで35 U/mLのパパインを45分間インキュベートした。残留パパイン活性は、ルパプチンで阻害された。この実験は一度行った。(D) 気管全体を高用量ジスパーゼ(16U/mL)で30分間インキュベートし、続いて0.1%トリプシンと1.6mM EDTAを30分間浸入させた。この実験を2回繰り返した。(E)気管全体を高用量ジスパーゼ(16U/mL)で30分間インキュベートし、続いてタイロードバッファーに26 U/mLパパインを含む上皮シートを30分間消化した。残留パパイン活性は、ルパプチンおよび大量希釈によって阻害された。この図のより大きなバージョンを表示するには、ここをクリックしてください。
ディスカッション
我々は、40分間の高用量ジスパーゼ治療の組み合わせと短いパパイン治療(30分)が気管消化およびブラシ細胞分離に最適なプロトコルを提供することを見出した。この組み合わせは、広範な消化を回避し、代替プロトコルと比較して、ブラシ細胞の最高収率を生成します。
血行細胞を抽出する肺消化は、古典的にコラゲナーゼIV15のような軽度の消化酵素に依存しているが、上皮細胞の単離には、より複雑なプロトコルが必要である。上皮細胞の単一細胞懸濁液は、互いに結合する接合部と地下膜、および細胞自体の脆弱さのために達成することがより困難です。上皮細胞消化のためのほとんどのプロトコルは、2つのステップを伴う - 最初のステップは、地下膜から上皮を分離し、その後のステップは、上皮細胞を互いに付着させるタイトなジャンクションとデスモソームを妨害する後のステップです。16歳,17.
いくつかのグループは、上皮細胞の単離のための2段階プロトコルの異なる修飾を使用して腸から化学感覚タフト細胞を正常に単離した:最初のステップは、サブ粘膜から上皮細胞を放出するためにEDTAとDTTを使用して、次に続くジスパーゼを伴う上皮シートの消化。Howittらは、5 mM EDTA + 1 mM DTTの混合物を使用し、続いて0.5単位/mLディスパセIIおよびDNase14で消化した。ガーベら.高濃度30mM EDTA単独で上皮画分を分離し、その後DNaseI18を補充したディスパーゼでインキュベートした。フォン・モルトケらは2.5mM EDTA、0.75 mM DTT、DNaseIを使用し、その後にジスパーゼ消化6を使用した。これらの技術は気管内の生存可能な上皮細胞の単離を可能にするが、気管ブラシ細胞の割合は非常に低く(図4B)、600-800ブラシ細胞の単離に対する我々の期待と一致しないことがわかった。我々の細胞学の評価に基づく気管。
気管上皮細胞分離プロトコルは、基底上皮細胞を研究するためにいくつかのグループによって開発されている。これらのプロトコルと腸内で使用されるものの主な違いは、消化酵素の配列にあります。最初のステップは、室温16で高濃度のジスパーゼ(16 U/mL)を有するインキュベーションを介した気管上皮の分離である。これにより、上皮を間葉層19から単一シートとして分離することができる。気管上皮のその後の処理は、トリプシンとEDTAの組み合わせを使用して、細胞剥離の最も頻繁に使用される酵素法の1つであり、単一の細胞懸濁液を達成する。トリプシンは、リジンおよびアルギニンアミノ酸残基のC末端側のペプチドを切断し、一方EDTAは、細胞および細胞マトリックス相互作用20のカルシウムキレート器として使用される。この技術を用いて、Rockらは転写プロファイリング16のための基底上皮細胞の回収に成功している。同様のプロトコルは最近、Tas2r143-CreERT2駆動eGFPレポーターおよびB6から細胞を発現する苦味受容体を単離するために使用された。RNAシーケンシング研究のためのIl25Flare25/Flare25 5,8.私たちの経験では、トリプシンとEDTAを用いた上皮シートの消化は、優れた上皮細胞回収につながったが、機能的または転写分析のためのコリン作動性気管ブラシ細胞の数は、それぞれに複数のマウスをプールしない限り、不十分な数であった。サンプル (図 4C)。
パパインは、パパイヤラテックスに由来する強力な内引性植物システインプロテアーゼであり、基本的なアミノ酸、特にアルギニン、リジンおよび残基を含むペプチド結合をフェニルアラニン21に続くクチビチ結合することが知られている。ChAT(BAC)-eGFPマウスからのパパインを用いて気管ブラシ細胞分離が最初にKrastevaら10によって報告された。パパイン消化はまた、ブラシ/タフト細胞が上皮細胞の小さな一部を含む単一細胞RNAシーケンシングのための気道上皮細胞を解離するために最近使用された11。パパインはまた、生存可能なニューロン22の単離のための脳組織の消化のために最も一般的に使用される酵素である。30分間パパインとの脳組織の解離は、トリプシン消化23と比較して著しく高い収率、神経の生存および完全性をもたらす。一部のブラシ細胞は神経終末3、10と密接に絡み合っているので、ブラシ細胞接合部をニューロンに正常に切断するためにパパインの使用が重要である可能性があります。しかし、35-40 U/mLの濃度でパパインを使用した45分の消化は、上皮細胞の生存率を劇的に低下させ、低ブラシ細胞回収につながることがわかった(図4D)。
私たちは、パパイン毒性を低減し、私たちの細胞収率を高めるために3つの方法を使用しました。まず、上皮シートをジスパーゼで分離することにより、パパインのその後のインキュベーション時間を45分から30分に短縮した。第二に、我々は直ちに、システインプロテアーゼ24の阻害剤であるルペプチンによるパパイン活性を阻害した。特に、ルププチンは4°Cで非常に不安定であり、-20°Cでアリクォートして凍結する必要があります。第3に、大量の冷たいPBSにおける酵素的に消化された組織の希釈は、消化細胞の生存率を維持するのにも役立つことがわかった。細胞収率を増加させるために重要なもう一つのステップは、厳格なトリチュレーション10です。長時間の渦も生存率を低下させる可能性があるため、トリチュレーションで部分的に置き換えた。18G針でトリチュレーションを行い、より大きな細胞塊を解離し、その後21G針で追加のトリチュレーションを行うことをお勧めします。最後に、eGFPは非常に光に敏感であり、あらゆるステップで直接光暴露からの保護が役立つことがわかりました。これらの修飾は、生存可能な気管ブラシ細胞の堅牢な回収を可能にした(図4E)。
ここで提案されるプロトコルの主な制限は、2段階の手順とパパインの使用、強力なシステインプロテアーゼです。いくつかのグループは最近、化学感覚細胞を単離する際に、ジスパーゼ5のリベラーゼを置き換えている。さらに、リベラーゼ消化は最近、鼻ポリープ25、26から化学感覚(ブラシ)上皮細胞を分離するために使用された。私たちは、リベラーゼ消化を私たちの2段階のジスパーゼ/パパイン消化プロトコルと直接比較していません。パパインは、上皮細胞27上皮細胞上のプロテアーゼ活性化受容体PAR2を活性化することができる強力なシステインプロテアーゼであり、ブラシ細胞自体の活性化または他の呼吸細胞によるメディエーターの生成に至る。ブラシセル。最後に、パパインは、表面受容体の切断を通じて受容体発現を調節することができ、フローサイトメトリー28、29によるブラシ細胞受容体発現の検証が困難である。
要約すると、我々は、生存可能な気管ブラシ細胞の堅牢な回復を可能にするChAT-eGFPレポーターマウスからの気管コリン作動性ブラシ細胞の単離プロトコルを提供する。このプロトコルは、RNAシーケンシング3によるブラシ細胞の単離および転写解析に成功した。
開示事項
著者は何も開示していない。
謝辞
ブリガムと女性の人間免疫学センターフローコアのアダム・チコインに感謝します。この研究は、国立衛生補助金研究所R01 HL120952(N.A.B.)、R01 AI134989(N.A.B)、U19 AI095219(N.A.B.、 L.G.B)、K08 AI132723(L.G.B)、および米国アレルギー・喘息・免疫学アカデミー(AAAAI)/アメリカ肺アレルギー呼吸器疾患賞(N.A.B.)、AAAAI財団教員育成賞(L.G.B.)、スティーブン・アンド・ジュディ・ケイ・ヤング・イノベーター賞(N.A.B.)、ジョイスリン・C・オースティン女性医師のキャリア開発基金(L.G.B.)、およびヴィニク家(L.G.B.)による寛大な寄付。
資料
| Name | Company | Catalog Number | Comments |
| Antibodies | |||
| Anti-GFP (Polyclonal goat Ig) | Abcam | cat# ab5450 | |
| APC anti-mouse CD326 (EpCAM) (G8.8) | Biolegend | cat#118214 | |
| APC Rat IgG2a, k isotype control | Biolegend | cat#400511 | |
| DAPI | Biolegend | cat#422801 | |
| Donkey anti-goat IgG (H+L) Highly Cross-Adsorbed Secondary Antibody, Alexa Fluor 488 | Life Technologies/Molecular Probes | cat#A-11055 | |
| Normal Goat IgG | R&D Systems | cat#AB-108-C | |
| Pacific Blue anti-mouse CD45 (30F-11) | Biolegend | cat#103126 | |
| Pacific Blue Rat IgG2b, k isotype control | Biolegend | cat#400627 | |
| TruStain FcX (anti-mouse CD16/32) Antibody | Biolegend | cat#101320 | |
| Chemicals, Peptides, and Recombinant Proteins | |||
| Dispase | Gibco | cat# 17105041 | |
| DNase I | Sigma | cat# 10104159001 | |
| HEPES-Tyrode’s Buffer Without Calcium (10 mM HEPES, 135 mM NaCl, 2.8 mM KCl, 1 mM MgCl2, 12 mM NaHCO3, 0.4 mM NaH2PO4, 0.25% BSA, 5.5 mM Glucose. Prepared in 18.2 megohms water and filtered through 0.22 µm filter | Boston BioProducts | cat# PY-912 | |
| Tyrode’s Solution (HEPES-Buffered) 140 mM NaCl, 5 mM KCl, 25 mM HEPES, 2 mM CaCl2, 2 mM MgCl2 and 10 mM glucose. Prepared in 18.2 megohms water and filtered through 0.22 µm filter. ) | Boston BioProducts | cat# BSS-355 | |
| L-Cysteine | Sigma | cat# C7352 | |
| Leupeptin trifluoroacetate salt | Sigma | cat# L2023 | |
| Papain from papaya latex | Sigma | cat# P3125 | |
| Propidium iodide | Sigma | cat# P4170 | |
| Experimental Models: Organisms/Strains | |||
| ChATBAC-eGFP (B6.Cg-Tg(RP23-268L19-EGFP)2Mik/J) | The Jackson Laboratory | 7902 | |
| Equipment | |||
| LSM 800 with Airyscan confocal system on a Zeiss Axio Observer Z1 Inverted Microscope | Zeiss | ||
| LSRFortessa | BD | 647465 | |
| Disposable equipment | |||
| 1.5 mL sterile tubes | Thomas Scientific | 1157C86 | |
| 5 mL Poysterene Round-bottom Tube, 12 mm x 75 mm style | Falcon | 14-959-1A | |
| 50 mL Polypropylene conical tube, 30 mm x 115 mm style | Falcon | 352098 | |
| Feather Disposable Scalpel no.12 | Fisher Scientific | NC9999403 | |
| Petri dish, 100 mm x 15 mm Style | Falcon | 351029 | |
| Sterile cell strainer, 100 μm | Fisherbrand | cat#22363549 |
参考文献
- Tizzano, M., et al. Nasal chemosensory cells use bitter taste signaling to detect irritants and bacterial signals. Proceedings of the National Academy of Sciences of the United States of America. 107 (7), 3210-3215 (2010).
- Genovese, F., Tizzano, M. Microvillous cells in the olfactory epithelium express elements of the solitary chemosensory cell transduction signaling cascade. PLoS One. 13 (9), 0202754(2018).
- Bankova, L. G., et al. The cysteinyl leukotriene 3 receptor regulates expansion of IL-25-producing airway brush cells leading to type 2 inflammation. Science Immunology. 3 (28), (2018).
- Krasteva, G., Canning, B. J., Papadakis, T., Kummer, W. Cholinergic brush cells in the trachea mediate respiratory responses to quorum sensing molecules. Life Sciences. 91 (21-22), 992-996 (2012).
- Nadjsombati, M. S., et al. Detection of Succinate by Intestinal Tuft Cells Triggers a Type 2 Innate Immune Circuit. Immunity. 49 (1), 33-41 (2018).
- von Moltke, J., Ji, M., Liang, H. E., Locksley, R. M. Tuft-cell-derived IL-25 regulates an intestinal ILC2-epithelial response circuit. Nature. 529 (7585), 221-225 (2016).
- Deckmann, K., et al. Bitter triggers acetylcholine release from polymodal urethral chemosensory cells and bladder reflexes. Proceedings of the National Academy of Sciences of the United States of America. 111 (22), 8287-8292 (2014).
- Liu, S., et al. Members of Bitter Taste Receptor Cluster Tas2r143/Tas2r135/Tas2r126 Are Expressed in the Epithelium of Murine Airways and Other Non-gustatory Tissues. Frontiers in Physiology. 8, 849(2017).
- Krasteva, G., et al. Cholinergic chemosensory cells in the auditory tube. Histochemistry and Cell Biology. 137 (4), 483-497 (2012).
- Krasteva, G., et al. Cholinergic chemosensory cells in the trachea regulate breathing. Proceedings of the National Academy of Sciences of the United States of America. 108 (23), 9478-9483 (2011).
- Montoro, D. T., et al. A revised airway epithelial hierarchy includes CFTR-expressing ionocytes. Nature. 560 (7718), 319-324 (2018).
- Plasschaert, L. W., et al. A single-cell atlas of the airway epithelium reveals the CFTR-rich pulmonary ionocyte. Nature. 560 (7718), 377-381 (2018).
- Dwyer, D. F., Barrett, N. A., Austen, K. F. Immunological Genome Project, C. Expression profiling of constitutive mast cells reveals a unique identity within the immune system. Nature Immunology. 17 (7), 878-887 (2016).
- Howitt, M. R., et al. Tuft cells, taste-chemosensory cells, orchestrate parasite type 2 immunity in the gut. Science. 351 (6279), 1329-1333 (2016).
- Bankova, L. G., Dwyer, D. F., Liu, A. Y., Austen, K. F., Gurish, M. F. Maturation of mast cell progenitors to mucosal mast cells during allergic pulmonary inflammation in mice. Mucosal Immunology. 8 (3), 596-606 (2015).
- Rock, J. R., et al. Basal cells as stem cells of the mouse trachea and human airway epithelium. Proceedings of the National Academy of Sciences of the United States of America. 106 (31), 12771-12775 (2009).
- Rock, J. R., et al. Multiple stromal populations contribute to pulmonary fibrosis without evidence for epithelial to mesenchymal transition. Proceedings of the National Academy of Sciences of the United States of America. 108 (52), 1475-1483 (2011).
- Gerbe, F., et al. Intestinal epithelial tuft cells initiate type 2 mucosal immunity to helminth parasites. Nature. 529 (7585), 226-230 (2016).
- Rock, J. R., et al. Transmembrane protein 16A (TMEM16A) is a Ca2+-regulated Cl- secretory channel in mouse airways. Journal of Biological Chemistry. 284 (22), 14875-14880 (2009).
- Olsen, J. V., Ong, S. E., Mann, M. Trypsin cleaves exclusively C-terminal to arginine and lysine residues. Molecular and Cellular Proteomics. 3 (6), 608-614 (2004).
- Verma, S., Dixit, R., Pandey, K. C. Cysteine Proteases: Modes of Activation and Future Prospects as Pharmacological Targets. Frontiers in Pharmacology. 7, 107(2016).
- Huettner, J. E., Baughman, R. W. Primary culture of identified neurons from the visual cortex of postnatal rats. Journal of Neuroscience. 6 (10), 3044-3060 (1986).
- Kaiser, O., et al. Dissociated neurons and glial cells derived from rat inferior colliculi after digestion with papain. PLoS One. 8 (12), 80490(2013).
- Aoyagi, T., Takeuchi, T., Matsuzaki, A., Kawamura, K., Kondo, S. Leupeptins, new protease inhibitors from Actinomycetes. Journal of Antibiotics (Tokyo). 22 (6), 283-286 (1969).
- Kohanski, M. A., et al. Solitary chemosensory cells are a primary epithelial source of IL-25 in patients with chronic rhinosinusitis with nasal polyps. The Journal of Allergy and Clinical Immunology. 142 (2), 460-469 (2018).
- Patel, N. N., et al. Solitary chemosensory cells producing interleukin-25 and group-2 innate lymphoid cells are enriched in chronic rhinosinusitis with nasal polyps. International Forum of Allergy & Rhinology. , (2018).
- Kouzaki, H., O'Grady, S. M., Lawrence, C. B., Kita, H. Proteases induce production of thymic stromal lymphopoietin by airway epithelial cells through protease-activated receptor-2. The Journal of Immunology. 183 (2), 1427-1434 (2009).
- Cambier, J. C., Vitetta, E. S., Kettman, J. R., Wetzel, G. M., Uhr, J. W. B-cell tolerance. III. Effect of papain-mediated cleavage of cell surface IgD on tolerance susceptibility of murine B cells. The Journal of Experimental Medicine. 146 (1), 107-117 (1977).
- Nishikado, H., et al. Cysteine protease antigens cleave CD123, the alpha subunit of murine IL-3 receptor, on basophils and suppress IL-3-mediated basophil expansion. Biochemical and Biophysical Research Communications. 460 (2), 261-266 (2015).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved