Method Article
小鼠特拉切斯刷细胞的分离与定量评价
摘要
刷细胞是罕见的胆碱能化学感觉上皮细胞发现在天真的小鼠气管。由于其数量有限,其功能在气道免疫和改造中的作用的体外评估具有挑战性。我们描述了一种通过流式细胞测定分离气管刷细胞的方法。
摘要
流毛刷细胞是胆碱能化学感觉上皮细胞,准备将信号从气道流明传输到免疫和神经系统。它们是化学感觉上皮细胞家族的一部分,包括肠道粘液中的突触细胞、气管中的刷细胞以及鼻黏液中的单独化学感觉和微绒细胞。不同上皮腔的切觉细胞共享关键的细胞内标记和核心转录特征,但也表现出显著的转录异质性,可能反映局部组织环境。需要从单细胞悬浮液中分离气管刷细胞,以详细定义这些稀有上皮细胞的功能,但它们的分离具有挑战性,这可能是由于气管刷细胞和神经末梢之间的密切相互作用或由于气道特异性的紧密和粘附结的组成。在这里,我们描述了从小鼠气管上皮分离刷细胞的过程。该方法基于气管上皮从亚粘液中的初始分离,允许随后用木瓜进行上皮板的较短孵育。此过程为流动细胞分和可行气管刷细胞的功能分析提供了快速、方便的解决方案。
引言
刷细胞属于一类化学感官上皮细胞,其特征是苦味受体的表达和味蕾细胞中发现的味觉受体转导机制。与味蕾细胞不同,化学感官上皮细胞分散在上皮表面,被称为鼻上皮1、2、气管中的微微神经质细胞。3,4,和肠中的突子细胞5,6。表达苦味受体和苦味转导机制的皮下细胞也存在于尿道7、8和听觉管9中。气道刷细胞在神经生成和免疫气道反应中具有独特的功能。它们是乙酰胆碱产生的化学感觉细胞,在用苦化合物和细菌代谢物(如法定感物质10)激活时引起保护性呼吸反射。气道刷细胞也是IL-25的主要气道上皮来源,它调节气道3中的气过敏原-2型炎症。
低气道刷细胞的完整转录组及其对环境刺激的反应的表征,由于在气管上皮中数量少,且大支气管10以外的数量非常有限。用于从肠道上皮分离化学感觉细胞的技术并没有从气管中产生比例高的数字,可能是因为神经末梢为10或其他的气管刷细胞的亲密接触呼吸粘部中的组织特异性因子,如粘附物和紧密结蛋白的组成。最近关于单细胞RNA测序分析成功分离高数量的气管刷细胞的报告,要么采用2小时培养,要么用帕金孵育,要么用18小时孵育11,12。由于使用消化酶的较长孵育期会降低细胞活力,并改变消化组织13细胞的转录轮廓,这可能偏向其他化学感觉上皮种群的比较分析。
在这里,我们报告一种用于RNA测序的气管刷细胞分离方法。用高剂量去巴西气管治疗将上皮从亚粘管中分离出来。随后消化上皮片与木瓜,允许这种结构细胞的出色地恢复。
研究方案
在进行以下实验之前,确保所有动物护理使用和规程都得到机构动物护理和使用委员会 (IACUC) 的批准,并符合国家研究理事会的"护理和使用指南"。实验室动物"( 第8版,2011年)和《大起百万人指南》。下文所述的所有程序都经过布里格姆和妇女医院的机构动物护理和使用委员会的审查和批准。
1. 试剂制备
- 制备脱脂消化溶液,这是一种PBS溶液,含有16U/mL消沉剂和20μg/mL DNase I。
- 在 Dulbeco 改性鹰介质 (DMEM) 中加入 5% 的热灭活胎牛血清 (FBS),以做出停止解决方案。
- 准备Tyrode I缓冲液:在无钙的HEPES-Tyrode缓冲液中加入26 U/mL木瓜(20 μL/mL 48 U/mg木瓜溶液)和10μL/mL-半胱氨酸。
- 准备Tyrode II缓冲液:用钙向HEPES-Tyrode的缓冲液中加入2μL/mL白蛋白(5毫克/mL)。
- 准备FACS缓冲液:使用汉克斯平衡盐溶液(HBSS),不含钙、镁和苯酚红色,辅以2 mM乙烯二甲酸乙酸(EDTA),并加入2%FBS。
2. 小鼠特拉切亚的解剖
注:该协议中使用的小鼠为 ChAT(BAC)-eGFP (B6)。Cg-Tg(RP23-268L19-EGFP)2Mik/J,3-6个月,男女年龄。尽量减少组织对直接光的暴露,以减少eGFP的光漂白。
- 使用100mg/kg五巴比妥安乐死溶液,在腹腔内注射或使用经IACUC批准的标准协议,使小鼠安乐死。
- 用21G针将鼠标固定在手术板上,并延长上肢和下肢。用 70% EtOH 喷洒毛皮,以消毒区域。
- 使用直钳,抬起腹部的皮肤和毛皮,并用解剖剪刀(直剪刀,3 厘米)在中心切开。使用剪刀,将皮肤从皮下组织从腹部分离到曼迪布拉。用钳子将皮下组织抱起来时,用剪刀在腹壁的中心进行一个小切口。
- 用 V 形切口打开围肠。使用钳子,轻轻地移动小肠到一侧,定位腹部主方和vena卡瓦,并用解剖剪刀进行切口,以便快速排泄。
- 找到隔膜。使用 18 G 针头,在胸骨正下方的隔膜中打开一个开口,使肺部放气。使用尖尖直解剖剪刀小心地将隔膜从肋笼中分离出来,沿肋骨底部切开。
- 使用钳子,抬起胸骨的外露端,并将胸骨从肋骨笼底纵向切割到颈部。用短直剪刀(2厘米)做一个中央宫颈切口,并分离下颌腺的两个叶。
- 小心地去除周围的结缔组织和胸腺覆盖卡林纳与一对细点高精度钳子。
- 首先在气管分裂水平上分离近端,然后在气管分叉水平上解剖远端。因此,首先将气管分离。
- 找到眼皮骨,并纵向切割气管从眼皮虫到卡利纳。
3. 斜管内皮消化
- 将气管放入含有750μL预加热(至37°C)的1.5 mL管中。在室温下在 200 rpm 的振动器上孵育 40 分钟。用铝箔盖住管子,以减少对直光的照射。
- 加入750 μL的冷DMEM与5%FBS停止反应。放在冰上。
- 将气管转移到培养皿(100 mm x 15 mm)并置于解剖显微镜下。将气管定向,上皮侧朝上。纵向解剖的气管具有半圆柱形,由软柱环保持。上皮在凹面上。
- 用直钳将气管的眼皮球区用直钳绑在培养皿上,并使用22号一次性手术刀,刮掉气管的上皮。上皮层作为半透明板分离。
- 用手术刀切碎上皮。将上皮层转移到 2 mL 管中。
- 用 750 μL 的 Tyrode I 缓冲液冲洗培养皿,并转移到包含上皮层的 2 mL 管中。
- 在 Tyrode I 缓冲器中孵育气管上皮层 30 分钟,在 37°C 下在 200 rpm 的摇床上孵育。用铝箔盖住管子,以减少对直光的照射。
- 加入750 μL的冷蒂罗德II缓冲液。涡旋被消化的组织大力为20-30s。用连接到18G针头的注射器将均质化10次。 切换到 21 G 仪表针,再三聚 10-20 次。
- 通过100μm滤网将细胞过滤成50 mL锥形管。添加 30:1 vol/vol 的冷 FACS 缓冲区。
- 在 4°C 下以 350 x g旋转 10 分钟,然后丢弃上清液。将颗粒重新悬浮在冷 FACS 缓冲液中,并将悬浮液转移到 12 mm x 75 mm (5 mL) 聚苯乙烯管中。在 4°C 下以 350 x g再次旋转 10 分钟,然后丢弃上清液。
- 在 100 μL 的 FACS 缓冲液中重新悬浮颗粒。
- 加入1μL抗小鼠CD16/32阻断抗体,以阻止非特异性结合,并在冰上孵育15分钟。不要清洗。
- 加入以下抗体和各自的等型对照:太平洋蓝色抗小鼠CD45或大鼠IgG2a,k(0.25μg/106细胞在100μL体积)和异化青霉素(APC)抗小鼠EpCAM或大鼠IgG2b,k(0.5μg/106细胞在100μL体积)单克隆抗体。在冰上孵育45分钟,防止直接光线照射。加入4.5 mL的冷FACS缓冲液,在350 x g下混合和旋转10分钟,在4°C下。丢弃 FACS 缓冲液,在 300 μL 的冷 FACS 缓冲液中重新悬浮颗粒。
- 在流量细胞分拣之前,立即添加碘化钠 (PI) (5 μg/mL)。
注:刷细胞具有不规则的形状,具有多个过程,可能会增加它们对过滤器的依从性(图3C)。我们比较了 30 mm 到 70 mm 和 100 mm 的过滤器,发现更大的孔隙过滤器可确保更好的产量。此外,在木瓜消化后细胞悬浮液的彻底三聚化可显著提高刷细胞的产量。我们建议使用18G针头进行初始三次三次分离,然后用较小的孔(21或23G针)对细胞进行更精细的解散。
4. 流式细胞测量测量策略
- 通过正向和侧面散射角度识别碎屑中产生的细胞。使用正向散射高度和宽度以及侧散射高度和宽度排除双精度值。双精度值是具有高宽度值的单元格。
- 在单个单元格中,将活细胞标识为 PI 阴性的填充。
- 在活的单细胞中,根据等型对照识别CD45从低到负细胞。
- 在CD45低/负细胞内,识别同样为eGFP阳性的EpCAM阳性细胞(在FITC通道中)。这是刷细胞的填充 (图 2A)。
结果
这个程序已经成功地实现分离气管刷细胞的RNA测序3。用2步方案分离气管和消化组织后,在排除带有PI的死细胞后,用荧光标记CD45和EpCAM收集并染色细胞。在基于正向和侧散射特性门控双精度点后,我们将画笔单元定义为 CD45 的低/负、EpCAM 的正值和 eGFP 的正数(图 2A)。刷细胞按流动细胞测定表示CD45低/负细胞的±0.16-0.42%,每个气管占250-600个细胞(图2B)。我们根据我们发表的对气管刷细胞3的广泛免疫组织学评估,将这些计数与 ChAT (BAC)-eGFP 小鼠整个气管支气管支架中 ChAT-eGFP 阳性细胞数量的估计值进行了比较, 此处说明了 (图 3.我们以前对野生型气管刷细胞、ChAT(BAC)-eGFP 小鼠和Il25F25/F25小鼠的研究表明,胆碱刷细胞与 DCLK1+和 IL25+细胞和帐户重叠 90%对于600-1000刷细胞每个气管3。值得注意的是,这个数字低于其他组10报告胆碱能刷细胞的数量。由于化学感官细胞数因接触微生物代谢物和原生动物5、14而改变,这些数字可能反映了机构间微生物群的变异性。因此,我们建议通过荧光显微镜估计刷细胞的数量,以便通过流式细胞分法测量分离的刷细胞的预期数量。
在建立我们的协议时,我们尝试了几种以前发表的分离化学感觉细胞的方法(图4)。当我们用650 U/mL胶原酶IV和1.84 U/mL除血剂用DNase I补充45分钟,这种组合经常用于从肺均质物15中获得单细胞悬浮液时,我们实现了单细胞悬浮上皮细胞,但我们只恢复了很少的刷细胞(图4A)。肠道中的Tuft细胞已成功分离出,使用2.5mM EDTA和0.75 mM Dithioththreitol (DTT)与DNase I分离20分钟,以去除上皮细胞,然后消化释放的上皮细胞与0.01 U/mL与DNaseI分离10分钟6.在我们手中,使用这个程序也导致气管刷细胞恢复不理想(图4B)。Krasteva等人10日介绍了一种成功分离气管刷细胞用于RNA分析的方案。遵循此协议,我们在 Tyrode 缓冲液中用 35 U/mL 木瓜孵育切碎的气管 45 分钟,没有实现良好的刷细胞恢复(图 4C)。Rock等人描述了气管上皮的消化方法,用于基底细胞分离,分两步:在室温下用高剂量脱脂(16 U/mL)分离上皮层,然后孵化剥离上皮与0.1 % 胰蛋白酶和1.6 mM EDTA在37°C1630分钟。遵循这些步骤可更好地恢复毛刷细胞,但每只鼠标实现的数字不足以进行深度功能分析(图4D)。为了优化协议,我们决定合并最后两种方法。通过用高剂量去巴西分离气管上皮,我们的目的是让木瓜更好地进入气管刷细胞。因此,在室温下在整个气管上使用16 U/mL的消血液分离上皮,随后在Tyrode缓冲液中用26 U/mL木瓜素分离上皮,从而达到最佳的刷细胞恢复(图4E)。

图 1:气管刷细胞分离的建议步骤的架构。该方案包括两个主要步骤:解剖后,整个气管在高剂量的消节溶液中孵育,以分离上皮;其次是消化上皮片与木瓜在钙含有Tyrode缓冲液(Tyrode I)和抗体染色。请点击此处查看此图的较大版本。

图 2:气管刷细胞的代表性流细胞测定分析。(A) 流细胞学门控策略的原理表示。单细胞根据其正向和侧散射特性进行封闭,活细胞根据碘化钠的排除选择。CD45低/负细胞基于等型对照选择,并评估其EpCAM的表达。如果EpCAM阳性细胞在FITC通道中表达eGFP荧光,则被视为刷细胞。(B). 小鼠气管的胆碱气管刷细胞数和频率以所有 CD45低/-细胞的百分比和 CD45低/-EpCAM+细胞的百分比表示。每个点表示单独的鼠标。数据来自3个独立的实验与2-3个小鼠每个。(C. 在用于 CD45 和 EpCAM 的野生型小鼠的气管上皮消化液中缺少 eGFP 阳性刷细胞。请点击此处查看此图的较大版本。
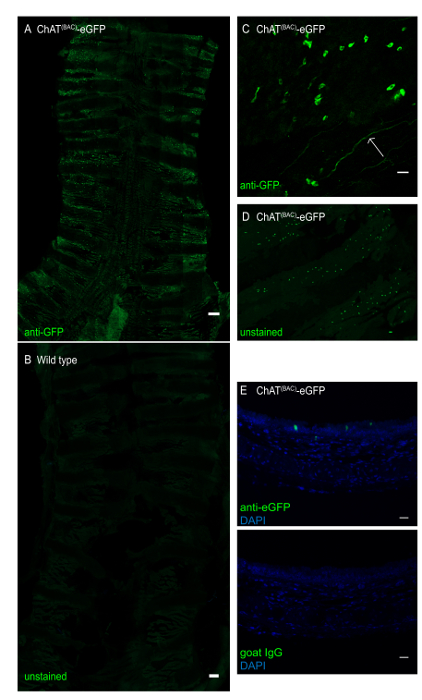
图 3:ChAT(BAC)-eGFP 鼠标的小鼠气管的整个安装。气管纵向打开,并沾染抗GFP抗体,以增强eGFP绿色荧光信号。(A) ChAT(BAC)-eGFP小鼠的整个气管安装,强烈的绿色荧光细胞代表刷细胞;刻度杆 1 毫米;(B) 野生型小鼠的全气管安装,显示没有刷细胞;刻度杆 = 1 毫米;(C) 上皮层放大,显示不规则形状的刷细胞(绿色细胞),以及胆碱状神经末梢(箭头);(D) ChAT (BAC) -eGFP 成像的ChAT(BAC)-eGFP成像的气管的整个气管安装,没有荧光信号的抗体增强;(E) 用抗GFP(绿色)或山羊IgG控制和DAPI(蓝色)染色的ChAT(BAC)-eGFP小鼠石蜡嵌入小鼠气管的横截面;刻度条 = 20 μm (C-E)。请点击此处查看此图的较大版本。

图 4:不同气管消化方案的比较。(A) 气管用650 U/mL胶原酶IV和1.84 U/mL消炎加补DNase I进行切碎和孵育45分钟。这个实验重复了2次。(B) 整个气管孵育2.5m M EDTA和0.75 mM DTT,辅以DNase I20分钟;上皮细胞被去除,并进一步消化0.01 U/mL消血和DNase I10分钟。这个实验重复了2次。(C) 气管在Tyrode I缓冲液中用35 U/mL的木瓜切开并孵育45分钟;残留的木瓜素活性被抑制与白蛋白。这个实验曾经执行过一次。(D) 整个气管用高剂量脱脂(16 U/mL)孵育30分钟,分离上皮片,然后孵化上皮片,其中0.1%胰蛋白酶和1.6 mM EDTA孵育30分钟。这个实验重复了2次。(E). 整个气管用高剂量脱脂 (16 U/mL) 孵育 30 分钟,然后消化上皮板,在 Tyrode 缓冲液中用 26 U/mL 木瓜蛋白进行 30 分钟。残留的木瓜素活性被抑制与白蛋白和大体积稀释。请点击此处查看此图的较大版本。
讨论
我们发现,高剂量消血治疗40分钟,然后短的木瓜治疗(30分钟)的组合为气管消化和刷细胞分离提供了最佳方案。与替代协议相比,这种组合既避免了广泛的消化,又能产生最高产量的刷细胞。
虽然肺消化提取造血细胞传统上依赖于温和的消化酶,如胶原酶IV15,但分离上皮细胞需要更复杂的方案。上皮细胞的单细胞悬浮体更难实现,因为紧密和粘附结将它们结合在彼此和基底膜上,并且由于细胞本身的弱点。大多数上皮细胞消化协议涉及两个步骤 - 第一步是从基底膜分离上皮,然后后续步骤来干扰紧结和脱毛体,这些结和脱毛体将上皮细胞粘附在彼此上16,17.
几个组已经成功地从肠道分离化学感觉突体细胞,使用两步协议的不同修改分离上皮细胞:第一步使用EDTA和DTT从亚粘体释放上皮细胞,然后消化上皮片与消沉。Howitt等人使用5 mM EDTA + 1 mM DTT的混合物,然后消化0.5单位/mL分酶II和DNase14。格贝等人.单独使用高浓度30 mM EDTA来分离上皮分数,随后用脱脂蛋白补充DNaseI18进行孵育。冯·莫尔特克等人使用2.5mM EDTA、0.75 mM DTT和DNaseI,随后是消酶消化6。我们发现,这些技术允许在气管中分离可行的上皮细胞,但气管刷细胞的百分比极低(图4B),不符合我们关于每节分离600-800个刷细胞的期望。气管基于我们的组织学评估。
若干组已开发沙套上皮细胞分离方案,以研究基底上皮细胞。这些协议与肠道中使用的方案之间的主要区别是消化酶的序列。第一步是通过在室温16下高浓度的脱脂(16U/mL)孵育,将气管上皮分离。这允许上皮从中间层19分离为单片。随后的气管上皮处理使用胰蛋白酶和EDTA的组合,这是细胞分离最常用的酶方法之一,以实现单个细胞悬浮。胰蛋白酶在裂解物和精氨酸氨基酸残留物的C端侧切合肽,而EDTA用作细胞-细胞和细胞-基质相互作用的钙合合剂20。利用这一技术,Rock等人已经成功地回收了基底上皮细胞进行转录分析16。最近,一个类似的协议被用来从Tas2r143-CreERT2驱动的eGFP报告器和B6分离苦味受体表达细胞。Il25Flare25/Flare25用于RNA测序研究 5,8.根据我们的经验,用胰蛋白酶和EDTA消化上皮片导致良好的上皮细胞恢复,但胆碱能气管刷细胞数量不足,无法进行功能或转录分析,除非每个小鼠都汇集在一起示例 (图 4C) 。
帕帕金是一种强效内解植物半胱氨酸蛋白酶,来源于木瓜乳胶,已知会裂解肽键,涉及基本氨基酸,特别是精氨酸、裂氨酸和苯丙氨酸21之后的残留物。克拉斯特瓦等人10日首次报道了克拉斯特瓦等人首先报告使用ChAT(BAC)-eGFP小鼠的木瓜的沙甲刷细胞分离。帕帕因消化最近也被用来分离气道上皮细胞,用于单细胞RNA测序,其中刷细胞/突触细胞构成上皮细胞的一小部分11。帕帕因也是最常见的酶消化脑组织分离可行的神经元22。与胰蛋白酶消化23相比,脑组织与木瓜的分离30分钟可显著提高产量、神经元存活率和完整性。由于一些刷细胞与神经末梢3,10紧密交织在一起,使用木瓜素对于刷细胞结到神经元的成功裂解可能是至关重要的。然而,我们发现,45分钟消化与木瓜在浓度为35-40 U/mL显著降低上皮细胞活力,导致低刷细胞恢复(图4D)。
我们使用3种方法来降低木瓜毒性,提高细胞产量。首先,通过分离上皮片与消炎,我们把木瓜的后续孵育时间从45分钟减少到30分钟。其次,我们立即抑制木瓜素活性与白蛋白素,半胱氨酸蛋白酶24的抑制剂。值得注意的是,白蛋白在4°C时极不稳定,应在-20°C处被无显著引用和冷冻。第三,我们发现,在大量冷PBS中稀释酶消化组织也有助于保持消化细胞的生存能力。另一个对提高细胞产量至关重要的步骤是严格的三聚体10。由于长时间的涡旋也会降低生存能力,我们部分地用三聚物代替了它。我们建议使用 18G 针头进行三聚,以分离较大的细胞团块,然后使用 21 G 针头进行额外的三聚。最后,我们发现eGFP对光非常敏感,在任何步骤中防止直接光照射都很有帮助。这些修改允许活气管刷细胞的强健恢复 (图 4E).
这里提出的协议的主要限制是两步程序和使用木瓜,一种有效的半胱氨酸蛋白酶。一些小组最近在分离化学感觉细胞时用利酶代替了消血5。此外,利氏酶消化最近被用来分离化学感觉(刷)上皮细胞从鼻息肉25,26。我们没有直接比较利司酶消化与我们的两步消炎/帕帕因消化方案。Papain 是一种有效的半胱氨酸蛋白酶,它可以激活上皮细胞27上的蛋白酶活性受体 PAR2,导致刷细胞本身或由其他呼吸细胞产生中介,从而激活刷单元格。最后,木瓜素可以通过表面受体的裂解调节受体表达,使得通过流式细胞测定28、29很难验证刷细胞受体表达。
总之,我们提供从ChAT-eGFP报告小鼠中分离气管胆碱刷细胞的协议,允许活气管刷细胞的强健恢复。该协议已经成功地用于通过RNA测序3对刷细胞进行分离和转录分析。
披露声明
作者没有什么可透露的。
致谢
我们感谢布里格姆和妇女人类免疫学中心流动核心的亚当·奇币,感谢他在流式细胞分型方面的帮助。这项工作得到了国家卫生研究院资助R01 HL120952(N.A.B.),R01 AI134989(N.A.B),U19 AI095219(N.A.B., L.G.B) 和 K08 AI132723 (L.G.B),由美国过敏、哮喘和免疫学学会 (AAAAI)/ 美国肺过敏呼吸疾病奖(N.A.B.),由AAAAI基金会教师发展奖(L.G.B.),史蒂文和朱迪·凯青年创新者奖(N.A.B.),乔伊斯琳·奥斯汀女医生职业发展基金(L.G.B.)颁发,维尼克家族的慷慨捐赠(L.G.B.)。
材料
| Name | Company | Catalog Number | Comments |
| Antibodies | |||
| Anti-GFP (Polyclonal goat Ig) | Abcam | cat# ab5450 | |
| APC anti-mouse CD326 (EpCAM) (G8.8) | Biolegend | cat#118214 | |
| APC Rat IgG2a, k isotype control | Biolegend | cat#400511 | |
| DAPI | Biolegend | cat#422801 | |
| Donkey anti-goat IgG (H+L) Highly Cross-Adsorbed Secondary Antibody, Alexa Fluor 488 | Life Technologies/Molecular Probes | cat#A-11055 | |
| Normal Goat IgG | R&D Systems | cat#AB-108-C | |
| Pacific Blue anti-mouse CD45 (30F-11) | Biolegend | cat#103126 | |
| Pacific Blue Rat IgG2b, k isotype control | Biolegend | cat#400627 | |
| TruStain FcX (anti-mouse CD16/32) Antibody | Biolegend | cat#101320 | |
| Chemicals, Peptides, and Recombinant Proteins | |||
| Dispase | Gibco | cat# 17105041 | |
| DNase I | Sigma | cat# 10104159001 | |
| HEPES-Tyrode’s Buffer Without Calcium (10 mM HEPES, 135 mM NaCl, 2.8 mM KCl, 1 mM MgCl2, 12 mM NaHCO3, 0.4 mM NaH2PO4, 0.25% BSA, 5.5 mM Glucose. Prepared in 18.2 megohms water and filtered through 0.22 µm filter | Boston BioProducts | cat# PY-912 | |
| Tyrode’s Solution (HEPES-Buffered) 140 mM NaCl, 5 mM KCl, 25 mM HEPES, 2 mM CaCl2, 2 mM MgCl2 and 10 mM glucose. Prepared in 18.2 megohms water and filtered through 0.22 µm filter. ) | Boston BioProducts | cat# BSS-355 | |
| L-Cysteine | Sigma | cat# C7352 | |
| Leupeptin trifluoroacetate salt | Sigma | cat# L2023 | |
| Papain from papaya latex | Sigma | cat# P3125 | |
| Propidium iodide | Sigma | cat# P4170 | |
| Experimental Models: Organisms/Strains | |||
| ChATBAC-eGFP (B6.Cg-Tg(RP23-268L19-EGFP)2Mik/J) | The Jackson Laboratory | 7902 | |
| Equipment | |||
| LSM 800 with Airyscan confocal system on a Zeiss Axio Observer Z1 Inverted Microscope | Zeiss | ||
| LSRFortessa | BD | 647465 | |
| Disposable equipment | |||
| 1.5 mL sterile tubes | Thomas Scientific | 1157C86 | |
| 5 mL Poysterene Round-bottom Tube, 12 mm x 75 mm style | Falcon | 14-959-1A | |
| 50 mL Polypropylene conical tube, 30 mm x 115 mm style | Falcon | 352098 | |
| Feather Disposable Scalpel no.12 | Fisher Scientific | NC9999403 | |
| Petri dish, 100 mm x 15 mm Style | Falcon | 351029 | |
| Sterile cell strainer, 100 μm | Fisherbrand | cat#22363549 |
参考文献
- Tizzano, M., et al. Nasal chemosensory cells use bitter taste signaling to detect irritants and bacterial signals. Proceedings of the National Academy of Sciences of the United States of America. 107 (7), 3210-3215 (2010).
- Genovese, F., Tizzano, M. Microvillous cells in the olfactory epithelium express elements of the solitary chemosensory cell transduction signaling cascade. PLoS One. 13 (9), 0202754(2018).
- Bankova, L. G., et al. The cysteinyl leukotriene 3 receptor regulates expansion of IL-25-producing airway brush cells leading to type 2 inflammation. Science Immunology. 3 (28), (2018).
- Krasteva, G., Canning, B. J., Papadakis, T., Kummer, W. Cholinergic brush cells in the trachea mediate respiratory responses to quorum sensing molecules. Life Sciences. 91 (21-22), 992-996 (2012).
- Nadjsombati, M. S., et al. Detection of Succinate by Intestinal Tuft Cells Triggers a Type 2 Innate Immune Circuit. Immunity. 49 (1), 33-41 (2018).
- von Moltke, J., Ji, M., Liang, H. E., Locksley, R. M. Tuft-cell-derived IL-25 regulates an intestinal ILC2-epithelial response circuit. Nature. 529 (7585), 221-225 (2016).
- Deckmann, K., et al. Bitter triggers acetylcholine release from polymodal urethral chemosensory cells and bladder reflexes. Proceedings of the National Academy of Sciences of the United States of America. 111 (22), 8287-8292 (2014).
- Liu, S., et al. Members of Bitter Taste Receptor Cluster Tas2r143/Tas2r135/Tas2r126 Are Expressed in the Epithelium of Murine Airways and Other Non-gustatory Tissues. Frontiers in Physiology. 8, 849(2017).
- Krasteva, G., et al. Cholinergic chemosensory cells in the auditory tube. Histochemistry and Cell Biology. 137 (4), 483-497 (2012).
- Krasteva, G., et al. Cholinergic chemosensory cells in the trachea regulate breathing. Proceedings of the National Academy of Sciences of the United States of America. 108 (23), 9478-9483 (2011).
- Montoro, D. T., et al. A revised airway epithelial hierarchy includes CFTR-expressing ionocytes. Nature. 560 (7718), 319-324 (2018).
- Plasschaert, L. W., et al. A single-cell atlas of the airway epithelium reveals the CFTR-rich pulmonary ionocyte. Nature. 560 (7718), 377-381 (2018).
- Dwyer, D. F., Barrett, N. A., Austen, K. F. Immunological Genome Project, C. Expression profiling of constitutive mast cells reveals a unique identity within the immune system. Nature Immunology. 17 (7), 878-887 (2016).
- Howitt, M. R., et al. Tuft cells, taste-chemosensory cells, orchestrate parasite type 2 immunity in the gut. Science. 351 (6279), 1329-1333 (2016).
- Bankova, L. G., Dwyer, D. F., Liu, A. Y., Austen, K. F., Gurish, M. F. Maturation of mast cell progenitors to mucosal mast cells during allergic pulmonary inflammation in mice. Mucosal Immunology. 8 (3), 596-606 (2015).
- Rock, J. R., et al. Basal cells as stem cells of the mouse trachea and human airway epithelium. Proceedings of the National Academy of Sciences of the United States of America. 106 (31), 12771-12775 (2009).
- Rock, J. R., et al. Multiple stromal populations contribute to pulmonary fibrosis without evidence for epithelial to mesenchymal transition. Proceedings of the National Academy of Sciences of the United States of America. 108 (52), 1475-1483 (2011).
- Gerbe, F., et al. Intestinal epithelial tuft cells initiate type 2 mucosal immunity to helminth parasites. Nature. 529 (7585), 226-230 (2016).
- Rock, J. R., et al. Transmembrane protein 16A (TMEM16A) is a Ca2+-regulated Cl- secretory channel in mouse airways. Journal of Biological Chemistry. 284 (22), 14875-14880 (2009).
- Olsen, J. V., Ong, S. E., Mann, M. Trypsin cleaves exclusively C-terminal to arginine and lysine residues. Molecular and Cellular Proteomics. 3 (6), 608-614 (2004).
- Verma, S., Dixit, R., Pandey, K. C. Cysteine Proteases: Modes of Activation and Future Prospects as Pharmacological Targets. Frontiers in Pharmacology. 7, 107(2016).
- Huettner, J. E., Baughman, R. W. Primary culture of identified neurons from the visual cortex of postnatal rats. Journal of Neuroscience. 6 (10), 3044-3060 (1986).
- Kaiser, O., et al. Dissociated neurons and glial cells derived from rat inferior colliculi after digestion with papain. PLoS One. 8 (12), 80490(2013).
- Aoyagi, T., Takeuchi, T., Matsuzaki, A., Kawamura, K., Kondo, S. Leupeptins, new protease inhibitors from Actinomycetes. Journal of Antibiotics (Tokyo). 22 (6), 283-286 (1969).
- Kohanski, M. A., et al. Solitary chemosensory cells are a primary epithelial source of IL-25 in patients with chronic rhinosinusitis with nasal polyps. The Journal of Allergy and Clinical Immunology. 142 (2), 460-469 (2018).
- Patel, N. N., et al. Solitary chemosensory cells producing interleukin-25 and group-2 innate lymphoid cells are enriched in chronic rhinosinusitis with nasal polyps. International Forum of Allergy & Rhinology. , (2018).
- Kouzaki, H., O'Grady, S. M., Lawrence, C. B., Kita, H. Proteases induce production of thymic stromal lymphopoietin by airway epithelial cells through protease-activated receptor-2. The Journal of Immunology. 183 (2), 1427-1434 (2009).
- Cambier, J. C., Vitetta, E. S., Kettman, J. R., Wetzel, G. M., Uhr, J. W. B-cell tolerance. III. Effect of papain-mediated cleavage of cell surface IgD on tolerance susceptibility of murine B cells. The Journal of Experimental Medicine. 146 (1), 107-117 (1977).
- Nishikado, H., et al. Cysteine protease antigens cleave CD123, the alpha subunit of murine IL-3 receptor, on basophils and suppress IL-3-mediated basophil expansion. Biochemical and Biophysical Research Communications. 460 (2), 261-266 (2015).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。