Method Article
Aislamiento y evaluación cuantitativa de células de pincel de tráqueas de ratón
En este artículo
Resumen
Las células del cepillo son células epiteliales quimiosensoriales colinérgicas raras que se encuentran en la tráquea de ratón ingenua. Debido a su número limitado, la evaluación ex vivo de su papel funcional en la inmunidad y remodelación de las vías respiratorias es un desafío. Describimos un método para el aislamiento de células de cepillo traqueal por citometría de flujo.
Resumen
Las células del cepillo traqueal son células epiteliales quimiosensoriales colinérgicas a las que se encuentra para transmitir señales desde el lumen de las vías respiratorias al sistema inmunitario y nervioso. Son parte de una familia de células epiteliales quimiosensoriales que incluyen células de mechón en la mucosa intestinal, células de cepillo en la tráquea, y células quimiosensoriales y microvasas solitarias en la mucosa nasal. Las células quimiosensoriales en diferentes compartimentos epiteliales comparten marcadores intracelulares clave y una firma transcripcional central, pero también muestran una heterogeneidad transcripcional significativa, probablemente reflejo del entorno tisular local. Se requiere aislamiento de las células del cepillo traqueal de las suspensiones de una sola célula para definir la función de estas células epiteliales raras en detalle, pero su aislamiento es difícil, potencialmente debido a la estrecha interacción entre las células del cepillo traqueal y las terminaciones nerviosas o debido a la composición específica de las vías respiratorias de uniones apretadas y adheridas. Aquí, describimos un procedimiento para el aislamiento de las células del cepillo del epitelio traqueal del ratón. El método se basa en una separación inicial del epitelio traqueal de la submucosa, lo que permite una posterior incubación más corta de la lámina epitelial con papaína. Este procedimiento ofrece una solución rápida y conveniente para la clasificación citométrica de flujo y el análisis funcional de células de cepillo traqueal viables.
Introducción
Las células de cepillo pertenecen a una clase de células epiteliales quimiosensoriales caracterizadas por la expresión de receptores de sabor amargo y la maquinaria de transducción de receptores de sabor que se encuentra en las células de los paladares. A diferencia de las células de los cogollos de sabor, las células epiteliales quimiosensoriales se dispersan en superficies epiteliales y se conocen como células quimiosensoriales solitarias (SCC) y células microvasas en el epitelio nasal1,2, células de cepillo en la tráquea 3,4, y células de mechón en el intestino5,6. Las células epiteliales que expresan receptores de sabor amargo y la maquinaria de transducción de sabor amargo también se encuentran en la uretra7,8 y el tubo auditivo9. Las células del cepillo de las vías respiratorias tienen funciones únicas en las respuestas neurogénicas e inmunitarias. Son células quimiosensoriales productoras de acetilcolina que evocan reflejos respiratorios protectores tras la activación con compuestos amargos y metabolitos bacterianos como las sustancias de observación de quórum10. Las células de cepillo de las vías respiratorias son también la fuente epitelial dominante dela VÍA respiratoria de IL-25, que regula la inflamación del tipo 2 con aeroallos en las vías respiratorias 3.
La caracterización del transcriptoma completo de las células del cepillo de las vías respiratorias inferiores y su respuesta a los estímulos ambientales se ha visto limitada por su bajo número en el epitelio traqueal y un número muy limitado más allá de los grandes bronquios10. Las técnicas utilizadas para el aislamiento de células quimiosensoriales del epitelio intestinal no han dado resultados proporcionalmente altos de la tráquea, posiblemente debido a los contactos íntimos de las células del cepillo traqueal con terminaciones nerviosas10 u otras factores específicos del tejido en la mucosa respiratoria, como la composición de adheridos y proteínas de unión apretada. Informes recientes de aislamiento exitoso de células de cepillo traqueal en números más altos para el análisis de secuenciación de ARN de una sola célula emplearon una incubación de 2 h con papaína o una incubación de 18 h con pronasa11,12. Dado que las incubaciones más largas con enzimas digestivas pueden disminuir la viabilidad celular y alterar el perfil transcripcional de las células de los tejidos digeridos13,esto podría sesgar el análisis comparativo con otras poblaciones epiteliales quimiosensoriales.
Aquí, informamos de un método para el aislamiento de células de cepillo traqueal para la secuenciación de ARN3. El tratamiento de la tráquea con dosis altas de dosis separa el epitelio de la submucosa. La digestión posterior de la lámina epitelial con papaína permite una excelente recuperación de esta célula estructural.
Protocolo
Antes de llevar a cabo los siguientes experimentos, asegúrese de que todo el uso y protocolos de cuidado animal sean aprobados por el Comité Institucional de Cuidado y Uso de Animales (IACUC) y realizados de acuerdo con la Guíapara el Cuidado y Uso del Consejo Nacional de Investigación Animales de Laboratorio" (8a Edición, 2011) y las directrices de LA ARRIVE. Todos los procedimientos descritos a continuación han sido revisados y aprobados por el Comité Institucional de Cuidado y Uso de Animales en el Brigham and Women's Hospital.
1. Preparación de reactivos
- Preparar la solución de digestión Dispase, que es una solución de PBS que contiene 16 U/ml de dosis y 20 g/ml de DNase I. Asegúrese de que el polvo de dosificación se disuelva completamente antes de calentar la solución en un baño de agua a 37 oC.
- Agregue un 5% de suero bovino fetal (FBS) con inactiva en calor a Dulbecco Modified Eagle Medium (DMEM) para hacer una solución de parada.
- Preparar tampón de Tyrode I: añadir 26 U/ml de papaína (20 l/ml de solución de papaína de 48 U/mg) y 10 l/ml de L-cisteína al tampón de HEPES-Tyrode sin calcio.
- Preparar el tampón Tyrode II: añadir leupeptina de 2 l/ml (5 mg/ml) al tampón de HEPES-Tyrode con calcio.
- Preparar tampón FACS: utilizar la solución de sal equilibrada de Hanks (HBSS) sin calcio, magnesio y rojo fenol, complementado con ácido etilendiaminetetraacético de 2 mM (EDTA) y añadir 2% FBS.
2. Disección de la tráquea de ratón
NOTA: Los ratones utilizados en este protocolo son ChAT(BAC)-eGFP (B6. Cg-Tg(RP23- 268L19-EGFP)2Mik/J), 3-6 meses de edad de ambos sexos. Minimizar la exposición del tejido a la luz directa para reducir el fotoblanqueo de eGFP.
- Eutanasia del ratón con 100 mg/kg de solución de eutanasia pentobarbital inyectada por vía intraperitoneal o utilizando protocolos estándar aprobados por la IACUC.
- Fije el ratón en una placa quirúrgica en la posición supina con agujas de 21 G con las extremidades superiores e inferiores extendidas. Rocíe el pelaje con 70% EtOH para desinfectar el área.
- Con fórceps rectos, levante la piel y el pelaje del abdomen y haga una incisión en el centro con tijeras dissección (tijeras rectas, 3 cm). Con las tijeras, separe la piel del tejido subcutáneo del abdomen a la mandibula. Mientras sostiene el tejido subcutáneo con los fórceps, haga una pequeña incisión con las tijeras en el centro de la pared abdominal.
- Abra el peritoneo con una incisión en forma de V. Con los fórceps, mueva suavemente el intestino delgado hacia un lado, localice la aorta abdominal y la vena cava y haga una incisión con las tijeras disectrizantes para permitir una rápida exsanguinación.
- Localice el diafragma. Con una aguja de 18 G, haga una abertura en el diafragma justo debajo del esternón para desinflar los pulmones. Separe cuidadosamente el diafragma de la caja torácica utilizando tijeras de diselación rectas de punta afilada para cortar a lo largo de la base de las costillas.
- Usando los fórceps, levante el extremo expuesto del esternón y corte el esternón longitudinalmente desde la base de la caja torácica hasta el cuello. Haga una incisión cervical central con tijeras rectas cortas (2 cm) y separe los dos lóbulos de la glándula submandibulular.
- Retire cuidadosamente el tejido conectivo circundante y el timo que cubre la carina con un par de fórceps de alta precisión de punta fina.
- Diseccionar la tráquea libre primero separando el extremo proximal a nivel de la epiglotis y luego diseccionando el extremo distal a nivel de la bifurcación de la tráquea.
- Localice la epiglotis y corte la tráquea longitudinalmente de la epiglotis a la carina.
3. Digestión epitelial traqueal
- Colocar la tráquea en un tubo de 1,5 ml que contenga 750 ml de solución de disipación precalentada (a 37 oC). Incubar en una coctelera a 200 rpm durante 40 min a temperatura ambiente. Cubra el tubo con papel de aluminio para reducir la exposición a la luz directa.
- Añadir 750 ml de DMEM en frío con 5% de FBS para detener la reacción. Colocar en hielo.
- Transfiera la tráquea a una placa Petri (100 mm x 15 mm) y colóquela bajo un microscopio de disección. Orientar la tráquea con el lado epitelial hacia arriba. La tráquea diseccionada longitudinalmente tiene una forma semi-cilíndrica mantenida por los anillos cartilaginosos. El epitelio está en la superficie cóncava.
- Ate el área de epiglotis de la tráquea con fórceps rectos a la placa Petri y usando un bisturí desechable de tamaño 22, raspar el epitelio de la tráquea. La capa epitelial se separa como una hoja translúcida.
- Mince el epitelio con el bisturí. Transfiera la capa epitelial a un tubo de 2 ml.
- Enjuague la placa Petri con 750 ml de tampón Tyrode I y transfiera al tubo de 2 ml que contiene la capa epitelial.
- Incubar la capa epitelial traqueal en tampón Tyrode I durante 30 min a 37 oC en una coctelera a 200 rpm. Cubra el tubo con papel de aluminio para reducir la exposición a la luz directa.
- Añadir 750 l de tampón Tyrode II frío. Vortex el tejido digerido vigorosamente durante 20-30 s. Triturar el homogeneizado con una jeringa unida a una aguja de 18 G 10 veces. Cambie a una aguja de calibre 21 G y triturar 10-20 veces más.
- Filtrar las células a través de un colador de 100 m en un tubo cónico de 50 ml. Agregue 30:1 vol/vol del buffer frío FACS.
- Girar a 350 x g durante 10 min a 4 oC y desechar el sobrenadante. Resuspenda el pellet en tampón FS frío y transfiera la suspensión a un tubo de poliestireno de 12 mm x 75 mm (5 ml). Vuelva a girar a 350 x g durante 10 min a 4 oC y deseche el sobrenadante.
- Vuelva a suspender el pellet en 100 l de búfer FACS.
- Añadir 1 l de anticuerpo de bloqueo antiratón CD16/32 para bloquear la unión no específica e incubar durante 15 minutos sobre hielo. No lavar.
- Añadir los siguientes anticuerpos y los respectivos controles de isotipo: azul pacífico antiratón CD45 o rata IgG2a, k (0,25 g/106 células en volumen de 100 l) y aloficocianina (APC) anti-ratón EpCAM o rata IgG2b, k (0,5 g/106 celdas en volumen de 100 ol) anticuerpos monoclonales. Incubar durante 45 min sobre hielo protegido de la luz directa. Añadir 4,5 ml de tampón DE FACS frío, mezclar y girar a 350 x g durante 10 minutos a 4 oC. Deseche el búfer FACS y vuelva a suspender el pellet en 300 ml de búfer FACS frío.
- Añadir yoduro de propidium (PI) (5 g/ml) inmediatamente antes de la clasificación citométrica de flujo.
NOTA: Las células de pincel tienen una forma irregular con varios procesos que potencialmente podrían aumentar su adherencia a los filtros (Figura3C). Comparamos filtros de 30 mm a 70 mm y 100 mm y encontramos que los filtros de poros más grandes aseguraban mejores rendimientos. Además, la trituración exhaustiva de la suspensión celular después de la digestión de la papaína mejora significativamente el rendimiento de la célula del cepillo. Recomendamos el uso de una aguja de 18G para la trituración inicial seguida de un agujero más pequeño (21 o 23 G aguja) para una disociación más fina de las células.
4. Estrategia de galada de citometría de flujo
- Identifique las células de los escombros por el ángulo de dispersión hacia adelante y hacia los lados. Excluya los dobletes utilizando la altura y la anchura de dispersión hacia delante y la altura y anchura de dispersión lateral. Los dobletes serían las celdas que tienen valores de ancho alto.
- Dentro de las células individuales, identifique las células vivas como la población que es PI negativa.
- Dentro de las celdas individuales vivas, identifique las celdas CD45 de baja a negativa en función del control de isotipo.
- Dentro de las células bajas/negativas CD45, identifique las células positivas EpCAM que también son positivas eGFP (en el canal FITC). Esta es la población de células de pincel (Figura2A).
Resultados
Este procedimiento se ha implementado con éxito para aislar células de cepillo traqueal para la secuenciación de ARN3. Después del aislamiento de la tráquea y ladigestión del tejido con un protocolo de 2 pasos (Figura 1), las células se recogieron y se mancharon con CD45 etiquetado fluorescentemente y EpCAM después de la exclusión de células muertas con PI. Después de hacer dobletes basados en las características de dispersión hacia adelante y lateral, definimos las celdas de pincel como bajas/negativas para CD45, positivas para EpCAM y positivas para eGFP (Figura2A). Las células de pincel representaban entre el 0,16 y el 0,42% de las célulasbaja/neg de CD45 por citometría de flujo y representaban entre 250 y 600 células por tráquea (Figura2B). Comparamos estos recuentos con una estimación del número de células positivas ChAT-eGFP en monturas traqueales enteras de ratones ChAT(BAC)-eGFP basados en nuestra evaluación inmunohistológica extensa publicada de células de cepillo traqueal3 e ilustradas aquí ( Figura 3). Nuestros estudios previos de células de cepillo traqueal en tipo salvaje, ratones ChAT(BAC)-eGFP y ratones Il25F25/F25 sugirieron que las células de cepillo colinérgicas están superpuestas en 90% con DCLK1+ e IL25+ células y cuenta para 600-1000 células de cepillo por tráquea3. En particular, este número es menor que el número de células de cepillo colinérgicas reportadas por otros grupos10. Como los números de células quimiosensoriales se venalterados por la exposición a metabolitos microbianos y protozoos 5,14,estos números podrían reflejar una variabilidad en la microbiota interinstitucional. Por lo tanto, sugerimos estimar el número de células de cepillo mediante microscopía de fluorescencia para medir el número esperado de células de cepillo aisladas por clasificación citométrica de flujo.
Al establecer nuestro protocolo, intentamos varios métodos de aislamiento decélulas quimiosensoriales publicados anteriormente (Figura 4). Cuando incubamos tráquea picada con 650 U/ml de colagenasa IV y 1,84 U/ml de dispensasuplementa suplementada con DNase I durante 45 min, una combinación frecuentemente utilizada para obtener suspensiones de una sola célula de homogeneizados pulmonares15,logramos una sola suspensión celular de células epiteliales, pero recuperamos sólo algunas células de cepillo (Figura4A). Las células tuft en el intestino se han aislado con éxito utilizando EDTA de 2,5 mM y 0,75 mM de ditiothreitol (TDT) con DNase I durante 20 minutos para desalojar las células epiteliales seguidas de la digestión de las células epiteliales liberadas con 0,01 U/ml de dispensación con DNaseI durante 10 minutos 6. En nuestras manos, el uso de este procedimiento también condujo a la recuperación subóptima de la célula del cepillo traqueal (Figura4B). Krasteva et al.10 describió un protocolo para el aislamiento exitoso de células de cepillo traqueal para el análisis de ARN. Siguiendo este protocolo, incubamos tráquea picada con 35 U/ml de papaína en tampón De tyrode durante 45 min y no logramos una buena recuperación de células de cepillo (Figura4C). Rock et al. describió un método de digestión del epitelio traqueal para el aislamiento de células basales con dos pasos: separación del epitelio de la capa mesenquimal con dosis altas de dosis (16 U/ml) a temperatura ambiente seguido de incubación del epitelio despojado con 0,1 % de trippsina y 1,6 mM de EDTA durante 30 min a 37oC16. Siguiendo estos pasos condujo a una mejor recuperación de las celdas de pincel, pero los números alcanzados por ratón fueron insuficientes para análisis funcionales en profundidad (Figura4D). Para optimizar el protocolo, decidimos combinar los dos últimos enfoques. Al separar el epitelio traqueal con una dosis alta de dosis, nuestro objetivo era permitir un mejor acceso de la papaína a las células del cepillo traqueal. Por lo tanto, el uso de 16 U/ml de dispensa a temperatura ambiente en toda la tráquea para separar el epitelio y la posterior incubación del epitelio con 26 U/ml de papaína en tampón de tyrode condujo a la mejor recuperación de células de cepillo (Figura4E).

Figura 1 : Esquema de los pasos propuestos para el aislamiento de células de cepillo traqueal. El protocolo incluye 2 pasos principales: después de la disección, toda la tráquea se incuba en una solución de dosis alta para separar el epitelio; esto es seguido por la digestión de la lámina epitelial con papaína en calcio que contiene tampón de tirado (Tyrode I) y tinción de anticuerpos. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2 : Análisis representativo de citometría de flujo de células de cepillo traqueal. (A). Representación esquemática de la estrategia de gating de citometría de flujo. Las células individuales fueron cerradas en función de sus características de dispersión hacia adelante y lateral y las células vivas fueron elegidas en función de la exclusión del yoduro de Propidium. Las células bajas/negativas CD45 se eligieron en función del control de isotipos y se evaluaron para su expresión de EpCAM. Las células positivas de EpCAM se consideraban células de cepillo si expresaban eGFP fluorescente en el canal FITC. (B). Número de células de cepillo traqueal colinérgicos por tráquea y frecuencia de ratón presentadas como porcentaje de todas las célulasbajas/- CD45 y como porcentaje de células CD45bajas/-EpCAM+. Cada punto representa un mouse independiente. Los datos son de 3 experimentos separados con 2-3 ratones cada uno. (C). Ausencia de células de cepillo positivo eGFP en un digestión epitelial traqueal de un ratón de tipo salvaje teñido para CD45 y EpCAM. Haga clic aquí para ver una versión más grande de esta figura.
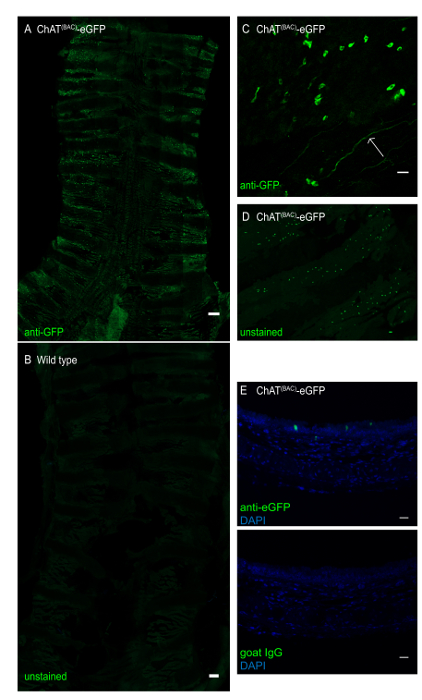
Figura 3 : Montaje completo de la tráquea del ratón de un ratón ChAT(BAC)-eGFP. La tráquea se abrió longitudinalmente y se tiñó con anticuerpos anti-GFP para mejorar la señal de fluorescencia verde eGFP. (A) Montaje traqueal entero del ratón ChAT(BAC)-eGFP, las células fluorescentes intensamente verdes representan células de pincel; barra de escala 1 mm; (B) montaje traqueal entero de un ratón de tipo salvaje que demuestra la ausencia de células de cepillo; Barra de escala de 1 mm; (C) aumento de la capa epitelial que demuestra células de cepillo de forma irregular (células verdes) así como una terminación del nervio colinérgico (flecha); (D) montaje traqueal completo de una tráquea de un ChAT(BAC)-eGFP con imagen para GFP sin mejora de anticuerpos de la señal de fluorescencia; (E) sección transversal de una tráquea de ratón incrustada en parafina de un ratón ChAT(BAC)-eGFP teñido con control IgG anti-GFP (verde) o caprino y DAPI (azul); Barras de escala a 20 m (C-E). Haga clic aquí para ver una versión más grande de esta figura.

Figura 4 : Comparación de diferentes protocolos de digestión traqueal. (A) La tráquea fue picada e incubada con 650 U/ml de colagenasa IV y 1,84 U/ml de dispensa suplementada con DNase I durante 45 min. Este experimento se repitió 2 veces. (B) Toda la tráquea fue incubada con 2,5 mM EDTA y 0,75 mM de TDT suplementada con DNase I durante 20 min; las células epiteliales fueron desalojadas y digeridas con 0.01 U/ml de dispensa ción y DNase I durante 10 min. Este experimento se repitió 2 veces. (C) La tráquea fue picada e incubada con 35 U/ml de papaína en tampón Tyrode I durante 45 min; la actividad residual de la papaína se inhibió con la leupeptina. Este experimento se realizó una vez. (D) Toda la tráquea se incuba con dosis altas de dosis de dosis (16 U/ml) durante 30 minutos para separar la lámina epitelial, seguida de la incubación de la lámina epitelial con 0,1% de trippsina y 1,6 mM de EDTA durante 30 min. Este experimento se repitió 2 veces. (E). Toda la tráquea se incuba con dosis altas de dosis de dosis (16 U/ml) durante 30 minutos seguida de la digestión de la lámina epitelial con 26 U/ml de papaína en tampón de Tyrode durante 30 min. La actividad residual de la papaína se inhibió con leupeptina y dilución de alto volumen. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Encontramos que una combinación de tratamiento de dosis altas durante 40 minutos seguido de un tratamiento corto con papaína (30 min) proporciona un protocolo óptimo para la digestión traqueal y el aislamiento de células de cepillo. Esta combinación evita una digestión extensa y produce el mayor rendimiento de células de cepillo, en comparación con los protocolos alternativos.
Mientras que la digestión pulmonar para extraer células hematopoyéticas se ha basado clásicamente en enzimas digestivas leves como la colagenasa IV15, el aislamiento de las células epiteliales requiere protocolos más complejos. Las suspensiones de células únicas de las células epiteliales son más difíciles de lograr debido a las uniones apretadas y adheridas que las unen entre sí y la membrana del sótano y debido a la fragilidad de las propias células. La mayoría de los protocolos para la digestión de células epiteliales implican dos pasos - un primer paso es la separación del epitelio de la membrana del sótano seguido de pasos posteriores para perturbar las uniones apretadas y los desmósomas que se adhieren a las células epiteliales entre sí 16 , 17.
Varios grupos han aislado con éxito células quimiosensoriales del intestino utilizando diferentes modificaciones de un protocolo de 2 pasos para el aislamiento de células epiteliales: el primer paso utiliza EDTA y TDT para liberar células epiteliales de la submucosa seguido de digestión de las láminas epiteliales con dispensa. Howitt et al. utilizaron una mezcla de 5 mM EDTA + 1 mM de TDT seguida de digestión con 0,5 unidades/ml de disipación II y DNase14. Gerbe et al. utiliza bachillerato de alta concentración 30 mM EDTA solo para separar la fracción epitelial y posteriormente incubado con dispensa suplementada con DNaseI18. Von Moltke et al. utilizaron 2,5 mM EDTA, 0,75 mM de TDT y DNaseI seguidos de disiasción de digestión6. Encontramos que estas técnicas permiten el aislamiento de células epiteliales viables en la tráquea, pero el porcentaje de células de cepillo traqueal fue extremadamente bajo (Figura4B)y no es consistente con nuestra expectativa de aislamiento de 600-800 células de cepillo por tráquea basada en nuestra evaluación histológica.
Varios grupos han desarrollado protocolos de aislamiento de células epiteliales traqueales para estudiar las células epiteliales basales. Las principales diferencias entre estos protocolos y los empleados en el intestino están en la secuencia de enzimas digestivas. El primer paso es la separación del epitelio traqueal a través de la incubación con una alta concentración de dispensa (16 U/ml) a temperatura ambiente16. Esto permite que el epitelio se separe como una sola hoja de la capa mesenquimal19. El procesamiento posterior del epitelio traqueal utiliza una combinación de tripsina y EDTA, uno de los métodos enzimáticos más utilizados de desprendimiento celular, para lograr una suspensión de una sola célula. La trippsina corta los péptidos en el lado C-terminal de los residuos de lisina y aminoácidos de arginina, mientras que EDTA se utiliza como un quelante de calcio para las interacciones células y células-matriz20. Usando esta técnica, Rock et al. han tenido éxito en la recuperación de células epiteliales basales para el perfil transcripcional16. Recientemente se utilizó un protocolo similar para aislar el receptor de sabor amargo que expresa células de un reportero de eGFP impulsado por Tas2r143-CreERT2 y de B6. Il25Flare25/Flare25 para estudios de secuenciación de ARN5,8. En nuestra experiencia, la digestión de la lámina epitelial con tripsina y EDTA condujo a una excelente recuperación de células epiteliales, pero un número insuficiente de células de cepillo traqueal colinérgicas para análisis funcionales o transcripcionales a menos que varios ratones se agruparan para cada muestra(Figura 4C).
La papaína es una potente planta endolítica de cisteína proteasa derivada del látex de papaya, y se sabe que se cortan los enlaces peptídicos que implican aminoácidos básicos, particularmente arginina, lisina y residuos después de la fenilalanina21. Krasteva et al10informó por primera vez el aislamiento de células de cepillo traqueal utilizando papaína de ratones ChAT(BAC)-eGFP. La digestión de la papaína también se utilizó recientemente para disociar las células epiteliales de las vías respiratorias para la secuenciación de ARN de células únicas, donde las células de cepillo/mechón comprendieron una pequeña fracción de células epiteliales11. La papaína es también la enzima más utilizada para la digestión del tejido cerebral para el aislamiento de las neuronas viables22. La disociación del tejido cerebral con papaína durante 30 min da como resultado rendimientos notablemente más altos, supervivencia neuronal e integridad en comparación con la digestión de trippsina23. Dado que algunas células del cepilloestán estrechamente entrelazadas con las terminaciones nerviosas 3,10, el uso de papaína podría ser crítico para el escote exitoso de las uniones celulares del cepillo a las neuronas. Sin embargo, encontramos que una digestión de 45 minutos con papaína a una concentración de 35-40 U/ml redujo drásticamente la viabilidad de las células epiteliales, lo que llevó a una recuperación celular de cepillo baja (Figura4D).
Utilizamos 3 métodos para reducir la toxicidad de la papaína y aumentar nuestros rendimientos celulares. En primer lugar, al separar la lámina epitelial con la dispensación, redujimos el tiempo de incubación posterior de la papaína de 45 a 30 min. En segundo lugar, inmediatamente inhibimos la actividad de la papaína con leupeptina, un inhibidor de las proteasas de cisteína24. En particular, la leupeptina es altamente inestable a 4 oC y debe estar alícuota y congelada a -20 oC. En tercer lugar, encontramos que la dilución del tejido enzimáticamente digerido en un gran volumen de PBS frío también ayuda a preservar la viabilidad de las células digeridas. Otro paso que es fundamental para aumentar el rendimiento celular es la rigurosa trituración10. Dado que el vórtice prolongado también podría disminuir la viabilidad, lo sustituimos parcialmente por la trituración. Recomendamos la trituración con una aguja de 18G para disociar grumos celulares más grandes seguidos de trituración adicional con una aguja de 21 G. Por último, descubrimos que eGFP es altamente sensible a la luz y la protección contra la exposición directa a la luz en cualquier paso es útil. Estas modificaciones permitieron una recuperación robusta de células de cepillo traqueal viables (Figura4E).
Las principales limitaciones del protocolo propuesto aquí son el procedimiento de 2 pasos y el uso de papaína, una potente proteasa de cisteína. Algunos grupos han sustituido recientemente la liberación por la dosis5 cuando se aíslan las células quimiosensoriales. Además, la digestión liberasa se utilizó recientemente para aislar células epiteliales quimiosensoriales (cepillos) de pólipos nasales25,26. No hemos comparado directamente la digestión con nuestro protocolo de digestión de dos pasos. La papaína es una potente proteasa de cisteína que puede activar el receptor activado por proteasa PAR2 en las células epiteliales27 que conduce a la activación de las células del cepillo ellos mismos o a la generación de mediadores por otras células respiratorias que a su vez podrían activar la células de cepillo. Por último, la papaína puede modular la expresión del receptor a través de la escisión de los receptores de superficie, lo que dificulta la validación de la expresión del receptor de células de cepillo mediante la citometría de flujo28,29.
En resumen, proporcionamos un protocolo de aislamiento de células de cepillo colinérgicas traqueales de ratones reportero ChAT-eGFP que permite una recuperación robusta de células de cepillo traqueal viables. Este protocolo se ha utilizado con éxito para el aislamiento y el análisis transcripcional de células de cepillo por secuenciación de ARN3.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Agradecemos a Adam Chicoine en el Centro de Inmunología Humana de Brigham and Women's Flow Core por su ayuda con la clasificación citométrica de flujo. Este trabajo fue apoyado por los Institutos Nacionales de Subvenciones sanitarias R01 HL120952 (N.A.B.), R01 AI134989 (N.A.B), U19 AI095219 (N.A.B., L.G.B), y K08 AI132723 (L.G.B), y por la Academia Estadounidense de Alergia, Asma e Inmunología (AAAAI) / Alergia Pulmonar Americana Premio a la Enfermedad Respiratoria (N.A.B.), por el Premio de Desarrollo Docente de la Fundación AAAAI (L.G.B.), por el Premio Steven y Judy Kaye Young Innovators (N.A.B.), por el Fondo Joycelyn C. Austen para el Desarrollo Profesional de Mujeres Científicas Médicas (L.G.B.), y por un generosa donación de la familia Vinik (L.G.B.).
Materiales
| Name | Company | Catalog Number | Comments |
| Antibodies | |||
| Anti-GFP (Polyclonal goat Ig) | Abcam | cat# ab5450 | |
| APC anti-mouse CD326 (EpCAM) (G8.8) | Biolegend | cat#118214 | |
| APC Rat IgG2a, k isotype control | Biolegend | cat#400511 | |
| DAPI | Biolegend | cat#422801 | |
| Donkey anti-goat IgG (H+L) Highly Cross-Adsorbed Secondary Antibody, Alexa Fluor 488 | Life Technologies/Molecular Probes | cat#A-11055 | |
| Normal Goat IgG | R&D Systems | cat#AB-108-C | |
| Pacific Blue anti-mouse CD45 (30F-11) | Biolegend | cat#103126 | |
| Pacific Blue Rat IgG2b, k isotype control | Biolegend | cat#400627 | |
| TruStain FcX (anti-mouse CD16/32) Antibody | Biolegend | cat#101320 | |
| Chemicals, Peptides, and Recombinant Proteins | |||
| Dispase | Gibco | cat# 17105041 | |
| DNase I | Sigma | cat# 10104159001 | |
| HEPES-Tyrode’s Buffer Without Calcium (10 mM HEPES, 135 mM NaCl, 2.8 mM KCl, 1 mM MgCl2, 12 mM NaHCO3, 0.4 mM NaH2PO4, 0.25% BSA, 5.5 mM Glucose. Prepared in 18.2 megohms water and filtered through 0.22 µm filter | Boston BioProducts | cat# PY-912 | |
| Tyrode’s Solution (HEPES-Buffered) 140 mM NaCl, 5 mM KCl, 25 mM HEPES, 2 mM CaCl2, 2 mM MgCl2 and 10 mM glucose. Prepared in 18.2 megohms water and filtered through 0.22 µm filter. ) | Boston BioProducts | cat# BSS-355 | |
| L-Cysteine | Sigma | cat# C7352 | |
| Leupeptin trifluoroacetate salt | Sigma | cat# L2023 | |
| Papain from papaya latex | Sigma | cat# P3125 | |
| Propidium iodide | Sigma | cat# P4170 | |
| Experimental Models: Organisms/Strains | |||
| ChATBAC-eGFP (B6.Cg-Tg(RP23-268L19-EGFP)2Mik/J) | The Jackson Laboratory | 7902 | |
| Equipment | |||
| LSM 800 with Airyscan confocal system on a Zeiss Axio Observer Z1 Inverted Microscope | Zeiss | ||
| LSRFortessa | BD | 647465 | |
| Disposable equipment | |||
| 1.5 mL sterile tubes | Thomas Scientific | 1157C86 | |
| 5 mL Poysterene Round-bottom Tube, 12 mm x 75 mm style | Falcon | 14-959-1A | |
| 50 mL Polypropylene conical tube, 30 mm x 115 mm style | Falcon | 352098 | |
| Feather Disposable Scalpel no.12 | Fisher Scientific | NC9999403 | |
| Petri dish, 100 mm x 15 mm Style | Falcon | 351029 | |
| Sterile cell strainer, 100 μm | Fisherbrand | cat#22363549 |
Referencias
- Tizzano, M., et al. Nasal chemosensory cells use bitter taste signaling to detect irritants and bacterial signals. Proceedings of the National Academy of Sciences of the United States of America. 107 (7), 3210-3215 (2010).
- Genovese, F., Tizzano, M. Microvillous cells in the olfactory epithelium express elements of the solitary chemosensory cell transduction signaling cascade. PLoS One. 13 (9), 0202754(2018).
- Bankova, L. G., et al. The cysteinyl leukotriene 3 receptor regulates expansion of IL-25-producing airway brush cells leading to type 2 inflammation. Science Immunology. 3 (28), (2018).
- Krasteva, G., Canning, B. J., Papadakis, T., Kummer, W. Cholinergic brush cells in the trachea mediate respiratory responses to quorum sensing molecules. Life Sciences. 91 (21-22), 992-996 (2012).
- Nadjsombati, M. S., et al. Detection of Succinate by Intestinal Tuft Cells Triggers a Type 2 Innate Immune Circuit. Immunity. 49 (1), 33-41 (2018).
- von Moltke, J., Ji, M., Liang, H. E., Locksley, R. M. Tuft-cell-derived IL-25 regulates an intestinal ILC2-epithelial response circuit. Nature. 529 (7585), 221-225 (2016).
- Deckmann, K., et al. Bitter triggers acetylcholine release from polymodal urethral chemosensory cells and bladder reflexes. Proceedings of the National Academy of Sciences of the United States of America. 111 (22), 8287-8292 (2014).
- Liu, S., et al. Members of Bitter Taste Receptor Cluster Tas2r143/Tas2r135/Tas2r126 Are Expressed in the Epithelium of Murine Airways and Other Non-gustatory Tissues. Frontiers in Physiology. 8, 849(2017).
- Krasteva, G., et al. Cholinergic chemosensory cells in the auditory tube. Histochemistry and Cell Biology. 137 (4), 483-497 (2012).
- Krasteva, G., et al. Cholinergic chemosensory cells in the trachea regulate breathing. Proceedings of the National Academy of Sciences of the United States of America. 108 (23), 9478-9483 (2011).
- Montoro, D. T., et al. A revised airway epithelial hierarchy includes CFTR-expressing ionocytes. Nature. 560 (7718), 319-324 (2018).
- Plasschaert, L. W., et al. A single-cell atlas of the airway epithelium reveals the CFTR-rich pulmonary ionocyte. Nature. 560 (7718), 377-381 (2018).
- Dwyer, D. F., Barrett, N. A., Austen, K. F. Immunological Genome Project, C. Expression profiling of constitutive mast cells reveals a unique identity within the immune system. Nature Immunology. 17 (7), 878-887 (2016).
- Howitt, M. R., et al. Tuft cells, taste-chemosensory cells, orchestrate parasite type 2 immunity in the gut. Science. 351 (6279), 1329-1333 (2016).
- Bankova, L. G., Dwyer, D. F., Liu, A. Y., Austen, K. F., Gurish, M. F. Maturation of mast cell progenitors to mucosal mast cells during allergic pulmonary inflammation in mice. Mucosal Immunology. 8 (3), 596-606 (2015).
- Rock, J. R., et al. Basal cells as stem cells of the mouse trachea and human airway epithelium. Proceedings of the National Academy of Sciences of the United States of America. 106 (31), 12771-12775 (2009).
- Rock, J. R., et al. Multiple stromal populations contribute to pulmonary fibrosis without evidence for epithelial to mesenchymal transition. Proceedings of the National Academy of Sciences of the United States of America. 108 (52), 1475-1483 (2011).
- Gerbe, F., et al. Intestinal epithelial tuft cells initiate type 2 mucosal immunity to helminth parasites. Nature. 529 (7585), 226-230 (2016).
- Rock, J. R., et al. Transmembrane protein 16A (TMEM16A) is a Ca2+-regulated Cl- secretory channel in mouse airways. Journal of Biological Chemistry. 284 (22), 14875-14880 (2009).
- Olsen, J. V., Ong, S. E., Mann, M. Trypsin cleaves exclusively C-terminal to arginine and lysine residues. Molecular and Cellular Proteomics. 3 (6), 608-614 (2004).
- Verma, S., Dixit, R., Pandey, K. C. Cysteine Proteases: Modes of Activation and Future Prospects as Pharmacological Targets. Frontiers in Pharmacology. 7, 107(2016).
- Huettner, J. E., Baughman, R. W. Primary culture of identified neurons from the visual cortex of postnatal rats. Journal of Neuroscience. 6 (10), 3044-3060 (1986).
- Kaiser, O., et al. Dissociated neurons and glial cells derived from rat inferior colliculi after digestion with papain. PLoS One. 8 (12), 80490(2013).
- Aoyagi, T., Takeuchi, T., Matsuzaki, A., Kawamura, K., Kondo, S. Leupeptins, new protease inhibitors from Actinomycetes. Journal of Antibiotics (Tokyo). 22 (6), 283-286 (1969).
- Kohanski, M. A., et al. Solitary chemosensory cells are a primary epithelial source of IL-25 in patients with chronic rhinosinusitis with nasal polyps. The Journal of Allergy and Clinical Immunology. 142 (2), 460-469 (2018).
- Patel, N. N., et al. Solitary chemosensory cells producing interleukin-25 and group-2 innate lymphoid cells are enriched in chronic rhinosinusitis with nasal polyps. International Forum of Allergy & Rhinology. , (2018).
- Kouzaki, H., O'Grady, S. M., Lawrence, C. B., Kita, H. Proteases induce production of thymic stromal lymphopoietin by airway epithelial cells through protease-activated receptor-2. The Journal of Immunology. 183 (2), 1427-1434 (2009).
- Cambier, J. C., Vitetta, E. S., Kettman, J. R., Wetzel, G. M., Uhr, J. W. B-cell tolerance. III. Effect of papain-mediated cleavage of cell surface IgD on tolerance susceptibility of murine B cells. The Journal of Experimental Medicine. 146 (1), 107-117 (1977).
- Nishikado, H., et al. Cysteine protease antigens cleave CD123, the alpha subunit of murine IL-3 receptor, on basophils and suppress IL-3-mediated basophil expansion. Biochemical and Biophysical Research Communications. 460 (2), 261-266 (2015).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados