Method Article
Isolamento e valutazione quantitativa delle celle pennello dalle trachea del topo
In questo articolo
Riepilogo
Le cellule pennello sono rare cellule epiteliali colinergiche chesidiche che si trovano nella trachea del topo ingenuo. A causa del loro numero limitato, la valutazione ex vivo del loro ruolo funzionale nell'immunità e nel rimodellamento delle vie aeree è impegnativa. Descriviamo un metodo per l'isolamento delle cellule del pennello tracheale dalla citometria di flusso.
Abstract
Le cellule pennello tracheali sono cellule epiteliali colinergiche pronte a trasmettere segnali dal lume delle vie aeree al sistema immunitario e nervoso. Fanno parte di una famiglia di cellule epiteliali chemiosensoriali che includono cellule del ciuffo nella mucosa intestinale, cellule pennello nella trachea, e cellule chemiosensoriali solitarie e microvillous nella mucosa nasale. Le cellule chemiosensoriali in diversi compartimenti epiteliali condividono marcatori intracellulari chiave e una firma trascrizionale di base, ma mostrano anche una significativa eterogeneità trascrizionale, probabilmente riflettente dell'ambiente del tessuto locale. L'isolamento delle cellule del pennello tracheale dalle sospensioni a cella singola è necessario per definire in dettaglio la funzione di queste rare cellule epiteliali, ma il loro isolamento è impegnativo, potenzialmente a causa della stretta interazione tra le cellule del pennello tracheale e le terminazioni nervose o a causa della composizione specifica delle vie aeree di giunzioni strette e aderenti. Qui, descriviamo una procedura per l'isolamento delle cellule pennello dall'epitelio tracheale del topo. Il metodo si basa su una separazione iniziale dell'epitelio tracheale dalla sottomucosa, consentendo una successiva incubazione più breve del foglio epiteliale con papaina. Questa procedura offre una soluzione rapida e conveniente per lo smistamento citometrico del flusso e l'analisi funzionale delle cellule pennello tracheale vitali.
Introduzione
Le cellule pennello appartengono a una classe di cellule epiteliali chemiosensoriali caratterizzate dall'espressione di recettori del gusto amaro e dal meccanismo di trasduzione del recettore del gusto presente nelle cellule delle papille gustative. A differenza delle cellule epiteliali chemiosensoriali, le cellule epiteliali chemiosensoriali sono sparse in superfici epiteliali e sono indicate come cellule chemiosensoriali solitarie (SCC) e cellule microvinili nell'epitelio nasale1,2, cellule pennello nel trachea 3,4, e cellule di ciuffo nell'intestino5,6. Le cellule epiteliali che esprimono recettori del gusto amaro eil meccanismo di trasduzione amara si trovano anche nell'uretra 7,8 e nel tubo uditivo9. Le cellule pennello delle vie aeree hanno funzioni uniche nelle risposte neurogeniche e immunitarie delle vie aeree. Sono cellule chemiosensoriali che producono acetilcolina che evocano riflessi respiratori protettivi dopo l'attivazione con composti amari e metaboliti batterici come sostanze di quorum-sensing10. Le cellule pennello delle vie aeree sono anche la fonte epiteliale delle vie aeree di IL-25, che regola l'infiammazione di tipo 2 aeroallergened nelle vie respiratorie3.
La caratterizzazione del trascrittoma completo delle cellule pennello delle vie aeree inferiori e la loro risposta agli stimoli ambientali è stata limitata dal loro basso numero nell'epitelio tracheale e da un numero molto limitato oltre il grande bronchi10. Le tecniche utilizzate per l'isolamento delle cellule chemiosensoriali dall'epitelio intestinale non hanno prodotto numeri proporzionalmente elevati dalla trachea, probabilmente a causa dei contatti intimi delle cellule pennello tracheale con terminazioni nervose10 o altro fattori specifici del tessuto nella mucosa respiratoria come la composizione di aderesi e proteine di giunzione strette. Recenti rapporti di isolamento riuscito delle cellule pennello tracheale in numero maggiore per l'analisi di sequenziamento di RNA a singola cellula hanno impiegato un'incubazione di 2 h con papaina o un'incubazione di 18 h con prosiano11,12. Poiché incubazioni più lunghe con enzimi digestivi possono diminuire la vitalità cellulare e alterare il profilo trascrizionale delle cellule dai tessuti digeriti13, questo potrebbe bias comparativa analisi con altre popolazioni epiteliali chemiosensoriali.
Qui, segnaliamo un metodo per l'isolamento delle cellule del pennello tracheale per il sequenziamento dell'RNA3. Il trattamento della trachea con dispase ad alto dosaggio separa l'epitelio dalla submucosa. La successiva digestione del foglio epiteliale con papaina consente un eccellente recupero di questa cellula strutturale.
Protocollo
Prima di condurre i seguenti esperimenti, assicurarsi che tutti gli usi e i protocolli per la cura degli animali siano approvati dall'Institutional Animal Care and Use Committee (IACUC) e siano eseguiti in accordo con la "Guida per la cura e l'uso di Laboratory Animals" (8a edizione 2011) e le linee guida DI ARRIVE. Tutte le procedure descritte di seguito sono state riviste e approvate dal Comitato istituzionale per la cura e l'uso degli animali presso il Brigham and Women's Hospital.
1. Preparazione dei reagenti
- Preparare la soluzione di digestione Dispase, che è una soluzione PBS che contiene 16 U/mL dispase e 20 g/mL DNase I. Assicurarsi che la polvere didispasi sia completamente dissolta prima di riscaldare la soluzione in un bagno d'acqua a 37 gradi centigradi.
- Aggiungere il 5% di siero bovino fetale inattivato dal calore (FBS) a Dulbecco Modified Eagle Medium (DMEM) per una soluzione di arresto.
- Preparare il buffer Tyrode I: aggiungere 26 U/mL di papaina (20 l/mL di soluzione papaina 48 U/mg) e 10 l/mL L-cisteina al buffer di HEPES-Tyrode senza calcio.
- Preparare il buffer Tyrode II: aggiungere 2 leupeptina l/mL (5 mg/mL) al buffer di HEPES-Tyrode con calcio.
- Preparare il buffer FACS: utilizzare la soluzione di sale equilibrato di Hanks (HBSS) senza calcio, magnesio e rosso fenolo, integrato con 2 mM di acido etileminamineaminetracetracetica (EDTA) e aggiungere 2% FBS.
2. Dissezione di Trachea del topo
NOT: I topi utilizzati in questo protocollo sono ChAT(BAC)-eGFP (B6. Cg-Tg(RP23- 268L19-EGFP)2Mik/J), 3-6 mesi di età di entrambi i sessi. Ridurre al minimo l'esposizione del tessuto alla luce diretta per ridurre il fotosbiancamento di eGFP.
- Eutanasia del topo con 100 mg/kg soluzione di eutanasia pentobarbitale iniettata intraperiti al tempo o utilizzando protocolli standard approvati dall'IACUC.
- Fissare il mouse su una scheda chirurgica in posizione supina con 21 G aghi con estremità superiori e inferiori estese. Spruzzare la pelliccia con il 70% di EtOH per sanificare l'area.
- Utilizzando pinze dritte, sollevare la pelle e la pelliccia dell'addome e fare un'incisione al centro con forbici dissecistrici (forbici dritte, 3 cm). Utilizzando le forbici, separare la pelle dal tessuto sottocutaneo dall'addome alla mandibula. Tenendo il tessuto sottocutaneo con le pinze, fare una piccola incisione con le forbici al centro della parete addominale.
- Aprire il peritoneo con un'incisione a forma di V. Utilizzando le pinze, spostare delicatamente l'intestino tenue di lato, individuare l'aorta addominale e vena cava e fare un'incisione con le forbici dissetanti per consentire una rapida esanguinazione.
- Individuare il diaframma. Utilizzando un ago da 18 G, fare un'apertura nel diaframma appena sotto lo sterno per sgonfiare i polmoni. Separare con cura il diaframma dalla gabbia toracica utilizzando forbici dritte appuntite per tagliare lungo la base delle costole.
- Utilizzando le pinze, sollevare l'estremità esposta dello sterno e tagliare lo sterno longitudinalmente dalla base della gabbia toracica al collo. Fare un'incisione cervicale centrale con forbici corte dritte (2 cm) e separare i due lobi della ghiandola submandibolare.
- Rimuovere con attenzione il tessuto connettivo circostante e il timo sovrastante la carina con un paio di pinze ad alta precisione punto fine.
- Assottigliare la trachea libera prima separando l'estremità prossimale a livello dell'epiglottide e poi sezionando l'estremità distale a livello della biforcazione della trachea.
- Individuare l'epiglottide e tagliare la trachea longitudinalmente dall'epiglottide alla carina.
3. Digestione epiteliale tracheale
- Collocare la trachea in un tubo da 1,5 mL contenente 750 l di soluzione di disgestione dispasi preriscaldata (a 37 gradi centigradi). Incubare su uno shaker a 200 rpm per 40 min a temperatura ambiente. Coprire il tubo con un foglio di alluminio per ridurre l'esposizione alla luce diretta.
- Aggiungere 750 l di DMEM freddo con 5% FBS per fermare la reazione. Mettere sul ghiaccio.
- Trasferire la trachea in un piatto Petri (100 mm x 15 mm) e metterla al microscopio dissettivo. Orientare la trachea con il lato epiteliale rivolto verso l'alto. La trachea sezionata longitudinale ha una forma semi-cilindrica mantenuta dagli anelli cartilagine. L'epitelio è sulla superficie concava.
- Legare l'area di epiglottide della trachea con pinze dritte al piatto Petri e utilizzando un bisturi monouso taglia 22, raschiare l'epitelio dalla trachea. Lo strato epiteliale si separa come un foglio traslucido.
- Mitare l'epitelio con il bisturi. Trasferire lo strato epiteliale in un tubo da 2 mL.
- Sciacquare il piatto Petri con 750 tamponanti di Tyrode I e trasferirlo al tubo da 2 mL contenente lo strato epiteliale.
- Incubare lo strato epiteliale tracheale nel buffer Tyrode I per 30 min a 37 gradi centigradi su uno shaker a 200 giri/m. Coprire il tubo con un foglio di alluminio per ridurre l'esposizione alla luce diretta.
- Aggiungere 750 l di tampone freddo Tyrode II. Vortice il tessuto digerito vigorosamente per 20-30 s. Triturare l'omogeneità con una siringa attaccata ad un ago 18 G 10 volte. Passare a un ago calibro 21 G e triturare 10-20 più volte.
- Filtrare le cellule attraverso un colino da 100 m in un tubo conico da 50 ml. Aggiungere 30:1 vol/vol di freddo FACS buffer.
- Girare a 350 x g per 10 min a 4 gradi centigradi e scartare il super-natante. Risospendere il pellet nel buffer FACS freddo e trasferire la sospensione in un tubo di polistirolo da 12 mm x 75 mm (5 mL). Girare di nuovo a 350 x g per 10 min a 4 gradi centigradi e scartare il supernatante.
- Sospendere nuovamente il pellet in 100 o L di BUFFER FACS.
- Aggiungere 1 l'anticorpo anti-topo cd16/32 per bloccare il legame non specifico e incubare per 15 min sul ghiaccio. Non lavare.
- Aggiungere i seguenti anticorpi e i rispettivi controlli isotipi: pacific blue anti-mouse CD45 o ratto IgG2a, k (0,25 g/106 cellule in 100 volume) e l'allophycocyanin (APC) anti-topo EpCAM o ratto IgG2b, k (0,5 g/106 cellule in volume 100) anticorpi monoclonali. Incubare per 45 min sul ghiaccio protetto dalla luce diretta. Aggiungere 4,5 mL di tampone FACS freddo, mescolare e girare a 350 x g per 10 min a 4 gradi centigradi. Eliminare il buffer FACS e sospendere nuovamente il pellet in 300 - L di buffer FACS a freddo.
- Aggiungere lo iodide di propidio (PI) (5 g/mL) immediatamente prima dello smistamento citometrico del flusso.
NOT: Le celle pennello hanno una forma irregolare con diversi processi che potrebbero potenzialmente aumentare la loro aderenza ai filtri (Figura 3C). Abbiamo confrontato filtri da 30 mm a filtri da 70 e 100 mm e abbiamo scoperto che i filtri dei pori più grandi garantivano una resa migliore. Inoltre, la triturazione completa della sospensione cellulare dopo la digestione della papaina migliora significativamente le rese delle cellule pennello. Si consiglia di utilizzare un ago 18G per la triturazione iniziale seguito da un foro più piccolo (21 o 23 G ago) per una dissociazione più fine delle cellule.
4. Strategia di flusso cytometry Gating
- Identificare le celle dai detriti in base all'angolo di dispersione in avanti e laterale. Escludere i doppietti utilizzando l'altezza e la larghezza della dispersione in avanti e l'altezza e la larghezza della dispersione laterale. I doppi sono le celle con valori di larghezza elevata.
- All'interno delle singole celle, identificare le cellule vive come la popolazione che è PI negativo.
- All'interno delle singole celle vive, identificare le cellule da basso a negativo CD45 in base al controllo isotipo.
- All'interno delle celle a basso/negativo CD45, identificare le celle positive EpCAM che sono anche eGFP positivo (nel canale FITC). Questa è la popolazione di celle pennello (Figura 2A).
Risultati
Questa procedura è stata implementata con successo per isolare le cellule del pennello tracheale per il sequenziamento dell'RNA3. Dopo l'isolamento della trachea e la digestione del tessuto con un protocollo in 2 fasi (Figura 1), le cellule sono state raccolte e macchiate con CD45 ed EpCAM con etichettaflua fluorescente dopo l'esclusione delle cellule morte con PI. Dopo aver creato doppietti in base alle caratteristiche di dispersione in avanti e laterale, abbiamo definito le celle pennello come basse/negative per CD45, positive per EpCAM e positive per eGFP (Figura 2A). Le celle pennello rappresentavano lo 0,16-0,42% delle celle cd45basso/neg per citometria di flusso e rappresentavano 250-600 celle per trachea (Figura 2B). Abbiamo confrontato questi conteggi con una stima del numero di cellule positive ChAT-eGFP in supporti tracheali interi da topi ChAT(BAC)-eGFP sulla base della nostra valutazione immunoistologica estesa pubblicata delle cellule pennello tracheale3 e illustrate qui ( Figura 3). I nostri studi precedenti di cellule pennello tracheale in tipo selvatico, topi ChAT(BAC)-eGFP e i topi Il25F25/F25 hanno suggerito che le cellule pennello colinergico si sovrappongono al 90% con DCLK1 e IL25- cellule e conto per 600-1000 cellule pennello per trachea3. In particolare, questo numero è inferiore al numero di cellule di pennello colinergiche riportate da altri gruppi10. Poiché il numero di cellule chemiosensoriali è alterato dall'esposizione a metaboliti microbici e protozoi5,14, questi numeri potrebbero riflettere una variabilità nel microbiota interistituzionale. Pertanto, suggeriamo di stimare il numero di cellule pennello mediante microscopia a fluorescenza per misurare il numero previsto di cellule pennello isolate mediante lo smistamento citometrico del flusso.
Durante la definizione del protocollo, abbiamo tentato diversi metodi precedentemente pubblicati di isolamento delle cellule chemiosensoriali (Figura 4). Quando abbiamo incubato la trachea macinata con 650 U/mL collagenase IV e 1.84 U/mL dispase integrato con DNase I per 45 min, una combinazione spesso utilizzata per ottenere sospensioni a singola cellula da omogeneizzati polmonari15, abbiamo raggiunto una sospensione a singola cellula di cellule epiteliali, ma abbiamo recuperato solo poche cellule pennello (Figura 4A). Le cellule di tuft nell'intestino sono state isolate con successo utilizzando 2,5 mM EDTA e 0,75 mM Dithiothreitol (DTT) con DNase I per 20 min per spostare le cellule epiteliali seguite dalla digestione delle cellule epiteliali rilasciate con 0,01 U/mL dispase con DeNasI per 10 min 6. Nelle nostre mani, utilizzando questa procedura ha portato anche al recupero delle cellule pennello tracheale non ottimale (Figura 4B). Un protocollo per il successo dell'isolamento delle cellule del pennello tracheale per l'analisi dell'RNA è stato descritto da Krasteva et al.10. Seguendo questo protocollo, abbiamo incubato la trachea macinata con 35 U/mL papain a tampone Tyrode per 45 min e non abbiamo ottenuto un buon recupero delle celle a pennello (Figura 4C). Rock et al. ha descritto un metodo di digestione dell'epitelio tracheale per l'isolamento delle cellule basali con due fasi: separazione dell'epitelio dallo strato mesenchimale con dispasi ad alta dose (16 U/mL) a temperatura ambiente seguita da incubazione dell'epitelio spogliato con 0,1 % trypsin e 1,6 mM EDTA per 30 min a 37 c16. Seguendo questi passaggi, il recupero delle celle pennello era insufficiente, ma i numeri ottenuti per mouse erano insufficienti per analisi funzionali approfondite (Figura 4D). Per ottimizzare il protocollo, abbiamo deciso di combinare gli ultimi due approcci. Separando l'epitelio tracheale con dispasi ad alta dose, abbiamo cercato di consentire un migliore accesso del papain alle cellule pennello tracheale. Così, utilizzando 16 U/mL di dispase a temperatura ambiente su trachea intera per separare l'epitelio e successiva incubazione dell'epitelio con 26 U/ mL papaina in Tyrode tampone ha portato al miglior recupero delle celle pennello (Figura 4E).

Figura 1 : schema dei passaggi proposti per l'isolamento delle celle del pennello tracheale. Il protocollo prevede due passaggi principali: dopo la dissezione, l'intera trachea viene incubata in una soluzione dispase ad alta dose per separare l'epitelio; questo è seguito dalla digestione del foglio epiteliale con papaina in calcio contenente Tyrode tampone (Tyrode I) e colorazione anticorpale. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 2 : analisi della citometria a flusso rappresentativa delle celle del pennello tracheale. (A). Rappresentazione schematica della strategia di gating della citometria di flusso. Le singole cellule sono state recintate in base alle loro caratteristiche di dispersione in avanti e laterale e le cellule vive sono state scelte in base all'esclusione dello Iodio Propidium Iodide. Le cellule basse/negative CD45 sono state scelte in base al controllo dell'isotipo e valutate per la loro espressione di EpCAM. Le cellule positive EpCAM sono state considerate cellule pennello se hanno espresso eGFP fluorescente nel canale FITC. (B). Numero di cellule pennello tracheale colinergico per trachea murino e frequenza presentate come percentuale di tutte le cellule CD45low/- e come percentuale di cellule CD45bassa/-EpCAM. Ogni punto rappresenta un mouse separato. I dati provengono da 3 esperimenti separati con 2-3 topi ciascuno. (C). Assenza di cellule pennello positivo eGFP in un digest epiteliale tracheale da un topo di tipo selvaggio macchiato per CD45 ed EpCAM. Fare clic qui per visualizzare una versione più grande di questa figura.
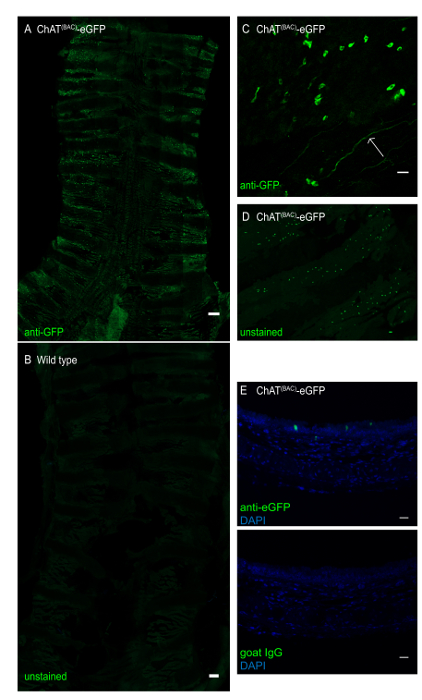
Figura 3 : Intero montaggio della trachea del topo di un mouse ChAT(BAC)-eGFP. La trachea è stata aperta longitudinalmente e macchiata con anticorpo anti-GFP per migliorare il segnale di fluorescenza verde eGFP. (A) Montaggio tracheale intero di topo ChAT(BAC)-eGFP, le celle fluorescenti intensamente verdi rappresentano le celle del pennello; barra della scala di 1 mm; (B) montaggio tracheale intero di un topo di tipo selvaggio che dimostra l'assenza di celle pennello; Barra della scala: 1 mm; (C) ingrandimento dello strato epiteliale che dimostra le cellule pennello di forma irregolare (cellule verdi) e un nervo colinergico finale (freccia); (D) montaggio intero tracheale di una trachea di una ChAT(BAC)-eGFP immagine per GFP senza anticorpo-miglioramento del segnale di fluorescenza; (E) sezione trasversale di una trachea di topo incorporata in paraffina di un topo ChAT(BAC)-eGFP macchiato con controllo anti-GFP (verde) o goat IgG e DAPI (blu); Barre della scala: 20 m (C-E). Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 4 : Confronto di diversi protocolli di digestione tracheale. (A) La trachea è stata macinata e incubata con 650 U/mL collagenase IV e 1,84 U/mL dispase integrati con DNase I per 45 min. Questo esperimento è stato ripetuto 2 volte. (B) L'intera trachea è stata incubata con 2,5 mEDTA e 0,75 mM DTT integrati con DNase I per 20 min; le cellule epiteliali sono state sloggiate e ulteriormente digerite con 0,01 U/mL dispase e DNase I per 10 min. Questo esperimento è stato ripetuto 2 volte. (C) La trachea è stata macinata e incubata con 35 U/mL di papain in Tyrode I buffer per 45 min; l'attività residua della papaina è stata inibita con leupeptina. Questo esperimento è stato eseguito una volta. (D) L'intera trachea è stata incubata con dispasi ad alta dose (16 U/mL) per 30 min per separare il foglio epiteliale, seguita da incubazione del foglio epiteliale con 0,1% di prova e 1,6 mM EDTA per 30 min. Questo esperimento è stato ripetuto 2 volte. (E). L'intera trachea è stata incubata con dispasi ad alta dose (16 U/mL) per 30 min seguita dalla digestione del foglio epiteliale con 26 U/mL di papaina nel tampone Tyrode per 30 min. L'attività residua della papaina è stata inibita con leupeptina e diluizione ad alto volume. Fare clic qui per visualizzare una versione più grande di questa figura.
Discussione
Abbiamo scoperto che una combinazione di trattamento dispase ad alta dose per 40 min seguita da un breve trattamento papaina (30 min) fornisce un protocollo ottimale per la digestione tracheale e l'isolamento delle cellule pennello. Questa combinazione evita una digestione estesa e produce la massima resa di celle pennello, rispetto ai protocolli alternativi.
Mentre la digestione polmonare per estrarre le cellule ematopoietiche ha classicamente invocato enzimi digestivi lievi come collagenae IV15, l'isolamento delle cellule epiteliali richiede protocolli più complessi. Le sospensioni a cella singola delle cellule epiteliali sono più difficili da ottenere a causa delle giunzioni strette e aderenti che le legano l'una all'altra e alla membrana del seminterrato e alla fragilità delle cellule stesse. La maggior parte dei protocolli per la digestione delle cellule epiteliali comporta due fasi - un primo passo è la separazione dell'epitelio dalla membrana del seminterrato seguita da passaggi successivi per disturbare le giunzioni strette e desmosomi che aderiscono le cellule epiteliali tra loro 16 , 17.
Diversi gruppi hanno isolato con successo le cellule di ciuffo chemiosensoriale dall'intestino utilizzando diverse modifiche di un protocollo in 2 fasi per l'isolamento delle cellule epiteliali: il primo passo utilizza EDTA e DTT per rilasciare cellule epiteliali dalla submucosa seguita da digestione dei fogli epiteliali con dispasi. Howitt et al. utilizzato una miscela di 5 mM EDTA - 1 mM DTT seguita da digestione con 0.5 unità/mL Dispase II e DNase14. Gerbe e altri. utilizzato ad alta concentrazione 30 mM EDTA da solo per separare la frazione epiteliale e successivamente incubato con dispase integrato con DNaseI18. Von Moltke et al. utilizzato 2,5 mM EDTA, 0.75 mM DTT eDNaseI seguito da digestione dispasi6 . Abbiamo scoperto che queste tecniche consentono l'isolamento di cellule epiteliali vitali nella trachea, ma la percentuale di cellule pennello tracheale era estremamente bassa (Figura 4B) e non coerente con la nostra aspettativa di isolamento di 600-800 cellule pennello per sulla nostra valutazione istologica.
Diversi gruppi di protocolli di isolamento delle cellule epiteliali tracheali sono stati sviluppati da diversi gruppi per studiare le cellule epiteliali basali. Le principali differenze tra questi protocolli e quelli impiegati nell'intestino sono nella sequenza degli enzimi digestivi. Il primo passo è la separazione dell'epitelio tracheale attraverso l'incubazione con un'alta concentrazione di dispasi (16 U/mL) a temperatura ambiente16. Questo permette all'epitelio di separarsi come un singolo foglio dallo strato mesenchymal19. La successiva elaborazione dell'epitelio tracheale utilizza una combinazione di trypsin ed EDTA, uno dei metodi ezimatici più frequentemente utilizzati per il distacco cellulare, per ottenere una singola sospensione cellulare. I peptidi della trypsina si arretrano sul lato terminale C dei residui di amminoacidi di lisina e argina, mentre l'EDTA viene utilizzato come chelatore di calcio per le interazioni cell-cell e cell-matrix20. Utilizzando questa tecnica, Rock ealtri sono riusciti a recuperare cellule epiteliali basali per la profilazione trascrizionale16. Un protocollo simile è stato recentemente utilizzato per isolare il recettore del gusto amaro che esprime le cellule da un giornalista Tas2r143-CreERT2 guidato eGFP e da B6. Il25Flare25/Flare25 per studi di sequenziamento dell'RNA5,8. Secondo la nostra esperienza, la digestione del foglio epiteliale con trypsin e EDTA ha portato a un eccellente recupero delle cellule epiteliali, ma un numero insufficiente di cellule pennellate tracheali colinergiche per l'analisi funzionale o trascrizionale a meno che più topi non siano stati raggruppati per campione (Figura 4C).
La papaina è una potente proteasi di cisteina vegetale endolitica derivata dal lattice papaya, ed è noto per fenicarsi legami di peptidi che coinvolgono aminoacidi di base, in particolare arginina, lisina e residui seguendo la fenililalinina21. L'isolamento delle cellule pennellate tracheali con papaina da topi ChAT(BAC)-eGFP è stato segnalato per la prima volta da Krasteva et al10. La digestione della papaina è stata recentemente utilizzata anche per dissociare le cellule epiteliali delle vie aeree per il sequenziamento dell'RNA a singola cellula in cui le cellule pennello/tuft comprendevano una piccola frazione di cellule epiteliali11. Papainè è anche l'enzima più comunemente usato per la digestione del tessuto cerebrale per l'isolamento di neuroni vitali22. Dissociazione del tessuto cerebrale con papaina per 30 min risultati in rese notevolmentepiù elevate, sopravvivenza neuronale e integrità rispetto alla digestione della metapessi2 . Dal momento che alcune cellule pennello sono strettamente intrecciate con terminazioni nervose3,10, l'uso della papaina potrebbe essere fondamentale per il successo scissione delle giunzioni delle cellule pennello ai neuroni. Tuttavia, abbiamo scoperto che una digestione di 45 min con papaina ad una concentrazione di 35-40 U/mL ha ridotto drasticamente la vitalità delle cellule epiteliali, portando a un basso recupero delle celle a pennello (Figura 4D).
Abbiamo usato 3 metodi per ridurre la tossicità papaina e aumentare le nostre rese cellulari. In primo luogo, separando il foglio epiteliale con dispase, abbiamo ridotto il successivo tempo di incubazione di papaina da 45 a 30 min. In secondo luogo, abbiamo immediatamente inibito l'attività papaina con leupeptina, un inibitore delle proteasi cisteine24. In particolare, la leupeptina è altamente instabile a 4 gradi centigradi e dovrebbe essere frantuata e congelata a -20 gradi centigradi. In terzo luogo, abbiamo scoperto che la diluizione del tessuto enzimatico digerito in un grande volume di PBS freddo aiuta anche a preservare la vitalità delle cellule digerite. Un altro passo che è fondamentale per aumentare i rendimenti cellulari è rigorosa triturazione10. Poiché il vortice prolungato potrebbe anche diminuire la vitalità, l'abbiamo parzialmente sostituito con la triturazione. Consigliamo la triturazione con un ago da 18G per dissociare grumi cellulari più grandi seguiti da una triturazione aggiuntiva con un ago da 21 G. Infine, abbiamo scoperto che eGFP è altamente sensibile alla luce e la protezione dall'esposizione diretta alla luce in qualsiasi fase è utile. Queste modifiche hanno permesso un robusto recupero delle cellule del pennello tracheale vitali (Figura 4E).
I principali limiti del protocollo qui proposto sono la procedura in due fasi e l'uso della papaina, una potente proteasi cisteina. Alcuni gruppi hanno recentemente sostituito la liberazione con il dispase5 quando isolano le cellule chemiosensoriali. Inoltre, la digestione libera è stata recentemente utilizzata per isolare le cellule epiteliali chemiosensoriali (pennello) dai polipi nasali25,26. Non abbiamo paragonato direttamente la digestione liberata al nostro protocollo di digestione didispa/papaina in due fasi. Papain è una potente proteasi cisteina che può attivare il recettore attivato proteasi PAR2 sulle cellule epiteliali27 che porta all'attivazione delle cellule pennellate stesse o alla generazione di mediatori da parte di altre cellule respiratorie che potrebbero a sua volta attivare il spazzolare le celle. Infine, la papaina può modulare l'espressione del recettore attraverso la scissione dei recettori superficiali rendendo difficile convalidare l'espressione del recettore delle cellule pennello per citometria di flusso28,29.
In sintesi, forniamo un protocollo di isolamento delle cellule pennello colinergico tracheale dai topi reporter ChAT-eGFP che consente un robusto recupero delle cellule pennello tracheale vitali. Questo protocollo è stato utilizzato con successo per l'isolamento e l'analisi trascrizionale delle cellule pennello mediante sequenziamento dell'RNA3.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Ringraziamo Adam Chicoine al Brigham and Women's Human Immunology Center Flow Core per il suo aiuto con lo smistamento citometrico del flusso. Questo lavoro è stato supportato da National Institutes of Health Grants R01 HL120952 (N.A.B.), R01 AI134989 (N.A.B), U19 AI095219 (N.A.B., L.G.B), e K08 AI132723 (L.G.B), e dall'American Academy of Allergy, Asthma, and Immunology (AAAAI)/ American Lung Allergic Respiratory Disease Award (N.A.B.), del Premio AAAAI Foundation Faculty Development Award (L.G.B.), dello Steven and Judy Kaye Young Innovators Award (N.A.B.), del Joycelyn C. Austen Fund for Career Development of Women Physician Scientists (L.G.B.), e di un generosa donazione da parte della famiglia Vinik (L.G.B.).
Materiali
| Name | Company | Catalog Number | Comments |
| Antibodies | |||
| Anti-GFP (Polyclonal goat Ig) | Abcam | cat# ab5450 | |
| APC anti-mouse CD326 (EpCAM) (G8.8) | Biolegend | cat#118214 | |
| APC Rat IgG2a, k isotype control | Biolegend | cat#400511 | |
| DAPI | Biolegend | cat#422801 | |
| Donkey anti-goat IgG (H+L) Highly Cross-Adsorbed Secondary Antibody, Alexa Fluor 488 | Life Technologies/Molecular Probes | cat#A-11055 | |
| Normal Goat IgG | R&D Systems | cat#AB-108-C | |
| Pacific Blue anti-mouse CD45 (30F-11) | Biolegend | cat#103126 | |
| Pacific Blue Rat IgG2b, k isotype control | Biolegend | cat#400627 | |
| TruStain FcX (anti-mouse CD16/32) Antibody | Biolegend | cat#101320 | |
| Chemicals, Peptides, and Recombinant Proteins | |||
| Dispase | Gibco | cat# 17105041 | |
| DNase I | Sigma | cat# 10104159001 | |
| HEPES-Tyrode’s Buffer Without Calcium (10 mM HEPES, 135 mM NaCl, 2.8 mM KCl, 1 mM MgCl2, 12 mM NaHCO3, 0.4 mM NaH2PO4, 0.25% BSA, 5.5 mM Glucose. Prepared in 18.2 megohms water and filtered through 0.22 µm filter | Boston BioProducts | cat# PY-912 | |
| Tyrode’s Solution (HEPES-Buffered) 140 mM NaCl, 5 mM KCl, 25 mM HEPES, 2 mM CaCl2, 2 mM MgCl2 and 10 mM glucose. Prepared in 18.2 megohms water and filtered through 0.22 µm filter. ) | Boston BioProducts | cat# BSS-355 | |
| L-Cysteine | Sigma | cat# C7352 | |
| Leupeptin trifluoroacetate salt | Sigma | cat# L2023 | |
| Papain from papaya latex | Sigma | cat# P3125 | |
| Propidium iodide | Sigma | cat# P4170 | |
| Experimental Models: Organisms/Strains | |||
| ChATBAC-eGFP (B6.Cg-Tg(RP23-268L19-EGFP)2Mik/J) | The Jackson Laboratory | 7902 | |
| Equipment | |||
| LSM 800 with Airyscan confocal system on a Zeiss Axio Observer Z1 Inverted Microscope | Zeiss | ||
| LSRFortessa | BD | 647465 | |
| Disposable equipment | |||
| 1.5 mL sterile tubes | Thomas Scientific | 1157C86 | |
| 5 mL Poysterene Round-bottom Tube, 12 mm x 75 mm style | Falcon | 14-959-1A | |
| 50 mL Polypropylene conical tube, 30 mm x 115 mm style | Falcon | 352098 | |
| Feather Disposable Scalpel no.12 | Fisher Scientific | NC9999403 | |
| Petri dish, 100 mm x 15 mm Style | Falcon | 351029 | |
| Sterile cell strainer, 100 μm | Fisherbrand | cat#22363549 |
Riferimenti
- Tizzano, M., et al. Nasal chemosensory cells use bitter taste signaling to detect irritants and bacterial signals. Proceedings of the National Academy of Sciences of the United States of America. 107 (7), 3210-3215 (2010).
- Genovese, F., Tizzano, M. Microvillous cells in the olfactory epithelium express elements of the solitary chemosensory cell transduction signaling cascade. PLoS One. 13 (9), 0202754(2018).
- Bankova, L. G., et al. The cysteinyl leukotriene 3 receptor regulates expansion of IL-25-producing airway brush cells leading to type 2 inflammation. Science Immunology. 3 (28), (2018).
- Krasteva, G., Canning, B. J., Papadakis, T., Kummer, W. Cholinergic brush cells in the trachea mediate respiratory responses to quorum sensing molecules. Life Sciences. 91 (21-22), 992-996 (2012).
- Nadjsombati, M. S., et al. Detection of Succinate by Intestinal Tuft Cells Triggers a Type 2 Innate Immune Circuit. Immunity. 49 (1), 33-41 (2018).
- von Moltke, J., Ji, M., Liang, H. E., Locksley, R. M. Tuft-cell-derived IL-25 regulates an intestinal ILC2-epithelial response circuit. Nature. 529 (7585), 221-225 (2016).
- Deckmann, K., et al. Bitter triggers acetylcholine release from polymodal urethral chemosensory cells and bladder reflexes. Proceedings of the National Academy of Sciences of the United States of America. 111 (22), 8287-8292 (2014).
- Liu, S., et al. Members of Bitter Taste Receptor Cluster Tas2r143/Tas2r135/Tas2r126 Are Expressed in the Epithelium of Murine Airways and Other Non-gustatory Tissues. Frontiers in Physiology. 8, 849(2017).
- Krasteva, G., et al. Cholinergic chemosensory cells in the auditory tube. Histochemistry and Cell Biology. 137 (4), 483-497 (2012).
- Krasteva, G., et al. Cholinergic chemosensory cells in the trachea regulate breathing. Proceedings of the National Academy of Sciences of the United States of America. 108 (23), 9478-9483 (2011).
- Montoro, D. T., et al. A revised airway epithelial hierarchy includes CFTR-expressing ionocytes. Nature. 560 (7718), 319-324 (2018).
- Plasschaert, L. W., et al. A single-cell atlas of the airway epithelium reveals the CFTR-rich pulmonary ionocyte. Nature. 560 (7718), 377-381 (2018).
- Dwyer, D. F., Barrett, N. A., Austen, K. F. Immunological Genome Project, C. Expression profiling of constitutive mast cells reveals a unique identity within the immune system. Nature Immunology. 17 (7), 878-887 (2016).
- Howitt, M. R., et al. Tuft cells, taste-chemosensory cells, orchestrate parasite type 2 immunity in the gut. Science. 351 (6279), 1329-1333 (2016).
- Bankova, L. G., Dwyer, D. F., Liu, A. Y., Austen, K. F., Gurish, M. F. Maturation of mast cell progenitors to mucosal mast cells during allergic pulmonary inflammation in mice. Mucosal Immunology. 8 (3), 596-606 (2015).
- Rock, J. R., et al. Basal cells as stem cells of the mouse trachea and human airway epithelium. Proceedings of the National Academy of Sciences of the United States of America. 106 (31), 12771-12775 (2009).
- Rock, J. R., et al. Multiple stromal populations contribute to pulmonary fibrosis without evidence for epithelial to mesenchymal transition. Proceedings of the National Academy of Sciences of the United States of America. 108 (52), 1475-1483 (2011).
- Gerbe, F., et al. Intestinal epithelial tuft cells initiate type 2 mucosal immunity to helminth parasites. Nature. 529 (7585), 226-230 (2016).
- Rock, J. R., et al. Transmembrane protein 16A (TMEM16A) is a Ca2+-regulated Cl- secretory channel in mouse airways. Journal of Biological Chemistry. 284 (22), 14875-14880 (2009).
- Olsen, J. V., Ong, S. E., Mann, M. Trypsin cleaves exclusively C-terminal to arginine and lysine residues. Molecular and Cellular Proteomics. 3 (6), 608-614 (2004).
- Verma, S., Dixit, R., Pandey, K. C. Cysteine Proteases: Modes of Activation and Future Prospects as Pharmacological Targets. Frontiers in Pharmacology. 7, 107(2016).
- Huettner, J. E., Baughman, R. W. Primary culture of identified neurons from the visual cortex of postnatal rats. Journal of Neuroscience. 6 (10), 3044-3060 (1986).
- Kaiser, O., et al. Dissociated neurons and glial cells derived from rat inferior colliculi after digestion with papain. PLoS One. 8 (12), 80490(2013).
- Aoyagi, T., Takeuchi, T., Matsuzaki, A., Kawamura, K., Kondo, S. Leupeptins, new protease inhibitors from Actinomycetes. Journal of Antibiotics (Tokyo). 22 (6), 283-286 (1969).
- Kohanski, M. A., et al. Solitary chemosensory cells are a primary epithelial source of IL-25 in patients with chronic rhinosinusitis with nasal polyps. The Journal of Allergy and Clinical Immunology. 142 (2), 460-469 (2018).
- Patel, N. N., et al. Solitary chemosensory cells producing interleukin-25 and group-2 innate lymphoid cells are enriched in chronic rhinosinusitis with nasal polyps. International Forum of Allergy & Rhinology. , (2018).
- Kouzaki, H., O'Grady, S. M., Lawrence, C. B., Kita, H. Proteases induce production of thymic stromal lymphopoietin by airway epithelial cells through protease-activated receptor-2. The Journal of Immunology. 183 (2), 1427-1434 (2009).
- Cambier, J. C., Vitetta, E. S., Kettman, J. R., Wetzel, G. M., Uhr, J. W. B-cell tolerance. III. Effect of papain-mediated cleavage of cell surface IgD on tolerance susceptibility of murine B cells. The Journal of Experimental Medicine. 146 (1), 107-117 (1977).
- Nishikado, H., et al. Cysteine protease antigens cleave CD123, the alpha subunit of murine IL-3 receptor, on basophils and suppress IL-3-mediated basophil expansion. Biochemical and Biophysical Research Communications. 460 (2), 261-266 (2015).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon