Method Article
Medindo a forma e o tamanho das partículas de lodo ativado imobilizada em ágar com um Pipeline de Software de código aberto
Neste Artigo
Resumo
O tamanho e forma das partículas em lamas activadas são parâmetros importantes que são medidos através de diferentes métodos. Imprecisões decorrem de amostragem não-representativo, imagens de qualidade inferior e parâmetros de análise subjetiva. Para minimizar esses erros e facilitar a medição, apresentamos um protocolo especificando cada passo, incluindo um pipeline de software de código aberto.
Resumo
Biorreatores experimentais, tais como aqueles tratamento de águas residuais, contêm partículas cujo tamanho e forma são parâmetros importantes. Por exemplo, o tamanho e a forma de flocos de lodo ativado podem indicar as condições para a microescala e também diretamente afetar bem como o lodo se instala um clarificador.
Forma e tamanho de partícula são as duas medições enganadoramente 'simples'. Muitas questões sutis, muitas vezes sem resposta nos protocolos informais, podem surgir quando a amostragem de imagem e análise de partículas. Métodos de amostragem podem ser tendencioso ou não fornecem energia suficiente estatística. As amostras se podem ser mal conservadas ou sofrem alteração durante a imobilização. As imagens podem não ser de qualidade suficiente; sobreposição de partículas, profundidade de campo, nível de ampliação e vários ruído pode tudo produzir maus resultados. Análise mal especificado pode apresentar viés, como que produzido por limiarização de imagem manual e segmentação.
Acessibilidade e throughput são desejáveis ao lado de reprodutibilidade. Um método acessível, alta taxa de transferência pode permitir mais frequente medição de partículas, produzindo muitas imagens contendo milhares de partículas. Um método que utiliza reagentes de baixo custo, um microscópio comum de dissecação e software de análise de código aberto disponível gratuitamente permite resultados experimentais repetíveis, acessíveis, reprodutíveis e parcialmente automatizada. Além disso, o produto de tal método pode ser bem formatada, bem definidos e facilmente compreendida pelo software de análise de dados, facilitando as análises em laboratório e dados de compartilhamento entre laboratórios.
Apresentamos um protocolo em que detalha os passos necessários para produzir um produto desse tipo, incluindo: amostragem, preparação e imobilização em ágar, aquisição de imagem digital, análise de imagem digital e exemplos de geração de experiência específica figura da amostra a resultados da análise. Nós também incluímos um pipeline de análise de dados de código aberto para suportar este protocolo.
Introdução
A finalidade desse método é fornecer um método bem definido, repetível e parcialmente automatizada para determinar as distribuições de tamanho e forma das partículas em biorreatores, particularmente aqueles que contêm flocos de lodo ativado e grânulos aeróbio1 , 2. a lógica por trás deste método melhorar a acessibilidade, a simplicidade, a taxa de transferência e, repetibilidade dos nossos actuais protocolos in-house3,4, facilitar a medição de partículas para os outros e facilitar a partilha e comparação de dados.
Existem duas grandes categorias de análise de medição de partículas - direto de imagem e inferencial métodos usando tais qualidades como espalhamento de luz5. Embora métodos inferencial podem ser automatizados e têm grande rendimento, o equipamento é caro. Além disso, enquanto métodos inferencial podem determinar com precisão o tamanho equivalente de uma partícula6, eles não fornecem informações de forma detalhada7.
Devido à necessidade de dados da forma, baseamos nosso método de direta de imagens. Embora existam alguns métodos da imagem latente de alta produtividade, solicitaram-se tradicionalmente caro hardware comercial ou soluções personalizadas construídas8,9. Nosso método foi desenvolvido para empregar comum, acessível de hardware e software que, embora sofrendo uma redução na taxa de transferência, produz imagens de partículas muito mais do que o mínimo necessário para muitas análises10.
Protocolos existentes não podem especificar importante amostragem e etapas de aquisição de imagem. Outros protocolos podem especificar etapas manuais que introduzir viés subjetivo (como ad-hoc limiarização11). Um método bem definido que especifica a amostragem, imobilização e imagem etapas de aquisição, combinadas com o software de análise livremente disponível irá melhorar tanto a análise de imagem dentro de laboratório e comparações entre laboratórios. Dos principais objetivos do presente protocolo é fornecer um fluxo de trabalho e ferramentas que devem conduzir a resultados reprodutíveis de laboratórios diferentes para a mesma amostra.
Além de normalizar o processo de análise de imagem, os dados produzidos por este gasoduto são gravados em um arquivo bem definidas e bem formatada12 adequado para uso por populares dados análise pacotes13,14, facilitando a experiência análises específicas (tais como geração de figura personalizada) e dados facilitando compartilhamento entre laboratórios.
Este protocolo é especialmente sugerido para pesquisadores que necessitam de dados de forma de partícula, não têm acesso aos métodos inferencial, não pretendo desenvolver seu próprio pipeline de análise de imagem e gostaria de compartilhar seus dados facilmente com outros
Protocolo
1. coletar amostras para análise de partículas
- Determinar o volume de amostra de reatores específicos que irá produzir partículas suficientes para análise estatística10 (> 500), evitando a sobreposição de partícula.
- Suponha que um intervalo de 0,5 a 2 mL por amostra do licor misto é suficiente para as amostras de lodo ativado com sólidos um licor misto suspenso (saudades) entre 250 e 5.000 mg/L.
- Caso contrário, prepare-se três placas de ágar de teste usando 0.5, 2 e 5 mL de amostra (etapas 1.2 através de 2.7).
- Visualmente, estimar quais (se houver) volumes de amostra melhores atendem aos critérios listados no passo 1.1.
- Se partículas sobrepõem-se, ainda, para a amostra de 0,5 mL, repita as etapas 1.1.2 e 1.1.3 com três amostras de 0,5 mL, diluídas com um adicional de 0,5, 1 e 2 mL de tampão fosfato solução salina para determinar o grau ao qual uma amostra de 0,5 mL deve ser diluída antes passo 2.1.
Nota: Passos 1.1 − 1.1.4 só precisa ser executada uma vez por experiência, ou se o reator Sumário mudança tal que medições posteriores já não atendem aos critérios listados no passo 1.1.
- Adquira uma amostra representativa de uma porção bem misturada do reator por agarrando ~ 40 mL em um béquer ou tubo de centrífuga de 50 mL, misturando delicadamente e imediatamente, despejando o volume de determinada amostra do agarrar bem misturado em um tubo de centrífuga de 15 mL. Dilua a amostra, é necessária, conforme determinado pelo passo 1.1.4.
Nota: O protocolo pode ser pausado aqui e a amostra pode ser armazenada sob refrigeração (4 ° C) por até 48 horas. Não congele a amostra.
Precaução: mídia comum de preservação (por exemplo, formaldeído/formamida) não é adequadas. A grande área de superfície da placa, em combinação com recipiente aberto, o calor da fonte de luz e potencialmente mal ventiladas microscopia instalação produzir desnecessariamente perigosas condições de pouco ganho em qualidade de imagem.
2. preparar placas de ágar de partículas manchadas, imobilizadas
- Adicionar 5 µ l de azul de metileno 1% (p/v) para cada amostra, em seguida, tampe e inverta suavemente ao menos 3 vezes para misturar. Permitir que amostras a mancha pelo menos 5 mas não mais que 30 minutos à temperatura ambiente.
- Prepare-se cerca de 10 mL por amostra do ágar de 7,5% (p/v) em água desionizada.
Nota: Ágar pode ser produzido antes do tempo e armazenado indefinidamente se esterilizados. Agarose pode ser substituído, mas não melhora substancialmente imagens. - Derreter o ágar usando um microondas ou água de banho e deixar arrefecer ligeiramente antes de usar. Certifique-se o ágar é completamente derretido e derrama-se facilmente. Glóbulos de sólidos do ágar mancharão diferente, produzindo imagens de má qualidade.
- Transferi o suficiente ágar derretido de 7,5% (p/v) para o tubo de centrifugação para trazer o volume total do tubo para entre 6,5 e 9 mL.
- Tubos de centrífuga de recapitular e inverta suavemente pelo menos 3 vezes para misturar.
- Ao apontar a tampa longe de si mesmo ou de um capuz, abra a tampa. Despeje o conteúdo do tubo em uma placa de Petri de plástico de 100mm enquanto balançando suavemente o prato para obter um revestimento completo, liso e uma visualmente uniforme distribuição de partículas.
Atenção: O calor do agar pode produzir uma ligeira sobrepressão no tubo. Isso muitas vezes produz um ruído audível e tem o potencial para expelir pequenas gotículas de ágar quente. - Permitir que as placas esfriar em temperatura ambiente pelo menos 5 minutos, até o ágar solidifies.
Nota: O protocolo pode ser uma pausa aqui. Loja chapeada invertido e selado (por exemplo, em um saco plástico da selagem ou com a película de parafina) para até 48 horas sob refrigeração (4 ° C).
3. adquirir imagens de partículas usando uma câmera digital e microscópio estereoscópico
- Coloque a placa de descoberta de face para cima no palco de um estereomicroscópio microscópio capaz de 10x para ampliação de 20 x. Ilumine a amostra de baixo com luz difusa, mesmo utilizando equipamentos como um carrinho de Iluminador LED ou luz de placa.
- Abra o software de captura de imagem, verifique o caminho de luz do microscópio é definido como fotoe clique sobre a câmera apropriada na lista de câmera.
- Ajuste o microscópio para que múltiplas partículas aparecem no software no plano focal, com bordas bem definidas, grandes. Use uma ampliação de 10-20 x para medir partículas mantendo um plano relativamente profundo focal.
- Temporariamente, retire a placa de ágar e colocar o micrômetro no palco. Ajuste o foco fino até as graduações no micrômetro aparecem fortemente concentradas no software de captura de imagem.
- Se não previamente calibrado, grave o pixel à relação micro para a ampliação atual.
- Definir o zoom para 100% clicando Zoom > tamanho real e selecione Opções > calibrar então alinhar a barra vermelha calibração na viewport principal ao longo do eixo do micrômetro, com as barras verticais centrados sobre as graduações de 0 e 200 µm. Na caixa de diálogo de calibrar , indicar o atual nível de ampliação e comprimento real de 200 µm.
- Se já calibrado selecione ampliação na barra de menus, e selecionar a ampliação atual nível e confirma a calibração.
- Selecione medições > linha > arbitrário linha. Clique sobre a interseção entre a graduação 0 e o longo eixo do micrômetro. Clique novamente no cruzamento em 200 e o longo eixo. A correta calibração deve exibir aproximadamente 200 µm. apagar a linha clicando sobre ele, pressionando delete, e pressionando Sim na caixa de confirmação.
Nota: As instruções dadas para selecionar a câmera e a calibração são específicas para o software usado para este hardware. Funções similares devem estar disponíveis em outro software de imagem. O objetivo é determinar o pixel à relação de mícron da imagem para a medição de tamanho de partícula precisos.
- Selecione medições > linha > arbitrário linha. Clique sobre a interseção entre a graduação 0 e o longo eixo do micrômetro. Clique novamente no cruzamento em 200 e o longo eixo. A correta calibração deve exibir aproximadamente 200 µm. apagar a linha clicando sobre ele, pressionando delete, e pressionando Sim na caixa de confirmação.
- Substitua a placa de ágar e ajustar o foco fino para alcançar o máximo de detalhe no software da imagem latente.
- Ajuste o software de imagem para que a máxima qualidade de imagem é alcançada.
- Aumente a profundidade de bits para o valor máximo permitido, selecionando o botão de opção no painel de Profundidade de bits da barra lateral da câmera . Ajustar o software para adquirir imagens em tons de cinza selecionando o botão de opção apropriado no painel Cor/cinza da barra lateral da câmera .
- Recolher todos os painéis lateral aberto entre a exposição e histograma. Reduzir o ganho de 1.0 e aumentar a exposição até uma imagem clara aparece na viewport e até o histograma aparece como uma distribuição que não é cortada por ambas as extremidades da caixa histograma.
- Ajuste o histograma para evitar a sobre e sub-exposição. No painel Histograma da barra lateral de câmera, deslize o limite esquerdo do histograma para fora os valores mais baixos e o limite certo para fora os valores mais altos.
- Salve a imagem como um TIFF não comprimido, incluindo informações de ampliação nos metadados de imagem, usando o arquivo > salvar como caixa de diálogo, selecionar o formato TIFF e garantindo que a caixa salvar informações de calibração é verificado.
Nota: Salvar metadados de imagem, incluindo calibração espacial, pode variar entre programas de aquisição. FIJI15, o software subjacente usado pelo pipeline, compreende as variantes mais comuns. As informações importantes para gravar é o pixel de altura, largura e unidade (s) associado. - Usando qualquer uma fase móvel ou mover manualmente a placa em si, selecione uma outra área, que não sobreposição de imagens anteriores, seguindo um caminho que alterna entre a esquerda para a direita e da direita para a esquerda como um se move para baixo a placa; também conhecido como um 'máquina de cortar relva padrão de pesquisa'. Repita a etapa 3.6 até imagens suficientes são produzidas para capturar pelo menos 500 partículas estimadas visualmente, mais são melhores.
Nota: Padrões alternativas (por exemplo., circular, aleatório) são aceitáveis, mas devem ser relatados. Aquisição de múltiplas imagens sobrepostas para combinação em um mosaico digital produz costura através de um tamanho de arquivo resultante que dificulta grandemente a jusante processamento e artefatos de costura pode ser introduzido e não é recomendado atualmente. - Manter placas até depois da análise de imagem para a imagem latente potencial de acompanhamento. Após a imagem final, descarte como adequado para os resíduos biológicos.
4. medir e analisar silhuetas de partícula
- Instalar os pacotes de software de análise de imagem necessária
- Instalar o FIJI (uma versão melhorada do ImageJ v1.52e do National Institutes of Health seguindo as instruções em: https://imagej.net/Fiji/Downloads
- Instalar o git, se não estiver presente, seguindo as instruções em: https://git-scm.com/downloads
- Adquira o código de análise de partículas de clonando o git Repositório16.
- Na linha de comando, recupere a versão mais recente do código digitando:
git clone https://github.com/joeweaver/SParMorIA-Sludge-Particle-Morphological-Image-Analysis.git- Instale o seguinte código de análise as instruções no arquivo de texto de README.md encontradas no diretório de nível superior do repositório clonado.
Nota: Utilizando o git é preferido, como ele será automaticamente recuperar a versão mais recente do código. Se o git não está disponível, também é possível baixar o código como um arquivo zip na página do lançamento em: https://github.com/joeweaver/SParMorIA-Sludge-Particle-Morphological-Image-Analysis/releases
- Instale o seguinte código de análise as instruções no arquivo de texto de README.md encontradas no diretório de nível superior do repositório clonado.
- Na linha de comando, recupere a versão mais recente do código digitando:
- Edite um arquivo de texto que lista os diretórios a serem processados, junto com parâmetros opcionais. Consulte o subdiretório de exemplos e análise para obter uma lista de parâmetros e exemplos.
- Execute a análise na linha de comando digitando:
< FIJI-PATH > \ImageJ-win64.exe - console - macro < paramsfile > SParMorIA-SludgeParticle_Morphological_Image_Analysis
onde < FIJI-caminho > é o diretório em que se encontra ImageJ-win64.exe e < paramsfile > a localização do arquivo de texto descrevendo a instalação de análise
Nota: O nome do executável pode variar, dependendo de qual sistema operacional FIJI está instalado. Dependendo do número e tamanho das imagens, a análise pode demorar alguns minutos a horas e será executado automaticamente. - Executar uma verificação de controle de qualidade
- Examine os arquivos de controle de qualidade, localizados no subdiretório do diretório de saída especificado de sobreposição. Observe imagens com espúrias, não atendidas e mal partículas capturadas, todo aparentes como contornos sombreados que não correspondem ao fundo. Consulte a Figura 3 para obter exemplos de tais. Os dados de partícula estão agora prontos para geração de figura de análise do experimento específico.
- Rejeite toda placas ou partículas individuais, especificando o código de análise o notáveis arquivos e/ou partícula IDs para ser ignorado. Consulte exemplos/censura no repositório de código relevante R e Python.
- Gere a experiência de figuras específicas usando os resultados de análise de imagem para cada imagem são armazenadas em um arquivo de texto separado vírgula arrumado12 no subdiretório do diretório de saída especificado de resultados. Consulte os exemplos/figuras/R e exemplos/figuras/Python subdiretórios para obter exemplos de como ler os arquivos de resultados.
Resultados
Arquivos gerados
O processo ilustrado na Figura 1 produzirá dois arquivos por imagem analisados. O primeiro arquivo é uma vírgula separados arquivo de texto CSV (valores) onde cada linha corresponde a uma partícula individual e as colunas descrevem várias métricas de partículas, tais como área, circularidade e solidez e definidos no manual o ImageJ.17. Arquivos CSV de exemplo estão incluídos como informação suplementar e no diretório de exemplos/dados.

Figura 1: Fluxo de trabalho gráfico descrevendo as quatro etapas principais do protocolo. Clique aqui para ver uma versão maior desta figura.
O segundo arquivo é destinado ao uso em controle de qualidade (QC) e é uma imagem GIF arquivo que sobrepõe as partículas de imagem com regiões semi-opaco representando identificada original, como ilustrado na Figura 2. A qualidade da partícula identificação e segmentação então pode ser avaliada rapidamente manualmente. Apesar de nenhum método de limiarização de partícula é perfeito18, Figura 2 é apresentado como um exemplo de um resultado aceitável. Imagens de má qualidade podem ser retomadas, ou se houver dados suficientes disponíveis, simplesmente removidas do processamento adicional.

Figura 2: Exemplo de um gif de controle de qualidade (CQ) gerado pelo pipeline de análise de imagem. Ampliação de 15x imagem principal. Trecho é ampliado digitalmente para mostrar números de identificação de partículas individuais na imagem. Clique aqui para ver uma versão maior desta figura.
Quando avaliar imagens QC, existem três erros comuns encontrados:
1. a falta de precisão em conformidade com os limites de partículas
2. a falta de identificação de partículas
3. inclusão de artefato devido a: componentes não-partícula (por exemplo, bolhas) ou erros em limiarização
Exemplos desses erros são ilustrados na Figura 3. Identificação de limite de partícula pobre e segmentação entre partículas, muitas vezes é um resultado de excesso de morrer, como visto na Figura 3a. Iluminação pobre pode levar a ambos falha para identificar artefato falso partículas (Figura 3b, círculo tracejado vermelho) e partículas (Figura 3b, círculo azul sólido). Non-partícula importa, tais como bolhas, fungos, protozoários e metazoários, tais como a Tardigrada em Figura 3 c também pode ser spuriously identificada como partículas.

Figura 3: Erros comuns detectados durante a análise QC. (um) deteção de limite de partícula pobre. (b) partículas espúrias (elipse vermelha tracejada) e partículas não segmentadas (azul sólida elipse). (c) não-partícula estranha objeto. Ampliação 15 x. Clique aqui para ver uma versão maior desta figura.
É mais fácil de rejeitar toda a imagem. No entanto, é possível usar o identificador de partícula na imagem do QC (Figura 2, inset) para rejeitar as partículas individuais. Esta abordagem é particularmente útil quando há um punhado de questões em uma imagem de outra maneira útil (como a inclusão de não-partículas) Figura 3C. Exemplos de fazer assim de forma reprodutível e reportável estão incluídos no diretório do repositório github exemplos/censurar.
Quando um pequeno diâmetro mínimo é especificado (< 10 pixels), ruído de imagem pode ser spuriously identificado como uma partícula. Nesses casos, a imagem pode ser ainda ser aceite quando ainda mais a jusante análise é remove sua presença. Como uma diretriz, dados da forma devem ser tratados com ceticismo, quando as partículas são compostas de menos de ~ 200 pixels19.
Geração de figura
Os arquivos CSV resultante da análise de imagem são arrumado12 e podem ser facilmente combinados e analisados no pacote de software preferencial do pesquisador (tais como os pandas20 com seaborn21 em Python ou dplyr22 com ggplot223 em R). No entanto, o tipo de número exato necessário variará necessariamente com perguntas de pesquisa e resultado. Um exemplo de uma possível figura está incluído abaixo (Figura 4) e o código correspondente para gerá-lo a partir dos arquivos CSV está disponível no github16.
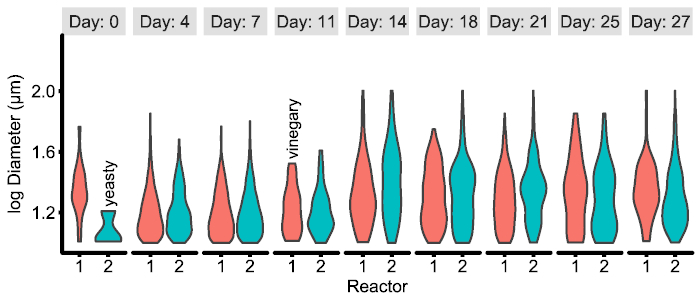
Figura 4: Exemplo de figura experimento específico gerado a partir de dados CSV, produzidos pelo pipeline de imagem. Neste exemplo, as distribuições de partícula entre dois reactores experimentais ao longo do tempo são exibidas e combinadas com metadados qualitativo observado pelo pesquisador. Ver exemplos/figuras/R para a geração de código e dados. Clique aqui para ver uma versão maior desta figura.
Discussão
Embora o sistema de análise de imagem é bastante robusto e QC medidas para assegurar imagens pobres são removidas, devida atenção a questões específicas na amostragem, preparação de chapa e aquisição de imagens pode melhorar tanto a precisão dos dados e a proporção de imagens passando QC.
Concentração de amostragem
Supondo que tomou-se uma amostra representativa, o passo mais importante é assegurar a partículas suficientes para análise eficiente e representativo9 enquanto não tão concentrado que partículas de sobreposição.
Isto tem correspondeu a cerca de 0,5 a 2 mL de licor misto sob uma grande variedade de sólidos suspensos totais, mas experiência específica determinação pode ser necessária. Exemplos de excessivamente concentrada, excessivamente - diluído, e as concentrações de partículas adequado são mostradas na Figura 5 como referência. A coloração também é afetada pela concentração de partículas. Diluição excessiva pode resultar em partículas excessivamente manchadas, borradas, enquanto sob diluição pode não produzir partículas com contraste suficiente para limiarização ideal.

Figura 5: Referência de imagens mostrando as concentrações de partículas que são muito concentrados, aceitável e excessivamente diluída. Ampliação 15 x. Clique aqui para ver uma versão maior desta figura.
Concentração de corante
A quantidade de mancha adicionada à amostra é crucial e a quantidade correta pode variar entre lamas. Aproximadamente 5 µ l de azul de metileno 1% (p/v) por 0,5 a 2 mL da amostra fornece contraste suficiente para limiarização sem causar 'sangrar' e obscurecendo a forma da partícula.
Não há nenhuma única concentração ideal; deve ser escolhido um equilíbrio entre o contraste e a claridade. A Figura 6 ilustra essa compensação em três amostras coradas com 5, 25 e 50 µ l de azul de metileno 1% por 2 mL de lodo. Quando esta troca de pesagem, a partícula mal contrastante ocasional (Figura 6a) é preferida por bolhas mal resolvidas (Figura 6C).

Figura 6: Mancha maior concentração melhora o contraste de partículas, mas também distorce o limite observado. Ampliação 15 x. Clique aqui para ver uma versão maior desta figura.
Armazenamento de placa
Após a imobilização, as placas podem ser armazenadas sob refrigeração (4 ° C) pelo menos 3 dias. Este é um período conservador, durante o qual é improvável que contaminar o crescimento e tintura difusão irá ocorrer. Placas não mostrando qualquer das questões descritas abaixo podem ainda ser fotografadas depois de 3 dias. Quando armazenados por muito tempo, as partículas existentes podem continuar a crescer e irá aparecer no plano focal de outras partículas, mantendo o matiz da mancha, como pode ser visto na Figura 7a. Contaminantes de superfície, tais como esporos de fungos, também podem crescer após longos períodos de armazenamento. Estes geralmente não pegará a cor da mancha e aparecerão em um diferente plano focal, como pode ser visto na Figura 7b. Em alguns casos, é claro se ocorreu crescimento excessivo ou difusão da mancha, tal como a parte inferior da Figura 7b e centro da Figura 7C. Independentemente da causa, pontos como os indicam que a placa envelheceu além do seu tempo de vida útil

Figura 7: Imagens de referência, ilustrando o supercrescimento de sinalização que foi armazenado um prato além do seu tempo de vida útil. Ampliação 15 x. Clique aqui para ver uma versão maior desta figura.
Preparação da placa
Há dois problemas associados a preparar fisicamente as placas de ágar - ágar excessivamente grossa e agitação excessiva. No primeiro caso (Figura 8), as partículas tornam-se suspenso em várias profundidades, dificultando a aquisição de imagens com a maioria das partículas em foco.
Figura 8: Quantidades excessivas de ágar produzirá uma amostra mais grossa do que o plano focal, resultando em partículas embaçadas. Ampliação 15 x. Clique aqui para ver uma versão maior desta figura.
No segundo caso, rodopiando produz uma distribuição não uniforme de partículas (Figura 9a), resultados de seções diferentes da placa de polarização (Figura 9b, c. Geralmente, não mais de 7 mL de ágar-ágar é necessário para cobrir um prato de Petri de 100 mm e apenas os movimentos de mão suave são necessárias para cobrir uniformemente o prato.

Figura 9: Excessivamente vigorosa agitação durante a preparação do prato aparecerá como partícula não-uniforme distribuições (um), polarização seções da chapa no sentido maior (b) e distribuições de partícula menores (c). Placa de 100 mm de diâmetro, micrografias ampliada x 15. Clique aqui para ver uma versão maior desta figura.
Geração de imagens microscópica
Há duas questões de aquisição de imagem principais que afetam a qualidade. A primeira questão é garantia de que a maioria das partículas no plano focal. Até mesmo na ampliação baixa, o tamanho de muitas partículas de lodo ativado é tal que sem pequenos ajustes para foco grosso, muitas partículas será ligeiramente fora de foco, introdução de medição de partículas impreciso. Nenhuma imagem conterá partículas perfeitamente focada 100%; Figura 8 e Figura 5b são exemplos respectivos de foco pobre e aceitável.
Os níveis de exposição constituem a segunda grande questão. Mal exposto o resultado de imagens em perda de dados e segmentação pobre11. Além disso, o alto contraste da tintura pode produzir um histograma estreito, reduzindo o alcance dinâmico dos dados. Os limites superiores e inferiores do histograma podem ser ajustados antes de capturar uma imagem para evitar a exposição pobre e aumentar a gama dinâmica. Exemplos de sobre, sob e aceitáveis as exposições estão incluídas abaixo na Figura 10.

Figura 10: Imagens de referência mostrando exposições de imagem pobre e aceitável. Clique aqui para ver uma versão maior desta figura.
Vantagens do método são que fornece critérios específicos, englobando todo o processo. Além disso, nós fornecemos um pipeline de software, facilitando a análise em laboratório e promover dados comparáveis entre-lab. A grande limitação desse método é que a exigência de manter todas as partículas focadas impede altas ampliações, limitando sua utilidade para partículas com pequenas dimensões menores - nomeadamente estruturas filamentosas. Sentidos futuros deste método poderiam incorporar técnicas de análise de imagem avançado (especificamente de24,de redução de ruído25, imagens de alta faixa dinâmica, foco empilhamento26,27e aprendizado de máquina assistida limiarização, segmentação e classificação28. A melhoria de aquisição de imagem grande iria incorporar software para controlar estágios mecânico8 e produzir arquivos de mosaico 'prato'.
Divulgações
Os autores não têm nada para divulgar.
Agradecimentos
Este trabalho foi financiado por um subsídio da National Science Foundation CBET 1336544.
Os logotipos de FIJI, R e Python são usados com a em conformidade com as seguintes diretivas de marca:
Python: https://www.python.org/psf/trademarks/
R: https://www.r-project.org/Logo/ , conforme a licença CC-BY-SA 4.0 listada em: https://creativecommons.org/Licenses/by-sa/4.0/
Fiji: https://imagej.net/Licensing
Materiais
| Name | Company | Catalog Number | Comments |
| 10% Bleach solution | Chlorox | 31009 | For workspace disinfection. |
| 15 mL centrifuge tube with cap | Corning | 430790 | Per sample. |
| 50 mL Erlenmeyer flask | Corning | 4980-50 | Other vessels are suitable so long as they can contain > 40 mL of sample and allow mixing |
| 500 mL Kimax Bottle | Kimble-Chase | 14395-50 | Or otherwise sufficient for agar handling |
| Agar | BD | 214010 | Solid, to prepare 7.5% gel. 7 mL per sample. |
| Data analysis software | N/A | N/A | R or Python are suggested |
| Deionized water | N/A | N/A | Sufficient to prepare stain and agar. If unavailable, tap should be fine. |
| Desktop computer | N/A | N/A | Image analysis is not CPU intensive, any 'ordinary' desktop computer circa 2017 should be sufficient. |
| External hard drive | Seagate | STEB5000100 | Not fully required, but extremely useful given the number an size of images. 2 or more TB of storage suggested. |
| FIJI | NIH | version 1.51d | Version is ImageJ core. Plugins are updated as of writing. Available at: https://imagej.net/Fiji/Downloads |
| GIT | Open Source | version 2.19.1 or later | Available at: https://git-scm.com/ |
| Image capture software | ToupView | version 3.7.5177 | Any compatible with camera, may come with camera. Should allow saving TIFF images with spatial calibration data. |
| Mechanical (X/Y) Stage | OMAX | A512 | Not fully required, but greatly aids image acquisition. |
| Methylene blue | Fisher | M291-100 | Solid, to prepare 1% w/v solution. 5 uL solution per sample. |
| Microscope camera | OMAX | A35140U | Any digitial camera compatible with microscope. Resolution providing at least 5 um per pixel at 10x magnification and a dynamic range of at least 8 bits per pixel per color channel is suggested. |
| Optical Stage Micrometer | OMAX | A36CALM1 | Or otherwise sufficient for spatial calibration. |
| Petri dish, 100 mm | Fisher | FB0875712 | 1 per sample. |
| PPE | N/A | N/A | Standard lab coat, gloves, and eyewear. |
| Sparmoria macro | NCSU | version 0.2.1 | Available at github repository : https://github.com/joeweaver/SParMorIA-Sludge-Particle-Morphological-Image-Analysis |
| Stereo/dissecting microscope | Nikon | SMZ-2T | Should provide 10 to 20x magnficiation and allow digital photos either with a buit-in camera or profide a mounting point for a CCD. |
Referências
- Show, K. Y., Lee, D. J., Tay, J. H. Aerobic granulation: Advances and challenges. Applied Biochemistry and Biotechnology. 167 (6), 1622-1640 (2012).
- Adav, S. S., Lee, D. -. J., Show, K. -. Y., Tay, J. -. H. Aerobic granular sludge: Recent advances. Biotechnology Advances. 26 (5), 411-423 (2008).
- Initial Investigations of Aerobic Granulation in an Annular Gap Bioreactor. North Carolina State University Available from: https://repository.lib.ncsu.edu/handle/1840.16/2162 (2004)
- . Effect of Hydrodynamics on Aerobic Granulation Available from: https://repository.lib.ncsu.edu/handle/1840.16/8761 (2012)
- Tay, J. H., Liu, Q. S., Liu, Y. Microscopic observation of aerobic granulation in sequential aerobic sludge blanket reactor. Journal of Applied Microbiology. 91 (1), 168-175 (2001).
- Kelly, R. N., et al. Graphical Comparison of Image Analysis and Laser Diffraction Particle Size Analysis Data Obtained From the Measurements of Nonspherical Particle Systems. AAPS Pharm SciTech. 7 (3), E1-E14 (2006).
- Walisko, R., et al. The Taming of the Shrew -Controlling the Morphology of Filamentous Eukaryotic and Prokaryotic Microorganisms. Advances in Biochemical Engineering/Biotechnology. 149, 1-27 (2015).
- Campbell, R. A. A., Eifert, R. W., Turner, G. C. Openstage: A Low-Cost Motorized Microscope Stage with Sub-Micron Positioning Accuracy. PLoS ONE. 9 (2), e88977 (2014).
- Dias, P. A., et al. Image processing for identification and quantification of filamentous bacteria in in situ acquired images. BioMedical Engineering OnLine. 15 (1), 64 (2016).
- Liao, J., Lou, I., de los Reyes, F. L. Relationship of Species-Specific Filament Levels to Filamentous Bulking in Activated Sludge. Applied and Environmental Microbiology. 70 (4), 2420-2428 (2004).
- Cromey, D. W. Avoiding twisted pixels: ethical guidelines for the appropriate use and manipulation of scientific digital images. Science and Engineering Ethics. 16 (4), 639-667 (2010).
- Wickham, H. Tidy Data. Journal of Statistical Software. 59 (10), (2014).
- van Rossum, G. . Python tutorial. , (1995).
- Schindelin, J., Arganda-Carreras, I., Frise, E. FIJI: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- . SParMorIA: Sludge Particle Morphological ImageAnalysis Available from: https://github.com/joeweaver/SParMorIA-Sludge-Particle-Morphological-Image-Analysis (2018)
- Ferreira, T., Rasband, W. . ImageJ User Guide: IJ 1.42 r. , (2012).
- Sezgin, M., Sankur, B. Survey over image thresholding techniques and quantitative performance evaluation. Journal of Electronic Imaging. 13 (1), 146-166 (2004).
- Kröner, S., Doménech Carbó, M. T. Determination of minimum pixel resolution for shape analysis: Proposal of a new data validation method for computerized images. Powder Technology. 245, 297-313 (2013).
- McKinney, W. Data Structures for Statistical Computing in Python. Proceedings of the 9th Python in Science Conference. , 51-56 (2010).
- Waskom, M., et al. . seaborn: v0.5.0 (November 2014). , (2014).
- . dplyr: A Grammar of Data Manipulation Available from: https://cran.r-project.org/web/packages/dplyr/index.html (2016)
- Riley, R. S., Ben-Ezra, J. M., Massey, D., Slyter, R. L., Romagnoli, G. Digital Photography: A Primer for Pathologists. Journal of Clinical Laboratory Analysis. 18 (2), 91-128 (2004).
- Singh, S., Bray, M. A., Jones, T. R., Carpenter, A. E. Pipeline for illumination correction of images for high-throughput microscopy. Journal of Microscopy. 256 (3), 231-236 (2014).
- Eastwood, B. S., Childs, E. C. Image Alignment for Multiple Camera High Dynamic Range Microscopy. Proceedings. IEEE Workshop on Applications of Computer Vision. , 225-232 (2012).
- High Dynamic Range Microscopy for Cytopathological Cancer Diagnosis. IEEE Journal of Selected Topics in Signal Processing (Special Issue on: Digital Image Processing Techniques for Oncology) Available from: https://www.lfb.rwth-aachen.de/en/ (2009)
- Jain, V., et al. Supervised Learning of Image Restoration with Convolutional Networks. 2007 IEEE 11th International Conference on Computer Vision. , 1-8 (2007).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados