Method Article
Messung von Form und Größe der Belebtschlamm Partikel unbeweglich in Agar mit einer Open-Source-Software-Pipeline
In diesem Artikel
Zusammenfassung
Die Größe und Form der Partikel im Belebtschlamm sind wichtige Parameter, die mit unterschiedlichen Methoden gemessen werden. Ungenauigkeiten ergeben sich aus nicht-repräsentative Probenahme, suboptimalen Bildern und subjektive Analyseparameter. Um diesen Fehler zu minimieren und Messung zu erleichtern, präsentieren wir ein Protokoll angeben, jeden Schritt, einschließlich einer open-Source-Software-Pipeline.
Zusammenfassung
Experimentelle Bioreaktoren, wie z. B. die Behandlung von Abwasser enthalten Partikel, deren Größe und Form wichtige Parameter sind. Beispielsweise können die Größe und Form des Belebtschlammes Flocken geben die Bedingungen an den Microscale und auch direkt beeinflussen, wie gut der Schlamm in einem Nachklärbecken absetzt.
Partikelgröße und-Form sind beide fälschlich "einfachen" Messungen. Viele subtile Probleme, oft unadressierte in informelle Protokolle können entstehen, wenn Probenahme, Bildgebung und Partikel zu analysieren. Probenahmeverfahren voreingenommen sein können oder nicht genügend statistische Strom liefern. Die Proben selbst können nur schlecht erhalten oder Veränderung während der Ruhigstellung zu unterziehen. Bilder möglicherweise nicht von ausreichender Qualität sind; überlappende Partikel, produzieren Schärfentiefe, Vergrößerungsstufe, und verschiedene Geräusche alle schlechte Ergebnisse. Schlecht spezifizierten Analyse kann Vorurteile, wie durch die manuelle Bild Schwellwerte und Segmentierung einführen.
Erschwinglichkeit und Durchsatz sind neben Reproduzierbarkeit wünschenswert. Eine erschwingliche, hoher Durchsatz-Methode können häufigere Partikel Messung, viele Bilder, die mit Tausenden von Partikel produzieren. Eine Methode, die preiswerte Reagenzien, eine gemeinsame sezierenden Mikroskop und frei verfügbaren open-Source-Analyse-Software ermöglicht wiederholbare, zugänglich, reproduzierbare und teilweise automatisiert Versuchsergebnisse. Darüber hinaus kann das Produkt einer solchen Methode gut formatierte, klar definierte und Datenanalyse-Software, Lockerung in Laboranalysen und Datenaustausch zwischen den Labors leicht verständlich sein.
Präsentieren wir eine Protokoll, das beschreibt die notwendigen Schritte um solch ein Produkt herzustellen, einschließlich: probieren, probieren, Vorbereitung und Immobilisierung in Agar, digitale Bildaufnahme, digitale Bildanalyse und Beispiele der Experiment-spezifische Abbildung Generation aus der die Ergebnisse der Analyse. Wir haben auch eine Open-Source-Daten-Analyse-Pipeline für dieses Protokoll aufgenommen.
Einleitung
Der Zweck dieser Methode ist, eine klar definierte, reproduzierbare und teilweise automatisiert Verfahren zur Bestimmung der Größe und Form-Distributionen von Partikeln in Bioreaktoren, besonders diejenigen mit Belebtschlamm Flocken und aerobe Granulat1 , 2. waren die Beweggründe für diese Methode zur Verbesserung der Erschwinglichkeit, Einfachheit, Durchsatz und Wiederholbarkeit unserer bestehenden internen Protokollen3,4, Partikel-Messung für andere zu erleichtern und Austausch erleichtern und Vergleich der Daten.
Es gibt zwei große Kategorien von Messung Partikelanalyse - direct imaging und schlussfolgernde Methoden mit solchen Qualitäten als Lichtstreuung5. Obwohl folgernd Methoden automatisiert werden können und großen Durchsatz haben, ist die Ausrüstung teuer. Darüber hinaus während folgernd Methoden der gleicher Größe eines Teilchens6genau bestimmen können, bieten sie keine detaillierte Form Informationen7.
Wegen der Notwendigkeit der Shape-Daten haben wir unsere Methode auf direkte Bildgebung basiert. Während einige Hochdurchsatz-bildgebenden Verfahren vorhanden sind, müssen sie traditionell entweder teure kommerzielle Hardware oder Sonderlösungen gebauten8,9. Unsere Methode wurde entwickelt, um gemeinsame, kostengünstige Hardware und Software, die zwar eine Reduzierung des Durchsatzes, leiden weit mehr Partikelbilder als das Minimum für viele Analysen10benötigt produziert zu beschäftigen.
Bestehende Protokolle können keinen wichtigen Probenahme und Bild Erwerb Schritte angeben. Andere Protokolle können manuelle Schritte angeben, die subjektive Voreingenommenheit (z. B. ad-hoc-Schwellwerte11) einzuführen. Eine klar definierte Methode, die Probenahme, Immobilisierung und Bild Erwerb Schritte kombiniert mit frei verfügbaren Analysesoftware angibt wird im Labor Bildanalyse und Vergleiche zwischen den Labors verbessern. Ein wesentliches Ziel dieses Protokolls ist, einen Workflow und Tools, die aus verschiedenen Labors für die gleiche Probe zu reproduzierbaren Ergebnissen führen sollten.
Neben der Normalisierung des Analyseprozesses Bild, werden die Daten durch diese Pipeline produziert in einem klar definierten, gut formatierte Datei12 geeignet für den Einsatz von beliebten Daten Analyse Pakete13,14, Lockerung Experiment aufgezeichnet. spezifische Analysen (z. B. benutzerdefinierte Zahl Generation) und erleichtern den Datenaustausch zwischen Labors.
Dieses Protokoll wird vor allem für Forscher vorgeschlagen, die Partikel-Shape-Daten benötigen, haben keinen Zugang zu schlussfolgernde Methoden, wollen nicht ihre eigenen Bild-Analyse-Pipeline zu entwickeln, und ihre Daten einfach mit anderen teilen möchten
Protokoll
1. sammeln Sie Proben für die Partikelanalyse
- Bestimmen die Probenmenge für bestimmte Reaktoren, die genügend Partikel für statistische Analysen10 produzieren (> 500) Partikel Überschneidungen zu vermeiden.
- Davon ausgehen Sie, dass eine Reihe von 0,5 bis 2 mL pro Probe des gemischten Schnaps ausreichend für Belebtschlamm Proben mit einer gemischten Alkohol ausgesetzt Feststoffe (MLSS) zwischen 250 und 5.000 mg/L.
- Ansonsten bereiten Sie drei Test-Agarplatten mit 0,5, 2 und 5 mL der Probe (Stufen 1,2 bis 2,7).
- Visuell zu schätzen, (falls vorhanden) die beste Probenvolumina in Schritt 1.1 aufgeführten Kriterien erfüllen.
- Wenn Partikel immer noch für die 0,5 mL Probe überschneiden, wiederholen Sie die Schritte 1.1.2 und 1.1.3 mit drei 0,5 mL Proben verdünnt mit einer zusätzlichen 0,5, 1 und 2 mL Phosphat gepufferte Kochsalzlösung zu prüfen, inwieweit eine 0,5 mL Probe vor Schritt 2.1 verdünnt werden muss.
Hinweis: Schritte 1.1 − 1.1.4 müssen nur einmal pro Experiment durchgeführt werden, oder wenn der Reaktor Änderung Inhalt, so dass nachfolgende Messungen nicht mehr aufgeführten Kriterien erfüllen in Schritt 1.1.
- Erwerben Sie eine repräsentative Stichprobe von einem gut durchmischten Teil des Reaktors durch aufmerksamkeitsstarke ~ 40 mL in ein Becherglas oder 50 mL Zentrifugenröhrchen, vorsichtig mischen und sofort Gießen der ermittelten Probenvolumen von dem gut durchmischten greifen in ein Zentrifugenröhrchen 15 mL. Verdünnen der Probe notwendig, da durch Schritt 1.1.4 bestimmt.
Hinweis: Das Protokoll kann hier angehalten und die Probe kann für bis zu 48 Stunden im Kühlschrank (4 ° C) gelagert werden. Die Probe nicht einfrieren.
Vorsicht: gemeinsame Bewahrung Medien (z. B. Formaldehyd/Formamid) sind nicht geeignet. Die große Oberfläche der Platte, in Kombination mit den offenen Behälter von der Lichtquelle und potentiell schlecht belüfteten Mikroskopie Einrichtung Wärmeproduktion unnötig gefährliche Bedingungen für wenig Gewinn an Bildqualität.
2. bereiten Sie Agarplatten gefärbt, immobilisierten Partikel
- Jede Probe 5 µL 1 % (w/V) Methylenblau hinzufügen dann verschließe und sanft Invertiere 3 zumindest zeitweise zu mischen. Lassen Sie Proben, für mindestens 5 aber nicht mehr als 30 Minuten bei Raumtemperatur zu beflecken.
- Ca. 10 mL pro Probe von 7,5 % (w/V) Agar in entionisiertem Wasser vorzubereiten.
Hinweis: Agar kann vor der Zeit produziert und auf unbestimmte Zeit gespeichert, wenn sterilisiert. Agarose kann ersetzt werden, aber Bilder nicht wesentlich verbessert. - Schmelzen Sie Agar mit Mikrowelle oder Wasserbad und leicht vor der Anwendung abkühlen lassen. Stellen Sie sicher der Agar vollständig geschmolzen ist und leicht gießt. Feste Kügelchen Agar färbt anders produzieren Bilder in schlechter Qualität.
- Ausreichende geschmolzene 7,5 % (w/V)-Agar auf Zentrifugenröhrchen bringen das gesamte Rohr Volumen zwischen 6,5 und 9 mL zu übertragen.
- Rekapitulieren Sie Zentrifuge Röhren und invertieren Sie sanft mindestens 3 Mal mischen.
- Und zeigt die Kappe weg von sich selbst oder in einer Kapuze, öffnen Sie die Kappe. Gießen Sie den Rohr-Inhalt in einem 100 mm Kunststoff Petrischale während sanft schaukelnden das Gericht um eine volle, glatte Beschichtung und eine optisch gleichmäßige Verteilung der Teilchen zu erreichen.
Achtung: Die Wärme aus dem Agar kann einen leichten Überdruck im Rohr führen. Oft erzeugt ein hörbares Zischen und hat das Potenzial, kleine Tropfen der heißen Agar zu vertreiben. - Lassen Sie die Platten für mindestens 5 Minuten, bis der Agar erstarrt bei Zimmertemperatur abkühlen.
Hinweis: Das Protokoll kann hier angehalten werden. Store vernickelt invertiert und versiegelt (z.B. in einen abdichtenden Plastiksack oder mit Paraffin Film) für bis zu 48 Stunden im Kühlschrank (4 ° C).
(3) erwerben Sie Partikelbilder mit einem Stereomikroskop und Digitalkamera
- Legen Sie die unbedeckten Platte aufgedeckte auf Mikroskoptisch eines Stereomikroskops in der Lage, 10 X, 20 X Vergrößerung. Beleuchten Sie die Probe von unten mit gleichmäßigen, diffusen Licht mit Geräten wie z. B. eine LED Beleuchtung Stand oder leichte Platte.
- Öffnen Sie die Image-Capture-Software, sicherzustellen Sie, dass das Mikroskop Strahlengang Fotoeingestellt ist, und klicken Sie auf die entsprechende Kamera aus der Kameraliste.
- Einstellen Sie das Mikroskop so, dass mehrere Partikel in der Software in der Brennebene mit großen, gut definierte Ränder angezeigt werden. Verwenden Sie eine Vergrößerung von 10-20 X, um Partikel messen und gleichzeitig relativ tief Brennebene.
- Vorübergehend entfernen Sie die Agarplatte und platzieren Sie der Mikrometer auf der Bühne zu. Einstellen Sie feine Schärfe, bis die Abstufungen auf den Mikrometer stark konzentriert in der Bild-Capture-Software angezeigt werden.
- Wenn nicht vorher kalibriert, Aufzeichnen der Pixel Mikro-Verhältnis für die aktuelle Vergrößerung.
- Stellen Sie den Zoom auf 100 %, indem Sie auf Zoom > Originalgröße und wählen Sie Optionen > kalibrieren richten Sie dann die rote Kalibrierung Bar im großen Ansichtsfenster entlang der Längsachse der Mikrometer mit den vertikalen Balken zentriert auf die 0 und 200 µm-Abstufungen. Geben Sie im Dialogfeld kalibrieren den aktuellen Vergrößerungsstufe und tatsächliche Länge von 200 µm.
- Wenn bereits kalibriert wählen Sie Vergrößerung aus der Menüleiste und wählen Sie die aktuelle Vergrößerung Ebene und die Kalibrierung zu bestätigen.
- Wählen Sie Messungen > Zeile > willkürliche Linie. Klicken Sie auf den Schnittpunkt der 0 Graduierung und Längsachse der Mikrometer. Klicken Sie erneut auf die Kreuzung 200 und die lange Achse. A korrekte Kalibrierung sollte angezeigt werden, etwa 200 µm. löschen Sie die Zeile durch anklicken, ENTF drücken, und auf dem Feld zur Bestätigung drücken Ja .
Hinweis: Die Anweisungen für die Auswahl der Kamera und Kalibrierung sind spezifisch für die Software für diese Hardware. Ähnliche Funktionen sollten in anderen imaging-Software verfügbar sein. Ziel ist es, die Pixel Mikron-Verhältnis des Bildes für genaue Partikelgrößenmessung bestimmen.
- Wählen Sie Messungen > Zeile > willkürliche Linie. Klicken Sie auf den Schnittpunkt der 0 Graduierung und Längsachse der Mikrometer. Klicken Sie erneut auf die Kreuzung 200 und die lange Achse. A korrekte Kalibrierung sollte angezeigt werden, etwa 200 µm. löschen Sie die Zeile durch anklicken, ENTF drücken, und auf dem Feld zur Bestätigung drücken Ja .
- Ersetzen Sie der Agarplatte und passen Sie die Feinfokussierung um maximale Details in der imaging-Software zu erreichen.
- Einstellen Sie die imaging-Software so, dass maximale Bildqualität erreicht wird.
- Erhöhen Sie die Bit-Tiefe, der zulässige Höchstwert, indem Sie das Optionsfeld im Bedienfeld " Bit-Tiefe " der Kamera Seitenleiste auswählen. Stellen Sie die Software Graustufenbilder zu erwerben, indem Sie das entsprechende Optionsfeld im Bedienfeld " Farbe/grau " von der Kamera -Seitenleiste auswählen.
- Offenen Seitenleiste Platten zwischen Belichtung und Histogramm zusammenbrechen. Reduzieren Sie die Verstärkung auf 1.0 und erhöhen Sie die Belichtung zu, bis ein klares Bild erscheint im Ansichtsfenster und bis das Histogramm erscheint als eine Distribution, die nicht von beiden Enden des Feldes Histogramm befestigt ist.
- Passen Sie das Histogramm, über zu vermeiden und Unterbelichtung. Schieben Sie im Bedienfeld "Histogramm" von der Kamera-Seitenleiste der linken Begrenzung des Histogramms auf knapp außerhalb der niedrigsten Werte und Rechte Begrenzung auf knapp außerhalb der höchsten Werte.
- Speichern Sie das Bild als eine unkomprimierte TIFF, einschließlich Vergrößerung Informationen in den Bild-Metadaten, mit Hilfe der Datei > Speichern als Dialogfeld, das TIFF-Format auswählen und sicherstellen, dass Feld mit Kalibrierungsinformationen speichern wird geprüft.
Hinweis: Bild-Metadaten, einschließlich der räumlichen Kalibrierung speichern variieren zwischen Erwerb Programme. Fidschi15, die zugrunde liegende Software, die von der Pipeline verwendet versteht gebräuchlichsten Varianten. Die wichtige Informationen zu erfassen ist der Pixelhöhe, Breite und damit verbundenen Stck. - Verwenden entweder eine mobile Bühne oder manuelles Verschieben der Platte selbst, wählen Sie einen anderen Bereich, der früheren Bilder, nach einem Weg, der abwechselnd rechts-links- und rechts-nach-links als eine bewegt sich die Platte nicht überlappt; auch bekannt als ein "Rasenmäher Suchmuster". Wiederholen Sie Schritt 3,6 bis genügend Bilder produziert werden, um mindestens 500 optisch geschätzte Partikel erfassen mehr sind besser.
Hinweis: Alternativen Muster (z. B.., runden, zufällige) sind akzeptabel, aber sollten gemeldet werden. Erwerb von mehreren überlappenden Bildern für Kombination in ein Mosaik über digitale Nähte erzeugt eine Dateigröße die downstream-Processing und Artefakte aus Nähten stark behindert eingeführt werden kann und wird derzeit nicht empfohlen. - Platten bis nach Bildanalyse für potenzielle Follow-up-Bildgebung zu behalten. Nach dem endgültigen Imaging, je nach Bedarf für Biomüll entsorgen.
(4) messen und analysieren von Partikel-Silhouetten
- Die gewünschte Bild-Analyse-Software-Pakete installieren
- Installieren von Fidschi (eine erweiterte Version des National Institutes of Health ImageJ v1.52e gemäß den Anweisungen an: https://imagej.net/Fiji/Downloads
- Installieren Sie Git, falls nicht bereits vorhanden, indem Sie die Anweisungen auf: https://git-scm.com/downloads
- Erwerben Sie der Partikel Analysecode von durch Klonen der Git Repository16.
- In der Befehlszeile zum Abrufen der neuesten Version des Codes eingeben:
Git Clone https://github.com/joeweaver/SParMorIA-Sludge-Particle-Morphological-Image-Analysis.git- Installieren der Analyse folgende Code die Anweisungen in der README.md-Textdatei im obersten Verzeichnis des geklonten Repository gefunden.
Hinweis: Mit Git wird bevorzugt, da es die neueste Version des Codes automatisch abgerufen werden. Wenn Git nicht verfügbar ist, ist es auch möglich, den Code als Zip-Datei auf die Release-Seite auf download: https://github.com/joeweaver/SParMorIA-Sludge-Particle-Morphological-Image-Analysis/releases
- Installieren der Analyse folgende Code die Anweisungen in der README.md-Textdatei im obersten Verzeichnis des geklonten Repository gefunden.
- In der Befehlszeile zum Abrufen der neuesten Version des Codes eingeben:
- Bearbeiten einer Textdatei Auflisten der Verzeichnisse zusammen mit optionalen Parameter verarbeitet werden. Sie finden Sie im Unterverzeichnis Beispiele/Analyse um eine Liste der Parameter und Beispiele.
- Führen Sie die Analyse in der Befehlszeile, indem Sie eingeben:
< Fidschi-Pfad > \ImageJ-win64.exe--console - Makro SParMorIA-SludgeParticle_Morphological_Image_Analysis < Paramsfile >
wo < Fidschi-Pfad > ist das Verzeichnis, in dem ImageJ-win64.exe befindet, und < Paramsfile > die Lage der Textdatei, in der Analyse Einrichtung beschrieben
Hinweis: Der Name der ausführbaren Datei kann abweichen, je nachdem, welches Betriebssystem Fidschi auf installiert ist. Je nach Anzahl und Größe der Bilder die Analyse kann ein paar Minuten zu Stunden dauern und wird automatisch ausgeführt. - Durchführen einer Qualitätskontrolle
- Untersuchen Sie die Qualitätskontrolle-Dateien befinden sich im Unterverzeichnis "Overlay" von der angegebenen Ausgabeverzeichnis. Beachten Sie die Bilder mit der fadenscheinigen, verpasste und schlecht aufgenommene Partikel, nur offensichtlich als schattierte Umrisse, die Hintergrund nicht übereinstimmen. Beispiele für solche finden Sie in Abbildung 3 . Die Partikeldaten sind nun bereit für Experiment-spezifische Analyse Abbildung Generation.
- Lehnen Sie entweder ganze Platten oder einzelne Partikel durch die Angabe in den Analysecode bekannten Dateien und/oder Partikel-IDs ignoriert werden. Siehe Beispiele/Zensur in das Repository für entsprechende R und Python-Code.
- Generieren Sie Experiment konkrete Zahlen über die Bild-Analyse-Ergebnisse für jedes Bild werden in einer ordentlich12 Komma getrennte Textdatei im Unterverzeichnis "Ergebnisse" von der angegebenen Output-Verzeichnis gespeichert. Beziehen sich auf die Beispiele/Zahlen/R und Beispiele/Zahlen/Python Unterverzeichnisse für Beispiele dafür, wie die Ergebnisdateien zu lesen.
Ergebnisse
Generierte Dateien
Die in Abbildung 1 dargestellten Prozess erzeugt zwei Dateien pro Bild analysiert. Die erste Datei ist ein Komma getrennt Wert (CSV) Text-Datei, wo jede Zeile entspricht einer einzelnen Teilchen und die Spalten zu beschreiben verschiedene Partikel Metriken wie Fläche, Rundheit und Solidität, und ImageJ manuelle17definiert. Beispiel-CSV-Dateien sind als ergänzende Informationen und Beispiele/Daten-Verzeichnis enthalten.

Abbildung 1: Grafische Workflow beschreiben die vier wichtigsten Schritte des Protokolls. Bitte klicken Sie hier für eine größere Version dieser Figur.
Die zweite Datei ist zur Verwendung in der Qualitätskontrolle (QC) und ist ein GIF-Bild-Dateien die Überlagerungen der ursprünglichen Bild mit halb deckenden Regionen repräsentieren identifiziert Partikel, wie in Abbildung 2. Die Qualität der Teilchenidentifikation und Segmentierung kann dann schnell manuell ausgewertet werden. Zwar keine Partikel Schnittstellenüberwachung Methode perfekt18, präsentiert sich als ein Beispiel für ein akzeptables Ergebnis Abbildung 2 . Schlechte Bildqualität werden wiederholt oder wenn genügend Daten verfügbar ist, einfach aus Weiterverarbeitung entfernt.

Abbildung 2: Beispiel für eine Qualitätskontrolle (QC) GIF-Datei generiert durch die Bild-Analyse-Pipeline. Vergrößerung von 15 X Hauptbild. Auszug wird Digital gezoomt, um Zahlen, die Identifizierung einzelner Partikel im Bild zeigen. Bitte klicken Sie hier für eine größere Version dieser Figur.
Beim QC Bilder auswerten, es gibt drei häufige Fehler gefunden:
1. die Nichtbeachtung genau die Partikel Grenzen entsprechen
2. Nichtbeachtung der Teilchen zu identifizieren
3. Artefakt Aufnahme wegen entweder:-Teilchen Komponenten (z. B. Bläschen) oder Fehler im Schnittstellenüberwachung
Beispiele für diese Fehler sind in Abbildung 3dargestellt. Armen Teilchenidentifikation Grenze und Segmentierung zwischen Teilchen oft ergibt sich aus zu sterben, wie in Abbildung 3azu sehen. Schlechte Beleuchtung führt zu beiden scheitern, Teilchen (Abb. 3 b, blau gefüllter Kreis) und Artefakt falsche Partikel (Abb. 3 b, gestrichelten Kreis) zu identifizieren. Non-Teilchen Materie, wie Luftblasen, Protozoen, Pilzen und Metazoen, wie z. B. die Bärtierchen in Abbildung 3 c auch fälschlicherweise als Partikel identifiziert werden kann.

Abbildung 3: Häufige Fehler bei QC Analyse festgestellt. (ein) schlechter Partikeldetektoren Grenze. (b) falsche Partikel (rote gestrichelte Ellipse) und unsegmented Partikel (blaue solide Ellipse). (c) nicht-Fremdkörper-Objekt. Vergrößerung 15 X. Bitte klicken Sie hier für eine größere Version dieser Figur.
Es empfiehlt sich, das gesamte Bild abzulehnen. Es ist jedoch möglich, die Partikel-ID in der QC-Bild verwenden (Abbildung 2, inset), einzelne Partikel abzulehnen. Dieser Ansatz ist besonders nützlich, wenn es eine Handvoll Probleme in einem sonst nützliche Bild (z. B. die Aufnahme von nicht-Teilchen gibt) Abbildung 3 c. Beispiele dafür sind also in gewissem Sinne reproduzierbar und meldepflichtigen im Github Repository-Verzeichnis Beispiele/Zensur enthalten.
Wenn ein kleine Mindestdurchmesser angegeben (< 10 Pixel), Bildrauschen fälschlicherweise als Teilchen identifiziert werden kann. In diesen Fällen das Bild werden nach wie vor zulässig sein wenn weitere nachgelagerte Analyse entfernt ist ihre Anwesenheit. Als Richtwert sollten Shape-Daten mit Skepsis behandelt werden, wenn weniger als ~ 200 Pixel19Teilchen zusammengesetzt sind.
Figur-Generation
Die CSV-Dateien aus der Bildanalyse sind ordentlich12 und können problemlos kombiniert und analysiert in der Forscher bevorzugte Software-Paket (z. B. Pandas20 mit Seaborn21 in Python oder Dplyr22 ggplot223 in R). Jedoch wird die genaue Zahl benötigt unbedingt mit Forschungsfragen und Ergebnis variieren. Ein Beispiel für eine mögliche Abbildung unten (Abbildung 4) enthalten ist und der entsprechende Code, es aus der CSV-Dateien zu erzeugen ist auf Github16.
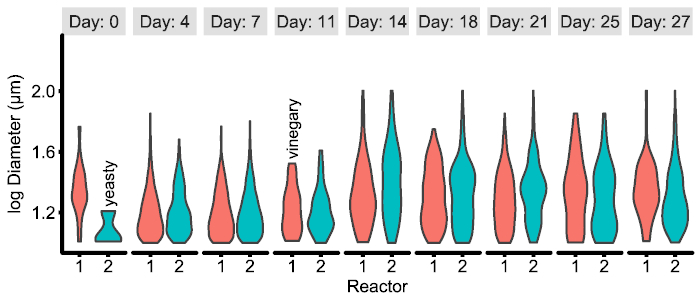
Abbildung 4: Beispiel der Experiment-spezifische Abbildung von CSV-Daten, die von der Bild-Pipeline erzeugt. In diesem Beispiel sind die Partikel Verteilungen zwischen zwei Versuchsreaktoren im Laufe der Zeit angezeigt und in Kombination mit qualitativen Metadaten vom Forscher festgestellt. Siehe Beispiele/Zahlen/R für die Generierung von Code und Daten. Bitte klicken Sie hier für eine größere Version dieser Figur.
Diskussion
Obwohl die Bild-Analyse-System ziemlich robust ist und QC Schritte unternommen, um sicherzustellen, dass schlechte Bilder entfernt sind, kann angemessene Aufmerksamkeit auf konkrete Fragestellungen in der Probenahme, Platte Vorbereitung und Bildaufnahme sowohl die Richtigkeit der Daten und der Anteil der verbessern Bilder vorbei QC.
Probenahme-Konzentration
Vorausgesetzt, dass eine repräsentative Probe entnommen worden, ist der wichtigste Schritt um sicherzustellen, dass genügend Partikel vorhanden für repräsentative9 und effiziente Analyse sind, während nicht so konzentriert, dass Partikel überlappen.
Dies hat etwa 0,5 bis 2 mL der gemischten Schnaps über einen weiten Bereich von insgesamt Schwebstoffe entsprach, Experiment-spezifische Bestimmung kann jedoch notwendig sein. Beispiele für übermäßig konzentriert, übermäßig - verdünnt, und entsprechenden Partikelkonzentrationen werden in Abbildung 5 als Referenz angezeigt. Färbung ist Partikelkonzentration betroffen. Übermäßige Verdünnung kann übermäßig gefärbt, verschwommen Partikel führen, während unter Verdünnung Partikel mit ausreichendem Kontrast für optimale Schwellwerte nicht produzieren kann.

Abbildung 5: Referenz Bilder zeigen Partikelkonzentrationen zu konzentriert, akzeptabel und übermäßig verdünnt sind. Vergrößerung 15 X. Bitte klicken Sie hier für eine größere Version dieser Figur.
Farbstoff-Konzentration
Die Höhe der Fleck hinzugefügt, um die Probe ist entscheidend und die richtige Menge variieren zwischen Schlämme. Ca. 5 µL 1 % (w/V) Methylenblau pro 0,5 bis 2 mL der Probe bietet ausreichenden Kontrast für Schwellwerte ohne "bluten" und verdunkelt die Kornform.
Es gibt keine einzelne ideale Konzentration; ein Gleichgewicht zwischen Kontrast und Klarheit muss gewählt werden. Abbildung 6 veranschaulicht dieses Kompromisses in drei Proben mit 5, 25 und 50 µL 1 % Methylenblau pro 2 mL Schlamm befleckt. Wenn dieser Kompromiss zu wiegen, ist das gelegentliche schlecht kontrastierende Teilchen (Abb. 6a) schlecht lösbaren Blobs (Abbildung 6 c) vorzuziehen.

Abbildung 6: Erhöhte Fleck Konzentration Partikel Kontrast verbessert, sondern auch verzerrt die beobachteten Grenze. Vergrößerung 15 X. Bitte klicken Sie hier für eine größere Version dieser Figur.
Platte-Lagerung
Nach Immobilisierung können Platten im Kühlschrank (4 ° C) für mindestens 3 Tage gelagert werden. Dies ist eine konservative Zeit, bei der es unwahrscheinlich ist, dass verunreinigen Wachstum und Farbstoff Diffusion erfolgt. Platten nicht zeigt eines der Probleme, die nachfolgend beschriebenen können noch nach 3 Tagen abgebildet werden. Wenn zu lange gelagert, vorhandene Partikel können weiter wachsen und wird erscheinen in der Brennebene des anderen Teilchen unter Beibehaltung des Farbtons des Flecks, wie in Abbildung 7agesehen werden kann. Oberflächenverunreinigungen wie Pilzsporen, können auch nach längerer Lagerung wachsen. Diese in der Regel die Farbe des Flecks nicht antreten werden und erscheint in einem unterschiedlichen Brennebene, wie in Abbildung 7 bersichtlich. In einigen Fällen ist es unklar, ob Überwucherung oder Diffusion des Flecks aufgetreten ist, z. B. in der Unterseite der Abbildung 7 b und Mitte der Abbildung 7 c. Unabhängig von der Ursache anzugeben Spots wie diejenigen, dass die Platte über seine Nutzungsdauer gealtert

Abbildung 7: Referenzbilder zur Veranschaulichung Überwucherung signalisiert, dass eine Platte über seine Nutzungsdauer gespeichert wurde. Vergrößerung 15 X. Bitte klicken Sie hier für eine größere Version dieser Figur.
Vorbereitung der Platte
Es gibt zwei Probleme im Zusammenhang mit körperlich vorbereiten Agarplatten - übermäßig dicken Agar und übermäßige Verwirbelung. Im ersten Fall (Abbildung 8) werden die Partikel in verschiedenen Tiefen, macht es schwierig, die Bilder mit der Mehrheit der Partikel im Fokus erwerben ausgesetzt.
Abbildung 8: Mit übermäßigen Mengen von Agar wird eine Probe dicker als die Fokalebene, was zu unscharfen Partikel produzieren. Vergrößerung 15 X. Bitte klicken Sie hier für eine größere Version dieser Figur.
Im zweiten Fall eine ungleichmäßige Verteilung der Partikel (Abbildung 9a), Vorspannen Ergebnisse aus verschiedenen Abschnitten der Platte produziert wirbelnden (Abbildung 9 b, c. In der Regel nicht mehr als 7 mL des Nährbodens ist erforderlich, um eine 100 mm Petrischale zu decken und nur sanften Handbewegungen sind notwendig, um die Schale gleichmäßig bedecken.

Abbildung 9: Übermäßig starke Verwirbelung während der Vorbereitung der Platte erscheint als ungleichmäßige Partikel Distributionen (ein), Abschnitte der Platte in Richtung größere (b) und kleiner (c) Partikel Distributionen vorspannen. Platte ist 100 mm Durchmesser, Mikrographen 15 X vergrößert. Bitte klicken Sie hier für eine größere Version dieser Figur.
Mikroskopische Bildgebung
Es gibt zwei große Bild Erwerb Probleme die Qualität beeinflussen. Die erste Ausgabe ist sicherzustellen, dass die Mehrheit der Partikel in der Brennebene. Selbst bei geringer Vergrößerung ist die Größe von vielen Belebtschlamm Teilchen so, dass ohne kleinere Anpassungen an groben Fokus, viele Partikel leicht unscharf, Einführung von ungenauen Partikel Messung. Kein Bild wird 100 % perfekt fokussiert Partikel enthalten; Abbildung 8 und Abbildung 5 b sind jeweils Beispiele für Arme und annehmbaren Fokus.
Exposition bilden das zweite große Thema. Schlecht ausgesetzt Bilder führen zu Datenverlust und schlechte Segmentierung11. Darüber hinaus kann der hohe Kontrast des Farbstoffs eine schmale Histogramm, Verringerung der effektiven Dynamikumfang der Daten produzieren. Die obere und die untere Grenze des Histogramms können angepasst werden, vor der Aufnahme eines Bilds, um zu verhindern, dass schlechte Belichtung sowohl den Dynamikumfang zu erhöhen. Beispiele von über, unter, und akzeptable Belichtungszeiten sind unten aufgeführt in Abbildung 10.

Abbildung 10: Armen und akzeptables Bild Aufnahmen zeigt Referenzbilder. Bitte klicken Sie hier für eine größere Version dieser Figur.
Vorteile dieser Methode sind, dass es bestimmte Kriterien umfasst den gesamten Prozess bietet. Darüber hinaus haben wir eine Software-Pipeline Lockerung in Laboranalysen und Förderung zwischen Lab vergleichbare Daten bereitgestellt. Die größte Beschränkung dieser Methode ist, dass die Forderung, alle Partikel konzentriert zu halten hohe Vergrößerungen, beschränken ihre Nützlichkeit für Teilchen mit kleinen kleinere Dimensionen - insbesondere faserigen Strukturen verhindert. Zukünftige Richtungen dieser Methode könnte erweiterte Bild-Analyse-Techniken (speziell Lärm-Reduzierung24,25, hohem Dynamikumfang Bildgebung, Schwerpunkt Stapeln26,27und maschinelles Lernen integrieren. assistierten Schnittstellenüberwachung, Segmentierung und Klassifikation28. Die großen Imagegewinn Erwerb würde Software zur Steuerung der mechanischen Stufen8 und produzieren "ganze Platte" Mosaik-Archiv integrieren.
Offenlegungen
Die Autoren haben nichts preisgeben.
Danksagungen
Diese Arbeit wurde durch einen Zuschuss von der National Science Foundation CBET 1336544 unterstützt.
Die Fidschi-Inseln, R und Python Logos werden mit dem in Übereinstimmung mit den folgenden Markenzeichen-Richtlinien verwendet:
Python: https://www.python.org/psf/trademarks/
R: https://www.r-project.org/Logo/ , wie pro die CC-BY-SA 4.0 Lizenz aufgelisten: https://creativecommons.org/Licenses/by-sa/4.0/
Fidschi: https://imagej.net/Licensing
Materialien
| Name | Company | Catalog Number | Comments |
| 10% Bleach solution | Chlorox | 31009 | For workspace disinfection. |
| 15 mL centrifuge tube with cap | Corning | 430790 | Per sample. |
| 50 mL Erlenmeyer flask | Corning | 4980-50 | Other vessels are suitable so long as they can contain > 40 mL of sample and allow mixing |
| 500 mL Kimax Bottle | Kimble-Chase | 14395-50 | Or otherwise sufficient for agar handling |
| Agar | BD | 214010 | Solid, to prepare 7.5% gel. 7 mL per sample. |
| Data analysis software | N/A | N/A | R or Python are suggested |
| Deionized water | N/A | N/A | Sufficient to prepare stain and agar. If unavailable, tap should be fine. |
| Desktop computer | N/A | N/A | Image analysis is not CPU intensive, any 'ordinary' desktop computer circa 2017 should be sufficient. |
| External hard drive | Seagate | STEB5000100 | Not fully required, but extremely useful given the number an size of images. 2 or more TB of storage suggested. |
| FIJI | NIH | version 1.51d | Version is ImageJ core. Plugins are updated as of writing. Available at: https://imagej.net/Fiji/Downloads |
| GIT | Open Source | version 2.19.1 or later | Available at: https://git-scm.com/ |
| Image capture software | ToupView | version 3.7.5177 | Any compatible with camera, may come with camera. Should allow saving TIFF images with spatial calibration data. |
| Mechanical (X/Y) Stage | OMAX | A512 | Not fully required, but greatly aids image acquisition. |
| Methylene blue | Fisher | M291-100 | Solid, to prepare 1% w/v solution. 5 uL solution per sample. |
| Microscope camera | OMAX | A35140U | Any digitial camera compatible with microscope. Resolution providing at least 5 um per pixel at 10x magnification and a dynamic range of at least 8 bits per pixel per color channel is suggested. |
| Optical Stage Micrometer | OMAX | A36CALM1 | Or otherwise sufficient for spatial calibration. |
| Petri dish, 100 mm | Fisher | FB0875712 | 1 per sample. |
| PPE | N/A | N/A | Standard lab coat, gloves, and eyewear. |
| Sparmoria macro | NCSU | version 0.2.1 | Available at github repository : https://github.com/joeweaver/SParMorIA-Sludge-Particle-Morphological-Image-Analysis |
| Stereo/dissecting microscope | Nikon | SMZ-2T | Should provide 10 to 20x magnficiation and allow digital photos either with a buit-in camera or profide a mounting point for a CCD. |
Referenzen
- Show, K. Y., Lee, D. J., Tay, J. H. Aerobic granulation: Advances and challenges. Applied Biochemistry and Biotechnology. 167 (6), 1622-1640 (2012).
- Adav, S. S., Lee, D. -. J., Show, K. -. Y., Tay, J. -. H. Aerobic granular sludge: Recent advances. Biotechnology Advances. 26 (5), 411-423 (2008).
- Initial Investigations of Aerobic Granulation in an Annular Gap Bioreactor. North Carolina State University Available from: https://repository.lib.ncsu.edu/handle/1840.16/2162 (2004)
- . Effect of Hydrodynamics on Aerobic Granulation Available from: https://repository.lib.ncsu.edu/handle/1840.16/8761 (2012)
- Tay, J. H., Liu, Q. S., Liu, Y. Microscopic observation of aerobic granulation in sequential aerobic sludge blanket reactor. Journal of Applied Microbiology. 91 (1), 168-175 (2001).
- Kelly, R. N., et al. Graphical Comparison of Image Analysis and Laser Diffraction Particle Size Analysis Data Obtained From the Measurements of Nonspherical Particle Systems. AAPS Pharm SciTech. 7 (3), E1-E14 (2006).
- Walisko, R., et al. The Taming of the Shrew -Controlling the Morphology of Filamentous Eukaryotic and Prokaryotic Microorganisms. Advances in Biochemical Engineering/Biotechnology. 149, 1-27 (2015).
- Campbell, R. A. A., Eifert, R. W., Turner, G. C. Openstage: A Low-Cost Motorized Microscope Stage with Sub-Micron Positioning Accuracy. PLoS ONE. 9 (2), e88977 (2014).
- Dias, P. A., et al. Image processing for identification and quantification of filamentous bacteria in in situ acquired images. BioMedical Engineering OnLine. 15 (1), 64 (2016).
- Liao, J., Lou, I., de los Reyes, F. L. Relationship of Species-Specific Filament Levels to Filamentous Bulking in Activated Sludge. Applied and Environmental Microbiology. 70 (4), 2420-2428 (2004).
- Cromey, D. W. Avoiding twisted pixels: ethical guidelines for the appropriate use and manipulation of scientific digital images. Science and Engineering Ethics. 16 (4), 639-667 (2010).
- Wickham, H. Tidy Data. Journal of Statistical Software. 59 (10), (2014).
- van Rossum, G. . Python tutorial. , (1995).
- Schindelin, J., Arganda-Carreras, I., Frise, E. FIJI: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- . SParMorIA: Sludge Particle Morphological ImageAnalysis Available from: https://github.com/joeweaver/SParMorIA-Sludge-Particle-Morphological-Image-Analysis (2018)
- Ferreira, T., Rasband, W. . ImageJ User Guide: IJ 1.42 r. , (2012).
- Sezgin, M., Sankur, B. Survey over image thresholding techniques and quantitative performance evaluation. Journal of Electronic Imaging. 13 (1), 146-166 (2004).
- Kröner, S., Doménech Carbó, M. T. Determination of minimum pixel resolution for shape analysis: Proposal of a new data validation method for computerized images. Powder Technology. 245, 297-313 (2013).
- McKinney, W. Data Structures for Statistical Computing in Python. Proceedings of the 9th Python in Science Conference. , 51-56 (2010).
- Waskom, M., et al. . seaborn: v0.5.0 (November 2014). , (2014).
- . dplyr: A Grammar of Data Manipulation Available from: https://cran.r-project.org/web/packages/dplyr/index.html (2016)
- Riley, R. S., Ben-Ezra, J. M., Massey, D., Slyter, R. L., Romagnoli, G. Digital Photography: A Primer for Pathologists. Journal of Clinical Laboratory Analysis. 18 (2), 91-128 (2004).
- Singh, S., Bray, M. A., Jones, T. R., Carpenter, A. E. Pipeline for illumination correction of images for high-throughput microscopy. Journal of Microscopy. 256 (3), 231-236 (2014).
- Eastwood, B. S., Childs, E. C. Image Alignment for Multiple Camera High Dynamic Range Microscopy. Proceedings. IEEE Workshop on Applications of Computer Vision. , 225-232 (2012).
- High Dynamic Range Microscopy for Cytopathological Cancer Diagnosis. IEEE Journal of Selected Topics in Signal Processing (Special Issue on: Digital Image Processing Techniques for Oncology) Available from: https://www.lfb.rwth-aachen.de/en/ (2009)
- Jain, V., et al. Supervised Learning of Image Restoration with Convolutional Networks. 2007 IEEE 11th International Conference on Computer Vision. , 1-8 (2007).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten