Method Article
Medición de la forma y el tamaño de las partículas de lodo activado inmovilizado en Agar con una tubería de Software de código abierto
En este artículo
Resumen
El tamaño y forma de las partículas de lodos activados son parámetros importantes que se miden utilizando diferentes métodos. Errores surgen de muestreo no representativo, imágenes subóptimas y parámetros de análisis subjetivo. Para minimizar estos errores y facilitar la medición, presentamos un protocolo especificando cada paso, incluyendo un oleoducto de software de código abierto.
Resumen
Bioreactores experimentales, tales como ésos tratamiento de aguas residuales, contienen partículas cuyo tamaño y forma son parámetros importantes. Por ejemplo, el tamaño y la forma de flóculos de lodo activado pueden indicar las condiciones en la microescala y afectan también directamente cómo el lodo se instala en un clarificador.
Forma y tamaño de las partículas son ambas medidas misleadingly 'simples'. Muchas cuestiones sutiles, a menudo ignoradas en protocolos informales, pueden surgir cuando el muestreo, la proyección de imagen y análisis de partículas. Métodos de muestreo pueden ser sesgados o no proporcionan suficiente poder estadístico. Las muestras se pueden llevar mal o sufren alteración durante la inmovilización. Las imágenes pueden ser de calidad suficiente; superposición de partículas, profundidad de campo, nivel de ampliación y ruidos varios puede todos producir malos resultados. Mal especificado análisis pueden introducir sesgos, como el producido por segmentación y umbral de imagen manual.
Rendimiento y la asequibilidad son deseables junto con reproducibilidad. Un método asequible, de alto rendimiento permite medición de partícula más frecuente, produciendo muchas imágenes que contiene miles de partículas. Un método que utiliza reactivos de bajo costo, un microscopio de disección común y libremente disponibles análisis software libre permite resultados experimentales repetibles, accesibles, reproducibles y parcialmente automatizado. Además, el producto de dicho método puede ser bien formateado, bien definido y fácil de entender por software de análisis de datos, facilitando datos entre laboratorios y análisis en laboratorio.
Presentamos un protocolo que detalla los pasos necesarios para producir un producto, incluyendo: toma de muestras, la muestra preparación e inmovilización en agar, adquisición de imagen digital, análisis digital de imágenes y ejemplos de generación específicos del experimento figura de la resultados del análisis. También hemos incluido un gasoducto de análisis de datos de código abierto para apoyar este protocolo.
Introducción
El propósito de este método es proporcionar un método bien definido, repetible y parcialmente automatizados para determinar las distribuciones de tamaño y forma de las partículas en biorreactores, especialmente aquellas que contienen los flóculos de lodo activado y gránulos aerobios1 , 2. el fundamento de este método mejorar la accesibilidad, sencillez, rendimiento y repetibilidad de nuestros actuales protocolos internos3,4, facilitar la medición de partículas de otros, facilitar el intercambio y comparación de los datos.
Hay dos categorías generales de análisis de medición de partículas - métodos directo imágenes e inferenciales mediante tales cualidades como la dispersión de la luz5. Aunque métodos inferenciales pueden ser automatizados y tienen gran rendimiento, el equipo es caro. Además, mientras métodos inferenciales pueden determinar con precisión el tamaño equivalente de una partícula6, no proporcionan información de forma detallada7.
Debido a la necesidad de datos de formas, nos hemos basado nuestro método en la proyección de imagen directa. Aunque existen algunos métodos de proyección de imagen de alto rendimiento, ha requerido tradicionalmente caro hardware comercial o soluciones construido8,9. Nuestro método ha sido desarrollado para emplear común y asequible hardware y software que, aunque sufren de una reducción en el rendimiento, produce imágenes de partículas mucho más que el mínimo necesario para muchos análisis10.
No debe especificar los protocolos muestreo importante y los pasos de adquisición de imagen. Otros protocolos pueden especificar pasos manuales que introducen sesgos subjetivos (tales como umbral ad hoc11). Un método bien definido que especifica los pasos de adquisición muestreo, inmovilización e imagen combinados con software de análisis gratuitamente mejorará tanto dentro del laboratorio de imagen análisis y comparaciones entre laboratorios. Un objetivo principal de este protocolo es proporcionar un flujo de trabajo y herramientas que deben conducir a resultados reproducibles de diferentes laboratorios para la misma muestra.
Además de normalizar el proceso de análisis de imagen, los datos producidos por este gasoducto se registran en un archivo bien definidos y bien formateado,12 adecuado para uso popular datos análisis paquetes13,14, experimento de relajación análisis específicos (como la generación de la figura de encargo) y facilitar información entre laboratorios.
Este protocolo se recomienda especialmente para los investigadores que requieren datos de forma de partícula, no tienen acceso a los métodos inferenciales, desea desarrollar su propia tubería de análisis de imagen y desea compartir sus datos fácilmente con otros
Protocolo
1. recolectar muestras para análisis de partículas
- Determinar el volumen de muestra para reactores específicos que se producen suficientes partículas para análisis estadístico10 (> 500) evitando superposición de partículas.
- Asumir que una gama de 0.5 a 2 mL por muestra de licor mezcla es suficiente para las muestras de lodos activados con una sólidos suspendido de licor mezcla (MLSS) entre 250 y 5.000 mg/L.
- De lo contrario, preparar tres placas de agar de ensayo con 0.5, 2 y 5 mL de muestra (pasos de 1.2 a 2.7).
- Estimar visualmente que (si cualquier) volúmenes de muestra mejor cumplir con los criterios enumerados en el paso 1.1.
- Si las partículas se superponen todavía para la muestra de 0,5 mL, repita los pasos 1.1.2 y 1.1.3 con tres muestras de 0,5 mL, diluidas con un agregado 0.5, 1 y 2 mL de tampón fosfato salino para determinar el grado en que una muestra de 0,5 mL debe diluirse antes de paso 2.1.
Nota: Pasos 1.1 − 1.1.4 deben realizarse solamente una vez por el experimento, o si el reactor contenido cambio tal que medidas no cumplen los criterios enumerados en el paso 1.1.
- Obtener una muestra representativa de una porción bien mezclada del reactor por acaparamiento ~ 40 mL en un vaso de precipitados o un tubo de centrífuga de 50 mL, mezclar suavemente y verter inmediatamente el volumen de muestra determinado de la cuchara bien mezclada en un tubo de centrífuga de 15 mL. Diluir la muestra, es necesario, según lo determinado por el paso 1.1.4.
Nota: El protocolo puede ser una pausa aquí y la muestra puede conservarse bajo refrigeración (4 ° C) hasta 48 horas. No congele la muestra.
PRECAUCIÓN: medio de conservación común (p. ej., formaldehído/formamida) no es adecuado. La gran superficie de la placa, en combinación con el recipiente abierto, calor de la fuente de luz y microscopia potencialmente mal ventilada instalación producir innecesariamente peligrosas condiciones para poco aumento en la calidad de la imagen.
2. preparar las placas de agar de partículas teñidas, inmovilizadas
- Añadir 5 μl de azul de metileno 1% (p/v) a cada muestra, luego tapa e invierta suavemente al menos 3 veces para mezclar. Permita que las muestras a la mancha de al menos 5 pero no más de 30 minutos a temperatura ambiente.
- Preparar aproximadamente 10 mL por muestra de agar 7,5% (p/v) en agua desionizada.
Nota: El Agar puede producido antes de tiempo y almacenado indefinidamente si esterilizado. Agarosa se puede sustituir, pero no mejora sustancialmente la imágenes. - Fundir el agar utilizando un baño de agua o microondas y deje que se enfríe un poco antes de su uso. Asegúrese de que el agar se derrita totalmente y vierte fácilmente. Glóbulos sólidos de agar se manchan diferentemente, produciendo imágenes de mala calidad.
- Transferir suficiente agar fundido de 7.5% (w/v) al tubo de centrífuga para hacer el volumen total del tubo entre 6,5 y 9 mL.
- Volver a tapar los tubos de centrífuga e invierta suavemente por lo menos 3 veces para mezclar.
- Y señalando la tapa lejos de uno mismo o en una campana, abra la tapa. Verter el contenido del tubo en un recipiente plástico de 100 mm plato de Petri mientras balanceo suavemente el plato para conseguir una capa completa, suave y una distribución visualmente uniforme de partículas.
PRECAUCIÓN: El calor del agar puede producir una ligera sobrepresión en el tubo. Esto a menudo produce un silbido audible y tiene el potencial para expulsar pequeñas gotitas de agar caliente. - Permita que las placas se enfríe a temperatura ambiente durante al menos 5 minutos, hasta que el agar se solidifica.
Nota: El protocolo se puede detener aquí. Tienda plateado invertida y sellados (por ejemplo, en una bolsa de plástico selladora o con la película de parafina) durante 48 horas bajo refrigeración (4 ° C).
3. adquisición de imágenes de partículas usando un estereomicroscopio y cámara digital
- Coloque la placa destapada boca arriba sobre la platina del microscopio de un estereomicroscopio capaz de 10 x a 20 aumentos. Iluminar la muestra desde abajo con luz difusa, incluso usando equipos como un soporte del iluminador LED o luz de placa.
- Abra el software de captura de imagen, asegúrese de la trayectoria de la luz de microscopio es fotoy haga clic en la correspondiente Cámara de la lista de la cámara.
- Ajuste del microscopio para que múltiples partículas aparecen en el software en el plano focal con bordes grandes y bien definidos. Utilice un aumento de 10-20 x para medir partículas manteniendo un plano focal relativamente profundo.
- Temporalmente, quite la placa de agar y colocar el micrómetro en el escenario. Ajuste el enfoque fino hasta que las graduaciones en el micrómetro agudamente enfocadas en el software de captura de imagen.
- Si no previamente calibrado, grabar el pixel ratio micro para la ampliación actual.
- Establezca el zoom al 100% haciendo clic en Zoom > tamaño real y seleccione Opciones > calibrar luego alinee la barra de calibración rojo en la vista principal en el eje largo del micrómetro, con las barras verticales centrados en las graduaciones de 0 a 200 μm. En el cuadro de diálogo calibrar , escriba el nivel actual de la ampliación y la longitud real de 200 μm.
- Si ya calibrado seleccione ampliación de la barra de menú, y seleccione la ampliación actual nivel y confirma la calibración.
- Seleccione medidas > línea > arbitraria línea. Haga clic en la intersección de la graduación 0 y eje del micrómetro. Haga clic de nuevo en la intersección en el 200 y el largo del eje. A correcta calibración debería mostrar aproximadamente 200 μm. Elimine la línea haciendo clic sobre él, presionar delete y presionar sí en el cuadro de confirmación.
Nota: Las instrucciones para seleccionar la cámara y la calibración son específicas para el software utilizado para este hardware. Funciones similares deben estar disponibles en otro software de proyección de imagen. El objetivo es determinar el píxel ratio micrones de la imagen para la medida de tamaño de partícula exacta.
- Seleccione medidas > línea > arbitraria línea. Haga clic en la intersección de la graduación 0 y eje del micrómetro. Haga clic de nuevo en la intersección en el 200 y el largo del eje. A correcta calibración debería mostrar aproximadamente 200 μm. Elimine la línea haciendo clic sobre él, presionar delete y presionar sí en el cuadro de confirmación.
- Vuelva a colocar la placa de agar y ajuste el enfoque fino para lograr el máximo detalle en el software de imágenes.
- Ajustar el software de imágenes para que se logre la máxima calidad de imagen.
- Aumentar la profundidad de bits para el valor máximo permitido, seleccionando el botón en el panel de la Profundidad de bits de la barra lateral de la cámara . Configure el software para la adquisición de imágenes en escala de grises seleccionando el botón de radio adecuado en el panel de Color gris de la barra lateral de la cámara .
- Contraer cualquier panel lateral abierto entre la exposición y el histograma. Reducir la ganancia de 1.0 y aumentar la exposición, aparezca una imagen clara en la vista y hasta que aparezca el histograma como una distribución que no se recorta por los extremos de la caja del histograma.
- Ajuste el histograma para evitar la sobre y subexposición. En el panel Histograma de la barra lateral de cámara, deslice el límite izquierdo del histograma a sólo fuera de los valores más bajos y el límite derecho apenas fuera de los valores más altos.
- Guarda la imagen como un TIFF sin comprimir, incluyendo información de ampliación en los metadatos de imagen, usando el archivo > Guardar como cuadro de diálogo, seleccionar el formato TIFF y asegurándose de que la casilla Guardar información de calibración se comprueba.
Nota: Guardar metadatos de imagen, incluyendo la calibración espacial, puede variar entre programas de adquisición. FIJI15, el software subyacente utilizado por la tubería comprende variantes más frecuentes. La información importante a registrar es el pixel altura, ancho y unidad asociada. - Use ya sea una etapa móvil o mover manualmente la placa en sí, seleccionar otra área, que no se superpone imágenes anteriores, siguiendo un camino que alterna entre de izquierda a derecha y de derecha a izquierda como uno se mueve hacia abajo de la placa; también conocido como un 'máquina patrón de búsqueda'. Repita el paso 3.6 hasta que se producen suficientes imágenes para capturar partículas visualmente estimadas por lo menos 500 más son mejores.
Nota: Patrones alternativas (por ejemplo., circular, al azar) son aceptables pero deben ser informados. Adquirir múltiples imágenes superpuestas para la combinación en un mosaico via digital costura produce un tamaño de archivo resultante que dificulta mucho procesamiento descendente y artefactos de costura puede introducirse y no es recomendable. - Retener las placas hasta después del análisis de imagen para la proyección de imagen de seguimiento posibles. Después de la proyección de imagen final, descartar como apropiado para residuos biológicos.
4. medir y analizar las siluetas de la partícula
- Instalar los paquetes de software de análisis de imagen requerida
- Instalar FIJI (una versión mejorada de ImageJ v1.52e de los institutos nacionales de salud siguiendo las instrucciones en: https://imagej.net/Fiji/Downloads
- Instalar git, si no está ya presente, siguiendo las instrucciones en: https://git-scm.com/downloads
- Adquirir el código de análisis de partículas de clonar el repositorio git del16.
- En la línea de comandos, recuperar la última versión del código escribiendo:
git clone https://github.com/joeweaver/SParMorIA-Sludge-Particle-Morphological-Image-Analysis.git- Instalar el siguiente código de análisis las instrucciones en el archivo de texto README.md se encuentran en el directorio superior del repositorio clonado.
Nota: Usando git es preferido, como va recuperar automáticamente la última versión del código. Si git no está disponible, también es posible descargar el código en un archivo zip en la página de lanzamiento en: https://github.com/joeweaver/SParMorIA-Sludge-Particle-Morphological-Image-Analysis/releases
- Instalar el siguiente código de análisis las instrucciones en el archivo de texto README.md se encuentran en el directorio superior del repositorio clonado.
- En la línea de comandos, recuperar la última versión del código escribiendo:
- Editar un archivo de texto, listado de los directorios a procesar, junto con parámetros opcionales. Consulte en el subdirectorio de ejemplos y análisis para obtener una lista de parámetros y ejemplos.
- Ejecutar el análisis en la línea de comandos escribiendo:
\ImageJ-win64.exe < ruta de FIJI >--consola - macro SParMorIA-SludgeParticle_Morphological_Image_Analysis < paramsfile >
donde < ruta de FIJI > es el directorio donde se encuentra win64.exe ImageJ y < paramsfile > la ubicación del archivo de texto que describe la configuración de análisis
Nota: El nombre del ejecutable puede diferir dependiendo de que sistema operativo FIJI está instalado en. Dependiendo del número y tamaño de las imágenes, el análisis puede llevar unos minutos a horas y se ejecutará automáticamente. - Realizar control de calidad
- Examinar los archivos de control de calidad ubicados en el subdirectorio de superposición del directorio de resultados especificado. Nota imágenes falsas, perdidas y mal capturado partículas todo aparente como contornos de sombreado que no coinciden con el fondo. Consulte figura 3 ejemplos de ello. Los datos de la partícula ahora están listos para la generación de la figura de análisis específicos del experimento.
- Rechazar todo placas o partículas individuales especificando en el código de análisis de los archivos conocidos y/o partículas ID a ser ignorado. Consulte los ejemplos/censura en el repositorio de código relevante R y Python.
- Generar figuras específicas del experimento utilizando los resultados de análisis de imagen para cada imagen se almacenan en un archivo de texto separado por comas ordenado12 en el subdirectorio resultados del directorio de resultados especificado. Consulte los ejemplos/figuras/R y ejemplos/figuras/Python subdirectorios para ejemplos de cómo leer los archivos de resultados.
Resultados
Archivos generados
El proceso ilustrado en la figura 1 produce dos archivos por imagen analizada. El primer archivo es una coma separa el archivo de texto de valores (CSV) donde cada fila corresponde a una partícula individual y las columnas describen varios indicadores de partículas tales como área, circularidad y solidez y definidos en el manual de ImageJ17. Archivos CSV de ejemplo se incluyen como información complementaria y en el directorio de ejemplos y datos.

Figura 1: Flujo de trabajo gráfico que describe los cuatro pasos principales del protocolo. Haga clic aquí para ver una versión más grande de esta figura.
El segundo archivo está diseñado para uso en control de calidad (QC) y es una imagen GIF archivo que sobrepone las partículas originales de imagen con regiones semi opacas que representa identificar, como en la figura 2. La calidad de la identificación de la partícula y segmentación luego puede ser evaluada rápidamente manualmente. Aunque ningún método de umbralización de la partícula es perfecto18, figura 2 se presenta como un ejemplo de un resultado aceptable. Imágenes de mala calidad pueden ser retomados, o si hay datos suficientes, simplemente extraídos de la transformación posterior.

Figura 2: Ejemplo de un gif de Control de calidad (QC), generado por la tubería de análisis de imagen. Ampliación de imagen principal 15 x. Extracto se haga zoom digital para mostrar los números de identificación de las partículas individuales de la imagen. Haga clic aquí para ver una versión más grande de esta figura.
Al evaluar imágenes de control de calidad, hay tres errores comunes encontrados:
1. Si no se ajustan exactamente a los límites de partículas
2. falta de identificar las partículas
3. inclusión de artefacto debido a: no partícula componentes (por ejemplo, burbujas), o errores en el umbral
Ejemplos de estos errores se ilustran en la figura 3. Pobre de la partícula límite identificación y segmentación entre partículas a menudo es el resultado de morir demasiado, como se ve en la figura 3a. Iluminación deficiente puede llevar a tanto fracaso para identificar partículas (figura 3b, círculo azul sólida) y artefacto falso (figura 3b, círculo discontinuo rojo). Partícula no importa, como burbujas, hongos, protozoos y metazoos, tales como el tardígrado en figura 3 c también puede identificarse cifra como partículas.

Figura 3: Errores comunes detectados durante el análisis de control de calidad. (a) detección de límite de partículas pobres. (b) partículas espurias (elipse discontinua roja) y no segmentados (elipse azul sólida). (c) extranjeros no partícula objeto. Aumento 15 x. Haga clic aquí para ver una versión más grande de esta figura.
Es más fácil rechazar toda la imagen. Sin embargo, es posible utilizar el identificador de partículas en la imagen de control de calidad (figura 2, encarte) para rechazar las partículas individuales. Este enfoque es particularmente útil cuando hay un puñado de temas en una imagen si no útil (como la inclusión de partículas no) c Figura 3. De hacer tan de una manera reproducible y reportable se incluyen ejemplos en el directorio ejemplos/censura del repositorio de github.
Cuando se especifica un diámetro mínimo (< 10 píxeles), ruido de imagen puede identificarse cifra como una partícula. En esos casos, la imagen puede ser todavía ser aceptado una vez más río abajo análisis elimina su presencia. Como pauta, datos de la forma deben tratarse con escepticismo cuando las partículas se componen de menos de ~ 200 píxeles19.
Generación de la figura
Los archivos CSV resultante de los análisis de la imagen son ordenado12 y pueden fácilmente combinar y analizados en el paquete de software recomendado: el investigador (por ejemplo, pandas20 con seaborn21 en Python o dplyr22 con ggplot223 en R). Sin embargo, el tipo de figura exacta requerido necesariamente variará de preguntas de investigación y resultado. Un ejemplo de una posible figura se incluye a continuación (figura 4) y el código correspondiente a la generación de los archivos CSV está disponible en github16.
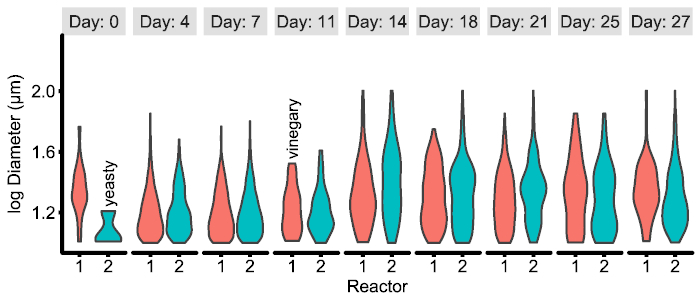
Figura 4: Ejemplo de figura de experimento específicos generado a partir de datos CSV producidos por la tubería de la imagen. En este ejemplo, la distribución de partículas entre dos reactores experimentales, con el tiempo se muestran y se combina con metadatos cualitativas observadas por el investigador. Ver ejemplos/figuras/R para la generación de código y datos. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Aunque el sistema de análisis de imagen es bastante robusto y pasos de control de calidad se toman para asegurar imágenes pobres se retiran, la atención adecuada a problemas específicos en la adquisición de la imagen, muestreo y preparación de las placas puede mejorar tanto la precisión de los datos y la proporción de imágenes pasando del control de calidad.
Concentración de muestras
Suponiendo que se ha tomado una muestra representativa, es el paso más importante asegurar que suficientes partículas están presentes para representante9 y análisis eficiente aunque no tan concentradas que las partículas se superponen.
Esto ha correspondido a aproximadamente 0.5 a 2 mL de licor mezcla sobre una amplia gama de sólidos suspendidos totales y específicos del experimento de determinación puede ser necesaria. Ejemplos de demasiado concentrado, demasiado - diluyen, y las concentraciones de partículas correspondientes se muestran en la figura 5 como una referencia. La coloración también es afectada por la concentración de partículas. Dilución excesiva puede resultar en partículas excesivamente manchadas, borrosas mientras que debajo-dilución no puede producir partículas con suficiente contraste de umbral óptimo.

Figura 5: Referencia de imágenes mostrando concentraciones de partículas que son demasiado concentrado, aceptable y demasiado diluido. Aumento 15 x. Haga clic aquí para ver una versión más grande de esta figura.
Concentración de colorante
La cantidad de colorante añadido a la muestra es crucial y la cantidad correcta puede variar entre lodos. Aproximadamente 5 μl de azul de metileno 1% (p/v) por 0.5 a 2 mL de la muestra proporciona suficiente contraste para umbral sin causar 'sangrado' y oscurecimiento de la forma de la partícula.
No hay solo concentración ideal; debe elegirse un balance entre el contraste y la claridad. La figura 6 ilustra esta compensación en tres muestras teñidas con 5, 25 y 50 μl de azul de metileno 1% por cada 2 mL de lodo. Cuando este equilibrio de peso, la partícula mal contraste ocasional (Figura 6a) se prefiere sobre mal solución gotas (figura 6 c).

Figura 6: Manchas de mayor concentración mejora el contraste de la partícula, pero también distorsiona el límite observado. Aumento 15 x. Haga clic aquí para ver una versión más grande de esta figura.
Almacenamiento de la placa
Después de la inmovilización, las placas pueden almacenarse bajo refrigeración (4 ° C) durante al menos 3 días. Se trata de un período conservador, durante el cual es probable que se presente contaminación de difusión del crecimiento y del tinte. Las placas no muestra ninguna de las cuestiones que se describen a continuación pueden ser reflejadas todavía después de 3 días. Cuando se almacena durante demasiado tiempo, partículas existentes pueden seguir creciendo y va aparecer en el plano focal de otras partículas conservando la tonalidad de la mancha, como puede verse en la Figura 7a. Contaminantes de la superficie, como las esporas de hongos, también pueden crecer después de largos períodos de almacenamiento. Estos generalmente no tomará el color de la mancha y aparecen en un plano focal diferente, como puede verse en la figura 7b. En algunos casos, es confuso si se ha producido crecimiento excesivo o difusión de la mancha, como en la parte inferior de la figura 7b y centro de la Figura 7c. Independientemente de la causa, manchas como las que indican que la placa ha envejecido más allá de su vida útil

Figura 7: Imágenes de referencia que ilustra el crecimiento excesivo de señalización que se ha almacenado una placa más allá de su vida útil. Aumento 15 x. Haga clic aquí para ver una versión más grande de esta figura.
Preparación de las placas
Hay dos problemas asociados con la preparación física de las placas de agar - agar demasiado espesa y excesiva agitación. En el primer caso (figura 8), las partículas a ser suspendidas en varias profundidades, dificultando la adquisición de imágenes con la mayoría de las partículas en foco.
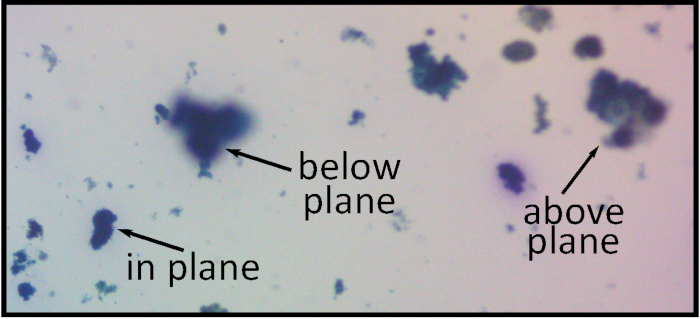
Figura 8: Usar cantidades excesivas de agar producirá una muestra más gruesa que el plano focal, resultando en partículas borrosas. Aumento 15 x. Haga clic aquí para ver una versión más grande de esta figura.
En el segundo caso, se arremolinan produce una distribución no uniforme de las partículas (Figura 9a), sesgar los resultados de las diferentes secciones de la placa (Figura 9b, c. Generalmente, no más de 7 mL de agar es necesaria para cubrir un plato de Petri de 100 mm y sólo movimientos de la mano suave se necesitan para cubrir uniformemente el plato.

Figura 9: Agitación demasiado vigorosa durante la preparación de las placas aparecerá como no uniforme distribución de partículas (una), las secciones de la placa más grande (b) y distribución de partículas más pequeñas (c) de polarización. Placa de 100 mm de diámetro, micrografías magnificado x 15. Haga clic aquí para ver una versión más grande de esta figura.
La proyección de imagen microscópica
Hay dos temas de adquisición de imagen principales que afectan a la calidad. La primera cuestión es asegurar que la mayoría de las partículas son en el plano focal. Incluso en la ampliación baja, el tamaño de muchas partículas de lodo activado es tal que sin ajustes menores a macrométrica, muchas partículas será ligeramente fuera de foco, introducir medida inexacta de la partícula. Ninguna imagen contendrá partículas 100% perfectamente centrado; Figura 8 y figura 5b son ejemplos respectivos de foco aceptable y pobre.
Los niveles de exposición constituyen la segunda cuestión importante. Mal expuestos resultan imágenes en pérdida de datos y segmentación pobres11. Además, el alto contraste de colorante puede producir un histograma estrecho, reducir el rango dinámico efectivo de los datos. Los límites superiores e inferiores del histograma pueden ajustarse antes de capturar una imagen para evitar la exposición de los pobres y aumentar el rango dinámico. Ejemplos de sobre, debajo y aceptable exposiciones se incluyen a continuación en la figura 10.

Figura 10: Imágenes de referencia que muestran exposiciones de imagen mala y aceptable. Haga clic aquí para ver una versión más grande de esta figura.
Ventajas de este método están que proporciona criterios específicos que abarca todo el proceso. Además, hemos incluido una tubería software facilitando el análisis en el laboratorio y la promoción de datos comparables entre lab. La principal limitación de este método es que el requisito de mantener todas las partículas se centró impide grandes aumentos, limitando su utilidad para las partículas con dimensiones menores pequeñas - en particular las estructuras filamentosas. Direcciones futuras de este método pueden incorporar técnicas de análisis de imágenes avanzado (específicamente de24,de reducción de ruido25, proyección de imagen de alto rango dinámico, enfoque apilamiento26,27y aprender de máquina asistida por umbralización, segmentación y clasificación28. La mejora de adquisición de imagen principales incorpora software para controlar las etapas mecánicas8 y producir archivos de mosaico 'placa entera'.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo fue financiado por una subvención de la nacional Science Foundation CBET 1336544.
Los logotipos de FIJI, R y Python se utilizan con el de acuerdo con las siguientes políticas de marca registrada:
Python: https://www.python.org/psf/trademarks/
R: https://www.r-project.org/Logo/ , según la licencia CC-BY-SA 4.0 en: https://creativecommons.org/Licenses/by-sa/4.0/
Fiji: https://imagej.net/Licensing
Materiales
| Name | Company | Catalog Number | Comments |
| 10% Bleach solution | Chlorox | 31009 | For workspace disinfection. |
| 15 mL centrifuge tube with cap | Corning | 430790 | Per sample. |
| 50 mL Erlenmeyer flask | Corning | 4980-50 | Other vessels are suitable so long as they can contain > 40 mL of sample and allow mixing |
| 500 mL Kimax Bottle | Kimble-Chase | 14395-50 | Or otherwise sufficient for agar handling |
| Agar | BD | 214010 | Solid, to prepare 7.5% gel. 7 mL per sample. |
| Data analysis software | N/A | N/A | R or Python are suggested |
| Deionized water | N/A | N/A | Sufficient to prepare stain and agar. If unavailable, tap should be fine. |
| Desktop computer | N/A | N/A | Image analysis is not CPU intensive, any 'ordinary' desktop computer circa 2017 should be sufficient. |
| External hard drive | Seagate | STEB5000100 | Not fully required, but extremely useful given the number an size of images. 2 or more TB of storage suggested. |
| FIJI | NIH | version 1.51d | Version is ImageJ core. Plugins are updated as of writing. Available at: https://imagej.net/Fiji/Downloads |
| GIT | Open Source | version 2.19.1 or later | Available at: https://git-scm.com/ |
| Image capture software | ToupView | version 3.7.5177 | Any compatible with camera, may come with camera. Should allow saving TIFF images with spatial calibration data. |
| Mechanical (X/Y) Stage | OMAX | A512 | Not fully required, but greatly aids image acquisition. |
| Methylene blue | Fisher | M291-100 | Solid, to prepare 1% w/v solution. 5 uL solution per sample. |
| Microscope camera | OMAX | A35140U | Any digitial camera compatible with microscope. Resolution providing at least 5 um per pixel at 10x magnification and a dynamic range of at least 8 bits per pixel per color channel is suggested. |
| Optical Stage Micrometer | OMAX | A36CALM1 | Or otherwise sufficient for spatial calibration. |
| Petri dish, 100 mm | Fisher | FB0875712 | 1 per sample. |
| PPE | N/A | N/A | Standard lab coat, gloves, and eyewear. |
| Sparmoria macro | NCSU | version 0.2.1 | Available at github repository : https://github.com/joeweaver/SParMorIA-Sludge-Particle-Morphological-Image-Analysis |
| Stereo/dissecting microscope | Nikon | SMZ-2T | Should provide 10 to 20x magnficiation and allow digital photos either with a buit-in camera or profide a mounting point for a CCD. |
Referencias
- Show, K. Y., Lee, D. J., Tay, J. H. Aerobic granulation: Advances and challenges. Applied Biochemistry and Biotechnology. 167 (6), 1622-1640 (2012).
- Adav, S. S., Lee, D. -J., Show, K. -Y., Tay, J. -H. Aerobic granular sludge: Recent advances. Biotechnology Advances. 26 (5), 411-423 (2008).
- Williams, J. C. Initial Investigations of Aerobic Granulation in an Annular Gap Bioreactor. North Carolina State University. , Available from: https://repository.lib.ncsu.edu/handle/1840.16/2162 (2004).
- Moghadam, B. K. Effect of Hydrodynamics on Aerobic Granulation. , Available from: https://repository.lib.ncsu.edu/handle/1840.16/8761 (2012).
- Tay, J. H., Liu, Q. S., Liu, Y. Microscopic observation of aerobic granulation in sequential aerobic sludge blanket reactor. Journal of Applied Microbiology. 91 (1), 168-175 (2001).
- Kelly, R. N., et al. Graphical Comparison of Image Analysis and Laser Diffraction Particle Size Analysis Data Obtained From the Measurements of Nonspherical Particle Systems. AAPS Pharm SciTech. 7 (3), Available from: http://www.aapspharmscitech.org E1-E14 (2006).
- Walisko, R., et al. The Taming of the Shrew -Controlling the Morphology of Filamentous Eukaryotic and Prokaryotic Microorganisms. Advances in Biochemical Engineering/Biotechnology. 149, 1-27 (2015).
- Campbell, R. A. A., Eifert, R. W., Turner, G. C. Openstage: A Low-Cost Motorized Microscope Stage with Sub-Micron Positioning Accuracy. PLoS ONE. 9 (2), e88977(2014).
- Dias, P. A., et al. Image processing for identification and quantification of filamentous bacteria in in situ acquired images. BioMedical Engineering OnLine. 15 (1), 64(2016).
- Liao, J., Lou, I., de los Reyes, F. L. III Relationship of Species-Specific Filament Levels to Filamentous Bulking in Activated Sludge. Applied and Environmental Microbiology. 70 (4), 2420-2428 (2004).
- Cromey, D. W. Avoiding twisted pixels: ethical guidelines for the appropriate use and manipulation of scientific digital images. Science and Engineering Ethics. 16 (4), 639-667 (2010).
- Wickham, H. Tidy Data. Journal of Statistical Software. 59 (10), (2014).
- R Core Team. R: A language and environment for statistical computing. , Available from: http://www.r-project.org (2017).
- van Rossum, G. Python tutorial. , Amsterdam. CS-R9526 (1995).
- Schindelin, J., Arganda-Carreras, I., Frise, E. FIJI: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Weaver, J. E. SParMorIA: Sludge Particle Morphological ImageAnalysis. , Available from: https://github.com/joeweaver/SParMorIA-Sludge-Particle-Morphological-Image-Analysis (2018).
- Ferreira, T., Rasband, W. ImageJ User Guide: IJ 1.42 r. , National Institute of Health. (2012).
- Sezgin, M., Sankur, B. Survey over image thresholding techniques and quantitative performance evaluation. Journal of Electronic Imaging. 13 (1), 146-166 (2004).
- Kröner, S., Doménech Carbó, M. T. Determination of minimum pixel resolution for shape analysis: Proposal of a new data validation method for computerized images. Powder Technology. 245, 297-313 (2013).
- McKinney, W. Data Structures for Statistical Computing in Python. Proceedings of the 9th Python in Science Conference. , 51-56 (2010).
- Waskom, M., et al. seaborn: v0.5.0 (November 2014). , (2014).
- Wickham, H. dplyr: A Grammar of Data Manipulation. , Available from: https://cran.r-project.org/web/packages/dplyr/index.html (2016).
- Wickham, H. ggplot2: Elegant Graphics for Data Analysis. , Springer-Verlag. New York. Available from: http://ggplot2.org (2009).
- Riley, R. S., Ben-Ezra, J. M., Massey, D., Slyter, R. L., Romagnoli, G. Digital Photography: A Primer for Pathologists. Journal of Clinical Laboratory Analysis. 18 (2), 91-128 (2004).
- Singh, S., Bray, M. A., Jones, T. R., Carpenter, A. E. Pipeline for illumination correction of images for high-throughput microscopy. Journal of Microscopy. 256 (3), 231-236 (2014).
- Eastwood, B. S., Childs, E. C. Image Alignment for Multiple Camera High Dynamic Range Microscopy. Proceedings. IEEE Workshop on Applications of Computer Vision. , 225-232 (2012).
- Bell, A. A., Brauers, J., Kaftan, J. N., Meyer-Ebrecht, D., Aach, T. High Dynamic Range Microscopy for Cytopathological Cancer Diagnosis. IEEE Journal of Selected Topics in Signal Processing (Special Issue on: Digital Image Processing Techniques for Oncology). 3 (1), Available from: https://www.lfb.rwth-aachen.de/en/ 170-184 (2009).
- Jain, V., et al. Supervised Learning of Image Restoration with Convolutional Networks. 2007 IEEE 11th International Conference on Computer Vision. , 1-8 (2007).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados
Utilizamos cookies para mejorar su experiencia en nuestra página web.
Al continuar usando nuestro sitio web o al hacer clic en 'Continuar', está aceptando nuestras cookies.
