Method Article
Isolamento, fixação e imagem de imunofluorescência de glândulas supra-renais de Mouse
Neste Artigo
Resumo
Aqui nós apresentamos um método para isolar as glândulas adrenal de ratos, corrigir os tecidos, seção-los e executar a mancha da imunofluorescência.
Resumo
Imunofluorescência é uma técnica bem estabelecida para a detecção de antígenos nos tecidos com o emprego de anticorpos conjugados a fluorocromo e tem um amplo espectro de aplicações. Deteção de antígenos permite a caracterização e identificação de vários tipos de células. Situada acima dos rins e encapsulado por uma camada de células mesenquimais, a glândula adrenal é um órgão endócrino, composto por dois tecidos diferentes, com diferentes origens embriológicos, o córtex exterior derivados mesoderme intermediário mesonéfricos e o neural crista-derivado de medula interna. O córtex adrenal secreta esteroides (ou seja, mineralocorticoides, glicocorticoides, hormônios sexuais), enquanto a medula adrenal produz catecolaminas (i.e., adrenalina, noradrenalina). Durante a realização de pesquisa de adrenal, é importante ser capaz de distinguir células únicas com funções diferentes. Aqui nós fornecemos um protocolo desenvolvido em nosso laboratório que descreve uma série de etapas sequenciais, necessários para a obtenção de mancha da imunofluorescência para caracterizar os tipos de células da glândula adrenal. Nós focamos primeiro a dissecação das glândulas supra-renais do mouse, a remoção microscópica de gordura periadrenal, seguida da fixação, processamento e incorporação de parafina do tecido. Descrevemos em seguida com um micrótomo rotativo de corte dos blocos de tecido. Por último, detalhamos um protocolo para coloração imunofluorescente de glândulas supra-renais que temos desenvolvido para minimizar tanto a ligação de anticorpos inespecíficos e autofluorescência para alcançar uma óptima do sinal.
Introdução
Imuno-histoquímica é uma técnica para a detecção de componentes de tecido com o uso de anticorpos contra moléculas celulares específicas e técnicas de coloração subsequentes para detectar os anticorpos conjugados1. Este procedimento de imuno-histoquímica requer fixação específica e processamento de tecidos que são frequentemente empiricamente determinados para o antígeno específico, tecido e anticorpo utilizaram2. A fixação é crucial para preservar o estado "original" de tecido e, mantendo intacta celular e subcellular estruturas e padrões de expressão. Mais processamento e incorporação de procedimentos são necessários para preparar o tecido para corte em fatias finas que são usadas para estudos histológicos, envolvendo a imuno-histoquímica.
Immunostaining pode ser executada com deteção fluorescente ou cromogênica. A detecção cromogênica exige a utilização de uma enzima para converter um substrato solúvel em um produto colorido insolúvel. Enquanto esta enzima pode ser conjugada com o anticorpo reconhecer o antígeno (anticorpo primário), é mais frequentemente conjugado ao anticorpo reconhecendo o anticorpo primário (ou seja, o anticorpo secundário). Esta técnica é altamente sensível; o produto colorido resultante da reação enzimática é fotoestável e requer apenas um microscópio brightfield para a imagem latente. No entanto, cromogênico immunostaining pode não ser adequado ao tentar visualizar duas proteínas que co localizar, uma vez que a deposição de uma cor pode mascarar a deposição do outro. No caso de co coloração, imunofluorescência tem provado para ser mais vantajoso. O advento da imunofluorescência é atribuído a Albert Coons e colegas, que desenvolveram um sistema para identificar o tecido antígenos com anticorpos marcados com fluoresceína e visualizá-las nos tecidos sob luz ultravioleta3seccionados. Detecção de fluorescência é baseado em um anticorpo conjugado com um fluoróforo que emite luz após a excitação. Porque existem vários fluorophores com emissões em diferentes comprimentos de onda (com pouca ou nenhuma sobreposição), esse método de deteção é ideal para os estudos de várias proteínas.
A glândula adrenal é um órgão emparelhado localizada acima do rim e caracterizado por dois componentes distintos embryologically rodeadas por uma cápsula mesenquimal. O córtex adrenal exterior, derivado da mesoderma intermediária mesonéfricos, segrega hormonas esteroides, enquanto a medula interna, derivada da crista neural, produz catecolaminas, incluindo adrenalina, noradrenalina e dopamina. O córtex adrenal é histologicamente e funcionalmente dividido em três zonas concêntricas, com cada zona secretoras de classes diferentes de hormônios esteroides: o exterior zona glomerulosa (zG) produz mineralocorticoides que regulam a homeostase do eletrólito e volume intravascular; a médio zona fasciculada (zF), diretamente abaixo do zG, segrega glicocorticoides que medeiam a resposta ao estresse através da mobilização das lojas da energia para aumentar a glicose do plasma; e o interior zona reticular (zR), que sintetiza sexo precursores esteroides (ou seja, Dehidroepiandrosterona (DHEAS))4.
Alguma variação no zoneamento adrenocortical está presente entre as espécies: por exemplo, Mus musculus carece da zR. A única zona X pós-natal de M. musculus é um remanescente do córtex fetal, caracterizado por pequenas células de lipídios-pobres com acidofílicas cytoplasms5. A X-zone desaparece na puberdade em ratos do sexo masculinos e após a primeira gravidez em ratos fêmeas, ou gradualmente degenera em fêmeas de raça não6,7. Além disso, a tortuosidade e a espessura das exposições zG marcada variação entre espécies como organização de células tronco e progenitoras periféricas em e adjacente para o zG. O rato, ao contrário de outros roedores, tem uma zona de indiferenciadas visível (zU) entre o zG e zF que funciona como uma zona de células-tronco e/ou uma zona de transiente amplificando progenitores. Se o zU é exclusivo para ratos, ou simplesmente uma forma mais organizada com destaque aglomerado de células é desconhecido8,9.
Células do córtex adrenal contêm gotículas lipídicas que armazenam os ésteres de colesterol que servem como o precursor de todos os hormônios esteroides10,11. O termo "esteroidogênese" define o processo de produção de hormônios esteroides de colesterol através de uma série de reações enzimáticas que envolvem a atividade esteroidogênica fator 1 (SF1), cuja expressão é um marcador de potencial esteroidogênica. Na glândula adrenal, Sf1 expressão está presente apenas em células do córtex12. Um interessante estudo encontrou a expressão de biotina endógena adrenocortical células com potencial esteroidogênica13. Enquanto esta pode ser a causa da maior experiência em biotina/estreptavidina-com base em métodos de coloração, devido a detecção de biotina endógena pelo anticorpo conjugado com estreptavidina, esta característica pode ser também empregada para distinguir o esteroidogênica células de outras populações dentro da glândula adrenal, ou seja, endoteliais, capsular e células da medula.
Inervados pelo simpáticos neurônios preganglionic, a medula adrenal é caracterizada por basophilic células com uma citoplasma granular contendo epinefrina e norepinefrina. Células da medula são denominadas "cromafim" devido ao alto teor de catecolaminas que formam um pigmento marrom após oxidação14. Tirosina Hidroxilase (TH) é a enzima que catalisa a etapa limitante na síntese de catecolaminas e, na glândula adrenal, é expressa apenas na medula15.
Aqui nós apresentamos um protocolo para a isolação do rato as glândulas supra-renais, seu processamento para incorporação em parafina e corte e um método para realizar a mancha na adrenais seções a fim de identificar os tipos celulares que constituem o córtex adrenal e medula. Este protocolo é um padrão em nosso laboratório de imunocoloração com múltiplos anticorpos usados rotineiramente em nossa pesquisa.
Protocolo
Todos os métodos foram realizados em conformidade com protocolos institucionalmente aprovados sob o auspício da Comissão Universidade do uso e cuidar dos animais da Universidade de Michigan.
1. preparação para a cirurgia
- No dia antes da cirurgia, preparar paraformaldeído 4% (PFA) / tampão fosfato salino (PBS). No caso de alíquotas congeladas, prossiga para descongelar um e armazenar a 4 ° C.
Nota: 4% PFA não é estável por mais de 48 h.
Cuidado: PFA é tóxico, evitar contato com pele e olhos e descarte em um recipiente apropriado. - No dia da cirurgia, preparar os instrumentos cirúrgicos por esterilizar a tesoura e pinça com 70% de etanol (EtOH) e deixe-os secar sobre uma toalha de papel.
- Lugar cheio de uma placa de 24 com PBS 1x (1 mL/poço é suficiente) em um balde de gelo.
Nota: As glândulas supra-renais serão mantidas neste prato de cultura multi bem após a cirurgia.
2. adrenal dissecação
- Eutanásia o mouse seguindo protocolos padrão aprovados pelo cuidado institucional do Animal e Comissão de utilização (IACUC). Um método secundário de eutanásia para garantir a morte (por exemplo, decapitação) é necessário.
- Para eutanásia por overdose de isoflurano, coloque o mouse em uma câmara cheia de isoflurano vapores até que cesse a respiração e, em seguida, remover o mouse da câmara, coloque-o sobre uma superfície e realizar deslocamento cervical.
Nota: a maioria dos métodos de eutanásia causar desconforto ao animal e não são adequados para estudos de stress, porque eles podem adicionar a variável de confundimento da ativação do eixo hipófise-adrenal e liberação de catecolaminas medulares. Nesta instância, decapitação é a técnica sugerida para adotar.
- Para eutanásia por overdose de isoflurano, coloque o mouse em uma câmara cheia de isoflurano vapores até que cesse a respiração e, em seguida, remover o mouse da câmara, coloque-o sobre uma superfície e realizar deslocamento cervical.
- Coloque o mouse em decúbito dorsal, esterilizar a área de incisão no abdômen e flancos com 70% EtOH.
Nota: Enquanto raspar o pelo irá aumentar a esterilidade, para esta aplicação específica não é necessário. - Cortar a pele no meio do abdômen, usando uma tesoura, separar a pele do peritônio, mesa o mouse por beliscar a pele em volta do corte e puxando-o em duas direções opostas (caudal e rostral). Em seguida, corte o peritônio até atingir os flancos direito e esquerdos posteriores.
- Remover o corte de murino glândula adrenal em torno do tecido adiposo circundante e colocá-lo na placa 24-multiwell repleto de 1X PBS e mantidos no gelo.
3. remoção de gordura Peri-adrenal
- Sob um microscópio de dissecação, coloque a adrenal em um vidro base ou um prato de Petri na placa de palco, posicione a fonte de luz, selecione a ampliação e ajustar o foco para obter uma visão clara da adrenal todo.
Nota: A ampliação usada pode variar dependendo das preferências pessoais. Uma ampliação total de 30 X com uma lente plano 1 X, zoom 3x, e ocular 10x permite para visualizar a glândula inteira com um bom campo de visão. - Remova rapidamente o adiposo adjacente com duas agulhas de 25 G, evitando a desidratação da adrenal. Se isso acontecer, antes de toda a gordura é removida, mover a adrenal volta dentro do poço contendo 1X PBS por 1 – 2 min e depois continuar com o processo de remoção de gordura.
- Lave 2x por 2 min cada em 1X PBS.
4. tecido processamento e incorporação
- Corrigir os tecidos em 4% PFA/PBS a 4 ° C em uma plataforma oscilante para 2h.
- Remova os 4% PFA e lave os tecidos com PBS 1x, 3x por 15 min a 4 ° C.
Cuidado: PFA é tóxico e é um resíduos perigosos; deve ser manuseado com cuidado, sob uma capa de química e descartado em um recipiente de resíduos perigosos. - Incubar as supra-renais em 50% EtOH a 4 ° C em uma plataforma oscilante para 2h.
- Incubar as supra-renais em 70% EtOH a 4 ° C em uma plataforma oscilante para um mínimo de 2 h.
Nota: Se não prosseguir com o tecido para a incorporação de processamento, as glândulas supra-renais podem ser armazenadas em 70% EtOH a 4 ° C. Evitando o armazenamento a longo prazo em 70% EtOH e prosseguir para tecido logo que possível processamento produz amostras de melhor qualidade. - Prepare a adrenal para processamento por envolvê-lo em gaze e delimitador-lo em um tecido incorporação fita de tecido. Coloque a fita em um frasco enchido com 70% EtOH e loja a 4 ° C até que esteja pronto para passar para o processador de tecido. Insira a fita para o processador de tecido programado conforme relatado na tabela 1 e executar o programa.
- Transferir a fita em uma estação de encastre cheia de parafina derretida a 65 ° C. Se não houver uma estação de resfriamento, coloque uma bandeja de refrigeração fria ao lado dele.
- Rotular um molde de encastre e abra o tecido incorporação de gaveta. Usando um par de pinças, Desembrulhe a gaze e coloque as supra-renais suavemente na posição desejada no centro da base no molde incorporação. Despeje a parafina derretida sobre as supra-renais. Se necessário, segure a adrenal com fórceps para assegurar sua posição no molde caso contrário ele pode se mover dentro do molde.
- Suavemente move o molde de encastre a bandeja de arrefecimento e esperar até o endurecimento da parafina. Depois disso, para facilitar o corte, armazene encastre moldes em lugar fresco.
5. corte com um micrótomo rotativo
- Verifique se o micrótomo está limpo antes de começar, afastar todos os resíduos descartados parafina, certifique-se de que a faca (ou lâmina) é afiada, o mecanismo interno de óleo e retrai completamente o titular do bloco, se necessário.
- Rotular uma série de corrediças do microscópio (positivamente carregada ou revestidas para evitar a perda de tecido (ver Tabela de materiais)), coloque-os em um conjunto de slides aquecedor a 37 ° C e distribuir água ultrapura autoclavado tipo 1 no topo de cada slide.
- Definir a espessura de corte em 5 µm.
- Insira a lâmina de micrótomo em porta-lâmina, controlar o ângulo da lâmina, certifique-se de que a lâmina está firmemente preso no suporte e verific o afastamento do bloco de parafina e titular do bloco.
- Trazer o titular do bloco até sua posição mais alta e, se possível, tranque o manípulo operacional, remover o bloco de parafina do molde e coloque-o no suporte do bloco, prendendo-o firmemente com o grampo. O ângulo da linha de centro da lâmina com a superfície de revestimento do bloco deve ser cerca de 20°. Se necessário, reajuste o bloco de parafina.
Atenção: A lâmina é afiada. - Se anteriormente bloqueado, destravar a roda de mão e baixe o bloco de parafina até que seu rosto está nivelado com a borda da lâmina do micrótomo. Gire a roda de mão com um ritmo constante. Execute o corte inicial para remover a parafina e expor as supra-renais.
- Continue girando a roda de mão e a seção até o fim das supra-renais. Use um microscópio brightfield ou dissecação para verificar a presença de tecido nas seções. Retire a fita da lâmina e com a ajuda de outro par de pinças, coloque-o sobre a água, colocada sobre a lâmina de vidro. Pode ser útil colocar a fita sobre uma superfície, esticá-lo cuidadosamente e então montá-lo no slide.
- Seque os slides sobre a chapa. Em seguida, coloque-as sobre uma bandeja de slide e asse a 37 ° C durante a noite ou mais se a água ainda está presente. Depois de seco, armazene os slides em uma caixa de slides à temperatura ambiente.
- Guarde todos os equipamentos usados e limpar o micrótomo.
6. imunofluorescência
- Selecione os slides para imunocoloração e colocá-los em um suporte de slide.
- Em uma chapa quente, traga um copo cheio de 0,01 M citrato em pH 2,0 para ferver. O volume da reserva depende do tamanho do copo e deve ser suficiente para cobrir as seções sobre os slides durante a ebulição (alguns evaporação precisa ser levado em conta). Cubra o copo com folha de alumínio.
Nota: Outros métodos para recuperação do antígeno estão disponíveis (ver discussão). - Deparaffinize os slides em xilol 100% 2 x por 5 min cada. Hidratar os slides usando a seguinte série: 100% EtOH 2 x por 5 min, 70% EtOH 2 x por 5 min, digite 1 água ultrapura por 5 min.
Nota: Após a deparaffinization, é importante não deixar as seções secar: cortes histologicos sempre devem ser cobertos com buffers ou soluções até ao final do procedimento ou a estrutura do tecido pode ser danificada. - Para recuperação do antígeno, coloque slides em um suporte de metal slide e inseri-lo no copo com citrato sem a folha de alumínio a ferver. Deixe ferver por 10 min.
- Retirar o copo do prato quente e deixe esfriar por 20 min. Certifique-se de que as seções adrenais ainda são cobertas com o buffer.
- Prepare a solução de bloqueio. Se usando a coloração comercialmente disponível kit de empregados para o Representante resultados (ver a Tabela de materiais), em um tubo, adicione 1,25 mL de 1X PBS, 1 gota (o equivalente a cerca de 45 µ l) de reagente de bloqueio de Ig de Mouse e 5% de soro de cabra normal. Armazene a solução bloqueio a 4 ° C ou em gelo durante o trabalho.
Nota: O soro usado depende de espécies de hospedeiros do anticorpo secundário. Aqui foram usados anticorpos secundários erguidos em cabra. Para outros anticorpos, concentrações séricas diferentes podem ser necessárias. Empiricamente, determine a concentração correta de soro testando várias concentrações. - Transferi os slides em uma jarra de Coplin contendo PBS 1x e lavagem 3 x 10 min cada um basculante com balanço suave.
- Prepare uma câmara umidificada para a coloração.
- Agite suavemente, fora a PBS de um slide; Limpe a parte inferior do slide com uma limpeza de fiapos para remover a excesso PBS.
- Usando um marcador especial para slides com propriedades hidrofóbicas, desenhe um círculo ao redor de cada seção adrenal, certificando-se que a superfície de vidro é seca para evitar a propagação da solução de tinta para a seção. Se necessário, limpe cuidadosamente seca a superfície. Coloque o slide na câmara umidificada.
- Rapidamente, pipete 50 µ l (ou o suficiente para cobrir as seções) de bloqueio solução sobre cada seção. Encube por 1h à temperatura ambiente.
Nota: Bloqueio de volume de solução necessário pode variar; é importante que as seções são bem cobertas com a solução. - Preparar a solução diluente do kit comercialmente disponível com 7,5 mL de 1X PBS, 600 µ l de proteína concentrar ações solução e 5% de soro de cabra normal (ou qualquer outro soro e concentração utilizada na solução de bloqueio). Armazene a solução diluente a 4 ° C ou em gelo durante o trabalho.
- Prepare as soluções de anticorpo primário, diluindo os anticorpos primários nas concentrações adequadas na solução diluente. Para coloração de co, adicionar uma alíquota de cada anticorpo em um novo tubo e misture suavemente. Anticorpos de lugar e soluções de anticorpo no gelo até estar pronto para usar.
Nota: Aqui usamos anticorpo anti-SF1 no coelho e um anticorpo anti-TH no mouse. Para preparar o anticorpo soluções de trabalho sigam as instruções.- Para a solução de trabalho de SF1, em um tubo, adicione 1 µ l de anticorpo anti-SF1 a 999 µ l de solução diluente (concentração final de 1,5 µ g/mL). Para a solução de trabalho de TH, em um tubo, adicione 1 anticorpo anti-TH µ l 499 µ l de solução diluente (estima-se a concentração final de 2-6 µ g/mL).
- Para SF1 + TH mix de trabalho de anticorpo, em um tubo fresco, pipetar 250 µ l de solução de trabalho de SF1 e 250 µ l de solução de trabalho de TH. Misture suavemente pipetando. Armazenar no gelo.
- Transferir os slides em uma jarra de Coplin contendo 1X PBS e lavar 3 x por 5 min cada um basculante com balanço suave.
- As lâminas de volta para a câmara umidificada depois limpando o excesso de PBS, pipeta o SF1 + TH anticorpo trabalho mix (ou outra solução de anticorpo primário) em cada seção, feche a câmara umidificada e deixá-lo durante a noite a 4 ° C.
- No dia seguinte, mova os slides em um Coplin jar contendo 1X PBS e lavagem 3x por 15 min em uma cadeira de balanço com balanço suave.
- Enquanto lavava os slides, prepare a solução de anticorpo secundário na solução diluente usando a concentração adequada. Se realizando co coloração, adicione uma quantidade igual de cada solução de anticorpo secundário em um tubo de novo. Misture suavemente pipetando. Armazenar no gelo. Proteger os tubos de luz e armazenar no gelo até estar pronto para usar.
Nota: Aqui, os anticorpos secundários utilizados são 488 nm fluorescente tingir-etiquetados anti-rato gerado na cabra e 549 fluorescente tingir-etiquetados anticoelho erguido em cabra. A solução de anticorpo secundário foi preparada pela adição de 0,5 µ l de cada anticorpo secundário em 799 µ l de solução diluente (concentrações finais de 1,2 µ g/mL). - Coloque os slides volta na câmara umidificada depois de retirar o excesso de PBS, rapidamente adicionar a solução de anticorpo secundário nas secções adrenais, feche a câmara umidificada e proteger da luz. Encube por 1h à temperatura ambiente.
- Lavar as lâminas em uma jarra de Coplin com 1X PBS e lavar 3x por 15 min em uma cadeira de balanço com balanço suave, certificando-se de protegê-los de luz.
- Preparar a 4', 6-diamidino-2-phenylindole (DAPI) solução para coloração nuclear: 1 µ l de DAPI (20 mg/mL) em 1 mL de 1X PBS.
Nota: Corante de contraste nuclear azul fluorescente pode também ser conseguido usando corante Hoechst. - Adicionar solução de DAPI para as seções de adrenais, cobrir de luz e incubar a temperatura ambiente por 7 min.
- Lavar as lâminas em uma jarra de Coplin com 1X PBS e lavar 3 x por 5 min em uma cadeira de balanço com balanço suave, protegendo os slides da luz.
- Em uma área protegida da luz directa, deite-se um vidro de tampa, e pipetar 60 µ l ou cerca de 3 gotas de agente de montagem apropriado para imunofluorescência ao longo da superfície do vidro tampa.
- Limpe cuidadosamente a parte de trás de um slide com uma limpeza de fiapos, posição do slide viradas para baixo em direção o tampa de vidro e paralelo a ele, então os cortes histologicos enfrentam o vidro de cobertura com o agente de montagem nele. Levemente pressione o slide sobre o vidro de cobertura e certifique-se de que nenhuma bolha de ar está preso entre o slide e o vidro de tampa.
- Se necessário, aplica mais pressão para remover as bolhas de ar e o excesso de agente de montagem.
- Estabelecer o slide em um recipiente escuro e cura à temperatura ambiente durante um período mínimo de 24 h (ou o tempo indicado na folha de informações do agente de montagem usado) e vá para a imagem.
7. imagem latente
Nota: Um microscópio de fluorescência, conectado a uma câmera é necessário para detectar e capturar a fluorescência emitida por tecidos após a excitação em determinados comprimentos de onda. Embora óbvio, é importante lembrar-se de escolher o secundário anticorpo conjugado com fluorochromes cuja excitação e espectros de emissão são compatíveis com os equipamentos disponíveis. Configurações de imagem variam de acordo com o microscópio e o software usado para captura de imagens. Existem algumas regras básicas que se aplicam para seções adrenais de imagem, tais como ter certeza de que o tempo de exposição, câmera obter configurações e intensidade da fonte de luz são mantidos constantes.
- Ligue a fonte de luz e a câmera, lançar o software de imagem seguindo as instruções do fabricante.
Nota: A ordem dessas ações pode diferir dependendo do equipamento utilizado. - Fixe o slide no palco, abrir o obturador e olhando pelas oculares do microscópio usar coloração nuclear (DAPI) canal e ampliação baixa (4x) para identificar o tecido no slide: seções adrenais são pequenas, e sua visualização pode exigir algum tempo.
- Mude para uma maior ampliação (10x), foco e fechar o obturador.
Nota: É importante evitar desnecessariamente longa exposição à luz que podem causar o fotobranqueamento, resultando em perda de sinal. - Usando os comandos do software, selecione o objetivo (10 X) e o canal em uso (DAPI), ajustar o tempo de exposição (1 s, pode ser ajustado se o sinal for muito forte ou fraco). Se disponível, defina binning para geração de imagens ao vivo (não aquisição) '2 X 2' conversão ganhar a 'médio', velocidade de leitura de 20 MHz'. Se o software utilizado não exibe a barra de escala no final da imagem, selecione a opção barra de escala do menu e posicionar o bar onde desejar.
- Abrir o obturador, re-ajustar o foco, se necessário e mudar de canal (FITC, TRITC, DAPI). Se o microscópio não é automatizado, tirar uma foto da adrenal em cada canal sem mover o palco e certifique-se de ajustar a seleção do canal em uso. Feche o botão do obturador uma vez terminado.
Nota: Anote as definições empregadas no caso o software não automaticamente salva-los. - Salve as fotos.
Nota: Fotos mescladas podem ser muitas vezes criadas usando software do microscópio ou outros pacotes de software de editor de gráficos. - Repita a imagem para outras áreas da seção e/ou com uma maior ampliação.
Nota: Uma ampliação de 20 X muitas vezes requer um menor tempo de exposição (ou seja, 800 ms). - No final da imagem, desligue todos os equipamentos na ordem correta.
Resultados
A Figura 1 representa um diagrama esquemático do todo protocolo descrito acima. As glândulas adrenais são colhidas de ratos, tecido adiposo adjacente é removido sob um microscópio de dissecação e a adrenal são então fixado em 4% PFA. Após esta etapa, supra-renais são processadas incorporadas em parafina e seccionadas com um micrótomo para corte o órgão em fatias finas depositadas em corrediças do microscópio. Após a secagem das seções, imunofluorescência é efectuada e as seções são fotografadas no microscópio.
A remoção de gordura adjacente(Figura 2)é importante para facilitar ainda mais o processamento e seccionamento das glândulas supra-renais. Remoção bem sucedida do tecido adiposo circundante é mostrada na Figura 2B, onde a adrenal é facilmente detectável e nenhuma gordura extra é visível. Durante esta etapa é fundamental, no entanto, para não deixar a glândula adrenal secar ou isso pode danificar a estrutura do tecido. Secura é reconhecível quando as supra-renais assume uma aparência enrugada (Figura 2C). Esse problema pode ser facilmente superado por reidratação a adrenal em 1X PBS antes de continuar com a remoção de gordura.
Os resultados finais obtidos neste protocolo são apresentados na Figura 3a seguir. As imagens de imunofluorescência ilustram a imunocoloração de uma glândula adrenal em dois diferentes ampliações. Vermelho nuclear SF1 coloração rotula as células adrenocortical, Considerando que a coloração citoplasmática verde rotula as células da medula. A cápsula externa é rotulada pela coloração nuclear em azul (DAPI), pois não é esteroidogênica (SF1-negativo).

Figura 1 : Representação esquemática do protocolo. Após a colheita as glândulas supra-renais e removendo o tecido adiposo adjacente, os tecidos são fixados em 4% PFA, processado para a incorporação de parafina e seccionados. As seções são então immunostained e fotografaram com um microscópio de fluorescência. Clique aqui para ver uma versão maior desta figura.

Figura 2 : Remoção de gordura peri-adrenal. (A), a gordura ao redor que da glândula adrenal é removida sob um microscópio de dissecação. (B) glândula Adrenal após a limpeza. (C) exemplo de tecido, secando e que necessita de hidratação. Clique aqui para ver uma versão maior desta figura.
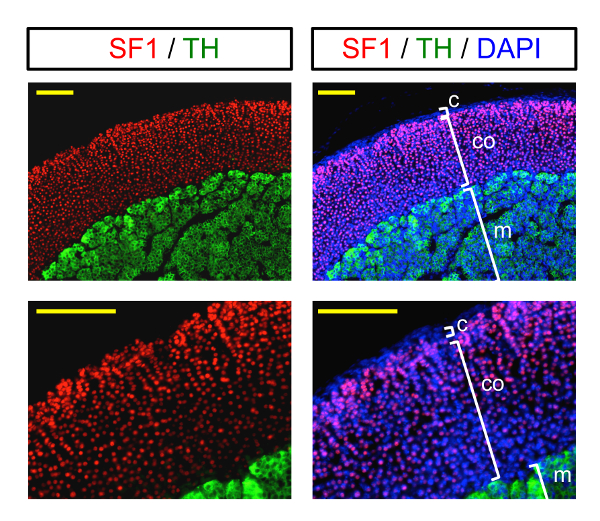
Figura 3 : Imagem de imunofluorescência da glândula adrenal. Exemplo de imagem de imunofluorescência (em diferentes ampliações) de uma glândula adrenal manchado com marcadores do córtex adrenal (SF1, coloração nuclear) e da medula adrenal (TH, verde citoplasmática). Núcleos (DAPI) são rotulados em azul. C: cápsula; CO: córtex; m: medula. Escala de barras = 200 µm. clique aqui para ver uma versão maior desta figura.
| Reagente | Estação | Temperatura | Duração |
| 70% EtOH | 1 | RT | 1 h |
| 90% EtOH | 2 | RT | 1 h |
| 90% EtOH | 3 | RT | 1 h |
| EtOH absoluto | 4 | RT | 1 h |
| EtOH absoluto | 5 | RT | 1 h |
| EtOH absoluto | 6 | RT | 1 h |
| EtOH absoluto | 7 | RT | 1 h |
| Xileno | 8 | RT | 1 h |
| Xileno | 9 | RT | 1 h |
| Xileno | 10 | RT | 1 h |
| Cera de parafina | 11 | 62 ° C | 1 h |
| Cera de parafina | 12 | 62 ° C | 1 h |
| Cera de parafina | 13 | 62 ° C | 1 h |
Tabela 1: Programa de processador de tecido.
Discussão
Este protocolo descreve um método para o isolamento de rato glândulas supra-renais juntamente com a preparação e coloração de glândulas supra-renais secionado rato de parafina.
Em comparação com outros protocolos que testamos, este protocolo de imunofluorescência revelou-se adequado para a maioria dos anticorpos utilizados em nosso laboratório. No entanto, em certos casos pode exigir alguns ajustes para melhorar os resultados da coloração. Uma variável que pode ser facilmente modificada e testada é o comprimento da fixação. Em nosso laboratório, a incubação em 4% PFA pode variar de 1h a 4h, enquanto em outros laboratórios, o tempo de fixação é estendido para 12-24 h16. Em nossas mãos, no entanto, um maior tempo de fixação levou ao aumento de ruídos e não era ideal para diversos anticorpos usados rotineiramente em nossa pesquisa.
O pH da recuperação do antígeno também pode desempenhar um papel no sucesso de coloração. Recuperação de epítopo induzida por calor (HIER) pode ser realizada empregando soluções comercialmente disponíveis com pH variando de ácida para alcalina, bem como outros amortecedores feitos in-house como citrato (pH 6), ácido etilenodiaminotetracético (EDTA, pH 8), Tris-EDTA (pH 9), Tris (pH 10). Tratamento enzimático também pode ser uma opção para o desmascaramento do antígeno. Incubar os slides deparaffinized por um tempo limitado com uma solução contendo uma concentração adequada de uma enzima (por exemplo proteinase K) pode ser um método alternativo para HIER. No entanto, é essencial para titula-se a concentração da enzima e determinar o tempo de incubação ideal, desde que o excesso de digestão pode afetar negativamente o tecido17.
A escolha do tampão de bloqueio também é outra variável para solução de problemas. Além da utilização de soro de cabra normal e o tampão de bloqueio disponível comercialmente mencionados neste protocolo (conveniente nesta instância quando usando anticorpos primários do rato sobre os tecidos do mouse para evitar que o fundo elevado devido a endógena do mouse IgG), existem opções adicionais disponíveis como soluções de proteína (albumina de soro bovino (BSA) ou leite seco) ou outros buffers disponíveis comercialmente. É fundamental ter a certeza de que o buffer não contém substâncias que podem interferir com a coloração, tais como biotina quando usar uma estreptavidina-biotina baseado método.
A glândula adrenal é um órgão endócrino caracteriza-se pelo alto teor lipídico que pode muitas vezes fazem immunostaining desafiador devido à alta autofluorescência dos lipídios. Além disso, córtices supra-renais de camundongos e ratos são ricos em autofluorescent intracitoplasmática lipofuscina, um material granulado e amorfo pigmentada que varia na cor de amarelo ao marrom. Para superar este problema, compostos tais como o Sudão negro B (SBB) podem saciar a fluorescência gerada pelo lipofuscins18. Outro fator que compromete o resultado de uma boa coloração é a presença de células do sangue. Hemoglobina presente nas hemácias absorve luz de comprimentos de onda < 600 nm e pode interferir com a fluorochromes que abrangem esse comprimento de onda de19,20. Enquanto técnicas de perfusão podem ser usadas para limpar as células do sangue dos vasos do tecido, o uso de sulfato de cobre de 10mm em pH 5 antes de executar o counterstaining nuclear também pode ajudar em suprimir a fluorescência indesejados21.
Um passo crítico no presente protocolo é a dissecação adrenal. A glândula adrenal é um órgão cuja localização pode ser difícil de localizar em situ: em camundongos, as glândulas são pequenas, e sua posição é um pouco variável. Especialmente em animais mais velhos, as glândulas supra-renais também estão rodeadas por tecido adiposo que podem interferir com a detecção de glândulas e sua consequente isolamento, por este motivo, é crucial ter uma visão clara da área durante esta etapa do protocolo. Remoção de remoção de gordura peri-adrenal é um passo delicado. Especial atenção deve ser pago para as supra-renais enquanto desanexar a gordura para não romper a cápsula. A glândula também deve ser mantida húmida com PBS durante o procedimento para evitar danos aos tecidos.
Quando o seccionamento, detectando a presença da pequena porção de tecido adrenal nas seções pode ser um desafio devido ao tecido hipopigmentação após a etapa de processamento. Um microscópio é muito útil durante o corte para discernir o tecido da cera.
Immunostaining em secções de parafina é uma valiosa técnica para immunolabeling proteínas de interesse enquanto preserva a morfologia do tecido. O método apresentado aqui baseia-se em cima da deteção de fluorescência e, embora seja particularmente funcional para estudos empregando anticorpos primários múltiplos, o sinal de fluorescência é sensível à luz e pode ser facilmente perdido ou enfraqueceu-se as lâminas não são tratadas adequadamente (i.e., prolongada exposição à luz do microscópio ou exposição desnecessária à luz ambiente). Além disso, podemos notar um declínio da qualidade do sinal de fluorescência em si ao longo do tempo. Esse problema pode ser evitado usando detecção cromogênica, que é fotoestável e pode ser visualizada por muitos anos. Este método, no entanto, não possui as vantagens da detecção de fluorescência, como maior precisão de rotulagem e etiquetagem simultânea de várias proteínas em um estudo.
Incorporação de parafina é um método conveniente para processar e armazenar várias amostras de tecido. No entanto, processamento de parafina, encaixando-se o tecido não é adequado para a imagem latente de repórteres fluorescentes endogenamente expressado em alguns animais transgênicos sem o uso de um anticorpo específico visando o repórter. Criopreservação é um método para evitar a degradação da proteína fluorescente e permitir a sua visualização directa sob um microscópio. Evitando o uso de um anticorpo extra pode representar uma vantagem. Por outro lado, criopreservação pode também ser um fator limitante já que isso afeta a morfologia do tecido; também requer equipamentos diferentes para corte, e o armazenamento de lâminas e blocos de tecido é possível em freezers somente.
Uma grande limitação de um tecido seccionado de imagem é a capacidade de obter imagens de componentes estruturais em alta resolução espacial. Composição do tecido, na verdade, é uma variável importante na determinação da qualidade da imagem latente, uma vez que influencia a penetração de luz e pode levar a resolução pobre. A glândula adrenal é um tecido rico em lipídios que causam22de espalhamento de luz. No cérebro, que também tem um alto teor lipídico, técnicas de limpeza de tecidos como clareza, BABB, iDISCO e 3DISCO foram desenvolvidas para melhorar a visualização do tecido, permitindo a melhor imagem e 3D de reconstrução do tecido23. Estas técnicas estão fornecendo pesquisadores de alta qualidade de imagem de dados e estão sendo adaptadas a uma gama de vários dos tecidos, e, no futuro, esperamos a empregar estes métodos de imagem adrenal também.
Divulgações
Os autores não têm nada para divulgar.
Agradecimentos
Agradecemos o Dr. Mohamad Zubair por suas sugestões úteis e assistência técnica no estabelecimento do presente protocolo. Este trabalho foi financiado pelo Instituto Nacional de Diabetes e digestivo e doenças renais, institutos nacionais de saúde Research Grant 2R01-DK062027 (de Games).
Materiais
| Name | Company | Catalog Number | Comments |
| 24-well cell culture plate | Nest Biotechnology Co. | 0412B | |
| Disposable needles 25 G x 5/8" | Exel International | 26403 | |
| Paraformaldehyde (PFA) | Sigma-Aldrich | P6148 | |
| Paraplast plus | McCormik scientific | 39502004 | Paraffin for tissue embedding |
| Shandon biopsy cassettes II with attached lid | Thermo scientific | 1001097 | Cassettes for tissue processing |
| High Profile Microtome Blades | Accu-Edge | 4685 | Disposable stainless steel blades |
| Peel-a-way disposable plastic tissue embedding molds | Polysciences Inc. | 18986 | Truncated, 22 mm square top tapered to 12 mm bottom |
| Superfrost Plus Microscope Slides | Fisherbrand | 12-550-15 | 75 mm x 25 mm x 1 mm |
| Xylene | Fisher Chemical | X5P1GAL | |
| 200 Proof Ethanol | Decon Labs, Inc. | ||
| Certi-Pad Gauze pads | Certified Safety Mfg, Inc | 231-210 | 3" x 3. Sterile latex free gauze pads |
| M.O.M kit | Vector laboratories | BMK-2202 | For detecting mouse primary antibodies on mouse tissue |
| KimWipes | Kimtech | 34155 | Wipes 4.4 inch x 8.4 inch |
| Super PAP PEN | Invitrogen | 00-8899 | Pen to draw on slides |
| Microscope cover glass | Fisherbrand | 12-544-D | Size: 22 x 50 x 1.5 |
| DAPI | Sigma | D9542 | (Prepared in 20 mg/mL stock) |
| ProLong Gold antifade reagent | Molecular Probes | P36930 | Mounting agent for immunofluorescence |
| X-cite series 120Q | Lumen Dynamics | Light source | |
| Coolsnap Myo | Photometrics | Camera | |
| Optiphot-2 | Nikon | Microscope | |
| microtome | American Optical | ||
| Tissue embedder | Leica | EG1150 H | |
| Tissue processor | Leica | ASP300S | |
| Normal goat serum | Sigma | G9023 | |
| Mouse anti-TH | Millipore | MAB318 | Primary antibody |
| Rabbit anti-SF1 | Ab proteintech group (PTGlabs) | custom made | Primary antibody |
| Alexa-488 Mouse IgG raised goat | Jackson ImmunoResearch | 115-545-003 | Secondary antibody |
| Dylight-549 Rabbit IgG raised goat | Jackson ImmunoResearch | 111-505-003 | Secondary antibody |
| Citrate acid anhydrous | Fisher Chemical | A940-500 | |
| NIS-Elements Basic Research | Nikon | Software for imaging |
Referências
- Brandtzaeg, P. The increasing power of immunohistochemistry and immunocytochemistry. Journal of Immunological Methods. 216 (1-2), 49-67 (1998).
- Matos, L. L., Trufelli, D. C., de Matos, M. G., da Silva Pinhal, M. A. Immunohistochemistry as an important tool in biomarkers detection and clinical practice. Biomark Insights. 5, 9-20 (2010).
- Coons, A. H., Creech, H. J., Jones, R. N. Immunological properties of an antibody containing a fluorescent group. Proceedings of the Society for Experimental Biology and Medicine. 47 (2), 200-202 (1941).
- Lerario, A. M., Finco, I., LaPensee, C., Hammer, G. D. Molecular Mechanisms of Stem/ Progenitor Cell Maintenance in the Adrenal Cortex. Frontiers in Endocrinology. 8, (2017).
- Yates, R., et al. Adrenocortical Development, Maintenance, and Disease. Endocrine Gland Development and Disease. 106, 239-312 (2013).
- Jones, I. C. Variation in the Mouse Adrenal Cortex with Special Reference to the Zona Reticularis and to Brown Degeneration, Together with a Discussion of the Cell Migration Theory. Quarterly Journal of Microscopical Science. 89 (1), 53 (1948).
- Sucheston, M. E. C., Samuel, M. The Transient-Zone in the Human and Mouse Adrenal Gland. The Ohio Journal of Science. 72, 120-126 (1972).
- Guasti, L., Paul, A., Laufer, E., King, P. Localization of Sonic hedgehog secreting and receiving cells in the developing and adult rat adrenal cortex. Molecular and Cellular Endocrinology. 336 (1-2), 117-122 (2011).
- Pihlajoki, M., Dorner, J., Cochran, R. S., Heikinheimo, M., Wilson, D. B. Adrenocortical zonation, renewal, and remodeling. Frontiers in Endocrinology. 6, 27 (2015).
- Farese, R. V., Walther, T. C. Lipid Droplets Finally Get a Little R-E-S-P-E-C-T. Cell. 139 (5), 855-860 (2009).
- Shen, W. J., Azhar, S., Kraemer, F. B. Lipid droplets and steroidogenic cells. Experimental Cell Research. 340 (2), 209-214 (2016).
- Finco, I., LaPensee, C. R., Krill, K. T., Hammer, G. D. Hedgehog signaling and steroidogenesis. Annual Review of Physiology. 77, 105-129 (2015).
- Paul, A., Laufer, E. Endogenous biotin as a marker of adrenocortical cells with steroidogenic potential. Molecular and Cellular Endocrinology. 336 (1-2), 133-140 (2011).
- Lowe, J., Anderson, P. . Stevens & Lowe's Human Histology, 4th Edition. , 263-285 (2015).
- Nagatsu, T. Genes for human catecholamine-synthesizing enzymes. Neuroscience Research. 12 (2), 315-345 (1991).
- Berthon, A., et al. Age-dependent effects of Armc5 haploinsufficiency on adrenocortical function. Human Molecular Geneticst. 26 (18), 3495-3507 (2017).
- Brown, C. Antigen retrieval methods for immunohistochemistry. Toxicologic Pathology. 26 (6), 830-831 (1998).
- Billinton, N., Knight, A. W. Seeing the wood through the trees: a review of techniques for distinguishing green fluorescent protein from endogenous autofluorescence. Analytical Biochemistry. 291 (2), 175-197 (2001).
- Hirsch, R. E., San George, R. C., Nagel, R. L. Intrinsic fluorometric determination of the stable state of aggregation in hemoglobins. Analytical Biochemistry. 149 (2), 415-420 (1985).
- Whittington, N. C., Wray, S. Suppression of Red Blood Cell Autofluorescence for Immunocytochemistry on Fixed Embryonic Mouse Tissue. Current Protocols in Neuroscience. 81, 28 (2017).
- Watson, J. Suppressing autofluorescence of erythrocytes. Biotechnic & Histochemistry. 86 (3), 207 (2011).
- Epp, J. R., et al. Optimization of CLARITY for Clearing Whole-Brain and Other Intact Organs. eNeuro. 2 (3), (2015).
- Erturk, A., et al. Three-dimensional imaging of solvent-cleared organs using 3DISCO. Nature Protocols. 7 (11), 1983-1995 (2012).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados