Method Article
Isolierung, Fixierung und Immunfluoreszenz Imaging der Maus Nebennieren
In diesem Artikel
Zusammenfassung
Hier präsentieren wir eine Methode, um die Nebennieren von Mäusen zu isolieren, das Gewebe zu beheben, sie Abschnitt und durchführen Immunfluoreszenz-Färbung.
Zusammenfassung
Immunfluoreszenz ist eine etablierte Methode zur Erkennung von Antigenen in Geweben mit der Beschäftigung von Fluorochrom-konjugierten Antikörpern und verfügt über ein breites Spektrum an Anwendungen. Erkennung von Antigenen ermöglicht die Charakterisierung und Identifizierung von mehreren Zelltypen. Oberhalb der Nieren und durch eine Schicht von mesenchymalen Zellen eingekapselt, ist der Nebenniere eine endokrine Organ, bestehend aus zwei verschiedenen Geweben mit unterschiedlicher embryologischen Herkunft, der mesonephric mittlere Mesoderm abgeleitet äußere Rinde und der neuronalen Kamm-abgeleiteten inneren Medulla. Die Nebennierenrinde sondert Steroide (d. h. Mineralocorticoids, Glukokortikoide, Sexualhormone), während das Nebennierenmark Katecholamine (z.B. Adrenalin, Noradrenalin) produziert. Während der Nebennieren forschen, ist es wichtig, einzigartige Zellen mit unterschiedlichen Funktionen unterscheiden zu können. Hier bieten wir ein Protokoll entwickelt, die in unserem Labor, das beschreibt eine Reihe von aufeinander folgenden Schritten erforderlich für den Erhalt der Immunfluoreszenz-Färbung, die Zelltypen der Nebenniere zu charakterisieren. Wir konzentrieren uns zunächst auf die Zerlegung der Nebennieren Maus die mikroskopische Entfernung von Periadrenal Fett, gefolgt von der Fixierung, die Verarbeitung und das Paraffin Einbettung des Gewebes. Wir beschreiben der Gewebe Blöcke mit einer rotierenden Mikrotom schneiden. Zu guter Letzt zeigen wir ein Protokoll für immunofluorescent Färbung der Nebennieren, die wir entwickelt haben, um unspezifische Antikörperbindung und Autofluoreszenz zu minimieren, um ein optimales Signal zu erreichen.
Einleitung
Immunohistochemistry ist eine Technik zur Erkennung von gewebeanteile mit dem Einsatz von Antikörpern gegen spezifische zelluläre Moleküle und anschließende befleckenden Techniken der konjugierten Antikörpern1zu erkennen. Diese immunhistochemische Verfahren erfordert spezielle Fixierung und Verarbeitung von Geweben, die für das Antigen oft empirisch ermittelt werden, Gewebe und Antikörper verwendet2. Die Fixierung ist entscheidend für den "ursprünglichen" Zustand des Gewebes und damit Erhaltung intakten zellulären und subzellulären Strukturen und Expressionsmuster beizubehalten. Weitere sind Verarbeitung und Einbettung Verfahren erforderlich, um das Gewebe vorbereiten, schneiden in dünne Scheiben schneiden, die histologische Studien mit Immunohistochemistry verwendet werden.
Immunostaining kann mit chromogenen oder fluoreszierende Erkennung durchgeführt werden. Chromogene Erkennung erfordert die Verwendung eines Enzyms zu einem löslichen Substrat in eine unlösliche farbige Produkt umzuwandeln. Während dieses Enzym an der Antikörper erkennt das Antigen (Primärantikörper) konjugiert werden kann, ist es immer öfter an den Antikörper erkennen den primären Antikörper (d.h. der Sekundärantikörper) konjugiert. Diese Technik ist sehr empfindlich; Das farbige Produkt aus der enzymatischen Reaktion ist Photostabil und erfordert nur ein Hellfeld-Mikroskop für die Bildgebung. Jedoch kann chromogenen Immunostaining nicht geeignet wenn Sie versuchen, zwei Proteine zu visualisieren, die Co lokalisieren, da die Abscheidung einer Farbe kann die Ablagerung des anderen Maske. Im Falle von Co Färbung, hat Immunfluoreszenz mehr als vorteilhaft erwiesen. Das Aufkommen der Immunfluoreszenz wird zugeschrieben Albert Coons und Kollegen, die ein System zur Identifizierung von Gewebe-Antigene mit Antikörpern mit Fluorescein gekennzeichnet und visualisieren im geschnittenen Gewebe unter ultraviolettem Licht3entwickelt. Fluoreszenz-Detektion basiert auf einem Antikörper konjugiert mit einem Fluorophore, die nach Anregung Licht ausstrahlt. Da gibt es mehrere Fluorophore mit Emissionen bei verschiedenen Wellenlängen (mit keine oder nur geringe Überlappung), eignet sich diese Nachweismethode für die Studien von mehreren Proteinen.
Die Nebenniere ist ein gekoppelten Organ befindet sich oberhalb der Niere und zeichnet sich durch zwei embryologically verschiedene Komponenten von mesenchymalen Kapsel umgeben. Die äußeren Nebennierenrinde, abgeleitet von der mesonephric mittlere Mesoderm sondert Steroidhormone während die inneren Medulla, abgeleitet aus der Neuralleiste Katecholamine wie Adrenalin, Noradrenalin und Dopamin produziert. Die Nebennierenrinde histologisch und funktional gliedert sich in drei konzentrische Zonen mit jeder Zone sezernierenden verschiedene Klassen von Steroid-Hormone: die äußeren Zona Glomerulosa (zG) produziert Mineralocorticoids, die Elektrolyt-Homöostase zu regulieren und intravasale Volumen; die mittlere Zona Fasciculata (zF), sondert direkt unterhalb der zG, Glukokortikoide, die die Stress-Reaktion durch die Mobilisierung der Energiespeicher Erhöhung der Plasma-Glukose zu vermitteln; und der inneren Zona Reticularis (zR), die synthetisiert sex Steroid Vorläufer (d. h. Dehydroepiandrosteron (DHEAS))4.
Einige Variationen in NNR Zonierung ist zwischen den Arten vorhanden: z. B. Mus Musculus fehlt der zR. Die einzigartige postnatale X-Zone des M. Musculus ist ein Überrest des fetalen Kortex zeichnet sich durch kleine Lipid-Armen Zellen mit acidophilen Cytoplasma5. Die X-Zone verschwindet in der Pubertät bei männlichen Mäusen und nach der ersten Schwangerschaft bei weiblichen Mäusen oder allmählich verkommt nicht gezüchtete Weibchen6,7. Darüber hinaus markiert die schlängelung und Dicke der zG Exponate Variation zwischen den Arten, wie Organisation von peripheren Stamm- und Vorläuferzellen in und neben der zG. Die Ratte, im Gegensatz zu anderen Nagetieren verfügt über eine sichtbare undifferenzierte Zone (zU) zwischen dem zG und zF funktioniert als eine Stammzell-Zone und/oder eine vorübergehende Verstärkung Stammväter-Zone. Ob die zU einzigartig für Ratten ist oder einfach mehr prominent Cluster von Zellen organisiert ist unbekannt8,9.
Zellen der Nebennierenrinde enthalten Lipid-Tröpfchen, die Cholesterin-Ester zu speichern, die als Vorläufer der alle Steroidhormone10,11dienen. Der Begriff "steroidgenese" definiert den Prozess der Produktion von Steroidhormonen aus Cholesterin über eine Reihe von enzymatischen Reaktionen, bei denen die Aktivität von steroidogenic Factor 1 (SF1), deren Ausdruck ein Marker für steroidogenic Potenzial ist. In der Nebenniere ist Sf1 Ausdruck nur in den Zellen der Hirnrinde12vorhanden. Eine interessante Studie fand den Ausdruck der endogene Biotin in NNR Zellen mit steroidogenic potenzielle13. Während dies kann die Ursache für einen höheren Hintergrund in Biotin/Streptavidin-basierte Färbung Methoden, durch die Erkennung von endogenen Biotin durch Antikörper konjugiert mit Streptavidin, könnte dieses Merkmal auch eingesetzt werden, um den steroidogenic unterscheiden Zellen aus anderen Populationen innerhalb der Nebenniere, d. h., Endothelzellen, Kapsel und Medulla Zellen.
Sympathische neuroendokrine Neuronen innerviert, zeichnet sich das Nebennierenmark durch basophile Zellen mit einem körnigen Zytoplasma, Adrenalin und Noradrenalin enthalten. Medulla Zellen sind aufgrund des hohen Gehaltes an Katecholaminen, die braunes Pigment nach Oxidation14 bilden"chromaffin" benannt. Tyrosin-Hydroxylase (TH) ist das Enzym das katalysiert die Bandbreitenbegrenzung Schritt in der Synthese der Katecholamine und in der Nebenniere, äußert sich nur in der Medulla15.
Hier stellen wir Ihnen ein Protokoll für die Isolierung der Maus Nebennieren, deren Verarbeitung für die Einbettung in Paraffin-Schnitt und eine Methode durchzuführen Immunfluoreszenz-Färbung auf Nebennieren Abschnitte um die zelluläre Arten bilden die Nebennierenrinde und Medulla. Dieses Protokoll ist ein Standard in unserem Labor für Immunostaining mit mehreren Antikörpern routinemäßig in unserer Forschung verwendet.
Protokoll
Alle Methoden wurden gemäß institutionell zugelassenen Protokolle unter der Schirmherrschaft des Ausschusses über Nutzung und Pflege von Tieren an der University of Michigan Universität durchgeführt.
1. Vorbereitung für die Operation
- Am Tag vor der Operation vorbereiten 4 % Paraformaldehyd (PFA) / Phosphat gepufferte Kochsalzlösung (PBS). Fahren Sie bei gefrorenen Aliquote mit einer Auftauen und Lagerung bei 4 ° C.
Hinweis: 4 % ist PFA nicht für mehr als 48 h stabil.
Achtung: PFA ist giftig, vermeiden Sie den Kontakt mit Haut und Augen, und in einen geeigneten Behälter entsorgen. - Am Tag der Operation chirurgische Instrumente durch Sterilisation der Scheren und Pinzetten mit 70 % Ethanol (EtOH) bereiten und auf einem Papiertuch trocknen lassen.
- Ort eine 24-Well-Platte gefüllt mit 1 X PBS (1 mL/gut ist ausreichend) in einem Eiskübel.
Hinweis: Nebennieren werden nach der Operation in diesem Multi-gut Kulturschale gehalten werden.
(2) Nebennieren Dissektion
- Einschläfern der Maus nach Standardprotokolle, die durch die institutionellen Animal Care and Verwendung Committee (IACUC) genehmigt. Eine sekundäre Methode der Sterbehilfe, Tod (z. B. Enthauptung) zu gewährleisten ist erforderlich.
- Für Euthanasie durch Isofluran Überdosis, platzieren Sie den Mauszeiger in einer Kammer gefüllt mit Isofluran dämpfen bis Atmung aufhört, dann entfernen Sie die Maus aus der Kammer, legen Sie es auf eine Oberfläche und führen Sie zervikale Dislokation.
Hinweis: Die meisten Euthanasie Methoden das Tier Leid zufügen und sind nicht geeignet für Stress Studien, weil sie der konfundierenden Variablen der Aktivierung der Hypophysen-Nebennieren-Achse und medulläre catecholamin-Freisetzung hinzufügen können. In diesem Fall ist Enthauptung die vorgeschlagene Technik annehmen.
- Für Euthanasie durch Isofluran Überdosis, platzieren Sie den Mauszeiger in einer Kammer gefüllt mit Isofluran dämpfen bis Atmung aufhört, dann entfernen Sie die Maus aus der Kammer, legen Sie es auf eine Oberfläche und führen Sie zervikale Dislokation.
- Legen Sie die Maus Rückenlage, Sterilisieren die Schnitt-Bereich auf den Bauch und die Flanken mit 70 % EtOH.
Hinweis: Während das Fell rasieren Sterilität ansteigen wird, ist für diese spezielle Anwendung es nicht notwendig. - Schneiden Sie die Haut in der Mitte des Bauches mit einer Schere, das Peritoneum die Haut trennen, deskin der Maus durch die Haut um den Schnitt zu kneifen und ziehen Sie ihn in zwei entgegengesetzte Richtungen (kaudalen und rostral). Dann schneiden Sie das Peritoneum bis hin zu den hinteren linken und rechten Flanken.
- Entfernen Sie das murine Nebenniere schneiden um das umliegende Fettgewebe zu und legen Sie sie in der 24-Multiwell-Platte mit 1 X PBS gefüllt und auf Eis gehalten.
(3) Peri-Nebennieren Fettentfernung
- Unter dem sezierenden Mikroskop legen die Nebennieren auf ein Glas base oder eine Petrischale auf den Tischeinsatz die Lichtquelle zu positionieren, wählen Sie die Vergrößerung und passen Sie den Fokus auf eine klare Sicht auf die gesamte Nebennieren zu erhalten.
Hinweis: Die verwendete Vergrößerung kann je nach persönlichen Vorlieben variieren. Eine Gesamtvergrößerung von 30 X mit einem Plan Objektiv 1 X, 3 X zoom und Okular 10 X ermöglicht, um die ganze Drüse mit ein gutes Sichtfeld zu visualisieren. - Schnell zu entfernen, das angrenzende Fettgewebe mit zwei 25 G Nadeln, Austrocknung der Nebennieren zu vermeiden. Wenn dies geschieht, bevor alles Fett entfernt wird, bewegen die Nebennieren wieder in den Brunnen, enthält 1 X PBS für 1 – 2 min. und dann weiter mit dem Prozess der Entfernung von Fett.
- Waschen Sie 2 X 2 min. 1 X PBS.
(4) Gewebe Verarbeitung und Einbettung
- Fixieren Sie das Gewebe in 4 % PFA/PBS bei 4 ° C auf eine rockende Plattform für 2 h.
- Entfernen Sie die 4 % PFA und waschen das Gewebe mit 1 X PBS, 3 X für 15 min bei 4 ° C.
Achtung: PFA ist giftig und ist als gefährlicher Abfall; Es sollte mit Vorsicht unter einer chemischen Haube behandelt und in einen Behälter für gefährliche Abfälle entsorgt werden. - Inkubieren Sie die Nebennieren in 50 % EtOH bei 4 ° C auf eine rockende Plattform für 2 h.
- Inkubieren Sie die Nebennieren in 70 % EtOH bei 4 ° C auf eine rockende Plattform für ein Minimum von 2 h.
Hinweis: Wenn nicht mit Gewebe Verarbeitung für die Einbettung von ausgehend, Nebennieren können gespeichert werden in 70 % EtOH bei 4 ° C. Vermeidung von Langzeitlagerung in 70 % ergibt EtOH und Sie fortfahren, um Gewebe Verarbeitung so schnell wie möglich bessere QUALITÄTSPROBEN. - Bereiten Sie die Nebennieren für Gewebe Verarbeitung durch in Gaze einwickeln und in einem Gewebe einbetten Kassette umschließt. Legen Sie die Kassette in ein Glas, gefüllt mit 70 % EtOH und Store bei 4 ° C bis bereit, an den Gewebe-Prozessor zu bewegen. Legen Sie die Kassette in den Gewebe-Prozessor programmiert, wie in Tabelle 1 gemeldet und führen Sie das Programm aus.
- Übertragen Sie die Kassette in ein Einbettungs-Station gefüllt mit geschmolzenem Paraffin bei 65 ° C. Wenn eine Kühlstation nicht verfügbar ist, positionieren Sie eine kalte kühle Fach daneben.
- Beschriften Sie ein Einbetten von Schimmel und öffnen Sie das Gewebe einbetten Kassette zu. Mit einer Zange, packen Sie die Gaze und legen Sie die Nebennieren sanft in die gewünschte Position in der Mitte der Basis in der einbettenden Form. Gießen Sie die geschmolzene Paraffin auf die Nebennieren. Bei Bedarf halten Sie die Nebennieren mit der Pinzette, sichern ihre Position in der Form sonst, dass es in der Form bewegen kann.
- Sanft bewegen Sie den Einbetten von Schimmel auf den kühlenden Behälter und warten Sie, bis die Aushärtung des Paraffins. Danach zur Erleichterung der Schnitt speichern Sie einbetten Formen an einem kühlen Ort.
5. Schneiden mit einem rotierenden Mikrotom
- Check das Mikrotom sauber ist, bevor Sie beginnen, Bürsten entfernt alle weggeworfenen Paraffin Rückstände, sicherzustellen, dass die Messer (oder Klinge) geschärft ist, Öl den internen Mechanismus und vollständig einfahren den Block-Halter, bei Bedarf.
- Eine Reihe von Objektträger beschriften (positiv aufgeladen oder beschichtet, um Gewebe zu verhindern (siehe Tabelle der Materialien)), legen Sie diese auf eine wärmere Folien-Set bei 37 ° C, und einige autoklaviert Typ1 Reinstwasser auf jeder Folie zu verzichten.
- 5 µm Dicke festgesetzt.
- Stecken Sie Mikrotom Klinge in den Klingenhalter, Steuern Sie den Winkel der Klinge zu, stellen Sie sicher, dass die Klinge fest in die Halterung befestigt ist und prüfen Sie den Abstand der paraffinblock und Block-Halter.
- Bringen Sie die Block-Halter in die höchste Position zu und, wenn möglich, Sperren Sie Bediengriff, entfernen Sie paraffinblock aus der Form und legen Sie sie in den Block-Halter befestigen Sie es fest mit der Klemme. Der Winkel von der Mittellinie des Blattes mit der gegenüberliegenden Fläche des Blocks sollte ca. 20° betragen. Ggf. nachjustieren der paraffinblock.
Achtung: Die Klinge ist scharf. - Wenn zuvor gesperrt, entsperren Sie das Handrad und senken Sie den paraffinblock, bis sein Gesicht mit der Kante des Blatts Mikrotom waagerecht steht. Drehen Sie das Handrad mit einem gleichmäßigen Rhythmus. Führen Sie erste trimmen, das Paraffin zu entfernen und die Nebennieren aussetzen.
- Drehen des Handrades, und Abschnitt bis zum Ende der Nebennieren. Verwenden Sie Hellfeld oder sezieren Mikroskop, um auf das Vorhandensein von Gewebe in den Abschnitten zu überprüfen. Lösen Sie das Band von der Klinge zu und mit Hilfe von ein paar Zangen legen Sie es auf dem Wasser auf dem Objektträger gelegt. Es kann nützlich sein, die Band auf eine Unterlage legen, ziehen Sie es vorsichtig und montieren Sie es auf der Folie.
- Lassen Sie die Folien auf der Heizplatte trocknen. Dann legen Sie sie flach auf ein Diahalter und backen bei 37 ° C über Nacht oder länger wenn Wasser noch vorhanden ist. Nach dem Trocknen, speichern Sie die Folien in einer Folie Box bei Raumtemperatur.
- Einlagerung der Gebrauchtgeräte und reinigen das Mikrotom.
(6) Immunfluoreszenz
- Wählen Sie die Folien für Immunostaining und legen Sie sie in einen Diahalter.
- Bringen Sie auf einer heißen Platte einen Becher gefüllt mit 0,01 M Citrat bei pH 2.0 zu kochen. Das Volumen des Puffers hängt von der Größe der Becher und muss ausreichen, für die Deckung der Abschnitte auf den Folien während des Kochens (einige Verdunstung muss berücksichtigt werden). Das Becherglas mit Alufolie abdecken.
Hinweis: Andere Methoden zum Abrufen von Antigen sind verfügbar (siehe Diskussion). - Deparaffinize Folien in 100 % Xylol 2 X 5 min. lang. Die Folien mit der folgenden Serie rehydrieren: 100 % EtOH 2 X 5 min, 70 % EtOH 2 X 5 min Typ 1 Reinstwasser für 5 min.
Hinweis: Nach deparaffinisierung, ist es wichtig, nicht die Abschnitte Austrocknen lassen: Gewebeschnitte müssen immer mit Puffer oder Lösungen abgedeckt werden, bis zum Ende des Verfahrens oder die Gewebestruktur kann beschädigt werden. - Für Antigen-Retrieval Folien in einem metallschlitten Halter und schieben Sie es in das Becherglas mit kochendem Citrat ohne die Aluminiumfolie. 10 min kochen lassen.
- Das Becherglas von der Heizplatte entfernen und abkühlen lassen für 20 min. sorgen dafür, dass die Nebennieren Abschnitte noch mit dem Puffer bedeckt sind.
- Bereiten Sie die blockierende Lösung. Wenn mit den im Handel erhältlichen Färbung für die Vertreter Ergebnisse eingesetzt Kit (siehe die Tabelle der Materialien), in einem Rohr 1,25 mL 1 X PBS, 1 Tropfen (entspricht ca. 45 µL) Maus Ig Blocking Reagenz und 5 % normalem ziegenserum hinzufügen. Speichern Sie die blockierende Lösung bei 4 ° C oder auf Eis während der Arbeit.
Hinweis: Das Serum verwendet richtet sich nach der Sekundärantikörper Wirtsarten. Hier wurden Sekundärantikörper wuchs in Ziege verwendet. Für andere Antikörper können unterschiedlichen Serumkonzentrationen notwendig sein. Bestimmen Sie empirisch die richtige Serum-Konzentration durch mehrere Konzentrationen testen. - Übertragen Sie die Folien in eine Coplin JAR-Datei mit 1 X PBS und Waschen 3 x 10 min auf einer Wippe mit sanftes Schaukeln.
- Bereiten Sie eine Feuchte Kammer für die Färbung.
- Schütteln Sie die PBS von einer Folie; Wischen Sie die Folie unten mit einem fusselfreiem abwischen, die überschüssige PBS zu entfernen.
- Mit einem speziellen Marker für Folien mit hydrophoben Eigenschaften, zeichnen Sie einen Kreis rund um jeden Nebennieren Abschnitt, um sicherzustellen, dass die Glasoberfläche zu vermeiden die Verbreitung der Tinte Lösung zum Abschnitt trocken ist. Bei Bedarf trocknen Sie sorgfältig die Oberfläche. Legen Sie die Folie in die Feuchte Kammer.
- Schnell, pipette, 50 µL (oder Abschnitte decken) Lösung auf jeden Abschnitt zu blockieren. 1 h bei Raumtemperatur inkubieren.
Hinweis: Blockiert Lösung benötigten Mengen variieren; Es ist wichtig, dass die Abschnitte mit der Lösung gut bedeckt sind. - Bereiten Sie die Verdünnungsmittel Lösung aus dem kommerziell erhältlichen Kit mit 7,5 mL 1 X PBS, 600 µL Protein Konzentration Lager-Lösung und 5 % normalem ziegenserum (oder jede andere Serum und Konzentration in die blockierende Lösung verwendet). Speichern Sie die Verdünnungsmittel Lösung bei 4 ° C oder auf Eis während der Arbeit.
- Bereiten Sie die primären Antikörper Lösungen der primären Antikörper in den entsprechenden Konzentrationen in die Verdünnungsmittel Lösung verdünnen. Fügen Sie für Co Färbung eine Aliquote jedes Antikörpers in einen neuen Schlauch und mischen Sie vorsichtig. Platzieren Sie Antikörper und Antikörper Lösungen auf Eis, bis zum Gebrauch.
Hinweis: Hier beschäftigten wir Anti-SF1-Antikörper in Kaninchen angehoben und Antikörpers Anti-TH in Maus angehoben. Zur Vorbereitung des Antikörpers folgen funktionierende Lösungen gerichtet.- Für SF1 Arbeitslösung in eine Röhre fügen Sie 1 µL Antikörper Anti-SF1 999 µL Verdünnungsmittel Lösung (Endkonzentration von 1,5 µg/mL hinzu). Für TH-Arbeitslösung in einem Rohr fügen Sie 1 µL Anti-TH-Antikörper in 499 µL Verdünnungsmittel Lösung (geschätzte Endkonzentration von 2-6 µg/mL hinzu).
- Für SF1 + TH Antikörper Arbeiten Mischung in einem frischen Rohr, pipette, 250 µL Arbeitslösung SF1 und 250 µL Arbeitslösung TH. Mischen Sie vorsichtig, durch pipettieren. Speichern Sie auf Eis.
- Transfer Folien in einem Coplin JAR-Datei mit 1 X PBS und Waschen 3 X 5 min auf einer Wippe mit sanftes Schaukeln.
- Ort, an dem die Rutschen in die Feuchte Kammer zurück, nach dem abwischen Übermaß an PBS, Pipette die SF1 + TH Antikörper Arbeiten Mix (oder anderen primären Antikörper-Lösung) auf die einzelnen Abschnitte schließen die Feuchte Kammer und lasse es über Nacht bei 4 ° C.
- Am nächsten Tag bewegen der Dias in einem Coplin jar mit 1 X PBS und Waschen 3 X 15 min. auf einer Wippe mit sanftes Schaukeln.
- Beim Waschen zubereiten der Folien Sekundärantikörper Lösung in die Verdünnungsmittel Lösung unter Verwendung der entsprechenden Konzentration. Wenn Leistung Co Färbung, fügen Sie gleich Menge jeder Sekundärantikörper Lösung in einen neuen Schlauch. Mischen Sie vorsichtig, durch pipettieren. Speichern Sie auf Eis. Die Rohre vor Licht schützen und speichern auf Eis bis zum Gebrauch.
Hinweis: Hier sind die sekundären Antikörper verwendet, 488 nm fluoreszierenden Farbstoff-markierten Anti-Maus in Ziege angehoben und 549 fluoreszierenden Farbstoff-markierten Anti-Kaninchen in Ziege angehoben. Die sekundäre Antikörper-Lösung wurde vorbereitet, indem man 0,5 µL jeder Sekundärantikörper in 799 µL Verdünnungsmittel Lösung (Endkonzentrationen von 1,2 µg/mL). - Legen Sie die Folien zurück in die Feuchte Kammer nach dem Entfernen der Überschuss an PBS pipette die sekundäre Antikörper-Lösung auf die Nebennieren Abschnitte, die Feuchte Kammer in der Nähe und schnell vor Licht schützen. 1 h bei Raumtemperatur inkubieren.
- Waschen Sie der Objektträger in einem Coplin Glas mit 1 X PBS und waschen Sie 3 X 15 min. auf einer Wippe mit sanftes Schaukeln, sicherstellen, dass sie vor Licht zu schützen.
- Bereiten Sie die 4', 6-Diamidino-2-Phenylindole (DAPI) Lösung für nukleare Färbung: 1 µL DAPI (20 mg/mL) in 1 mL 1 X PBS.
Hinweis: Blau-fluoreszierende nuklearen gegenfärbung kann auch mit Hoechst Farbstoff erreicht werden. - Pipette DAPI-Lösung auf die Nebennieren Abschnitte aus Licht abdecken und bei Raumtemperatur für 7 min inkubieren.
- Waschen Sie der Objektträger in einem Coplin Glas mit 1 X PBS und waschen Sie 3 X 5 min auf einer Wippe mit sanftes Schaukeln und die Folien vor Licht zu schützen.
- Auf einer Fläche von direktem Licht abgeschirmt legte sich ein Deckglas und pipette 60 µL oder ca. 3 Tropfen des Montage-Agents für Immunfluoreszenz entlang der Oberfläche der Glasabdeckung geeignet.
- Wischen Sie die Rückseite eines Dias mit einem fusselfreiem abwischen, Position die Folie verdeckt auf das Deckglas und parallel dazu, so die Gewebeschnitte das Deckglas mit dem Montage-Agent auf es Gesicht. Leicht andrücken der Folie auf das Deckglas und stellen Sie sicher, dass keine Luftblase zwischen der Folie und dem Deckglas eingeklemmt ist.
- Falls erforderlich, weitere Druck, Luftblasen und die Überschreitung des Montage-Agent zu entfernen.
- Legen Sie die Folie in einem dunklen Behälter und Heilung bei Raumtemperatur für mindestens 24 h (oder die Zeitangabe in dem Informationsblatt des Montage-Agent verwendet) und fahren Sie anschließend mit Bildbearbeitung.
(7) Bildgebung
Hinweis: Ein Fluoreszenzmikroskop an eine Kamera angeschlossen ist erforderlich für die Erkennung und Erfassung der Fluoreszenz emittiert durch das Gewebe nach Anregung bei bestimmten Wellenlängen. Während es offensichtlich ist, ist es wichtig, um daran zu erinnern, wählen die sekundäre Antikörper konjugiert mit Fluorochromes deren Anregung und Emission-Spektren sind kompatibel mit den Geräten zur Verfügung. Bildgebung Einstellungen variieren je nach das Mikroskop und die Software zum Erfassen von Bildern verwendet. Es gibt einige grundlegenden Regeln, die gelten für imaging-Nebennieren Abschnitte, z. B. dafür sorgen, dass die Belichtungszeit, Kamera gain-Einstellungen und Lichtquelle Intensität konstant gehalten werden.
- Die Lichtquelle und die Kamera schalten Sie ein, starten Sie die imaging-Software nach den Anweisungen des Herstellers.
Hinweis: Die Reihenfolge der Aktionen kann je nach der Ausstattung abweichen. - Die Folie auf der Bühne zu sichern, öffnen Sie den Verschluss und Blick in das Mikroskop Okulare nuklearen Färbung (DAPI) Kanal und geringer Vergrößerung (4 X) verwenden, um das Gewebe auf der Folie zu identifizieren: Nebennieren Abschnitte sind klein, und ihre Visualisierung kann einige Zeit dauern.
- Verschieben Sie den Fokus auf eine höhere Vergrößerung (10 X), und schließen Sie den Auslöser.
Hinweis: Es ist wichtig, um unnötig lange Exposition unter dem Licht, Immunofluoreszenz, was zum Verlust des Signals verursachen können, zu vermeiden. - Mit den Software-Befehlen, wählen Sie das Ziel (10 X) und der Kanal im Einsatz (DAPI), passen Sie die Belichtungszeit (1 s, eingestellt werden, wenn das Signal zu stark oder zu schwach ist). Falls verfügbar, binning für live Imaging (nicht Erwerb), "2 X 2', Konvertierung zu gewinnen,"Mitte", Anzeige Geschwindigkeit auf 20 MHz" festgelegt. Wenn die Software verwendet die Maßstabsleiste am Ende der Bildgebung nicht angezeigt wird, wählen Sie im Menü die Skalierungsoption Bar und positionieren Sie die Leiste an die gewünschte Stelle.
- Öffnen Sie den Auslöser, einzustellen Sie den Fokus bei Bedarf neu und Umschalten Sie der Sender (FITC, TRITC, DAPI). Wenn das Mikroskop nicht automatisiert ist, nehmen Sie ein Bild von den Nebennieren in jedem Kanal ohne bewegliche Bühne und achten Sie darauf, die Auswahl des Kanals im Einsatz anzupassen. Schließen Sie den Auslöser einmal fertig.
Hinweis: Notieren Sie die Einstellungen beschäftigt, für den Fall, dass die Software sie nicht automatisch speichert. - Die Bilder zu speichern.
Hinweis: Zusammengeführten Bilder können oft mit dem Mikroskop-Software oder andere Grafik-Editor-Software-Pakete erstellt werden. - Wiederholen Sie Imaging für andere Bereiche des Abschnitts und/oder mit einer höheren Vergrößerung.
Hinweis: Ein 20 X Vergrößerung oft erfordert eine kürzere Belichtungszeit (d. h. 800 ms). - Am Ende der Bildgebung schalten Sie alle Geräte in der richtigen Reihenfolge.
Ergebnisse
Abbildung 1 stellt eine schematische Darstellung des das gesamte Protokoll beschriebenen. Nebennieren werden geerntet, von Mäusen, angrenzende Fettgewebe wird entfernt, unter dem sezierenden Mikroskop und die Nebennieren sind dann fixiert, in 4 % PFA. Nach diesem Schritt sind Nebennieren verarbeitet und in Paraffin eingebettet und geschnitten mit ein Mikrotom, die Orgel in dünne Scheiben schneiden, die auf Objektträger abgelegt werden. Nach dem Trocknen der Abschnitte Immunfluoreszenz wird durchgeführt und die Abschnitte werden am Mikroskop abgebildet.
Die Entfernung von benachbarten Fett (Abb. 2A) ist wichtig für die Erleichterung der weiteren Verarbeitung und Schnitt der Nebennieren. Abwahl des umgebenden Fettgewebes ist in Abbildung 2Bgezeigt, wo der Nebennieren ist leicht nachweisbar und keine extra-Fett ist sichtbar. Bei diesem Schritt ist es wichtig, jedoch nicht austrocknen, Nebenniere oder das lassen die Gewebestruktur beschädigen. Trockenheit ist erkennbar, wenn die Nebennieren eine faltige Optik (Abbildung 2C) annimmt. Dieses Problem kann leicht überwunden werden, durch die Nebennieren in 1 X PBS Rehydration, bevor Sie mit der Entfernung von Fett.
Das Endergebnis erhalten folgende dieses Protokolls sind in Abbildung 3dargestellt. Die Immunfluoreszenz-Bilder illustrieren die Immunostaining eine Nebenniere bei zwei verschiedenen Vergrößerungen. Roten nuklearen SF1 Färbung kennzeichnet Nebennierenrindeninsuffizienz Zellen, während zytoplasmatischen grüne Färbung Zellen von der Medulla Etiketten. Die außenkapsel ist gekennzeichnet durch nukleare Färbung blau (DAPI), da es nicht steroidogenic (SF1-negativ).

Abbildung 1 : Schematische Darstellung des Protokolls. Nach Ernte der Nebennieren und das angrenzende Fettgewebe zu entfernen, sind die Gewebe in 4 % fixiert PFA, bearbeitet für die Einbettung von Paraffin und geschnitten. Die Abschnitte sind dann Immunostained und mit einem Fluoreszenzmikroskop abgebildet. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 2 : Entfernung von Peri-Nebennieren Fett. (A) das Fett umgeben, die unter dem Mikroskop Dissektion der Nebenniere entfernt wird. (B) Nebenniere nach der Sanierung. (C) Beispiel Gewebe austrocknen und das erfordert Hydratation. Bitte klicken Sie hier für eine größere Version dieser Figur.
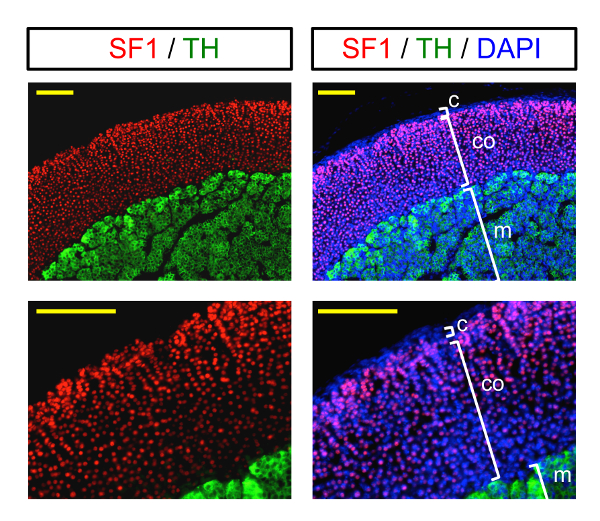
Abbildung 3 : Immunfluoreszenz-Bildgebung der Nebenniere. Beispiel der Immunfluoreszenz Bildgebung (bei verschiedenen Vergrößerungen) eine Nebenniere gebeizt mit Markern der Nebennierenrinde (SF1, nukleare Färbung) und das Nebennierenmark (TH, zytoplasmatischen grün). Kerne (DAPI) sind blau gekennzeichnet. C: Kapsel; CO: Kortex; m: Medulla. Skalieren von Balken = 200 µm. Bitte klicken Sie hier für eine größere Version dieser Figur.
| Reagenz | Bahnhof | Temperatur | Dauer |
| 70 % EtOH | 1 | RT | 1 h |
| 90 % EtOH | 2 | RT | 1 h |
| 90 % EtOH | 3 | RT | 1 h |
| Absolute EtOH | 4 | RT | 1 h |
| Absolute EtOH | 5 | RT | 1 h |
| Absolute EtOH | 6 | RT | 1 h |
| Absolute EtOH | 7 | RT | 1 h |
| Xylol | 8 | RT | 1 h |
| Xylol | 9 | RT | 1 h |
| Xylol | 10 | RT | 1 h |
| Paraffin Wachs | 11 | 62 ° C | 1 h |
| Paraffin Wachs | 12 | 62 ° C | 1 h |
| Paraffin Wachs | 13 | 62 ° C | 1 h |
Tabelle 1: Gewebe Prozessor Programm.
Diskussion
Dieses Protokoll beschreibt eine Methode für die Isolierung von Maus Nebennieren zusammen mit der Vorbereitung und Färbung der geschnittenen Paraffin-eingebetteten Maus Nebennieren.
Im Vergleich zu anderen Protokollen, die wir getestet, hat dieses Immunfluoreszenz-Protokoll für die meisten der in unserem Labor verwendeten Antikörper geeignet erwiesen. In bestimmten Fällen kann es jedoch, einige Anpassungen zur Verbesserung der Färbung Ergebnisse verlangen. Eine Variable, die leicht geändert und getestet werden kann ist die Länge der Fixierung. In unserem Labor kann die Inkubation bei 4 % PFA variieren von 1 h bis 4 h, während in anderen Labors der Fixierzeit bis 12 – 24 h16verlängert wird. In unseren Händen jedoch einen längeren Fixierzeit führte zu erhöhten Hintergrundgeräusche und war nicht optimal für mehrere Antikörper, die routinemäßig in der Forschung eingesetzt.
Der pH-Wert des Antigen-Retrieval kann auch eine Rolle für den Erfolg der Färbung. Hitze-induzierte Epitop Retrieval (HIER) kann erfolgen durch den Einsatz von handelsüblicher Lösungen mit pH-Wert von sauer bis alkalisch, sowie andere interne gemacht Puffer wie Citrat (pH 6), Ethylenediaminetetraacetic Säure (EDTA, pH 8), Tris-EDTA (pH 9), Tris (pH 10). Enzymatische Behandlung kann auch eine Option für Antigen Demaskierung. Inkubation der deparaffinized Folien für einen begrenzten Zeitraum mit einer Lösung, die eine richtige Konzentration eines Enzyms (zum Beispiel Proteinase K) kann eine alternative Methode, um HIER sein. Es ist jedoch wichtig, die Konzentration des Enzyms titrieren und die ideale Inkubationszeit zu bestimmen, da übermäßige Verdauung Gewebe17negativ beeinflussen kann.
Die Wahl der blockierenden Puffer ist auch eine andere Variable für die Problembehandlung. Neben der Verwendung von normalem ziegenserum und der im Handel erhältlichen blockierende Puffer erwähnt in diesem Protokoll (bequem in diesem Fall als primäre Maus-Antikörper auf Maus-Gewebe mit um hohen Hintergrund durch endogene Maus IgG zu verhindern) gibt es Zusatzoptionen wie Proteinlösungen (bovine Serum Albumin (BSA) oder Trockenmilch) oder andere kommerziell verfügbare Puffer zur Verfügung. Es ist wichtig, um sicherzustellen, dass der Puffer keine Stoffe enthält, die mit der Färbung, wie Biotin bei der Verwendung einer Biotin-Streptavidin Methode stören können.
Die Nebenniere ist ein endokrine Organ zeichnet sich durch hohe Fettgehalt, die oft Immunostaining durch hohe Autofluoreszenz der Lipid anspruchsvoll machen kann. Adrenal Cortex von Mäusen und Ratten sind außerdem reich an Autofluorescent Intrazytoplasmatische Lipofuszin, ein pigmentierter körnige und amorphen Material, das in der Farbe von gelb bis braun reicht. Um dieses Problem zu überwinden, können Verbindungen wie Sudan Schwarz B (SBB) die Fluoreszenz erzeugt durch Lipofuscins18stillen. Ein weiterer Faktor, der das Ergebnis eine gute Färbung gefährdet ist das Vorhandensein von Blutzellen. Hämoglobin in den Erythrozyten vorhanden absorbiert Licht der Wellenlängen < 600 nm und kann mit Fluorochromes, die diese Wellenlänge19,20umfassen stören. Während Perfusion Techniken verwendet werden können, um Blutzellen aus Gewebe Schiffe zu löschen, kann die Verwendung von 10 mM Kupfersulfat bei pH 5 vor nuklearen gegenfärbung auch helfen, unerwünschte Fluoreszenz21zu unterdrücken.
Ein wichtiger Schritt in diesem Protokoll ist die Nebennieren Dissektion. Die Nebenniere ist ein Organ, dessen Lage schwierig sein kann, in Situzu finden: bei Mäusen, die Drüsen sind klein und ihre Position ist etwas variabel. Vor allem bei älteren Tieren sind Nebennieren auch von Fettgewebe umgeben, die mit der Erkennung von Drüsen und ihre konsequente Isolation, aus diesem Grund ist es wichtig beeinträchtigen können, einen klaren Überblick über das Gebiet während dieses Schritts des Protokolls zu haben. Entfernung der Peri-Nebennieren Fettabsaugung ist eine heikle Schritt. Besondere Aufmerksamkeit sollte der Nebennieren geschenkt werden während Sie lösen das Fett um die Kapsel reißen nicht zu. Die Drüse muss auch während des Verfahrens um Gewebeschäden zu vermeiden feucht mit PBS gehalten werden.
Beim Schneiden, kann erkennen das Vorhandensein von die kleine Portion des adrenalen Gewebes in den Abschnitten durch Gewebe Hypopigmentierung nach der Verarbeitungsschritt schwierig sein. Ein Mikroskop ist sehr hilfreich bei der Schnitt für anspruchsvolle das Gewebe vom Wachs.
Immunostaining auf Paraffin-eingebetteten Abschnitte ist eine wertvolle Technik für Immunolabeling interessierender Proteine unter Beibehaltung der Morphologie des Gewebes. Die hier vorgestellte Methode beruht auf Fluoreszenz-Detektion, und während es besonders funktional für Studien mit mehreren primären Antikörper, das Fluoreszenzsignal ist lichtempfindlich und können leicht verloren gehen oder geschwächt, wenn die Folien nicht behandelt werden richtig (z.B. längerer Exposition gegenüber dem Licht Mikroskop oder unnötige Exposition gegenüber Umgebungslicht). Darüber hinaus können wir einen Rückgang der Lebensqualität das Fluoreszenzsignal selbst im Laufe der Zeit feststellen. Dieses Problem kann vermieden werden, durch die Verwendung von chromogenen Erkennung, Photostabil und visualisiert werden, seit vielen Jahren. Diese Methode fehlt jedoch die Vorteile der Fluoreszenz-Detektion, wie Kennzeichnung höhere Präzision und gleichzeitige Kennzeichnung von mehreren Proteinen in einer Studie.
Einbetten von Paraffin ist eine bequeme Methode zur Verarbeitung und Speicherung von mehreren Gewebeproben. Das Gewebe Verarbeitung für Paraffin einbetten selbst ist jedoch nicht geeignet für die Darstellung von fluoreszierenden Reporter endogen in einigen Transgene Tiere ohne den Einsatz eines spezifischen Antikörpers Ausrichtung der Reporters zum Ausdruck gebracht. Kryokonservierung ist eine Methode zum Abbau des fluoreszierenden Proteins zu vermeiden und ermöglichen die direkte Visualisierung unter dem Mikroskop. Der Verzicht auf einen zusätzlichen Antikörper kann einen Vorteil darstellen. Auf der anderen Seite kann Kryokonservierung auch begrenzt werden, da sie Gewebe Morphologie betrifft; Es erfordert auch andere Ausrüstung für Schneiden, und die Lagerung von Folien und Gewebe Blöcke ist in den Tiefkühltruhen nur möglich.
Eine wichtige Einschränkung von imaging-geschnittenen Gewebe ist die Fähigkeit, Bilder von Bauteilen mit hohen räumlichen Auflösungen zu erhalten. Zusammensetzung, ist in der Tat eine wichtige Variable bestimmt die Qualität der Bildgebung, da es Lichteinfall beeinflusst und kann zu schlechter Auflösung führen. Die Nebenniere ist ein Gewebe, das Reich an Lipiden, die Lichtstreuung22verursachen. Im Gehirn, das auch einen hohen Fettgehalt hat, sind Gewebe-Clearing Techniken wie Klarheit, BABB, iDISCO und 3DISCO entwickelt worden, um Gewebe-Visualisierung, zulassend bessere Bildgebung und 3D Gewebe Wiederaufbau23zu verbessern. Diese Techniken sind Forscher bietet qualitativ hochwertige Bilddaten und sind an einer verschiedenen Reihe von Geweben angepasst, und in der Zukunft, wir hoffen, diese Methoden für adrenale imaging sowie zu beschäftigen.
Offenlegungen
Die Autoren haben nichts preisgeben.
Danksagungen
Wir danken Dr. Mohamad Zubair für seine Anregungen und technische Hilfe bei der Schaffung dieses Protokolls. Diese Arbeit wurde vom National Institute of Diabetes und Magen-Darm und Nieren-Erkrankungen, nationale Institute der Gesundheit Research Grant 2R01-DK062027 (zu G.D.H) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| 24-well cell culture plate | Nest Biotechnology Co. | 0412B | |
| Disposable needles 25 G x 5/8" | Exel International | 26403 | |
| Paraformaldehyde (PFA) | Sigma-Aldrich | P6148 | |
| Paraplast plus | McCormik scientific | 39502004 | Paraffin for tissue embedding |
| Shandon biopsy cassettes II with attached lid | Thermo scientific | 1001097 | Cassettes for tissue processing |
| High Profile Microtome Blades | Accu-Edge | 4685 | Disposable stainless steel blades |
| Peel-a-way disposable plastic tissue embedding molds | Polysciences Inc. | 18986 | Truncated, 22 mm square top tapered to 12 mm bottom |
| Superfrost Plus Microscope Slides | Fisherbrand | 12-550-15 | 75 mm x 25 mm x 1 mm |
| Xylene | Fisher Chemical | X5P1GAL | |
| 200 Proof Ethanol | Decon Labs, Inc. | ||
| Certi-Pad Gauze pads | Certified Safety Mfg, Inc | 231-210 | 3" x 3. Sterile latex free gauze pads |
| M.O.M kit | Vector laboratories | BMK-2202 | For detecting mouse primary antibodies on mouse tissue |
| KimWipes | Kimtech | 34155 | Wipes 4.4 inch x 8.4 inch |
| Super PAP PEN | Invitrogen | 00-8899 | Pen to draw on slides |
| Microscope cover glass | Fisherbrand | 12-544-D | Size: 22 x 50 x 1.5 |
| DAPI | Sigma | D9542 | (Prepared in 20 mg/mL stock) |
| ProLong Gold antifade reagent | Molecular Probes | P36930 | Mounting agent for immunofluorescence |
| X-cite series 120Q | Lumen Dynamics | Light source | |
| Coolsnap Myo | Photometrics | Camera | |
| Optiphot-2 | Nikon | Microscope | |
| microtome | American Optical | ||
| Tissue embedder | Leica | EG1150 H | |
| Tissue processor | Leica | ASP300S | |
| Normal goat serum | Sigma | G9023 | |
| Mouse anti-TH | Millipore | MAB318 | Primary antibody |
| Rabbit anti-SF1 | Ab proteintech group (PTGlabs) | custom made | Primary antibody |
| Alexa-488 Mouse IgG raised goat | Jackson ImmunoResearch | 115-545-003 | Secondary antibody |
| Dylight-549 Rabbit IgG raised goat | Jackson ImmunoResearch | 111-505-003 | Secondary antibody |
| Citrate acid anhydrous | Fisher Chemical | A940-500 | |
| NIS-Elements Basic Research | Nikon | Software for imaging |
Referenzen
- Brandtzaeg, P. The increasing power of immunohistochemistry and immunocytochemistry. Journal of Immunological Methods. 216 (1-2), 49-67 (1998).
- Matos, L. L., Trufelli, D. C., de Matos, M. G., da Silva Pinhal, M. A. Immunohistochemistry as an important tool in biomarkers detection and clinical practice. Biomark Insights. 5, 9-20 (2010).
- Coons, A. H., Creech, H. J., Jones, R. N. Immunological properties of an antibody containing a fluorescent group. Proceedings of the Society for Experimental Biology and Medicine. 47 (2), 200-202 (1941).
- Lerario, A. M., Finco, I., LaPensee, C., Hammer, G. D. Molecular Mechanisms of Stem/ Progenitor Cell Maintenance in the Adrenal Cortex. Frontiers in Endocrinology. 8, (2017).
- Yates, R., et al. Adrenocortical Development, Maintenance, and Disease. Endocrine Gland Development and Disease. 106, 239-312 (2013).
- Jones, I. C. Variation in the Mouse Adrenal Cortex with Special Reference to the Zona Reticularis and to Brown Degeneration, Together with a Discussion of the Cell Migration Theory. Quarterly Journal of Microscopical Science. 89 (1), 53(1948).
- Sucheston, M. E. C., Samuel, M. The Transient-Zone in the Human and Mouse Adrenal Gland. The Ohio Journal of Science. 72, n2 (March, 1972) 120-126 (1972).
- Guasti, L., Paul, A., Laufer, E., King, P. Localization of Sonic hedgehog secreting and receiving cells in the developing and adult rat adrenal cortex. Molecular and Cellular Endocrinology. 336 (1-2), 117-122 (2011).
- Pihlajoki, M., Dorner, J., Cochran, R. S., Heikinheimo, M., Wilson, D. B. Adrenocortical zonation, renewal, and remodeling. Frontiers in Endocrinology. 6, 27(2015).
- Farese, R. V., Walther, T. C. Lipid Droplets Finally Get a Little R-E-S-P-E-C-T. Cell. 139 (5), 855-860 (2009).
- Shen, W. J., Azhar, S., Kraemer, F. B. Lipid droplets and steroidogenic cells. Experimental Cell Research. 340 (2), 209-214 (2016).
- Finco, I., LaPensee, C. R., Krill, K. T., Hammer, G. D. Hedgehog signaling and steroidogenesis. Annual Review of Physiology. 77, 105-129 (2015).
- Paul, A., Laufer, E. Endogenous biotin as a marker of adrenocortical cells with steroidogenic potential. Molecular and Cellular Endocrinology. 336 (1-2), 133-140 (2011).
- Lowe, J., Anderson, P. Stevens & Lowe's Human Histology, 4th Edition. , Elsevier/Mosby. 263-285 (2015).
- Nagatsu, T. Genes for human catecholamine-synthesizing enzymes. Neuroscience Research. 12 (2), 315-345 (1991).
- Berthon, A., et al. Age-dependent effects of Armc5 haploinsufficiency on adrenocortical function. Human Molecular Geneticst. 26 (18), 3495-3507 (2017).
- Brown, C. Antigen retrieval methods for immunohistochemistry. Toxicologic Pathology. 26 (6), 830-831 (1998).
- Billinton, N., Knight, A. W. Seeing the wood through the trees: a review of techniques for distinguishing green fluorescent protein from endogenous autofluorescence. Analytical Biochemistry. 291 (2), 175-197 (2001).
- Hirsch, R. E., San George, R. C., Nagel, R. L. Intrinsic fluorometric determination of the stable state of aggregation in hemoglobins. Analytical Biochemistry. 149 (2), 415-420 (1985).
- Whittington, N. C., Wray, S. Suppression of Red Blood Cell Autofluorescence for Immunocytochemistry on Fixed Embryonic Mouse Tissue. Current Protocols in Neuroscience. 81, 28(2017).
- Watson, J. Suppressing autofluorescence of erythrocytes. Biotechnic & Histochemistry. 86 (3), 207(2011).
- Epp, J. R., et al. Optimization of CLARITY for Clearing Whole-Brain and Other Intact Organs. eNeuro. 2 (3), (2015).
- Erturk, A., et al. Three-dimensional imaging of solvent-cleared organs using 3DISCO. Nature Protocols. 7 (11), 1983-1995 (2012).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten