Method Article
Isolamento, fissazione e immunofluorescenza Imaging delle ghiandole adrenali Mouse
In questo articolo
Riepilogo
Qui presentiamo un metodo per isolare ghiandole surrenali da topi, difficoltà i tessuti, sezione loro ed eseguire la colorazione di immunofluorescenza.
Abstract
L'immunofluorescenza è una tecnica affermata per il rilevamento degli antigeni nei tessuti con l'impiego di anticorpi coniugati fluorocromo e ha un ampio spettro di applicazioni. Rilevamento degli antigeni permette per la caratterizzazione ed identificazione di più tipi di cellule. Situato sopra i reni e incapsulati da uno strato di cellule mesenchimali, il surrene è un organo endocrino, composto da due tessuti differenti con differenti origini embriologiche, mesonephric intermedia derivati mesoderma corteccia esterna e neurali derivati dalla cresta midollo interno. La corteccia surrenale secerne steroidi (cioè, i mineralcorticoidi, glucocorticoidi, ormoni sessuali), mentre il midollo surrenale produce catecolamine (cioè, adrenalina, noradrenalina). Durante lo svolgimento di ricerca adrenale, è importante essere in grado di distinguere le uniche cellule con funzioni diverse. Qui forniamo un protocollo sviluppato nel nostro laboratorio che descrive una serie di passi sequenziali necessarie per ottenere la colorazione di immunofluorescenza per caratterizzare i tipi di cellule della ghiandola surrenale. Prima ci concentriamo sulla dissezione delle ghiandole surrenali del mouse, la rimozione microscopica del grasso di periadrenal seguita dalla fissazione, elaborazione e inclusione in paraffina del tessuto. Descriviamo quindi la divisione dei blocchi di tessuto con un microtomo rotativo. Infine, abbiamo dettaglio un protocollo per la macchiatura immunofluorescente delle ghiandole adrenali che abbiamo sviluppato per ridurre al minimo sia non specifico anticorpo che lega e autofluorescenza al fine di ottenere un segnale ottimo.
Introduzione
Immunohistochemistry è una tecnica per la rilevazione di componenti del tessuto con l'uso di anticorpi contro specifiche molecole cellulari e successive tecniche di colorazione per rilevare gli anticorpi coniugati1. Questa procedura di immunohistochemical richiede particolare attenzione e il trattamento dei tessuti che sono spesso empiricamente determinati per l'antigene specifico, dei tessuti e l'anticorpo utilizzato2. La fissazione è cruciale per mantenere lo stato "originale" del tessuto e quindi mantenendo intatto cellular e strutture subcellulari e modelli di espressione. Ulteriore elaborazione e incorporare procedure necessari per preparare il tessuto per il taglio a fettine sottili che vengono utilizzati per gli studi istologici che coinvolgono immunohistochemistry.
Immunostaining può essere eseguita con rilevamento o cromogenico o fluorescente. Cromogenico rilevamento richiede l'utilizzo di un enzima per convertire un substrato solubile in un prodotto colorato insolubile. Mentre questo enzima può essere coniugato all'anticorpo riconosce l'antigene (anticorpo primario), esso è più spesso coniugata con l'anticorpo che riconosce l'anticorpo primario (cioè, l'anticorpo secondario). Questa tecnica è altamente sensibile; il prodotto colorato risultante dalla reazione enzimatica è fotostabile e richiede solo un microscopio a campo chiaro per l'imaging. Tuttavia, cromogenico immunostaining può non essere adatto quando si tenta di visualizzare due proteine che co-localizzano, poiché la deposizione di un colore può mascherare la deposizione di altro. In caso di co-macchiatura, immunofluorescenza ha dimostrato di essere più vantaggioso. L'avvento dell'immunofluorescenza è attribuita a Albert Coons e colleghi, che ha sviluppato un sistema per identificare gli antigeni del tessuto con anticorpi marcati con fluoresceina e visualizzarli nei tessuti sezionati sotto luce ultravioletta3. Rilevazione della fluorescenza è basato su un anticorpo coniugato con un fluoroforo che emette luce dopo l'eccitazione. Poiché esistono diversi fluorofori con emissioni a lunghezze d'onda (con poca o nessuna sovrapposizione), questo metodo di rilevamento è ideale per gli studi di molte proteine.
Il surrene è un organo accoppiato situato sopra il rene e caratterizzato da due componenti embriologicamente distinte, circondate da una capsula mesenchymal. Corteccia surrenale esterna, derivata dal mesoderma intermedio mesonefrici, secerne ormoni steroidei, mentre il midollo interno, derivato dalla cresta neurale, produce le catecolamine tra cui adrenalina, noradrenalina e dopamina. La corteccia surrenale è istologicamente e funzionalmente suddiviso in tre zone concentriche, con ogni zona che secernono diverse classi di ormoni steroidei: l'esterno zona glomerulare (zG) produce mineralcorticoidi che regolano l'omeostasi dell'elettrolito e volume intravascolare; la centrale zona fascicolata (zF), direttamente sotto il zG, secerne i glucocorticoidi che mediano la risposta allo stress attraverso la mobilitazione delle riserve di energia per aumentare il glucosio del plasma; e i reticularis di zona interna (zR), che sintetizza il sesso precursori steroidei (cioè, del deidroepiandrosterone (DHEAS))4.
Qualche variazione nella zonazione corticosurrenale è presente tra le specie: per esempio, Mus musculus manca la zR. X-zone postnatale unica di M. musculus è un residuo della corteccia fetale caratterizzata da piccole cellule lipido-poveri con acidofilico citoplasmi5. X-zone scomparirà alla pubertà nei topi maschi e dopo la prima gravidanza nei topi femmina, o gradualmente degenera in femmine di razza non6,7. Inoltre, la tortuosità e lo spessore delle esposizioni zG segnato variazione tra le specie come organizzazione delle cellule staminali e progenitori periferiche in ed adiacente la zG. Il ratto, a differenza di altri roditori, ha una zona indifferenziata visibile (zU) tra il zG e zF che funzioni come una zona di cellule staminali e/o una zona del transiente amplificando progenitori. Se il zU è unica ai ratti o semplicemente un più prominente organizzato aggregato di cellule è sconosciuto8,9.
Le cellule della corteccia surrenale contengono goccioline lipidiche contenenti esteri del colesterolo che servono come il precursore di tutti gli ormoni steroidei10,11. Il termine "steroidogenesi" definisce il processo di produzione di ormoni steroidei dal colesterolo tramite una serie di reazioni enzimatiche che coinvolgono l'attività del fattore steroidogenico 1 (SF1), la cui espressione è un indicatore del potenziale steroidogenic. Nella ghiandola adrenale, Sf1 espressione è presente solo nelle cellule della corteccia12. Un interessante studio ha trovato l'espressione di biotina endogena in cellule corticosurrenali con potenziali steroidogenic13. Mentre questo può essere la causa di un più elevato background in metodi di colorazione biotina/streptavidina-base, a causa del rilevamento di biotina endogena di anticorpo coniugato con streptavidina, questa caratteristica potrebbe essere impiegata anche per distinguere il steroidogenic cellule da altre popolazioni all'interno della ghiandola surrenale, cioè, endoteliale, capsulare e cellule di midollo.
Innervati dai neuroni preganglionic simpatici, il midollo surrenale è caratterizzato da cellule basophilic con un citoplasma granulare contenente epinefrina e norepinefrina. Cellule di midollo sono denominate "cromaffine" grazie all'elevato contenuto di catecolamine che formano un pigmento marrone dopo ossidazione14. Tirosina idrossilasi (TH) è l'enzima che catalizza la tappa limitante della sintesi delle catecolamine e, nella ghiandola adrenale, è espresso solo nel midollo15.
Qui presentiamo un protocollo per l'isolamento delle ghiandole surrenali di mouse, loro elaborazione per l'incorporamento in paraffina e sezionamento e un metodo per eseguire immunofluorescenza su sezioni adrenale di colorazione al fine di identificare i tipi cellulari che costituiscono il corteccia surrenale e nel midollo. Questo protocollo è uno standard nel nostro laboratorio per immunostaining con gli anticorpi più abitualmente utilizzati nella nostra ricerca.
Protocollo
Tutti i metodi sono stati effettuati secondo protocolli istituzionalmente approvati sotto gli auspici del Comitato Università sull'uso e la cura degli animali presso l'Università del Michigan.
1. preparazione per la chirurgia
- Il giorno prima dell'intervento chirurgico, preparare la paraformaldeide al 4% (PFA) / tampone fosfato salino (PBS). In caso di aliquote congelate, procedere a scongelare uno e conservare a 4 ° C.
Nota: 4% PFA non è stabile per più di 48 h.
Attenzione: PFA è tossico, evitare il contatto con pelle e occhi e gettare in un contenitore appropriato. - Il giorno dell'intervento chirurgico, preparare gli strumenti chirurgici di sterilizzazione le forbici e pinze con 70% di etanolo (EtOH) e lasciarle asciugare su della carta assorbente.
- Luogo pieno di una piastra a 24 pozzetti con PBS 1X (1 mL/pozzetto è sufficiente) in un secchio di ghiaccio.
Nota: Le ghiandole surrenali verranno mantenute in questo piatto multi-pozzetto cultura dopo la chirurgia.
2. adrenale dissezione
- Eutanasia il mouse seguendo protocolli standard approvati dalla istituzionale Animal Care and uso Committee (IACUC). È necessario un metodo secondario dell'eutanasia per assicurare la morte (ad esempio decapitazione).
- Per l'eutanasia per overdose di isoflurano, posizionare il mouse in una camera piena di vapori di isoflurano, fino a quando non cessa di respirazione, quindi rimuovere il mouse dalla camera, collocarlo su una superficie ed eseguire dislocazione cervicale.
Nota: La maggior parte dei metodi di eutanasia provocare disagio per l'animale e non sono adatti per gli studi di stress perché essi possono aggiungere la variabile di confusione dell'attivazione dell'asse ipofisi-surrene e rilascio di catecolamine midollare. In questo caso, la decapitazione è la tecnica suggerita da adottare.
- Per l'eutanasia per overdose di isoflurano, posizionare il mouse in una camera piena di vapori di isoflurano, fino a quando non cessa di respirazione, quindi rimuovere il mouse dalla camera, collocarlo su una superficie ed eseguire dislocazione cervicale.
- Posare il mouse Supino, sterilizzare l'area incisione sull'addome e fianchi con 70% EtOH.
Nota: Mentre rasatura aumenterà la sterilità, per questa particolare applicazione non è necessario. - Tagliare la pelle al centro dell'addome utilizzando le forbici, separare la pelle dal peritoneum, deskin il mouse pizzicare la pelle intorno il taglio e tirandolo in direzioni opposte (caudale e rostrale). Poi tagliare il peritoneo fino a raggiungere i fianchi posteriori sinistro e destro.
- Rimuovere il taglio della ghiandola surrenale murino intorno il tessuto adiposo circostante e inserirlo nella piastra 24-pozzetti riempito con 1x PBS e tenuta su ghiaccio.
3. rimozione di grasso Peri-adrenali
- Sotto un microscopio per dissezione, collocare le surrenali su un vetro base o una piastra di Petri sul piatto fase, posizionare la sorgente di luce, selezionare l'ingrandimento e regolare la messa a fuoco per ottenere una visione chiara dell'intera adrenale.
Nota: L'ingrandimento utilizzato può variare a seconda delle preferenze personali. Un ingrandimento totale di 30 X con una lente piano 1 X, zoom 3x e oculare 10x permette di visualizzare l'intera ghiandola con un buon campo di vista. - Rimuovere rapidamente i tessuti grassi adiacenti con due aghi 25g, evitando la disidratazione dell'adrenale. Se questo accade prima che tutto il grasso viene rimosso, mossa adrenale indietro nel pozzo contenente 1X PBS per 1 – 2 min e poi continuare con il processo di rimozione di grasso.
- Lavare 2x per 2 minuti ciascuno, in PBS 1X.
4. tessuto lavorazione e incorporamento
- Difficoltà i tessuti in 4% PFA/PBS a 4 ° C su una piattaforma a dondolo per 2 h.
- Rimuovere il 4% PFA e lavare i tessuti con PBS 1X, 3x per 15 minuti ciascuno, a 4 ° C.
Attenzione: PFA è tossico ed è un rifiuto pericoloso; deve essere maneggiato con cautela sotto una cappa chimica e disposti in un contenitore di rifiuti pericolosi. - Incubare le ghiandole surrenali in 50% EtOH a 4 ° C su una piattaforma a dondolo per 2 h.
- Incubare le ghiandole surrenali nel 70% EtOH a 4 ° C su una piattaforma a dondolo per un minimo di 2 h.
Nota: Se non procedendo con lavorazione per l'incorporamento del tessuto, le ghiandole surrenali possono essere memorizzate in 70% EtOH a 4 ° C. Evitando la conservazione a lungo termine in 70% EtOH e procedere al tessuto lavorazione appena possibile produce campioni di qualità migliori. - Preparare le surrenali per lavorazione da avvolgendolo in garza e incorporarla in un tessuto che cassetta del tessuto. Posizionare la cassetta in un vaso riempito con 70% EtOH e conservare a 4 ° C fino al momento di spostare il processatore di tessuti. Inserire la cassetta nel processatore di tessuti programmato come riportato nella tabella 1 ed eseguire il programma.
- Trasferire la cassetta in una stazione di incorporamento riempita con paraffina fusa a 65 ° C. Nel caso in cui una stazione di raffreddamento non è disponibile, posizionare un vassoio di raffreddamento freddo accanto ad essa.
- Etichettare un'incorporamento muffa e aprire il tessuto l'incorporamento di cassetta. Utilizzando un paio di pinze, scartare la garza e posizionare le surrenali delicatamente nella posizione desiderata al centro della base nello stampo incorporamento. Versare la paraffina fusa su adrenale. Se necessario, è possibile tenere adrenale con pinze per consolidare la sua posizione nello stampo altrimenti esso può muoversi all'interno dello stampo.
- Delicatamente spostare lo stampo incorporamento per il vassoio di raffreddamento e attendere l'indurimento della paraffina. Dopo di che, per facilitare il sezionamento, memorizzare l'incorporamento stampi in un luogo fresco.
5. sezionamento con un microtomo rotativo
- Controllare che il microtomo sia pulito prima di iniziare, spazzare via tutti i residui di paraffina scartati, assicurarsi che il coltello (o lama) è affilato, il meccanismo interno di olio e retrarre completamente del supporto del blocco se necessario.
- Etichettare una serie di vetrini da microscopio (positivamente caricata o rivestito per evitare la perdita di tessuto (Vedi Tabella materiali)), stenderli su un insieme di diapositive più caldo a 37 ° C ed erogare alcuni acqua ultrapura in autoclave di tipo 1 in cima a ogni diapositiva.
- Impostare lo spessore di sezione a 5 µm.
- Inserire la lama del microtomo del portalama, controllare l'angolo della lama, assicurarsi che la lama è fissata saldamente nel supporto e verificare il gioco del blocco di paraffina e supporto del blocco.
- Portare il titolare di blocco nella posizione più alta e, se possibile, bloccare la leva d'armamento, rimuovere il blocco di paraffina dallo stampo e inserirlo nel supporto blocco fissandolo saldamente con il morsetto. L'angolo della linea centrale della lama con la superficie di rivestimento del blocco dovrebbe essere di circa 20°. Se necessario, regolare di nuovo il blocco di paraffina.
Attenzione: La lama è affilata. - Se precedentemente bloccato, sbloccare la rotella di mano e abbassare il blocco di paraffina fino a quando il suo volto è a livello con il bordo della lama del microtomo. Ruotare la rotella di mano con un ritmo costante. Eseguire la rimozione iniziale per rimuovere la paraffina ed esporre le surrenali.
- Mantenere girando la rotella di mano e la sezione fino alla fine dell'adrenale. Utilizzare un microscopio a campo chiaro o dissezione per verificare la presenza di tessuto nelle sezioni. Togliere il nastro dalla lama e con l'aiuto di un'altra coppia di pinze posarla sull'acqua posato su vetrino. Può essere utile posizionare il nastro su una superficie, allungarlo con attenzione e quindi montarla sulla diapositiva.
- Asciugare i vetrini sulla piastra calda. Stendetele piatta su un vassoio di diapositiva, quindi infornare a 37 ° C durante la notte o più, se l'acqua è ancora presente. Una volta asciutto, è possibile conservare i vetrini in una scatola di diapositiva a temperatura ambiente.
- Riporre tutte le attrezzature usate e pulire il microtomo.
6. immunofluorescenza
- Selezionare le diapositive per immunostaining e metterli in un portavetrini.
- Su un piatto caldo, portare un becher pieno di 0,01 M citrato a pH 2.0 a bollire. Il volume del buffer dipende dalle dimensioni Becher e deve essere sufficiente per coprire le sezioni sulle diapositive durante l'ebollizione (alcuni evaporazione deve essere presa in considerazione). Coprire il recipiente con carta stagnola.
Nota: Altri metodi di ricupero dell'antigene sono disponibili (Vedi discussione). - Deparaffinizzare le diapositive in xilene 100% 2 x per 5 minuti ciascuno. Reidratare le diapositive utilizzando la seguente serie: 100% EtOH 2 x per 5 min, 70% EtOH 2 x per 5 min, digitare 1 acqua ultrapura per 5 min.
Nota: Dopo Sparaffinatura, è importante non lasciare che le sezioni asciugarsi: sezioni di tessuto devono essere sempre coperti con buffer o soluzioni fino alla fine della procedura o la struttura del tessuto può essere danneggiata. - Per ricupero dell'antigene, mettere i vetrini in un supporto a slitta in metallo e inserirlo nel becher con bollente citrato senza il foglio di alluminio. Far bollire per 10 min.
- Rimuovere il recipiente dalla piastra scaldante e lasciarlo raffreddare per 20 min. Assicuratevi che le sezioni adrenale sono ancora coperti con il buffer.
- Preparare la soluzione di blocco. Se usando la macchiatura disponibili in commercio kit impiegato per la Rappresentante risultati (Vedi la Tabella materiali), in una provetta aggiungere 1,25 mL di PBS 1X, 1 goccia (pari a circa 45 µ l) di Mouse Ig reagente bloccante e il 5% di siero di capra normale. Conservare la soluzione bloccante a 4 ° C o su ghiaccio durante il lavoro.
Nota: Il siero utilizzato dipende dalla specie ospite di anticorpo secondario. Qui sono stati utilizzati anticorpi secondari generati in capra. Per altri anticorpi, le concentrazioni nel siero diverse può essere necessari. Empiricamente determinare la concentrazione nel siero corretta testando diverse concentrazioni. - Trasferire i vetrini in una vaschetta di Coplin contenente PBS 1X e lavare 3 x 10 min ciascuno su un rocker con dolce dondolio.
- Preparare una camera umidificata per la colorazione.
- Delicatamente, scrollarsi di dosso il PBS da una diapositiva; pulire la parte inferiore della diapositiva con un panno privo di lanugine per rimuovere l'eccesso di PBS.
- Usando un pennarello speciale per diapositive con proprietà idrofobe, disegnare un cerchio che circonda ogni sezione adrenale, assicurandosi che la superficie di vetro è asciutta per evitare la diffusione della soluzione inchiostro alla sezione. Se necessario, asciugare delicatamente la superficie. Porre il vetrino nella camera umidificata.
- Rapidamente, pipettare 50 µ l (o abbastanza per coprire sezioni) di soluzione su ogni sezione di blocco. Incubare per 1 h a temperatura ambiente.
Nota: Blocco volume di soluzione necessario può variare; è importante che le sezioni sono ben coperti con la soluzione. - Preparare la soluzione di diluente da kit disponibile in commercio con 7,5 mL di PBS 1X, 600 µ l di proteina concentrato siero normale di capra stock soluzione e 5% (o qualsiasi altri siero e concentrazione usata nella soluzione bloccante). Conservare la soluzione diluente a 4 ° C o su ghiaccio durante il lavoro.
- Preparare le soluzioni di anticorpo primario diluendo gli anticorpi primari a concentrazioni appropriate nella soluzione diluente. Per co-macchiatura, aggiungere un'aliquota di ciascun anticorpo in un nuovo tubo e mescolare delicatamente. Mettere gli anticorpi e soluzioni dell'anticorpo sul ghiaccio fino all'uso.
Nota: Qui abbiamo impiegato anticorpo anti-SF1 alzato nel coniglio e un anticorpo anti-TH alzato nel topo. Per preparare l'anticorpo allestimenti da seguono come indicato.- Per la soluzione di lavoro di SF1, in una provetta, aggiungere 1 µ l di anticorpo anti-SF1 a 999 µ l di soluzione diluente (concentrazione finale di 1,5 µ g/mL). Per la soluzione di lavoro del TH, in una provetta, aggiungere 1 µ l anti-TH anticorpo in 499 µ l di soluzione diluente (stimato concentrazione finale di 2-6 µ g/mL).
- Per SF1 + TH mix di lavoro dell'anticorpo, in una nuova provetta, pipettare 250 µ l di soluzione di lavoro di SF1 e 250 µ l di soluzione di lavoro di TH. Mescolare delicatamente pipettando. Conservare il ghiaccio.
- Trasferire i vetrini in una vaschetta di Coplin contenente 1X PBS e lavare 3 volte per 5 minuti ciascuno su un rocker con dolce dondolio.
- Posto le diapositive indietro nella camera umidificata dopo pulire fuori l'eccesso di PBS, pipetta il SF1 + TH anticorpo lavoro mix (o altra soluzione di anticorpo primario) su ogni sezione, chiudere la camera umidificata e lasciarlo tutta la notte a 4 ° C.
- Il giorno seguente, spostare le diapositive in un Coplin barattolo contenente 1X PBS e lavare 3x per 15 min su un rocker con dolce dondolio.
- Mentre ci si lava le diapositive, preparare la soluzione di anticorpo secondario nella soluzione diluente usando la concentrazione appropriata. Se eseguendo co-macchiatura, aggiungere pari quantità di ogni soluzione di anticorpo secondario in un nuovo tubo. Mescolare delicatamente pipettando. Conservare il ghiaccio. Proteggere i tubi dalla luce e conservare il ghiaccio fino all'uso.
Nota: Qui, gli anticorpi secondari utilizzati sono 488 nm fluorescente tingere-contrassegnati anti-topo generato in capra e 549 fluorescente tingere-contrassegnati anti-coniglio sollevato in capra. La soluzione di anticorpo secondario è stata preparata con l'aggiunta di 0,5 µ l di ogni anticorpo secondario in 799 µ l di soluzione diluente (concentrazioni finali di 1,2 µ g/mL). - Porre i vetrini indietro nella camera umidificata dopo aver rimosso l'eccesso di PBS, rapidamente dispensare la soluzione di anticorpo secondario sulle sezioni adrenale, chiudere la camera umidificata e proteggerlo dalla luce. Incubare per 1 h a temperatura ambiente.
- Lavare i vetrini in una vaschetta di Coplin con 1x PBS e lavare 3x per 15 min su un rocker con dondolio, assicurandosi di proteggerli dalla luce.
- Preparare la soluzione 6-diamidino-2-phenylindole (DAPI), 4' per la macchiatura nucleare: 1 µ l di DAPI (20 mg/mL) in 1 mL di PBS 1X.
Nota: Controcolorazione nucleare blu fluorescente può essere ottenuto anche utilizzando colorante Hoechst. - Pipettare soluzione DAPI sulle sezioni adrenale, coprire dalla luce e incubare a temperatura ambiente per 7 min.
- Lavare i vetrini in una vaschetta di Coplin con 1x PBS e lavare 3 volte per 5 min su un rocker con dondolio, proteggendo i vetrini dalla luce.
- In una zona al riparo da luce diretta, stabilire una copertura vetrata e pipettare 60 µ l o circa 3 gocce di agente di montaggio adatto per immunofluorescenza lungo la superficie del vetro di copertura.
- Strofinare delicatamente la parte posteriore di una diapositiva con un panno privo di lanugine, posizione della diapositiva a faccia in giù verso il vetro di copertura e parallelo ad esso, in modo da affrontano le sezioni di tessuto il vetro di copertura con l'agente di montaggio su di esso. Premere la diapositiva il vetro di copertura leggermente e assicurarsi che nessuna bolla di aria è intrappolata tra la diapositiva e il vetro di copertura.
- Se necessario, applicare una pressione ulteriore per rimuovere le bolle d'aria e l'eccesso di agente di montaggio.
- Fissare il vetrino in un contenitore scuro e la cura a temperatura ambiente per un minimo di 24h (o il tempo indicato nella finestra delle informazioni dell'agente montaggio utilizzato) e quindi procedere a imaging.
7. imaging
Nota: Un microscopio a fluorescenza collegato ad una macchina fotografica è necessario per il rilevamento e l'acquisizione della fluorescenza emessa dai tessuti dopo l'eccitazione a determinate lunghezze d'onda. Mentre è ovvio, è importante ricordarsi di scegliere il secondario anticorpo coniugato con fluorocromi cui eccitazione e spettri di emissione sono compatibili con le attrezzature disponibili. Impostazioni di imaging variano secondo il microscopio e il software utilizzato per catturare le immagini. Ci sono alcune regole di base che si applicano per sezioni adrenale di imaging, ad esempio per assicurarsi che il tempo di esposizione, fotocamera impostazioni di guadagno e intensità della sorgente luminosa vengono mantenuti costanti.
- Accendere la fonte di luce e la fotocamera, avviare il software di imaging seguendo le indicazioni del produttore.
Nota: L'ordine di queste azioni può differire a seconda dell'attrezzatura impiegata. - Proteggere il vetrino sul palco, aprire l'otturatore ed esaminando gli oculari del microscopio utilizzare nucleare colorazione (DAPI) canale e basso ingrandimento (4x) per identificare il tessuto sulla diapositiva: sezioni adrenale sono piccole, e la loro visualizzazione potrebbe richiedere qualche tempo.
- Cambiare per un maggiore ingrandimento (10x), messa a fuoco e chiudere l'otturatore.
Nota: È importante evitare inutilmente lunga esposizione alla luce che possono causare photobleaching, con conseguente perdita di segnale. - Utilizzando i comandi del software, selezionare l'obiettivo (X 10) e il canale in uso (DAPI), regolare il tempo di esposizione (1 s, può essere regolato se il segnale è troppo forte o debole). Se disponibili, impostare binning per formazione immagine dal vivo (non acquisto) su "2 X 2', conversione guadagno 'mid', velocità di lettura a 20 MHz". Se il software utilizzato non Visualizza la barra della scala alla fine dell'imaging, selezionare l'opzione di barra di scala dal menu e la barra di posizione dove desiderato.
- Aprire l'otturatore, regolare nuovamente la messa a fuoco se necessario e cambiare i canali (FITC, TRITC, DAPI). Se il microscopio non è automatico, scattare una foto dell'adrenale in ciascun canale senza spostare il palco e assicurarsi di regolare la selezione del canale in uso. Chiudere l'otturatore una volta finito.
Nota: Annotare le impostazioni impiegate nel caso in cui il software non salva automaticamente li. - Salvare le immagini.
Nota: Immagini unite possono essere spesso creati utilizzando software del microscopio o altri pacchetti di software di editor di grafica. - Formazione immagine di ripetizione per altri settori della sezione e/o con un ingrandimento maggiore.
Nota: Un ingrandimento 20 X spesso richiede un tempo di esposizione più breve (cioè, 800 ms). - Alla fine dell'imaging, spegnere tutte le apparecchiature nell'ordine corretto.
Risultati
Figura 1 rappresenta lo schema dell'intero protocollo descritto in precedenza. Ghiandole surrenali vengono raccolte dai topi, tessuto adiposo adiacente viene rimosso sotto un microscopio per dissezione e adrenale sono fissate in 4% PFA. Dopo questo passaggio, le ghiandole surrenali sono elaborate e inclusi in paraffina e sezionate con un microtomo per tagliare l'organo in fette sottili che si depositano su vetrini da microscopio. Dopo l'essiccazione delle sezioni, immunofluorescenza è effettuato e le sezioni sono ripreso al microscopio.
La rimozione del grasso adiacente (Figura 2A) è importante per facilitare l'ulteriore elaborazione e sezionamento delle ghiandole surrenali. Rimozione di successo del tessuto adiposo circostante è illustrata nella Figura 2B, dove adrenale è facilmente rilevabile e nessun grasso extra è visibile. Durante questo passaggio è fondamentale, tuttavia, per non lasciare che la ghiandola surrenale asciuga o questo potrebbe danneggiare la struttura del tessuto. L'aridità è riconoscibile quando adrenale assume un aspetto rugoso (Figura 2C). Questo problema può essere facilmente superato da reidratante adrenale in 1X PBS prima di continuare con la rimozione di grasso.
I risultati finali ottengono seguendo questo protocollo sono presentato nella Figura 3. Le immagini di immunofluorescenza illustrano immunostaining di una ghiandola surrenale a due diversi ingrandimenti. Rosso SF1 macchiatura nucleare etichette le cellule corticosurrenali, considerando che la macchiatura citoplasmica verde etichette cellule del midollo. La capsula esterna è etichettata dalla macchiatura nucleare in blu (DAPI) poiché non si tratta di steroidogenic (SF1-negativo).

Figura 1 : Rappresentazione schematica del protocollo. Dopo la raccolta le ghiandole surrenali e rimuovere il tessuto adiposo adiacente, i tessuti sono stati corretti nel 4% PFA, elaborato per l'inclusione in paraffina e sezionati. Le sezioni sono quindi immunostained ed imaged con un microscopio a fluorescenza. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2 : Rimozione del grasso peri-adrenali. (A), il grasso che circonda che la ghiandola surrenale viene rimosso sotto un microscopio di dissezione. Surrene (B) dopo la pulitura. (C) esempio di tessuto prosciugando e che richiede idratazione. Clicca qui per visualizzare una versione più grande di questa figura.
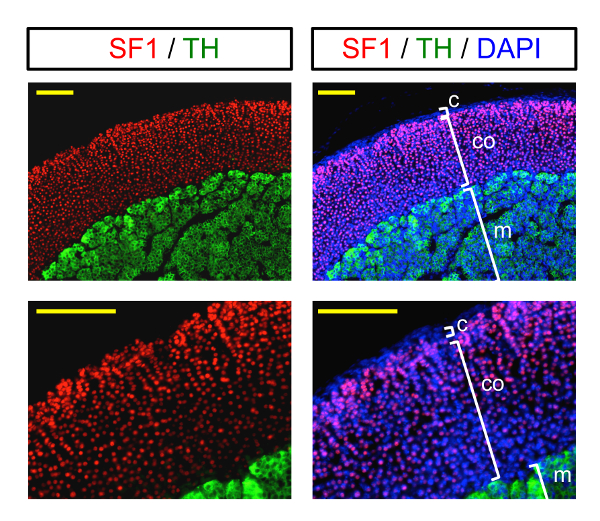
Figura 3 : Formazione immagine di immunofluorescenza della ghiandola surrenale. Esempio di formazione immagine di immunofluorescenza (a diversi ingrandimenti) di una ghiandola surrenale macchiato con marcatori della corteccia surrenale (SF1, macchiatura nucleare) e del midollo surrenale (TH, verde citoplasmatica). I nuclei (DAPI) sono contrassegnati in blu. C: capsula; CO: corteccia; m: midollo. Scala bar = 200 µm. Clicca qui per visualizzare una versione più grande di questa figura.
| Reagente | Stazione | Temperatura | Durata |
| 70% EtOH | 1 | RT | 1 h |
| 90% EtOH | 2 | RT | 1 h |
| 90% EtOH | 3 | RT | 1 h |
| EtOH assoluto | 4 | RT | 1 h |
| EtOH assoluto | 5 | RT | 1 h |
| EtOH assoluto | 6 | RT | 1 h |
| EtOH assoluto | 7 | RT | 1 h |
| Xilene | 8 | RT | 1 h |
| Xilene | 9 | RT | 1 h |
| Xilene | 10 | RT | 1 h |
| Cera di paraffina | 11 | 62 ° C | 1 h |
| Cera di paraffina | 12 | 62 ° C | 1 h |
| Cera di paraffina | 13 | 62 ° C | 1 h |
Tabella 1: Programma processore tessuto.
Discussione
Questo protocollo descrive un metodo per l'isolamento delle ghiandole surrenali del mouse insieme con la preparazione e colorazione delle ghiandole surrenali sezionato paraffina-incastonato del mouse.
Rispetto ad altri protocolli che abbiamo testato, questo protocollo di immunofluorescenza ha dimostrato adatto per la maggior parte degli anticorpi utilizzati nel nostro laboratorio. Tuttavia, in alcuni casi può richiedere qualche aggiustamento per migliorare i risultati di colorazione. Una variabile che può essere facilmente modificata e testata è la lunghezza della fissazione. Nel nostro laboratorio, l'incubazione nel 4% PFA può variare da 1 h a 4 h, mentre in altri laboratori il tempo di fissazione è esteso a 12 – 24 h16. Nelle nostre mani, tuttavia, un tempo più lungo di fissazione ha condotto al rumore di fondo aumentato e non era ottimo per parecchi anticorpi abitualmente utilizzati nella nostra ricerca.
Il pH di ricupero dell'antigene può anche svolgere un ruolo nel successo della macchiatura. Smascheramento dell'epitopo indotto da calore (HIER) può essere effettuata impiegando soluzioni disponibili in commercio con pH che vanno da acido ad alcalino, come pure altri buffer made in-House come citrato (pH 6), acido etilendiamminotetraacetico (EDTA, pH 8), Tris-EDTA (pH 9), Tris (pH 10). Trattamento enzimatico può anche essere un'opzione per smascheramento dell'antigene. Le diapositive Sparaffinatura in incubazione per un tempo limitato con una soluzione contenente una concentrazione adeguata di un enzima (ad esempio proteinasi K) può essere un metodo alternativo per HIER. È, tuttavia, essenziale a titolare la concentrazione dell'enzima e per determinare il tempo di incubazione ideale, poiché la digestione eccessiva può compromettere il tessuto17.
La scelta di tampone bloccante è anche un'altra variabile per la risoluzione dei problemi. Oltre all'uso del siero di capra normale e il tampone bloccante commercialmente disponibili citate in questo protocollo (comodo in questo caso usando gli anticorpi del mouse primario sui tessuti del mouse per evitare alta priorità bassa a causa di IgG di topo endogeno), ci sono opzioni aggiuntive disponibili come soluzioni di proteine (albumina di siero bovino (BSA) o latte in polvere) o altri tamponi disponibili sul mercato. È fondamentale per assicurarsi che il buffer non contiene sostanze che possono interferire con la colorazione, come biotina quando usando una biotina-streptavidina basato il metodo.
Il surrene è un organo endocrino caratterizzato da elevata di lipidi che spesso possono fare immunostaining impegnativo a causa di alta autofluorescenza del lipido. Inoltre, cortecce surrenali da topi e ratti sono ricche di autofluorescent lipofuscin intracitoplasmici, un materiale granulare e amorfo pigmentato che varia di colore dal giallo al marrone. Per ovviare a questo problema, composti come Sudan nero B (FFS) riesce a placare la fluorescenza generata da lipofuscine18. Un altro fattore che compromette il risultato di una buona colorazione è la presenza di cellule del sangue. Emoglobina presente negli eritrociti assorbe la luce delle lunghezze d'onda < 600 nm e può interferire con fluorocromi che si estendono su quella lunghezza d'onda19,20. Mentre tecniche di perfusione possono essere utilizzati per cancellare le celle di sangue dai vasi del tessuto, l'uso di solfato di rame 10 mM a pH 5 prima di eseguire la colorazione di contrasto nucleare può aiutare anche nella soppressione della fluorescenza indesiderati21.
Un passaggio fondamentale in questo protocollo è la dissezione adrenale. Il surrene è un organo cui posizione può essere difficile da individuare in situ: nei topi, le ghiandole sono piccole e la loro posizione è un po' variabile. Soprattutto negli animali più vecchi, le ghiandole surrenali sono circondate dal tessuto adiposo che possono interferire con il rilevamento delle ghiandole e il loro conseguente isolamento, per questo motivo che è fondamentale per avere una visione chiara della zona durante questo passaggio del protocollo. Rimozione di rimozione del grasso peri-adrenali è un passo delicato. Particolare attenzione dovrebbe essere pagata per le ghiandole surrenali mentre si toglie il grasso per non rompere la capsula. La ghiandola anche deve essere tenuta umida con PBS durante la procedura per evitare danni ai tessuti.
Durante il taglio, rilevare la presenza della piccola porzione di tessuto adrenale nelle sezioni può essere difficile a causa del tessuto hypopigmentation dopo la fase di lavorazione. Un microscopio è molto utile durante il sezionamento per discernere il tessuto dalla cera.
Immunostaining sulle sezioni paraffina-incastonate è una tecnica importante per immunolabeling proteine di interesse pur conservando la morfologia del tessuto. Il metodo qui presentato si basa sulla rilevazione della fluorescenza e, mentre è particolarmente funzionale per gli studi che impiegano anticorpi primari multipli, il segnale di fluorescenza è sensibile alla luce e può essere facilmente perso o indebolito se le diapositive non vengono gestite correttamente (cioè, prolungata esposizione al microscopio luce o l'esposizione inutile alla luce ambientale). Inoltre, possiamo notare un calo della qualità del segnale di fluorescenza stesso nel tempo. Questo problema può essere evitato utilizzando cromogenico rilevazione, che è fotostabile e possa essere visualizzati per molti anni. Questo metodo, tuttavia, manca i vantaggi del rilevamento fluorescenza, ad esempio etichettatura più alta precisione e l'etichettatura simultanea di diverse proteine in uno studio.
Inclusione in paraffina è un metodo conveniente per elaborare e archiviare più campioni di tessuto. Tuttavia, il lavorazione per sé di inclusione a paraffina del tessuto non è adatto per l'imaging di reporter fluorescenti in modo endogeno espresse in alcuni animali transgenici senza l'uso di un anticorpo specifico che mira il reporter. Crioconservazione è un metodo per evitare la degradazione della proteina fluorescente e permettere la visualizzazione diretta sotto un microscopio. Evitando l'uso di un anticorpo supplementare può rappresentare un vantaggio. D'altra parte, crioconservazione può essere limitante anche quanto riguarda la morfologia del tessuto; richiede anche diverse apparecchiature per il sezionamento e l'archiviazione di diapositive e blocchetti del tessuto è possibile nei congelatori solo.
Uno dei principali limiti di imaging un tessuto sezionato è la possibilità di ottenere immagini di componenti strutturali ad alte risoluzioni spaziali. Composizione del tessuto, infatti, è una variabile importante nel determinare la qualità dell'imaging poiché essa influenza la penetrazione della luce e può portare a scarsa risoluzione. La ghiandola surrenale è un tessuto ricco di lipidi che causano22di diffusione della luce. Nel cervello, che ha anche un contenuto lipidico elevato, tessuto-schiarimento tecniche come chiarezza, Barreto, iDISCO e 3DISCO sono state sviluppate per migliorare la visualizzazione del tessuto, permettendo per meglio imaging e 3D tessuto ricostruzione23. Queste tecniche stanno fornendo i ricercatori dati di imaging di alta qualità e sono corso di adattamento a una varia gamma di tessuti e, in futuro, ci auguriamo di utilizzare questi metodi per l'imaging adrenale pure.
Divulgazioni
Gli autori non hanno nulla a rivelare.
Riconoscimenti
Ringraziamo il Dr. Mohamad Zubair per i suoi utili suggerimenti e assistenza tecnica alla creazione di questo protocollo. Questo lavoro è stato supportato dal National Institute of Diabetes e digerente e malattie renali, istituti nazionali di salute Research Grant 2R01-DK062027 (per Gallucci).
Materiali
| Name | Company | Catalog Number | Comments |
| 24-well cell culture plate | Nest Biotechnology Co. | 0412B | |
| Disposable needles 25 G x 5/8" | Exel International | 26403 | |
| Paraformaldehyde (PFA) | Sigma-Aldrich | P6148 | |
| Paraplast plus | McCormik scientific | 39502004 | Paraffin for tissue embedding |
| Shandon biopsy cassettes II with attached lid | Thermo scientific | 1001097 | Cassettes for tissue processing |
| High Profile Microtome Blades | Accu-Edge | 4685 | Disposable stainless steel blades |
| Peel-a-way disposable plastic tissue embedding molds | Polysciences Inc. | 18986 | Truncated, 22 mm square top tapered to 12 mm bottom |
| Superfrost Plus Microscope Slides | Fisherbrand | 12-550-15 | 75 mm x 25 mm x 1 mm |
| Xylene | Fisher Chemical | X5P1GAL | |
| 200 Proof Ethanol | Decon Labs, Inc. | ||
| Certi-Pad Gauze pads | Certified Safety Mfg, Inc | 231-210 | 3" x 3. Sterile latex free gauze pads |
| M.O.M kit | Vector laboratories | BMK-2202 | For detecting mouse primary antibodies on mouse tissue |
| KimWipes | Kimtech | 34155 | Wipes 4.4 inch x 8.4 inch |
| Super PAP PEN | Invitrogen | 00-8899 | Pen to draw on slides |
| Microscope cover glass | Fisherbrand | 12-544-D | Size: 22 x 50 x 1.5 |
| DAPI | Sigma | D9542 | (Prepared in 20 mg/mL stock) |
| ProLong Gold antifade reagent | Molecular Probes | P36930 | Mounting agent for immunofluorescence |
| X-cite series 120Q | Lumen Dynamics | Light source | |
| Coolsnap Myo | Photometrics | Camera | |
| Optiphot-2 | Nikon | Microscope | |
| microtome | American Optical | ||
| Tissue embedder | Leica | EG1150 H | |
| Tissue processor | Leica | ASP300S | |
| Normal goat serum | Sigma | G9023 | |
| Mouse anti-TH | Millipore | MAB318 | Primary antibody |
| Rabbit anti-SF1 | Ab proteintech group (PTGlabs) | custom made | Primary antibody |
| Alexa-488 Mouse IgG raised goat | Jackson ImmunoResearch | 115-545-003 | Secondary antibody |
| Dylight-549 Rabbit IgG raised goat | Jackson ImmunoResearch | 111-505-003 | Secondary antibody |
| Citrate acid anhydrous | Fisher Chemical | A940-500 | |
| NIS-Elements Basic Research | Nikon | Software for imaging |
Riferimenti
- Brandtzaeg, P. The increasing power of immunohistochemistry and immunocytochemistry. Journal of Immunological Methods. 216 (1-2), 49-67 (1998).
- Matos, L. L., Trufelli, D. C., de Matos, M. G., da Silva Pinhal, M. A. Immunohistochemistry as an important tool in biomarkers detection and clinical practice. Biomark Insights. 5, 9-20 (2010).
- Coons, A. H., Creech, H. J., Jones, R. N. Immunological properties of an antibody containing a fluorescent group. Proceedings of the Society for Experimental Biology and Medicine. 47 (2), 200-202 (1941).
- Lerario, A. M., Finco, I., LaPensee, C., Hammer, G. D. Molecular Mechanisms of Stem/ Progenitor Cell Maintenance in the Adrenal Cortex. Frontiers in Endocrinology. 8, (2017).
- Yates, R., et al. Adrenocortical Development, Maintenance, and Disease. Endocrine Gland Development and Disease. 106, 239-312 (2013).
- Jones, I. C. Variation in the Mouse Adrenal Cortex with Special Reference to the Zona Reticularis and to Brown Degeneration, Together with a Discussion of the Cell Migration Theory. Quarterly Journal of Microscopical Science. 89 (1), 53(1948).
- Sucheston, M. E. C., Samuel, M. The Transient-Zone in the Human and Mouse Adrenal Gland. The Ohio Journal of Science. 72, n2 (March, 1972) 120-126 (1972).
- Guasti, L., Paul, A., Laufer, E., King, P. Localization of Sonic hedgehog secreting and receiving cells in the developing and adult rat adrenal cortex. Molecular and Cellular Endocrinology. 336 (1-2), 117-122 (2011).
- Pihlajoki, M., Dorner, J., Cochran, R. S., Heikinheimo, M., Wilson, D. B. Adrenocortical zonation, renewal, and remodeling. Frontiers in Endocrinology. 6, 27(2015).
- Farese, R. V., Walther, T. C. Lipid Droplets Finally Get a Little R-E-S-P-E-C-T. Cell. 139 (5), 855-860 (2009).
- Shen, W. J., Azhar, S., Kraemer, F. B. Lipid droplets and steroidogenic cells. Experimental Cell Research. 340 (2), 209-214 (2016).
- Finco, I., LaPensee, C. R., Krill, K. T., Hammer, G. D. Hedgehog signaling and steroidogenesis. Annual Review of Physiology. 77, 105-129 (2015).
- Paul, A., Laufer, E. Endogenous biotin as a marker of adrenocortical cells with steroidogenic potential. Molecular and Cellular Endocrinology. 336 (1-2), 133-140 (2011).
- Lowe, J., Anderson, P. Stevens & Lowe's Human Histology, 4th Edition. , Elsevier/Mosby. 263-285 (2015).
- Nagatsu, T. Genes for human catecholamine-synthesizing enzymes. Neuroscience Research. 12 (2), 315-345 (1991).
- Berthon, A., et al. Age-dependent effects of Armc5 haploinsufficiency on adrenocortical function. Human Molecular Geneticst. 26 (18), 3495-3507 (2017).
- Brown, C. Antigen retrieval methods for immunohistochemistry. Toxicologic Pathology. 26 (6), 830-831 (1998).
- Billinton, N., Knight, A. W. Seeing the wood through the trees: a review of techniques for distinguishing green fluorescent protein from endogenous autofluorescence. Analytical Biochemistry. 291 (2), 175-197 (2001).
- Hirsch, R. E., San George, R. C., Nagel, R. L. Intrinsic fluorometric determination of the stable state of aggregation in hemoglobins. Analytical Biochemistry. 149 (2), 415-420 (1985).
- Whittington, N. C., Wray, S. Suppression of Red Blood Cell Autofluorescence for Immunocytochemistry on Fixed Embryonic Mouse Tissue. Current Protocols in Neuroscience. 81, 28(2017).
- Watson, J. Suppressing autofluorescence of erythrocytes. Biotechnic & Histochemistry. 86 (3), 207(2011).
- Epp, J. R., et al. Optimization of CLARITY for Clearing Whole-Brain and Other Intact Organs. eNeuro. 2 (3), (2015).
- Erturk, A., et al. Three-dimensional imaging of solvent-cleared organs using 3DISCO. Nature Protocols. 7 (11), 1983-1995 (2012).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon