Method Article
Isolation, Fixation et l’Immunofluorescence imagerie des glandes surrénales de souris
Dans cet article
Résumé
Nous présentons ici une méthode pour isoler les glandes surrénales de souris, difficulté les tissus, leur section et effectuez l’immunofluorescence souillant.
Résumé
Immunofluorescence est une technique bien établie pour la détection des antigènes dans les tissus avec l’emploi d’anticorps conjugués fluorochrome et dispose d’un large éventail d’applications. Détection d’antigènes permet la caractérisation et l’identification de plusieurs types de cellules. Située au-dessus des reins et encapsulé par une couche de cellules mésenchymateuses, la glande surrénale est un organe endocrine composé de deux tissus différents avec différentes origines embryologiques, le cortex externe mésonéphriques dérivés mesoderm intermédiaire et les neurones medulla interne dérivée de crête. La corticosurrénale sécrète des stéroïdes (c.-à-d., les minéralocorticoïdes, glucocorticoïdes, hormones sexuelles), tandis que la médullosurrénale produit des catécholamines (c.-à-d., adrénaline, noradrénaline). En effectuant une recherche surrénalienne, il est important d’être capable de distinguer les cellules uniques avec des fonctions différentes. Ici, nous fournissons un protocole mis au point dans notre laboratoire qui décrit une série d’étapes séquentielles requises pour l’obtention d’immunofluorescence souillant pour caractériser les types de cellules de la glande surrénale. Nous nous concentrons d’abord sur la dissection des souris les glandes surrénales, l’élimination microscopique des graisses periadrenal suivie de la fixation, le traitement et la paraffine incorporant des tissus. Nous décrivons ensuite la découpe des blocs de tissus avec un microtome rotatif. Enfin, nous détaillons un protocole pour l’immunofluorescence des glandes surrénales que nous avons élaborée pour minimiser les anticorps non-spécifiques et autofluorescence afin d’obtenir un signal optimal.
Introduction
Immunohistochemistry est une technique de détection de composants tissulaires avec l’utilisation d’anticorps dirigés contre des molécules cellulaires spécifiques et des techniques de coloration ultérieures pour détecter les anticorps conjugués1. Cette procédure d’immunohistochemical nécessite une fixation spécifique et traitement des tissus qui sont souvent empiriquement déterminées pour l’antigène spécifique, les tissus et les anticorps utilisés2. La fixation est essentielle préserver l’état « original » du tissu et ainsi maintenir intact cellulaires et des structures subcellulaires et profils d’expression. Plus de traitement et d’incorporation des procédures sont tenus de préparer le tissu pour la coupe en tranches fines qui sont utilisés pour les études histologiques concernant l’immunohistochimie.
Immunomarquage peut être effectuée avec détection chromogénique ou fluorescente. Détection chromogénique nécessite l’utilisation d’une enzyme pour convertir un substrat soluble en un produit coloré insoluble. Alors que cette enzyme peut se conjuguer à l’anticorps reconnaissant l’antigène (anticorps primaire), il est plus souvent conjugué à l’anticorps reconnaissant l’anticorps primaire (c.-à-d., l’anticorps secondaire). Cette technique est très sensible ; le produit coloré résultant de la réaction enzymatique est photostable et nécessite seulement un microscope à fond clair pour l’imagerie. Cependant, immunomarquage chromogène peut ne pas convenir lorsque vous essayez de visualiser deux protéines qui co localiser, étant donné que la déposition d’une couleur peut masquer la déposition de l’autre. Dans le cas des taches, immunofluorescence s’est avéré pour être plus avantageux. L’avènement de l’immunofluorescence est attribuée à Albert Coons et ses collègues, qui a mis au point un système permettant d’identifier les antigènes de tissu avec des anticorps marqués à la fluorescéine et les visualiser dans les tissus sectionnés sous lumière ultraviolette3. Détection de fluorescence est issue d’un anticorps conjugué avec un fluorophore qui émet de la lumière après excitation. Parce qu’il y a plusieurs fluorophores avec des émissions aux longueurs d’onde différentes (avec peu ou pas de chevauchement), cette méthode de détection est idéale pour l’étude des protéines multiples.
La glande surrénale est un organe jumelé situé au-dessus du rein et se caractérise par deux éléments Embryologiquement distinctes, entourés par une capsule mésenchymateuse. Le cortex surrénalien externe, dérivé du mésoderme intermédiaire mésonéphriques, sécrète des hormones stéroïdes alors que la médullaire interne, dérivée de la crête neurale, produit des catécholamines dont l’adrénaline, la noradrénaline et la dopamine. Le cortex surrénalien est histologiquement et fonctionnellement divisé en trois zones concentriques, chaque zone sécrétant des différentes classes d’hormones stéroïdes : la zone extérieure glomérulée (zG) produit des minéralocorticoïdes qui régulent l’homéostasie de l’électrolyte et volume intravasculaire ; le milieu zona fasciculata (zF), directement sous le zG, sécrète des glucocorticoïdes médiateurs de la réponse au stress par la mobilisation des réserves énergétiques pour augmenter le taux de glucose plasmatique ; et les reticularis de zona interne (zR), qui synthétise le sexe précurseurs stéroïdes (c.-à-d., la déhydroépiandrostérone (SDHEA))4.
Certaines variations dans la corticosurrénale zonation sont présente entre les espèces : par exemple, Mus musculus manque le zR. L’unique zone X postnatale de M. musculus est un vestige du cortex foetal caractérisé par des petites cellules pauvres en lipides avec cytoplasmes acidophiles5. La zone X disparaît à la puberté chez les souris mâles et après la première grossesse chez les souris femelles, ou dégénère progressivement dans les femelles de race n’est pas6,7. En outre, la tortuosité et l’épaisseur des pièces zG marqué la variation entre les espèces comme le fait l’Organisation des cellules souches et progénitrices périphériques dans et à côté de la zG. Le rat, à la différence des autres rongeurs, dispose d’une zone visible indifférenciée (zU) entre le zG et zF qui fonctionne comme une zone de cellules souches et/ou une zone transitoire amplifier les progéniteurs. Si la zone d’incertitude est unique à des rats ou simplement plus organisés en évidence amas de cellules sont inconnue8,9.
Les cellules du cortex surrénal contiennent des gouttelettes de lipides qui stockent des esters de cholestérol qui servent comme le précurseur de toutes les hormones stéroïdes10,11. Le terme « stéroïdogenèse » définit le processus de production des hormones stéroïdes de cholestérol via une série de réactions enzymatiques qui impliquent l’activité du facteur stéroïdogénique 1 (SF1), dont l’expression est un marqueur potentiel stéroïdogènes. Dans la glande surrénale, expression Sf1 est présente uniquement dans les cellules du cortex12. Une étude intéressante a trouvé l’expression de la biotine endogène dans les cellules corticosurrénales avec potentiel stéroïdogène13. Tandis que cela peut être la cause d’une formation supérieure en méthodes de coloration basé/streptavidine-biotine, en raison de la détection de biotine endogène par l’anticorps conjugué avec la Streptavidine, cette caractéristique pourrait être aussi employée pour distinguer le stéroïdogènes cellules des autres populations au sein de la glande surrénale, c.-à-d., endothélial, capsulaire et cellules de la moelle.
Innervé par les neurones préganglionnaires sympathiques, la médullosurrénale est caractérisée par des cellules basophiles avec un cytoplasme granulaire contenant de l’épinéphrine et la norépinéphrine. Cellules de la moelle sont nommés « chromaffines » en raison de la forte teneur des catécholamines qui forment un pigment brun après oxydation14. Tyrosine hydroxylase (TH) est l’enzyme qui catalyse l’étape cinétiquement limitante dans la synthèse des catécholamines et, dans la glande surrénale, s’exprime uniquement dans la médulla15.
Nous présentons ici un protocole pour l’isolement des glandes surrénales de souris, leur traitement pour l’enrobage de paraffine et de sectionnement et une méthode pour exécuter immunofluorescence souillant sur sections surrénales afin d’identifier les types cellulaires qui constituent la cortex surrénal et la moelle. Ce protocole est une norme dans notre laboratoire pour l’immunohistochimie avec des anticorps multiples utilisés couramment dans nos recherches.
Protocole
Toutes les méthodes ont été réalisés conformément aux protocoles approuvés sur le plan institutionnel sous les auspices du Comité universitaire sur l’utilisation et l’entretien des animaux à l’Université du Michigan.
1. préparation pour la chirurgie
- Le jour avant la chirurgie, préparer 4 % paraformaldéhyde (PFA) / tampon phosphate salin (PBS). Dans le cas des aliquotes congelés, procéder à un dégel et conserver à 4 ° C.
NOTE : 4 % PFA n’est pas stable pendant plus de 48 h.
ATTENTION : PFA est toxique, éviter tout contact avec la peau et les yeux et disposer dans un contenant approprié. - Le jour de la chirurgie, préparer les instruments chirurgicaux en stérilisant les ciseaux et pinces avec 70 % d’éthanol (EtOH) et laissez-les sécher sur du papier absorbant.
- Place une plaque 24 puits remplie avec du PBS 1 x (1 mL/puits suffit) dans un seau à glace.
NOTE : Glandes surrénales est mémorisés dans cette boîte de Petri multipuits après la chirurgie.
2. surrénalienne Dissection
- Euthanasier la souris à la suite de protocoles standards approuvés par le Comité de l’emploi (IACUC) et d’institutionnels animalier. Il faut une méthode secondaire d’euthanasie pour s’assurer de la mort (décapitation, par exemple).
- L’euthanasie par surdose d’isoflurane, placez la souris dans une chambre remplie de vapeurs d’isoflurane, jusqu'à ce que la respiration cesse, puis retirez la souris de la chambre, posez-le sur une surface et effectuez la dislocation cervicale.
NOTE : La plupart des méthodes de l’euthanasie, causent une détresse à l’animal et ne conviennent pas pour les études de stress parce qu’ils peuvent ajouter la variable confusionnelle de l’activation de l’axe hypophyso-surrénalien et la libération de catécholamines médullaires. Dans ce cas, la décapitation est la technique proposée d’adopter.
- L’euthanasie par surdose d’isoflurane, placez la souris dans une chambre remplie de vapeurs d’isoflurane, jusqu'à ce que la respiration cesse, puis retirez la souris de la chambre, posez-le sur une surface et effectuez la dislocation cervicale.
- Poser la souris en position couchée, stériliser la zone d’incision sur l’abdomen et les flancs avec 70 % EtOH.
Remarque : Bien que raser la fourrure augmentera la stérilité, pour cette application particulière il n’est pas nécessaire. - Couper la peau au milieu de l’abdomen à l’aide de ciseaux, séparer la peau du péritoine, deskin la souris en pinçant la peau autour de la coupe et en tirant dessus dans deux directions opposées (caudale et rostrale). Ensuite, couper le péritoine jusqu'à atteindre les flancs gauche et droit postérieurs.
- Enlevez la bouture murine glande surrénale autour du tissu adipeux environnant et placez-le dans la plaque 24-multiwell rempli de solution 1 PBS x et gardé sur glace.
3. Peri-surrénales dégraissage
- Sous un microscope à dissection, placez les surrénales sur le verre de base ou un Pétri sur la platine, la position de la source lumineuse, sélectionnez le grossissement et ajuster la mise au point afin d’obtenir une vision claire de la surrénale ensemble.
Remarque : Le grossissement utilisé peut varier selon vos préférences personnelles. Un grossissement total de 30 X avec un objectif de plan 1 X, zoom 3 X et oculaire 10 X permet de visualiser la glande entière avec un bon champ de vision. - Supprimer rapidement les tissus adipeux adjacentes avec deux aiguilles 25 G, évitant la déshydratation de la surrénale. Si cela se produit avant que toute la graisse est enlevée, déplacer la surrénale retour dans la cupule contenant 1 x PBS pendant 1 à 2 min et puis continuer avec le processus de suppression de graisse.
- Laver 2 x de 2 min chacun dans du PBS 1 x.
4. tissu traitement et intégration
- Difficulté les tissus chez 4 % PFA/PBS à 4 ° C sur une plate-forme bascule pendant 2 h.
- Enlevez les 4 % PFA et laver les tissus avec du PBS 1 x, 3 x pour 15 min chacun, à 4 ° C.
ATTENTION : PFA est toxique et est un déchet dangereux ; il doit être manipulé avec précaution sous une hotte chimique et éliminé dans un conteneur de déchets dangereux. - Incuber les glandes surrénales dans 50 % EtOH à 4 ° C sur une plate-forme bascule pendant 2 h.
- Incuber les glandes surrénales dans 70 % EtOH à 4 ° C sur une plate-forme bascule pour un minimum de 2 h.
Remarque : Si ne traite de transformation pour l’enrobage des tissus, glandes surrénales peuvent être stockés dans 70 % EtOH à 4 ° C. Éviter l’entreposage à long terme à 70 % EtOH et procéder au traitement des tissus dès que possible donne des échantillons de qualité meilleures. - Préparer les surrénales pour tissus traitement en enroulant dans de la gaze et enfermant dans un tissu intégrant la cassette. Placez la cassette dans un bocal rempli de 70 % EtOH et conserver à 4 ° C jusqu’au moment de passer au transformateur de tissus. Insérez la cassette dans le processeur de tissu programmé comme indiqué dans le tableau 1 et exécutez le programme.
- Transférer la cassette dans une encastrement station remplie de paraffine fondue à 65 ° C. Si une station de refroidissement n’est pas disponible, placez un bac de refroidissement froid à côté de lui.
- Étiqueter un moule encastrement et ouvrir le tissu intégrant la cassette. À l’aide d’une paire de pinces, déroulez la gaze et placer la surrénale doucement dans la position désirée au centre de la base dans le moule d’encastrement. Verser de la paraffine fondue sur les surrénales. Si nécessaire, tenir les surrénales avec une pince pour garantir sa position dans le moule sinon il peut se déplacer à l’intérieur du moule.
- Doucement, déplacer le moule encastrement dans le plateau de refroidissement et attendre le durcissement de la paraffine. Après cela, pour faciliter la découpe, stocker les moules encastrement dans un endroit frais.
5. la section avec un Microtome rotatif
- Vérifiez que le microtome est propre avant de commencer, balayer tous les restes de paraffine mis au rebut, veiller à ce que le couteau (ou lame) est affûté, huiler le mécanisme interne et rentrer complètement le support du bloc si nécessaire.
- Étiqueter une série de lames de microscope (positivement chargées ou enduit pour éviter la perte de tissu (voir Table des matières)), disposez-les sur un ensemble de diapositives plus chaud à 37 ° C et passer outre certains eau ultrapure stérilisés à l’autoclave de type 1 sur le dessus de chaque diapositive.
- Épaisseur de coupe réglée à 5 µm.
- Insérer la lame microtome dans le porte-lame, régler l’inclinaison de la lame, assurez-vous que la lame est bien fixée dans le support et vérifier le jeu du bloc de paraffine et titulaire de bloc.
- Amener le titulaire de la bloquer en position haute et, si possible, verrouiller la poignée de commande, retirez le bloc de paraffine du moule et placez-le dans le porte-bloc fixant solidement à l’aide de la pince. L’angle de l’axe central de la lame avec la face plate du bloc devrait être d’environ 20°. Si nécessaire, réajuster le bloc de paraffine.
ATTENTION : La lame est tranchante. - S’il est déjà verrouillé, débloquer la roue à main et abaissez le bloc de paraffine jusqu'à ce que son visage est à niveau avec le bord de la lame du microtome. Faites tourner la roue à main avec un rythme soutenu. Effectuer la coupe initiale pour enlever la paraffine et d’exposer les surrénales.
- Garder en tournant le volant à main et l’article jusqu'à la fin de la surrénale. Un microscope à fond clair ou dissection permet de vérifier la présence de tissus dans les sections. Retirer le ruban de la lame et avec l’aide d’une autre paire de pinces, placez-le sur l’eau sur la lame de verre. Il peut être utile de placer le ruban sur une surface, soigneusement l’étirer, puis montez-la sur la diapositive.
- Sécher les diapositives sur la plaque chauffante. Posez-les à plat sur un plateau de la diapositive, puis cuire à 37 ° C pendant une nuit ou plus si l’eau est toujours présente. Une fois sec, stocker les lames dans une boîte de diapositive à la température ambiante.
- Ranger tout le matériel utilisé et nettoyer le microtome.
6. immunofluorescence
- Sélectionnez les diapositives pour immunostaining et placez-les dans un support Dia.
- Sur une plaque chauffante, apporter un bécher rempli avec du citrate de 0,01 M à pH 2,0 à ébullition. Le volume de la mémoire tampon dépend de la taille gobelet et doit être suffisant pour couvrir les sections sur les lames pendant l’ébullition (certains évaporation doit être pris en compte). Couvrir le bécher d’une feuille d’aluminium.
Remarque : Autres méthodes de recherche d’antigène sont disponibles (voir Discussion). - Déparaffiner les diapositives de xylène à 100 % 2 x de 5 min chacun. Réhydrater les diapositives à l’aide de la série suivante : 100 % EtOH 2 x pendant 5 min, 70 % EtOH 2 type-x pendant 5 min, 1 eau ultrapure pendant 5 min.
Remarque : Après déparaffinage, il est important de ne pas laisser les sections dessécher : coupes tissulaires doivent toujours être couverts avec des tampons ou des solutions jusqu'à la fin de la procédure ou de la structure du tissu peut être endommagée. - Pour la recherche d’antigène, placer les lames dans un support métallique dia et insérez-le dans le bécher avec ébullition citrate sans le papier d’aluminium. Laisser bouillir pendant 10 min.
- Retirer le becher de la plaque chauffante et laisser refroidir pour 20 min., s’assurer que les sections surrénales sont encore recouvertes de la mémoire tampon.
- Préparez la solution de blocage. Si en utilisant la coloration commercialement disponible kit employées pour les Résultats représentant (voir la Table des matières), dans un tube ajouter 1,25 mL de PBS 1 x, 1 goutte (égale à environ 45 µL) de souris Ig blocage réactif et 5 % de sérum de chèvre normal. Stocker la solution de blocage à 4 ° C ou sur la glace alors qu’il travaillait.
Remarque : Le sérum utilisé dépend des espèces hôtes de l’anticorps secondaire. Ici, des anticorps secondaires chez les caprins ont été utilisés. Pour les autres anticorps sériques différents peuvent être nécessaires. Déterminer empiriquement la concentration sérique correcte en testant plusieurs concentrations. - Transférer les lames dans une coloration contenant PBS 1 x et lavage 3 x 10 min chacun sur un balancier avec doux balancement.
- Préparer une chambre humidifiée pour la coloration.
- Secouer doucement, les PBS d’une diapositive ; Essuyez le fond de la diapositive avec un chiffon non pelucheux pour enlever l’excès PBS.
- À l’aide d’un marqueur spécial pour diapositives avec des propriétés hydrophobes, tracez un cercle qui entoure chaque section surrénalienne, en vous assurant que la surface du verre est sec pour éviter la propagation de la solution de l’encre à la section. Si nécessaire, essuyer soigneusement sécher la surface. Placez la lame dans la chambre humidifiée.
- Rapidement, Pipetter 50 µL (ou assez pour couvrir les sections) de blocage solution sur chaque section. Incuber pendant 1 heure à température ambiante.
Remarque : Bloquer le volume de solution nécessaire peut varier ; Il est important que les sections sont bien couverts avec la solution. - Préparez la solution de diluant du kit disponible dans le commerce avec 7,5 mL de PBS 1 x, 600 µL de protéines concentré stock solution et 5 % de sérum de chèvre normal (ou n’importe quel autre sérum et concentration utilisée dans la solution de blocage). Conserver la solution diluant à 4 ° C ou sur la glace alors qu’il travaillait.
- Préparer les solutions d’anticorps primaire diluer les anticorps primaires aux concentrations appropriées dans la solution de diluant. Pour les colorer, ajouter une partie aliquote de chaque anticorps dans un nouveau tube et mélanger doucement. Placez les anticorps et les solutions d’anticorps sur la glace jusqu'à utilisation.
NOTE : Ici nous avons utilisé anticorps de lapin anti-SF1 et un anticorps anti-TH chez la souris. Pour préparer l’anticorps solutions travail suivent comme indiqué.- Pour la solution de travail SF1, dans un tube, ajouter 1 µL d’anticorps anti-SF1 à 999 µL de solution de diluant (concentration finale de 1,5 µg/mL). Pour la solution de travail TH, dans un tube, ajouter 1 anticorps d’anti-TH µL dans 499 µL de solution de diluant (concentration finale estimée de 2 à 6 µg/mL).
- Pour les SF1 + TH mélange de travail des anticorps, dans un nouveau tube, pipette 250 µL de solution de travail SF1 et 250 µL de solution de travail de TH. Mélanger doucement de pipetage. Magasin sur la glace.
- Transférer les lames dans une coloration contenant 1 x PBS et laver 3 x de 5 min chacun sur un balancier avec doux balancement.
- Replacez les diapositives dans la chambre humidifiée, après avoir essuyé l’excédent de PBS, pipette la SF1 + TH anticorps travail mix (ou autre solution d’anticorps primaire) sur chaque section, fermer la chambre humidifiée et laisser la nuit à 4 ° C.
- Le lendemain, déplacer les diapositives dans un Coplin jar contenant 1 x PBS et laver 3 x pendant 15 minutes sur un balancier avec doux balancement.
- Tout en lavant les diapositives, préparer la solution d’anticorps secondaire dans la solution de diluant à l’aide de la concentration appropriée. Si vous effectuez co coloration, ajouter une quantité égale de chaque solution d’anticorps secondaire dans un nouveau tube. Mélanger doucement de pipetage. Magasin sur la glace. Protéger les tubes de lumière et de stocker sur la glace jusqu'à utilisation.
NOTE : Ici, les anticorps secondaires utilisés sont 488 nm fluorescent dye-labeled anti-souris soulevées en chèvre et 549 fluorescent dye-labeled anti-lapin déclenché chez les caprins. La solution d’anticorps secondaire a été préparée en ajoutant 0,5 µL de chaque anticorps secondaire en 799 µL de solution de diluant (la concentration finale de 1,2 µg/mL). - Replacez les diapositives dans la chambre humidifiée après avoir enlevé l’excès de PBS, rapidement déposer la solution d’anticorps secondaire sur les sections surrénales, fermer la chambre humidifiée et protéger de la lumière. Incuber pendant 1 heure à température ambiante.
- Laver les lames dans une coloration avec 1 x PBS et laver 3 x pendant 15 minutes sur un balancier avec balancement doux, en veillant à protéger de la lumière.
- Préparer les 4', 6-diamidino-2-phénylindole (DAPI) solution pour la coloration des noyaux : 1 µL de DAPI (20 mg/mL) dans 1 mL de PBS 1 x.
NOTE : Contre-colorant nucléaire bleu fluorescente aussi est possible à l’aide de colorant de Hoechst. - Pipetter solution DAPI sur les sections surrénaliennes, couvrir de la lumière et incuber à température ambiante pendant 7 min.
- Laver les lames dans une coloration avec 1 x PBS et laver 3 fois pendant 5 min sur un balancier avec bascule doucement tout en protégeant les diapositives de la lumière.
- Dans une zone protégée de la lumière directe, fixer un couvercle en verre, et Pipeter 60 µL ou environ 3 gouttes d’agent de montage adapté pour l’immunofluorescence le long de la surface de la lamelle couvre-objet.
- Essuyez doucement le dos d’une lame avec un chiffon non pelucheux, position de la diapositive face vers le bas, vers le couvercle en verre et en parallèle, pour les coupes de tissus font face le couvercle en verre avec l’agent de montage là-dessus. Légèrement, appuyez sur la diapositive sur la lamelle couvre-objet et veillez à ce qu’aucune bulle d’air n’est coincée entre la lame et le couvercle en verre.
- Si nécessaire, appliquer une pression supplémentaire pour enlever les bulles d’air et l’excès d’agent de montage.
- Fixer la lame dans un récipient noir et cure à température ambiante pendant au moins 24 h (ou à l’heure indiquée dans la fiche d’information de l’agent de montage utilisé) et passez à l’imagerie.
7. imagerie
Remarque : Il faut un microscope à fluorescence relié à une caméra de détection et de capture de la fluorescence émise par les tissus après excitation aux longueurs d’onde déterminées. Alors que c’est évident, il est important à retenir pour choisir l’image secondaire anticorps conjugué avec fluorochromes dont excitation et spectres d’émission sont compatibles avec l’équipement disponible. L’imagerie paramètres varient selon le microscope et le logiciel utilisé pour capturer des images. Il y a quelques règles de base qui s’appliquent pour l’imagerie surrénaliennes sections, par exemple en vérifiant que la durée d’exposition, caméra réglages de gain et intensité de la source lumineuse est maintenue constante.
- Allumez la source de lumière et la caméra, lancez le logiciel d’imagerie en suivant les instructions du fabricant.
Remarque : L’ordre des ces actions peut différer selon l’équipement utilisé. - Sécuriser la diapositive sur la scène, ouvrir l’obturateur et à la recherche dans les oculaires de microscope utiliser nucléaire coloration (DAPI) channel et faible grossissement (X 4) pour identifier le tissu sur la diapositive : sections surrénales sont petites et leur visualisation peut exiger quelque temps.
- Changez pour un grossissement plus élevé (10 X), mise au point et fermer l’obturateur.
Remarque : Il est important d’éviter inutilement longue exposition à la lumière qui peut causer le photoblanchiment, résultant en une perte de signal. - En utilisant les commandes du logiciel, sélectionnez l’objectif (10 X) et le canal en cours d’utilisation (DAPI), ajuster la durée d’exposition (1 s, peut être réglée si le signal est trop faible ou trop forte). Le cas échéant, la valeur binning pour l’imagerie live (pas d’acquisition) « 2 X 2', conversion gain au « milieu », vitesse de lecture à 20 MHz ». Si le logiciel utilisé n’affiche pas la barre d’échelle à la fin de l’image, sélectionnez l’option barre d’échelle dans le menu et placer la barre si vous le désirez.
- Ouvrir l’obturateur, ré-ajuster le focus si nécessaire et changer de chaîne (FITC, TRITC, DAPI). Si le microscope n’est pas automatisé, prendre une photo de la surrénale dans chaque canal sans bouger la scène et n’oubliez pas d’ajuster la sélection du canal en cours d’utilisation. Fermer la vanne une fois terminé.
Remarque : Notez les paramètres utilisés dans le cas où le logiciel n’enregistre pas automatiquement les. - Enregistrer les images.
NOTE : Images fusionnées peuvent être souvent créées à l’aide du logiciel du microscope ou autres logiciels de l’éditeur graphique. - Répétez l’imagerie pour d’autres domaines de la section et/ou avec un grossissement plus élevé.
Remarque : Un grossissement de 20 X souvent nécessite un temps d’exposition plus court (par exemple, 800 ms). - À la fin de l’imagerie, fermer tous les équipements dans l’ordre approprié.
Résultats
La figure 1 représente une représentation schématique de l’ensemble du protocole décrit ci-dessus. Les glandes surrénales sont récoltées de souris, adjacent de tissus adipeux est enlevé sous un microscope à dissection et les surrénales sont ensuite fixés à 4 % PFA. Après cette étape, les glandes surrénales sont traitées et incorporés à la paraffine et sectionnés avec un microtome permettant de couper l’orgue en fines tranches qui sont déposés sur lames de microscope. Après séchage des sections, immunofluorescence est effectué et les sections sont imagées au microscope.
L’élimination de la graisse adjacente (Figure 2A) est importante pour faciliter davantage de traitement et sectionnant des glandes surrénales. Suppression réussie du tissu adipeux environnant est illustrée à la Figure 2B, où la surrénale est facilement détectable et aucune graisse supplémentaire n’est visible. Au cours de cette étape, il est essentiel, cependant, afin de ne pas laisser la glande surrénale sécher ou cela pourrait endommager la structure du tissu. La sécheresse est reconnaissable quand la surrénale assume une apparence ridée (Figure 2C). Ce problème peut être facilement surmonté en réhydratant les surrénales en solution 1 PBS x avant de continuer avec l’enlèvement du gras.
Les résultats finaux obtient suivant ce protocole sont présentés à la Figure 3. Les images de l’immunofluorescence illustrent l’immunomarquage d’une glande surrénale à deux grossissements différents. Coloration rouge des noyaux SF1 étiquettes les cellules corticosurrénales, tandis que la coloration verte cytoplasmique étiquettes des cellules de la moelle. La capsule externe est marquée par la coloration des noyaux en bleu (DAPI) puisqu’il n’est pas stéroïdogène (SF1-négatif).

Figure 1 : Représentation schématique du protocole. Après la récolte les glandes surrénales et enlever le tissu adipeux adjacent, les tissus sont fixés à 4 % PFA, transformés pour l’enrobage de paraffine et sectionnés. Les sections sont ensuite immunostained et photographié avec un microscope à fluorescence. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 2 : Élimination de la graisse peri-surrénal. (A), la graisse qui entoure que la glande surrénale est retirée sous un microscope à dissection. (B) surrénale après le nettoyage. (C) exemple de tarissement des tissus et qui exige hydratation. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
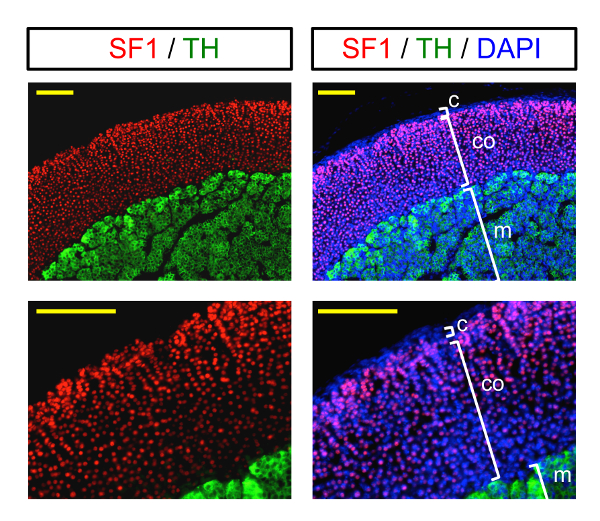
Figure 3 : Imagerie d’immunofluorescence de la glande surrénale. Exemple d’imagerie d’immunofluorescence (à différents grossissements) d’une glande surrénale colorées avec des marqueurs de la corticosurrénale (SF1, coloration nucléaire) et de la médullosurrénale (TH, vert cytoplasmique). Noyaux (DAPI) sont marqués en bleu. C : capsule ; CO : cortex ; m: médullaire. Barreaux de l’échelle = 200 µm. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
| Réactif | Station | Température | Durée |
| 70 % EtOH | 1 | RT | 1 h |
| 90 % EtOH | 2 | RT | 1 h |
| 90 % EtOH | 3 | RT | 1 h |
| EtOH absolue | 4 | RT | 1 h |
| EtOH absolue | 5 | RT | 1 h |
| EtOH absolue | 6 | RT | 1 h |
| EtOH absolue | 7 | RT | 1 h |
| Xylène | 8 | RT | 1 h |
| Xylène | 9 | RT | 1 h |
| Xylène | 10 | RT | 1 h |
| Cire de paraffine | 11 | 62 ° C | 1 h |
| Cire de paraffine | 12 | 62 ° C | 1 h |
| Cire de paraffine | 13 | 62 ° C | 1 h |
Tableau 1 : Programme de processeur tissus.
Discussion
Ce protocole décrit une méthode pour l’isolement des glandes surrénales de souris ainsi que de la préparation et la coloration des glandes surrénales de souris de paraffine sectionnés.
Comparé à d’autres protocoles que nous avons testé, ce protocole immunofluorescence s’est avéré convenant à la plupart des anticorps utilisés dans notre laboratoire. Toutefois, dans certains cas, il peut exiger des ajustements pour améliorer les résultats de coloration. Une variable qui peut facilement être modifiée et testée est la longueur de la fixation. Dans notre laboratoire, l’incubation chez 4 % PFA peut varier de 1 h à 4 h, alors que dans d’autres laboratoires la fixation est prolongée de 12 à 24 h16. Dans nos mains, cependant, un plus long temps de fixation conduit à une augmentation des bruits et n’était pas optimal pour plusieurs anticorps utilisés couramment dans nos recherches.
Le pH de recherche d’antigène peut aussi jouer un rôle dans le succès de la coloration. Démasquage par chaleur (HIER) peut être effectuée en employant des solutions disponibles dans le commerce avec un pH allant d’acide à alcaline, ainsi que d’autres tampons faits internes tels que le citrate (pH 6), de l’acide éthylènediaminetétraacétique (EDTA, pH 8), Tris-EDTA (pH 9), Tris (pH 10). Le traitement enzymatique peut également être une option pour démasquer l’antigène. Incuber les lames déparaffinées pour un temps limité avec une solution contenant une concentration appropriée d’une enzyme (par exemple la protéinase K) peut être une méthode alternative d’HIER. Toutefois, il est essentiel pour titrer la concentration de l’enzyme et de déterminer le temps d’incubation idéale, puisque la digestion excessive peut nuire le tissu17.
Le choix de tampon de blocage est également une autre variable pour le dépannage. Outre l’utilisation de sérum de chèvre normal et le tampon de blocage disponible dans le commerce mentionnés dans le présent protocole (pratique dans le cas présent lors de l’utilisation des anticorps de souris primaire sur les tissus de souris afin d’éviter de fond élevé en raison de l’endogène souris IgG), il n’y a options supplémentaires disponibles comme solutions de protéines (albumine sérique bovine (BSA) ou lait) ou les autres tampons disponibles dans le commerce. Il est essentiel de s’assurer que le tampon ne contienne pas de substances qui peuvent interférer avec la coloration, comme la biotine quand utilisant une streptavidine-biotine selon la méthode.
La glande surrénale est un organe endocrine caractérisé par une teneur élevée en lipides qui peut souvent faire immunostaining difficile en raison de la forte autofluorescence des lipides. En outre, cortex surrénal des souris et des rats sont riches en auto-fluorescente intracytoplasmiques lipofuscine, un matériau granulaire et amorphe pigmentée qui varie en couleur du jaune au brun. Pour surmonter ce problème, les composés tels que le Soudan noir B (SBB) peuvent étancher la fluorescence produite par lipofuscins,18. Un autre facteur qui compromet l’issue d’une bonne coloration est la présence de cellules sanguines. L’hémoglobine dans les érythrocytes absorbe la lumière des longueurs d’onde < 600 nm et peut interférer avec les fluorochromes qui s’étendent sur cette longueur d’onde19,20. Si les techniques de perfusion peuvent être utilisés pour effacer les globules de navires de tissu, l’utilisation de sulfate de cuivre de 10 mM à pH 5 avant d’effectuer une contre-coloration nucléaire peut également aider à réprimer la fluorescence non désirées21.
Une étape cruciale dans le présent protocole est la dissection surrénalienne. La glande surrénale est un organe dont l’emplacement peut être difficile de trouver sur place: chez les souris, les glandes sont de petite taille et leur position est un peu variable. Surtout chez les animaux plus âgés, glandes surrénales sont entourés de tissu adipeux qui peuvent interférer avec la détection des glandes et leur isolement qui en découle, c’est pourquoi qu'il est crucial d’avoir une vue claire de la région au cours de cette étape du protocole. Suppression de dégraissage peri-surrénalien est une étape délicate. Devrait être une attention particulière pour les glandes surrénales tout en détachant la graisse pour éviter la rupture de la capsule. La glande doit également être conservée humide avec du PBS au cours de la procédure afin d’éviter des lésions tissulaires.
Lorsque le sectionnement, détecter la présence de la petite quantité de tissu surrénalien dans les sections peut être difficile en raison de l’hypopigmentation tissus après l’étape de traitement. Un microscope est très utile lors de la découpe pour discerner le tissu de la cire.
Immunohistochimie sur des sections de paraffine est une technique précieuse pour immunomarquage des protéines d’intérêt tout en préservant la morphologie des tissus. La méthode présentée ici est basée sur la détection par fluorescence et, bien qu’il soit particulièrement fonctionnel pour études employant des anticorps primaires multiples, le signal de fluorescence est sensible à la lumière et peut être facilement perdu ou affaiblie si les lames ne sont pas gérés correctement (c'est-à-dire prolongé exposition au microscope léger ou inutiles à la lumière ambiante). En outre, on remarque une baisse de la qualité du signal de fluorescence lui-même au fil du temps. Ce problème peut être évité en utilisant la détection chromogénique, qui est photostable et peut être visualisée depuis de nombreuses années. Cette méthode, il manque toutefois, les avantages de la détection de la fluorescence, comme plus haut précision d’étiquetage et marquage simultanée de plusieurs protéines dans une étude.
L’incorporation de paraffine est une méthode pratique pour traiter et stocker plusieurs échantillons de tissus. Cependant, les tissus traitement paraffine s’encastrer ne convient pas pour l’imagerie de reporters fluorescents exprimés dans des animaux transgéniques sans l’utilisation d’un anticorps spécifique ciblant le reporter. Cryoconservation est une méthode pour éviter la dégradation de la protéine fluorescente et de permettre sa visualisation directe sous un microscope. En évitant l’utilisation d’un anticorps supplémentaire peut représenter un avantage. En revanche, cryoconservation peut aussi être limitée car il affecte la morphologie tissulaire ; Il faut aussi différents équipements pour la coupe et le stockage des diapos et des blocs de tissus est possible dans les congélateurs seulement.
Une limitation majeure de l’imagerie d’un tissu sectionné est la possibilité d’obtenir des images des composantes structurales à haute résolution spatiale. Composition du tissu, en fait, est une variable importante dans la détermination de la qualité de l’imagerie puisqu’elle influe sur la pénétration de la lumière et peut conduire à faible résolution. La glande surrénale est un tissu riche en lipides qui causent22de diffusion de la lumière. Dans le cerveau, qui a également une teneur élevée en lipides, techniques de nettoyage des tissus tels que clarté, BABB, iDISCO et 3DISCO ont été développées pour améliorer la visualisation des tissus, permettant de mieux d’imagerie et 3D tissus reconstruction23. Ces techniques sont fournissant aux chercheurs données d’imagerie de haute qualité et sont adaptés à une diverse gamme de tissus, et, à l’avenir, nous espérons d’employer ces méthodes d’imagerie surrénalienne ainsi.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Nous remercions le Dr Mohamad Zubair pour ses suggestions utiles et assistance technique dans la mise en place du présent protocole. Ce travail a été soutenu par le National Institute of Diabetes et Digestive and Kidney Diseases, instituts nationaux de santé recherche Grant 2R01-DK062027 (à Gadio).
matériels
| Name | Company | Catalog Number | Comments |
| 24-well cell culture plate | Nest Biotechnology Co. | 0412B | |
| Disposable needles 25 G x 5/8" | Exel International | 26403 | |
| Paraformaldehyde (PFA) | Sigma-Aldrich | P6148 | |
| Paraplast plus | McCormik scientific | 39502004 | Paraffin for tissue embedding |
| Shandon biopsy cassettes II with attached lid | Thermo scientific | 1001097 | Cassettes for tissue processing |
| High Profile Microtome Blades | Accu-Edge | 4685 | Disposable stainless steel blades |
| Peel-a-way disposable plastic tissue embedding molds | Polysciences Inc. | 18986 | Truncated, 22 mm square top tapered to 12 mm bottom |
| Superfrost Plus Microscope Slides | Fisherbrand | 12-550-15 | 75 mm x 25 mm x 1 mm |
| Xylene | Fisher Chemical | X5P1GAL | |
| 200 Proof Ethanol | Decon Labs, Inc. | ||
| Certi-Pad Gauze pads | Certified Safety Mfg, Inc | 231-210 | 3" x 3. Sterile latex free gauze pads |
| M.O.M kit | Vector laboratories | BMK-2202 | For detecting mouse primary antibodies on mouse tissue |
| KimWipes | Kimtech | 34155 | Wipes 4.4 inch x 8.4 inch |
| Super PAP PEN | Invitrogen | 00-8899 | Pen to draw on slides |
| Microscope cover glass | Fisherbrand | 12-544-D | Size: 22 x 50 x 1.5 |
| DAPI | Sigma | D9542 | (Prepared in 20 mg/mL stock) |
| ProLong Gold antifade reagent | Molecular Probes | P36930 | Mounting agent for immunofluorescence |
| X-cite series 120Q | Lumen Dynamics | Light source | |
| Coolsnap Myo | Photometrics | Camera | |
| Optiphot-2 | Nikon | Microscope | |
| microtome | American Optical | ||
| Tissue embedder | Leica | EG1150 H | |
| Tissue processor | Leica | ASP300S | |
| Normal goat serum | Sigma | G9023 | |
| Mouse anti-TH | Millipore | MAB318 | Primary antibody |
| Rabbit anti-SF1 | Ab proteintech group (PTGlabs) | custom made | Primary antibody |
| Alexa-488 Mouse IgG raised goat | Jackson ImmunoResearch | 115-545-003 | Secondary antibody |
| Dylight-549 Rabbit IgG raised goat | Jackson ImmunoResearch | 111-505-003 | Secondary antibody |
| Citrate acid anhydrous | Fisher Chemical | A940-500 | |
| NIS-Elements Basic Research | Nikon | Software for imaging |
Références
- Brandtzaeg, P. The increasing power of immunohistochemistry and immunocytochemistry. Journal of Immunological Methods. 216 (1-2), 49-67 (1998).
- Matos, L. L., Trufelli, D. C., de Matos, M. G., da Silva Pinhal, M. A. Immunohistochemistry as an important tool in biomarkers detection and clinical practice. Biomark Insights. 5, 9-20 (2010).
- Coons, A. H., Creech, H. J., Jones, R. N. Immunological properties of an antibody containing a fluorescent group. Proceedings of the Society for Experimental Biology and Medicine. 47 (2), 200-202 (1941).
- Lerario, A. M., Finco, I., LaPensee, C., Hammer, G. D. Molecular Mechanisms of Stem/ Progenitor Cell Maintenance in the Adrenal Cortex. Frontiers in Endocrinology. 8, (2017).
- Yates, R., et al. Adrenocortical Development, Maintenance, and Disease. Endocrine Gland Development and Disease. 106, 239-312 (2013).
- Jones, I. C. Variation in the Mouse Adrenal Cortex with Special Reference to the Zona Reticularis and to Brown Degeneration, Together with a Discussion of the Cell Migration Theory. Quarterly Journal of Microscopical Science. 89 (1), 53 (1948).
- Sucheston, M. E. C., Samuel, M. The Transient-Zone in the Human and Mouse Adrenal Gland. The Ohio Journal of Science. 72, 120-126 (1972).
- Guasti, L., Paul, A., Laufer, E., King, P. Localization of Sonic hedgehog secreting and receiving cells in the developing and adult rat adrenal cortex. Molecular and Cellular Endocrinology. 336 (1-2), 117-122 (2011).
- Pihlajoki, M., Dorner, J., Cochran, R. S., Heikinheimo, M., Wilson, D. B. Adrenocortical zonation, renewal, and remodeling. Frontiers in Endocrinology. 6, 27 (2015).
- Farese, R. V., Walther, T. C. Lipid Droplets Finally Get a Little R-E-S-P-E-C-T. Cell. 139 (5), 855-860 (2009).
- Shen, W. J., Azhar, S., Kraemer, F. B. Lipid droplets and steroidogenic cells. Experimental Cell Research. 340 (2), 209-214 (2016).
- Finco, I., LaPensee, C. R., Krill, K. T., Hammer, G. D. Hedgehog signaling and steroidogenesis. Annual Review of Physiology. 77, 105-129 (2015).
- Paul, A., Laufer, E. Endogenous biotin as a marker of adrenocortical cells with steroidogenic potential. Molecular and Cellular Endocrinology. 336 (1-2), 133-140 (2011).
- Lowe, J., Anderson, P. . Stevens & Lowe's Human Histology, 4th Edition. , 263-285 (2015).
- Nagatsu, T. Genes for human catecholamine-synthesizing enzymes. Neuroscience Research. 12 (2), 315-345 (1991).
- Berthon, A., et al. Age-dependent effects of Armc5 haploinsufficiency on adrenocortical function. Human Molecular Geneticst. 26 (18), 3495-3507 (2017).
- Brown, C. Antigen retrieval methods for immunohistochemistry. Toxicologic Pathology. 26 (6), 830-831 (1998).
- Billinton, N., Knight, A. W. Seeing the wood through the trees: a review of techniques for distinguishing green fluorescent protein from endogenous autofluorescence. Analytical Biochemistry. 291 (2), 175-197 (2001).
- Hirsch, R. E., San George, R. C., Nagel, R. L. Intrinsic fluorometric determination of the stable state of aggregation in hemoglobins. Analytical Biochemistry. 149 (2), 415-420 (1985).
- Whittington, N. C., Wray, S. Suppression of Red Blood Cell Autofluorescence for Immunocytochemistry on Fixed Embryonic Mouse Tissue. Current Protocols in Neuroscience. 81, 28 (2017).
- Watson, J. Suppressing autofluorescence of erythrocytes. Biotechnic & Histochemistry. 86 (3), 207 (2011).
- Epp, J. R., et al. Optimization of CLARITY for Clearing Whole-Brain and Other Intact Organs. eNeuro. 2 (3), (2015).
- Erturk, A., et al. Three-dimensional imaging of solvent-cleared organs using 3DISCO. Nature Protocols. 7 (11), 1983-1995 (2012).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon