Method Article
Lumíforo formação em várias conformações de albumina de soro bovino por ligação de Gold(III)
Neste Artigo
Resumo
Os protocolos para estudar a ligação de ouro cátions (Au(III)) para várias conformações de albumina de soro bovino (BSA), bem como para caracterizar a fluorescência de BSA-Au única dependente conformacional são apresentadas.
Resumo
O objetivo dos protocolos apresentados é estudar o processo de ligação de Au(III) a BSA, rendendo fluorescência vermelha induzida pela mudança de conformação (λem = 640 nm) de complexos de BSA-Au(III). O método ajusta o pH para mostrar que o surgimento da fluorescência vermelha está correlacionado com as transições de equilíbrio de pH-induzida de conformações da BSA. Fluorescente vermelha BSA-Au(III) complexos só podem ser formados com um ajuste de pH igual ou superior a 9,7, que corresponde a conformação de "Uma-forma" da BSA. O protocolo para ajustar a BSA a razão molar de Au e para monitorar o tempo-curso do processo de vinculação de Au(III) é descrito. O número mínimo de Au(III) por BSA, para produzir a fluorescência vermelha, tem menos de sete anos. Descrevemos o protocolo em etapas para ilustrar a presença de vários sites de ligação Au(III) em BSA. Primeiro, pela adição de cobre (Cu(II)) ou níquel (Ni(II)) cações seguidas por Au(III), este método revela um sítio de ligação para Au(III) que não é o fluoróforo vermelho. Em segundo lugar, modificando BSA tiol tampando agentes, outro sítio de ligação de Au(III) nonfluorophore-formando é revelado. Em terceiro lugar, alterando a conformação de BSA por clivagem e nivelamento das ligações de bissulfeto, Au(III) possível ligação site é ilustrado. O protocolo descrito, para controlar as conformações de BSA e Au(III) ligação, pode ser aplicado geralmente para estudar as interações de outras proteínas e cátions metálicos.
Introdução
Um composto de BSA-Au exibindo uma radiação ultravioleta (UV)-fluorescência vermelha excitável, com notável stokes turno, tem sido sintetizado originalmente por Xie et al. 1. a fluorescência vermelha única e estável pode encontrar várias aplicações em campos como a detecção de3,2,4, imagem5,6,7ou nanomedicina8 ,9,10,11,12,13. Este composto tem sido estudado extensivamente por muitos pesquisadores no campo da nano-ciência em anos recentes14,15,16. O composto de BSA-Au tem sido interpretado como Au25 nanoclusters. O objetivo do método apresentado é para examinar este composto em detalhe e para compreender a origem da fluorescência vermelha. Seguindo a abordagem apresentada, a presença de vários sites de ligação do Au e a origem da fluorescência, alternativa para a nucleação de single-site de Au25 nanoclusters, podem ser ilustrados. A mesma abordagem pode ser utilizada para estudar como outras proteínas17,18,19 complexado com Au(III) pode alterar suas propriedades intrínsecas, fluorescentes.
A síntese do composto fluorescente vermelha BSA-Au requer um controle estreito dos rácios molares da BSA para Au (BSA:Au) para maximizar a intensidade da fluorescência e a localização dos picos a excitação-emissão de mapa (EEM)20. Pode-se demonstrar que vários sites de vinculação existem para Au(III) vincular, incluindo o fragmento de asparagina (ou fragmento de Asp, os primeiro de quatro resíduos de aminoácidos no N-terminal da BSA)21,22. O aminoácido 34th de BSA (Cys-34) também é mostrado para coordenar Au(III) e de estar envolvido no mecanismo do fluorescence([Cys34-capped-BSA]-Au(III)) vermelho20. Fendendo a todas as ligações de bissulfeto Cys-Cys e tampando todos fluorescência de tióis, vermelho não é produzido ([all-thiol-capped-BSA]-Au(III)). Isto indica a necessidade de ligações de bissulfeto Cys-Cys como o sítio de ligação do Au(III) para produzir a fluorescência vermelha.
Técnicas de química de proteínas não foram amplamente utilizadas para estudar os complexos de BSA-Au(III) na Comunidade de nano-ciência. No entanto, é importante empregar estas técnicas para entender alguns aspectos destes complexos, bem como para obter uma compreensão detalhada dos locais de ligação Au(III) da BSA. Este artigo pretende mostrar algumas dessas técnicas.
Protocolo
1. síntese do complexo de BSA-Au(III)
- Dissolva 25 mg de BSA em 1 mL de água de grau de cromatografia líquida de alto desempenho (HPLC) em um frasco de reação de 5 mL.
Nota: A solução deve aparecer claramente. - Dissolva o ouro (III) cloreto trihidrato (ácido chloroauric) a uma concentração de 5 mM em água de grau HPLC.
Nota: A solução deve aparecer amarela. Solução de Ácido cloroáurico preparada nessa concentração resultará em uma BSA, à relação entre Au 01:13.- Em alternativa, preparar uma solução de Ácido cloroáurico com uma concentração de em qualquer lugar entre 0,38 mM (BSA:Au = 1:1) de 20 mM (BSA:Au = 01:50) em HPLC grau água.
Nota: Diferentes rácios de BSA de ouro irão resultar em padrões de fluorescência vermelha drasticamente diferente do mapa de excitação-emissão.
- Em alternativa, preparar uma solução de Ácido cloroáurico com uma concentração de em qualquer lugar entre 0,38 mM (BSA:Au = 1:1) de 20 mM (BSA:Au = 01:50) em HPLC grau água.
- Coloque o frasco de reação da BSA em banho maria a 37 ° C e agitar vigorosamente a 750 rpm utilizando um agitador magnético.
- Imediatamente após a agitação começa, adicione 1 mL de Ácido cloroáurico à solução. A cor da solução deve se transformar de clear para amarelo.
- Agite a mistura por 2 min a 37 ° C e a 750 rpm utilizando um agitador magnético.
- Dentro do frasco de reação, adicione 100 μL de 1 M de NaOH à solução para trazer o pH para 12.
Nota: Imediatamente depois de NaOH é adicionado, a solução deve escurecer ligeiramente para um amarelo-marrom e então entregue-se ao amarelo. - Continuar a agitar a 750 rpm por 2 h e a 37 ° C. A solução deve lentamente mudar de amarelo para cor amarelo/marrom escura. Esta mudança de cor indica a formação da BSA-Au(III) fluorescentes vermelhas complexas.
- Permitir que a amostra sentar-se à temperatura ambiente por 2 dias e a solução continuará a escurecer para um marrom âmbar e irá aumentar a intensidade de fluorescência.
- Como alternativa, deixe a amostra continuar a agitar a 37 ° C por 12 h mais como a cor da solução evolui para um âmbar marrom.
2. síntese de BSA-Cu(II)-Au(III)
- Dissolva 25 mg de BSA em 1 mL de água de grau HPLC. A solução deve aparecer claramente.
- Dissolva o cobre (II) cloreto hidratado em água de grau HPLC para uma concentração de 5 mM. A solução deve aparecer a luz azul.
- Adicione 1 mL da solução aquosa BSA para um frasco de reação de 5 mL e colocar em banho maria a 37 ° C. Agite a mistura em 750 rpm.
- Imediatamente Adicione 0,5 mL da solução de-hidratado cobre (II) cloreto ao frasco de reação e misture por 2 min. A solução permanecerá luz azul.
- Adicione 75 μL de 1 M NaOH para trazer o pH para 12 e permitem misturar por 2 h. A solução se tornará roxa.
- Dissolva o Ácido cloroáurico em água de grau HPLC para uma concentração de 5 mM.
- Adicionar 0,5 mL de Ácido cloroáurico aquosa ao frasco de reação e ajustar o pH volta a 12 usando 1 M de NaOH.
- Agite a mistura de reação para h 2.
Nota: A solução deve evoluir para uma cor marrom.
3. síntese de BSA-Ni(II)-Au(III)
- Dissolva 25 mg de BSA em 1 mL de água de grau HPLC. A solução deve aparecer claramente.
- Dissolva o cloreto de níquel (II) hexaidratado em água de grau HPLC para uma concentração de 5 mM. A solução deve aparecer a luz verde.
- Adicione 1 mL da solução aquosa BSA para um frasco de reação de 5 mL e coloque num banho de água em 37 oC. agitar a mistura em 750 rpm.
- Imediatamente Adicione 0,5 mL da solução de hexaidrato cloreto de níquel (II) para o frasco de reação e misture por 2 min.
Nota: A solução permanecerá luz verde. - Adicione 75 μL de 1 M NaOH para trazer o pH para 12 e permitem misturar por 2 h.
Nota: A solução se tornará amarelo escuro. - Dissolva o Ácido cloroáurico em água de grau HPLC para uma concentração de 5 mM.
- Adicionar 0,5 mL de Ácido cloroáurico aquosa ao frasco de reação e ajustar o pH volta a 12.
- Agite a mistura de reação para h 2.
Nota: A solução deve evoluir para uma cor marrom.
4. síntese de [Cys34-capped-BSA]-Au(III)
- Dissolva 2 mg de N-proteà (NEM) em 1 mL de salina tamponada fosfato (PBS, pH 7,4).
- Dissolva 2 mg de BSA em 1 mL de solução de PBS-NEM.
- Transferir a solução para um frasco de reação de 5 mL e agitar a 20 ° C a 500 rpm por 1h.
- Dialize a solução usando 12 kDa tubulação da diálise em 500 mL de PBS, agitando a 50 rpm com um agitador magnético durante a noite para remover NEM não tenha reagido.
- Dissolva o Ácido cloroáurico em PBS a uma concentração de 0,4 mM.
Nota: A solução será um amarelo fraco. - Transferência do frasco de reação para um banho de água a 37 ° C. Misture a 750 rpm.
- Imediatamente adicione 1 mL da solução de Ácido cloroáurico ao frasco de reação e permitir a mistura por 2 min.
- Adicione 75 μL de 1 M de NaOH no frasco de reação para trazer o pH para 12 e permitem misturar por 2 h.
5. síntese de [all-thiol-capped-BSA]-Au(III)
- Prepare uma solução de 2 M 50 milímetros e ureia bicarbonato de amónio (NH4HCO3, pH 8.0) em água de grau HPLC.
- Dissolva a 3,3 mg de BSA em 1 mL da solução acima e transferir para um frasco de reação de 5 mL.
- Fazer uma solução stock de 0,25 M tris(2-carboxyethyl) fosfina (TCEP) pela dissolução de 62,5 mg de TCEP em 1 mL de água HPLC.
- Adicione a solução-mãe de TCEP ao frasco de reação até que a concentração final de TCEP é de 8 mM.
- Incubar a solução em um banho de água durante 1 h a 50 ° C. Misture a 500 rpm utilizando um agitador magnético.
- Deixe a solução arrefecer completamente à temperatura ambiente.
- Prepare uma solução stock de 100mm NEM pela dissolução de 12,5 mg de NEM em 1 mL de água de grau HPLC.
- Adicione a solução stock de NEM ao frasco de reação até que a concentração final de NEM é 16 milímetros.
- Permitir que a solução combinar para 2 h a 20 ° C. Misture a 500 rpm.
- Dialize a solução usando um tubo de diálise 12 kDa, agitando a solução a 50 rpm com um agitador magnético durante a noite em 500 mL de 50mm NH4HCO3 para remover o excesso TCEP, NEM e ureia.
- Mover o frasco de reação para um banho-maria a 37 ° C e agitar a 750 rpm.
- Dissolva o Ácido cloroáurico em água de grau HPLC para uma concentração de 0,66 mM.
- Imediatamente adicione 1 mL da solução de Ácido cloroáurico ao frasco de reação e permitir a mistura por 2 min.
- Adicionar 1 M de NaOH até que o pH da solução é 12 e permitir que a solução continuar a misturar por 2 h.
Resultados
De fluorescência do complexo BSA-Au(III), tem sido observado que a conversão da fluorescência azul intrínseca de BSA (λem = 400 nm) para fluorescência vermelha (λem = 640 nm) ocorre no sobre pH 9,7 através de um equilíbrio transição (Figura 1). EEM de BSA-Au(III) no BSA diferente rácios molar Au é mostrado na Figura 2, e esses dados mostram como alterar as proporções molares produz o mesmo comprimento de onda de emissão de comprimentos de onda de excitação diferentes. Cu(II), Ni(II) e Au(III) competitivamente vinculam a um local conhecido (fragmento de Asp) em BSA (Figura 3). A BSA Cys34-tampado mostra uma mudança nos padrões de pico EEM mediante vinculação de Au(III), e esses resultados mostram como alteração de locais de ligação específica altera os padrões de fluorescência. A BSA tudo-tiol-tampado não mostra nenhuma fluorescência vermelha e revela ligações de bissulfeto Cys-Cys como sítios de ligação possível para produzir o fluoróforo vermelho (Figura 4).

Figura 1. Fluorescência de BSA-Au(III) e o conformacional induzida por mudança de azul para vermelho (A) a absorção e fluorescência (λex = 365 nm) de BSA-Au(III). (B) fluorescência vermelha seres a emergir no próximo de pH 9.7, no qual altera a conformação da BSA. (C) azul decaimentos de fluorescência como fluorescência vermelha emerge. Clique aqui para ver uma versão maior desta figura.

Figura 2. Medições de mapa (EEM) relação métrica excitação-emissão de BSA-Au(III). EEM de BSA-Au(III) complexos sintetizados usando o protocolo padrão enquanto ajusta a proporção de BSA para ouro. (A) BSA em pH 12, (B) BSA:Au = 1:1, BSA:Au (C) = 1:7, BSA:Au (D) = 01:13, BSA:Au (E) = 01:26, BSA:Au (F) = 01:30, BSA:Au (G) = 01:40, BSA:Au (H) = 01:52. Clique aqui para ver uma versão maior desta figura.
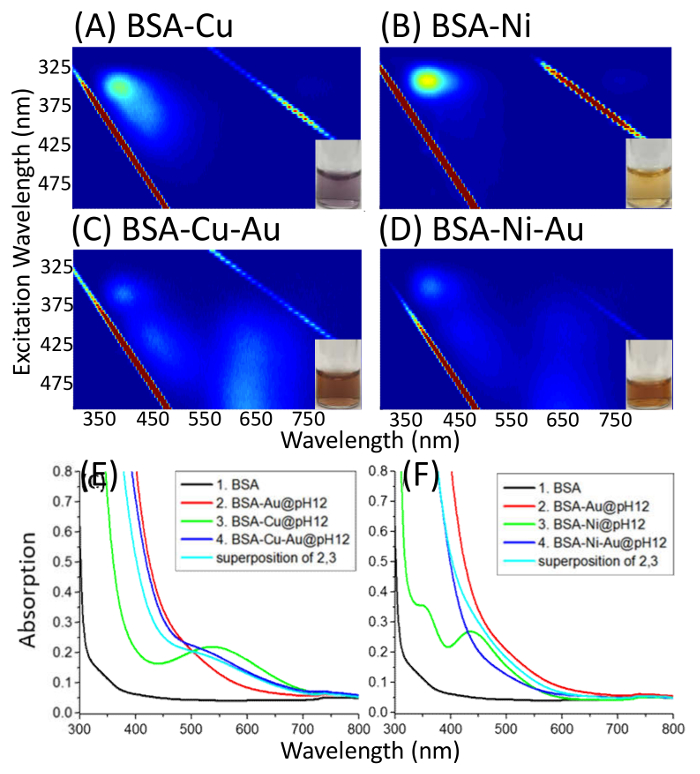
Figura 3. Complexos de EEM de BSA-Cu(II)/Ni(II)-Au(III). Excitação-emissão de mapas (excitação: 290-500 nm; emissão: 300-850 nm) de BSA complexado com Cu(II)/Ni(II) a pH 12 (A e B), BSA complexado com Cu(II)/Ni(II) e, em seguida, com Au(III) em pH 12 (C e D) e absorção espectros comparando BSA, BSA-Au, BSA-Cu(II)/Ni(II) e BSA-Cu(II)/Ni(II)-Au(III) (E e F). Curva 4 é comparada com a superposição de curvas 2 e 3. Esta figura foi modificada de Dixon, J. M. & Egusa, S. J. am. Chem. Soc. 140 2265-2271, (2018). Clique aqui para ver uma versão maior desta figura.

Figura 4. EEM de Cys34 tampado e tióis todo tampados. EEM (excitação: 300-500 nm; emissão: 300-700 nm) do (A) Cys34-tampado BSA reagiu com Au em pH 12. Em (B), todas as ligações de bissulfeto Cys-Cys em BSA foram clivadas e então o todo-tiol-tampado-BSA foi reagiu com Au em pH 12. Esta figura foi modificada de Dixon, J. M. & Egusa, S. J. am. Chem. Soc. 140 2265-2271, (2018). Clique aqui para ver uma versão maior desta figura.
Discussão
Os compostos de BSA-Au(III) preparados em pH 12 apresentam fluorescência vermelha em um comprimento de onda de emissão de λem= 640 nm quando excitadas com ultravioleta (UV) luz λex= 365 nm (figura 1A). O aparecimento de fluorescência vermelha é um processo lento e levará alguns dias à temperatura ambiente para aumentar a uma intensidade máxima. Executando a reação a 37 ° C irá produzir os melhores resultados, apesar de temperatura mais elevada pode ser usada para produzir a fluorescência vermelha rapidamente. Irreversível degradação da proteína pode ocorrer em temperaturas superiores a 45 ° C23. O ajuste do pH para que BSA transforma-se em sua idade (pH > 10) conformação21 ("uma-forma") é fundamental para fluorescência vermelha; pH é finamente ajustado de neutro a base para determinar o limiar da ocorrência da fluorescência vermelha (figura 1B, C). Para máxima intensidade fluorescente vermelha, o pH deve ser ajustado acima de 11. Para fluorescência vermelha, o pH pode ser ajustado para além de 11, embora extremamente basic (pH > 13) condições podem desnaturar BSA e causar a fluorescência vermelha desaparecer.
Variando a relação estequiométrica de BSA e Au pode ilustrar a vinculação do Au de BSA. Os espectros de fluorescência dos compostos BSA-Au(III) variam de acordo com os rácios estequiométricos da BSA para Au (Figura 2). A BSA à relação de ouro é ajustada para 01:26, um máximo na intensidade de fluorescência vermelha é observado em λex= 500 nm. Por outro lado, como a relação BSA:gold é ajustada para fluorescência vermelha 1:7, é observada principalmente em λex= 365 nm. Nenhuma fluorescência vermelha pode ser detectada em uma proporção de BSA para Au menos de 1:7 ou acima 01:52. O número mínimo de ouro cátions necessária para produzir o vermelho fluorescência é inferior a 7 e mais de 1, e o número máximo para a perda da fluorescência vermelha é maior do que 52 (Figura 2B, C). Além disso, a redução de todas as amostras acima mencionadas ocorrerá sob borohidreto de sódio em excesso, elucidar que todas as amostras ainda contenham Au(III) catiônica. Além disso, a adição de quantidades excessivas de ouro, além de 20 milímetros pode causar a solução tornar-se muito ácida e desnaturar a proteína. Se a desnaturação da proteína ocorre devido à alta acidez, reduza a concentração de BSA e Au relativamente para mediar esta questão.
Ligação do competidor da UA e outros cátions metálicos de BSA pode ilustrar os locais obrigatórios em BSA. É sabido que o Cu(II) e o Ni(II) ligam para o Asp fragmento no N-terminal de BSA24,25,26,27. Através da adição de Cu(II), um fichário de forte para o Asp-fragmento, seguido pela adição de Au(III), os espectros de absorvância do BSA-Cu(II)-Au(III) e os espectros de absorvância de BSA-Au(III) e BSA-Cu(II) são os mesmos - indicando que o ouro e cobre do não competir para o mesmo sítio de ligação em Asp-fragmento (Figura 3). Ni(II) liga-se fracamente para o Asp-fragmento e, portanto, Au(III) concorre com Ni(II) como o ouro é adicionado; foi observado que os espectros de absorvância de BSA-Ni(II) e BSA-Au(III) não se correlaciona com a do BSA-Ni(II)-Au(III) (Figura 3F). Através do protocolo acima, pode-se mostrar como Au(III) vincula-se para o sítio de ligação conhecida da BSA. Esta técnica também requer o ajustamento do pH acima de 11 e a técnica é modificada pela adição de duas vezes a concentração de BSA, mas na metade do volume, assim, esta deve ser realizada em baixa BSA rácios Au para manter a conformação da proteína.
Modificando a resíduos de cisteína em BSA ainda mais pode elucidar os locais obrigatórios do Au. Ouro é conhecido por ter uma afinidade elevada para tiol28 e BSA possui uma superfície acessível thiol em (Cys34)21. Através do bloquear deste tiol, sítios de ligação secundária podem ser elucidados. O bloqueio desta cisteína é realizado antes da adição de Au(III) para a amostra e mostra um padrão de fluorescência alterados de BSA-Au(III), indicando uma possível transferência via envolvidos no mecanismo da fluorescência vermelha (Figura 4A). É imperativo para adicionar o agente de bloqueio tiol, neste caso NEM, em pH neutro. Fendendo a todas as ligações de bissulfeto e tampar subsequentes de suas revelações de grupos tiol livre sem fluorescência vermelha (Figura 4B). Estes resultados indicam que uma ligação dissulfureto é necessária para produzir um complexo vermelho fluorescente.
Temos demonstrado em vários protocolos, através do uso de espectroscopia e técnicas de química de proteínas, um método para analisar os complexos de BSA-Au(III). Técnicas de química de proteínas aqui apresentadas não foram amplamente utilizadas na pesquisa nano-materiais à base de proteínas14. Estas técnicas podem ser geralmente aplicável e valioso para entender o processo de ligação de metal e os locais de ligação possível em outro, se não todos, proteínas como a tripsina, pepsina, lisozima e transferrina17,29. As proteínas são dinâmicos, ainda muito precisos "nano-materiais". Compreensão detalhada do sítio de ligação metal pode pavimentar o caminho para novos materiais à base de proteínas com propriedades óticas controladas com infinidade de aplicações potenciais.
Divulgações
Os autores não têm nada para divulgar.
Agradecimentos
S.E. reconhece o apoio do fundo especial iniciativa Duke, Wells Fargo fundo, PhRMA Foundation, bem como fundos de inicialização da Universidade da Carolina do Norte, Charlotte.
Materiais
| Name | Company | Catalog Number | Comments |
| Bovine Serum Albumin (BSA), 96% | Sigma-Aldrich | A5611 | |
| gold (III) chloride trihydrate, 99.9% | Sigma-Aldrich | 520918 | |
| Copper (II) chloride dihydrate, 99.999% | Sigma-Aldrich | 459097 | |
| Nickel (II) chloride hexahydrate, 99.9% | Sigma-Aldrich | 654507 | |
| N-Ethylmaleimide (NEM), >99.0% | Sigma-Aldrich | 4259 | |
| Tris(2-carboxyethyl)phosphine hydrochloride (TCEP), >98.0% | Sigma-Aldrich | C4706 | |
| Sodium hydroxide, >98.0% | Sigma-Aldrich | S8045 | |
| Urea, 99.5% | Chem-Implex Int'l | 30142 | |
| Phospate buffered saline (PBS) | Corning | MT21040CV | |
| Ammonium bicarbonate, 99.5% | Sigma-Aldrich | 9830 |
Referências
- Xie, J., Zheng, Y., Ying, J. Y. Protein-Directed Synthesis of Highly Fluorescent Gold Nanoparticles. Journal of the American Chemical Society. 131, 888-889 (2009).
- Saha, K., Agasti, S. S., Kim, C., Li, X., Rotello, V. M. Gold Nanoparticles in Chemical and Biological Sensing. Chemical Reviews. 112, 2739-2779 (2012).
- Zhang, Y., et al. New Gold Nanostructures for Sensor Applications: A Review. Materials. 7, 5169-5201 (2014).
- Chen, L. -Y., Wang, C. -W., Yuan, Z., Chang, H. -T. Fluorescent Gold Nanoclusters: Recent Advances in Sensing and Imaging. Analytical Chemistry. 87 (1), 216-229 (2015).
- Cai, W., Gao, T., Hong, H., Sun, J. Applications of Gold Nanoparticles in Cancer Nanotechnology. Nanotechnology, Science and Applications. 1, 17-32 (2008).
- Nune, S. K., et al. Nanoparticles for Biomedical Imaging. Expert Opinion on Drug Delivery. 6, 1175-1194 (2009).
- Dorsey, J. F., et al. Gold Nanoparticles in Radiation Research: Potential Applications for Imaging and Radiosensitization. Translational Cancer Research. 2, 280-291 (2013).
- Daniel, M. -C., Astruc, D. Gold Nanoparticles: Assembly, Supramolecular Chemistry, Quantum-Size-Related Properties, and Applications toward Biology, Catalysis, and Nanotechnology. Chemical Reviews. 104 (1), 293-346 (2004).
- Ferrari, M. Cancer Nanotechnology: Opportunities and Challenges. Nature Reviews Cancer. 5, 161-171 (2005).
- Huang, X., Jain, P. K., El-Sayed, I. H., El-Sayed, M. A. Gold Nanoparticles: Interesting Optical Properties and Recent Applications in Cancer Diagnostics and Therapy. Nanomedicine. 2, 681(2007).
- Arvizo, R., Bhattacharya, R., Mukherjee, P. Gold Nanoparticles: Opportunities and Challenges in Nanomedicine. Expert Opinion on Drug Delivery. 7, 753-763 (2010).
- Doane, T. L., Burda, C. The Unique Role of Nanoparticles in Nanomedicine: Imaging, Drug Delivery and Therapy. Chemical Society Reviews. 41, 2885(2012).
- Egusa, S., Ebrahem, Q., Mahfouz, R. Z., Saunthararajah, Y. Ligand Exchange on Gold Nanoparticles for Drug Delivery and Enhanced Therapeutic Index Evaluated in Acute Myeloid Leukemia Models. Experimental Biology and Medicine. 239, 853(2014).
- Qu, X., et al. Fluorescent Gold Nanoclusters: Synthesis and Recent Biological Application. Journal of Nanomaterials. (784097), (2015).
- Chakraborty, I., Pradeep, T. Atomically Precise Clusters of Noble Metals: Emerging Link between Atoms and Nanoparticles. Chemical Reviews. 117, 8208-8271 (2017).
- Raut, S., et al. Evidence of energy transfer from tryptophan to BSA/HSA protected gold nanoclusters. Methods and Applications in Fluorescence. 2, (2014).
- Le Guével, X., Daum, N., Schneider, M. Synthesis and Characterization of Human Transferrin-Stabilized Gold Nanoclusters. Nanotechnology. 22 (27), (2011).
- Kawasaki, H., Yoshimura, K., Hamaguchi, K., Arakawa, R. Trypsin-Stabilized Fluorescent Gold Nanocluster for Sensitive and Selective Hg2+ Detection. Analytical Sciences. 27 (6), 591(2011).
- Lu, D., et al. Lysozyme-Stabilized Gold Nanoclusters as a Novel Fluorescence Probe for Cyanide Recognition. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy. 121, 77-80 (2014).
- Dixon, J. M., Egusa, S. Conformational Change-Induced Fluorescence of Bovine Serum Albumin-Gold Complexes. Journal of the American Chemical Society. 140, 2265-2271 (2018).
- Peters, T. Jr All About Albumin. , (1996).
- Masuoka, J., Saltman, P. Zinc(II) and Copper(II) Binding to Serum Albumin. A Comparative Study of Dog, Bovine, and Human Albumin. Journal of Biological Chemistry. 269, 25557-25561 (1994).
- Takeda, K., Wada, A., Yamamoto, K., Moriyama, Y., Aoki, K. Conformational Change of Bovine Serum Albumin by Heat Treatment. Journal of Protein Chemistry. 8 (5), 653-659 (1989).
- Klotz, I. M., Curme, H. G. The Thermodynamics of Metallo-protein Combinations. Copper with Bovine Serum Albumin. Journal of the American Chemical Society. 70, 939-943 (1948).
- Fiess, H. A., Klotz, I. M. The Thermodynamics of Metallo-Protein Combinations. Comparison of Copper Complexes with Natural Proteins. J. Am. Chem. Soc. 74, 887-891 (1952).
- Rao, M. S. N. A Study of the Interaction of Nickel(II) with Bovine Serum Albumin. Journal of the American Chemical Society. 84, 1788-1790 (1962).
- Peters, T. Jr, Blumenstock, F. A. Copper-Binding Properties of Bovine Serum Albumin and Its Amino-terminal Peptide Fragment. Journal of Biological Chemistry. 242, 1574-1578 (1967).
- Xue, Y., Li, X., Li, H., Zhang, W. Quantifying Thiol-Gold Interactions towards the Efficient Strength Control. Nature Communications. 5, 4348(2014).
- Xu, Y., et al. The Role of Protein Characteristics in the Formation and Fluorescence of Au Nanoclusters. Nanoscale. 6 (3), 1515-1524 (2014).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados