Method Article
Gold(III)의 바인딩에 의해 소 혈 청 알 부 민의 다양 한 Conformations에 Luminophore 형성
요약
골드 양이온 (소 혈 청 알 부 민 (BSA) 구조적 종속 독특한 BSA Au 형광 특성화에 관해서는 잘 제시의 다양 한 conformations 하 Au(III))의 바인딩 공부에 대 한 프로토콜.
초록
제시 프로토콜의 목적은 Au(III) 바인딩할 구조 변화 유도 빨간색 형광 저조한 BSA의 과정을 공부 하는 (λem = 640 nm) BSA-Au(III) 복합물의. 메서드를 사용 하면 pH 빨간색 형광의 출현을 BSA conformations의 pH 유도 평형 전환 연관 표시를 조정 합니다. 빨간 형광 BSA-Au(III) 단지는 pH 9.7, 이상 해당 BSA의 "양식" 나 란 하의 조정만 형성 수 있습니다. 누구나 어 금 니 비율을 BSA를 조정 하 고 Au(III) 바인딩 과정의 시간 과정을 모니터를 프로토콜 설명 되어 있습니다. 빨간 형광을 생산 하기 위해 BSA 당 Au(III)의 최소 수 미만 7 이다. 우리는 BSA에 여러 Au(III) 바인딩 사이트의 존재를 설명 하는 단계에서 프로토콜을 설명 합니다. 구리를 추가 하 여 첫 번째 (Cu(II)) 또는 니켈 (Ni(II)) 양이온 Au(III) 다음,이 방법을 보여준다 바인딩 사이트 빨간 fluorophore는 Au(III)에 대 한. 둘째, thiol 에이전트를 상한 하 여 BSA를 수정 하 여 다른 nonfluorophore 형성 Au(III) 바인딩 사이트가 드러났습니다. 셋째, 가능한 Au(III) 바인딩 사이트 고착 및 이황화 결합의 상한 BSA 구조 변경, 그림은. 프로토콜 설명, BSA conformations 및 Au(III) 바인딩을 제어 하는 다른 단백질 및 금속 양이온의 상호 작용을 공부 하 일반적으로 적용할 수 있습니다.
서문
BSA-Au 화합물 전시는 자외선 (UV)-놀라운와 고르기 빨간색 형광 shift 스톡 스, 시 외원래 합성. 1. 고유 하 고 고정적 빨간 형광2,3,4,5,,67이미징 또는 nanomedicine8 감지 분야에서 다양 한 응용 프로그램을 찾을 수 있습니다 ,,910,11,,1213. 이 화합물은 최근 몇 년 동안14,,1516나노 과학의 분야에서 많은 연구자에 의해 광범위 하 게 공부 되었습니다 했다. BSA-Au 화합물 Au25 nanoclusters로 해석 되었습니다. 제시 방법의 목표는 세부에서이 화합물을 확인 하 고 빨간 형광의 기원 이해를 이다. 제시 방법에 따라, 여러 Au 바인딩 사이트의 존재 그리고 형광, Au25 nanoclusters의 단일 사이트 nucleation 대안의 기원 그림 될 수 있습니다. 동일한 접근은 다른 단백질17,,1819 complexed Au(III)와 그들의 본질적인 형광 속성을 변경할 수 있습니다 어떻게 연구 하 사용할 수 있습니다.
레드-형광 BSA Au 화합물의 합성에는 au (BSA:Au) 여기 방출 지도 (EEM)20에 봉우리의 위치는 형광의 강도 극대화 하는 BSA의 어 금 니 비율의 좁은 제어를 필요 합니다. 그것은 수 표시 여러 바인딩 사이트에 바인딩하려면 Au(III)에 대 한 존재는 아스파라긴 조각 (또는 Asp 조각, BSA의 N-말단에서 처음 4 개의 아미노산 잔류물)를 포함 하 여21,22. BSA (Cys-34)의 34번째 아미노산 Au(III)를 조정 하 고 레드 fluorescence([Cys34-capped-BSA]-Au(III))20의 구조에 참여 하는 것에 표시 됩니다. 모든 Cys Cys 이황화 결합을 고착 하 고 모든 thiols, 빨간색 형광 상한 시은 생산된 ([all-thiol-capped-BSA]-Au(III)). 이 빨간 형광을 생산 하는 Au(III) 바인딩 사이트 Cys Cys 이황화 결합의 필요성을 나타냅니다.
단백질 화학 기법은 하지 널리 나노 과학 커뮤니티에서 BSA-Au(III) 단지 공부를 사용 되었습니다. 그러나, 그것은이 단지, 또한 BSA에서 Au(III) 바인딩 사이트의 상세한 이해로 특정 측면을 이해 하는이 기법을 채택 하는 귀중 한 것입니다. 이 문서는 이러한 기술 중 일부를 보여 것입니다.
프로토콜
1입니다. 복잡 한 BSA-Au(III)의 합성
- 고성능 액체 크로마토그래피 (HPLC) 학년 물 5 mL 반응 유리병에서의 1 mL에 BSA의 25 mg을 디졸브.
참고: 솔루션 분명 나타납니다. - HPLC 학년 물에 5 m m의 농도에 금 (III) 염화 물 안내 (chloroauric 산)을 분해.
참고: 솔루션 노란색 나타납니다. Chloroauric 산 성 솔루션이이 농도에서 준비는 BSA Au 비율 1시 13분의 발생 합니다.- 어디의 농도와 chloroauric 산의 솔루션을 준비 또는 0.38 m m 사이 (BSA:Au = 1:1) 20 m m (BSA:Au = 1시 50분) HPLC에 학년 물.
참고: 금 BSA의 다른 비율 여기 방출 지도 크게 다른 빨간 형광 패턴에 발생 합니다.
- 어디의 농도와 chloroauric 산의 솔루션을 준비 또는 0.38 m m 사이 (BSA:Au = 1:1) 20 m m (BSA:Au = 1시 50분) HPLC에 학년 물.
- 37 ° C 물 욕조에 BSA의 반응 유리병을 배치 하 고 적극적으로 자력을 사용 하 여 750 rpm에서 저 어.
- 교 반 시작, 후에 즉시 솔루션에 chloroauric 산의 1 mL를 추가 합니다. 솔루션의 색 노란색 클리어에서 변환 해야 합니다.
- 37 ° C에서와 750 rpm는 자력을 사용 하 여 2 분 동안 혼합물을 저 어.
- 반응 유리병으로 1 M NaOH의 100 μ 12 pH를가지고 솔루션을 추가 합니다.
참고: NaOH를 추가 후에 즉시 솔루션 노란색-갈색으로 약간 어둡게 한 해야 다음 다시 노란색으로 설정 합니다. - 2 h 750 rpm에서 고 37 ° c.에 저 어로 진행 솔루션 천천히 어두운 노랑/브라운 색상을 노란색에서 변경 해야 합니다. 이 색깔 변화 복잡 한 붉은 fluorescing BSA-Au(III)의 형성을 나타냅니다.
- 2 일 동안 실내 온도에 앉아 샘플을 허용 하 고 솔루션 황색 갈색 어둡게 하 계속 되 고 형광 강도 증가.
- 또는, 샘플 솔루션의 컬러는 주황색 갈색에 발전 함에 따라 더 많은 h 12 37 ° C에서 저를 계속 하자.
2입니다. BSA-Cu(II)-Au(III)의 합성
- HPLC 학년 물의 1 mL에서 BSA의 25 mg을 디졸브. 솔루션은 분명 나타납니다.
- HPLC 학년 물 5 m m의 농도에 구리 (II) 염화 물이 수화물을 디졸브. 솔루션 빛 나타납니다 파란색.
- 5 mL 반응 유리병을 BSA 용액 1 mL를 추가 하 고 37 ° c.에 물 욕조에 배치 750 rpm에 혼합물을 저 어.
- 즉시 반응 유리병에 구리 (II) 염화 물이 수화물 해결책의 0.5 mL을 추가 하 고 2 분에 대 한 믹스. 솔루션 빛 남아 블루.
- 하는 pH 12 2 h에 대 한 혼합 수 1 M NaOH의 75 μ를 추가 합니다. 솔루션은 보라색 될 것입니다.
- HPLC 학년 물 5 m m의 농도에 chloroauric 산을 분해.
- 반응 유리병에 수성 chloroauric 산의 0.5 mL을 추가 하 고 다시 1 M NaOH를 사용 하 여 12에 pH를 조정.
- 2 시간에 대 한 반응 혼합물을 저 어.
참고: 솔루션 갈색 색상으로 진화 한다.
3입니다. BSA-Ni(II)-Au(III)의 합성
- HPLC 학년 물의 1 mL에서 BSA의 25 mg을 디졸브. 솔루션은 분명 나타납니다.
- 니켈 (II) 염화 물 hexahydrate 5 m m의 농도를 HPLC 학년 물에 용 해. 솔루션 나타납니다 빛 녹색.
- 5 mL 반응 유리병에 BSA 용액 1 mL를 추가 하 고 750 rpm에 혼합물 37 oC. 볶음에 물 욕조에 배치.
- 즉시 반응 유리병을 2 분 동안 혼합 니켈 (II) 염화 물 hexahydrate 솔루션의 0.5 mL를 추가 합니다.
참고: 솔루션 빛 유지 됩니다 녹색. - 하는 pH 12 2 h에 대 한 혼합 수 1 M NaOH의 75 μ를 추가 합니다.
참고: 솔루션 어두운 노란색 될 것입니다. - HPLC 학년 물 5 m m의 농도에 chloroauric 산을 분해.
- 반응 유리병에 수성 chloroauric 산의 0.5 mL을 추가 하 고 pH 12 다시 조정 합니다.
- 2 시간에 대 한 반응 혼합물을 저 어.
참고: 솔루션 갈색 색상으로 진화 한다.
4입니다. [Cys34-capped-BSA]-Au(III)의 합성
- 버퍼링 하는 인산 염 (PBS, pH 7.4)의 1 mL에 N-ethylmaleimide (NEM)의 2 밀리 그램을 디졸브.
- 1 mL의 PBS NEM 솔루션에 BSA의 2 밀리 그램을 디졸브.
- 5 mL 반응 유리병에 솔루션을 전송 하 고 1 시간에 500 rpm에서 20 ° C에서 저 어.
- 500 mL PBS, unreacted NEM 제거를 자력 하룻밤 함께 50 rpm에서 교 반에 12 kDa 투 석 튜브를 사용 하 여 솔루션 dialyze
- 0.4 m m의 농도에 PBS에 chloroauric 산을 분해.
참고: 솔루션 희미 한 노란색을 될 것입니다. - 37 ° c.에 물 목욕을 반응 유리병을 전송 750 rpm에서 저 어.
- 즉시 반응 유리병에 chloroauric 산 성 해결책의 1 mL을 추가 하 고 2 분 대 혼합을 허용.
- PH 12를가지고 고 2 h에 대 한 혼합 반응 유리병에 1 M NaOH의 75 μ를 추가 합니다.
5입니다. [all-thiol-capped-BSA]-Au(III)의 합성
- 2 M 요소와 50 m m 염화 중 탄산염 (NH4HCO3, pH 8.0) HPLC 학년 물에의 한 솔루션을 준비 합니다.
- 위의 솔루션의 5 mL 반응 유리병에 1 mL에 BSA의 3.3 mg을 디졸브.
- 0.25 M의 재고 솔루션 tris(2-carboxyethyl) HPLC 물의 1 mL에서의 TCEP 62.5 mg를 용 해 하 여 phosphine (TCEP).
- TCEP의 최종 농도 8 m m까지 재고 TCEP 솔루션 반응 유리병에 추가 합니다.
- 50 ° c.에 1 시간을 위한 물 욕조에 솔루션을 품 어 자력 교 반기를 사용 하 여 500 rpm에서 저 어.
- 실내 온도에 완전히 냉각 솔루션을 수 있습니다.
- 12.5 mg NEM의 HPLC 학년 물 1 mL에 용 해 하 여 100mm NEM의 재고 솔루션을 준비 합니다.
- NEM의 최종 농도 16 m m까지 반응 유리병에 NEM의 재고 솔루션을 추가 합니다.
- 솔루션 2 h 20 ° c.에 대 한 결합을 허용합니다 500 rpm에서 저 어.
- 초과 TCEP, NEM, 및 요소를 제거 하는 50mm NH4HCO3 의 500 mL에서 하룻밤 자력으로 50 rpm에서 솔루션을 저 어 12 kDa 투 석 튜브를 사용 하 여 솔루션 dialyze
- 37 ° C에 물 목욕을 반응 유리병을 이동 하 고 750 rpm에서 저 어.
- 0.66 m m의 농도를 HPLC 학년 물 산 성 chloroauric를 분해.
- 즉시 반응 유리병에 chloroauric 산 성 해결책의 1 mL을 추가 하 고 2 분 대 혼합을 허용.
- 해결책의 pH는 12까지 1 M NaOH를 추가 하 고 2 시간에 대 한 혼합 계속 솔루션을 허용.
결과
BSA-Au(III) 복합물의 형광에서 관찰 되었다 하는 BSA의 본질적인 파란 형광의 변환 (λem = 400 nm) 빨간색 형광을 (λem = 640 nm) 평형 통해 pH 9.7에 대해 발생 합니다 전환 (그림 1)입니다. EEM BSA-Au(III) Au 어 금 니 비율에 다른 BSA에 그림 2에 표시 하 고이 데이터 어떻게 다른 여기 파장에서 같은 방출 파장을 생성 어 금 니 비율 변경 보여줍니다. Cu(II), Ni(II), 그리고 Au(III) 경쟁적으로 BSA (그림 3)에서 알려진된 사이트 (Asp 조각)에 바인딩합니다. Cys34 출장 BSA Au(III) 바인딩 시 EEM 피크 패턴에 변화를 표시 하 고 이러한 결과 어떻게 형광 패턴 변경 특정 바인딩 사이트의 변경. 모든 thiol 출장 BSA 아니 빨간색 형광 표시 하 고 붉은 fluorophore (그림 4)를 생산 가능한 바인딩 사이트 Cys Cys 이황화 결합을 보여준다.

그림 1입니다. BSA-Au(III)와는 구조적 형광 유도에서 무엇이 변경 (A)는 흡 광도 형광 (ex λ= 365 nm) BSA-Au(III)의. (B) 붉은 형광 존재 pH 9.7, 주위에 등장 하는 BSA의 구조 변경. (C) 빨간 형광 나온다로 부패 한다 형광 블루. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.

그림 2입니다. 여기 방출 비율 통계 지도 (EEM) 측정 BSA-Au(III). EEM의 BSA-Au(III) 복잡 한 표준 프로토콜을 사용 하 여 금 BSA의 비율을 조정 하면서 합성. PH 12, (B) BSA:Au에서 (A) BSA = 1:1, (C) BSA:Au = 1:7, (D) BSA:Au = 1:13, BSA:Au (E) = 1:26, (F) BSA:Au = 1:30, (G) BSA:Au = 1:40, (H) BSA:Au = 1시 52분. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
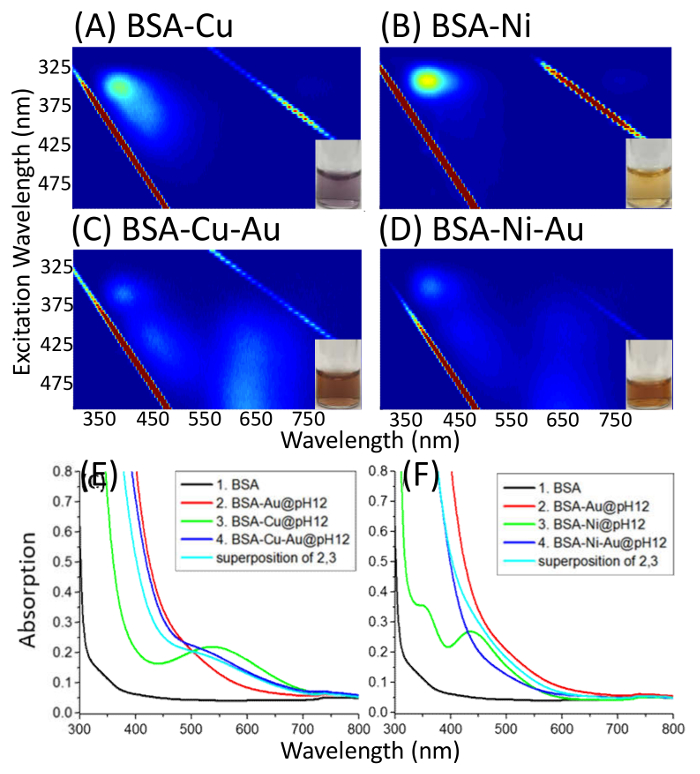
그림 3입니다. EEM의 BSA-Cu(II)/Ni(II)-Au(III) 단지. 자극 방출 지도 (여기: 290-500 nm; 방출: 300-850 nm) BSA complexed pH 12에서 Cu(II)/Ni(II)와 (A 와 B), BSA complexed Cu(II)/Ni(II)와 함께 다음 pH 12에서 Au(III) (C , D), 및 흡수 스펙트럼을 비교 하는 BSA, BSA Au, BSA-Cu(II)/Ni(II) 및 BSA-Cu(II)/Ni(II)-Au(III) (E 와 F). 곡선 4 곡선 2와 3의 중첩 비교 됩니다. 이 그림에서 딕슨, J. M. & Egusa, S. 수정 되었습니다 제이 이에요 화학 soc. 140 2265-2271, (2018). 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.

그림 4입니다. EEM Cys34 출장 및 모든 thiols 출장. EEM (여기: 300-500 nm; 방출: 300-700 nm) (A)의 Cys34 출장 BSA pH 12에서 Au와 반응. (B)에서 BSA 모든 Cys Cys 이황화 결합 했다 죽 습 한 다음 모든-thiol-출장-BSA pH 12에서 Au로 반응 했다. 이 그림에서 딕슨, J. M. & Egusa, S. 수정 되었습니다 제이 이에요 화학 soc. 140 2265-2271, (2018). 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
토론
PH 12에서 BSA-Au(III) 화합물 λ그들의 방출 파장에 빨간색 형광을 전시 = 640 nm로 자외선 (UV) 빛 λ전= 365 nm (그림 1A). 빨간 형광의 출현은 느린 과정이 고 최대 강도를 높이기 위해 실내 온도에 몇 일을 걸릴 것입니다. 37 ° C에서 반응 실행 높은 온도 빨리 빨간 형광을 생산 하 사용할 수 있습니다 최적의 결과 얻을 것 이다. 단백질의 돌이킬 수 없는 저하2345 ° C 이상의 온도에서 발생할 수 있습니다. 조정 pH의 BSA의 세 (pH > 10)으로 변환 되도록 나 란21 ("A-형태") 중요 하다 빨간 형광; pH는 가늘게 조정 중립에서 빨간 형광 (그림 1B, C)의 발생의 임계값을 결정 하는 기본. 최대 빨간색 형광 강도 대 한 11 위의 산도 조정 한다. 비록 매우 기본 (pH > 13) 조건 수 있는 BSA 변성 사라질 빨간색 형광을 일으킬 빨간 형광에 대 한 pH 11, 넘어 조정할 수 있습니다.
BSA와 Au의 화학 량 론 비율 변화 BSA에 Au의 바인딩을 설명 수 있습니다. BSA-Au(III) 화합물의 형광 스펙트럼 au (그림 2) BSA의 화학 량 론 비율에 따라 다릅니다. 빨간 형광 강도 최대전 λ에서 관찰 황금 비율을 BSA 1시 26분에 조정 이다, = 500 nm. 다른 한편으로, BSA:gold 비율 1:7, 빨간색 형광을 조정전 λ에서 주로 관찰 = 365 nm. 없음 빨간색 형광 Au 미만 1:7 이상 1시 52분에 BSA의 비율에서 감지할 수 있습니다. 골드 양이온의 최소 수 필요한 레드를 생산 하기 위해 형광은 7 미만 및 이상의 1, 및 빨간 형광의 손실에 대 한 최대 수는 52 (그림 2B, C) 보다 큰 합니다. 또한, 모든 상기 샘플의 감소는 과잉 나트륨 borohydride, 모든 샘플 여전히 양이온 Au(III)를 포함 하는 elucidating에서 발생 합니다. 또한, 골드 20 m m 넘어의 초과 하는 금액의 추가 너무 산 성 되 고 단백질을 변성 솔루션을 발생할 수 있습니다. 높은 산 성도 때문에 단백질 변성 경우 BSA와 Au은 상대적으로이 문제를 중재의 농도 줄일 수 있습니다.
Au 및 BSA에 다른 금속 양이온의 경쟁 바인딩 BSA에 바인딩 사이트 설명 수 있습니다. 그것은 Cu(II) 및 Ni(II)는 Asp에 바인딩할 알려져 BSA24,25,,2627의 N-말단에 조각. Cu(II), Au(III)의 추가 의해 따라 Asp 조각에 강한 바인더의 추가 통해 BSA-Cu(II)-Au(III)의 흡 광도 스펙트럼 및 BSA-Au(III) 및 BSA-Cu(II)의 흡 광도 스펙트럼은 동일-금과 구리 하지 않습니다 나타내는 Asp-조각 (그림 3C)에서 동일한 바인딩 사이트에 대 한 경쟁. Ni(II) 약하게 하는 Asp 조각에 바인딩하고 따라서 Au(III)와 경쟁 Ni(II) 골드 추가; 그것은 BSA-Ni(II)와 BSA-Au(III)의 흡 광도 스펙트럼 BSA-Ni(II)-Au(III) (그림 3 층)와 연관 되지 않은 관찰 되었습니다. 위의 프로토콜을 통해 하나 Au(III) BSA의 알려진된 바인딩 사이트에 바인딩 하는 방법을 보여줄 수 있다. 이 기술은 또한 11 위의 pH의 조정 필요 기술은 BSA 농도 두 번 추가 하 여 수정 하지만 절반 볼륨에 따라서이 수행 되어야 한다 단백질 구조를 유지 하기 위해 누구나 비율 낮은 BSA에서.
BSA에 있는 시스테인 잔류물 수정 Au 바인딩 사이트 명료 추가 수 있습니다. BSA (Cys34)21에 표면 접근 thiol 보유 및 골드 thiol28 에 대 한 높은 선호도가지고 알려져 있다. 이 thiol의 차단을 통해 보조 바인딩 사이트 해명 될 수 있다. 이 시스테인의 차단 Au(III)의 샘플에 추가 하기 전에 밖으로 실행 되 고 빨간 형광 (그림 4A)의 메커니즘에 관련 된 가능한 전송 경로 나타내는 BSA-Au(III)의 변경된 형광 패턴을 보여 줍니다. 이 경우 NEM, 중립 pH에 thiol 차단 에이전트를 추가 하는 것이 필수적입니다. 고착 모든 이황화 결합 하 고 그들의 무료 thiol 그룹 계시의 후속 상한 없음 빨간색 형광 (그림 4B). 이 결과 이황화 결합 빨간색 형광 복잡 한 생산 하는 데 필요한을 나타냅니다.
우리는 광을 사용 하 여 다양 한 프로토콜에 증명 하고있다 및 단백질 화학 기법, BSA-Au(III) 단지를 분석 하는 방법. 단백질 화학 방법은 여기에 소개가 되어 널리 사용 되지 단백질 기반 나노 재료 연구14. 이러한 기술을 일반적으로 적용 되 고 있을 경우 모두, 트립 신, 펩 신, lysozyme, 및 처리가17,29등 단백질 금속 바인딩 프로세스와 다른, 가능한 바인딩 사이트를 이해 하 고 있는. 단백질은 동적, 아직 매우 정확한 "나노 물질". 금속 바인딩 사이트의 상세한 이해 수 길을 향해 무수와 제어 광학 특성을 가진 새로운 단백질 기반 재료의 잠재적인 응용 프로그램.
공개
저자는 공개 없다.
감사의 말
남동 시작 자금에서 노스 캐롤라이나 대학, 뿐만 아니라 듀크 기부 특별 한 이니셔티브 기금, 웰 스 파고 기금, PhRMA 재단에서 지원 샬 롯을 인정합니다.
자료
| Name | Company | Catalog Number | Comments |
| Bovine Serum Albumin (BSA), 96% | Sigma-Aldrich | A5611 | |
| gold (III) chloride trihydrate, 99.9% | Sigma-Aldrich | 520918 | |
| Copper (II) chloride dihydrate, 99.999% | Sigma-Aldrich | 459097 | |
| Nickel (II) chloride hexahydrate, 99.9% | Sigma-Aldrich | 654507 | |
| N-Ethylmaleimide (NEM), >99.0% | Sigma-Aldrich | 4259 | |
| Tris(2-carboxyethyl)phosphine hydrochloride (TCEP), >98.0% | Sigma-Aldrich | C4706 | |
| Sodium hydroxide, >98.0% | Sigma-Aldrich | S8045 | |
| Urea, 99.5% | Chem-Implex Int'l | 30142 | |
| Phospate buffered saline (PBS) | Corning | MT21040CV | |
| Ammonium bicarbonate, 99.5% | Sigma-Aldrich | 9830 |
참고문헌
- Xie, J., Zheng, Y., Ying, J. Y. Protein-Directed Synthesis of Highly Fluorescent Gold Nanoparticles. Journal of the American Chemical Society. 131, 888-889 (2009).
- Saha, K., Agasti, S. S., Kim, C., Li, X., Rotello, V. M. Gold Nanoparticles in Chemical and Biological Sensing. Chemical Reviews. 112, 2739-2779 (2012).
- Zhang, Y., et al. New Gold Nanostructures for Sensor Applications: A Review. Materials. 7, 5169-5201 (2014).
- Chen, L. -Y., Wang, C. -W., Yuan, Z., Chang, H. -T. Fluorescent Gold Nanoclusters: Recent Advances in Sensing and Imaging. Analytical Chemistry. 87 (1), 216-229 (2015).
- Cai, W., Gao, T., Hong, H., Sun, J. Applications of Gold Nanoparticles in Cancer Nanotechnology. Nanotechnology, Science and Applications. 1, 17-32 (2008).
- Nune, S. K., et al. Nanoparticles for Biomedical Imaging. Expert Opinion on Drug Delivery. 6, 1175-1194 (2009).
- Dorsey, J. F., et al. Gold Nanoparticles in Radiation Research: Potential Applications for Imaging and Radiosensitization. Translational Cancer Research. 2, 280-291 (2013).
- Daniel, M. -C., Astruc, D. Gold Nanoparticles: Assembly, Supramolecular Chemistry, Quantum-Size-Related Properties, and Applications toward Biology, Catalysis, and Nanotechnology. Chemical Reviews. 104 (1), 293-346 (2004).
- Ferrari, M. Cancer Nanotechnology: Opportunities and Challenges. Nature Reviews Cancer. 5, 161-171 (2005).
- Huang, X., Jain, P. K., El-Sayed, I. H., El-Sayed, M. A. Gold Nanoparticles: Interesting Optical Properties and Recent Applications in Cancer Diagnostics and Therapy. Nanomedicine. 2, 681(2007).
- Arvizo, R., Bhattacharya, R., Mukherjee, P. Gold Nanoparticles: Opportunities and Challenges in Nanomedicine. Expert Opinion on Drug Delivery. 7, 753-763 (2010).
- Doane, T. L., Burda, C. The Unique Role of Nanoparticles in Nanomedicine: Imaging, Drug Delivery and Therapy. Chemical Society Reviews. 41, 2885(2012).
- Egusa, S., Ebrahem, Q., Mahfouz, R. Z., Saunthararajah, Y. Ligand Exchange on Gold Nanoparticles for Drug Delivery and Enhanced Therapeutic Index Evaluated in Acute Myeloid Leukemia Models. Experimental Biology and Medicine. 239, 853(2014).
- Qu, X., et al. Fluorescent Gold Nanoclusters: Synthesis and Recent Biological Application. Journal of Nanomaterials. (784097), (2015).
- Chakraborty, I., Pradeep, T. Atomically Precise Clusters of Noble Metals: Emerging Link between Atoms and Nanoparticles. Chemical Reviews. 117, 8208-8271 (2017).
- Raut, S., et al. Evidence of energy transfer from tryptophan to BSA/HSA protected gold nanoclusters. Methods and Applications in Fluorescence. 2, (2014).
- Le Guével, X., Daum, N., Schneider, M. Synthesis and Characterization of Human Transferrin-Stabilized Gold Nanoclusters. Nanotechnology. 22 (27), (2011).
- Kawasaki, H., Yoshimura, K., Hamaguchi, K., Arakawa, R. Trypsin-Stabilized Fluorescent Gold Nanocluster for Sensitive and Selective Hg2+ Detection. Analytical Sciences. 27 (6), 591(2011).
- Lu, D., et al. Lysozyme-Stabilized Gold Nanoclusters as a Novel Fluorescence Probe for Cyanide Recognition. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy. 121, 77-80 (2014).
- Dixon, J. M., Egusa, S. Conformational Change-Induced Fluorescence of Bovine Serum Albumin-Gold Complexes. Journal of the American Chemical Society. 140, 2265-2271 (2018).
- Peters, T. Jr All About Albumin. , (1996).
- Masuoka, J., Saltman, P. Zinc(II) and Copper(II) Binding to Serum Albumin. A Comparative Study of Dog, Bovine, and Human Albumin. Journal of Biological Chemistry. 269, 25557-25561 (1994).
- Takeda, K., Wada, A., Yamamoto, K., Moriyama, Y., Aoki, K. Conformational Change of Bovine Serum Albumin by Heat Treatment. Journal of Protein Chemistry. 8 (5), 653-659 (1989).
- Klotz, I. M., Curme, H. G. The Thermodynamics of Metallo-protein Combinations. Copper with Bovine Serum Albumin. Journal of the American Chemical Society. 70, 939-943 (1948).
- Fiess, H. A., Klotz, I. M. The Thermodynamics of Metallo-Protein Combinations. Comparison of Copper Complexes with Natural Proteins. J. Am. Chem. Soc. 74, 887-891 (1952).
- Rao, M. S. N. A Study of the Interaction of Nickel(II) with Bovine Serum Albumin. Journal of the American Chemical Society. 84, 1788-1790 (1962).
- Peters, T. Jr, Blumenstock, F. A. Copper-Binding Properties of Bovine Serum Albumin and Its Amino-terminal Peptide Fragment. Journal of Biological Chemistry. 242, 1574-1578 (1967).
- Xue, Y., Li, X., Li, H., Zhang, W. Quantifying Thiol-Gold Interactions towards the Efficient Strength Control. Nature Communications. 5, 4348(2014).
- Xu, Y., et al. The Role of Protein Characteristics in the Formation and Fluorescence of Au Nanoclusters. Nanoscale. 6 (3), 1515-1524 (2014).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유