Method Article
Luminophor Bildung in verschiedenen Konformationen von Rinderserumalbumin durch Bindung von Gold(III)
In diesem Artikel
Zusammenfassung
Die Protokolle für das Studium der Bindung von gold-Kationen (Au(III)) zu verschiedenen Konformationen der Rinderserumalbumin (BSA) wie auch für die Charakterisierung der Konformationsänderungen abhängigen einzigartige BSA-Au Fluoreszenz dargestellt werden.
Zusammenfassung
Die vorgestellten Protokolle soll den Prozess der Au(III) Bindung an die BSA, nachgiebig Konformation bedingte rote Fluoreszenz (λEm = 640 nm) der BSA-Au(III)-komplexe. Die Methode stellt den pH-Wert zu zeigen, dass die Entstehung der rote Fluoreszenz mit der pH-induzierte Gleichgewicht Übergänge von der BSA Konformationen korreliert ist. Rot fluoreszierende BSA-Au(III)-komplexe können nur mit einer Einstellung des pH-Wertes bei oder über 9,7, das entspricht der "A-Form" Konformation der BSA gebildet werden. Das Protokoll die BSA, Au Molverhältnis anpassen und den zeitlichen Verlauf des Prozesses der Au(III) Bindung zu überwachen ist beschrieben. Die minimale Anzahl von Au(III) pro BSA, der rote Fluoreszenz zu produzieren ist weniger als sieben. Wir beschreiben das Protokoll in Schritten, um das Vorhandensein von mehreren Au(III)-Bindungsstellen im BSA zu veranschaulichen. Erstens, durch Zugabe von Kupfer (Cu(II)) oder Nickel (Ni(II)) kationen gefolgt von Au(III), zeigt diese Methode eine Bindungsstelle für Au(III), die nicht das rote Fluorophor. Zweitens wird durch BSA von Thiol Deckelung Agenten ändern, ein anderes Nonfluorophore bilden Au(III) Bindungsstelle aufgedeckt. Drittens sind ändern die BSA-Konformation durch Spaltung und Begrenzung der Disulfid-Bindungen, die mögliche Au(III) Bindung Webseite(n) illustriert. Das Protokoll beschrieben, zur Steuerung der BSA Konformationen und Au(III) Bindung, kann in der Regel angewendet werden, um die Wechselwirkungen von anderen Proteinen und Metallkationen zu studieren.
Einleitung
Eine BSA-Au-Verbindung Ausstellen einer Ultraviolett (UV)-leicht erregbaren rote Fluoreszenz, mit bemerkenswerten schürt Verschiebung, wurde ursprünglich von Xie Et al.synthetisiert worden. 1. einzigartige und stabile rote Fluoreszenz finden Sie verschiedene Anwendungen in den Bereichen Fernerkundung,2,3,4, bildgebenden5,6,7oder Nanomedizin8 ,9,10,11,12,13. Diese Verbindung wurde von vielen Forschern auf dem Gebiet der Nano-Wissenschaft in den letzten Jahren14,15,16ausgiebig untersucht. Die BSA-Au-Verbindung wurde als Au25 nanocluster interpretiert. Das Ziel der vorgestellten Methode ist, diese Verbindung im Detail zu untersuchen und zu verstehen, die Herkunft der rote Fluoreszenz. Den vorgestellten Ansatz folgend können das Vorhandensein von mehreren Au Bindungsstellen, und die Herkunft der Fluoreszenz, Alternative zu einem Standort Nukleation von Au25 nanocluster dargestellt werden. Der gleiche Ansatz kann eingesetzt werden, zu studieren, wie andere Proteine17,18,19 komplexiert mit Au(III) ihren fluoreszierenden Eigenschaften ändern können.
Die Synthese der BSA-Au rot fluoreszierende Verbindung erfordert eine enge Kontrolle über das molare Verhältnis von BSA, Au (BSA:Au), die Intensität der Fluoreszenz und die Lage der Gipfel der Erregung-Emission Karte (EEM)20zu maximieren. Es kann gezeigt werden, dass mehrere Bindungsstellen für Au(III) zu binden, gibt es einschließlich der Asparagin-Fragment (oder Asp-Fragment, die ersten vier Aminosäurereste am N-Terminus des BSA)21,22. Die 34th Aminosäure der BSA (Cys-34) zeigt sich auch, Au(III) zu koordinieren und in den Mechanismus der roten fluorescence([Cys34-capped-BSA]-Au(III))20einbezogen werden. Auf alle Cys-Cys-Disulfid-Bindungen zu Spalten und verschließen alle Thiole, rote Fluoreszenz ist nicht produziert ([all-thiol-capped-BSA]-Au(III)). Dies weist auf die Notwendigkeit der Cys-Cys Disulfid Anleihen als die Au(III)-Bindungsstelle, die rote Fluoreszenz zu produzieren.
Protein-Chemie-Techniken haben nicht weit verbreitet, um die BSA-Au(III)-komplexe in der Nano-Science-Community zu studieren. Allerdings wäre es wertvoll, um diese Techniken zu verstehen, bestimmte Aspekte dieser komplexe, Detailwissen über die Au(III)-Bindungsstellen im BSA zu gewinnen. Dieser Artikel soll einige dieser Techniken zu zeigen.
Protokoll
(1) Synthese von BSA-Au(III) Komplex
- 25 mg der BSA in 1 mL Hochleistungs-Flüssigkeitschromatographie (HPLC) Grade Wasser in einer 5 mL Reaktion Phiole zu lösen.
Hinweis: Die Lösung sollte klar angezeigt werden. - Gold (III) chlorid Trihydrate (chlorogoldsäure) zu einer Konzentration von 5 mM in HPLC Grade Wasser auflösen.
Hinweis: Die Lösung sollte gelb angezeigt. Chloroauric Säure Lösung vorbereitet bei dieser Konzentration führt zu einem BSA in Au Verhältnis von 01:13.- Alternativ bereiten Sie eine Lösung von chlorogoldsäure mit einer Konzentration von überall zwischen 0,38 mM (BSA:Au = 1:1) bis 20 mM (BSA:Au = 01:50) in HPLC Grad Wasser.
Hinweis: Unterschiedliche Verhältnisse der BSA Gold drastisch unterschiedlich rote Fluoreszenz-Muster der Erregung-Emission Karte führt.
- Alternativ bereiten Sie eine Lösung von chlorogoldsäure mit einer Konzentration von überall zwischen 0,38 mM (BSA:Au = 1:1) bis 20 mM (BSA:Au = 01:50) in HPLC Grad Wasser.
- Die Reaktion Phiole der BSA in einem 37 ° C Wasserbad legen und kräftig rühren bei 750 u/min mit einem Magnetrührer.
- Unmittelbar nach der Aufregung beginnt, fügen Sie 1 mL der chlorogoldsäure der Projektmappe hinzu. Die Farbe der Lösung sollte von klar bis gelb verwandeln.
- Rühren Sie die Mischung für 2 min bei 37 ° C und bei 750 u/min mit einem Magnetrührer.
- Fügen Sie in das Fläschchen Reaktion 100 μL 1 M NaOH Lösung bringen den pH-Wert auf 12 hinzu.
Hinweis: Unmittelbar nach NaOH hinzugefügt wird, die Lösung sollte leicht zu einem gelb-braun zu verdunkeln und dann zurückdrehen bis gelb. - Weiterhin rühren bei 750 u/min für 2 h und bei 37 ° C. Die Lösung sollte langsam von Gelb in eine dunkle gelb/braun Farbe ändern. Diese Farbveränderung zeigt die Bildung der roten fluoreszierenden BSA-Au(III) komplexe.
- Lassen Sie die Probe bei Raumtemperatur für 2 Tage und die Lösung zu sitzen wird weiterhin ein Bernstein Braun verdunkeln und die Fluoreszenzintensität erhöht.
- Alternativ lassen Sie die Probe bei 37 ° C für 12 rühren mehr h wie die Farbe der Lösung zu einem braunen Bernstein entwickelt sich weiter.
(2) Synthese von BSA-Cu(II)-Au(III)
- 25 mg der BSA in 1 mL HPLC Grade Wasser auflösen. Die Lösung sollte klar erscheinen.
- Kupfer (II)-chlorid-Dihydrat in HPLC Grade Wasser zu einer Konzentration von 5 mM zu lösen. Die Lösung sollte Licht erscheinen blau.
- Eine Reaktion Ampulle 5 mL 1 mL der wässrigen BSA-Lösung hinzu und legen Sie in einem Wasserbad bei 37 ° C. Rühren Sie die Mischung bei 750 u/min.
- Sofort die Reaktion Phiole 0,5 mL Kupfer (II)-chlorid-Dihydrat-Lösung hinzu und mischen Sie 2 min. lang. Die Lösung bleibt Licht blau.
- Fügen Sie 75 μL 1 M NaOH bis pH 12 und 2 h zu mischen. Die Lösung wird lila werden.
- Lösen Sie chlorogoldsäure in HPLC Grade Wasser zu einer Konzentration von 5 mM auf.
- Die Reaktion Phiole 0,5 mL wässrige chlorogoldsäure hinzu und passen Sie den pH-Wert wieder auf 12 mit 1 M NaOH.
- Rühren Sie das Reaktionsgemisch für 2 h.
Hinweis: Die Lösung sollte auf eine braune Farbe zu entwickeln.
(3) Synthese von BSA-Ni(II)-Au(III)
- 25 mg der BSA in 1 mL HPLC Grade Wasser auflösen. Die Lösung sollte klar erscheinen.
- Nickel (II)-Chlorid-Hexahydrat in HPLC Grade Wasser zu einer Konzentration von 5 mM zu lösen. Die Lösung sollte Licht erscheinen grün.
- Eine Reaktion Ampulle 5 mL 1 mL der wässrigen BSA-Lösung hinzu und legen Sie in einem Wasserbad bei 37 oC. rühren die Mischung bei 750 u/min.
- Fügen Sie 0,5 mL der Nickel (II)-Chlorid-Hexahydrat-Lösung sofort die Reaktion Phiole und Mischung für 2 min hinzu.
Hinweis: Die Lösung bleibt Licht grün. - Fügen Sie 75 μL 1 M NaOH bis pH 12 und 2 h zu mischen.
Hinweis: Die Lösung werden dunkelgelb. - Lösen Sie chlorogoldsäure in HPLC Grade Wasser zu einer Konzentration von 5 mM auf.
- Die Reaktion Phiole 0,5 mL der wässrigen chlorogoldsäure hinzu und passen Sie den pH-Wert wieder auf 12.
- Rühren Sie das Reaktionsgemisch für 2 h.
Hinweis: Die Lösung sollte auf eine braune Farbe zu entwickeln.
4. Synthese von [Cys34-capped-BSA]-Au(III)
- 2 mg N-Ethylmaleimide (NEM) in 1 mL Phosphat gepufferte Kochsalzlösung (PBS, pH 7,4) auflösen.
- 2 mg der BSA in 1 mL PBS-NEM Lösung zu lösen.
- Die Lösung zu einem 5 mL Reaktion Fläschchen zu übertragen und bei 20 ° C bei 500 u/min für 1 h rühren.
- Dialyse der Lösung mit 12 kDa Dialyse Schläuche in 500 mL PBS, bei 50 u/min unter Rühren mit einem Magnetrührer über Nacht nicht umgesetztes NEM entfernen.
- Lösen Sie chlorogoldsäure mit PBS-Puffer zu einer Konzentration von 0,4 mM auf.
Hinweis: Die Lösung wird ein schwaches gelb sein. - Übertragung der Reaktion Fläschchen in einem Wasserbad bei 37 ° C. Bei 750 u/min rühren.
- Sofort die Reaktion Ampulle 1 mL Chloroauric Säure-Lösung hinzufügen und für 2 min mischen lassen.
- Das Fläschchen Reaktion den pH 12 und für 2 h mischen fügen Sie 75 μL 1 M NaOH hinzu.
5. Synthese von [all-thiol-capped-BSA]-Au(III)
- Bereiten Sie eine Lösung von 2 M Harnstoff und 50 mM Ammonium Bicarbonat (NH4HCO3, pH 8,0) in HPLC Grade Wasser.
- 3,3 mg der BSA in 1 mL der obigen Lösung und Transfer zu einem 5 mL-Fläschchen Reaktion auflösen.
- Machen Sie eine Stammlösung von 0,25 M tris(2-carboxyethyl) Phosphin (DÄMMUND) durch DÄMMUND 62,5 mg in 1 mL HPLC Wasser auflösen.
- Die Reaktion Phiole fügen Sie der Stammlösung DÄMMUND bis die Endkonzentration von DÄMMUND 8 mM ist hinzu.
- Inkubieren Sie die Lösung in einem Wasserbad für 1 h bei 50 ° c Rühren Sie bei 500 u/min mit einem Magnetrührer.
- Lassen Sie die Lösung vollständig auf Zimmertemperatur abkühlen.
- Bereiten Sie eine Stammlösung von 100 mM NEM durch NEM 12,5 mg in 1 mL HPLC Grade Wasser auflösen.
- Die Reaktion Phiole fügen Sie der Stammlösung von NEM bis die Endkonzentration von NEM 16 mM ist hinzu.
- Lassen Sie die Lösung verbinden für 2 h bei 20 ° C. Bei 500 u/min rühren.
- Dialyse die Lösung unter Verwendung eines 12 kDa Dialyse Schlauchs, rühren die Lösung bei 50 u/min mit einem Magnetrührer über Nacht in 500 mL 50 mM NH4HCO3 , überschüssige DÄMMUND, NEM und Harnstoff zu entfernen.
- Bewegen Sie die Reaktion Phiole in einem Wasserbad bei 37 ° C und bei 750 u/min rühren.
- Chlorogoldsäure in HPLC Grade Wasser zu einer Konzentration von 0,66 mM auflösen.
- Sofort die Reaktion Ampulle 1 mL Chloroauric Säure-Lösung hinzufügen und für 2 min mischen lassen.
- Fügen Sie 1 M NaOH bis pH der Lösung 12 und lassen Sie die Lösung weiterhin für 2 h mischen.
Ergebnisse
Aus der Fluoreszenz des BSA-Au(III) komplexes, es wurde beobachtet, dass die Umwandlung der inneren blauen Fluoreszenz der BSA (λEm = 400 nm), rote Fluoreszenz (λEm = 640 nm) tritt bei etwa pH 9,7 durch ein Gleichgewicht Übergang (Abbildung 1). EEM BSA-Au(III) bei verschiedenen BSA Au molare Verhältnis ist in Abbildung 2dargestellt, und diese Daten zeigt, wie die gleichen Emissionswellenlänge bei verschiedenen Erregung Wellenlängen ergibt das molare Verhältnis zu verändern. 600-fache, Ni(II) und Au(III) binden kompetitiv zu einer bekannten Website (Asp-Fragment) in BSA (Abbildung 3). Die Cys34-capped BSA zeigt eine Veränderung der EEM Spitze Muster auf Au(III) Bindung, und diese Ergebnisse zeigen, wie Änderung der spezifischen Bindungsstellen Fluoreszenz-Muster verändert. Die All-Thiol-capped BSA zeigt keine rote Fluoreszenz und enthüllt Cys-Cys Disulfid Anleihen als möglichen Bindungsstellen, die rote Fluorophor (Abbildung 4) zu produzieren.

Abbildung 1: Fluoreszenz des BSA-Au(III) und der Konformationsänderungen induzierte Übergang von blau zu rot (A) die Absorption und Fluoreszenz (λex = 365 nm) des BSA-Au(III). (B) rote Fluoreszenz Wesen entstehen bei um pH 9.7, an denen ändert die Konformation der BSA. (C) blaue Fluoreszenz zerfällt, wie rote Fluoreszenz entsteht. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 2: Verhältnis-Metrik Erregung-Karte (EEM) Emissionsmessungen von BSA-Au(III). EEM von BSA-Au(III) komplexe synthetisiert Standardprotokolls beim Einstellen des Verhältnisses der BSA zu Gold. (A) BSA bei pH 12, (B) BSA:Au = 1:1, (C) BSA:Au = 1:7, (D) BSA:Au = 01:13, (E) BSA:Au = 01:26, (F) BSA:Au = 01:30, (G) BSA:Au = 01:40, (H) BSA:Au = 01:52. Bitte klicken Sie hier für eine größere Version dieser Figur.
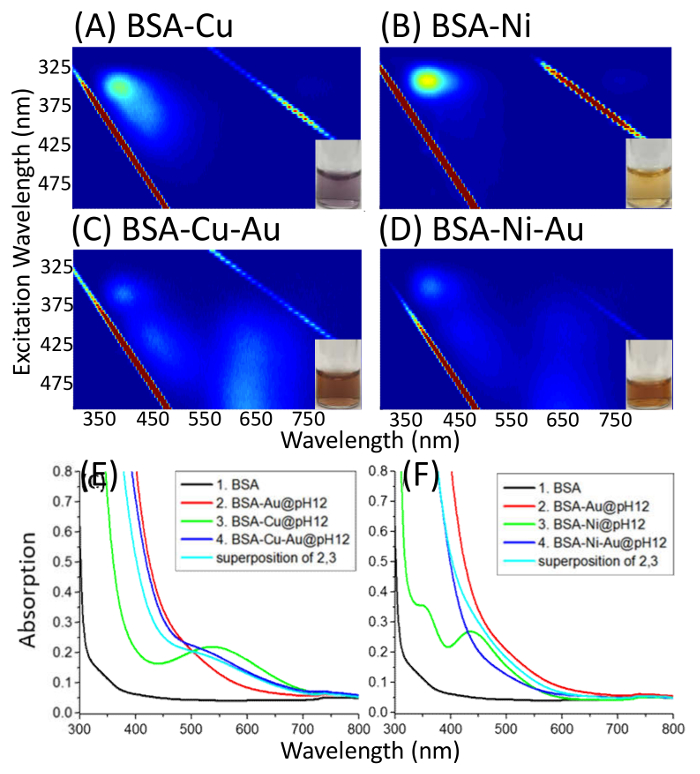
Abbildung 3. EEM BSA-Cu(II)/Ni(II)-Au(III) komplexe. Erregung-Emission Karten (Anregung: 290-500 nm, Emission: 300-850 nm) des BSA komplexiert mit Cu(II)/Ni(II) bei pH 12 (A und B), BSA komplexiert mit Cu(II)/Ni(II) und dann mit Au(III) bei pH 12 (C und D) und Absorption Spektren vergleichen BSA, BSA-Au, BSA-Cu(II)/Ni(II) und BSA-Cu(II)/Ni(II)-Au(III) (E und F). Kurve 4 wird mit der Überlagerung von Kurven 2 und 3 verglichen. Diese Zahl wurde geändert von Dixon, J. M. & Egusa, S. J. ÄV Chem Soc. 140 2265-2271, (2018). Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 4. EEM der Cys34 gekappt und alle Thiole gekappt. EEM (Anregung: 300-500 nm, Emission: 300-700 nm) (A) Cys34-capped BSA reagierte mit Au bei pH 12. (B) alle Cys-Cys-Disulfid-Bindungen in BSA waren gespalten und dann wurde die All-Thiol-begrenzt-BSA reagierten mit Au bei pH 12. Diese Zahl wurde geändert von Dixon, J. M. & Egusa, S. J. ÄV Chem Soc. 140 2265-2271, (2018). Bitte klicken Sie hier für eine größere Version dieser Figur.
Diskussion
Die BSA-Au(III) Verbindungen vorbereitet bei pH 12 weisen rote Fluoreszenz bei einer Emissionswellenlänge λEm= 640 nm bei Erregung mit ultravioletten (UV) Licht λex= 365 nm (Abbildung 1A). Die Entstehung der rote Fluoreszenz ist ein langsamer Prozess und dauert ein paar Tage bei Raumtemperatur bis zu einer maximalen Intensität zu erhöhen. Läuft die Reaktion bei 37 ° C wird die optimale Ergebnisse liefern, obwohl höherer Temperatur verwendet werden kann, um die rote Fluoreszenz schneller zu produzieren. Irreversible Schädigung des Proteins kann bei Temperaturen über 45 ° C23auftreten. Die Einstellung des pH-Wertes, so dass BSA seine im Alter (pH-Wert > 10 verwandelt) Konformation21 ("A-Form") ist entscheidend für rote Fluoreszenz; pH ist fein aus neutralen Basis zu bestimmen, die Schwelle des Auftretens der rote Fluoreszenz (Abbildung 1 b, C) angepasst. Für maximale rote Fluoreszenz Intensität sollte der pH-Wert über 11 eingestellt. Für rote Fluoreszenz ist der pH-Wert über 11, einstellbar, obwohl extrem Basic (pH > 13) Bedingungen können BSA denaturieren und rote Fluoreszenz verursachen zu verschwinden.
Variation der stöchiometrischen Verhältnis von BSA und Au kann die Bindung von Au, BSA verdeutlichen. Die Fluoreszenz-Spektren der BSA-Au(III) Verbindungen variieren je nach der stöchiometrischen Verhältnis von BSA, Au (Abbildung 2). Wie die BSA gold-Verhältnis um 01:26 angepasst, wird ein Maximum an rote Fluoreszenzintensität beobachtet bei λex= 500 nm. Auf der anderen Seite, wie das BSA:gold-Verhältnis auf 1:7, rote Fluoreszenz justiert ist in erster Linie an λexbeobachtet = 365 nm. Keine rote Fluoreszenz detektiert werden in einem Verhältnis von BSA au weniger als 1:7 oder höher 01:52. Die minimale Anzahl von gold-kationen erforderlich, produzieren die rote Fluoreszenz ist weniger als 7 und mehr als 1, und die maximale Teilnehmerzahl für den Verlust der rote Fluoreszenz ist größer als 52 (Abb. 2 b, C). Darüber hinaus wird die Reduktion aller oben genannten Proben auftreten unter überschüssige Natriumborohydrid, Aufklärung, daß alle Proben noch kationischen Au(III) enthalten. Darüber hinaus kann die Zugabe von überschüssigen Mengen an Gold über 20 mM die Lösung zu übersäuern und das Protein denaturieren. Wenn Protein-Denaturierung durch Übersäuerung auftritt, reduzieren Sie die Konzentration der BSA und Au relativ zu diesem Thema zu vermitteln.
Wettbewerbsfähige Bindung der Afrikanischen Union und anderen Metallkationen, BSA kann die Bindungsstellen im BSA verdeutlichen. Es ist bekannt, dass 600-fache und Ni(II) an die Asp binden Fragment am N-Terminus von BSA24,25,26,27. Durch die Zugabe von 600-fache, ein starkes Bindemittel an das Asp-Fragment, gefolgt von dem Zusatz von Au(III), sind die Absorption Spektren von BSA-Cu(II)-Au(III) und die Absorption Spektren von BSA-Au(III) und BSA-Cu(II) die gleichen - darauf hinweist, dass Gold und Kupfer nicht konkurrieren Sie um die gleiche Bindungsstelle an der Asp-Fragment (Abbildung 3). NI(II) bindet schwach an das Asp-Fragment und daher Au(III) konkurriert mit Ni(II) wie Gold hinzugefügt wird; Es wurde beobachtet, dass die Absorption Spektren von BSA-Ni(II) und BSA-Au(III) korreliert nicht mit der BSA-Ni(II)-Au(III) (Abbildung 3F). Durch die oben genannten Protokoll kann man zeigen, wie Au(III) an der bekannten Bindungsstelle des BSA bindet. Diese Technik erfordert auch die Einstellung des pH-Wertes über 11 und die Technik wird geändert, indem Sie zweimal die Konzentration an BSA aber mit halber Lautstärke, so sollte dies bei niedrigen BSA Au-Verhältnisse die Protein-Konformation weiterhin durchgeführt werden.
Ändern von Cystein-Rückständen in BSA kann die Au-Bindungsstellen weiter aufzuklären. Gold ist bekannt, dass eine hohe Affinität für Thiol28 und BSA besitzt eine Oberfläche zugänglich Thiol (Cys34)21. Durch die Sperrung dieser Thiol, können sekundäre Bindungsstellen aufgeklärt werden. Die Blockierung dieser Cystein erfolgt vor der Zugabe von Au(III) auf die Probe und zeigt eine veränderte Fluoreszenz-Muster von BSA-Au(III), zeigt einen möglichen Transfer Weg in den Mechanismus der rote Fluoreszenz (Abb. 4A) beteiligt. Es ist zwingend notwendig, um die Thiol blockierungsmittel, in diesem Fall NEM, bei einem neutralen pH-Wert hinzufügen. Spalten alle Disulfid-Bindungen und die anschließende Deckelung der ihre freie Thiol-Gruppen zeigt keine rote Fluoreszenz (Abbildung 4 b). Diese Ergebnisse zeigen, dass eine Disulfid Bindung erforderlich, einen roten fluoreszierenden Komplex zu produzieren ist.
Wir haben bewiesen, in verschiedenen Protokollen, durch den Einsatz von spektroskopischen und Protein Chemie Techniken, eine Methode, die komplexe BSA-Au(III) zu analysieren. Protein-Chemie-Techniken enthaltenen haben nicht in der Protein-basierten Nano-Materialien Forschung14verbreitet. Diese Techniken können in der Regel anwendbar sein und wertvoll für die Bindung von Metallen-Prozess und die möglichen Bindungsstellen in anderen zu verstehen, wenn nicht sogar alle Proteine wie Pepsin, Trypsin, Lysozym und Transferrin17,29. Proteine sind dynamisch und dennoch sehr präzise "Nano-Materialien". Detailliertes Verständnis der Metall Bindungsstelle könnte den Weg für neue Protein-basierten Materialien mit gesteuerten optischen Eigenschaften mit unzähligen Einsatzmöglichkeiten ebnen.
Offenlegungen
Die Autoren haben nichts preisgeben.
Danksagungen
S.E anerkennt die Unterstützung von Duke Stiftungsfonds besondere Initiative, Wells Fargo Fonds, PhRMA Stiftung sowie Startup-Fonds von der University of North Carolina, Charlotte.
Materialien
| Name | Company | Catalog Number | Comments |
| Bovine Serum Albumin (BSA), 96% | Sigma-Aldrich | A5611 | |
| gold (III) chloride trihydrate, 99.9% | Sigma-Aldrich | 520918 | |
| Copper (II) chloride dihydrate, 99.999% | Sigma-Aldrich | 459097 | |
| Nickel (II) chloride hexahydrate, 99.9% | Sigma-Aldrich | 654507 | |
| N-Ethylmaleimide (NEM), >99.0% | Sigma-Aldrich | 4259 | |
| Tris(2-carboxyethyl)phosphine hydrochloride (TCEP), >98.0% | Sigma-Aldrich | C4706 | |
| Sodium hydroxide, >98.0% | Sigma-Aldrich | S8045 | |
| Urea, 99.5% | Chem-Implex Int'l | 30142 | |
| Phospate buffered saline (PBS) | Corning | MT21040CV | |
| Ammonium bicarbonate, 99.5% | Sigma-Aldrich | 9830 |
Referenzen
- Xie, J., Zheng, Y., Ying, J. Y. Protein-Directed Synthesis of Highly Fluorescent Gold Nanoparticles. Journal of the American Chemical Society. 131, 888-889 (2009).
- Saha, K., Agasti, S. S., Kim, C., Li, X., Rotello, V. M. Gold Nanoparticles in Chemical and Biological Sensing. Chemical Reviews. 112, 2739-2779 (2012).
- Zhang, Y., et al. New Gold Nanostructures for Sensor Applications: A Review. Materials. 7, 5169-5201 (2014).
- Chen, L. -. Y., Wang, C. -. W., Yuan, Z., Chang, H. -. T. Fluorescent Gold Nanoclusters: Recent Advances in Sensing and Imaging. Analytical Chemistry. 87 (1), 216-229 (2015).
- Cai, W., Gao, T., Hong, H., Sun, J. Applications of Gold Nanoparticles in Cancer Nanotechnology. Nanotechnology, Science and Applications. 1, 17-32 (2008).
- Nune, S. K., et al. Nanoparticles for Biomedical Imaging. Expert Opinion on Drug Delivery. 6, 1175-1194 (2009).
- Dorsey, J. F., et al. Gold Nanoparticles in Radiation Research: Potential Applications for Imaging and Radiosensitization. Translational Cancer Research. 2, 280-291 (2013).
- Daniel, M. -. C., Astruc, D. Gold Nanoparticles: Assembly, Supramolecular Chemistry, Quantum-Size-Related Properties, and Applications toward Biology, Catalysis, and Nanotechnology. Chemical Reviews. 104 (1), 293-346 (2004).
- Ferrari, M. Cancer Nanotechnology: Opportunities and Challenges. Nature Reviews Cancer. 5, 161-171 (2005).
- Huang, X., Jain, P. K., El-Sayed, I. H., El-Sayed, M. A. Gold Nanoparticles: Interesting Optical Properties and Recent Applications in Cancer Diagnostics and Therapy. Nanomedicine. 2, 681 (2007).
- Arvizo, R., Bhattacharya, R., Mukherjee, P. Gold Nanoparticles: Opportunities and Challenges in Nanomedicine. Expert Opinion on Drug Delivery. 7, 753-763 (2010).
- Doane, T. L., Burda, C. The Unique Role of Nanoparticles in Nanomedicine: Imaging, Drug Delivery and Therapy. Chemical Society Reviews. 41, 2885 (2012).
- Egusa, S., Ebrahem, Q., Mahfouz, R. Z., Saunthararajah, Y. Ligand Exchange on Gold Nanoparticles for Drug Delivery and Enhanced Therapeutic Index Evaluated in Acute Myeloid Leukemia Models. Experimental Biology and Medicine. 239, 853 (2014).
- Qu, X., et al. Fluorescent Gold Nanoclusters: Synthesis and Recent Biological Application. Journal of Nanomaterials. (784097), (2015).
- Chakraborty, I., Pradeep, T. Atomically Precise Clusters of Noble Metals: Emerging Link between Atoms and Nanoparticles. Chemical Reviews. 117, 8208-8271 (2017).
- Raut, S., et al. Evidence of energy transfer from tryptophan to BSA/HSA protected gold nanoclusters. Methods and Applications in Fluorescence. 2, (2014).
- Le Guével, X., Daum, N., Schneider, M. Synthesis and Characterization of Human Transferrin-Stabilized Gold Nanoclusters. Nanotechnology. 22 (27), (2011).
- Kawasaki, H., Yoshimura, K., Hamaguchi, K., Arakawa, R. Trypsin-Stabilized Fluorescent Gold Nanocluster for Sensitive and Selective Hg2+ Detection. Analytical Sciences. 27 (6), 591 (2011).
- Lu, D., et al. Lysozyme-Stabilized Gold Nanoclusters as a Novel Fluorescence Probe for Cyanide Recognition. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy. 121, 77-80 (2014).
- Dixon, J. M., Egusa, S. Conformational Change-Induced Fluorescence of Bovine Serum Albumin-Gold Complexes. Journal of the American Chemical Society. 140, 2265-2271 (2018).
- Peters, T. . All About Albumin. , (1996).
- Masuoka, J., Saltman, P. Zinc(II) and Copper(II) Binding to Serum Albumin. A Comparative Study of Dog, Bovine, and Human Albumin. Journal of Biological Chemistry. 269, 25557-25561 (1994).
- Takeda, K., Wada, A., Yamamoto, K., Moriyama, Y., Aoki, K. Conformational Change of Bovine Serum Albumin by Heat Treatment. Journal of Protein Chemistry. 8 (5), 653-659 (1989).
- Klotz, I. M., Curme, H. G. The Thermodynamics of Metallo-protein Combinations. Copper with Bovine Serum Albumin. Journal of the American Chemical Society. 70, 939-943 (1948).
- Fiess, H. A., Klotz, I. M. The Thermodynamics of Metallo-Protein Combinations. Comparison of Copper Complexes with Natural Proteins. J. Am. Chem. Soc. 74, 887-891 (1952).
- Rao, M. S. N. A Study of the Interaction of Nickel(II) with Bovine Serum Albumin. Journal of the American Chemical Society. 84, 1788-1790 (1962).
- Peters, T., Blumenstock, F. A. Copper-Binding Properties of Bovine Serum Albumin and Its Amino-terminal Peptide Fragment. Journal of Biological Chemistry. 242, 1574-1578 (1967).
- Xue, Y., Li, X., Li, H., Zhang, W. Quantifying Thiol-Gold Interactions towards the Efficient Strength Control. Nature Communications. 5, 4348 (2014).
- Xu, Y., et al. The Role of Protein Characteristics in the Formation and Fluorescence of Au Nanoclusters. Nanoscale. 6 (3), 1515-1524 (2014).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten