Method Article
Luminophore 金の結合によるウシ血清アルブミンの様々 な立体構造の形成
要約
金陽イオン (Au(III)) ウシ血清アルブミン (BSA) としてコンフォメーション依存のユニークな BSA Au 蛍光を特徴付けるのためのと同様、提示の様々 なコンフォメーションにバインディングを勉強のためのプロトコル。
要約
示されたプロトコルの目的は BSA、構造変更によって誘発される赤い蛍光を降伏への金 (iii) バインドのプロセスを研究する (λem = 640 nm) BSA-Au(III) 複合体の。メソッドは、赤い蛍光性の出現は、BSA のコンホメーションの pH による平衡遷移と相関していることを表示するために pH を調整します。赤蛍光 BSA-Au(III) 複合体は、BSA の「A フォーム」の構造に対応する pH 9.7、以上の調整でのみ形成できます。Au のモル比に BSA を調整して錯結合のプロセスの経過を監視するためのプロトコルを説明するとします。BSA、赤色の蛍光を出すあたり金 (iii) の最小数は、7 時より小さいです。BSA に複数の金 (iii) 結合部位の存在を説明するための手順でプロトコルについて述べる。まず、銅を追加することによって (Cu(II)) またはニッケル (Ni(II)) 陽イオン錯に続いて、この方法については明らかに結合部位錯赤の蛍光体ではないです。第二に、チオール保護剤によって BSA を変更して、別の nonfluorophore 形成錯結合部位が明らかにされます。第三に、BSA の構造を変更するには、切断とキャッピングの二硫化物結束の可能な錯結合サイトを示します。BSA のコンホメーションと錯バインディングを制御する、説明されたプロトコルは、他のタンパク質と金属イオンとの相互作用を研究に一般に適用できます。
概要
Uv (紫外線) を出展 BSA Au 化合物-顕著なと興奮の赤蛍光ストークス シフト、もともと謝らによって合成されています。1一意かつ安定した赤い蛍光センシング2,3,4の5,6、7、やナノメディシン8 のイメージングなどの分野でさまざまなアプリケーションを検索できます。 ,9,10、11,12,13。この化合物は、近年14,,1516ナノサイエンスの分野で多くの研究者によって広く研究されています。BSA Au 化合物は、Au25ナノクラ スターとして解釈されています。本手法の目標して詳細にこの化合物を調べ、赤い蛍光性の起源を理解することです。提示されたアプローチで、複数の Au 結合部位の存在と蛍光、Au25ナノクラ スターの単一サイトの核に代わるものの起源を示すことができます。その他タンパク質17,18,19金 (iii) との複合体の本質的な蛍光特性を変更する方法を勉強する、同じアプローチを使用できます。
赤蛍光 BSA Au 化合物の合成には、Au (BSA:Au) の蛍光強度と励起発光マップ (EEM)20のピークの場所を最大限に BSA のモル比の狭いコントロールが必要です。それ示すことができる、バインドする錯の複数の結合部位が存在するアスパラギン フラグメント (または Asp フラグメント、BSA の N 末端の最初の 4 つのアミノ酸残基) を含む21,22。金 (iii) を調整して赤 fluorescence([Cys34-capped-BSA]-Au(III))20の機構に関与する、BSA (システイン-34) の 34番目のアミノ酸も表示されます。すべてのシステイン Cys ジスルフィド結合を切断、すべてチオール、赤い蛍光をキャッピングは作り出された ([all-thiol-capped-BSA]-Au(III))。これは赤色の蛍光を生成する錯結合部位としてシステイン Cys 二硫化物結束の必要性を示します。
タンパク質化学の技術は、ナノ科学コミュニティの BSA-Au(III) 錯体の研究に広く使用していないされています。ただし、これらの複合体、同様 BSA 錯結合部位の詳細な理解を得るための特定の側面を理解するこれらの技術を採用する価値のあること。この資料は、これらの技術のいくつかを示すものです。
プロトコル
1. BSA-Au(III) 複合体の合成
- 高速液体クロマトグラフィー (HPLC) グレード水 5 mL 反応瓶で 1 mL に BSA の 25 mg を溶解します。
注: ソリューションが明確に表示されます。 - 金 (III) 塩化物三水和物 (塩化金酸) を 5 mM HPLC グレードの水の濃度に溶解します。
注: ソリューションは黄色で表示されます。この濃度で塩化金酸溶液は Au 比 1:13、BSA になります。- また、どこの濃度と塩化金酸の溶液を調製 0.38 ミリメートルの間 (BSA:Au = 1:1) 20 mm (BSA:Au = 1:50) hplc グレードの水。
注: 異なるギア比の BSA のゴールドは励起発光マップの大幅に異なる赤蛍光パターンになります。
- また、どこの濃度と塩化金酸の溶液を調製 0.38 ミリメートルの間 (BSA:Au = 1:1) 20 mm (BSA:Au = 1:50) hplc グレードの水。
- 37 ° C の水浴の BSA の反応バイアルを置き、精力的に磁性攪拌器を使用して 750 rpm で攪拌します。
- 攪拌を開始した後すぐに 1 mL の塩化金酸をソリューションに追加します。ソリューションの色は、黄色にクリアから変換する必要があります。
- 磁性攪拌器を使用して 750 rpm、37 ° C で 2 分の混合物をかき混ぜなさい。
- 反応バイアルに 1 M NaOH の 100 μ L を 12 の pH をもたらすにソリューションに追加します。
注: 水酸化ナトリウムを追加すると、直後にソリューションする必要があります黄色茶色に少し暗くなるし、黄色に再度オンします。 - 2 h 750 rpm、37 ° C で攪拌し続けるソリューションは黄色から濃い黄色/茶色色にゆっくりと変更ください。この色の変化は、複雑な赤の蛍光 BSA-Au(III) の形成を示します。
- 2 日間室温で放置し、サンプルを許可するソリューションは引き続き黄色茶色に暗くし、蛍光強度が増加します。
- また、ソリューションの色が黄色茶色に進化するにつれてより多くの h を 12 の 37 ° C で攪拌し続けるサンプルをしましょう。
2. BSA-Cu(II)-Au(III) の合成
- HPLC グレードの水 1 mL に BSA の 25 mg を溶解します。ソリューションが明確に表示されます。
- 5 mM の濃度に HPLC グレードの水で銅の (II) 塩化物水和物を溶解します。ソリューションは、光を表示する必要があります青。
- 5 mL の反応バイアルに BSA 溶液の 1 mL を追加し、37 ° C の水浴の配置750 rpm で混合物をかき混ぜます。
- すぐに反応バイアルに銅の (II) 塩化物水和物溶液 0.5 mL を加え、2 分混ぜます。ソリューションは引き続きライト ブルー。
- 12 の pH をもたらすし、2 h のミックスすることができます 1 M NaOH の 75 μ L を追加します。ソリューションは、紫色になります。
- 5 mM の濃度に HPLC グレードの水で塩化金酸を溶解します。
- 反応バイアルに水溶液中の塩化金酸 0.5 mL を追加し、1 M NaOH を使用して 12 に pH を調整します。
- 2 h の反応混合物をかき混ぜなさい。
注: ソリューションは、茶色の色に進化すべき。
3. BSA-Ni(II)-Au(III) の合成
- HPLC グレードの水 1 mL に BSA の 25 mg を溶解します。ソリューションが明確に表示されます。
- 5 mM の濃度に HPLC グレードの水のニッケル (II) 塩化物水和物を溶解します。ソリューションは、光を表示する必要がありますグリーン。
- 5 mL 反応バイアルに BSA 溶液の 1 mL を追加し、水浴に 37 oC. 炒め 750 rpm で混合物を置きます。
- すぐに反応バイアルおよび 2 分のミックスにニッケル (II) 塩化物水和物溶液 0.5 mL を追加します。
注: ソリューションのままライト グリーン。 - 12 の pH をもたらすし、2 h のミックスすることができます 1 M NaOH の 75 μ L を追加します。
注: ソリューションは、濃い黄色になります。 - 5 mM の濃度に HPLC グレードの水で塩化金酸を溶解します。
- 反応バイアルに水溶液中の塩化金酸 0.5 mL を追加し、12 に pH を調整します。
- 2 h の反応混合物をかき混ぜなさい。
注: ソリューションは、茶色の色に進化すべき。
4. [Cys34-capped-BSA]-Au(III) の合成
- N-エチルマレイミド (NEM) 2 mg をリン酸緩衝生理食塩水 (PBS、pH 7.4) 1 mL に溶かしてください。
- PBS NEM 溶液 1 mL に BSA の 2 mg を溶解します。
- 5 mL の反応バイアルに溶液を移し、1 時間 500 rpm で 20 ° C でかき混ぜます。
- 500 mL の PBS、未反応 NEM を削除する一晩マグネチックスターラーで攪拌 50 回転で 12 kDa の透析チューブを使用して、ソリューションを dialyze します。
- 0.4 mM の濃度に PBS で塩化金酸を溶解します。
注: ソリューションは、淡い黄色になります。 - 反応バイアルを 37 ° C の水浴に転送します。750 rpm で攪拌します。
- すぐに反応バイアルに塩化金酸溶液の 1 mL を追加し、2 分のミックスすることができます。
- 12 の pH をもたらすし、2 h のミックスすることができます反応バイアルに 1 M 水酸化ナトリウムの 75 μ L を追加します。
5. [all-thiol-capped-BSA]-Au(III) の合成
- 2 M 尿素と 50 mM 重炭酸アンモニウム (NH4HCO3、pH 8.0) HPLC グレードの水のソリューションを準備します。
- 上記のソリューションと 5 mL の反応バイアルへの転送の 1 mL に BSA の 3.3 mg を溶解します。
- 0.25 M の原液を作る tris(2-carboxyethyl) HPLC 水 1 mL で TCEP 62.5 mg を溶解してホスフィン (TCEP)。
- TCEP の最終濃度が 8 mM になるまで反応バイアルに TCEP の原液を追加します。
- 50 ° C で 1 時間湯せんでソリューションを孵化させなさい磁性攪拌器を使用して 500 rpm で攪拌します。
- 完全に部屋の温度に冷却ソリューションを許可します。
- HPLC グレードの水の 1 mL の NEM の 12.5 mg を溶解することにより 100 mM NEM の原液を準備します。
- NEM の最終濃度が 16 mM まで反応バイアルに NEM の原液を追加します。
- 20 ° C で 2 時間を結合するソリューションを許可します。500 rpm で攪拌します。
- 過剰な TCEP、満場一致、尿素を削除する 50 mM NH4HCO3の 500 mL で一晩マグネチックスターラーで 50 rpm で液を攪拌 12 kDa の透析の管を使用して、ソリューションを dialyze します。
- 反応バイアルを 37 ° C で水のお風呂に移動し、750 rpm で攪拌します。
- 0.66 mM の濃度に HPLC グレードの水で塩化金酸を溶解します。
- すぐに反応バイアルに塩化金酸溶液の 1 mL を追加し、2 分のミックスすることができます。
- 解決の pH は 12 まで 1 M NaOH を追加し、2 h ミックスし続けるソリューションします。
結果
BSA-Au(III) 複合体の蛍光からそれが観測されています BSA の本質的な青色蛍光の変換 (λem = 400 nm) 赤い蛍光 (λem = 640 nm) pH 9.7 平衡については、遷移 (図 1)。BSA-Au(III) EEM Au モル比異なる BSA では図 2に示すように、このデータは、どのように異なる励起波長で同じ発光波長が得られますモル比を変更することを示しています。金 (iii)、ni (ii), 銅 (ii) は、競争力のある BSA (図 3) で知られているサイト (Asp フラグメント) にバインドします。Cys34 キャップ BSA 錯結合 EEM ピーク パターンの変更を示しています、これらの結果を示す蛍光パターンを変更する特定の結合部位の変更方法。すべてチオール頂いた BSA は、赤い蛍光性を示さないし、赤の蛍光体 (図 4) を生成するバインドできるサイトとしてシステイン Cys ジスルフィド結合を明らかにします。

図 1。BSA-Au(III) と、構造の蛍光励起青から赤への変更(A) 吸光度、蛍光 (ex λ= 365 nm) の BSA-Au(III)。(B) 赤蛍光人間 pH 9.7、周辺で出現する BSA のコンフォメーションが変化します。(C) 出てくる赤い蛍光性と蛍光減衰を青。この図の拡大版を表示するのにはここをクリックしてください。

図 2。BSA-Au(III) の励起発光比率メトリック地図 (EEM) の測定。EEM の BSA-Au(III) 複雑な BSA と金の比率を調整しながら標準的なプロトコルを使用して合成しました。(A) BSA で pH 12、(B) BSA:Au = 1:1、(C) BSA:Au = 1:7、(D) BSA:Au = 1:13、(E) BSA:Au = 1:26、(F) BSA:Au = 1:30、(G) BSA:Au = 1:40、(H) BSA:Au = 1:52。この図の拡大版を表示するのにはここをクリックしてください。
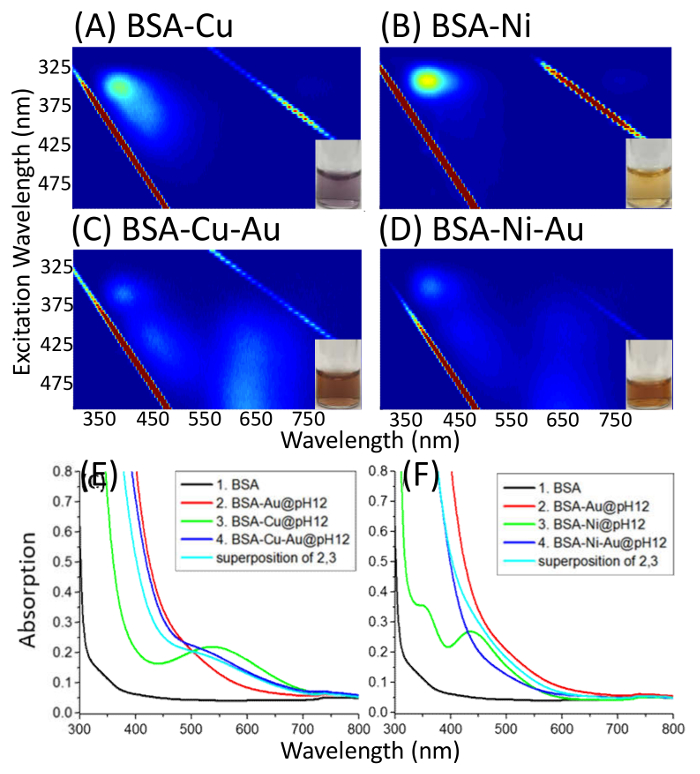
図 3。BSA-Cu(II)/Ni(II)-Au(III) EEM 錯体。マップを励起発光 (励起: 290-500 nm; 排出量: 300-850 nm) BSA 複合 pH 12 で Cu(II)/Ni(II) を (AおよびB)、BSA 複合体 Cu(II)/Ni(II) とし、pH が 12 で錯 (CとD)、吸収のスペクトル比較 BSA、BSA Au、BSA-Cu(II)/Ni(II)、BSA-Cu(II)/Ni(II)-Au(III) (EおよびF)。4 カーブは、カーブの 2 と 3 の重ね合わせと比較されます。この図は、ディクソン ・ j. m. s. 江草から変更されているj ・ アメリカ化学会140 2265-2271 (2018 年)。この図の拡大版を表示するのにはここをクリックしてください。

図 4。EEM の Cys34 キャップと頂いたすべてのチオール。EEM (励起: 300 ~ 500 nm; 排出量: 300-700 nm) ph 12 (A) の Cys34 キャップ BSA が Au と反応しました。(B) BSA のすべてのシステイン Cys ジスルフィド結合が切断され、すべて-チオール-キャップ-BSA は pH 12 で Au と反応しました。この図は、ディクソン ・ j. m. s. 江草から変更されているj ・ アメリカ化学会140 2265-2271 (2018 年)。この図の拡大版を表示するのにはここをクリックしてください。
ディスカッション
PH 12 で作製した BSA-Au(III) 化合物展示発光波長λemで赤い蛍光性 = 640 nm の紫外線 (UV) 光 λexで興奮すると = 365 nm (図 1 a)。赤い蛍光性の出現は遅いプロセスであり、最大の強度を高めるため室温で数日をかかります。赤の蛍光を高速生成する高温を利用できますが、37 ° C で反応を実行する最適な結果なります。2345 ° C 以上の温度で蛋白質の不可逆的な劣化が起こります。調整 pH の BSA は、その高齢者 (pH > 10) に変換、立体配座21 (「A フォーム」) は赤い蛍光性のための重要なpH は中性から出現する赤い蛍光性 (図 1 bC) のしきい値を決定する基本的な細かく調整されます。最大の赤色蛍光強度、pH は 11 の上調整してください。赤い蛍光性が基本 (pH > 13) 条件ことができます BSA を変性、消えて赤い蛍光が発生非常に 11、を超えて pH を調整できます。
BSA と Au の化学量論比を変化させると、BSA に Au のバインディングが説明することが。BSA-Au(III) 化合物の蛍光スペクトルは、Au (図 2) BSA の化学量論比によって異なります。赤の蛍光強度の最大値がλexで観測された 1:26 に BSA ゴールド比を調節すると、= 500 nm。一方、1:7、赤い蛍光 BSA:gold 比を調整する際は観測主にex λ= 365 nm。Au 未満 1:7 以上 1:52 に BSA の比でない赤い蛍光を検出できます。金の陽イオンの最小数が必要なは、赤を生成する蛍光、7 未満と以上 1、赤い蛍光性の損失のための最大数が 52 (図 2 b, C) より大きい。さらに、前述のすべてのサンプルの削減が過剰なナトリウム水素化ホウ素、すべてのサンプルがまだ錯陽イオンを含む解明の下で発生します。さらに、金 20 mM を超えての過剰添加は、解決策も酸性になるし、タンパク質の変性を引き起こす可能性が。高酸度によるタンパク質変性が発生した場合は、BSA と Au は、比較的この問題を仲介する濃度を低減します。
Au と BSA に他の金属イオンの結合は、BSA の結合部位を示すことができます。銅 (ii) と ni (ii) の両方が Asp にバインドすると知られている BSA24,25,26,27の N 末端フラグメント。銅 (ii) 錯の添加に続いて、Asp フラグメントに強力なバインダーの添加による BSA-Cu(II)-Au(III) の吸光度スペクトルと BSA-Au(III) と BSA-Cu(II) の吸光度スペクトルが同じ - 金と銅がないことを示すAsp フラグメント (図 3) で同じ部位を競います。Ni (ii) は弱く Asp フラグメントにバインドし、したがって金 (iii) と競合している ni (ii) 金が追加されます。BSA-Ni(II)-Au(III) (図 3 f) の BSA-Ni(II) と BSA-Au(III) の吸光度スペクトルが関連付けないことが観察されています。上記のプロトコルを介して錯が BSA の既知のバインディング サイトにバインドする方法を示すことができる 1 つ。この手法も 11 を超える pH の調整が必要しテクニックは 2 倍濃度を BSA に追加することによって変更が、半分のボリュームに従ってこの対象となるタンパク質の立体構造を維持するために Au 比低 BSA で。
BSA のシステイン残基を変更することができますさらに Au 結合部位を解明します。ゴールドはチオール28の高親和性を有する、BSA (Cys34)21日表面アクセスできるチオールを所有しています。このチオールのブロックを介してセカンダリ結合部位解明されうる。このシステインのブロックがサンプルに金 (iii) を添加する前に行われ、赤い蛍光性 (図 4 a) の機構に関与する転送経路を示す BSA-Au(III) の改変蛍光パターンを示しています。この場合は満場一致、中性 pH にチオール ブロッキング エージェントを追加することが不可欠です。すべてのジスルフィド結合と後続を制限、無料のチオール グループを明らかにしない赤い蛍光性 (図 4 b) を切断します。ジスルフィド結合は赤い蛍光錯体を生成する必要があるされました。
分光法を使用して、さまざまなプロトコルで私たちを示しているとタンパク質化学の技術、BSA-Au(III) 複合体を解析する手法。蛋白質ベースのナノ材料研究14での提示したタンパク質化学の技術が広く使用されていません。これらの技術は、一般的に適用されるでき、場合すべて、トランスフェリン、リゾチーム、ペプシン、トリプシンの17,29等のタンパク質、金属結合プロセスとその他、可能な結合部位を理解する価値があります。タンパク質は、ダイナミックなまだ非常に正確な「ナノ材料」です。金属結合部位の詳細を理解は、潜在的なアプリケーションの制御光学特性に無数の新しい蛋白質ベース素材へ道を開く可能性があります。
開示事項
著者が明らかに何もありません。
謝辞
東南は、シャーロットからデューク特別なイニシアチブ基金、ウェルズ ファーゴ基金 PhRMA 財団、スタートアップ資金、ノースカロライナの大学からの支援を認めています。
資料
| Name | Company | Catalog Number | Comments |
| Bovine Serum Albumin (BSA), 96% | Sigma-Aldrich | A5611 | |
| gold (III) chloride trihydrate, 99.9% | Sigma-Aldrich | 520918 | |
| Copper (II) chloride dihydrate, 99.999% | Sigma-Aldrich | 459097 | |
| Nickel (II) chloride hexahydrate, 99.9% | Sigma-Aldrich | 654507 | |
| N-Ethylmaleimide (NEM), >99.0% | Sigma-Aldrich | 4259 | |
| Tris(2-carboxyethyl)phosphine hydrochloride (TCEP), >98.0% | Sigma-Aldrich | C4706 | |
| Sodium hydroxide, >98.0% | Sigma-Aldrich | S8045 | |
| Urea, 99.5% | Chem-Implex Int'l | 30142 | |
| Phospate buffered saline (PBS) | Corning | MT21040CV | |
| Ammonium bicarbonate, 99.5% | Sigma-Aldrich | 9830 |
参考文献
- Xie, J., Zheng, Y., Ying, J. Y. Protein-Directed Synthesis of Highly Fluorescent Gold Nanoparticles. Journal of the American Chemical Society. 131, 888-889 (2009).
- Saha, K., Agasti, S. S., Kim, C., Li, X., Rotello, V. M. Gold Nanoparticles in Chemical and Biological Sensing. Chemical Reviews. 112, 2739-2779 (2012).
- Zhang, Y., et al. New Gold Nanostructures for Sensor Applications: A Review. Materials. 7, 5169-5201 (2014).
- Chen, L. -Y., Wang, C. -W., Yuan, Z., Chang, H. -T. Fluorescent Gold Nanoclusters: Recent Advances in Sensing and Imaging. Analytical Chemistry. 87 (1), 216-229 (2015).
- Cai, W., Gao, T., Hong, H., Sun, J. Applications of Gold Nanoparticles in Cancer Nanotechnology. Nanotechnology, Science and Applications. 1, 17-32 (2008).
- Nune, S. K., et al. Nanoparticles for Biomedical Imaging. Expert Opinion on Drug Delivery. 6, 1175-1194 (2009).
- Dorsey, J. F., et al. Gold Nanoparticles in Radiation Research: Potential Applications for Imaging and Radiosensitization. Translational Cancer Research. 2, 280-291 (2013).
- Daniel, M. -C., Astruc, D. Gold Nanoparticles: Assembly, Supramolecular Chemistry, Quantum-Size-Related Properties, and Applications toward Biology, Catalysis, and Nanotechnology. Chemical Reviews. 104 (1), 293-346 (2004).
- Ferrari, M. Cancer Nanotechnology: Opportunities and Challenges. Nature Reviews Cancer. 5, 161-171 (2005).
- Huang, X., Jain, P. K., El-Sayed, I. H., El-Sayed, M. A. Gold Nanoparticles: Interesting Optical Properties and Recent Applications in Cancer Diagnostics and Therapy. Nanomedicine. 2, 681(2007).
- Arvizo, R., Bhattacharya, R., Mukherjee, P. Gold Nanoparticles: Opportunities and Challenges in Nanomedicine. Expert Opinion on Drug Delivery. 7, 753-763 (2010).
- Doane, T. L., Burda, C. The Unique Role of Nanoparticles in Nanomedicine: Imaging, Drug Delivery and Therapy. Chemical Society Reviews. 41, 2885(2012).
- Egusa, S., Ebrahem, Q., Mahfouz, R. Z., Saunthararajah, Y. Ligand Exchange on Gold Nanoparticles for Drug Delivery and Enhanced Therapeutic Index Evaluated in Acute Myeloid Leukemia Models. Experimental Biology and Medicine. 239, 853(2014).
- Qu, X., et al. Fluorescent Gold Nanoclusters: Synthesis and Recent Biological Application. Journal of Nanomaterials. (784097), (2015).
- Chakraborty, I., Pradeep, T. Atomically Precise Clusters of Noble Metals: Emerging Link between Atoms and Nanoparticles. Chemical Reviews. 117, 8208-8271 (2017).
- Raut, S., et al. Evidence of energy transfer from tryptophan to BSA/HSA protected gold nanoclusters. Methods and Applications in Fluorescence. 2, (2014).
- Le Guével, X., Daum, N., Schneider, M. Synthesis and Characterization of Human Transferrin-Stabilized Gold Nanoclusters. Nanotechnology. 22 (27), (2011).
- Kawasaki, H., Yoshimura, K., Hamaguchi, K., Arakawa, R. Trypsin-Stabilized Fluorescent Gold Nanocluster for Sensitive and Selective Hg2+ Detection. Analytical Sciences. 27 (6), 591(2011).
- Lu, D., et al. Lysozyme-Stabilized Gold Nanoclusters as a Novel Fluorescence Probe for Cyanide Recognition. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy. 121, 77-80 (2014).
- Dixon, J. M., Egusa, S. Conformational Change-Induced Fluorescence of Bovine Serum Albumin-Gold Complexes. Journal of the American Chemical Society. 140, 2265-2271 (2018).
- Peters, T. Jr All About Albumin. , (1996).
- Masuoka, J., Saltman, P. Zinc(II) and Copper(II) Binding to Serum Albumin. A Comparative Study of Dog, Bovine, and Human Albumin. Journal of Biological Chemistry. 269, 25557-25561 (1994).
- Takeda, K., Wada, A., Yamamoto, K., Moriyama, Y., Aoki, K. Conformational Change of Bovine Serum Albumin by Heat Treatment. Journal of Protein Chemistry. 8 (5), 653-659 (1989).
- Klotz, I. M., Curme, H. G. The Thermodynamics of Metallo-protein Combinations. Copper with Bovine Serum Albumin. Journal of the American Chemical Society. 70, 939-943 (1948).
- Fiess, H. A., Klotz, I. M. The Thermodynamics of Metallo-Protein Combinations. Comparison of Copper Complexes with Natural Proteins. J. Am. Chem. Soc. 74, 887-891 (1952).
- Rao, M. S. N. A Study of the Interaction of Nickel(II) with Bovine Serum Albumin. Journal of the American Chemical Society. 84, 1788-1790 (1962).
- Peters, T. Jr, Blumenstock, F. A. Copper-Binding Properties of Bovine Serum Albumin and Its Amino-terminal Peptide Fragment. Journal of Biological Chemistry. 242, 1574-1578 (1967).
- Xue, Y., Li, X., Li, H., Zhang, W. Quantifying Thiol-Gold Interactions towards the Efficient Strength Control. Nature Communications. 5, 4348(2014).
- Xu, Y., et al. The Role of Protein Characteristics in the Formation and Fluorescence of Au Nanoclusters. Nanoscale. 6 (3), 1515-1524 (2014).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved