Method Article
Luminophore formazione in varie conformazioni di albumina di siero bovino di legame dell'oro
In questo articolo
Riepilogo
I protocolli per studiare l'associazione di oro cationi (Au(III)) a varie conformazioni di albumina di siero bovino (BSA) come pure per caratterizzare la fluorescenza di BSA-Au unica dipendente conformazionale sono presentati.
Abstract
Lo scopo dei protocolli presentati è quello di studiare il processo di associazione Au(III) a BSA, cedendo la fluorescenza rossa indotta da cambiamento di conformazione (λem = 640 nm) dei complessi BSA-Au(III). Il metodo consente di regolare il pH per mostrare che l'emersione della fluorescenza rossa è correlato con le transizioni di equilibrio pH-indotta delle conformazioni BSA. Rosso fluorescente BSA-Au(III) complessi possono essere formati solo con un adeguamento del pH pari o superiore a 9.7, che corrisponde alla conformazione "A-form" di BSA. Il protocollo per regolare la BSA al rapporto molare Au e per monitorare il corso di tempo del processo di associazione Au(III) è descritto. Il numero minimo di Au(III) a BSA, per produrre la fluorescenza rossa, è meno di sette. Descriviamo il protocollo nei passaggi per illustrare la presenza di più siti di legame di Au(III) in BSA. Prima, con l'aggiunta di rame (Cu(II)) o nichel (cationi Ni(II)) seguiti da Au(III), questo metodo si rivela un sito di legame per Au(III) che non è il fluoroforo rosso. In secondo luogo, modificando tiolo tappatura agenti BSA, viene rivelato un altro sito di legame di Au(III) nonfluorophore-formanti. In terzo luogo, i dominî di BSA di sfaldatura e tappatura dei legami disolfuro, sono illustrati i possibili siti di associazione Au(III). Il protocollo descritto, per controllare le conformazioni di BSA e l'associazione Au(III), può essere generalmente applicato per studiare le interazioni di altre proteine e cationi metallici.
Introduzione
Un composto di BSA-Au esibendo un ultravioletto (UV)-eccitabile fluorescenza rossa, con notevole spostamento di stokes, è stato originariamente sintetizzato da Xie et al. 1. la fluorescenza rossa univoco e stabile può trovare varie applicazioni in campi quali rilevamento2,3,4,5,6,7o imaging nanomedicina8 ,9,10,11,12,13. Questo composto è stato studiato estesamente da molti ricercatori nel campo delle nano-scienze in ultimi anni14,15,16. Il composto di BSA-Au è stato interpretato come Au25 nanocluster. L'obiettivo del metodo presentato è per esaminare questo composto in dettaglio e per capire l'origine della fluorescenza rossa. Seguendo l'approccio presentato, la presenza di più siti di legame di Au e l'origine della fluorescenza, alternativa per la nucleazione di singolo sito di nanocluster di Au25 , possono essere illustrate. Lo stesso approccio può essere impiegato per studiare come altre proteine17,18,19 complessato con Au(III) può cambiare le loro proprietà intrinseche, fluorescente.
La sintesi del composto rosso fluorescente BSA-Au richiede un controllo stretto dei rapporti molari di BSA per Au (BSA:Au) per massimizzare l'intensità della fluorescenza e la posizione dei picchi a eccitazione-emissione mappa (EEM)20. Si può dimostrare che più siti di legame esistano per Au(III) per l'associazione, tra cui il frammento di asparagina (o frammento di Asp, i primi quattro residui dell'amminoacido al N-terminale di BSA)21,22. Dell'aminoacidoth 34 di BSA (Cys-34) è inoltre indicato per coordinare Au(III) e di essere coinvolti nel meccanismo del rosso fluorescence([Cys34-capped-BSA]-Au(III))20. Su tutti i ponti disolfuro Cys Cys di sfaldatura e tappatura tutti fluorescenza di tioli, rosso non è prodotta ([all-thiol-capped-BSA]-Au(III)). Questo indica la necessità di legami disolfuro Cys Cys come il sito di legame di Au(III) per produrre la fluorescenza rossa.
Tecniche di chimica della proteina non sono stati ampiamente utilizzati per studiare i complessi di BSA-Au(III) della comunità di nano-scienza. Tuttavia, sarebbe prezioso per impiegare queste tecniche per capire alcuni aspetti di questi complessi, nonché di acquisire una comprensione dettagliata delle sedi del legame di Au(III) in BSA. Questo articolo è destinato a mostrare alcune di queste tecniche.
Protocollo
1. sintesi del complesso BSA-Au(III)
- Sciogliere 25 mg di BSA in 1 mL di acqua di grado di cromatografia liquida ad alte prestazioni (HPLC) in un flaconcino di reazione da 5 mL.
Nota: La soluzione dovrebbe apparire chiara. - Sciogliere triidrato di oro (III) cloruro (acido cloroaurico) ad una concentrazione di 5 millimetri di acqua di grado HPLC.
Nota: La soluzione appare gialla. Soluzione di acido cloroaurico preparata a questa concentrazione si tradurrà in una BSA al rapporto tra Au 01:13.- In alternativa, preparare una soluzione di acido cloroaurico con una concentrazione di ovunque tra 0,38 mM (BSA:Au = 1:1) fino a 20 mM (BSA:Au = 01:50) in HPLC del grado dell'acqua.
Nota: Diversi rapporti di BSA all'oro si tradurrà in modelli drasticamente diversa fluorescenza rossa della mappa eccitazione-emissione.
- In alternativa, preparare una soluzione di acido cloroaurico con una concentrazione di ovunque tra 0,38 mM (BSA:Au = 1:1) fino a 20 mM (BSA:Au = 01:50) in HPLC del grado dell'acqua.
- Collocare il flaconcino di reazione di BSA in bagnomaria a 37 ° C e mescolare vigorosamente a 750 giri/min con un agitatore magnetico.
- Subito dopo inizia l'agitazione, aggiungere 1 mL di acido cloroaurico alla soluzione. Il colore della soluzione dovrebbe trasformare da incolore a giallo.
- Mescolare il composto per 2 min a 37 ° C e a 750 giri/min con un agitatore magnetico.
- Nella fiala di reazione, aggiungere 100 μL di 1 M NaOH alla soluzione per portare il pH a 12.
Nota: Immediatamente dopo l'aggiunta di NaOH, la soluzione dovrebbe scurire leggermente al giallo-marrone e poi tornare indietro al giallo. - Continuare a mescolare a 750 giri/min per 2 h e a 37 ° C. La soluzione dovrebbe cambiare lentamente dal giallo ad un colore giallo/marrone scuro. Questo cambiamento di colore indica la formazione del rosso fluorescenti BSA-Au(III) complesso.
- Lasciare riposare a temperatura ambiente per 2 giorni, il campione e la soluzione continuerà a scurire ad un marrone ambrato e aumenterà l'intensità di fluorescenza.
- In alternativa, lasciare il campione continuare a mescolare a 37 ° C per 12 h più come il colore della soluzione si evolve ad un'ambra marrone.
2. sintesi di BSA-Cu(II)-Au(III)
- Sciogliere 25 mg di BSA in 1 mL di acqua di grado HPLC. La soluzione dovrebbe apparire chiara.
- Sciogliere il rame (II) cloruro diidrato in acqua di grado HPLC a una concentrazione di 5 mM. La soluzione dovrebbe apparire la luce blu.
- Aggiungere 1 mL di soluzione acquosa di BSA per un flaconcino di reazione da 5 mL e posto in un bagno di acqua a 37 ° C. Mescolare il composto a 750 giri/min.
- Immediatamente aggiungere 0,5 mL della soluzione di rame (II) cloruro diidrato nel flaconcino di reazione e mescolare per 2 min. La soluzione rimarrà luce blu.
- Aggiungere 75 µ l di 1 M NaOH per portare il pH a 12 e lasciar per mescolare per 2 h. La soluzione diventerà viola.
- Sciogliere l'acido cloroaurico in acqua di grado HPLC a una concentrazione di 5 mM.
- Aggiungere 0,5 mL di acido cloroaurico acquosa nel flaconcino di reazione e regolare il pH torna a 12 utilizzando 1 M NaOH.
- Mescolare la miscela di reazione per 2 h.
Nota: La soluzione dovrebbe evolvere in un color marrone.
3. sintesi di BSA-Ni(II)-Au(III)
- Sciogliere 25 mg di BSA in 1 mL di acqua di grado HPLC. La soluzione dovrebbe apparire chiara.
- Sciogliere il nichel (II) cloruro esaidrato in acqua di grado HPLC a una concentrazione di 5 mM. La soluzione dovrebbe apparire la luce verde.
- Aggiungere 1 mL di soluzione acquosa di BSA per un flaconcino di reazione da 5 mL e porre in un bagno di acqua a 37 oC. mescolare la miscela a 750 giri/min.
- Immediatamente aggiungere 0,5 mL della soluzione di nichel (II) cloruro esaidrato flaconcino di reazione e mescolare per 2 min.
Nota: La soluzione rimarrà luce verde. - Aggiungere 75 µ l di 1 M NaOH per portare il pH a 12 e lasciar per mescolare per 2 h.
Nota: La soluzione diventa giallo scuro. - Sciogliere l'acido cloroaurico in acqua di grado HPLC a una concentrazione di 5 mM.
- Aggiungere 0,5 mL di acido cloroaurico acquosa nel flaconcino di reazione e regolare il pH torna a 12.
- Mescolare la miscela di reazione per 2 h.
Nota: La soluzione dovrebbe evolvere in un color marrone.
4. sintesi di [Cys34-capped-BSA]-Au(III)
- Sciogliere 2 mg di N-ethylmaleimide (NEM) in 1 mL di tampone fosfato salino (PBS, pH 7.4).
- Sciogliere 2 mg di BSA in 1 mL di soluzione di PBS-NEM.
- Trasferire la soluzione in un flaconcino di reazione da 5 mL e mescolare a 20 ° C a 500 giri/min per 1 h.
- Dializzare la soluzione utilizzando 12 tubi di dialisi di kDa in 500 mL di PBS, agitazione a 50 giri/min con un agitatore magnetico durante la notte per rimuovere NEM non reagito.
- Sciogliere l'acido cloroaurico in PBS per una concentrazione di 0,4 mM.
Nota: La soluzione sarà un giallo tenue. - Trasferire il flaconcino di reazione a un bagno di acqua a 37 ° C. Mescolare a 750 giri/min.
- Immediatamente aggiungere 1 mL di soluzione di acido cloroaurico nel flaconcino di reazione e lasciar per mescolare per 2 min.
- Aggiungere 75 μL di 1 M NaOH al flaconcino di reazione per portare il pH a 12 e lasciar per mescolare per 2 h.
5. sintesi di [all-thiol-capped-BSA]-Au(III)
- Preparare una soluzione 2 M urea e 50mm di bicarbonato di ammonio (NH4HCO3, pH 8.0) in acqua di grado HPLC.
- Sciogliere 3,3 mg di BSA in 1 mL della soluzione precedente e trasferimento di un flaconcino di reazione da 5 mL.
- Fare una soluzione stock di 0,25 M tris(2-carboxyethyl) fosfina (TCEP) sciogliendo 62,5 mg di TCEP in 1 mL di acqua per HPLC.
- Aggiungere la soluzione madre di TCEP nel flaconcino di reazione fino a quando la concentrazione finale di TCEP è di 8 mM.
- Incubare la soluzione in un bagno di acqua per 1 h a 50 ° C. Mescolare a 500 giri/min con un agitatore magnetico.
- Lasciare la soluzione completamente raffreddare a temperatura ambiente.
- Preparare una soluzione stock di 100 mM NEM sciogliendo 12,5 mg di NEM in 1 mL di acqua di grado HPLC.
- Aggiungere la soluzione madre di NEM nel flaconcino di reazione fino a quando la concentrazione finale di NEM è di 16 mM.
- Lasciare agire la soluzione combinare per 2 h a 20 ° C. Mescolare a 500 giri/min.
- Dializzare la soluzione utilizzando un tubo di dialisi di 12 kDa, mescolando la soluzione a 50 giri/min con un agitatore magnetico pernottamento in 500 mL di 50mm NH4HCO3 per rimuovere l'eccesso TCEP, NEM e urea.
- Spostare il flaconcino di reazione in un bagno di acqua a 37 ° C e mescolare a 750 giri/min.
- Sciogliere l'acido cloroaurico in acqua di grado HPLC a una concentrazione di 0,66 mM.
- Immediatamente aggiungere 1 mL di soluzione di acido cloroaurico nel flaconcino di reazione e lasciar per mescolare per 2 min.
- Aggiungere 1 M NaOH fino a quando il pH della soluzione è 12 e lasciare che la soluzione di continuare a mescolare per 2 h.
Risultati
Dalla fluorescenza del complesso BSA-Au(III), è stato osservato che la conversione della fluorescenza intrinseca blu di BSA (λem = 400 nm) a fluorescenza rossa (λem = 640 nm) si verifica a circa pH 9.7 attraverso un equilibrio transizione (Figura 1). EEM di BSA-Au(III) alle diversa BSA a rapporti molari Au è illustrato nella Figura 2, e questi dati mostrano come alterare i rapporti molari produce la stessa lunghezza d'onda di emissione a lunghezze d'onda di eccitazione differente. Cu (II), investigata e Au(III) modo competitivo legano ad un sito noto (frammento di Asp) in BSA (Figura 3). La BSA Cys34-capped Mostra un cambiamento nei modelli di punta EEM Au(III) legandosi, e questi risultati mostrano come alterazione di specifici siti di legame altera modelli di fluorescenza. La BSA tutti-tiolo-capped non mostra nessuna fluorescenza rossa e rivela legami disolfuro Cys Cys come siti di legame possibile per produrre il fluoroforo rosso (Figura 4).

Figura 1. Fluorescenza di BSA-Au(III) e il conformazionali indotte cambia dal blu al rosso (A) la capacità di assorbimento e fluorescenza (λex = 365 nm) di BSA-Au(III). (B) esseri di fluorescenza rossa ad emergere a intorno a pH 9.7, in cui cambia la conformazione del BSA. (C) blu decadimenti di fluorescenza, come emerge in fluorescenza rossa. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2. Misure di mappa (EEM) rapporto-metrica eccitazione-emissione di BSA-Au(III). EEM di BSA-Au(III) complesso sintetizzato utilizzando il protocollo standard durante la regolazione del rapporto di BSA all'oro. BSA (A) a pH 12, (B) BSA:Au = 1:1, BSA:Au (C) = 1:7, BSA:Au (D) = 01:13, BSA:Au (E) = 01:26, BSA:Au (F) = 01:30, BSA:Au (G) = 01:40, BSA:Au (H) = 01:52. Clicca qui per visualizzare una versione più grande di questa figura.
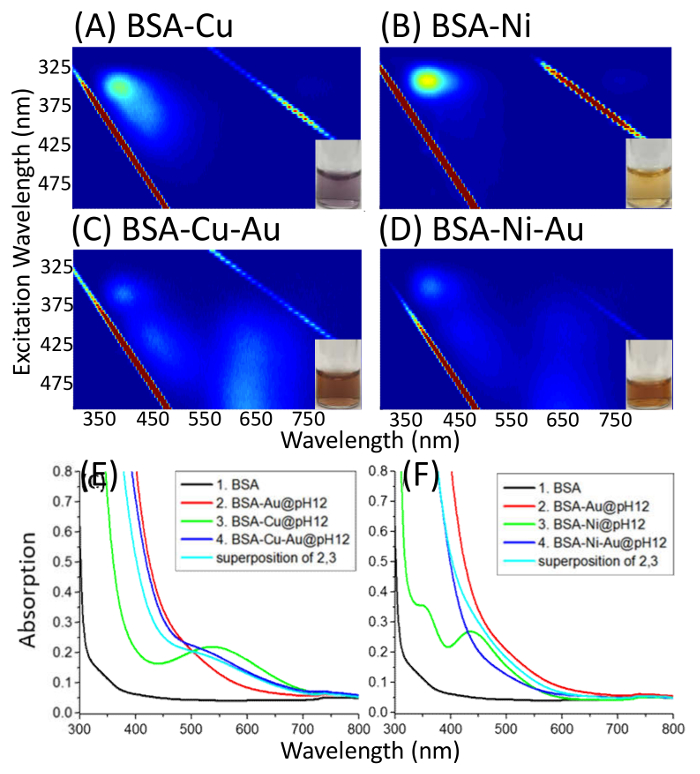
Figura 3. Complessi di EEM di BSA-Cu(II)/Ni(II)-Au(III). Mappe: eccitazione-emissione (eccitazione: 290-500 nm; emissione: 300-850 nm) di BSA complessato con Cu(II)/Ni(II) a pH 12 (A e B), BSA complessato con Cu(II)/Ni(II) e poi con Au(III) a pH 12 (C e D) e assorbimento spettri confrontando BSA, BSA-Au, BSA-Cu(II)/Ni(II) e BSA-Cu(II)/Ni(II)-Au(III) (E e F). Curva 4 viene confrontato con la sovrapposizione di curve 2 e 3. Questa figura è stata modificata da Dixon, J. M. & Egusa, S. J. em. Chem. Soc. 140 2265-2271, (2018). Clicca qui per visualizzare una versione più grande di questa figura.

Figura 4. EEM di Cys34 ridotta e tutti i tioli capped. EEM (eccitazione: 300-500 nm; emissione: 300-700 nm) di (A) Cys34-capped BSA ha reagito con Au a pH 12. (B), tutti i ponti disolfuro Cys Cys in BSA era spaccati e quindi il tutto-tiolo-capped-BSA è stato reagito con Au a pH 12. Questa figura è stata modificata da Dixon, J. M. & Egusa, S. J. em. Chem. Soc. 140 2265-2271, (2018). Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
I composti di BSA-Au(III) preparati a pH 12 presentano fluorescenza rossa ad una lunghezza d'onda di emissione di λem= 640 nm quando eccitato con raggi ultravioletti (UV) luce λex= 365 nm (Figura 1A). L'emergere di fluorescenza rossa è un processo lento e avrà un paio di giorni a temperatura ambiente per aumentare a un'intensità massima. In esecuzione della reazione a 37 ° C produrrà i risultati ottimali, anche se alta temperatura può essere utilizzato per produrre la fluorescenza rossa più velocemente. Irreversibile degradazione della proteina può verificarsi a temperature superiori a 45 ° C23. La regolazione del pH in modo che BSA si trasforma in suo invecchiato (pH > 10) conformazione21 ("A-form") è fondamentale per fluorescenza rossa; pH è finemente regolata da neutro a base per determinare la soglia dell'occorrenza di fluorescenza rossa (Figura 1B, C). Per la massima intensità di fluorescenza rossa, deve essere regolato il pH superiore a 11. Per fluorescenza rossa, il pH può essere regolato oltre 11, anche se estremamente basic (pH > 13) condizioni possono denaturare BSA e causare fluorescenza rossa a scomparire.
Variando il rapporto stechiometrico della BSA e Au può illustrare l'associazione dell'Au di BSA. Gli spettri di fluorescenza dei composti BSA-Au(III) variano a seconda i rapporti stechiometrici di BSA per Au (Figura 2). Come la BSA rapporto oro viene regolata a 01:26, un massimo di intensità di fluorescenza rossa è osservato a λex= 500 nm. D'altra parte, si osserva come viene regolato il rapporto di BSA:gold a fluorescenza rossa 1:7, principalmente a λex= 365 nm. Nessuna fluorescenza rossa può essere rilevato con un rapporto di BSA per Au meno di 1:7 o sopra 01:52. Il numero minimo di cationi oro necessaria per produrre il rosso fluorescenza è meno di 7 e più di 1, e il numero massimo per la perdita di fluorescenza rossa è maggiore di 52 (Figura 2B, C). Inoltre, la riduzione di tutti i campioni di cui sopra avverrà sotto boroidruro di sodio in eccesso, chiarire che tutti i campioni contengono ancora Au(III) cationici. Inoltre, l'aggiunta di una quantità eccessiva di oro oltre 20 mM può provocare la soluzione diventare troppo acida e denaturare la proteina. In caso di denaturazione delle proteine a causa della elevata acidità, ridurre la concentrazione di BSA e Au relativamente a mediare questo problema.
Legame competitivo di Au e altri cationi metallici a BSA può illustrare i siti di legame in BSA. È noto che il Cu (II) e investigata entrambi legano all'applicazione Asp frammento al N-terminale del BSA24,25,26,27. Attraverso l'aggiunta di Cu (II), un forte legante per il frammento di Asp, seguito dall'aggiunta di Au(III), gli spettri di assorbanza di BSA-Cu(II)-Au(III) e gli spettri di assorbanza di BSA-Au(III) e BSA-Cu(II) sono gli stessi - che indica che oro e rame non competere per la stessa sede del legame al frammento di Asp (Figura 3). Investigata si lega debolmente al frammento di Asp e di conseguenza Au(III) compete con investigata come oro viene aggiunto; è stato osservato che gli spettri di assorbanza di BSA-Ni(II) e BSA-Au(III) non correla con quella di BSA-Ni(II)-Au(III) (Figura 3F). Attraverso il protocollo di cui sopra, si può mostrare come Au(III) si lega al sito associazione conosciuta di BSA. Questa tecnica richiede anche la regolazione del pH superiore a 11 e la tecnica è modificata con l'aggiunta di due volte la concentrazione a BSA ma a metà del volume, quindi questo deve essere eseguito alla BSA basso ai rapporti di Au per mantenere la conformazione della proteina.
Modifica di residui di cisteina in BSA può più ulteriormente per delucidare i siti di legame di Au. Oro è noto per avere un'alta affinità per il tiolo28 e BSA possiede un superficie tiolo accessibile su (Cys34)21. Attraverso il blocco di questo tiolo, siti di legame secondario possono essere delucidati. Il blocco di questa cisteina viene effettuato prima dell'aggiunta del Au(III) al campione e Mostra un pattern di fluorescenza alterata di BSA-Au(III), che indica una via di possibile trasferimento coinvolte nel meccanismo della fluorescenza rosso (Figura 4A). È imperativo per aggiungere l'agente bloccante del tiolo, in questo caso NEM, ad un pH neutro. Fendendo tutti i ponti disolfuro e la successiva non tappatura di loro rivela di gruppi tiolici liberi nessuna fluorescenza rossa (Figura 4B). Questi risultati indicano che un legame disolfuro è necessario per produrre un complesso rosso fluorescente.
Abbiamo dimostrato in vari protocolli, attraverso l'uso di spettroscopiche e tecniche di chimica della proteina, un metodo per analizzare i complessi BSA-Au(III). Tecniche di chimica della proteina qui presentate non sono stati ampiamente utilizzate nella ricerca nano-materiali basati su proteine14. Queste tecniche possono essere generalmente applicabile ed essere utile per capire il processo di associazione del metallo e i siti di legame possibile in altri, se non tutte, le proteine come tripsina, pepsina, lisozima e transferrina17,29. Le proteine sono dinamici, ma molto precisi "nano-materiali". Conoscere in dettaglio il sito di legame del metallo potrebbe aprire la strada verso nuovi materiali a base di proteine con proprietà ottiche controllata con la miriade di potenziali applicazioni.
Divulgazioni
Gli autori non hanno nulla a rivelare.
Riconoscimenti
S.E. riconosce il sostegno dal fondo di Duke dotazione speciale iniziativa, fondo di Wells Fargo, PhRMA Foundation, nonché avvio fondi presso la University of North Carolina, Charlotte.
Materiali
| Name | Company | Catalog Number | Comments |
| Bovine Serum Albumin (BSA), 96% | Sigma-Aldrich | A5611 | |
| gold (III) chloride trihydrate, 99.9% | Sigma-Aldrich | 520918 | |
| Copper (II) chloride dihydrate, 99.999% | Sigma-Aldrich | 459097 | |
| Nickel (II) chloride hexahydrate, 99.9% | Sigma-Aldrich | 654507 | |
| N-Ethylmaleimide (NEM), >99.0% | Sigma-Aldrich | 4259 | |
| Tris(2-carboxyethyl)phosphine hydrochloride (TCEP), >98.0% | Sigma-Aldrich | C4706 | |
| Sodium hydroxide, >98.0% | Sigma-Aldrich | S8045 | |
| Urea, 99.5% | Chem-Implex Int'l | 30142 | |
| Phospate buffered saline (PBS) | Corning | MT21040CV | |
| Ammonium bicarbonate, 99.5% | Sigma-Aldrich | 9830 |
Riferimenti
- Xie, J., Zheng, Y., Ying, J. Y. Protein-Directed Synthesis of Highly Fluorescent Gold Nanoparticles. Journal of the American Chemical Society. 131, 888-889 (2009).
- Saha, K., Agasti, S. S., Kim, C., Li, X., Rotello, V. M. Gold Nanoparticles in Chemical and Biological Sensing. Chemical Reviews. 112, 2739-2779 (2012).
- Zhang, Y., et al. New Gold Nanostructures for Sensor Applications: A Review. Materials. 7, 5169-5201 (2014).
- Chen, L. -Y., Wang, C. -W., Yuan, Z., Chang, H. -T. Fluorescent Gold Nanoclusters: Recent Advances in Sensing and Imaging. Analytical Chemistry. 87 (1), 216-229 (2015).
- Cai, W., Gao, T., Hong, H., Sun, J. Applications of Gold Nanoparticles in Cancer Nanotechnology. Nanotechnology, Science and Applications. 1, 17-32 (2008).
- Nune, S. K., et al. Nanoparticles for Biomedical Imaging. Expert Opinion on Drug Delivery. 6, 1175-1194 (2009).
- Dorsey, J. F., et al. Gold Nanoparticles in Radiation Research: Potential Applications for Imaging and Radiosensitization. Translational Cancer Research. 2, 280-291 (2013).
- Daniel, M. -C., Astruc, D. Gold Nanoparticles: Assembly, Supramolecular Chemistry, Quantum-Size-Related Properties, and Applications toward Biology, Catalysis, and Nanotechnology. Chemical Reviews. 104 (1), 293-346 (2004).
- Ferrari, M. Cancer Nanotechnology: Opportunities and Challenges. Nature Reviews Cancer. 5, 161-171 (2005).
- Huang, X., Jain, P. K., El-Sayed, I. H., El-Sayed, M. A. Gold Nanoparticles: Interesting Optical Properties and Recent Applications in Cancer Diagnostics and Therapy. Nanomedicine. 2, 681(2007).
- Arvizo, R., Bhattacharya, R., Mukherjee, P. Gold Nanoparticles: Opportunities and Challenges in Nanomedicine. Expert Opinion on Drug Delivery. 7, 753-763 (2010).
- Doane, T. L., Burda, C. The Unique Role of Nanoparticles in Nanomedicine: Imaging, Drug Delivery and Therapy. Chemical Society Reviews. 41, 2885(2012).
- Egusa, S., Ebrahem, Q., Mahfouz, R. Z., Saunthararajah, Y. Ligand Exchange on Gold Nanoparticles for Drug Delivery and Enhanced Therapeutic Index Evaluated in Acute Myeloid Leukemia Models. Experimental Biology and Medicine. 239, 853(2014).
- Qu, X., et al. Fluorescent Gold Nanoclusters: Synthesis and Recent Biological Application. Journal of Nanomaterials. (784097), (2015).
- Chakraborty, I., Pradeep, T. Atomically Precise Clusters of Noble Metals: Emerging Link between Atoms and Nanoparticles. Chemical Reviews. 117, 8208-8271 (2017).
- Raut, S., et al. Evidence of energy transfer from tryptophan to BSA/HSA protected gold nanoclusters. Methods and Applications in Fluorescence. 2, (2014).
- Le Guével, X., Daum, N., Schneider, M. Synthesis and Characterization of Human Transferrin-Stabilized Gold Nanoclusters. Nanotechnology. 22 (27), (2011).
- Kawasaki, H., Yoshimura, K., Hamaguchi, K., Arakawa, R. Trypsin-Stabilized Fluorescent Gold Nanocluster for Sensitive and Selective Hg2+ Detection. Analytical Sciences. 27 (6), 591(2011).
- Lu, D., et al. Lysozyme-Stabilized Gold Nanoclusters as a Novel Fluorescence Probe for Cyanide Recognition. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy. 121, 77-80 (2014).
- Dixon, J. M., Egusa, S. Conformational Change-Induced Fluorescence of Bovine Serum Albumin-Gold Complexes. Journal of the American Chemical Society. 140, 2265-2271 (2018).
- Peters, T. Jr All About Albumin. , (1996).
- Masuoka, J., Saltman, P. Zinc(II) and Copper(II) Binding to Serum Albumin. A Comparative Study of Dog, Bovine, and Human Albumin. Journal of Biological Chemistry. 269, 25557-25561 (1994).
- Takeda, K., Wada, A., Yamamoto, K., Moriyama, Y., Aoki, K. Conformational Change of Bovine Serum Albumin by Heat Treatment. Journal of Protein Chemistry. 8 (5), 653-659 (1989).
- Klotz, I. M., Curme, H. G. The Thermodynamics of Metallo-protein Combinations. Copper with Bovine Serum Albumin. Journal of the American Chemical Society. 70, 939-943 (1948).
- Fiess, H. A., Klotz, I. M. The Thermodynamics of Metallo-Protein Combinations. Comparison of Copper Complexes with Natural Proteins. J. Am. Chem. Soc. 74, 887-891 (1952).
- Rao, M. S. N. A Study of the Interaction of Nickel(II) with Bovine Serum Albumin. Journal of the American Chemical Society. 84, 1788-1790 (1962).
- Peters, T. Jr, Blumenstock, F. A. Copper-Binding Properties of Bovine Serum Albumin and Its Amino-terminal Peptide Fragment. Journal of Biological Chemistry. 242, 1574-1578 (1967).
- Xue, Y., Li, X., Li, H., Zhang, W. Quantifying Thiol-Gold Interactions towards the Efficient Strength Control. Nature Communications. 5, 4348(2014).
- Xu, Y., et al. The Role of Protein Characteristics in the Formation and Fluorescence of Au Nanoclusters. Nanoscale. 6 (3), 1515-1524 (2014).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon