Method Article
Hidrogel Bioprintable alginato/gelatina 3D em Vitro sistemas modelo induzem a formação de esferoide de célula
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Desenvolvemos um modelo de câncer de mama heterogênea consistindo de células de tumor e fibroblasto imortalizadas incorporadas em um bioink de alginato/gelatina de bioprintable. O modelo recapitula o microambiente do tumor na vivo e facilita a formação de esferoides tumor multicelulares, produzindo insights sobre os mecanismos de condução tumorigênese.
Resumo
A heterogeneidade celular, bioquímica e biofísica do microambiente do tumor nativo não é recapitulada por linhas de células de câncer imortalizado crescente usando a cultura convencional bidimensional (2D) celular. Esses desafios podem ser superados por meio de técnicas bioprinting para construir modelos heterogêneos tridimensional (3D) tumor, segundo o qual diferentes tipos de células são incorporados. Alginato e gelatina são dois dos biomateriais mais comuns empregados em bioprinting devido à sua biocompatibilidade, biomimetismo e propriedades mecânicas. Combinando os dois polímeros, atingimos um hidrogel composto bioprintable com semelhanças com a arquitetura microscópica de uma estroma do tumor nativo. Estudamos a qualidade de impressão de hidrogel composto através de reologia e obtidos da janela de impressão ideal. Fibroblastos e células de câncer de mama foram incorporados no hidrogel e impressos para formar um modelo 3D, imitando o microambiente no vivo . O modelo heterogêneo bioprinted alcança uma alta viabilidade para cultura de células a longo prazo (> 30 dias) e promove a auto-montagem de células de câncer de mama em esferoides tumor multicelulares (MCTS). Observamos a migração e a interação das células de câncer-associado do fibroblasto (CAFs) com o MCTS neste modelo. Usando plataformas de cultura de células bioprinted como sistemas de co-cultura, dispõe de uma exclusiva ferramenta para estudar a dependência da tumorigênese sobre a composição do estroma. Esta técnica apresenta uma alta produtividade, baixo custo e alta reprodutibilidade, e também pode fornecer um modelo alternativo para culturas convencionais monocamada e modelos de tumor animal para estudar a biologia do câncer.
Introdução
Embora a cultura de pilha 2D é amplamente utilizada na pesquisa do câncer, existem limitações como as células são cultivadas em um formato de monocamada com uma concentração uniforme de nutrientes e oxigênio. Essas culturas faltam importante célula-célula e interações célula-matriz presentes no microambiente do tumor nativo (TME). Consequentemente, estes modelos mal recapitular condições fisiológicas, resultando em comportamentos aberrantes de células, incluindo morfologias antinaturais, organização irregular do receptor, polarização de membrana e expressão do gene anormal, entre outros condições1,2,3,4. Por outro lado, a cultura de células 3D, onde as células são expandidas em um espaço volumétrico como agregados, esferoides ou organoids, oferece uma técnica alternativa para criar ambientes em vitro mais precisos para estudar a fisiologia e biologia celular fundamentais. Modelos de cultura de células 3D também podem incentivar interações célula-ECM que são críticas características fisiológicas do nativo TME em vitro1,4,5. A tecnologia emergente de bioprinting 3D fornece possibilidades para construir modelos que imitam o TME heterogêneo.
Bioprinting 3D é derivado de prototipagem rápida e permite a fabricação de microestruturas 3D que são capazes de imitar as complexidades da vida6,7amostras de tecido. Os atuais métodos de bioprinting incluem jato de tinta, extrusão e assistida por laser impressão8. Entre eles, o método de extrusão permite a heterogeneidade ser controlado dentro de matrizes de impressos por precisamente posicionamento distintos tipos de materiais em locais diferentes do iniciais. Portanto, é a melhor abordagem para fabricar modelos heterogêneos em vitro envolvendo vários tipos de células ou matrizes. Bioprinting de extrusão tem sido usada com sucesso para construir andaimes de forma auricular9, estruturas vasculares de11,10,12e tecidos13, resultando em células e alta fidelidade de impressão de pele viabilidade. A tecnologia também possui seleções materiais versátil, a capacidade de depositar materiais com células incorporado com um conhecido de densidade e alta reprodutibilidade14,15,16,17 . Hidrogel natural e sintética é usadas frequentemente como bioinks para bioprinting 3D, devido à sua biocompatibilidade, Bioatividade e suas redes hidrofílicos que podem ser projetados para assemelhar-se estruturalmente o ECM7,18 ,19,20,21,22,23. Hidrogel também é vantajosos, já que podem incluir sites adesivos para células, elementos estruturais, permeabilidade de nutrientes e gases, e as propriedades mecânicas adequadas para incentivar desenvolvimento24da pilha. Por exemplo, o colágeno hidrogel oferece integrina locais de ancoragem que células podem usar para conectar para a matriz. Gelatina, colágeno desnaturado, mantém sites semelhantes de adesão celular. Em contraste, o alginato é bioinert mas fornece integridade mecânica, formando ligações cruzadas com íons divalentes25,26,,27,28.
Neste trabalho, desenvolvemos um hidrogel composto como um bioink, composto de alginato e gelatina, com semelhanças com a arquitetura microscópica de uma estroma do tumor nativo. Fibroblastos e células de câncer de mama foram incorporados o hidrogel e impresso através de uma bioprinter baseada em extrusão para criar um modelo 3D que imita o microambiente no vivo . O ambiente 3D projetado permite que as células cancerosas formar esferoides tumor multicelulares (MCTS) com uma alta viabilidade por longos períodos de cultura celular (> 30 dias). Este protocolo demonstra as metodologias de sintetizar compostos hidrogel, caracterizando a microestrutura dos materiais e qualidade de impressão, bioprinting celular modelos heterogêneos e observar a formação de MCTS. Essas metodologias podem ser aplicadas a outros bioinks em extrusão bioprinting, bem como para diferentes projetos de modelos de tecidos heterogêneos com aplicações potenciais na despistagem de drogas, ensaios de migração celular e estudos que se concentram em célula fundamental funções fisiológicas.
Protocolo
1. preparação dos materiais, hidrogel e materiais de cultura celular
-
Preparação de material e solução
- Lave e seque a 250 mL e copos de vidro de 100 mL, Agitadores magnéticos, espátulas, cartuchos 10ml, bocais cilíndricos de 25g com (um comprimento de 0,5 na) e um diâmetro interno de 250 µm. Esterilizar os materiais em autoclave-los em 121 ° C/15 min/1 ATM. manter os materiais em condições estéreis até o uso.
Nota: Consulte a Tabela de materiais , para obter informações do fornecedor. - Pese 3 g de alginato (3% p/v) e 7 gramas de gelatina (7% w/v) (denotado como A3G7 agora em diante).
- Esterilize os seguintes itens à luz pelo menos 4 h: alginato e gelatina pós, película de parafina, pedaços de folha de alumínio de 5 cm2e 1 mL e seringas de 5ml UV. Esterilizar as tampas, tampões de ponta e pistões imergindo-os em etanol a 70% pelo menos 4 h e lavá-los 2 x com água ultra-pura esterilizada.
Nota: Consulte a Tabela de materiais , para obter informações do fornecedor. - Dissolver 4 g de agarose com água ultra pura e esterilize em autoclave.
Nota: A agarose é completamente dissolvido após o processo de esterilização em autoclave. - Prepare uma solução de 100 mM de cloreto de cálcio anidro (CaCl2) em água ultra pura esterilizada e um filtro estéril (com um tamanho de poros de 0,22 µm) antes da sua utilização.
- Para placas com revestimento em agarose 6-poço, derreter o agarose estéril no microondas para obter uma solução líquida; Então, sob um armário de biossegurança (BSC) e usando uma micropipeta de 1 mL, adicionar 2 mL por bem e misture delicadamente para criar uma camada uniforme no fundo do poço. Deixe arrefecer e selar o poço com película de parafina. Mantê-lo em temperatura ambiente (RT) até o uso.
- Lave e seque a 250 mL e copos de vidro de 100 mL, Agitadores magnéticos, espátulas, cartuchos 10ml, bocais cilíndricos de 25g com (um comprimento de 0,5 na) e um diâmetro interno de 250 µm. Esterilizar os materiais em autoclave-los em 121 ° C/15 min/1 ATM. manter os materiais em condições estéreis até o uso.
-
Preparação do hidrogel A3G7 precursor
- Misture 3 g de alginato e 7 g de pó de gelatina em um copo de 250 mL, dentro de um BSC. Adicione um agitador magnético e 100 mL de DPBS. Sele o recipiente com papel filme e alumínio parafina estéril (2de 5 cm) para evitar a contaminação.
- Dissolva o pó sob uma agitação constante em uma placa magnética/quente com 600 rpm a 60 ° C, durante 1 h e no RT por mais 2 h.
- Aquecer o material a 37 ° C, até que o gel passa por uma fase de transição para o estado líquido (para 100 mL de solução de gel de estoque, isto leva aproximadamente 45 min). Transferir a solução para tubos de centrifuga conico de estéril 50ml, selá-los e centrifugar os tubos a 834 x g por 5 min eliminar as bolhas de gás com o material.
- Aspire o precursor de hidrogel para seringas de 10 mL. Selar as seringas com os tampões e película de parafina. Armazená-los em 4 ° C até o uso.
-
Cultura celular
Nota: As etapas nesta seção devem ser realizadas sob condições estéreis.- Preparar o meio DMEM basal como segue (1 L): em um BSC, misture 100 mL de soro fetal bovino (FBS) e mais 10 mL de uma solução de antibiótico/antimicótico (100 x solução estabilizada) em um recipiente estéril fresco. Adicionar meio DMEM para ajustar a mistura até 1.000 mL. Feche o recipiente e mantê-lo em 4 ° C.
- Em um banho de água previamente aquecida (37 ° C), descongelar 1 frasco de MDA-MB-231-GFP (linhagem de células de câncer materno localização nuclear, GFP-etiquetado) e 1 frasco de IMR-90-mCherry (associada a câncer fibroblasto célula linhas mCherry-rotulados, com localização citoplasmática ) as células de armazenamento de nitrogênio líquido, movendo-os suavemente na água. As linhas de célula e os plasmídeos de GFP e mCherry de rotulagem, estão disponíveis comercialmente.
- Transferir 160 µ l/poço de solução de célula (3 x 106 células/mL) em uma placa de 6 e adicionar 5 mL de meio DMEM base aquecida (37 ° C). Incube a placa em 37 °C/5% CO2 por 24-48 h até as células alcançar 80% de confluência.
- Depois que as células alcançar confluência, descartar o meio e enxágue as células duas vezes com DPBS; Incube as celulas com 500 µ l de solução de tripsina-EDTA/poço (0,25%, 1 x, previamente aquecido a 37 ° C) a 37 ° C por 6min. Em seguida, desativar a tripsina adicionando 500 µ l de FBS, recuperar a solução de célula e transferi-lo para frascos de T-75. Incube-los novamente a 37 °C/5% CO2 até as células alcançar 80% de confluência.
Nota: O volume de solução de tripsina-EDTA pode variar dependendo do navio do crescimento celular. - Repita a etapa anterior para trabalhar com células em passagem 3-4 como é quando as células têm mais estabilidade e atividade metabólica.
- Conte as células usando um ensaio de azul de trypan (0,4%) para determinar a concentração inicial de células a ser misturado com o hidrogel.
2. medições das propriedades reológicas de hidrogel
- Prepare o precursor de hidrogel de alginato/gelatina conforme descrito na etapa 1.2.
Nota: Condições estéreis não são necessárias para gerado para ensaios mecânicos e análise de amostras. Todos os testes reológicos são executados em triplicado. - Pegue uma seringa de hidrogel precursor e aquecer em banho-maria 37 ° C por 1h.
- Ligue o rheometer e inicializar o sistema de acordo com as etapas a seguir.
- Liga o compressor de ar ligado ao rheometer e deixe o compressor de ar, correr por 30 min. Switch na caixa de controle de temperatura para o rheometer, ligue o rheometer em si e ligue o computador ligado para o rheometer.
- Abra o software rheometer, clique em inicializar no painel de controle e deixa o processo de inicialização terminar. Defina a temperatura de plataforma a 37 ° C no painel de controle.
- Clique na guia do conjunto de medição e navegue até a função de serviço de início, selecione Adjust inércia de motorista no menu drop-down e clique em Iniciar ajuste na janela pop-up.
- Monte um paralelo ferramenta no rheometer de medição. Todos os experimentos realizados aqui usam um prato de diâmetro de 25 mm com uma abertura de 1 mm entre as placas.
- Clique em ajustar zero-distância do painel de controle e aguardar o processo terminar. Preste atenção para a força normal durante este processo.
Nota: Após este procedimento, a força normal deve ser 0. - Clique na guia do conjunto de medição e navegue até a função de serviço de início, selecione Adjust inércia de sistema medição superiore clique em Iniciar ajuste na janela pop-up. Uma vez feito, clique no botão do triângulo no painel de controle para permitir que o instrumento de medição mover para cima.
- Realizar uma varredura de amplitude.
- Clique em Iniciar, em seguida, clique em Inserir no menu superior, selecione a espera do menu drop-down. Puxe a janela de configuração e definir o tempo de espera de 2 h.
Nota: Isto irá adicionar uma etapa de espera antes dos testes. - Clique em Iniciar, em seguida clique novamente no botão Inserir e no menu suspenso, selecione o dispositivo. Puxe a janela de configuração, escolha a temperaturae configurá-lo para ser 25 ° C. Desmarque a caixa de espera até que valor é atingido.
- Clique a etapa de medição, então clique a variável tensão de oscilação, puxe a janela de configuração, defina o perfil para ser o logaritmo de rampae altere o valor para 0,001% e 100% como a tensão inicial e final, tensão, respectivamente. Defina a frequência a 0,01 Hz.
- Clique no botão Adicionar para adicionar a variável de temperatura . Clique a variável temperatura e configurá-lo para ser 25 ° C. Na janela de pull-up, expanda calculadora, defina o ponto de densidade para 10 pontos/década.
- Pegue a seringa fora o banho de água e extrude aproximadamente 0,5 mL do precursor na plataforma rheometer.
- Clique no triângulo para baixo botão painel de controle. Espere que o instrumento de medição mover para baixo para a posição de corte.
- Use uma espátula para aparar qualquer excesso precursores que escaparam à beira do instrumento de medição e descartar o material supérfluo.
- Pipetar óleo mineral sobre o canto do instrumento de medição e esperar até que o óleo totalmente lacra o limite.
- Clique em continuar no painel de controle. Clique no botão Iniciar (triângulo verde), seguido por clicar botão continuar na tela de fundo.
- Quando o teste é feito, liberar o instrumento de medição e então clique na para cima Triângulo botão no painel de controle. Retire o instrumento de medição e limpe-o com etanol a 70%. Limpe a plataforma com etanol a 70%.
- No projeto atual, clique em etapa de medição e puxe a janela de configuração. Agora, o conjunto a frequência de 100 Hz. manter todos os outros parâmetros inalterados.
- Repita as etapas 2.4.5 - 2.4.10.
- Clique em diagrama. Observar a curva de G', G " contra a estirpe de oscilação. Encontrar os pontos de deflexão de G' para ambas as frequências (0,01 Hz e 100 Hz). Encontre as estirpes de oscilação correspondente para ambos os pontos de deflexão.
- Escolher a menor tensão de oscilação e usar 1/10 desta variedade para todos os testes de oscilação realizados posteriormente.
Nota: O aparecimento de G' desvio é considerado o ultimo linear elástica tensão (ULES) que não deve ser excedida em testes de acompanhamento. A proporção de 1/10 é geralmente usada em engenharia por razões de segurança. Este calculado estirpe é denotado como gC. - Depois que o teste é concluído, clique em tabela, copiar todos os dados e colá-lo em um arquivo de texto.
- Clique em Iniciar, em seguida, clique em Inserir no menu superior, selecione a espera do menu drop-down. Puxe a janela de configuração e definir o tempo de espera de 2 h.
- Realizar uma varredura de temperatura.
- Clique em meus aplicativos e selecione o modelo rampa de temperatura, oscilatória: gelificação.
- Nome do projeto.
- Clique a etapa de medição do fluxo de trabalho. Clique na variável temperatura, puxe a janela de configuração e definir a temperatura inicial e final para ser a 37 ° C e 25 ° C, respectivamente.
- Na janela de pull-up, defina estirpe de oscilação para 0,1%, frequência de oscilação de 1Hz. Em seguida, defina o número de pontos de dados para ser 61. Definir a frequência de coleta de dados de ponto 1/min. clique em calculadora e definir o ponto de densidade de 0,2 ° C/ponto.
Nota: Isto permitirá que a temperatura mudar a uma velocidade de 0,2 ° C/min. - Carregar a amostra na plataforma rheometer e realize o teste seguindo as etapas 2.4.5 - 2.4.10.
- Clique em diagrama, observar o G', G " contra a temperatura. Encontrar o ponto de cruzamento de G' e G ". Encontre a temperatura no ponto de cruzamento.
Nota: Esta é a temperatura de transição do sol/gel do precursor hidrogel. - Repita a etapa 2.4.15.
- Realizar uma varredura de tempo isotérmico.
- Clique em meus apps e encontrar e clique no modelo isotérmica tempo-temperatura de teste. Clique a etapa de medição do fluxo de trabalho e, em seguida, clique a variável tensão de oscilação, puxe a janela de configuração, defina a estirpe de oscilação para 0,1% e definir a frequência de oscilação de 1 Hz. Na janela de pull-up, defina o número de pontos de dados para 120. Defina a frequência de coleta de dados de ponto 1/min.
Nota: O valor desta estirpe é baseado nos resultados da varredura da amplitude. - Clique o botão Adicionar para adicionar a variável de temperatura . Clique em variáveis de temperatura na janela do meio e defina-a 25 ° C.
- Botão direito do mouse o passo dispositivo mover-se para o ponto de medição do fluxo de trabalho, clique em excluir. Clique em etapa que dispositivo definir valor, desmarque a caixa de espera até que seja atingido valore defina o valor para 25 ° C. Clique em imagens, tittle, botões na tela inferior, desmarque a caixa de continuar. Em seguida, clique em Iniciar, nome do projeto da etapa e salvá-lo.
- Carregar a amostra para a plataforma rheometer e iniciar o teste seguindo as etapas 2.4.5 - 2.4.10.
- Observar o G', G " contra o tempo. Encontrar o ponto de cruzamento de G' e G ". Encontre o tempo no ponto de cruzamento. Depois que o teste é concluído, clique em tabela, copiar todos os dados e colá-lo em um arquivo de texto.
Nota: Este é o tempo de transição do sol/gel do hydrogel precursor a 25 ° C.
- Clique em meus apps e encontrar e clique no modelo isotérmica tempo-temperatura de teste. Clique a etapa de medição do fluxo de trabalho e, em seguida, clique a variável tensão de oscilação, puxe a janela de configuração, defina a estirpe de oscilação para 0,1% e definir a frequência de oscilação de 1 Hz. Na janela de pull-up, defina o número de pontos de dados para 120. Defina a frequência de coleta de dados de ponto 1/min.
- Medir a força de rendimento em vários tempos de coagulação.
- Clique em meus apps e encontrar e clique no modelo stress de rendimento e fluxo, Gel-like. Nome do projeto. Clique o passo Iniciar o fluxo de trabalho. Clique em Inserir no menu superior e, no menu drop-down, selecione esperar. Puxe a janela de configuração e definir o tempo de espera para ser 20 min.
Nota: Isto irá adicionar uma etapa de espera antes dos testes. - Clique em Iniciar, em seguida, clique em Inserir novamente e, no menu drop-down, selecione o dispositivo. Puxe a janela de configuração, escolheu a temperatura e configurá-lo para 25 ° C. Desmarque a caixa de espera até que valor é atingido.
- Clique a etapa de medição do fluxo de trabalho, selecione a variável tensão de cisalhamento, puxe a janela de configuração e definir a tensão de cisalhamento inicial e final para 0 e 10.000 Pa, respectivamente. Clique em calculadora, defina o ponto de densidade para 0,2 ponto/PA. Na aba de pontos de dados no lado esquerdo, conjunto 1 ponto por segundo.
Nota: isto irá resultar em uma taxa de subida de estresse de 5 Pa/s. - Clique na guia controle de evento na parte inferior da janela do pull-up e definir o critério de parada: parar a medição se o cisalhamento taxa > 100 s-1.
Nota: Isto irá automaticamente parar a medição se o material é gerou. - Carregar a amostra para a plataforma rheometer e iniciar o teste seguindo as etapas 2.4.5 - 2.4.10.
- Clique em diagrama. Observe a curva de tensão-estresse. Encontre o ponto de deflexão de seu correspondente estresse e a tensão. Repita as etapas 2.7.2 - 2.7.6, mas altere o tempo de espera para 30, 40 e 50 min para cada replicação; Isso resultará na força de rendimento em momentos diferentes de coagulação.
Nota: Esta tensão é considerada como a força de rendimento aparente.
Nota: o software cliques podem diferir por rheometer modelos e versões de software. Recomendamos que os leitores a tomar referência dos parâmetros de teste, nós fornecemos, tempo consulte o manual do rheometer/software específico no uso prático.
- Clique em meus apps e encontrar e clique no modelo stress de rendimento e fluxo, Gel-like. Nome do projeto. Clique o passo Iniciar o fluxo de trabalho. Clique em Inserir no menu superior e, no menu drop-down, selecione esperar. Puxe a janela de configuração e definir o tempo de espera para ser 20 min.
3. modelos de impressão 3D, hidrogel célula-carregado e Design do andaime
-
Projeto de andaime
- Desenhe um modelo de hélice, como no papel.
Nota: O modelo de hélice, como é projetado com base nas seguintes considerações: (a) que simula o cenário na vivo onde as células cancerosas estão rodeadas por CAFs; (b) minimiza a concentração de estresse através do uso de geometrias circulares; (c) é flexível para que setores mais podem ser adicionados para o modelo no futuro sem alterar as geometrias existentes; e (d) é plana na sua escala vertical para facilitar a difusão de nutrientes. - Deixe o centro da hélice são a origem e usar os símbolos R0 R1e R2 para representar o raio máximo do círculo interno, sectores médios e sectores exteriores, respectivamente. Use os símbolos m e n para representar o número de arcos internos e raios dentro da área do setor, respectivamente.
- Calcular as coordenadas de cada nó do modelo hélice-como e escrevê-los em expressões simbólicas de R0 R1, R2, me n.
- Iniciar um script de programa conjunto R0 R1, R2, me n como variáveis e a expressão simbólica de cada nó chave de entrada.
Nota: Consulte a Tabela de materiais para qualquer informações de software. - Organizar um caminho que conecta os nós e atribuir um cartucho para o círculo interno, os setores médios e dos sectores exteriores. Defina a espessura de camada a ser 150 µm e o número de camadas para ser 4.
- Deixe o programa um arquivo de texto no formato de código G que é reconhecível pelo bioprinter de saída.
- Conjunto R0 = 3,85, R1 = 6.85, R2 = 8,65, m = 2 e n = 5. Execute o script e recuperar o arquivo de G-código gerado. Copie e cole o arquivo para a pasta de código G dedicada a bioprinter.
- Ative o bioprinter e seu software de controle. Inicialize a impressora. Abra o script de código G acabou de criar e definir todas as pressões para zero. Retornar para o software de controle, clique na guia gerador de andaimese, em seguida, clique no botão executar no canto inferior direito. Observe o movimento caminho da impressora.
Nota: Isto irá testar a precisão do G-código gerado. Consulte a Tabela de materiais , para obter informações relacionadas com a bioprinter. - Esta etapa é opcional. Construa um modelo 3D demonstrativo baseado nos parâmetros acima através do software de desenho assistido por computador (CAD).
Nota: Consulte a Tabela de materiais para as informações de fornecedores de software.
- Desenhe um modelo de hélice, como no papel.
-
Fazer um precursor de hidrogel de A3G7 célula-carregado
Nota: As etapas nesta seção devem ser realizadas sob condições estéreis. Mantenha o bioprinter dentro de um BSC.- Esterilizar o bioprinter em etanol a 70% de pulverização completamente e expô-lo à luz UV durante a noite.
- Pegue uma seringa de precursor hidrogel (a 4 ° C) e aquecê-lo em banho-maria a 37 ° C por 1h.
- Pegue o T-balão com células (consulte a etapa 1.3) da CO2 incubadora e coloque-a dentro de um BSC. Descartar o meio de cultura e enxagúe as células com DPBS duas vezes. Adicionar uma solução de aquecida do trypsin-EDTA (3,0 mL) e incubar as células a 37 ° C por 6 min. inativar a tripsina com um mesmo volume de FBS. Conte as células usando trypan azul ensaio.
- Pegue a seringa do hydrogel precursor do banho, limpe-o e sterilize com etanol a 70%. Colocar a seringa para o BSC.
- EXTRUDE aproximadamente 3 mL de hidrogel precursor em um cartucho de impressão de 10 mL. Misture o precursor com células MDA-MB-231-GFP a 1 x 106 células/mL pipetando lentamente, evitando a produção de bolhas. Cubra o cartucho com o fim de estéril e parte superior e selá-lo com a película de parafina. -Centrifugar a 834 x g por 1 min eliminar as bolhas de gás produzidas.
- Repita as etapas 3.2.3 - 3.2.5 para o precursor de célula-carregado do IMR-90-mCherry e o precursor de célula livre.
- Esterilizar todos os 3 cartuchos com etanol a 70% e depois carregá-los para as câmaras do bioprinter. No software de controle da impressora, definir a temperatura de cartucho a 25 ° C. Espere 35 minutos para permitir que o precursor alcançar condições para impressão.
Nota: Desta vez não afeta a viabilidade das células incorporado no hidrogel.
-
Modelos de impressão 3D
- No software de controle da impressora, expanda a guia de cabeça da ferramenta em software de controle da impressora, clique em 1 cartucho na interface gráfica do lado esquerdo e, em seguida, clique no botão de medida curta para medir a posição da ponta do bico. Repita isto para os outros 2 cartuchos.
- Coloque uma microplaca de poliestireno clara, abra o arquivo de código G e mudar a pressão de 200 kPa para todos os cartuchos. Retornar para o software de controle, clique na guia gerador de andaimes, selecione um ponto para iniciar a impressão e, em seguida, clique no botão executar no canto inferior direito. Repita esta etapa para obter 3 repetições mais.
- Depois de imprimir todas as réplicas dos modelos de hélice, adicionar um 100 mM CaCl2 solução cross-link os modelos por 1 min e enxaguá-lo 2x com DPBS para remover o excesso de íons Ca ++ .
- Transferi com cuidado, os modelos em uma placa de 6-Poços revestidos agarose usando uma espátula. Adicione 5 mL de mídia DMEM a cada poço. Incube as placas em uma incubadora a 37 ° C e 5% de CO2.
Nota: Certifique-se que os modelos estão flutuando em poços. - Substituir o meio de cultura celular com meio fresco a cada 3 dias, cultura-lo por 30 dias no total.
4. viabilidade e experiências de formação esferoide sobre os discos de hidrogel.
-
Preparação do disco de hidrogel
- Repita os passos de 3.2.1 - 3.2.6.
Nota: É possível substituir o cartucho com um pequeno recipiente estéril. - Use uma seringa de 1ml graduada estéril e corte o bocal para criar um grande buraco na seringa (o buraco tem o mesmo diâmetro que o resto do tubo seringa). Limpe-o com 70% de etanol e deixá-lo até que esteja seco.
Nota: Fazer isto em um BSC estéril. - Usar uma tampa de poço-placa, adicionar 100 mM CaCl2 até que a superfície é coberta; Então, leve o celular-carregado de hidrogel para encher a seringa; EXTRUDE 100 µ l usando o enforcamento cair método. Deixe o hidrogel para 1 min e enxague com DPBS excessiva. Transferir os discos de hidrogel em uma placa 6-poços de agarose-revestido, adicionar 5 mL de DMEM basal e incube-os a 37 ° C e 5% de CO2 por até 30 dias. Atualize o meio a cada 3 dias.
- Repita os passos de 3.2.1 - 3.2.6.
-
Viabilidade celular e esferoide
- Use um ensaio MTS para determinar a viabilidade celular. Lavar cada disco com DPBS e corte em 4 partes com uma boa lâmina estéril. Recolher as peças de todo o disco e transferi-los para uma placa de 96 poços. Em seguida, adicionar 100 μL de DMEM além de 20 µ l de reagente MTS a cada poço e incubar a mistura a 37 ° C por 2 h.
- Após a reação de MTS, recuperar o sobrenadante e transferir para uma placa limpa de 96. Medir a absorvância das amostras em 490 nm.
-
Formação de esferoide
- Pegue o modelo da hélice ou disco incubado da incubadora nos dias 0, 7, 15, 21 e 30 da cultura e transferi-los para uma placa limpa de 6.
- Uso um disco giratório confocal microscópio para visualizar os esferoides e adquirir as imagens usando várias posições e z-pilhas invertido. Cada hélice, ou modelo de disco, ao longo do seu diâmetro horizontal da esquerda para a direita com uma lacuna de 500 µm e adquirir uma z-pilha do fundo para o topo plano focal em cada posição horizontal da imagem.
Nota: Consulte a Tabela de materiais para as informações do fornecedor. - Reconstrua a imagem usando uma ferramenta de pilha máximo aritmética, fornecida pelo programa ImageJ, para criar as imagens 2D usadas para análise um esferoide.
5. microscopia eletrônica (SEM)
- Prepare o hidrogel de alginato/gelatina conforme descrito na etapa 1.2.
Nota: Não são necessárias condições estéreis.
Cuidado: Paraformaldeído e nitrogênio líquido são perigosos e devem ser manuseados com cuidado. - Colocar 1 mL de hidrogel em um almofariz, adicionar nitrogênio líquido e triturá-lo usando um pilão. Continue a adicionar nitrogênio líquido para evitar o hidrogel de descongelação. Transferir o pó em um tubo de centrífuga de 1,5 mL, selá-lo e armazená-lo a-80 ° C por 2 h. congelar a amostra por 24 h.
- Para a imagem latente de esferoide, lave o hidrogel suavemente com DPBS 2 x, consertar as células por imersão em paraformaldeído 4% durante 30 min a 37 ° C e em seguida Enxague com DPBS e congelá-los com nitrogênio líquido. Finalmente, congela a amostra por 24 h.
- Analisar a estrutura de hidrogel/esferoide e morfologia com um microscópio eletrônico de varredura (MEV) em 25,0 kV, abaixo dos 70 Pa (pressão de câmara), com uma ampliação de 40 X 5, 000 X.
Resultados
A varredura de temperatura mostra uma diferença distinta do precursor A3G7 a 25 ° C e 37 ° C. O precursor é líquido a 37 ° C e tem uma viscosidade complexa de 1938.1 ± 84,0 mPa x s, o que é validado por um G maior "sobre G'. Como a temperatura diminui, o precursor sofre física gelificação devido o emaranhamento física espontânea das moléculas de gelatina em uma formação de tri-hélice29,30. Ambos o G' e a G "aumentar e convergem a 30,6 ° C, indicando uma transição sol-gel. Os módulos continuam a aumentar, com a diminuição da temperatura, atingindo 468.5 ± 34,2 Pa de G' e 140.7 ± 9,3 Pa de G "a 25 ° C (Figura 1a). Baseado nos resultados da varredura da temperatura, a 25 ° C como a temperatura da impressão. O experimento de cinética de gelificação simula a mudança de temperatura que ocorre durante a preparação das amostras e manipulação (ou seja, retirar a amostra a 37 ° C da água banho e colocá-lo na câmara de bioprinter de 25 ° C). G', G ", e | η * | aumentar com o tempo, a temperatura baixou, e a transição sol-gel acontece no ~ 17 min a 25 ° C, quando G' ≈ G "≈ 64,3 Pa e o fator de perda é igual a 1 (Figura 1b e 1C). O precursor continua a endurecer e atinge uma janela de impressão após 50-90 min de gelificação. Dentro desta janela de impressão, o precursor pode ser suavemente extrudado usando um bocal cilíndrico G25 com uma pressão de 200 kPa. A existência de elasticidade implica um comportamento do material sólido e aumenta a integridade estrutural após a extrusão para suportar seu próprio peso31. A rampa de stress reconhece o stress de rendimento em momentos diferentes da gelificação. Os resultados mostram que o stress de rendimento aumenta com o tempo de gelificação crescente. À 50 min de gelificação, o stress de rendimento atinge 325.9 Pa, assegurando que o modelo é estável após a extrusão.
O modelo de impresso da hélice é mostrado na Figura 2a. Microscopia confocal confirma os locais de extrusão inicial de ambos o MDA-MB-231-GFP e as células de IMR-90-mCherry (Figura 2b). As células de MDA-MB-231-GFP começam a desenvolver esferoides 15 dias o período de cultura, seguido pelo aumento de tamanho e números de esferoides até dia 30 (Figura 2C - 2f). Algumas das células IMR-90-mCherry também formam aglomerações (Figura 2 g - 2j). Visivelmente, após 30 dias de cultura, IMR-90-mCherry células são observadas na região inicialmente ocupada pelas células MDA-MB-231-GFP (Figura 2f), implicando a eventos de migração possível no modelo. Da mesma forma, migrados MDA-MB-231-GFP de células também podem ser observadas na região de Gir-90-mCherry dominado no dia 30 (Figura 2j).
O modelo de disco é mostrado na Figura 3a. Microscopia confocal confirma a distribuição homogênea de células dentro do disco (Figura 3b). As células de MDA-MB-231-GFP se comportam da mesma forma no modelo de disco como fizeram quando impresso como um modelo de hélice. Imagens representativas são exibidas na Figura 3C - 3f. Imagem SEM revela um hidrogel de esferoide-carregado do MDA-MB-231-GFP após 21 dias da cultura (figura 4a). A geração e a presença, do spheroid é validado comparando as imagens SEM com hidrogel sem célula (figura 4b).
A viabilidade celular de ambos os tipos de célula é demonstrada na Figura 4C. MDA-MB-231-GFP células expressam uma maior viabilidade celular, em comparação com células IMR-90-mCherry. Curiosamente, as células de MDA-MB-231-GFP apresentam uma tendência aumentada de viabilidade antes do dia 15, com o triplo do número de células viáveis em relação ao dia 0. Isto é seguido por uma diminuição no dia 21, antes de recuperar novamente no dia 30. Em contraste, as células do IMR-90-mCherry têm flutuações mínimas de viabilidade durante a totalidade do período de cultura. Os valores decrescentes na viabilidade das células MDA-MB-231-GFP no dia 21 correspondem a uma grande formação de MTCSs, que desenvolveu núcleos necróticos.

Figura 1: caracterização reológica do precursor hidrogel. (um) A temperatura varredura mostra a transição sol-gel 30,6 ° c. (b-c) A cinética de gelificação do precursor A3G7 mostra um aumento de G', G ", e | η*| no tempo de gelificação, o sol-gel e transição acontece em aproximadamente 17 min a 25 ° C. (d) este painel mostra a elasticidade de precursor versus o tempo de gelificação. Observa-se um aumento da elasticidade com um tempo de mais coagulação. Os resultados são apresentados em média ± DP, n≥ 3. Clique aqui para ver uma versão maior desta figura.

Figura 2: Formação de MCTS dentro de um modelo in vitro de bioprinted 3D consistindo de Miofibroblasto IMR-90-mCherry e células de câncer de mama MDA-MB-231-GFP. (um) essas fotografias mostram o bioprinted em vitro amostra (à esquerda) e o modelo do CAD (à direita). (b) esta imagem representativa de lapso de tempo confocal mostra o MDA-MB-231-GFP (verde) e IMR-90-mCherry (vermelho) células bioprinted dentro do modelo. (c - f) Esses zoom-ins mostrar as regiões de célula de MDA-MB-231-GFP (caixas brancas pontilhadas). (g - j) esses zoom-ins mostrar as regiões de célula IMR-90-mCherry (amarelas caixas pontilhadas). As barras de escala são 2 mm no painel 2a, 1 mm no painel 2be 500 µm em painéis 2C - 2j para áreas selecionadas, e a ampliação é de 10 X. "D" maiusculo nas imagens significa "dias da cultura". Clique aqui para ver uma versão maior desta figura.
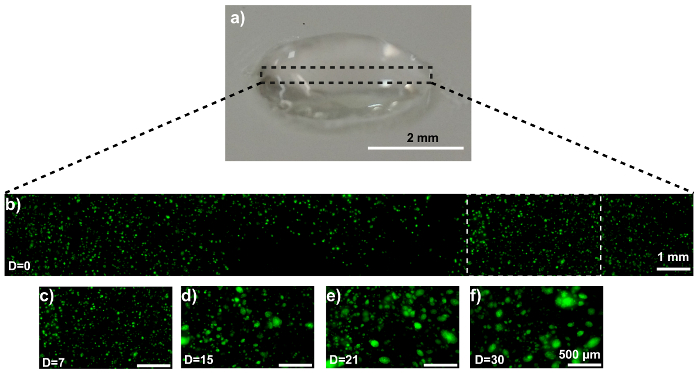
Figura 3: formação MCTS dentro de um disco de hidrogel MDA-MB-231-GFP-carregado 3D. (um) esta fotografia mostra um disco de hidrogel. (b) esta imagem confocal representativa mostra células de MDA-MB-231-GFP incorporado em resina composta. (c-f) Esses zoom-ins mostrar a região da célula MDA-MB-231-GFP (caixa branca pontilhada no painel 3b) a (c) 0, (d) 7, (e) 15 e (f), 21 dias de cultura. As barras de escala são 2 mm no painel 3a, 1 mm no painel 3be 500 µm em painéis 3C - 3f para áreas selecionadas, e a ampliação é de 10 X. "D" maiusculo nas imagens significa "dias da cultura". Clique aqui para ver uma versão maior desta figura.

Figura 4: viabilidade de morfologia e célula de MTCSs. (um) SEM esta imagem mostra um MCTS MDA-MB-231-GFP dentro do gel após 21 dias da cultura, mostrando pequeno MCTS (pontas de seta). (b), SEM esta imagem mostra um hidrogel de alginato/gelatina sem células. A ampliação é de 350 X. (c) este painel mostra a viabilidade celular de MDA-MB-231-GFP e IMR-90-mCherry durante 30 dias de cultura dentro do hidrogel. Os resultados foram analisados como a média ± DP e analisaram estatisticamente usando uma ANOVA de duas vias e pós-teste de Bonferroni um. p (*) < 0.05, n ≥ 3. Os dados foi normalizados para a densidade de células usada para criar as amostras no dia 0. Clique aqui para ver uma versão maior desta figura.
Discussão
Estruturas celulares-carregado podem ser comprometidas se a contaminação (química ou biológica) ocorre em qualquer ponto no processo. Geralmente, contaminação biológica é vista após dois ou três dias da cultura como uma cor mudar os meios de cultura ou a estrutura de bioprinted. Portanto, a esterilização (desinfecção química e física) é um passo fundamental para todos os processos relacionados à célula. Notável, gelatina de autoclavagem altera suas propriedades de coagulação, que tornou mais lento do gel nos ensaios conduzidos. Portanto, estamos esterilizados o alginato e gelatina poder através de UV exposição. Devido a capacidade muito limitada de penetração de luz UV, uma camada muito fina (< 0.5 mm) deve ser usada. A concentração de alginato e gelatina pode ser arbitrariamente alterada para ajustar as propriedades mecânicas e biológicas de32. No presente trabalho, optamos por A3G7, porque ele fornece printabilidade desejável durante a janela de impressão, e o hidrogel de quitosana proporciona uma estabilidade elevada através da experiência de 30 dias. Aquecimento a 60 ° C enquanto dissolvendo o pó DPBS ajuda a realçar a liquefação da gelatina, que facilita a agitação. Uma temperatura mais baixa também pode ser usada; no entanto, uma vez mais agitação será necessária.
A varredura de temperatura reológicas dá um ponto de sol-gel em 30,6 ° C, que é compatível com outras publicações33. Teoricamente, qualquer temperatura acima de 30,6 ° C pode liquefazer o precursor. Escolhemos a 37 ° C para simplificar o trabalho, como meio de cultura celular é previamente aquecido em banho maria a 37 ° C. Baseia-se a cinética de gelificação (antes os géis de precursor), há aproximadamente 17 min para célula de mistura; Após esse tempo, misturar as células e o precursor de hidrogel é difícil devido ao aumento da viscosidade e modulares, causando uma bioink célula-carregado não homogéneo. Portanto, sugerimos que lidar com o trabalho de célula-mistura dentro o primeiro 10 min de gelificação. O stress de rendimento não é considerado para ser um atributo material que afeta a qualidade de impressão até recentemente34; de qualquer maneira, foi amplamente reconhecido pelos cientistas do polímero como um marcador de fluido pastoso/granulado31,35,36,37. A existência de elasticidade ajuda a construir uma integridade estrutural para suportar seu próprio peso. Um rendimento elevado stress também pode exigir uma pressão aumentada de inicialização na extrusão; assim, isso pode resultar em danos às células devido à excessiva tensão de cisalhamento32. A fidelidade do modelo pode ser comprometida se o processo de extrusão ocorre fora da janela de impressão ideal. Indicadores comuns deste problema são mostradas na estrutura de bioprinted final: isso será muito difícil ou muito líquido nas bordas. O precursor de A3G7 exibe uma janela de impressão ideal durante 50-90 min de coagulação que satisfaça tanto a estabilidade estrutural e a sobrevivência da célula e pode ser usado como o meio para construir tumor heterogêneo modelos14.
A altura total do modelo da hélice é 600 µm como ele é gerado de quatro camadas de 150 µm de filamentos. Esse design permite que nutrientes e gás trocar como as células são, no máximo, 300 µm da superfície de contato com a mídia durante a incubação. Modelos mais são realizáveis em fabricação, mas são um gargalo pela distância limitada difusão dos nutrientes no hidrogel38, que pode resultar em uma sobrevivência da pilha baixa na região do núcleo.
Diferentes estratégias foram desenvolvidas para formulário MCTS em vitro, tais como a gota de enforcamento, microfluidic microplaqueta, assembly e bioprinting39. No entanto, algumas dessas metodologias podem alterar a fisiologia celular e bioquímica, gerando comportamentos diferentes células que ocorrem no tecido normal do tumor. Por exemplo, a suspensão drop método único de forças células para permanecer como agregados de células através de de confinamento físico40. Também, a indução química para formar MCTS por uma adição de peptídeo pode alterar a bioquímica do de esferoides41. O hidrogel composto descrito aqui permite uma formação MCTS, criando um ambiente biomimético sem estressores externos. Começando como únicas pilhas bem dispersas, após 7 dias de culturas, reorganizar as células como MCTS pequenas (mais de 6 células por esferoide), aumentando seu tamanho e quantidade durante 30 dias de cultura.
Os resultados desta pesquisa, descobrimos que esferoides MDA-MB-231-GFP diminuem a viabilidade celular no dia 21, correlacionando este fenômeno com a formação de esferoides grandes. Um tumor sólido é composto de três camadas diferentes, segundo a qual a camada externa apresenta uma taxa de proliferação elevada em comparação com a camada média e o núcleo interno de necrótico ou senescente do esferoide18. Isto poderia explicar a diminuição de viabilidade nos resultados.
Esta limitações do presente protocolo são (1) bioink dinâmica e compatibilidade do tipo de célula (2). Bioink dinâmica refere-se as diferentes propriedades de material durante o processo de gelificação, resultando em uma janela de impressão ideal para além do qual a estrutura impressa está com defeito. Compatibilidade do tipo de célula refere-se a incapacidade de certos tipos de células (linha celular ou cultura primária) exibem um comportamento nativo na vivo .
O hidrogel de A3G7 atinge uma elevada estabilidade e célula viabilidade. Bioprinting 3D pode ser usado para construir modelos 3D doença heterogênea com alta produtividade, baixo custo e alta reprodutibilidade como uma alternativa mais realista para cultura celular tradicional e modelos de tumor de animais pequenos.
Divulgações
Os autores não têm nada para divulgar.
Agradecimentos
Tao Jiang graças a China Scholarship Council (201403170354) e prêmio de doutorado engenharia de McGill (90025) para o financiamento de bolsas de estudo. Jose G. Munguia-Lopez Obrigado CONACYT (250279, 290936 e 291168) e FRQNT (258421) para o financiamento de bolsas de estudo. Salvador Flores-Torres Obrigado CONACYT para sua bolsa de financiamento (751540). Joseph M. Kinsella graças a ciência nacional e Engineering Research Council, a Fundação Canadense para a inovação, a Fundação da família de Townshend-Lamarre e McGill University para seu financiamento. Gostaríamos de agradecer a Allen Ehrlicher que nos permite usar seu rheometer, Dan Nicolau nos permitir usar seu microscópio confocal e Morag Park para conceder-nos acesso a linhas de célula fluorescente etiquetadas.
Materiais
| Name | Company | Catalog Number | Comments |
| Sodium alginate | FMC BioPolymer | CAS-No: 9005-38-3 | Protanal LF 10/60 FT |
| Gelatin | Sigma-Aldrich | G9391 | Type B gelatin from bovine skin |
| Dubelcco's phosphate buffered saline (DPBS 1X) | Gibco | LS14190136 | 1×, w/o calcium, w/o magnesium |
| Magnetic hotplate | Corning | N/A | Stirrer/hot plate model PC-420 |
| 50 mL centrifuge tubes | Corning | 352098 | Falcon® 50mL High Clarity PP Centrifuge Tube, Conical Bottom, Sterile |
| Centrifuge | GMI | N/A | Sorvall RT6000D, GMI, USA |
| Calcium chloride anhydrous | Sigma-Aldrich | C1016 | |
| MilliQ water | Millipore | N/A | |
| Millipore 0.22 µm filters | Millipore | SLGS033SB | Millex-GS Syringe Filter Unit, 0.22 µm, mixed cellulose esters, 33 mm, ethylene oxide sterilized |
| Oscillation rheometer MCR 302 | Anton Paar | N/A | |
| Rheometer measuring tool CP25 | Anton Paar | 79038 | Conical plate geometry for rheometer |
| RheoCompass | Anton Paar | N/A | Software controlling rheometer MCR 302 |
| Scanning electron microscope | Hitachi | N/A | SEM, Hitachi SU-3500 Variable Pressure |
| Paraformaldehyde, 96%, extra pure | Acros Organics | 416785000 | |
| Dulbecco modified eagle medium (DMEM) | Gibco | 11965092 | |
| Antibiotic/Antimycotic solution (100X) stabilized | Sigma | A5955 | |
| Fetal bovine serum | Wisent Bioproducts | 080-150 | |
| Cell culture T-75 flasks | Sigma-Aldrich | CLS430641 | 75 cm2 TC-Treated surface treatment |
| 3D bioprinter BioScaffolder 3.1 | GeSiM | N/A | |
| GeSim software | GeSiM | N/A | Software controlling BioScaffolder 3.1 |
| 10cc cartridge UV resist | EFD Nordson | 7012126 | |
| End cap | EFD Nordson | 7014472 | |
| Tip cap | EFD Nordson | 7014469 | |
| Piston | EFD Nordson | 7012182 | |
| Stainless nozzle G25 | EFD Nordson | 7018345 | |
| Water bath | VWR | N/A | |
| Agarose | Sigma-Aldrich | A9539 | Bioreagent, for molecular biology |
| Costar 6-well plates | Corning | 3516 | TC-Treated Multiple Well Plates, Individually Wrapped, Sterile |
| Confocal spinning disk inverted microscope | Olympus Life Science | N/A | Olympus IX83 |
| MTS assay kit | Promega | G3582 | CellTiter 96® AQueous One Solution Cell Proliferation Assay |
| Live/Dead viability cytotoxicity kit | Molecular Probes,ThermoFisher Scientific | L3224 | |
| Trypsin 0.25/EDTA 1X | Gibco | 25200-072 | |
| Corning 96-well plate | Corning | 3595 | Clear Flat Bottom Polystyrene TC-Treated Microplate, Individually Wrapped, with Low Evaporation Lid, Sterile |
| Autoclave Tuttnauer | Heidolph Brinkmann | N/A | Heidolph Tuttnauer 2540E Autoclave Sterilizer Electronic Model with 4 Stainless Steel Trays, 23L Capacity |
| Trypan blue | Invitrogen | T10282 | 0.4% solution |
| Ethanol | Commercial Alcohols | P016EA95 | Greenfield Speciality Alcohols |
| CO2 Incubator | Panasonic | N/A | MCO 19AIC-PA |
| Lyophilizer | SP Scientific | N/A | Virtis Sentry 2.0 |
| SolidWorks | Dassault Systems | N/A | A CAD software used to build demostrative propeller-like model |
| MATLAB | The MathWorks | N/A | A programming software used to generate G-code for BioScaffolder 3.1 |
Referências
- Cui, X., Hartanto, Y., Zhang, H. Advances in multicellular spheroids formation. Journal of the Royal Society Interface. 14 (127), (2017).
- Yip, D., Cho, C. H. A multicellular 3D heterospheroid model of liver tumor and stromal cells in collagen gel for anti-cancer drug testing. Biochemical and Biophysical Research Communications. 433 (3), 327-332 (2013).
- Breslin, S., O'Driscoll, L. The relevance of using 3D cell cultures, in addition to 2D monolayer cultures, when evaluating breast cancer drug sensitivity and resistance. Oncotarget. 7 (29), 45745-45756 (2016).
- Yue, X., Lukowski, J. K., Weaver, E. M., Skube, S. B., Hummon, A. B. Quantitative proteomic and phosphoproteomic comparison of 2D and 3D colon cancer cell culture models. Journal of Proteome Research. 15 (12), 4265-4276 (2016).
- Priwitaningrum, D. L., et al. Tumor stroma-containing 3D spheroid arrays: a tool to study nanoparticle penetration. Journal of Controlled Release. 244 (Pt B), 257-268 (2016).
- Hong, S., et al. Cellular behavior in micropatterned hydrogels by bioprinting system depended on the cell types and cellular interaction. Journal of Bioscience and Bioengineering. 116 (2), 224-230 (2013).
- Dolati, F., et al. In vitro evaluation of carbon-nanotube-reinforced bioprintable vascular conduits. Nanotechnology. 25 (14), 145101(2014).
- Murphy, S. V., Atala, A. 3D bioprinting of tissues and organs. Nature Biotechnology. 32 (8), 773-785 (2014).
- Kang, H. W., et al. A 3D bioprinting system to produce human-scale tissue constructs with structural integrity. Nature Biotechnology. 34 (3), 312-319 (2016).
- Miller, J. S., et al. Rapid casting of patterned vascular networks for perfusable engineered three-dimensional tissues. Nature Materials. 11 (9), 768-774 (2012).
- Jia, W., et al. Direct 3D bioprinting of perfusable vascular constructs using a blend bioink. Biomaterials. 106, 58-68 (2016).
- Kolesky, D. B., Homan, K. A., Skylar-Scott, M. A., Lewis, J. A. Three-dimensional bioprinting of thick vascularized tissues. Proceedings of the National Academy of Sciences of the United States of America. 113 (12), 3179-3184 (2016).
- Lee, V., et al. Design and fabrication of human skin by three-dimensional bioprinting. Tissue Engineering Part C: Methods. 20 (6), 473-484 (2014).
- Jiang, T., et al. Directing the self-assembly of tumour spheroids by bioprinting cellular heterogeneous models within alginate/gelatin hydrogels. Scientific Reports. 7 (1), 4575(2017).
- Knowlton, S., Onal, S., Yu, C. H., Zhao, J. J., Tasoglu, S. Bioprinting for cancer research. Trends in Biotechnology. 33 (9), 504-513 (2015).
- Derby, B. Printing and prototyping of tissues and scaffolds. Science. 338 (6109), 921-926 (2012).
- Nair, K., et al. Characterization of cell viability during bioprinting processes. Biotechnology Journal. 4 (8), 1168-1177 (2009).
- Costa, E. C., et al. 3D tumor spheroids: an overview on the tools and techniques used for their analysis. Biotechnology Advances. 34 (8), 1427-1441 (2016).
- Zhao, Y., et al. Three-dimensional printing of Hela cells for cervical tumor model in vitro. Biofabrication. 6 (3), 035001(2014).
- Ling, K., et al. Bioprinting-based high-throughput fabrication of three-dimensional MCF-7 human breast cancer cellular spheroids. Engineering. 1 (2), 269-274 (2015).
- Liang, Y., et al. A cell-instructive hydrogel to regulate malignancy of 3D tumor spheroids with matrix rigidity. Biomaterials. 32 (35), 9308-9315 (2011).
- Szot, C. S., Buchanan, C. F., Freeman, J. W., Rylander, M. N. 3D in vitro bioengineered tumors based on collagen I hydrogels. Biomaterials. 32 (31), 7905-7912 (2011).
- Carey, S. P., Kraning-Rush, C. M., Williams, R. M., Reinhart-King, C. A. Biophysical control of invasive tumor cell behavior by extracellular matrix microarchitecture. Biomaterials. 33 (16), 4157-4165 (2012).
- Hospodiuk, M., Dey, M., Sosnoski, D., Ozbolat, I. T. The bioink: a comprehensive review on bioprintable materials. Biotechnology Advances. 35 (2), 217-239 (2017).
- Caliari, S. R., Burdick, J. A. A practical guide to hydrogels for cell culture. Nature Methods. 13 (5), 405-414 (2016).
- Bhutani, U., Laha, A., Mitra, K., Majumdar, S. Sodium alginate and gelatin hydrogels: viscosity effect on hydrophobic drug release. Materials Letters. 164, 76-79 (2016).
- Biswal, D., et al. Effect of mechanical and electrical behavior of gelatin hydrogels on drug release and cell proliferation. Journal of the Mechanical Behavior of Biomedical Materials. 53, 174-186 (2016).
- Rowley, J. A., Madlambayan, G., Mooney, D. J. Alginate hydrogels as synthetic extracellular matrix materials. Biomaterials. 20 (1), 45-53 (1999).
- Djabourov, M., Leblond, J., Papon, P. Gelation of aqueous gelatin solutions. I. Structural investigation. Journal de Physique (France). 49 (2), 319-332 (1988).
- Djabourov, M., Leblond, J., Papon, P. Gelation of aqueous gelatin solutions. II. Rheology of the sol-gel transition. Journal de Physique (France). 49 (2), 333-343 (1988).
- Coussot, P. Rheometry of Pastes, Suspensions, and Granular Materials: Applications in Industry and Environment. , Wiley-Interscience. Hoboken, NJ. (2005).
- Ouyang, L., Yao, R., Zhao, Y., Sun, W. Effect of bioink properties on printability and cell viability for 3D bioplotting of embryonic stem cells. Biofabrication. 8 (3), 035020(2016).
- Michon, C., Cuvelier, G., Launay, B. Concentration dependence of the critical viscoelastic properties of gelatin at the gel point. Rheologica Acta Rheologica Acta: An International Journal of Rheology. 32 (1), 94-103 (1993).
- Mouser, V. H., et al. Yield stress determines bioprintability of hydrogels based on gelatin-methacryloyl and gellan gum for cartilage bioprinting. Biofabrication. 8 (3), 035003(2016).
- Benbow, J. J., Oxley, E. W., Bridgwater, J. The extrusion mechanics of pastes-the influence of paste formulation on extrusion parameters. Chemical Engineering Science. 42 (9), 2151-2162 (1987).
- Bingham, E. C. Fluidity and plasticity. , McGraw-Hill. New York, NY. (1922).
- Horrobin, D. J., Nedderman, R. M. Die entry pressure drops in paste extrusion. Chemical Engineering Science. 53 (18), 3215-3225 (1998).
- Soman, P., et al. Cancer cell migration within 3D layer-by-layer microfabricated photocrosslinked PEG scaffolds with tunable stiffness. Biomaterials. 33 (29), 7064-7070 (2012).
- Asghar, W., et al. Engineering cancer microenvironments for in vitro 3-D tumor models. Materials Today. 18 (10), 539-553 (2015).
- Lin, R. Z., Chang, H. Y. Recent advances in three-dimensional multicellular spheroid culture for biomedical research. Biotechnology Journal. 3 (9-10), 1172-1184 (2008).
- Akasov, R., et al. Formation of multicellular tumor spheroids induced by cyclic RGD-peptides and use for anticancer drug testing in vitro. International Journal of Pharmaceutics. 506 (1-2), 148-157 (2016).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados