Method Article
Bioprintable Alginat/Gelatine Hydrogel 3D In-vitro- Modellsysteme induzieren Sphäroid Zellbildung
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Wir entwickelten eine heterogene Brust-Krebs-Modell, bestehend aus verewigt Tumor und Fibroblasten-Zellen eingebettet in ein Bioprintable Alginat/Gelatine Bioink. Das Modell der in Vivo Tumor Mikroumgebung rekapituliert und erleichtert die Bildung von mehrzelligen Tumor Sphäroide, Einblick in die Mechanismen fahren Tumorgenese nachgeben.
Zusammenfassung
Die zelluläre, Biochemische und biophysikalische Heterogenität der native Tumor Mikroumgebung ist nicht durch wachsende verewigt Krebszelllinien, die mit herkömmlichen zweidimensionalen (2D) Zellkultur zusammengefaßt. Durch den Einsatz von Bioprinting Techniken die um heterogene dreidimensionale (3D) Tumor Modelle zu bauen, wobei verschiedene Arten von Zellen eingebettet sind, können diese Herausforderungen bewältigt werden. Alginat und Gelatine sind zwei der am häufigsten verwendeten Biomaterialien in Bioprinting aufgrund ihrer Biokompatibilität, Bionik und mechanischen Eigenschaften eingesetzt. Durch die Kombination der beiden Polymere, erzielten wir ein Bioprintable zusammengesetzte Hydrogel Ähnlichkeiten mit der mikroskopischen Architektur eine native Tumor-Stroma. Wir studierten die Bedruckbarkeit der zusammengesetzten Hydrogel über Rheologie und erhalten die optimale Druck-Fenster. Brustkrebs-Zellen und Fibroblasten waren eingebettet in die Hydrogele und gedruckt werden, um ein 3D-Modell imitiert die Mikroumgebung in Vivo zu bilden. Das Bioprinted heterogenen Modell erreicht eine hohe Rentabilität für langfristige Zellkultur (> 30 Tage) und fördert die Selbstorganisation von Brustkrebszellen in mehrzelligen Tumor Sphäroide (MCTS). Wir beobachteten die Migration und die Interaktion der Krebs-assoziierten fibroblastenzellen (CAFs) mit MCTS in diesem Modell. Bioprinted Zelle Kultur Plattformen als kokultur Systeme verwenden, bietet es ein einzigartiges Werkzeug, um die Abhängigkeit der Tumorgenese Stroma Komposition zu studieren. Diese Technik verfügt über einen hohen Durchsatz, niedrige Kosten und hohe Reproduzierbarkeit kann, und es auch ein alternatives Modell zu herkömmlichen Zellkulturen Monolage und tierischen Tumormodellen Krebsbiologie zu studieren.
Einleitung
Obwohl 2D Zellkultur in der Krebsforschung verbreitet ist, gibt es Einschränkungen, wie die Zellen in einem monomolekularen Film-Format mit einer einheitlichen Konzentration von Nährstoffen und Sauerstoff angebaut werden. Diese Kulturen fehlen wichtige Zell-Zell und Zellmatrix Interaktionen in der nativen Tumor Mikroumgebung (TME). Diese Modelle rekapitulieren infolgedessen schlecht physiologische Bedingungen, wodurch aberranten Zelle Verhalten, einschließlich unnatürlich Morphologien, unregelmäßige Rezeptor Organisation, Membran-Polarisation und abnorme Genexpression, unter anderem Bedingungen1,2,3,4. Auf der anderen Seite bietet 3D Zellkultur, wo Zellen in einem volumetrischen Raum als Aggregate, Sphäroide oder Organellen erweitert werden, eine alternative Technik erstellen genauere in-vitro- Umgebungen um grundlegende Zellbiologie und Physiologie zu studieren. 3D zellmodelle Kultur können auch Zelle-ECM Interaktionen fördern, die kritischen physiologischen Eigenschaften des nativen TME in-vitro-1,4,5. Die neue 3D Bioprinting Technologie bietet Möglichkeiten Modelle zu bauen, die die heterogene TME zu imitieren.
3D Bioprinting ist abgeleitet von rapid-Prototyping und ermöglicht die Herstellung von 3D Mikrostrukturen, die imitiert einige von der Komplexität des Lebens können Gewebe Proben6,7. Die aktuellen Bioprinting Methoden beinhalten Inkjet, Extrusion und Lasergestützte Druck8. Unter ihnen kann die Extrusion-Methode die Heterogenität innerhalb der gedruckten Matrizen durch die präzise Positionierung verschiedene Arten von Materialien an verschiedenen ursprünglichen Standorten gesteuert werden. Daher ist es der beste Ansatz für heterogene in-vitro- Modelle mit mehreren Arten von Zellen oder Matrizen zu fabrizieren. Extrusion Bioprinting hat erfolgreich zur Ohrmuschel geformte Gerüste9, vaskulären Strukturen10,11,12, zu bauen und die Haut Gewebe13, was zu hohen Druck Treue und Zelle Lebensfähigkeit. Die Technologie bietet auch vielseitige Material Auswahlen, die Möglichkeit, Materialien mit Zellen eingebettet mit einem bekannten Dichte und hohe Reproduzierbarkeit14,15,16,17 zu hinterlegen . Natürliche und synthetische Hydrogele dienen häufig als Bioinks für 3D Bioprinting wegen ihrer Bioverträglichkeit, Bioaktivität und ihre hydrophilen Netzwerke, die entwickelt werden können, um die ECM7,18 strukturell ähneln ,19,20,21,22,23. Hydrogele sind auch vorteilhaft, da sie können Klebestellen für Zellen, Strukturelemente, Durchlässigkeit für Nährstoffe und Gase enthalten, und die entsprechenden mechanischen Eigenschaften fördern Entwicklung24 Zelle. Zum Beispiel bieten Kollagen Hydrogele Integrin Anchorage-Websites, die Zellen verwenden können, um die Matrix zuordnen. Gelatine, denaturiertes Kollagen, behält sich ähnliche Zelle Adhäsion Websites. Im Gegensatz dazu Alginat ist Bioinert bietet aber mechanische Integrität durch die Bildung von Querverbindungen mit zweiwertigen Ionen25,26,27,28.
In dieser Arbeit entwickelten wir eine zusammengesetzte Hydrogel als ein Bioink, bestehend aus Alginat und Gelatine, Ähnlichkeiten mit der mikroskopischen Architektur eine native Tumor-Stroma. Brustkrebs-Zellen und Fibroblasten waren eingebettet in die Hydrogele und gedruckt über eine Extrusion-basierte Bioprinter um ein 3D-Modell zu erstellen, die in Vivo Mikroumgebung imitiert. Veränderte 3D-Umgebung kann Krebszellen zu mehrzelligen Tumor Sphäroide (MCTS) bilden mit einer hohen Rentabilität für lange Zeitspannen der Zellkultur (> 30 Tage). Dieses Protokoll zeigt die Methoden der Synthese zusammengesetzter Hydrogele, Charakterisierung der Materialien Mikrostruktur und Bedruckbarkeit, heterogene zellmodellen Bioprinting, und beobachten die Bildung von MCT-Fette. Diese Methoden können genutzt werden, um andere Bioinks in Extrusion Bioprinting sowie über verschiedene Ausführungen von heterogenen Gewebemodelle mit Anwendungsmöglichkeiten in Drogen-Screening, Zelle Migration Tests und Studien, die sich auf grundlegende Zelle physiologischen Funktionen.
Protokoll
1. Vorbereitung der Materialien, Hydrogel und Zelle Kultur Materialien
-
Material und Lösung Vorbereitung
- Waschen Sie und trocknen Sie, 250 mL und 100 mL Glas Becher, 25 G zylindrische Düsen (eine Länge von 0,5 in) mit einem Innendurchmesser von 250 µm, magnetische Rührwerke, Spachteln, 10 mL-Kartuschen. Die Materialien durch Autoklavieren zu sterilisieren Sie bei 121 ° C/15 min/1 ATM halten die Materialien unter sterilen Bedingungen bis zur Verwendung.
Hinweis: Beziehen sich auf die Tabelle der Materialien für die Herstellerinformationen. - Gewicht 3 g Alginat (3 % w/V) und 7 g Gelatine (7 % w/V) (im folgenden als A3G7 bezeichnet).
- Sterilisieren Sie die folgenden Elemente unter UV-Licht für mind. 4 h: Alginat und Gelatine Pulver, Paraffin-Film, Aluminium Folienstücke von 5 cm2, und 1 mL und 5 mL Spritzen. Sterilisieren Sie die Endkappen, Spitze Kappen und Kolben durch Eintauchen in 70 % igem Ethanol für mindestens 4 h und waschen Sie sie 2 X mit sterilisierten Ultrareines Wasser.
Hinweis: Beziehen sich auf die Tabelle der Materialien für die Herstellerinformationen. - 4 g Agarose mit hochreinem Wasser auflösen und durch Autoklavieren zu sterilisieren.
Hinweis: Die Agarose ist nach dem Autoklavieren Prozess aufgelöst hat. - Bereiten Sie eine 100 mM-Lösung von wasserfreiem Calciumchlorid (CaCl2) in sterilisierten Ultrareines Wasser und ein Sterilfilter (mit einer Porengröße von 0,22 µm) vor der Verwendung.
- Schmelzen Sie für Agarose-beschichteten 6-Well-Platten die sterile Agarose in einer Mikrowelle, eine flüssige Lösung zu erhalten; Fügen Sie dann unter eine biologische Kabinett (BSC) und mit einer Mikropipette 1 mL, 2 mL pro Bohrloch und mischen Sie es vorsichtig, um eine gleichmäßige Schicht in den Boden des Brunnens zu schaffen. Lassen Sie es abkühlen und Versiegeln des Brunnens mit Paraffin Film. Halten Sie es bei Raumtemperatur (RT) bis zur Verwendung.
- Waschen Sie und trocknen Sie, 250 mL und 100 mL Glas Becher, 25 G zylindrische Düsen (eine Länge von 0,5 in) mit einem Innendurchmesser von 250 µm, magnetische Rührwerke, Spachteln, 10 mL-Kartuschen. Die Materialien durch Autoklavieren zu sterilisieren Sie bei 121 ° C/15 min/1 ATM halten die Materialien unter sterilen Bedingungen bis zur Verwendung.
-
Vorbereitung der A3G7 Hydrogel-Vorstufe
- Mischen Sie 3 g Alginat und 7 g Gelatine-Pulver in einen 250-mL-Becherglas innerhalb einer BSC. Fügen Sie ein Magnetrührer und 100 mL des DPBS. Verschließen Sie den Becher mit sterilem Paraffin Film und Aluminiumfolie (5 cm2) zur Vermeidung von Kontaminationen.
- Lösen Sie das Pulver unter ständiger Bewegung in einem magnetischen/heißen Teller mit 600 u/min bei 60 ° C für 1 h und bei RT gegen Aufpreis 2 h.
- Das Material bei 37 ° C zu erhitzen, bis das Gel einen Phasenübergang in den flüssigen Zustand erfährt (für 100 mL Lager Gel-Lösung, dies dauert ca. 45 min.). Übertragen Sie die Lösung in sterilen 50 mL konische Zentrifuge Röhren, versiegeln Sie und Zentrifugieren Sie Schläuche am 834 X g für 5 min Gasblasen aus dem Material zu beseitigen.
- Aspirieren Sie den Hydrogel-Vorläufer in 10 mL Spritzen. Siegel der Spritzen mit Kappen und Paraffin-Film. Bis zur Verwendung bei 4 ° C lagern.
-
Zellkultur
Hinweis: Die Schritte in diesem Abschnitt müssen unter sterilen Bedingungen durchgeführt werden.- Vorbereiten der basalen DMEM Medium wie folgt (1 L): in einer BSC mischen 100 mL des fetalen bovine Serum (FBS) plus 10 mL einer Antibiotikum/antimykotische Lösung (100 x stabilisierte Lösung) in einen frischen sterilen Behälter. DMEM Medium Anpassen der Mischung hinzufügen bis zu 1.000 mL. Verschließen Sie den Behälter und halten Sie es bei 4 ° C.
- Tauen Sie in einem zuvor erwärmte Wasserbad (37 ° C) auf, 1 Durchstechflasche von MDA-MB-231-GLP (menschliche Brust Krebs Zell-Linie mit der Bezeichnung der GFP, nukleare Lokalisierung) und 1 Phiole der IMR-90-mCherry (Krebs-assoziierten Fibroblasten Zelllinien mit zytoplasmatischen Lokalisierung-beschriftet, mCherry ) Zellen aus dem flüssigen Stickstoff-Speicher durch Verschieben sie sanft ins Wasser. Zell-Linien sowohl die Plasmide für GLP und mCherry Beschriftung, sind im Handel erhältlich.
- Übertragen Sie 160 µL/Well Zelle Lösung (3 x 106 Zellen/mL) in einem 6-Well-Platte und 5 mL basale DMEM Medium erwärmt (37 ° C). Inkubieren Sie die Platte bei 37 °C/5% CO2 für 24-48 h, bis die Zellen Zusammenfluss von 80 % erreichen.
- Nachdem die Zellen Zusammenfluss erreicht haben, verwerfen Sie das Medium zu und spülen Sie die Zellen zweimal mit DPBS; Inkubation der Zellen mit 500 µL Trypsin-EDTA Lösung/Well (0,25 %, 1 X zuvor erwärmt bei 37 ° C) bei 37 ° C 6 min. lang. Dann inaktivieren die Trypsin durch Zugabe von 500 µL der FBS, die Zelle Lösung zu erholen und überträgt es auf T-75 Flaschen. Inkubieren sie wieder bei 37 °C/5% CO2 , bis die Zellen Zusammenfluss von 80 % erreichen.
Hinweis: Das Volumen der Trypsin-EDTA Lösung variieren je nach das Zellwachstum Schiff. - Wiederholen Sie den vorherigen Schritt, Passage 3-4 mit Zellen zu arbeiten, wie das ist, wenn Zellen mehr metabolische Aktivität und Stabilität haben.
- Zählen Sie die Zellen mit einem Trypan blau-Assay (0,4 %) festzustellen, die Ausgangskonzentration der Zellen mit dem Hydrogel gemischt werden.
(2) Messungen der rheologischen Eigenschaften der Hydrogele
- Bereiten Sie den Alginat/Gelatine Hydrogel Vorläufer wie unter Punkt 1.2 beschrieben.
Hinweis: Sterile Bedingungen sind nicht erforderlich für Proben für mechanische Tests und Analysen erstellt. Alle sind rheologische Prüfungen in dreifacher Ausfertigung. - Nehmen Sie eine Spritze der Hydrogel-Vorstufe und Aufwärmen im Wasserbad 37 ° C für 1 h.
- Schalten Sie das Rheometer und initialisieren Sie das System nach den folgenden Schritten zu.
- Schalten Sie die Luft-Kompressor mit dem Rheometer und lassen Sie die Luft-Kompressor für 30 min. Schalten Sie die Temperatur-Control-Box für das Rheometer Rheometer selbst schalten, und schalten Sie den Computer laufen mit dem Rheometer verbunden verbunden.
- Öffnen Sie die Rheometer-Software, klicken Sie auf die Systemsteuerung zu initialisieren , und lassen Sie die Initialisierungsprozess beenden. Die Plattform-Temperatur auf 37 ° C auf dem Bedienfeld einstellen.
- Klicken Sie auf die Registerkarte " Measuring Set " und navigieren Sie zu der Service-Funktion starten, wählen Sie Adjust Massenträgheit des Fahrzeugführers im Drop-Down-Menü aus und klicken Sie im Popup-Fenster Anpassung zu starten .
- Montieren Sie eine parallele Messwerkzeug in dem Rheometer. Alle Experimente verwenden eine 25 mm-Durchmesser-Platte mit einem 1 mm Abstand zwischen den Platten.
- Klicken Sie auf dem Bedienfeld auf null-Abstand einstellen und warten Sie, bis das Verfahren zu beenden. Achten Sie auf die normale Kraft während dieses Prozesses.
Hinweis: Nach diesem Vorgang sollte die Normalkraft 0 sein. - Klicken Sie auf die Registerkarte " Measuring Set " und navigieren Sie zu der Service-Funktion zu starten, wählen Sie Adjust oberen Mess-System Trägheit, und klicken Sie im Popup-Fenster Anpassung zu starten . Ist das erledigt, klicken Sie auf die Dreieck-Taste auf dem Bedienfeld ermöglicht das Messwerkzeug, aufzusteigen.
- Führen Sie eine Amplitude Sweep.
- Klicken Sie auf Start, dann klicken Sie auf Einfügen im Menü oben, wählen Sie aus dem Dropdown-Menü warten . Ziehen Sie das Setup-Fenster und legen Sie die Wartezeit bis 2 h.
Hinweis: Dadurch wird einen Schritt warten vor den Tests hinzugefügt. - Klicken Sie auf Start, klicken Sie erneut auf die Schaltfläche " Einfügen ", und wählen Sie aus der Drop-Down-Menü Gerät. Ziehen Sie das Setup-Fenster, wählen Sie Temperaturund setzen Sie ihn auf 25 ° c. Deaktivieren Sie das Kontrollkästchen der warten, bis der Wert erreicht wird.
- Klicken Sie auf den Schritt Messung, dann klicken Sie auf die Variable Schwingung Belastung, ziehen Sie das Setup-Fenster, Profil zu Rampe Logarithmusund ändern Sie den Wert auf 0,001 % und 100 % als anfangsdehnung und endgültige Belastung, bzw.. Stellen Sie die Frequenz bei 0,01 Hz.
- Klicken Sie auf Hinzufügen , fügen Sie die Variable Temperatur . Klicken Sie auf die Variable Temperatur und setzen Sie ihn auf 25 ° c. Im Pull-up-Fenster erweitern Sie Taschenrechner, Punktdichte auf 10 Punkte/Dekade gesetzt.
- Nehmen Sie die Spritze aus dem Wasserbad und Extrudieren Sie etwa 0,5 mL der Vorstufe auf die Rheometer-Plattform.
- Klicken Sie auf den nach unten Dreieck-Taste auf dem Bedienfeld. Warten Sie, bis das Messwerkzeug zur Trimmung Position nach unten zu bewegen.
- Einem Spatel zu trimmen alle überschüssigen Vorläufersubstanzen, die am Rande des Mess-Tools zu entkommen und das überflüssige Material.
- Pipette Mineralöl auf den Rand des Mess-Tools und warten Sie, bis das Öl vollständig die Grenze versiegelt.
- Klicken Sie auf weiter auf dem Bedienfeld. Klicken Sie auf die Schaltfläche Start (grünes Dreieck), gefolgt durch Klicken auf die Schaltfläche " weiter " am unteren Bildschirm.
- Nach Abschluss der Prüfung Loslassen des Mess-Tools, und klicken Sie dann auf die nach oben Dreieck-Taste auf dem Bedienfeld. Entfernen Sie das Messwerkzeug und reinigen Sie sie mit 70 % Ethanol. Reinigen Sie die Plattform mit 70 % Ethanol.
- Klicken Sie im aktuellen Projekt auf den Schritt Messung und ziehen Sie das Setup-Fenster. Nun, die Frequenz bis 100 Hz. halten alle anderen Parameter unverändert.
- Wiederholen Sie die Schritte 2.4.5 - 2.4.10.
- Klicken Sie auf Diagramm. Beobachten die Kurve von G', G " gegen die Oszillation Belastung. Finden der Umlenkpunkte g ' für beide Frequenzen (0,01 Hz und 100 Hz). Finden Sie die entsprechende Schwingung Belastungen für beide Umlenkpunkte.
- Wählen Sie die kleineren Schwingung Belastung und 1/10 dieser Sorte für alle Oszillation Tests durchgeführt, danach.
Hinweis: Das Auftreten von G' Durchbiegung gilt als die ultimative lineare elastischen Dehnung (Module), die im Follow-up-Tests nicht überschritten werden sollte. Das Verhältnis 1/10 ist in der Regel in den Ingenieurwissenschaften aus Sicherheitsgründen verwendet. Der berechnete Belastung als gCbezeichnet wird. - Nachdem der Test abgeschlossen ist, klicken Sie auf Tabelle, kopieren Sie alle Daten, und fügen Sie ihn in eine Textdatei.
- Klicken Sie auf Start, dann klicken Sie auf Einfügen im Menü oben, wählen Sie aus dem Dropdown-Menü warten . Ziehen Sie das Setup-Fenster und legen Sie die Wartezeit bis 2 h.
- Führen Sie einen Temperatur-Sweep.
- Klicken Sie auf meine apps und wählen Sie die Vorlage temperaturrampe, Oszillatorische Scherung: Gelierung.
- Nennen Sie das Projekt.
- Klicken Sie auf den Schritt Messung im Workflow. Klicken Sie auf die Variable Temperatur, ziehen Sie das Setup-Fenster und stellen Sie die Anfangs- und Endwert Temperatur auf 37 ° C und 25 ° C betragen.
- Stellen Sie in dem Pull-up-Fenster Oszillation Belastung auf 0,1 %, Schwingungsfrequenz zu 1Hz ein Legen Sie die Anzahl der Datenpunkte sind 61. Die Daten-Sammlung-Frequenz auf 1 Punkt/min. Klicken Sie auf Rechner und auf 0,2 ° C eingestellt Punktdichte/point.
Hinweis: Dies ermöglicht die Temperatur mit einer Rate von 0,2 ° C/min ändern. - Laden Sie die Probe auf die Rheometer-Plattform und führen Sie den Test durch folgende Schritte 2.4.5 - 2.4.10.
- Klicken Sie auf Diagramm, beobachten die G', G " gegenüber der Temperatur. Finden der Crossover-Punkt G' und G ". Die Temperatur, bei der Crossover-Punkt zu finden.
Hinweis: Dies ist der Sol/Gel-Übergangstemperatur der Hydrogel-Vorstufe. - Wiederholen Sie Schritt 2.4.15..
- Führen Sie eine isothermische Zeit Sweep.
- Klicken Sie auf meine apps finden Sie und klicken Sie auf die Vorlage Isothermen Zeit / Temperatur zu testen. Klicken Sie auf den Schritt Messung im Workflow, und klicken Sie dann auf die Variable Schwingung Stamm, Hochziehen der Setup-Fenster, die Oszillation Belastung auf 0,1 %, und die Schwingungsfrequenz auf 1 Hz eingestellt. In dem Pull-up-Fenster Anzahl der Datenpunkte auf 120. Stellen Sie die Daten-Sammlung-Frequenz auf 1 Punkt/min.
Hinweis: Der Wert dieser Sorte basiert auf den Ergebnissen der Amplitude Sweep. - Klicken Sie auf die Schaltfläche " Hinzufügen ", um die Temperatur Variable hinzuzufügen. Klicken Sie auf Variable Temperatur im mittleren Fenster und setzen Sie ihn auf 25 ° C.
- Den Gerät bewegen, Messpunkt Schritt im Workflow der rechten Maustaste, klicken Sie auf Löschen. Klicken Sie auf den Schritt Gerät Wert festlegen, deaktivieren Sie das Kontrollkästchen warten, bis der Wert erreicht wirdund legen Sie Wert auf 25 ° C. Klicken Sie auf Bild, Pünktchen, Tasten am unteren Bildschirm, deaktivieren Sie das Kontrollkästchen weiter. Dann klicken Sie auf den Schritt beginnen, Name des Projekts, und speichern sie.
- Laden Sie die Probe auf die Rheometer-Plattform zu und starten Sie den Test durch folgende Schritte 2.4.5 - 2.4.10.
- Beobachten der G', G " gegen die Zeit. Finden der Crossover-Punkt G' und G ". Finden Sie die Zeit in der Crossover-Punkt. Nachdem der Test abgeschlossen ist, klicken Sie auf Tabelle, kopieren Sie alle Daten, und fügen Sie ihn in eine Textdatei.
Hinweis: Dies ist der Sol/Gel-Übergangszeit der Hydrogel-Vorstufe bei 25 ° C.
- Klicken Sie auf meine apps finden Sie und klicken Sie auf die Vorlage Isothermen Zeit / Temperatur zu testen. Klicken Sie auf den Schritt Messung im Workflow, und klicken Sie dann auf die Variable Schwingung Stamm, Hochziehen der Setup-Fenster, die Oszillation Belastung auf 0,1 %, und die Schwingungsfrequenz auf 1 Hz eingestellt. In dem Pull-up-Fenster Anzahl der Datenpunkte auf 120. Stellen Sie die Daten-Sammlung-Frequenz auf 1 Punkt/min.
- Die Streckgrenze gelierende verschiedentlich zu messen.
- Klicken Sie auf meine apps finden und klicken Sie auf die Vorlage Ertrag und Flow Stress, Gel-artige. Nennen Sie das Projekt. Klicken Sie auf die starten Schritt im Workflow. Klicken Sie im oberen Menü auf Einfügen , und wählen Sie im Drop-Down-Menü warten. Ziehen Sie das Setup-Fenster und setzen Sie die Wartezeit 20 min. sein.
Hinweis: Dadurch wird einen Schritt warten vor den Tests hinzugefügt. - Klicken Sie auf Start, dann Einfügen klicken Sie erneut auf, und wählen Sie im Drop-Down-Menü Gerät. Ziehen Sie das Setup-Fenster, wählen Sie Temperatur, und setzen Sie ihn auf 25 ° C. Deaktivieren Sie das Kontrollkästchen warten, bis der Wert erreicht wird.
- Klicken Sie auf den Schritt Messung im Workflow, wählen Sie die Variable Schubspannung, ziehen Sie das Setup-Fenster und die Anfangs- und Endwert Scherspannung "bzw." auf 0 und 10.000 Pa festgelegt. Klicken Sie auf Rechner, die Punktdichte auf 0,2 Punkt/PA. Legen Sie in der Registerkarte " Datenpunkte " auf der linken Seite 1 Punkt pro Sekunde.
Hinweis: Dies wird in einer Stress-Rampen-Rate von 5 Pa/s führen. - Klicken Sie auf die Ereignissteuerung Registerkarte am unteren Rand der Pull-up-Fenster und legen Sie die Stop-Kriterium: die Messung zu stoppen, wenn die Schere > 100 s-1bewerten.
Hinweis: Dies wird die Messung automatisch beendet, wenn das Material ergab. - Laden Sie die Probe auf die Rheometer-Plattform zu und starten Sie den Test durch folgende Schritte 2.4.5 - 2.4.10.
- Klicken Sie auf Diagramm. Beobachten Sie die Stamm-Spannungsverlauf. Suchen Sie die Durchbiegung der Belastung und der entsprechenden Stress. Wiederholen Sie die Schritte 2.7.2 - 2.7.6, aber ändern Sie die Wartezeit auf 30, 40 und 50 min für jede Wiederholung; Dadurch wird die Streckgrenze gelierende zeitversetzt.
Hinweis: Dieser Stress gilt als die scheinbare Streckgrenze.
Hinweis: Software Klicks können durch Rheometer Modelle und Software-Versionen unterscheiden. Wir empfehlen Leser Verweis von der Prüfparameter nehmen wir bieten, Weile finden Sie im Handbuch des spezifischen Rheometer/Software im praktischen Einsatz.
- Klicken Sie auf meine apps finden und klicken Sie auf die Vorlage Ertrag und Flow Stress, Gel-artige. Nennen Sie das Projekt. Klicken Sie auf die starten Schritt im Workflow. Klicken Sie im oberen Menü auf Einfügen , und wählen Sie im Drop-Down-Menü warten. Ziehen Sie das Setup-Fenster und setzen Sie die Wartezeit 20 min. sein.
(3) Gerüst Design, Zelle-beladenen Hydrogel und 3D-Druck Modelle
-
Gerüst-design
- Ein Propeller-ähnliches Modell auf Papier zu zeichnen.
Hinweis: Die Propeller-ähnliches Modell dient basiert auf folgenden Überlegungen: (a) Es simuliert die in Vivo -Szenario wo Krebszellen von CAFs umgeben sind; (b) es minimiert die Konzentration der Stress über die Verwendung von kreisförmigen Geometrien; (c) Es ist flexibel, so dass mehr Sektoren in das Modell in der Zukunft hinzugefügt werden können, ohne die vorhandenen Geometrien; und (d) Es ist flach in die vertikale Skala Nährstoff Verbreitung zu erleichtern. - Das Zentrum des Propellers werden die Herkunft und verwenden Sie die Symbole R0, R1und R2 , den maximale Radius des inneren Kreis, mittleren Sektoren und äußeren Sektoren bzw. vertreten zu lassen. Verwenden Sie die Symbole m und n , um die Anzahl der internen Bögen und Speichen innerhalb des Sektors, bzw. darzustellen.
- Berechnen Sie die Koordinaten der einzelnen Knoten auf den Propeller-ähnliches Modell und schreibe diese in die symbolische Ausdrücke R0, R1, R2, mund n.
- Ein Programm-Skript starten, R0, R1, R2, mund n als Variablen festlegen und Eingabe des symbolische Ausdrucks der einzelnen zentralen Knoten.
Hinweis: Beziehen sich auf die Tabelle der Materialien für alle Softwareinformationen. - Vereinbaren Sie einen Pfad, der die Knoten miteinander verbindet und weisen Sie eine Patrone für den inneren Kreis, den mittleren Sektoren und den äußeren Bereichen. Die Schichtdicke 150 µm und die Anzahl der Schichten auf 4 gesetzt.
- Lassen Sie das Programm eine Textdatei im G-Code-Format ausgeben, die durch die Bioprinter erkennbar ist.
- R0 eingestellt = 3,85, R1 = 6,85, R2 = 8,65 m = 2 und n = 5. Führen Sie das Skript und rufen Sie die erzeugten G-Code-Datei ab. Kopieren Sie und fügen Sie die Datei in den Bioprinter engagierten G-Code-Ordner.
- Aktivieren Sie die Bioprinter und die Steuerungssoftware. Initialisieren des Druckers. Öffnen Sie das G-Code-Skript einfach erstellt und alle drücke auf NULL gesetzt. Zurück zu die Steuerungs-Software, klicken Sie auf die Registerkarte Gerüstbauer Generator, und klicken Sie dann auf die Schaltfläche " Ausführen " in der rechten unteren Ecke. Beobachten Sie den bewegenden Pfad des Druckers.
Hinweis: Dies wird die Präzision der generierte G-Code testen. Beziehen sich auf die Tabelle der Materialien für Informationen in Bezug auf die Bioprinter. - Dieser Schritt ist optional. Bauen Sie eine demonstrative 3D-Modell basierend auf den Parametern über per Computer aided Design (CAD) Software.
Hinweis: Beziehen sich auf die Tabelle der Materialien für die Informationen der Hersteller.
- Ein Propeller-ähnliches Modell auf Papier zu zeichnen.
-
Machen Sie eine Zelle beladenen A3G7 Hydrogel Vorstufe
Hinweis: Die Schritte in diesem Abschnitt müssen unter sterilen Bedingungen durchgeführt werden. Halten Sie die Bioprinter innerhalb einer BSC.- Die Bioprinter durch Besprühen 70 % igem Ethanol gründlich zu sterilisieren und UV-Licht ausgesetzt über Nacht.
- Nehmen Sie eine Spritze mit dem Hydrogel-Vorläufer (bei 4 ° C) und warm es in einem Wasserbad bei 37 ° C für 1 h.
- Nehmen Sie den T-Kolben mit Zellen (siehe Punkt 1.3) von der CO2 Inkubator und legen Sie sie in einen Bachelor of Science. Das Kulturmedium zu verwerfen und die Zellen mit DPBS zweimal spülen. Hinzufügen einer erwärmten Trypsin-EDTA-Lösung (3,0 mL) und inkubieren Sie die Zellen bei 37 ° C 6 min. Inaktivierung der Trypsin mit einem gleichen Volumen der FBS. Zählen der Zellen verwenden Trypan blau-Assay.
- Nehmen Sie die Spritze der Hydrogel-Vorstufe aus dem Wasserbad, reinigen Sie und Sterilisieren sie mit 70 % Ethanol. Legen Sie die Spritze in den BSC.
- Extrudieren Sie ca. 3 mL Hydrogel Vorläufer in einer 10 mL Druck Patrone. Die Vorstufe mit MDA-MB-231-GFP Zellen 1 x 106 Zellen/ml zu mischen, langsam, pipettieren, die Produktion von Luftblasen zu vermeiden. Decken Sie die Patrone mit dem sterilen Ende und oberen Abdeckkappen und Abdichten mit Paraffin Film. Zentrifugieren sie 834 X g für 1 min, Gasblasen erzeugt zu beseitigen.
- Wiederholen Sie die Schritte 3.2.3 - 3.2.5 für IMR-90-mCherry Zelle beladenen Vorläufer und der zellfreien Vorläufer.
- Alle 3 Patronen mit 70 % Ethanol zu sterilisieren und anschließend in die Kammern der Bioprinter laden. Stellen Sie in der Drucker-Steuerungssoftware die Patrone Temperatur bis 25 ° C. Warten Sie 35 min damit den Vorläufer der druckbare Bedingungen erreichen kann.
Hinweis: Dieses Mal berührt nicht die Lebensfähigkeit der Zellen in das Hydrogel eingebettet.
-
3D Drucken von Modellen
- In der Drucker-Steuerungssoftware erweitern Sie Registerkarte Werkzeugkopf in der Drucker-Steuerungs-Software zu, klicken Sie auf 1 Patrone auf der grafischen Oberfläche auf der linken Seite und klicken Sie dann auf die Maßnahme kurz -Schaltfläche, um die Position der Düsenspitze messen. Wiederholen Sie diesen Vorgang für die anderen 2 Patronen.
- Legen Sie ein klares Polystyrol Mikrotestplatte, öffnen Sie die G-Code-Datei und ändern Sie den Druck, bis 200 kPa für alle Patronen. Zurück zu die Steuerungs-Software, klicken Sie auf die Registerkarte Gerüstbauer Generator, wählen Sie einen Punkt mit dem Drucken beginnen und klicken Sie dann auf die Schaltfläche " Ausführen " in der rechten unteren Ecke. Wiederholen Sie diesen Schritt, um 3 weitere Wiederholungen zu bekommen.
- Nach dem Drucken alle Replikate der Propeller Modelle, fügen Sie einen 100 mM CaCl2 -Lösung für die Modelle für 1 min zu vernetzen und spülen es 2 X mit DPBS, den Überschuss an Ca++ Ionen zu entfernen.
- Die Modelle auf einem Agarose-beschichteten 6-Well-Platte mit einem Spatel vorsichtig zu übertragen. Geben Sie 5 mL DMEM Medien in jedem. Inkubieren Sie die Platten in einem Inkubator bei 37 ° C und 5 % CO2.
Hinweis: Stellen Sie sicher, dass die Modelle in den Brunnen zu schweben. - Ersetzen Sie das Zellkulturmedium mit frischem Medium alle 3 Tage, für insgesamt 30 Tage Kultur.
(4) Lebensfähigkeit und Sphäroid Bildung Experimente auf den Hydrogel-Datenträgern.
-
Hydrogel-Disk-Vorbereitung
- Wiederholen Sie die Schritte 3.2.1 - 3.2.6.
Hinweis: Es ist möglich, die Patrone mit einem kleinen sterilen Behälter zu ersetzen. - Verwenden Sie eine sterile abgestuften 1 mL Spritze und schneiden Sie die Düse um ein großes Loch in die Spritze zu erstellen (das Loch hat den gleichen Durchmesser wie der Rest der Spritze Röhre). Reinigen Sie sie mit 70 % Ethanol und lassen Sie es, bis es trocken ist.
Hinweis: Hierzu in einem sterilen BSC. - Verwenden Sie einen Well-Platte Deckel, fügen Sie 100 mM CaCl2 hinzu , bis die Oberfläche bedeckt ist; nehmen Sie dann die Zelle beladenen Hydrogel um die Spritze zu füllen; Extrudieren 100 µL mit den hängenden drop-Methode. Verlassen Sie das Hydrogel für 1 min und spülen Sie ihn mit übermäßigen DPBS. Übertragen Sie die Hydrogel-Datenträger auf einem Agarose-beschichtet 6-Well-Platte zu, fügen Sie 5 mL basale DMEM und bis zu 30 Tage bei 37 ° C und 5 % CO2 inkubieren. Aktualisieren Sie das Medium alle 3 Tage.
- Wiederholen Sie die Schritte 3.2.1 - 3.2.6.
-
Zelle und Sphäroid Tragfähigkeit
- Verwenden Sie einen MTS-Test, um die Zellviabilität festzustellen. Jede Scheibe mit DPBS waschen und mit einer feinen sterilen Klinge in 4 Teile schneiden. Sammeln Sie die Teile der gesamten Festplatte und übertragen Sie sie auf einer 96-Well-Platte. Dann fügen Sie 100 μL der DMEM plus 20 μL der MTS-Reagenz in jede Vertiefung hinzu und inkubieren Sie die Mischung bei 37 ° C für 2 h.
- Nach der MTS-Reaktion den überstand zu erholen und auf eine saubere 96-Well-Platte übertragen. Messen Sie die Absorption der Proben bei 490 nm.
-
Sphäroid Bildung
- Herausnehmen des inkubierten Propeller oder Festplatte Modells aus dem Inkubator auf 0, 7, 15, 21 und 30 Tage der Kultur und übertragen Sie sie auf eine saubere 6-Well-Platte.
- Verwenden Sie konfokale drehenden Scheibe invertiert Mikroskop zu visualisieren die Sphäroide und erwerben die Bilder mit mehreren Positionen und Z-Stapel. Das Bild jeder Propeller oder Festplatte Modell entlang seiner horizontalen Durchmesser von links nach rechts mit einem Abstand von 500 µm und einen Z-Stapel von unten auf die obere Brennebene in jeder horizontalen Position zu erwerben.
Hinweis: Beziehen sich auf die Tabelle der Materialien für die Herstellerinformationen. - Rekonstruieren Sie das Bild mit einer maximalen Stack arithmetische Werkzeug, vom Programm ImageJ, erstelle ich die 2D Bilder für ein Sphäroid-Analyse verwendet.
5. Rasterelektronenmikroskopie (SEM)
- Bereiten Sie das Alginat/Gelatine Hydrogel wie unter Punkt 1.2 beschrieben.
Hinweis: Sterile Bedingungen sind nicht erforderlich.
Achtung: Flüssigstickstoff und Paraformaldehyd sind gefährlich und müssen mit Vorsicht behandelt werden. - 1 mL Hydrogel in einem Mörser genommen, flüssigen Stickstoff hinzufügen und mit einem Stößel zu mahlen. Fügen Sie flüssigen Stickstoff um das Hydrogel von Auftauen zu vermeiden. Übertragen Sie das Pulver in eine 1,5 mL Zentrifugenröhrchen, versiegeln Sie es und speichern Sie es bei-80 ° C für 2 h. Installationsprogrammen die Probe für 24 h.
- Für Sphäroid Bildgebung, waschen das Hydrogel sanft mit DPBS 2 X, die Zellen durch Eintauchen in 4 % Paraformaldehyd für 30 min bei 37 ° C zu beheben und dann spülen sie mit DPBS und frieren sie mit flüssigem Stickstoff. Zu guter Letzt Installationsprogrammen der Probe für 24 h.
- Analysieren Sie die Hydrogel/Sphäroid Struktur und Morphologie mit einem Rasterelektronenmikroskop (SEM) bei 25,0 kV, unter 70 Pa (Kammerdruck) mit einer Vergrößerung von 40 X bis zu 5 000 X.
Ergebnisse
Die Temperatur-Sweep zeigt einen deutlichen Unterschied der A3G7 Vorstufe bei 25 ° C und 37 ° C. Die Vorstufe ist bei 37 ° C flüssig und hat eine komplexe Viskosität von 1938.1 ± 84,0 mPa x s, die durch eine größere G überprüft wird "über G'. Da die Temperatur abnimmt, erfährt der Vorläufer physischen Gelierung durch die spontane körperliche verfangen der Gelatine Moleküle in einem Tri-Helix Bildung29,30. Sowohl die G' und G "erhöhen und konvergieren auf 30,6 ° C zeigt einen Sol-Gel-Übergang. Die Moduli weiter zunimmt, wobei geringere Temperatur erreichen 468.5 ± 34,2 Pa G' und 140,7 ± 9,3 Pa G "bei 25 ° C (Abb. 1a). Basierend auf den Ergebnissen des Temperatur-Sweeps, wählten wir als Druck Temperatur 25 ° C. Die Gelierung Kinetik Experiment simuliert die Temperaturänderung, die auftritt, während der Probenvorbereitung und der Handhabung (d. h.Entfernen der Probenmaterials aus der 37 ° C Wasser Bad und stellen Sie es in die Bioprinter Kammer 25 ° C). G', G ", und | η * | mit der Zeit auf die Absenktemperatur zu erhöhen, und der Sol-Gel-Übergang geschieht bei ~ 17 min bei 25 ° C, wenn G' ≈ G "≈ 64,3 Pa und der Verlustfaktor ist gleich 1 (Abbildung 1 b und 1 c). Der Vorläufer zu versteifen weiter und erreicht ein Drucken-Fenster nach 50-90 min Gelierung. Innerhalb dieses Drucken Fenster kann die Vorstufe reibungslos mit einer G25 zylindrische Düse mit einem Druck von 200 kPa extrudiert werden. Die Existenz der Fließspannung impliziert eine fest-wie Verhalten des Materials und wirft die strukturelle Integrität nach der Extrusion, eigenem Gewicht31zu widerstehen. Die Stress-Rampe erkennt die Streckgrenze zu unterschiedlichen Tageszeiten die Gelierung. Ergebnisse zeigen, dass die Streckgrenze erhöht sich mit der zunehmenden Gelierung Zeit. 50 min Gelierung, die Streckgrenze erreicht 325.9 Pa, versichert, dass das Modell ist nach der Extrusion stabil.
Das gedruckte Propeller-Modell ist in Abbildung 2agezeigt. Konfokale Mikroskopie bestätigt die ersten Extrusion Standorte von MDA-MB-231-GFP und der IMR-90-mCherry-Zellen (Abb. 2 b). Die MDA-MB-231-GFP-Zellen beginnen Sphäroide 15 Tage in die kulturdauer entwickeln gefolgt von erhöhte Größe und Anzahl der Sphäroide bis Tag 30 (Abbildung 2 c - 2f). Einige der IMR-90-mCherry-Zellen bilden auch Agglomerationen (Abbildung 2 g - 2j). Spürbar, werden nach 30 Tagen der Kultur, IMR-90-mCherry Zellen in der Region zunächst besetzt durch die MDA-MB-231-GFP-Zellen (Abb. 2f), mögliche Migration Veranstaltungen im Modell impliziert beobachtet. Ebenso können migrierte MDA-MB-231-GFP-Zellen auch im Großraum IMR-90-mCherry dominiert am Tag 30 (Abbildung 2j) beobachtet werden.
Die Disk-Modell ist in Abbildung 3agezeigt. Konfokale Mikroskopie bestätigt die homogene Zelle Verteilung innerhalb der Scheibe (Abb. 3 b). Die MDA-MB-231-GFP-Zellen Verhalten sich ähnlich im Disk-Modell, wie damals, als wie ein Propeller-Modell gedruckt. Repräsentative Bilder sind in Abbildung 3 c - 3fangezeigt. SEM Bildgebung zeigt ein MDA-MB-231-GFP Sphäroid beladenen Hydrogel nach 21 Tagen der Kultur (Abb. 4a). Die Erzeugung und die Präsenz des sphäroids wird durch den Vergleich der REM-Bilder mit zellfreien Hydrogele (Abbildung 4 b) validiert.
Die Zellviabilität beide Zelltypen wird in Abbildung 4 cgezeigt. MDA-MB-231-GFP Zellen zum Ausdruck bringen eine höhere Zellviabilität im Vergleich zu IMR-90-mCherry-Zellen. Interessanterweise zeigen die MDA-MB-231-GFP-Zellen eine erhöhte Tendenz der Rentabilität vor 15.Tag mit einer Verdreifachung der Anzahl der lebensfähigen Zellen im Vergleich zum Tag 0. Danach ist eine Abnahme am Tag 21, vor der Wiederherstellung wieder auf 30 Tage. Im Gegensatz dazu haben die IMR-90-mCherry-Zellen minimalen Schwankungen der Lebensfähigkeit während der gesamten Kultur Periode. Die abnehmende Werte Lebensfähigkeit der MDA-MB-231-GFP Zellen an Tag 21 entsprechen eine große MTCSs-Formation, die nekrotische Kerne entwickelt hat.

Abbildung 1: rheologische Charakterisierung des Vorläufers Hydrogel. (ein) A Temperatur Sweep zeigt den Sol-Gel-Übergang bei 30,6 ° C. (b-c) Die Gelierung Kinetik der A3G7 Vorstufe zeigt einen Anstieg von G', G ", und | η*| Zeitpunkt der Gelierung und das Sol-Gel Übergang geschieht bei ca. 17 min bei 25 ° C. (d) dieses Panel zeigt die Streckgrenze der Vorläufer im Vergleich zu den Zeitpunkt Gelierung. Eine Erhöhung der Streckgrenze wird mit einer mehr gelierende Zeit beobachtet. Die Ergebnisse sind in Mittelwert ± SD, n≥ 3 gezeigt. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 2: MCTS Bildung in einem 3D Bioprinted in Vitro Modell bestehend aus IMR-90-mCherry-Myofibroblast und MDA-MB-231-GFP Brustkrebszellen. (ein) diese Fotos zeigen die Bioprinted in Vitro Probe (links) und das CAD-Modell (rechts). (b) dieses repräsentativen konfokale Zeitraffer Bild zeigt die MDA-MB-231-GLP (grün) und IMR-90-mCherry (rot)-Zellen Bioprinted innerhalb des Modells. (c - f) Diese Zoom-ins zeigen die MDA-MB-231-GFP Zelle Regionen (weiße gestrichelten Boxen). (g - j) diese Zoom-ins zeigen die IMR-90-mCherry-Zelle-Regionen (gelb gestrichelten Boxen). Der Maßstabsbalken sind etwa 2 mm in Panel 2a, 1 mm im Panel 2 bund 500 µm in Platten 2 c - 2j für ausgewählte Gebiete und die Vergrößerung ist 10 X. Kapital "D" in den Bildern: "Tage der Kultur". Bitte klicken Sie hier für eine größere Version dieser Figur.
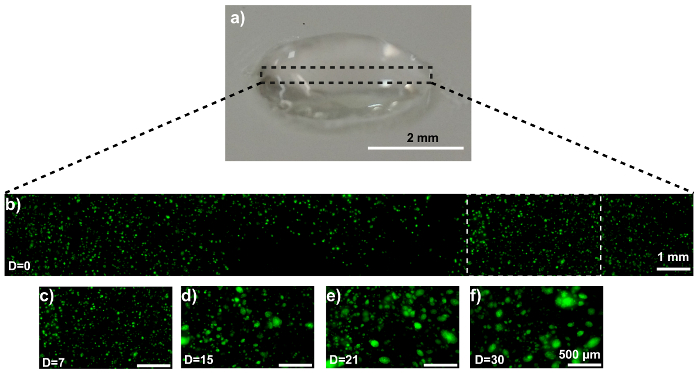
Abbildung 3: MCTS Bildung innerhalb einer 3D MDA-MB-231-GFP-beladenen Hydrogel-Scheibe. (ein) dieses Foto zeigt einen Hydrogel-Datenträger. (b) zeigt dieses repräsentativen konfokale Bild MDA-MB-231-GFP Zellen eingebettet im Verbund. (c-f) Diese Zoom-ins anzeigen die MDA-MB-231-GFP Zelle Region (weiße gepunktete Feld im Panel 3 b) (c) 0, (d) 7, (e) 15, und (f) 21 Tage der Kultur. Der Maßstabsbalken sind etwa 2 mm in Panel 3a, 1 mm im Panel 3 bund 500 µm in Paneele 3 c - 3f für ausgewählte Gebiete und die Vergrößerung ist 10 X. Kapital "D" in den Bildern: "Tage der Kultur". Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 4: Morphologie und Zelle Tragfähigkeit der MTCSs. (ein) das REM-Bild zeigt einen MDA-MB-231-GFP MCTS in das Gel nach 21 Tagen der Kultur, zeigen kleine MCTS (Pfeil-Spitzen). (b) diese SEM Bild zeigt ein Alginat/Gelatine Hydrogel ohne Zellen. Die Vergrößerung beträgt 350 X. (c) zeigt dieses Fenster die Zellviabilität von MDA-MB-231-GFP und IMR-90-mCherry während 30 Tagen nach der Kultur innerhalb der Hydrogel. Die Ergebnisse wurden als Mittelwert ± SD analysiert und mit einer zwei-Wege-ANOVA und eine Bonferroni Posttest statistisch analysiert. p (*) < 0,05, n ≥ 3. Die Daten wurde auf die Zelldichte verwendet, um die Proben am Tag 0 erstellen normalisiert. Bitte klicken Sie hier für eine größere Version dieser Figur.
Diskussion
Zelle-beladenen Strukturen können beeinträchtigt werden, wenn Kontamination (biologische oder chemische) an jedem Punkt im Prozess auftritt. In der Regel Biologische Kontamination gilt nach zwei oder drei Tage der Kultur als eine Farbe ändern in den Kultur-Medien oder die Bioprinted-Struktur. Daher ist die Sterilisation (physikalische und chemische Desinfektion) ein wichtiger Schritt für alle Handy-bezogenen Prozesse. Bemerkenswert, Autoklavieren Gelatine ändert seine gelierende Eigenschaften, wodurch es langsamer gel in den Studien, die wir durchgeführt. Daher sterilisiert wir die Alginat und Gelatine macht über UV Belichtung. Aufgrund der sehr begrenzten Penetration Fähigkeit, UV-Licht sollte eine sehr dünne Schicht (< 0,5 mm) verwendet werden. Die Konzentration von Alginat und Gelatine kann beliebig verändert werden, um die mechanische und biologische Eigenschaften32Stimmen. In der vorliegenden Arbeit haben wir uns A3G7, weil es wünschenswert Bedruckbarkeit während seiner Drucken Fenster bietet und vernetzt Hydrogel eine hohe Stabilität durch die 30-Tage-Experiment bietet. Heizung auf 60 ° C, während Pulver in DPBS auflösen, um die Liquefication der Gelatine zu verbessern hilft, das erleichtert des rühren. Eine niedrigere Temperatur kann auch verwendet werden; jedoch werden mehr Rührzeit dann erforderlich.
Der rheologischen Temperatur Sweep gibt einen Sol-Gel-Punkt bei 30,6 ° C, die mit anderen Publikationen33kompatibel ist. Theoretisch kann jeder über 30,6 ° C Temperatur den Vorläufer verflüssigen. Wir entschieden uns für 37 ° C, die Arbeit zu vereinfachen, wie Zellkulturmedium im Wasserbad 37 ° C vorgewärmt ist. Basierend auf die Gelierung Kinetik (bevor die Vorläufer-Gele), gibt es ca. 17 min zum Mischen von Zelle; nach dieser Zeit ist die Vermischung der Zellen und der Hydrogel-Vorläufer schwierig wegen der erhöhten Viskosität und Moduli, verursacht eine nicht homogene Zelle beladenen Bioink. Wir empfehlen daher, die Zelle mischen Arbeit innerhalb der ersten 10 min der Gelbildung. Die Streckgrenze gilt nicht als eine materielle Eigenschaft, die Bedruckbarkeit bis vor kurzem34betrifft; Egal, ist weitgehend von Polymer-Wissenschaftlern als Marker für pastöse/körnige Flüssigkeit31,35,36,37erkannt worden. Die Existenz der Fließspannung hilft zum Aufbau einer strukturellen Integrität, sein eigenes Gewicht zu widerstehen. Eine hohe Streckgrenze kann auch einen erhöhte Start Druck in der Extrusion erfordern; So kann dies zu Schäden führen zu den Zellen durch übermäßige Schubspannung32. Die Modell-Treue kann beeinträchtigt werden, tritt im Extrusionsverfahren außerhalb des optimalen Druck-Fensters. Gemeinsame Indikatoren für dieses Problem sind in der letzten Bioprinted-Struktur gezeigt: Es werden entweder zu hart oder zu flüssig an den Rändern. A3G7 Vorläufer weist eine optimale Druck-Fenster während der 50-90 min Gelier-, die erfüllt die strukturelle Stabilität und das Überleben der Zellen und kann verwendet werden, als das Medium, heterogene Tumor zu bauen14Modelle.
Die Gesamthöhe des Modells Propeller ist 600 µm als er von vier generiert wird 150 µm Filamente geschichtet. Dieses Design ermöglicht es, Nährstoff- und Gas austauschen, wie Zellen sind höchstens 300 µm von der Oberfläche Kontakt mit den Medien während der Inkubation. Höher Modelle sind erreichbar in der Herstellung aber durch die begrenzte Verbreitung Entfernung der Nährstoffe in das Hydrogel38, was eine niedrige Zelle Überleben in der Kernregion führen kann beseitigt werden.
Unterschiedliche Strategien wurden in Form MCTS in Vitro, wie z. B. hängenden Tropfen, Mikrofluidik-Chip, Montage- und Bioprinting39entwickelt. Jedoch können einige dieser Methoden verändern der Zelle Physiologie und Biochemie, Generierung von verschiedenen Zelle Verhalten, die auftreten im normalen Tumorgewebe. Zum Beispiel die hängenden drop-Methode Kräfte einzelne Zellen als Zelle Aggregate durch physische Entbindung40zu bleiben. Auch kann die chemische Induktion zu bilden MCTS durch eine Peptid-Ergänzung der Biochemie der Sphäroide41verändern. Der hier beschriebenen Hydrogel-Verbund ermöglicht eine MCTS-Bildung durch die Schaffung einer biomimetischen Umgebung ohne externe Stressoren. Start als Einzelzellen gut dispergierte, nach 7 Tagen von Kulturen, Zellen neu ordnen als kleine MCTS erhöhen (mehr als 6 Zellen pro Sphäroid), ihre Größe und Menge während 30 Tagen nach der Kultur.
In den Ergebnissen dieser Forschung fanden wir, dass MDA-MB-231-GFP Sphäroide verringern die Zellviabilität am Tag 21, dieses Phänomen mit der Gründung der großen Sphäroide korrelieren. Ein solide Tumor besteht aus drei verschiedenen Schichten, wobei die äußere Schicht eine hohe proliferationsrate im Vergleich zu der mittleren Schicht und den internen nekrotische oder alternde Kern der Sphäroid18präsentiert. Dies könnte erklären, die Lebensfähigkeit Abnahme in den Ergebnissen.
Diese Einschränkungen dieses Protokolls sind (1) Bioink Dynamik und (2) Zelle Typkompatibilität. Bioink Dynamik bezieht sich auf die unterschiedlichen Materialeigenschaften bei der Gelierung, wodurch eine optimale Drucken Fenster, jenseits, die derer die gedruckten Struktur defekt ist. Zelle Typkompatibilität bezieht sich auf die Unfähigkeit bestimmte Zelltypen (Zelllinie oder Primärkultur), eine native in Vivo Verhalten aufweisen.
A3G7 Hydrogel wird eine hohe Stabilität und Zelle Tragfähigkeit erreicht. 3D Bioprinting kann verwendet werden, zum Erstellen von 3D heterogene Erkrankung Modellen mit hohem Durchsatz, niedrige Kosten und hohe Reproduzierbarkeit als eine realistischere Alternative zu traditionellen Zellkultur und kleine Tier Tumormodellen.
Offenlegungen
Die Autoren haben nichts preisgeben.
Danksagungen
Tao Jiang Dank der China Scholarship Council (201403170354) und McGill Engineering Promotion Award (90025) für ihre Stipendium Finanzierung. Jose G. Munguia-Lopez Dank CONACYT (250279, 290936 und 291168) und FRQNT (258421) für ihre Stipendium Finanzierung. Salvador Flores-Torres Dank CONACYT für ihr Stipendium finanziert (751540). Joseph M. Kinsella Dank der National Science und Engineering Research Council, der kanadischen Stiftung für Innovation, die Townshend-Lamarre Family Foundation und die McGill University für ihre Finanzierung. Wir möchten Allen Ehrlicher danken für die Erlaubnis, seine Rheometer, Dan Nicolau für die Überlassung seiner confocal Mikroskop und Morag Park für die Gewährung von Zugang zu eindringmittel beschrifteten Zelllinien zu verwenden.
Materialien
| Name | Company | Catalog Number | Comments |
| Sodium alginate | FMC BioPolymer | CAS-No: 9005-38-3 | Protanal LF 10/60 FT |
| Gelatin | Sigma-Aldrich | G9391 | Type B gelatin from bovine skin |
| Dubelcco's phosphate buffered saline (DPBS 1X) | Gibco | LS14190136 | 1×, w/o calcium, w/o magnesium |
| Magnetic hotplate | Corning | N/A | Stirrer/hot plate model PC-420 |
| 50 mL centrifuge tubes | Corning | 352098 | Falcon® 50mL High Clarity PP Centrifuge Tube, Conical Bottom, Sterile |
| Centrifuge | GMI | N/A | Sorvall RT6000D, GMI, USA |
| Calcium chloride anhydrous | Sigma-Aldrich | C1016 | |
| MilliQ water | Millipore | N/A | |
| Millipore 0.22 µm filters | Millipore | SLGS033SB | Millex-GS Syringe Filter Unit, 0.22 µm, mixed cellulose esters, 33 mm, ethylene oxide sterilized |
| Oscillation rheometer MCR 302 | Anton Paar | N/A | |
| Rheometer measuring tool CP25 | Anton Paar | 79038 | Conical plate geometry for rheometer |
| RheoCompass | Anton Paar | N/A | Software controlling rheometer MCR 302 |
| Scanning electron microscope | Hitachi | N/A | SEM, Hitachi SU-3500 Variable Pressure |
| Paraformaldehyde, 96%, extra pure | Acros Organics | 416785000 | |
| Dulbecco modified eagle medium (DMEM) | Gibco | 11965092 | |
| Antibiotic/Antimycotic solution (100X) stabilized | Sigma | A5955 | |
| Fetal bovine serum | Wisent Bioproducts | 080-150 | |
| Cell culture T-75 flasks | Sigma-Aldrich | CLS430641 | 75 cm2 TC-Treated surface treatment |
| 3D bioprinter BioScaffolder 3.1 | GeSiM | N/A | |
| GeSim software | GeSiM | N/A | Software controlling BioScaffolder 3.1 |
| 10cc cartridge UV resist | EFD Nordson | 7012126 | |
| End cap | EFD Nordson | 7014472 | |
| Tip cap | EFD Nordson | 7014469 | |
| Piston | EFD Nordson | 7012182 | |
| Stainless nozzle G25 | EFD Nordson | 7018345 | |
| Water bath | VWR | N/A | |
| Agarose | Sigma-Aldrich | A9539 | Bioreagent, for molecular biology |
| Costar 6-well plates | Corning | 3516 | TC-Treated Multiple Well Plates, Individually Wrapped, Sterile |
| Confocal spinning disk inverted microscope | Olympus Life Science | N/A | Olympus IX83 |
| MTS assay kit | Promega | G3582 | CellTiter 96® AQueous One Solution Cell Proliferation Assay |
| Live/Dead viability cytotoxicity kit | Molecular Probes,ThermoFisher Scientific | L3224 | |
| Trypsin 0.25/EDTA 1X | Gibco | 25200-072 | |
| Corning 96-well plate | Corning | 3595 | Clear Flat Bottom Polystyrene TC-Treated Microplate, Individually Wrapped, with Low Evaporation Lid, Sterile |
| Autoclave Tuttnauer | Heidolph Brinkmann | N/A | Heidolph Tuttnauer 2540E Autoclave Sterilizer Electronic Model with 4 Stainless Steel Trays, 23L Capacity |
| Trypan blue | Invitrogen | T10282 | 0.4% solution |
| Ethanol | Commercial Alcohols | P016EA95 | Greenfield Speciality Alcohols |
| CO2 Incubator | Panasonic | N/A | MCO 19AIC-PA |
| Lyophilizer | SP Scientific | N/A | Virtis Sentry 2.0 |
| SolidWorks | Dassault Systems | N/A | A CAD software used to build demostrative propeller-like model |
| MATLAB | The MathWorks | N/A | A programming software used to generate G-code for BioScaffolder 3.1 |
Referenzen
- Cui, X., Hartanto, Y., Zhang, H. Advances in multicellular spheroids formation. Journal of the Royal Society Interface. 14 (127), (2017).
- Yip, D., Cho, C. H. A multicellular 3D heterospheroid model of liver tumor and stromal cells in collagen gel for anti-cancer drug testing. Biochemical and Biophysical Research Communications. 433 (3), 327-332 (2013).
- Breslin, S., O'Driscoll, L. The relevance of using 3D cell cultures, in addition to 2D monolayer cultures, when evaluating breast cancer drug sensitivity and resistance. Oncotarget. 7 (29), 45745-45756 (2016).
- Yue, X., Lukowski, J. K., Weaver, E. M., Skube, S. B., Hummon, A. B. Quantitative proteomic and phosphoproteomic comparison of 2D and 3D colon cancer cell culture models. Journal of Proteome Research. 15 (12), 4265-4276 (2016).
- Priwitaningrum, D. L., et al. Tumor stroma-containing 3D spheroid arrays: a tool to study nanoparticle penetration. Journal of Controlled Release. 244 (Pt B), 257-268 (2016).
- Hong, S., et al. Cellular behavior in micropatterned hydrogels by bioprinting system depended on the cell types and cellular interaction. Journal of Bioscience and Bioengineering. 116 (2), 224-230 (2013).
- Dolati, F., et al. In vitro evaluation of carbon-nanotube-reinforced bioprintable vascular conduits. Nanotechnology. 25 (14), 145101(2014).
- Murphy, S. V., Atala, A. 3D bioprinting of tissues and organs. Nature Biotechnology. 32 (8), 773-785 (2014).
- Kang, H. W., et al. A 3D bioprinting system to produce human-scale tissue constructs with structural integrity. Nature Biotechnology. 34 (3), 312-319 (2016).
- Miller, J. S., et al. Rapid casting of patterned vascular networks for perfusable engineered three-dimensional tissues. Nature Materials. 11 (9), 768-774 (2012).
- Jia, W., et al. Direct 3D bioprinting of perfusable vascular constructs using a blend bioink. Biomaterials. 106, 58-68 (2016).
- Kolesky, D. B., Homan, K. A., Skylar-Scott, M. A., Lewis, J. A. Three-dimensional bioprinting of thick vascularized tissues. Proceedings of the National Academy of Sciences of the United States of America. 113 (12), 3179-3184 (2016).
- Lee, V., et al. Design and fabrication of human skin by three-dimensional bioprinting. Tissue Engineering Part C: Methods. 20 (6), 473-484 (2014).
- Jiang, T., et al. Directing the self-assembly of tumour spheroids by bioprinting cellular heterogeneous models within alginate/gelatin hydrogels. Scientific Reports. 7 (1), 4575(2017).
- Knowlton, S., Onal, S., Yu, C. H., Zhao, J. J., Tasoglu, S. Bioprinting for cancer research. Trends in Biotechnology. 33 (9), 504-513 (2015).
- Derby, B. Printing and prototyping of tissues and scaffolds. Science. 338 (6109), 921-926 (2012).
- Nair, K., et al. Characterization of cell viability during bioprinting processes. Biotechnology Journal. 4 (8), 1168-1177 (2009).
- Costa, E. C., et al. 3D tumor spheroids: an overview on the tools and techniques used for their analysis. Biotechnology Advances. 34 (8), 1427-1441 (2016).
- Zhao, Y., et al. Three-dimensional printing of Hela cells for cervical tumor model in vitro. Biofabrication. 6 (3), 035001(2014).
- Ling, K., et al. Bioprinting-based high-throughput fabrication of three-dimensional MCF-7 human breast cancer cellular spheroids. Engineering. 1 (2), 269-274 (2015).
- Liang, Y., et al. A cell-instructive hydrogel to regulate malignancy of 3D tumor spheroids with matrix rigidity. Biomaterials. 32 (35), 9308-9315 (2011).
- Szot, C. S., Buchanan, C. F., Freeman, J. W., Rylander, M. N. 3D in vitro bioengineered tumors based on collagen I hydrogels. Biomaterials. 32 (31), 7905-7912 (2011).
- Carey, S. P., Kraning-Rush, C. M., Williams, R. M., Reinhart-King, C. A. Biophysical control of invasive tumor cell behavior by extracellular matrix microarchitecture. Biomaterials. 33 (16), 4157-4165 (2012).
- Hospodiuk, M., Dey, M., Sosnoski, D., Ozbolat, I. T. The bioink: a comprehensive review on bioprintable materials. Biotechnology Advances. 35 (2), 217-239 (2017).
- Caliari, S. R., Burdick, J. A. A practical guide to hydrogels for cell culture. Nature Methods. 13 (5), 405-414 (2016).
- Bhutani, U., Laha, A., Mitra, K., Majumdar, S. Sodium alginate and gelatin hydrogels: viscosity effect on hydrophobic drug release. Materials Letters. 164, 76-79 (2016).
- Biswal, D., et al. Effect of mechanical and electrical behavior of gelatin hydrogels on drug release and cell proliferation. Journal of the Mechanical Behavior of Biomedical Materials. 53, 174-186 (2016).
- Rowley, J. A., Madlambayan, G., Mooney, D. J. Alginate hydrogels as synthetic extracellular matrix materials. Biomaterials. 20 (1), 45-53 (1999).
- Djabourov, M., Leblond, J., Papon, P. Gelation of aqueous gelatin solutions. I. Structural investigation. Journal de Physique (France). 49 (2), 319-332 (1988).
- Djabourov, M., Leblond, J., Papon, P. Gelation of aqueous gelatin solutions. II. Rheology of the sol-gel transition. Journal de Physique (France). 49 (2), 333-343 (1988).
- Coussot, P. Rheometry of Pastes, Suspensions, and Granular Materials: Applications in Industry and Environment. , Wiley-Interscience. Hoboken, NJ. (2005).
- Ouyang, L., Yao, R., Zhao, Y., Sun, W. Effect of bioink properties on printability and cell viability for 3D bioplotting of embryonic stem cells. Biofabrication. 8 (3), 035020(2016).
- Michon, C., Cuvelier, G., Launay, B. Concentration dependence of the critical viscoelastic properties of gelatin at the gel point. Rheologica Acta Rheologica Acta: An International Journal of Rheology. 32 (1), 94-103 (1993).
- Mouser, V. H., et al. Yield stress determines bioprintability of hydrogels based on gelatin-methacryloyl and gellan gum for cartilage bioprinting. Biofabrication. 8 (3), 035003(2016).
- Benbow, J. J., Oxley, E. W., Bridgwater, J. The extrusion mechanics of pastes-the influence of paste formulation on extrusion parameters. Chemical Engineering Science. 42 (9), 2151-2162 (1987).
- Bingham, E. C. Fluidity and plasticity. , McGraw-Hill. New York, NY. (1922).
- Horrobin, D. J., Nedderman, R. M. Die entry pressure drops in paste extrusion. Chemical Engineering Science. 53 (18), 3215-3225 (1998).
- Soman, P., et al. Cancer cell migration within 3D layer-by-layer microfabricated photocrosslinked PEG scaffolds with tunable stiffness. Biomaterials. 33 (29), 7064-7070 (2012).
- Asghar, W., et al. Engineering cancer microenvironments for in vitro 3-D tumor models. Materials Today. 18 (10), 539-553 (2015).
- Lin, R. Z., Chang, H. Y. Recent advances in three-dimensional multicellular spheroid culture for biomedical research. Biotechnology Journal. 3 (9-10), 1172-1184 (2008).
- Akasov, R., et al. Formation of multicellular tumor spheroids induced by cyclic RGD-peptides and use for anticancer drug testing in vitro. International Journal of Pharmaceutics. 506 (1-2), 148-157 (2016).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten