Method Article
Imagem de Ca2 + respostas durante Shigella infecção das células epiteliais
Neste Artigo
Resumo
Aqui, apresentamos os protocolos para visualizar respostas de cálcio (Ca2 +) eliciadas células HeLa infectadas por Shigella. Otimizando os parâmetros de infecção bacteriana e imagem latente com sondas fluorescentes de Ca2 + , caracterizam-se atípica globais e locais Ca2 + sinais induzidos por bactérias sobre uma escala grande da cinética da infecção.
Resumo
CA2 + é um íon ubíquo envolvido em todos os processos celulares conhecidos. Enquantoglobais Ca 2 + respostas podem mudar o destino de célula, variações locais grátis Ca2 + citosólico concentrações, ligada à liberação de lojas internas ou um influxo através dos canais da membrana plasmática, regulam processos de célula cortical. Patógenos que aderir ou invadir o hospedeiro células gatilho uma reorganização do citoesqueleto de actina subjacentes a membrana plasmática de anfitrião, que provavelmente afeta Ca2 + sinalização globais e locais. Porque esses eventos podem ocorrer em baixas frequências de forma pseudo estocástica sobre cinética estendida, a análise de Ca2 + sinais induzidos por patógenos gera grandes desafios técnicos que devem ser abordadas.
Aqui, nós relatamos protocolos para a detecção de Ca2 + sinais globais e locais em cima de uma infecção de Shigella de células epiteliais. Estes protocolos, artefatos ligados a uma exposição prolongada e Fotodano associado com a excitação de sondas fluorescentes de Ca2 + são solucionados problemas ao controlar rigorosamente os parâmetros de aquisição durante períodos de tempo definidos durante um Shigella invasão. Os procedimentos são implementados para analisar com rigor a amplitude e frequência da global citosólico Ca2 + sinais durante a cinética de infecção prolongada usando a sonda química Fluo-4.
Introdução
CA2 + regula todos os processos de célula conhecida, incluindo a reorganização do citoesqueleto, respostas inflamatórias e caminhos de morte celular relacionados ao hospedeiro-patógeno interações1,2,3. Sob condições fisiológicas, basal citosólico Ca2 + as concentrações são baixas, em centenas de gama nM, mas podem ser submetidas a aumentos transitórios mediante estimulação agonista. Estas variações frequentemente apresentam comportamento oscilatório através da ação das bombas e canais em membranas do plasma e retículo endoplasmático. O padrão dessas oscilações é caracterizado pelo período, duração e amplitude de Ca2 + aumenta e é descriptografado por células que, por sua vez, provocam respostas específicas no que é conhecido como o Ca2 + código4,5 . Um aumento sustentado da citosólico Ca2 + concentração sob condições patológicas pode levar à morte celular associada a permeabilização de membranas mitocondriais e o lançamento do pro-apoptotic ou fatores necróticos6, 7.
Shigella, o agente causador da disenteria bacilar, invade células epiteliais injetando efetores em células hospedeiras, usando um tipo III secreção sistema (T3SS)8,9. Uma invasão de Shigella das células do hospedeiro é associada com o locais e globais Ca2 + sinais eliciados a T3SS. Quanto à formação de poros toxinas, o translocon T3SS que insere as membranas de pilha de anfitrião e é necessária para a injeção de efetores T3SS é provavelmente responsável para a ativação do PLC e do triphosphate do inositol (1, 4, 5) (InsP3)-dependente Ca2 + lançamento. A combinação de estimulação localizada PLC e o acúmulo de actina polimerizada em sites de um resultado de invasão de Shigella em uma Ca InsP3 dependente atipicamente longa duração2 + versão10. O efetor do III tipo IpgD, um bisfosfato fosfatidil 4,5 (PIP2) -4-fosfatase, limita a quantidade de local de PIP2, assim, controlar a quantidade de substrato disponível para PLC gerar InsP3, que contribui para o confinamento do local Ca2 + respostas em sites de invasão bacteriana11,12. Estes locais Ca 2 + respostas provavelmente contribuem para a polimerização de actina no Shigella invasão sites10. Global Ca2 + respostas que são também provocadas pela Shigella, no entanto, são dispensáveis para o processo de invasão bacteriana, mas provocar a abertura de hemichannels connexin na membrana plasmática e a liberação de ATP no extracelular compartimento. Lançado ATP agindo de forma parácrina, por sua vez, estimula aCa 2 + oscilatórias respostas nas células ao lado da célula infectada. IpgD também é responsável pela formaçãoglobais Ca 2 + respostas em erráticas respostas isoladas com dinâmica lenta. Eventualmente, após uma prolongada infecção bacteriana, IpgD leva para a inibição de InsP3 mediada por Ca2 + sinais. Através de sua interferência com sinalização de Ca2 + , IpgD atrasa um Ca2 +-ativação Calpaína dependente, levando para a desmontagem de estruturas de adesão focal e o descolamento prematuro da infectado as células13.
Enquanto Ca2 + sinais estão envolvidos em aspectos críticos da patogênese, a utilização de um microrganismo gera um número de desafios técnicos que não são encontrados em estudos clássicos agonista. Os protocolos descritos aqui usam o comumente usado fluorescente Ca2 + indicador químico impresso Fluo-4 que nós produzimos para caracterizar o local de Ca2 + sinais durante uma infecção de Shigella . Passos essenciais para a detecção destes sinais são discutidos, bem como procedimentos implementados para sua análise quantitativa que é necessário para caracterizar o papel de efetores bacterianas em sinalização de Ca2 + .
Protocolo
1. preparações
-
Preparação de bactérias
- As bactérias da placa — estirpe do selvagem-tipoShigella expressando a adesina umFAE (M90T-umFAE) — para um trypticase agar soja (TCS) placa contendo 0,01% de vermelho de Congo (CR) e incube-os por 18 h a 37 ° C.
Nota: Para aumentar a sua reprodutibilidade, as placas de Shigella obtidas na etapa 1.1.1 são armazenadas a 4 ° C e devem ser usadas dentro de uma semana, porque todas as colônias em meio de CR eventualmente girará o vermelhas ao longo do tempo. - Inocule TCS caldo de pré-cultura escolhendo 3 colônias vermelhas das placas raia.
Nota: Uma inoculação com 3 colônias é realizada para limitar a probabilidade de escolher um único clone plasmídeo cuja virulência sofreu uma recombinação genética. - Cultivar culturas bacterianas líquidas numa incubadora tremendo para 16 h a 37 ° C a 200 rpm. Adicione ampicilina em uma concentração final de 75 mg/mL. Concentrações de antibiótico não devem exceder 3 x a concentração inibitória mínima, como um excesso de antibiótico pode levar à perda do plasmídeo grande virulência.
Nota: A manutenção do plasmídeo de virulência a Shigella deve ser verificada pelo chapeamento as culturas bacterianas em placas CR suplementadas com concentrações de antibiótico adequadas. A presença de colônias brancas indica perda do plasmídeo. - Inocule a cultura TCS com a cultura bacteriana prévia a uma diluição de 1: 100. -Incube a 37 ° C numa incubadora de agitação por 2 h a 200 rpm. Certifique-se de que a densidade óptica em 600 nm (OD600nm) é de 0,2 - 0,4.
- Centrifugar a cultura bacteriana por 2 min a 13.000 x g a 21 ° C e resuspenda o pellet em uma quantidade equivalente de médio EM (120 mM NaCl, 7 mM KCl, 1.8 mM CaCl2, 0,8 mM MgCl2, glicose de 5 mM e 25mm HEPES pH = 7.3).
- Diluir a suspensão bacteriana em um buffer EM um final de OD600nm de 0.1 e usá-lo imediatamente ou armazená-lo a 21 ° C e usá-lo dentro o próximo 60 min.
- As bactérias da placa — estirpe do selvagem-tipoShigella expressando a adesina umFAE (M90T-umFAE) — para um trypticase agar soja (TCS) placa contendo 0,01% de vermelho de Congo (CR) e incube-os por 18 h a 37 ° C.
-
Preparação da pilha
- Cultura de células de HeLa em DMEM com 1 g/L de glicose suplementado com 10% de soro fetal bezerro (FCS) e cultivá-las a 37 ° C, com 10% de CO2. Cresce TC-7 cultivadas em DMEM com 4,5 g/L de glicose, contendo 10% FCS e não aminoácidos essenciais em uma incubadora de 37 ° C contendo 10% de CO2.
- Para a manutenção da célula, dividir as células regularmente para evitar uma inibição de crescimento-contato ligada aos Estados confluentes; Isto é crítico para uma Ca2 + sonda carregamento/transfeccao eficiência elevada.
- Placa de células HeLa no estéril de 25 mm de diâmetro circular lamelas em placas de 6-poços em uma densidade de 3 x 105 células/poço no dia anterior a experiência para as células HeLa.
- Para células de TC-7, trypsinize e contar as células. Semente-los em 4 x 105 células/poço e incube-os 5-7 dias a 37 ° C em um 10% CO2-incubadora antes os experimentos para permitir uma polarização.
- Atualize o meio de cultura celular todos os dias até o dia do experimento.
Nota: Câmaras descartáveis de 35 mm de diâmetro inferior de vidro também podem ser usadas como uma alternativa aos poços contendo lamelas. Se os últimos são utilizados, controle de temperatura através de um estágio aquecido ou objetivo não é suficiente, e uma câmara de incubação termostato montado sobre o palco do microscópio é necessário.
- Atualize o meio de cultura celular todos os dias até o dia do experimento.
- No dia do experimento, remover o meio e lavar as células 3 x com média de 1 mL EM 21 ° c.
- Carregar as pilhas com 3 mM de Fluo-4h14 em um buffer EM por 30 min a 21 ° C.
Nota: Quando o carregamento de sub confluentes células HeLa não levanta grandes problemas, o carregamento de células polarizadas TC-7 é frequentemente heterogêneo e pouco eficiente. Para essas células, nós encontramos que a eficiência de carregamento é realçada pela adição do agente de dispersão — ácido pluronic — em uma concentração final de 0,1% e o ânion-transporte bromosulfophtalein de inibidor em uma concentração final de 20 µM para o EM fluo-4-AM-contendo. O uso de químico ratiometric sondas ou geneticamente codificado-FRET sondas que requerem dual-aquisição não é compatível com a velocidade de aquisição, necessária para o tratamento de imagens de locais Ca2 + respostas. - Lavar as amostras 3 x com EM buffer e incube-os ainda mais em 1 mL de tampão na 21 ° C, para permitir que a hidrólise da fracção AM. Usar Fluo-4 carregado células imediatamente ou dentro do próximo 90 min (mantida a 21 ° C).
2. infecção e aquisição de imagens de locais de Ca2 + respostas
- Coloca a lamela contendo as células de Fluo-4 carregado em uma imagem de câmara ou câmara de vidro-fundo. Lavar as amostras na câmara de imagens ou descartável de vidro-fundo câmara 3x com buffer EM remover compostos potencialmente resultantes de lise celular. Adicione 1 mL de tampão de EM.
- Coloque a câmara em um palco de microscópio de fluorescência invertido aquecido a 33 ° C.
Nota: Esta temperatura é selecionada como um compromisso entre as temperaturas ideais compatíveis com o processo de invasão de Shigella e o abrandamento deCa 2 + respostas para visualizar respostas locais. Nós usamos um 63 X objetivo de óleo de imersão (at = 1.25) equipado com anéis de contraste de fase. - Selecione um campo de microscopia e configurar parâmetros de aquisição, incluindo o tempo de exposição e binning se necessário, para otimizar o sinal fluorescente Fluo-4.
Nota: Os principais desafios de local Ca2 + imagem são de baixa amplitude e a pequena duração das respostas, que exigem a aquisição pelo menos a cada 30 ms. várias disponíveis comercialmente back-iluminado EM-CCD ou C-MOS câmeras apresentam o necessário sensibilidade para a detecção de Ca2 + respostas locais usando Fluo-4. Sensibilidade da deteção é também uma questão importante limitar Fotodano ou artefatos como respostas espontâneas ligadas à excitação fluorescente de Fluo-4 em uma alta frequência. Aqui, uma baseada em LED iluminação de 470 nm, com um filtro de excitação 480 ± 40 nm band-pass, um filtro dicroico 505 nm e uma 527 ± 30 nm passa-banda de emissão utilizados em 5% da sua máxima intensidade, combinada com um filtro de densidade neutra a 1,0 foram usados para minimizar estes problemas sob um fluxo de aquisições de duração limitada. Uma análise de Ca2 + sinais locais por lotes de 120 fluxos de s foi realizada de rotina. Nestas condições de baixa iluminação, fluoróforo fotobranqueamento não foi observado durante as aquisições de min-fluxo 2. Aquisições sucessivas na mesma amostra podem ser realizadas, desde diferentes campos são utilizados. Como regra geral, um primeiro fluxo de aquisição é executado em um campo de controle na ausência de estimulação de bactérias para garantir a ausência de respostas espontâneas. Se observam-se respostas espontâneas, as amostras são lavadas com tampão EM até sem respostas são observadas. - Para adicionar bactérias para a amostra, remover 500 µ l de tampão EM da câmara e adicione 500 µ l da suspensão bacteriana preparada na etapa 1.1.6 para obter um final OD600nm de 0.05, com os cuidados adequados para evitar se mover o campo da microscopia selecionado; os volumes de assegurar uma adequada mistura de bactérias e uma distribuição homogênea das bactérias em amostras de célula.
- Realize uma aquisição mediante a adição de bactérias. Alternativamente, realize uma aquisição 10 min após a adição de bactérias, que corresponde ao tempo necessário para que as bactérias sedimentos nas células nas condições usadas. No final do fluxo de aquisição, adquira uma imagem de contraste de fase do campo seleccionado para visualizar as bactérias em contato com as células e os babados de membrana associados com sites de invasão bacteriana.
- Repita o procedimento de aquisição como na etapa 2.5, em intervalos que são favoráveis à duração da caixa aquisições de imagem, arquivos, seleção de um novo campo para cobrir todo o processo.
Nota: Para Shigella, encontramos que a aquisição transmite cada 5 min por 20 min, seguindo a sedimentação bacteriana 10 min, autorizada a cobrir a maior parte dos eventos de invasão. - No final do processo de aquisição, adicione uma concentração final de 2 µM de Ca2 + ionóforo ionomycin amostras para determinar a amplitude máxima dos sinais de Ca2 + . Adquirir imagens cada 3-5 s até a estabilização do sinal, geralmente para menos de 10 min.
- Siga pela adição de Ca2 + quelante EGTA em uma concentração final de 10 mM para determinar o sinal de fluorescência na ausência de Ca2 +. Adquirir imagens cada 3-5 s até a estabilização do sinal, geralmente para menos de 10 min.
Nota: Por causa da dinâmica relativamente lenta das variações Ca2 + globais, execute estas aquisições cada 3-5 s (não no modo de streaming), permitindo a Ca2 + imagem no mesmo campo microscópico durante os tratamentos sucessivos.
3. análise
- Express citosólico Ca2 + variações ao longo do tempo como a porcentagem de ΔF/F0, onde ΔF representa a variação da intensidade da fluorescência média da região de interesse (ROI) e F0 a fluorescência de base no ROI mesmo, para que um não relevantes para a região do campo desprovido de células é subtraído.
- Remover os níveis basais de fluorescência para cada célula em diferentes campos, correspondente aos níveis de base; Estes níveis podem ser determinados sem ambiguidade devido a baixa frequência e relativamente curta duração dolocais Ca 2 + respostas na aquisição de um determinado fluxo.
Nota: Quantificar características marcantes das respostas relacionadas às perguntas feitas e o modelo patogênico estudado. Classicamente, vários parâmetros são levados em conta para analisar Ca2 + sinais, incluindo a frequência de células mostrandolocais ou globais Ca 2 + respostas, bem como a duração, amplitude e frequência dessas respostas. No caso de Shigella e respostas locais, outro aspecto importante da análise é a associação espacial das respostas com sites de invasão bacteriana.
- Remover os níveis basais de fluorescência para cada célula em diferentes campos, correspondente aos níveis de base; Estes níveis podem ser determinados sem ambiguidade devido a baixa frequência e relativamente curta duração dolocais Ca 2 + respostas na aquisição de um determinado fluxo.
- Para quantificar a percentagem de células responsivas apresentando respostas globais ou locais, desenhe ROIs em células, na série de tempo correspondente às variações de intensidade de Fluo-4.
- Definir parâmetros rigorosos para identificar Ca2 + respostas locais, tais como uma amplitude de variações de fundo triplo acima a linha de fluorescência de média intensidade célula base, ou uma duração de pelo menos 200 ms, para evitar marcar um falso positivo.
Nota: Como regra geral, mesmo pequenas Ca2 + respostas locais podem ser distinguidas de qualquer ruído de fundo pelo seu perfil. O ROIs deve ser grande o suficiente para integrar suficientes sinais de fluorescência para permitir a detecção de variações locais. Dependendo da intensidade da detecção Fluo-4, estes ROIs podem corresponder a círculos com diâmetros variando de 2 a 5 mM. - Medir as variações da média intensidade da fluorescência Fluo-4 em 2 regiões em uma área distinta da mesma célula, para determinar se as respostas são locais ou globais.
Nota: A análise de um grande número de células é facilitada pela utilização de software que permite a exibição de tela on-line das variações da intensidade da fluorescência média ao longo do tempo para as regiões selecionadas de imagem. Software de imagem comercialmente disponível tem essa opção, mas isso também pode ser realizada usando o Icy freeware, usando o plugin de Evolução de intensidade de ROI . - Determine a porcentagem de células apresentando respostas locais.
Nota: Este percentual é calculado a partir do número total de células analisadas no campo de microscopia, que deve ser em número suficiente para suportar um estatisticamente significância usando um teste não-paramétrico. - Determine a duração das respostas locais.
Nota:Locais de Ca 2 + respostas podem ser ainda mais distinguidas de acordo com os intervalos de duração (ou seja, menos de 500 ms, entre 5 e 10 s, ou acima de 10 s) e sua associação com sites de invasão de Shigella .
- Definir parâmetros rigorosos para identificar Ca2 + respostas locais, tais como uma amplitude de variações de fundo triplo acima a linha de fluorescência de média intensidade célula base, ou uma duração de pelo menos 200 ms, para evitar marcar um falso positivo.
- Quantificar a amplitude das respostas. Primeiro, calibre as máxima Ca2 + e célula fundo níveis determinados como na etapa 2.1.7. Desde que a carga de Fluo-4 pode variar para cada célula, execute essas determinações para células individuais no campo.
- Expressa a amplitude das respostas em percentagem relativa da resposta máxima.
- Realizar testes estatísticos utilizando um teste de normalidade, seguido de um teste paramétrico para analisar possíveis diferenças na amplitude das respostas entre as amostras.
- Determine a associação dessas respostas em relação os sites de invasão bacteriana por sua respectiva localização para os babados de membrana induzida por bactérias visualizado nas imagens de contraste de fase correspondente.
Resultados
Invasão de Shigella está associado atípica duradouro Ca2 + respostas locais:
Seguindo o protocolo mencionado acima, as células HeLa Fluo-4-carregado foram desafiadas com WT Shigella e aquisições de fluxo foram realizadas para analisar sinais de Ca2 + . Um experimento de representante é mostrado na Figura 1, com uma série de imagens de lapso de tempo da intensidade da fluorescência da sonda Fluo-4 em média, em uma região de interesse para uma única célula e a correspondente imagem de contraste de fase (figura 1A, à esquerda painel). O local de invasão de Shigella é caracterizado por membrana babados detectados na imagem de contraste de fase (figura 1A, seta). Local atípica aumenta na enciclopédia citosólico Ca2 + são observados no local da invasão de Shigella com uma amplitude de variação e durações que variam de 2,5-5 s (Figuras 1A e 1B, setas), seguido por aumentos globais os infectados célula (figura 1B, pontas de seta).
O efetor do III tipo IpgD regula a transição do local aoglobais Ca 2 + respostas induzidas pela Shigella nas células HeLa:
A análise de Ca2 + sinais induzidos por selvagem-tipo Shigella e um deficiente isogénicas estirpe mutante para o tipo efetor III IpgD, um fosfatidil 4, 5 bisfosfato fosfatase, indicada que este último tensão induzida mais global e menos respostas locais atípicas com durações longas (RATPs), com 11,3 ± 4,4 (SEM) % e 40,3 ± 7,5 (SEM) % de células ágil, com respostas globais, no caso de um mutante WT e ipgD, respectivamente (Figura 1)15. Este mutante ipgD obtém respostas locais em uma frequência similar como a estirpe do WT.
Shigella inibir InsP3 dependente global Ca2 + aumenta em células HeLa durante a cinética da infecção prolongada:
A imagem latente de global Ca2 + respostas sobre cinética de infecção prolongada apontava para uma diminuição na frequência de respostas 30 min após o desafio com o selvagem-tipo Shigella (Figura 2A). Foi observada uma diminuição semelhante na frequência de Ca2 + respostas em TC-7 células infectadas por 30 min com o selvagem-tipo Shigella15. A quantificação das respostas de célula de dose-dependente para a histamina Ca2 + agonista ilustra a inibição de uma liberação de InsP3 dependentes de Ca2 + em fases finais de uma infecção por Shigella . WT Shigella leva a atípica isolada Ca2 + respostas durante o primeiro 30 min da infecção, e depois ainda mais a incubação, uma drástica redução na amplitude e frequência deCa 2 + respostas foi observada (Figura 2B).

Figura 1 . Locais e globais Ca 2 + respostas durante a invasão de Shigella . Células HeLa foram carregadas com Fluo-4-AM e desafiadas com WT Shigella. (A), o painel esquerdo mostra imagens de contraste de fase. O painel direito mostra série de tempo de intensidade média de fluorescência Fluo-4 com o código de cor retratado na direita. O tempo de início da aquisição é indicado em segundos, 10 min após o desafio bacteriano. A seta indica os focos de invasão. Os círculos descritos correspondem às regiões analisadas em (B) onde os traços com a cor correspondente representam as variações na intensidade de fluorescência média Fluo-4 sobre a linha de base. As setas indicam respostas locais. As setas indicam respostas globais. (C) este é um esquema representando a determinação da duração das respostas a Ca2 + . Linha horizontal pontilhada indica os basal Ca2 + os níveis (F0); as barras verticais indicam variações de fundo. A linha pontilhada vertical indica a amplitude máxima da resposta; as barras horizontais indicam a duração da resposta determinada no metade-máxima amplitude. (D) é a percentagem de células responsivo ± SEM mostrando respostas locais e global Ca2 + respostas induzidas por 5 min após infecção com o WT Shigella (barras cinza escuras) ou o mutante ipgD (barras cinza-claro). RATPs são locais Ca2 + respostas que duram por mais de 5 s. N = 4; > 60 células de cada vez. Teste de Wilcoxon, *P < 0,05; P < 0,01. Clique aqui para ver uma versão maior desta figura.
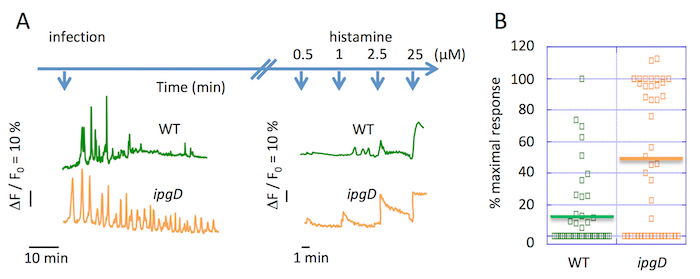
Figura 2 . Inibição daglobais Ca 2 + respostas durante prolongada cinética da infecção por Shigella . (A), o azul superior setas representam a escala de tempo do desafio bacteriano e histamina nas concentrações indicadas. Este painel mostra os traços representativos de célula única global Ca2 + variações após a infecção pelo WT Shigella (verde) e ipgD estirpe mutante (laranja). (B) este painel mostra a porcentagem da amplitude deCa 2 + respostas em relação a resposta máxima, em cima de uma estimulação em 0,5 histamina μM das células infectadas com as tensões indicadas para 90 min. A barra horizontal sólida representa a porcentagem máxima média. Teste de Wilcoxon, * *P < 0,01. Clique aqui para ver uma versão maior desta figura.
Discussão
Este manuscrito descreve o protocolo que estamos projetados para seguir Ca2 + sinais locais durante a cinética relativamente curta de uma invasão de Shigella , bem como Ca2 + respostas globais durante a cinética estendida de Shigella. Abaixo, a chave encontram problemas que precisam ser abordadas para otimizar a detecção de Ca2 + sinais minimizando qualquer interferência com os processos biológicos.
Química vs geneticamente codificado sondas de Ca2 + :
Para local Ca2 + variações de imagem, usamos a sonda química Fluo-4 por causa de seu rendimento quântico alta e sua dinâmica de resposta rápida. A velocidade necessária para a aquisição também impede o uso de sondas ratiometric, desde que não pode ser executada uma aquisição de duplo comprimento de onda. O uso de microorganismos patogênicos, no entanto, pode interferir com os procedimentos padrão usando sondas de Ca2 + químicas. Por exemplo, uma infecção de célula prolongada mais de 60 min por Shigella impede qualquer célula de carga com sondas químicas, presumivelmente por causa de alterações induzidas pelo patógeno das membranas plasma celular anfitrião. Consistentemente, é observada uma diminuição da célula associada da fluorescência Fluo-4 durante a cinética da infecção longa, devido à perda citoplasmática desta sonda. Portanto, implementar um controle tais como a adição de ionomycin para determinar a fluorescência nas máxima Ca2 + concentrações no final das aquisições é crítico para identificar as células sensíveis. Também, polarizadas células epiteliais intestinais relevantes para uma infecção do patógeno parecem ser refratários a um carregamento da sonda de Ca2 + e exigem procedimentos de carregamento específico. Enquanto o uso de geneticamente codificado Ca2 + repórter (GECR) pode ajudar a resolver alguns desses problemas, introduz também outros desafios. A eficiência da transfecção em sistemas de células do hospedeiro pode representar uma limitação séria, especialmente se ele sobrepõe com um pobre rendimento infeccioso. Além disso, as características de uma capacidade de resposta de Ca2 + variações da maioria dos GECRs não são compatíveis com a rápida cinética necessária para análise de Ca2 + local. Finalmente, a expressão da GECR pode interferir com processos mediada por agentes patogénicos. Não vamos discutir o uso de GECR para o estudo de Ca2 + sinalização durante uma interação patógeno-hospedeiro. A engenharia recente e em curso de vários GECR "rápido-resposta" provavelmente mereceria pesquisadores para revisitar sua utilização em estudos futuros.
Tempo de aquisição delocais Ca 2 + respostas durante infecção bacteriana:
A imagem dolocais Ca 2 + respostas requer uma alta velocidade de aquisição de imagem, implicando uma excitação sustentado fluorescência da sonda Fluo-4. Por causa do Fotodano relacionado com a aquisição de alta frequência, é fundamental que a intensidade da luz fluoróforo excitação é mantida ao mínimo necessário para obter uma relação sinal / ruído suficiente com um tempo de exposição não superior a 30 ms. tivemos bons resultados usando um sistema de LED em 5% da sua máxima intensidade, combinados com um filtro de densidade óptica 1,0 com a afinação de aquisição conforme descrito na etapa 2.1.4. Mesmo sob estas condições, no entanto, encontramos que a iluminação contínua necessária para a aquisição do modo de transmissão não permitir por um período de aquisição mais 2 min. Uma iluminação mais forte ou período de aquisições que exceda este limite pode resultar em específico Ca2 + respostas globais e/ou na inibição dos processos de invasão bacteriana, presumivelmente ligado a Fotodano. Enquanto a imagem de local Ca2 + respostas sobre cinética mais longa pode ser possível com meios de deteção mais sensíveis, no presente estado que tal imagem só pode ser executada sobre uma fração de tempo limitado do processo de invasão de Shigella de 15 min. Para cobrir todo o processo, foram realizadas sucessiva série de aquisições de fluxo contínuo de 2 min. Este intervalo de tempo é suficiente para acompanhar inicial locais e globais Ca2 + respostas no início do processo de infecção e estabelecer diferenças significativas na estirpe selvagem-tipo Shigella e seu mutante isogénicas ipgD16. O desenvolvimento de uma câmera altamente sensível pode permitir aos investigadores mais reduzir a intensidade da iluminação fluoróforo e executar local Ca2 + imagem latente durante longos períodos, melhorando o tempo de resolução de mais Ca transiente2 + sinais.
Correlação espacial entre Ca2 + respostas locais e sites de invasão bacteriana:
Por causa do aspecto local de eventos de sinalização induzida por microrganismos, é importante estudar o local Ca2 + sinais com relação a sua associação com os locais das interações patógeno-hospedeiro celular. Isso levantou dois tipos de considerações. Em primeiro lugar, todas as células não podem ser infectadas, e todos os microorganismos não podem desencadear a sinalização. Para Shigella, apenas uma minoria de bactérias desencadear uma invasão, e todas as células não podem ser infectadas. Em nossos experimentos, o MOI foi ajustado para que uma célula forma um 0,7 - 1 foco da invasão bacteriana. Os números mais altos de focos/célula podem levar a uma possível interferência de análise de eventos individuais de invasão e, inversamente, números mais baixos podem tornar a análise muito complexa, em particular quando estudar células transfectadas transitoriamente. Nós achamos que a eficiência de transfeccao precisa atingir pelo menos 30% das células para trazer para baixo o número de experimentos replicar para números gerenciáveis. Em segundo lugar, sites de invasão de Shigella podem ser facilmente detectados por microscopia de contraste de fase. Para outros processos, podem ser utilizados outros métodos de detecção baseada em fluorescência. Um aspecto importante, no entanto, é que em afinações mais experimentais, o fluxo de aquisição necessário para local Ca2 + imagem se opõe a outros tipos de aquisição durante o período. Isto implica que o processo analisado não deve mostrar movimento significativo durante este fluxo para permitir sua correlação espacial com Ca2 + sinais locais. Embora este seja o caso de eventos de invasão de Shigella que localizar para a mesma área da célula por vários minutos, processos altamente motile podem não ser controláveis ou provavelmente exigiria mais curtos fluxos de aquisição.
Marcando e análise de local Ca2 + respostas:
Enquantoglobais Ca 2 + respostas são facilmente detectadas, a detecção de local Ca2 + respostas de pequena amplitude e duração requer a otimização da aquisição de sinais fluorescentes acima descrito. Também é importante que critérios rigorosos são aplicados para diferenciar os sinais acima as variações de fundo. Como regra, podemos marcar como um sinal de Ca2 + um aumento da média intensidade da fluorescência Fluo-4 que atinge pelo menos 3 x as variações da linha de base em três consecutivos 30 ms de aquisições. Esta resposta é considerada como local se outra região da célula, apresentando a mesma intensidade de fluorescência média não mostra esse aumento. O marcador de local Ca2 + respostas em várias amostras não deve causar grandes dificuldades se estas regras são aplicadas sistematicamente. Em nossas mãos, a baixa frequência de Ca2 + sinais locais associados à invasão bacteriana e que variam de 5 a 20% da célula analisada representou um grande obstáculo. Além das variações biológicas detalhadas no parágrafo anterior, o facto de apenas um fluxo correspondente a uma fração do processo de invasão analisadas também contribui para essa baixa frequência. Devido a esta baixa frequência, que estabelece as diferenças entre as amostras pode implicar realizando um teste de potência em experiências piloto para estimar o tamanho de amostra para alcançar uma significância estatística.
Aplicações futuras:
Acreditamos que os protocolos funcionou analisar local Ca2 + sinais durante uma invasão de Shigella vai ser útil para imagem Ca2 + respostas locais para todos os processos que permanecem espacialmente confinado durante o período de aquisição. Enquanto Ca2 + sinalização é versátil, pode ser mais relevante para os processos que ocorrem no plasma ou membranas intracelulares onde residem as fontes de ponto iniciais dos sinais Ca2 + sinalização local. Assim, durante as interações célula microbiana-host, Ca2 + sinais locais podem ser relevantes para processos invasivos ou adesivos na membrana plasmática ou ocorrem nas membranas intracelulares de patógeno contendo vacúolos. Por outro lado, os protocolos que nós projetamos para analisar sinais de Ca2 + globais sobre a cinética da infecção prolongada podem ser relevantes para os processos que afetam a fisiologia celular geral durante uma infecção, tais como o Regulamento do transcriptional programa ou caminhos de morte celular por patógenos.
Divulgações
Os autores não têm nada a declarar.
Agradecimentos
Jenny Lee Thomassin Agradecemos a ajuda em editar o manuscrito. O trabalho foi apoiado pela ANR concede MITOPATHO e PATHIMMUN, concede do Labex Memolife e PSL IDEX Shigaforce. Cristina Sun é um destinatário de uma bolsa de doutorado do Conselho da bolsa de China. Laurent Combettes e Guy Tran Van Nhieu são destinatários de uma troca de WBI-França Tournesol programa N ° 31268YG (Wallonie-Bruxelles International, Fonds de la Recherche Scientifique, Ministère Français des Affaires étrangères et européennes, Ministère de l'Enseignement supérieur et des de cadre de la Recherche dans le parcerias Hubert Curien).
Materiais
| Name | Company | Catalog Number | Comments |
| Fluo-4 AM | Invitrogen | F14201 | |
| Metamorph version 7.7 | Universal Imaging | ||
| CoolLED illumination system pE-2 | Roper Scientific | ||
| micro-dish 35 mm, high | IBIDI | 81156 | |
| Trypticase Soy (TCS) broth | Thermofisher | B11768 | |
| TCS agar | Thermofisher | B11043 | |
| Congo red | Sigma-Aldrich | 75768 | |
| M90T-AfaE | Sun et al. 2017 | Shigella flexneri serotype V. expressing the AfaE adhesin | |
| ipgD-AfaE | Sun et al. 2017 | isogenic ipgD mutant strain expressing the AfaE adhesin |
Referências
- Ashida, H., Ogawa, M., Kim, M., Mimuro, H., Sasakawa, C. Bacteria and host interactions in the gut epithelial barrier. Nature Chemical Biology. 8 (1), 36-45 (2012).
- Berridge, M. J., Lipp, P., Bootman, M. D. The versatility and universality of calcium signaling. Nature Reviews Molecular Cell Biology. 1 (1), 11-21 (2000).
- Strehler, E. E. Plasma membrane calcium ATPases: from generic Ca(2+) sump pumps to versatile systems for fine-tuning cellular Ca(2). Biochemical and Biophysical Research Communications. 460 (1), 26-33 (2015).
- Muallem, S. Decoding Ca2+ signals: a question of timing. Journal of Cell Biology. 170 (2), 173-175 (2005).
- Uhlen, P., Fritz, N. Biochemistry of calcium oscillations. Biochemical and Biophysical Research Communications. 396 (1), 28-32 (2010).
- Carneiro, L. A., et al. Shigella induces mitochondrial dysfunction and cell death in nonmyleoid cells. Cell Host & Microbe. 5 (2), 123-136 (2009).
- Horng, T. Calcium signaling and mitochondrial destabilization in the triggering of the NLRP3 inflammasome. Trends in Immunology. 35 (6), 253-261 (2014).
- Galan, J. E., Lara-Tejero, M., Marlovits, T. C., Wagner, S. Bacterial type III secretion systems: specialized nanomachines for protein delivery into target cells. Annual Review of Microbiology. 68, 415-438 (2014).
- Ashida, H., Mimuro, H., Sasakawa, C. Shigella manipulates host immune responses by delivering effector proteins with specific roles. Frontiers in Immunology. 6, 219 (2015).
- Tran Van Nhieu, G., et al. Actin-based confinement of calcium responses during Shigella invasion. Nature Communications. 4, 1567 (2013).
- Niebuhr, K., et al. Conversion of PtdIns(4,5)P(2) into PtdIns(5)P by the S. flexneri effector IpgD reorganizes host cell morphology. The EMBO Journal. 21 (19), 5069-5078 (2002).
- Konradt, C., et al. The Shigella flexneri type three secretion system effector IpgD inhibits T cell migration by manipulating host phosphoinositide metabolism. Cell Host & Microbe. 9 (4), 263-272 (2011).
- Friedrich, P. The intriguing Ca2+ requirement of calpain activation. Biochemical and Biophysical Research Communications. 323 (4), 1131-1133 (2004).
- Thomas, D., et al. A comparison of fluorescent Ca2+ indicator properties and their use in measuring elementary and global Ca2+ signals. Cell Calcium. 28 (4), 213-223 (2000).
- Sun, C. H., et al. The Shigella type III effector IpgD recodes Ca2+ signals during invasion of epithelial cells. The EMBO Journal. 36 (17), 2567-2580 (2017).
- Allaoui, A., Menard, R., Sansonetti, P. J., Parsot, C. Characterization of the Shigella flexneri IpgD and IpgF genes, which are located in the proximal part of the mxi locus. Infection and Immunity. 61 (5), 1707-1714 (1993).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados