Method Article
Preparação de Fitoterapia: Decocção Er-Xian e Soro contendo Er-Xian para
Neste Artigo
Resumo
Aqui, apresentamos a preparação de uma decocção er-xian (EXD) em quatro etapas - imersão, decocção, filtração e concentração - e demonstram a administração de um soro contendo EXD preparado para ratos. Estes métodos são aplicáveis ao estudo in vivo e in vitro de decocções à base de plantas, como medicamentos tradicionais chineses.
Resumo
A medicina tradicional à base de plantas, uma medicina alternativa no cenário clínico, recebeu atenção crescente nos últimos anos. Antes da entrega ao corpo, um procedimento de extração adicional é comumente requerido para liberar os constituintes ativos das ervas cruas. A decocção de água é um procedimento de extração clássico que ainda é amplamente utilizado nas configurações clínicas. Aqui, propomos um protocolo detalhado para a decocção er-xian (EXD), a fim de aplicar decocções à base de plantas para estudos experimentais. O cálculo de uma dose apropriada para animais é descrito, bem como os quatro passos principais de EXD: imersão, decocção de água, filtração e concentração. Além disso, o EXD contendo soro é introduzido em ratos como meio de validação in vitro . Aqui, os ratos foram administrados oralmente EXD por três dias. As amostras de sangue foram então recolhidas, inactivadas, centrifugadas e filtradas. O soro, diluído com o meio de cultura, pode ser utilizado para tratar células ou tecidos em vItro. Por exemplo, EXD foi aplicado tanto em estudos in vivo como in vitro e demonstrou que o EXD melhora a osteogênese. Este protocolo pode ser usado como referência para a preparação e aplicação de medicamentos à base de plantas.
Introdução
O interesse no estudo e na aplicação de ervas medicinais tradicionais está crescendo atualmente. Ao contrário das drogas modernas, nas quais os ingredientes químicos são definitivos, as fórmulas à base de plantas possuem alguns ingredientes desconhecidos e requerem processos de extração para permitir a entrega de seus compostos ativos. Embora muitos estudos tentam selecionar um composto pequeno com uma estrutura bem conhecida como representante da erva inteira ou fórmula herbal, nem as eficiências farmacológicas nem os mecanismos podem ser considerados equivalentes 1 , 2 . Embora as impressões digitais permitam a análise dos constituintes de fórmulas ervas complexas, alguns constituintes ainda não são claramente analisados, levando a um desafio ao combinar todos os extratos para o estudo 3 . As interações de vários constituintes / extratos medeiam os efeitos terapêuticos das ervas medicinais. Para manter essa vantagem, o extrato tradicional decoctaIon - ainda é amplamente utilizado na clínica. Uma vez que o procedimento de extração tem um grande impacto sobre a eficácia terapêutica, é necessário um protocolo padrão de decocção de água tradicional, especialmente para estudos in vivo 4 , 5 .
Por outro lado, ao explorar mecanismos farmacológicos, a administração de decocções de ervas durante estudos in vitro ou ex vivo também é um desafio. O conceito de soro contendo drogas foi proposto pela primeira vez por Tashino em 1988 6 . Desde então, um número crescente de pesquisadores aplicou-o à medicina herbal 7 , 8 , 9 . Embora o método do soro contendo fármaco tenha algumas limitações, como a influência de certos componentes do soro, ainda é considerado um método que imita de perto as condições fisiológicas.
A decocção er-xian foi desenvolvida no início dos anos 50 para aliviar os sintomas da menopausa 10 , 11 , 12 , 13 . Também foi aplicado ao tratamento de anemia aplástica 14 , osteoporose menopausa 15 , 16 , 17 , insuficiência ovariana prematura 18 , câncer de mama 19 , câncer de ovário 20 e puberdade retardada 21 . Aqui, apresentamos protocolos detalhados para a preparação da decocção er-xian (EXD) e do seu soro contendo fármaco. Além disso, descrevemos a aplicação de EXD e EXD contendo soro para modelos osteoporóticos da menopausa murina.
Um EXD é composto por 9 g de cada um de Curculigo Orchioides Gaertn , Herbaa Epimedii , Radix Morindae Officinalis e Radix Angelicae Sinensis e 6 g de Cortex Phellodendri e Rhizoma Anemarrhenae por paciente adulto por dia. A dose equivalente para um mouse é 0.1418 EXD / kg / dia com base na seguinte equação 22 : dB = dA * RB / RA * (WA / WB) 1/3 . DA e dB referem-se à dose por peso corporal (mg / kg) do ser humano e do mouse, respectivamente. A dose, em mg / kg, é substituída pelo número de EXD / kg. RA e RB representam o fator do corpo humano e o fator do corpo do mouse, respectivamente, que são proporcionais à (área de superfície do corpo (m 2 ) / peso corporal (kg)) 2/3 (ver Tabela 1 ). WA e WB indicam o peso corporal (kg) do humano e do mouse, respectivamente.
Protocolo
O protocolo segue as diretrizes de cuidados com os animais da Universidade de Medicina Tradicional Chinesa de Xangai e é aprovado pelo experimento animal Comitê de Ética Animal de Xangai.
1. Protocolo I: Preparação do EXD
- Cálculo
- Administrar o EXD a um grupo de tratamento de 10 camundongos de região de controle de Imprinting Control (ICR) de seis meses de idade (0,02 kg / mouse), 5 dias por semana durante 12 semanas.
NOTA: Um total de 1,702 EXDs são necessários. Como os EXDs são medidos em incrementos discretos, na prática real, administre 2 EXDs. - Calcule o volume de EXD aplicado por mouse ( ou seja, V = (0.1418 EXD / kg • dia) * (0.02 kg / mouse) * 50 mL / EXD = 0.14 mL / rato • dia).
- Administrar o EXD a um grupo de tratamento de 10 camundongos de região de controle de Imprinting Control (ICR) de seis meses de idade (0,02 kg / mouse), 5 dias por semana durante 12 semanas.
- Embebendo
- Coloque todas as matérias-primas de dois EXDs ( ou seja, Curculigo orchioides Gaertn (18 g), Herbaa Epimedii (18 g), Radix Morindae Officinalis (18 g), RAdix Angelicae Sinensis (18 g), Cortex Phellodendri (12 g) e Rhizoma Anemarrhenae (12 g), 96 g no total) em um recipiente com uma tampa.
NOTA: Recomenda-se um recipiente de cerâmica. - Macerar as ervas em bruto com 500 mL de água destilada durante 1 h; A água deve cobrir as ervas em cerca de uma polegada. Deixe todas as ervas mergulharem completamente.
- Coloque todas as matérias-primas de dois EXDs ( ou seja, Curculigo orchioides Gaertn (18 g), Herbaa Epimedii (18 g), Radix Morindae Officinalis (18 g), RAdix Angelicae Sinensis (18 g), Cortex Phellodendri (12 g) e Rhizoma Anemarrhenae (12 g), 96 g no total) em um recipiente com uma tampa.
- Primeira decocção de água
- Aqueça as ervas usando um fogão a gás ou um fogão de indução com alta potência até que a água ferva (cerca de 5 a 10 min, o tempo depende da potência de aquecimento, do recipiente e da quantidade de ervas e água). Desligue o poder para um ferver baixo durante 2 h.
- Primeira filtração
- Cubra um copo de vidro de 500 ml com papel de filtro regular ou com gaze e algodão. Retire cuidadosamente a decocção no copo através do filtro. Deixe as ervas no recipiente.
- Retornar o restante resíduo de plantasN o papel de filtro para o recipiente.
- Segunda decocção de água
- Adicione água destilada ao recipiente com as ervas; Deixe cobrir as ervas por cerca de uma polegada.
- Repita o passo 1.3.
- Segunda filtração
- Repita as etapas 1.4.1 e 1.4.2.
- Despeje a segunda decocção no mesmo copo. Misture a primeira e a segunda decocções juntas.
- Concentração
- Coloque o copo em um fogão a gás com uma gaze de arame sem amianto entre eles, aqueça a decocção com um fogo baixo e misture lentamente e continuamente com uma barra de vidro.
- Quando a decocção se reduz a 200 mL, transfira-a para um copo de 500 mL.
- Repita o passo 1.7.1 até a decocção reduzir para 100 mL.
- Armazenamento e administração
- Transfira a decocção concentrada para uma garrafa de vidro estéril. Deixe esfriar no quarto temperatuRe (RT). Armazenar a 4 ° C se estiver usando dentro de uma semana ou a -70 ° C para armazenamento a longo prazo.
- Usando uma agulha de gavagem, administre 0,14 mL / rato da decocção a ratinhos ovariectomizados (OVX) uma vez por dia, 5 dias por semana durante 12 semanas.
2. Protocolo II: Preparação de soro contendo EXD
- Cálculo
- Calcule a dose de equivalente de rato (ROV) usando 0,15 kg como o peso corporal de cada rato (1 mês de idade): dB = (1/60) * (90/100) * (60 / 0.15) 1/3 = 0.111 EXD / Kg / dia.
NOTA: Um total de 10 mL de soro contendo EXD é necessário para preparar 100 mL de meio de cultura (10% de soro contendo EXD). Espera-se que cada rato forneça 2 mL de soro. Assim, 6 ratos (uma perda de 20% é levada em consideração) são necessários para a administração EXD uma vez por dia durante 3 dias. O número de EXDs é: (0.111 EXD / kg • dia) * (0.15 kg / rato) * (6 ratos) * (3 dias) = 0.300 EXD. Novamente, porque os EXDs são medidos em incrementos discretos,Use 1 EXD. - Calcule o volume de EXD aplicado por rato ( ou seja, V = (0.111 EXD / kg • dia) * (0.15 kg / rato) * (50 mL / EXD) = 0.83 mL / rato • dia).
- Calcule a dose de equivalente de rato (ROV) usando 0,15 kg como o peso corporal de cada rato (1 mês de idade): dB = (1/60) * (90/100) * (60 / 0.15) 1/3 = 0.111 EXD / Kg / dia.
- Embebendo
- Coloque as matérias-primas para 1 EXD em um recipiente com uma tampa. Macerar as ervas em bruto em água destilada durante 1 h; A água deve cobrir as ervas em cerca de uma polegada. Deixe todas as ervas mergulharem completamente.
- Primeira decocção de água
- Aqueça as ervas usando um fogão de indução com alta potência até que a água ferva (cerca de 5 a 10 min, o tempo depende da energia do calor, do recipiente e da quantidade de ervas e água). Desligue a alimentação para um fogo baixo durante 2 h.
- Primeira filtração
- Cubra um copo de vidro de 500 ml com papel de filtro regular ou com gaze e algodão. Retire cuidadosamente a decocção no copo através do filtro. Deixe as ervas no recipiente.
- Retornar o resíduo de ervas no papel de filtro para o recipiente.
- Segunda decocção de água
- Adicione água destilada ao recipiente com as ervas; Deixe cobrir as ervas por cerca de uma polegada.
- Repita a etapa 2.4.
- Segunda filtração
- Repita as etapas 2.5.1 e 2.5.2.
- Despeje a segunda decocção no mesmo copo como no passo 2.4.1 e misture a primeira e a segunda decocções juntas.
- Concentração
- Coloque o copo em um fogão a gás com uma gaze de arame isenta de amianto entre eles, aquecer a decocção usando um fogo baixo e agitar lenta e continuamente com uma barra de vidro.
- Quando a decocção se reduz a 100 mL, transfira-a para um copo de 100 mL.
- Repita o passo 2.7.1 até a decocção reduzir para 50 mL.
- Armazenamento e administração
- Transfira a decocção concentrada para um esterGarrafa de vidro. Deixe esfriar para RT. Armazenar a 4 ° C se estiver usando dentro de uma semana ou a -70 ° C para armazenamento a longo prazo.
- Administre intragástricamente 0,83 ml / rato uma vez por dia durante 3 dias.
- Preparação de soro contendo EXD
- Anestesiar os ratos por injeção intraperitoneal de 300 mL / 100 g de 80 mg / kg de cetamina e 10 mg / kg de xilazina às 1 h após a última administração de EXD. Confirme a anestesia apropriada por pressão do dedo do pé.
- Incentive a pele e o peritoneo do rato do abdômen até o fundo do tórax usando um bisturi (ou tesoura de ação direta). Crie uma incisão de comprimento e profundidade de cerca de 5 cm e 0,5 cm, respectivamente. Mova as vísceras abdominais para a esquerda usando papel de seda.
- Usando papel de seda, remova o tecido conjuntivo da aorta abdominal para expor claramente o vaso.
- Desenhe o sangue lentamente da aorta abdominal usando uma seringa de calibre 22 de 10 mL. Transfira paraUm tubo estéril de 15 mL após a remoção da agulha; Um rato pode produzir 8-10 mL de sangue.
NOTA: O rato deve estar vivo ( ou seja, com a pulsação da aorta abdominal pulsante) ao iniciar o desenho do sangue e morto após o desenho completar. - Coote o sangue em posição vertical durante 30 a 60 min na RT da sala. Centrifugar a 500-600 xg por 20 min. Coloque cuidadosamente todo o sobrenadante (soro) em um tubo estéril de 50 ml e misture todo o soro (de diferentes animais) juntos.
- Realize a inativação do calor incubando o soro em um banho de água a 56 ° C durante 30 min. Filtra o soro usando um filtro de seringa com uma membrana hidrófila de poliéter sulfona de tamanho de poro de 0,22 μm. Use o soro fresco ou guarde-o a -20 ° C.
- Controle a preparação de soro contendo fármaco (usada no grupo controle)
- Administrar cada rato com o mesmo volume de solução salina (0,83 mL) uma vez por dia durante 3 dias. Os outros passos são os mesmos que no passo 2.9.
- Aplicação
- Adicione 10 mL de soro contendo EXD ou soro contendo fármaco para cada 100 mL de meio, mais 1% de penicilina-estreptomicina (PS) 23 .
Resultados
O efeito de EXD sobre a densidade óssea de camundongos OVX
A coloração com hematoxilina e eosina (H & E) da vértebra lombar mostra aumento da trabécula óssea após o tratamento com EXD in vivo ( Figura 1A , painel direito) em comparação com os do grupo OVX ( Figura 1A , painel esquerdo). A Figura 1B mostra as imagens μCT representativas do 4º lombar em camundongos OVX ( Figura 1B , painel esquerdo) e ratos OVX com tratamento EXD por 12 semanas ( Figura 1B , painel direito). Mais ossos trabeculares são vistos dentro da vértebra lombar de camundongos tratados com EXD do que aqueles de ratos OVX controle. Os dados da imagem μCT indicam aumento do volume ósseo / volume do tecido (BV / TV), número trabecular (Tb. N) e espessura trabecular (Tb. Th) e diminuição do espaçamento trabecular (Tb. Sp) do 4º lombar Em camundongos EXD ( Figura 1C ).
O efeito de EXD na osteogênese de células estaminais mesenquimais ósseas (bMSCs) de camundongos OVX
A Figura 2 representa o potencial osteogênico das BMSCs. As gotas de gordura (asterisco, forma irregular de uma gota de lípido) são formadas automaticamente quando os BMSCs de ratos OVX são cultivados durante 7 dias ( Figura 2A , painel esquerdo). Em camundongos tratados com EXD, formam-se nódulos ósseos (seta) em vez de uma gota de gordura ( Figura 2B , painel direito). Um teste de fosfatase alcalina (ALP) demonstra que mais células ALP positivas (roxo) podem ser detectadas em bMSCs tratados com EXD ( Figura 2B , painel direito) em comparação com aqueles em bMSCs de camundongos OVX de controle ( Figura 2B , painel esquerdo).
As alterações na expressão gênica entre ratos OVX e EXDS = "xref"> 24
O agrupamento hierárquico mostra que a expressão de 389 genes revelados por microarray em bMSCs foi dobrada (> 1.5, normalizada por camundongos não-OVX) entre ratos tratados com OVX e EXD in vivo (total: 26.991 genes) ( Figura 3 ). Verde indica que a expressão foi regulada para cima, enquanto o vermelho indica que a expressão foi downregulated. Três amostras no mesmo grupo são agrupadas em primeiro lugar, indicando as qualidades confiáveis do perfil. A Figura 4 mostra a via de sinalização sobreposta direcionada pelo EXD, tanto in vivo como in vitro .

Figura 1: O efeito de EXD na Morfologia Óssea.
( A ) coloração H & E da 4ª seção lombar de ratos tratados com OVX e EXD. ( B) Imagens reconstrutivas μCT tridimensionais do 4º osso trabecular lombar no controle de camundongos tratados com OVX e EXD. ( C ) Quantificação de μCT. BV: volume ósseo, TV: volume do tecido, Tb.N: número trabecular, Tb.Th: espessura trabecular e Tb.Sp: espaçamento trabecular. As colunas representam a média ± SE. N = 6 por grupo. * P <0,05, ** p <0,01 EXD versus OVX (teste t de Student). ( AC ) foram modificados de Shufen Liu et al. 24. Clique aqui para ver uma versão maior desta figura.

Figura 2: O efeito de EXD na diferenciação BMSC.
( A ) Imagens de BMSCs cultivadas por 7 dias após beiNg isolado do fêmur de ratos tratados com OVX ou EXD. * Indica uma gota de gordura. Uma flecha indica um nódulo ósseo. ( B ) coloração de ALP de BMSC tratados com OVX e EXD cultivados durante 7 dias (o roxo representa ALP positivo). ( C ) Quantificação de ( B ). As colunas representam a média ± SE de três pratos (seis ratos) por grupo. ** p <0,01 EXD versus OVX (teste t de Student). ( AC ) foram modificados de Shufen Liu et al. 24. Clique aqui para ver uma versão maior desta figura.
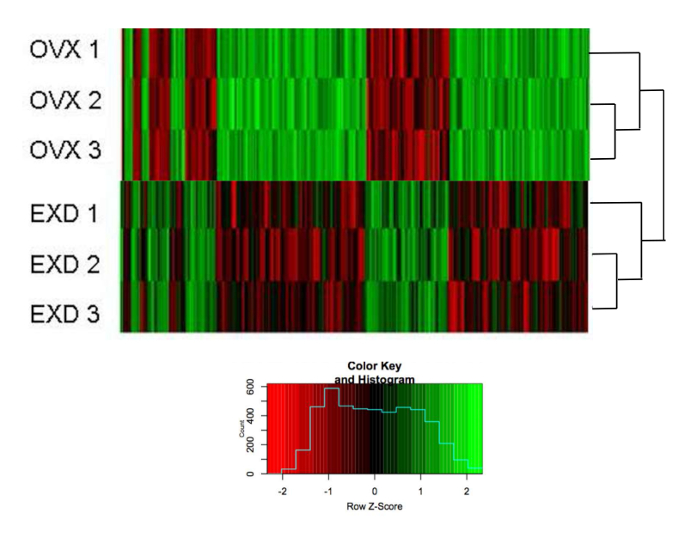
Figura 3: O efeito de EXD no perfil de expressão genética.
Heatmap do agrupamento hierárquico de expressão de 389 genes em OMS de OVX e EXD Colhida no 7º dia após a desassociação. A escala (imagem pequena) indica mudanças de dobra normalizadas por bMSCs não-OVX. A lista de genes é fornecida no arquivo suplementar 1 . A figura foi modificada de Shufen Liu et al. 24. Clique aqui para ver uma versão maior desta figura.

Figura 4: O efeito de EXD no caminho de sinalização sobreposto em experiências in vivo e in vivo.
As primeiras 10 vias de sinalização sobrepostas que são invertidas por EXD in vivo e soro contendo EXD in vitro com base na via KEGG. Os genes relacionados aos caminhos são mostrados no arquivo suplementar 2 ./files/ftp_upload/55654/55654fig4large.jpg "target =" _ blank "> Clique aqui para ver uma versão maior desta figura.
| Espécies | Rato | Rato | cobaia | Coelho | Gato | Macaco | Cachorro | Humano |
| R | 59 | 90 | 99 | 93 | 82 | 111 | 104 | 100 |
Tabela 1: Fator R em Espécies Diferentes.
O fator R em 8 espécies que são comumente usadas em pesquisa farmacológica. O fator R é proporcional a: (área de superfície do corpo (m 2 ) / bPeso em massa (kg)) 2/3 .
Arquivo suplementar 1.
Informações sobre 389 genes que são regulados ou regulados negativamente ≥1,5 vezes, mas são resgatados por EXD in vivo . Clique aqui para baixar este arquivo.
Arquivo suplementar 2.
Informações sobre a via de sinalização (com base na via KEGG) e genes relacionados em experimentos in vivo e in vitro . Clique aqui para baixar este arquivo.
Discussão
Nos últimos anos, tem sido dada mais atenção às ervas medicinais, um tipo de medicina alternativa que foi aplicada no cenário clínico no mundo oriental há milhares de anos. Diferente do padrão de "banco para cama" da medicina moderna, a medicina herbal tradicional exige primeiro o padrão de "cama a bancada" para explicar seus mecanismos. Isso pode ser seguido de validação realizada no estágio do banco e processamento para o desenvolvimento de novos medicamentos otimizados. Até agora, existem vários métodos de extração que foram relatados aos componentes ativos de liberação de fórmulas inteiras ou ervas. Entre eles, a extração de água é a mais amplamente utilizada.
A extração de água de plantas medicinais tem quatro etapas básicas. O primeiro passo está embebendo. Uma erva medicinal complexa é macerada em água por um período de tempo, geralmente de 0,5 a 1 h. O período de imersão depende da quantidade e da propriedade das ervas em bruto. ParaCertifique-se de que as ervas em bruto são completamente embebidas, o centro de cada peça ou bloco deve ser mergulhado. O volume de água depende do volume total de ervas. Às vezes, o peso das ervas é usado para determinar a quantidade de água necessária para imersão. No entanto, as densidades de ervas variam amplamente. Uma vez que o propósito da imersão é macerar todas as ervas, facilitando a liberação dos componentes ativos durante as etapas a seguir, o volume de ervas é preferido para uso como padrão de referência para o volume de água. O segundo passo é cozinhar. Os processos de ferver e ferver foram desenvolvidos ao longo de milhares de anos. A variação no tempo de cozimento depende principalmente do tipo de ervas, devido às suas diferentes características físicas, químicas e farmacológicas 12 . Os diaforéticos são sugeridos para cozinhar por um curto período de tempo, geralmente menos de 20 min, enquanto os aromáticos devem ser adicionados apenas alguns minutos antes da primeira fervura para evitar reações voláteis. FOu ervas tônicas, um longo período de tempo é necessário para lixiviar seus constituintes terapêuticos. Neste caso, o EXD é utilizado para o tratamento da osteoporose pós-menopausa ao longo das décadas 12 . Na teoria da medicina tradicional chinesa, esta síndrome é considerada como causada por uma deficiência relacionada ao rim. O EXD é projetado principalmente para tonificar o rim. Portanto, o EXD foi cozido durante 2 a 3 h para permitir que o EXD exercesse seus efeitos anti-osteoporóticos 15 . O terceiro passo é a filtração. A filtração ajuda a evitar que a agulha da gavagem seja entupida com os grânulos de ervas. O quarto passo é a concentração. O volume de administração de sonda deve ser cuidadosamente considerado. Foi relatado que grandes volumes, como 10 mL / kg ou mais, administrados por gavagem oral podem resultar em vários problemas relacionados à absorção, incluindo a rápida remoção dos compostos para o duodeno ou pneumonia por aspiração associada ao refluxo passivo do matériaEm direção ao esôfago 25 . Assim, os volumes escolhidos para os ratos e ratos foram em torno de 7,5 mL / kg e 5,5 mL / kg, respectivamente.
É importante confirmar se os componentes efetivos dos EXD digeridos e metabolizados no sangue são semelhantes aos do extrato bruto. Em termos de bioequivalência EXD, Wu et al. Relatou a determinação de 7 componentes em plasma de cão: epimedina A, epimedina B, epimedina C, icariina, sagitatosídeo B, 2 "-O-rhamnosilo icarisido II e baohuósido I 26 . Hu et al. Encontrou 21 compostos em plasma de rato após administração oral 27 . Até agora, o extrato bruto da EXD não foi relatado. No entanto, alguns dos componentes eficazes testados em sangue, como icariina e berberina, foram aplicados diretamente aos animais para observação comparativa 28 .
Existem várias abordagens para calcular o bioe animalDose quivalente. O método tradicional baseado no peso corporal (mg / kg) não é apropriado porque a farmacocinética varia em diferentes espécies. O cálculo com base na área de superfície corporal (mg / m 2 ), em que a taxa metabólica está relacionada ao tamanho animal individual, é freqüentemente usado 29 . A equação aplicada aqui leva em consideração a área de superfície corporal e o peso corporal e é comumente utilizada na medicina tradicional chinesa 30 .
Muitos tipos de animais, como coelhos, cobaias, ratos e ratos, podem ser escolhidos para a preparação de soro contendo fármaco. A mesma espécie que a das células tratadas in vitro é preferida. Neste estudo, os ratos foram escolhidos porque fornecem mais soro do que os ratos e estão mais próximos dos camundongos em termos de espécies em comparação com outros animais. Além disso, recomenda-se a dose equivalente em uso in vivo ou clínico, como o protocolo in vitro mostrou. O dilutO ião do soro (1:10 é recomendado) não é levado em consideração; Ou seja, 10 vezes a dose equivalente não é aplicada aos animais providos pelo soro devido à potencial reação tóxica causada por células ou órgãos tratados 31 . A frequência de administração de fármaco varia de uma vez por dia durante 3 a 14 dias a duas vezes por dia (2 h entre cada administração) 7 , 8 , 32 . O tempo de coleta geralmente ocorre entre as horas 1 e 2 (antes da hora 6) após a última administração 33 , 34 . O objetivo é manter a concentração de drogas no sangue relativamente estável e no seu nível máximo quando as amostras são coletadas 35 . As rotinas de administração podem incluir injeção, administração de pele ou inalação, de acordo com as rotinas de administração in vivo .
A inativação da droga-Contendo soro ainda é controverso. Os adeptos pensam que a presença de muitos componentes ativos, como hormônios, enzimas, anticorpos e complementos no próprio soro, pode resultar em reações inesperadas que afetam os resultados 36 . A oposição acredita que os componentes ativos produzidos pelas drogas também podem ser removidos pelo processo de inativação 37 . Para equilibrar isso, as pessoas projetam o grupo controle de modo que o soro de animais tratados com solução salina seja usado.
Existem algumas limitações ao protocolo. A qualidade do extrato não é avaliada antes do início da experimentação in vivo e in vitro . Em segundo lugar, os antibióticos são utilizados no meio de cultura, o que pode causar interações com ervas medicinais e requer testes adicionais. Em terceiro lugar, o tempo de imersão e simmer é determinado com base na experiência adquirida com a prática clínica e a experimentação animal. Mais períodos de tempo podem ser escolhidos fOu comparação. Os tempos de imersão e ferver podem ser modificados para diferentes fórmulas à base de plantas. O volume de decocção para administração animal pode ser modificado de acordo com a espécie e a idade e peso do animal. O animal escolhido para a preparação do soro contendo fármaco e para as rotinas de administração pode ser alterado, conforme discutido acima.
Em conjunto, o protocolo e os resultados fornecem um exemplo para a preparação e aplicação de decocção de ervas em estudos in vivo e in vitro . Em diferentes casos, alguns dos detalhes devem ser otimizados, incluindo períodos de tratamento, espécies e rotinas de administração, com base nas características de ervas.
Divulgações
Os autores declaram que não têm interesses financeiros concorrentes.
Agradecimentos
Este trabalho foi apoiado pela National Natural Science Foundation of China (81573992). Agradecemos a Emily K. Lo e Kathleen DiNapoli pela assistência de edição de idiomas.
Materiais
| Name | Company | Catalog Number | Comments |
| Curculigo orchioides Gaertn (9 g), Herbaa Epimedii (9 g), Radix Morindae Officinalis (9 g), Radix Angelicae Sinensis (9 g), Cortex Phellodendri (6 g), and Rhizoma Anemarrhenae (6 g) | Kang-qiao Chinese Medicine Yinpian Co. Ltd (Shanghai, CN) | 160922 | EXD components |
| Filter paper | GElifesciences | 99-103-952 | Filter EXD decoction before concentration |
| Imprinting Control Region (ICR) mice | Shanghai Laboratory Animal Center | SCXK 2007-0005 | In vivo study |
| Sprague Dawley rats | Shanghai Laboratory Animal Center | SCXK 2007-0005 | EXD-containing serum preparation |
| Syringe filter | Millipore | SLGP033RB | 0.22 µm |
| gavage needles (10 ml) | Shanghai BO Ge trade sales department | 59104274 | Adminstration of EXD |
| Ketamine (80 mg/kg) | Fujian Gutian Pharma Co. Ltd | H35020148 | Anesthesia |
| Xylazine (10 mg/kg) | Sunway Pharma Co. Ltd | CB07591 | Anesthesia |
| Dulbecco’s modification of Eagle’s medium Dulbecco (DMEM) culture medium | Gibco | 12800-116 | DMEM with 2 mM L-glutamine and without ribonucleosides and ribonucleotides |
| Streptomycin | Sigma | 1277 | 100 µg / ml |
| Penicillin | Sigma | 4687 | 100 µg / ml |
Referências
- Zhang, L. G., Ouyang, X. W., Wu, T. T., Ni, L. J., Shi, W. Z. Quantitative evaluation of in vitro effects and interactions of active fractions in a Chinese medicinal formula (Yaotongning Capsule) on rat chondrocytes. J Ethnopharmacol. 155 (3), 1424-1432 (2014).
- Ogawa, Y., Fujii, Y., Sugiyama, R., Konishi, T. The role of the seven crude drug components in the sleep-promoting effect of Yokukansan. J Ethnopharmacol. 177, 19-27 (2016).
- Kim, J. H., Doh, E. J., Lee, G. Evaluation of Medicinal Categorization of Atractylodes japonica Koidz. by Using Internal Transcribed Spacer Sequencing Analysis and HPLC Fingerprinting Combined with Statistical Tools. Evid Based Complement Alternat Med. 2016, 2926819(2016).
- Sheridan, H., et al. The potential of metabolic fingerprinting as a tool for the modernisation of TCM preparations. J Ethnopharmacol. 140 (3), 482-491 (2012).
- Planas, G. M., Kucacute, J. Contraceptive Properties of Stevia rebaudiana. Science. 162 (3857), 1007(1968).
- Tashino, S. "Serum pharmacology" and "serum pharmaceutical chemistry": from pharmacology of Chinese traditional medicines to start a new measurement of drug concentration in blood. Ther Drug Monit Res. 5, 54-64 (1988).
- Cao, Y., Liu, F., Huang, Z., Zhang, Y. Protective effects of Guanxin Shutong capsule drug-containing serum on tumor necrosis factor-alpha-induced endothelial dysfunction through nicotinamide adenine dinucleotide phosphate oxidase and the nitric oxide pathway. Exp Ther Med. 8 (3), 998-1004 (2014).
- Fu, L., et al. Ex Vivo Stromal Cell-Derived Factor 1-Mediated Differentiation of Mouse Bone Marrow Mesenchymal Stem Cells into Hepatocytes Is Enhanced by Chinese Medicine Yiguanjian Drug-Containing Serum. Evid Based Complement Alternat Med. 2016, 7380439(2016).
- Chen, X., et al. Application of serum pharmacology in evaluating the antitumor effect of Fuzheng Yiliu Decoction from Chinese Medicine. Chin J Integr Med. 20 (6), 450-455 (2014).
- Sze, S. C., et al. A novel mechanism: Erxian Decoction, a Chinese medicine formula, for relieving menopausal syndrome. J Ethnopharmacol. 123 (1), 27-33 (2009).
- Sze, S. C., et al. Effects of Erxian decoction, a Chinese medicinal formulation, on serum lipid profile in a rat model of menopause. Chin Med. 6, 40(2011).
- Zhong, L. L., et al. A randomized, double-blind, controlled trial of a Chinese herbal formula (Er-Xian decoction) for menopausal symptoms in Hong Kong perimenopausal women. Menopause. 20 (7), 767-776 (2013).
- Wang, S. W., et al. Steroidogenic effect of Erxian decoction for relieving menopause via the p-Akt/PKB pathway in vitro and in vivo. J Ethnopharmacol. , (2016).
- Lin, L., Wu, S., Tang, J. [Clinical observation and experimental study of the treatment of aplastic anemia by warming and tonifying the spleen and kidney]. Zhong Xi Yi Jie He Za Zhi. 10 (5), 272-274 (1990).
- Nian, H., et al. Antiosteoporotic activity of Er-Xian Decoction, a traditional Chinese herbal formula, in ovariectomized rats. J Ethnopharmacol. 108 (1), 96-102 (2006).
- Qin, L., et al. Antiosteoporotic chemical constituents from Er-Xian Decoction, a traditional Chinese herbal formula. J Ethnopharmacol. 118 (2), 271-279 (2008).
- Xue, L., et al. A HNMR-based metabonomics study of postmenopausal osteoporosis and intervention effects of Er-Xian Decoction in ovariectomized rats. Int J Mol Sci. 12 (11), 7635-7651 (2011).
- Lu, X. N., Xu, X. R., Lin, L. J. [Clinical observation of bushen er'xian decoction in treating premature ovarian failure]. Zhongguo Zhong Xi Yi Jie He Za Zhi. 28 (7), 594-596 (2008).
- Yu, X., et al. Anti-angiogenic activity of Erxian Decoction, a traditional Chinese herbal formula, in zebrafish. Biol Pharm Bull. 35 (12), 2119-2127 (2012).
- Chu, E. S., et al. An in vitro and in vivo investigation of the antimetastatic effects of a Chinese medicinal decoction, erxian decoction, on human ovarian cancer models. Integr Cancer Ther. 12 (4), 336-346 (2013).
- Zhu, Z., Li, L., Jin, X., Fang, J., Zhang, D. Er-Xian Decoction, a traditional Chinese herbal formula, intervening early in hypothalamic-pituitary axis of male rats with delayed puberty. Pharmacogn Mag. 10 (40), 517-521 (2014).
- Miao, M. S. Experimental animals and technology. 1997, Chinese Modical Publisher. Beijing. 145(1997).
- Soleimani, M., Nadri, S. A protocol for isolation and culture of mesenchymal stem cells from mouse bone marrow. Nat Protoc. 4 (1), 102-106 (2009).
- Lu, S., Huang, J., Wang, J., et al. Er-Xian Decoction Stimulates Osteoblastic Differentiation of Bone Mesenchymal Stem Cells in Ovariectomized Mice and Its Gene Profile Analysis. Stem Cells International. 2016, 4079210(2016).
- Turner, P. V., Brabb, T., Pekow, C., Vasbinder, M. A. Administration of substances to laboratory animals: routes of administration and factors to consider. J Am Assoc Lab Anim Sci. 50 (5), 600-613 (2011).
- Wu, C., et al. Simultaneous determination of seven flavonoids in dog plasma by ultra-performance liquid chromatography-tandem mass spectrometry and its application to a bioequivalence study of bioactive components in Herba Epimedii and Er-Xian Decoction. J Pharm Biomed Anal. 54 (1), 186-191 (2011).
- Hu, Y. M., et al. Identification of the major chemical constituents and their metabolites in rat plasma and various organs after oral administration of effective Erxian Decoction (EXD) fraction by liquid chromatography-mass spectrometry. Biomed Chromatogr. 24 (5), 479-489 (2010).
- Xue, L., et al. Effects and interaction of icariin, curculigoside, and berberine in er-xian decoction, a traditional chinese medicinal formula, on osteoclastic bone resorption. Evid Based Complement Alternat Med. , (2012).
- Nair, A. B., Jacob, S. A simple practice guide for dose conversion between animals and human. J Basic Clin Pharm. 7 (2), 27-31 (2016).
- Xu, X., et al. Protective effect of the traditional Chinese medicine xuesaitong on intestinal ischemia-reperfusion injury in rats. Int J Clin Exp Med. 8 (2), 1768-1779 (2015).
- Li, Z., Wang, J. On the methods for Chinese herbs serum pharmcology. Zhong Guo Zhong Yi Yao Xing Xi Za Zhi. 9 (2), 5-6 (2002).
- Jiang, Y. R., et al. Effect of chinese herbal drug-containing serum for activating-blood and dispelling-toxin on ox-LDL-induced inflammatory factors' expression in endothelial cells. Chin J Integr Med. 18 (1), 30-33 (2012).
- Guo, C. Y., Ma, X. J., Liu, Q., Yin, H. J., Shi, D. Z. [Effect of Chinese herbal drug-containing serum for activating blood, activating blood and dispelling toxin on TNF-alpha-induced adherence between endothelial cells and neutrophils and the expression of MAPK pathway]. Zhongguo Zhong Xi Yi Jie He Za Zhi. 35 (2), 204-209 (2015).
- Li, Y., Xia, J. Y., Chen, W., Deng, C. L. Effects of Ling Qi Juan Gan capsule drug-containing serum on PDGF-induced proliferation and JAK/STAT signaling of HSC-T6 cells]. Zhonghua Gan Zang Bing Za Zhi. 21 (9), 663-667 (2013).
- Li, Y. K. [Some issues in methology of Chinese herbs serum pharmcology]. Zhong Yao Xin Yao Yu Lin Chuang Yao Li. 10 (5), 263(1999).
- Zhang, L., et al. [A review of Chinese herbs serum pharmcology methodological study]. Nan Jing Zhong Yi Yao Da Xue Xue Bao. 18 (4), 254(2002).
- Zhang, D. [Issues and strategies for study of serum pharmcology in oncology]. Zhong Yi Yan Jiu. 17 (5), 13-14 (2004).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados