Method Article
약초의 준비 : Er-Xian의 달임과 Er-Xian 함유 세럼
요약
여기에서는 4 가지 단계 (담금질, 달인, 여과 및 농축)의 erxian decoction (EXD) 준비 과정을 제시하고 준비된 EXD 함유 혈청을 쥐에게 투여하는 방법을 보여줍니다. 이 방법은 생약과 생체 외 연구에 적용 할 수 있습니다.
초록
임상 약제로 사용되는 대체 의학 인 한약은 최근 몇 년 동안 주목을 받아 왔습니다. 인체에 전달하기 전에 원료 약초에서 활성 성분을 방출하기 위해 일반적으로 추가 추출 절차가 필요합니다. 수분 섭취는 여전히 임상 환경에서 광범위하게 사용되는 고전적인 추출 과정입니다. 여기에서는 실험적 연구에 약초 즙을 적용하기 위해 erxian decoction (EXD)에 대한 상세한 프로토콜을 제안합니다. EXD의 4 가지 주요 단계 (수적, 수분 섭취, 여과 및 농축)뿐만 아니라 동물에 적합한 용량의 계산이 기술되어있다. 또한, 혈청 함유 EXD는 생체 외 검증을위한 수단으로 쥐에게 도입됩니다. 여기에 쥐에게 EXD를 3 일간 경구 투여 하였다. 혈액 샘플을 채취하고, 불 활성화시키고, 원심 분리하고, 여과시켰다. 배양 배지로 희석 된 혈청은 세포 또는 조직 을 vitro. 예를 들어, EXD는 in vivo 및 in vitro 연구에 모두 적용되었으며 EXD가 골 형성을 향상시키는 것으로 나타났습니다. 이 프로토콜은 약초의 제조 및 응용에 대한 참고 자료로 사용할 수 있습니다.
서문
전통적인 약초의 연구와 응용에 대한 관심이 현재 커지고 있습니다. 화학 성분이 확실한 현대 의약품과는 달리, 허브 성분에는 미지 성분이 포함되어 있으며 활성 성분을 전달할 수 있도록 추출 과정이 필요합니다. 많은 연구가 잘 알려진 구조를 가진 하나의 작은 화합물을 전체 약초 또는 허브 공식의 대표자로 선택하려고 시도하지만 약리학 적 효능이나 메커니즘은 동등한 것으로 간주 될 수 없다. 핑거 프린팅 (fingerprinting)은 복잡한 허브 수식의 구성 성분을 분석 할 수 있지만, 일부 성분은 아직 명확하게 분석되지 않아 연구 3에서 모든 추출물을 결합 할 때 어려움을 겪습니다. 수많은 성분 / 추출물의 상호 작용은 약초의 치료 효과를 중재합니다. 이러한 장점을 유지하기 위해 전통적인 추출물 형태이온은 여전히 클리닉에서 널리 사용됩니다. 추출 과정은 치료 효능에 큰 영향을 미치기 때문에, 특히 생체 내 연구 4,5 에서 전통적 물 추출법의 표준 프로토콜이 필요합니다.
반면에, 약리학 적 기작을 탐색 할 때, 생체 외 또는 생체 외 연구 중에 약초를 처치하는 것은 도전 과제입니다. 약물 함유 혈청의 개념은 1988 년 Tashino에 의해 처음 제안되었다. 그 이후로 점점 많은 연구자들이 한약 7 , 8 , 9 에 그것을 적용 해왔다. 약물 함유 혈청의 방법은 혈청의 특정 성분의 영향과 같은 몇 가지 제한이 있지만, 여전히 생리 학적 조건을 밀접하게 모방하는 방법으로 간주됩니다.
er-xian 달임은 갱년기 증상 10 , 11 , 12 , 13 을 완화하기 위해 1950 년대 초에 개발되었습니다. 또한 재생 불량성 빈혈 14 , 폐경기 골다공증 15 , 16 , 17 , 조기 난소 부전 18 , 유방암 19 , 난소 암 20 및 사춘기 지연 21에도 적용 되었습니다. 여기, 우리는 에르 - 시안 (erxian) 추출 (EXD)과 그 약물 함유 혈청의 제조를위한 상세한 프로토콜을 제시합니다. 또한 폐경기 골다공증 모델에 EXD 및 EXD를 함유 한 혈청을 적용하는 방법을 설명합니다.
EXD는 Curculigo orchioides Gaertn , Herba Epimedii Radix Morindae Officinalis , Radix Angelicae Sinensis , Cortex Phellodendri 및 Rhizoma Anemarrhenae 각각 6 g을 하루에 성인 1 인당 투여한다. 마우스의 등가 선량은 다음 식 22 에 따라 0.1418 EXD / kg / day입니다. dB = dA * RB / RA * (WA / WB) 1/3 . dA와 dB는 각각 사람과 마우스의 체중 당 투여 량 (mg / kg)을 의미합니다. 용량 (mg / kg)은 EXD / kg의 수로 대체됩니다. RA와 RB는 각각 신체 표면적 (m 2 ) / 체중 (kg) 2/3 ( 표 1 참조)에 비례하는 인간 신체 계수와 마우스 몸 계수를 나타냅니다. WA 및 WB는 각각 사람 및 마우스의 체중 (kg)을 나타낸다.
프로토콜
이 프로토콜은 상하이 한의대의 동물 관리 지침을 따르며 동물 실험 상하이 동물 윤리위원회의 승인을 받았습니다.
1. 프로토콜 I : EXD 준비
- 계산
- EXD를 6 주령의 ICR (female Imprinting Control Region) 마우스 (0.02 kg / mouse) 10 마리의 치료 그룹에 12 주 동안 주 5 회 투여하십시오.
참고 : 총 1.702 EXD가 필요합니다. EXD는 개별 증분으로 측정되기 때문에 실제로는 2 개의 EXD를 관리해야합니다. - 마우스 당 EXD 부피를 계산하십시오 ( 예 : V = (0.1418 EXD / kg • 일) * (0.02 kg / 마우스) * 50 mL / EXD = 0.14 mL / 마우스 • 일).
- EXD를 6 주령의 ICR (female Imprinting Control Region) 마우스 (0.02 kg / mouse) 10 마리의 치료 그룹에 12 주 동안 주 5 회 투여하십시오.
- 몸을 담그다
- 두 가지 EXD ( 즉, Curculigo orchioides Gaertn (18g), Herba Epimedii (18g), Radix Morindae Officinalis (18g), RAdix Angelicae Sinensis (18g), Cortex Phellodendri (12g), Rhizoma Anemarrhenae (12g), 총 96g)를 뚜껑이 달린 용기에 넣습니다.
참고 : 세라믹 용기를 사용하는 것이 좋습니다. - 생 약초를 500 mL의 증류수로 1 시간 동안 담그고; 물은 허브를 약 1 인치까지 덮어야합니다. 모든 허브가 완전히 흡수되도록하십시오.
- 두 가지 EXD ( 즉, Curculigo orchioides Gaertn (18g), Herba Epimedii (18g), Radix Morindae Officinalis (18g), RAdix Angelicae Sinensis (18g), Cortex Phellodendri (12g), Rhizoma Anemarrhenae (12g), 총 96g)를 뚜껑이 달린 용기에 넣습니다.
- 첫 번째 물 추출
- 물이 끓을 때까지 (약 5 ~ 10 분, 시간은 가열 력, 용기 및 허브와 물의 양에 따라 달라질 때까지) 가스 밥솥이나 고주파 밥솥을 사용하여 약초를 가열하십시오. 2 시간 동안 낮은 끓는 물로 전원을 끕니다.
- 첫 번째 여과
- 일반 여과지 또는 거즈와면을 사용하여 500mL 유리 비이커를 덮으십시오. 조심스럽게 필터를 통해 비누에 달걀을 붓습니다. 컨테이너에 허브를 남겨주세요.
- 남은 허브 잔여 물을 반환하십시오.용기에 걸러진 여과지.
- 2 차 수분 섭취
- 허브와 함께 증류수를 용기에 넣으십시오. 약 1 인치 정도의 약초를 가려야합니다.
- 단계 1.3을 반복하십시오.
- 2 차 여과
- 1.4.1 및 1.4.2 단계를 반복하십시오.
- 같은 비이커에 두 번째 달인을 붓는다. 첫 번째와 두 번째 즙을 함께 섞는다.
- 집중
- 비누를 사이에 석면이없는 철제 거즈가 달린 가스 밥솥에 올려 놓고 낮은 끓인 물로 가열하고 천천히 연속적으로 유리 막대로 저어 준다.
- 달임이 200 mL로 줄어들면 500 mL 비이커로 옮긴다.
- 달여가 100 mL가 될 때까지 1.7.1 단계를 반복하십시오.
- 보관 및 관리
- 농축 된 달걀을 멸균 유리 병에 옮기십시오. 그것은 room temperatu로 식도록 내버려둬 라.re (RT). 장기간 보관할 경우 1 주일 이내에 -70 ° C에서 사용하는 경우 4 ° C에서 보관하십시오.
- 위관 (gavage) 바늘을 사용하여 1 일 1 회, 12 주 동안 1 주일에 1 회, 난소 절제 (OVX) 마우스에 0.14 mL / 마우스 췌장을 투여하십시오.
2. 프로토콜 II : EXD 함유 세럼의 제조
- 계산
- 각 쥐 (1 개월)의 체중으로 0.15 kg을 사용하여 쥐 - 등가 선량 (RED)을 계산하십시오 : dB = (1/60) * (90/100) * (60 / 0.15) 1/3 = 0.111 EXD / kg / 일.
참고 : 100 mL의 배지 (10 % EXD 함유 혈청)를 준비하기 위해 총 10 mL의 EXD 함유 혈청이 필요합니다. 각 쥐는 2 mL의 혈청을 제공해야합니다. 따라서 하루 3 회 EXD 투여를 위해서는 6 마리의 쥐 (20 %의 손실을 감안)가 필요합니다. EXD의 수는 다음과 같습니다 : (0.111 EXD / kg • day) * (0.15 kg / rat) * (6 마리) * (3 일) = 0.300 EXD. 다시, EXD는 이산 증분으로 측정되기 때문에,1 EXD를 사용하십시오. - 쥐 ( 즉, V = (0.111 EXD / kg • day) * (0.15 kg / rat) * (50 mL / EXD) = 0.83 mL / rat • day) 당 적용된 EXD의 부피를 계산합니다.
- 각 쥐 (1 개월)의 체중으로 0.15 kg을 사용하여 쥐 - 등가 선량 (RED)을 계산하십시오 : dB = (1/60) * (90/100) * (60 / 0.15) 1/3 = 0.111 EXD / kg / 일.
- 몸을 담그다
- 1 EXD 용 원료를 뚜껑이 달린 용기에 넣으십시오. 생약을 증류수에 1 시간 동안 담가 두십시오. 물은 허브를 약 1 인치까지 덮어야합니다. 모든 허브가 완전히 흡수되도록하십시오.
- 첫 번째 물 추출
- 물이 끓을 때까지 고전력의 유도 밥솥을 사용하여 약초를 가열하십시오 (약 5 ~ 10 분, 시간은 화력, 용기 및 허브와 물의 양에 따라 다릅니다). 2 시간 동안 낮은 끓는 물로 전원을 끕니다.
- 첫 번째 여과
- 일반 여과지 또는 거즈와면을 사용하여 500mL 유리 비이커를 덮으십시오. 조심스럽게 필터를 통해 비누에 달걀을 붓습니다. 컨테이너에 허브를 남겨주세요.
- 여과지에있는 생약 잔여 물을 용기에 넣으십시오.
- 2 차 수분 섭취
- 허브와 함께 증류수를 용기에 넣으십시오. 약 1 인치 정도의 약초를 가려야합니다.
- 2.4 단계를 반복하십시오.
- 2 차 여과
- 2.5.1 및 2.5.2 단계를 반복하십시오.
- 두 번째 달인을 2.4.1 단계에서와 같은 비이커에 붓고 첫 번째와 두 번째 데오스를 함께 섞는다.
- 집중
- 비누를 사이에 석면없는 철사 거즈가 달린 가스 밥솥에 올려 놓고 낮은 끓인 물로 가열하고 유리 막대로 천천히 연속적으로 저어 준다.
- 달이기가 100 mL가 될 때까지 100 mL 비이커에 옮긴다.
- 달임이 50 mL가 될 때까지 2.7.1 단계를 반복하십시오.
- 보관 및 관리
- 농축 된 달걀을 증기로 옮기십시오.ile 유리 병입니다. 그것을 RT로 식히자. 장기간 보관할 경우 1 주일 이내에 -70 ° C에서 사용하는 경우 4 ° C에서 보관하십시오.
- 1 일 1 회, 0.83 mL / 래트를 3 일간 위내에 투여한다.
- EXD 함유 혈청 제제
- EXD의 마지막 투여 후 1 시간에 300mg / 100g의 80mg / kg ketamine과 10mg / kg xylazine을 복강 내 주사하여 쥐를 마취시킨다. 발끝으로 적절한 마취를 확인하십시오.
- 메스를 사용하여 쥐의 피부와 복막을 복부에서 흉부 바닥으로 절개하십시오 (또는 가위를 똑바로 세우십시오). 각각 약 5cm와 0.5cm의 길이와 깊이의 절개를 만듭니다. 티슈 페이퍼를 사용하여 복부 내장을 왼쪽으로 움직입니다.
- 휴지를 사용하여 복부 대동맥의 결합 조직을 제거하여 혈관을 명확하게 노출시킵니다.
- 10 ML, 22 게이지 주사기를 사용하여 복부 대동맥에서 천천히 혈액을 그리십시오. 전송 대상 :바늘을 제거한 후 15mL 멸균 튜브; 한 마리의 쥐가 8-10 mL의 혈액을 생산할 수 있습니다.
참고 : 쥐는 혈액이 채워지기 시작할 때 ( 즉, 복부 대동맥이 맥박이있는 상태에서) 살아 있어야합니다. - 방 RT에서 30-60 분 동안 똑바로 세워 혈액을 채 웁니다. 20 분 동안 500-600 XG에서 원심 분리기. 조심스럽게 모든 상등액 (혈청)을 50 mL 멸균 튜브 1 개에 넣고 여러 동물의 모든 혈청을 함께 섞으십시오.
- 30 분 동안 56 ° C 수조에서 혈청을 배양하여 열 불 활성화를 수행하십시오. 0.22 μm의 공극 크기의 친수성 폴리 에테르 설폰 막을 가진 주사기 필터를 사용하여 혈청을 여과합니다. 신선한 혈청을 사용하거나 -20 ° C에서 보관하십시오.
- 대조군 약물 함유 혈청 제제 (대조군에서 사용)
- 1 일 1 회 3 일 동안 동일한 용량의 생리 식염수 (0.83 mL)로 각 랫트를 투여하십시오. 다른 단계는 2.9 단계와 동일합니다.
- 신청
- EXD 함유 혈청 또는 약물 함유 혈청 10 mL를 각 100 mL의 배지에 첨가하고 1 % 페니실린 - 스트렙토 마이신 (PS) 23을 첨가합니다.
결과
EXX가 OVX 마우스의 골밀도에 미치는 영향
요추 척수 절편의 Hematoxylin과 eosin (H & E) 염색은 OVX 군 ( 그림 1A , 왼쪽 패널)과 비교하여 생체 내 EXD 치료 후 증가 된 골소주 ( 그림 1A , 오른쪽 패널)를 보여줍니다. 그림 1B 는 OVX 마우스 ( 그림 1B , 왼쪽 패널)와 EXX 치료 12 주 ( 그림 1B , 오른쪽 패널) OVX 마우스의 4 번째 요추의 대표적인 μCT 이미지를 보여줍니다. EXD 처리 된 마우스의 요추 내에서보다 많은 골질 뼈가 대조 OVX 마우스의 것보다 많이 보인다. μCT 영상에서 얻은 데이터는 제 4 요추의 골량 / 조직 부피 (BV / TV), 섬유주 수 (Tb N), 섬유주 두께 (Tb Th) 및 섬유주 간격의 감소 (Tb. Sp) EXD 마우스 ( 그림 1C )에서.
OVX 마우스의 골 간엽 줄기 세포 (bMSCs)의 골 형성에 대한 EXD의 영향
그림 2는 bMSC의 골 형성 가능성을 나타냅니다. OVX 생쥐의 bMSC가 7 일 동안 배양 될 때 지방 방울 (별표, 지질 방울의 불규칙한 모양)이 자동으로 형성됩니다 ( 그림 2A , 왼쪽 패널). EXD 처리 마우스에서는 뚱뚱한 물방울 대신에 뼈 노듈 (화살표)이 형성됩니다 ( 그림 2B , 오른쪽 패널). 알칼리 포스 파타 아제 (ALP) 분석은 대조 OVX 마우스 ( 그림 2B , 왼쪽 패널)의 bMSCs에 비해 EXD 처리 된 bMSCs ( 그림 2B , 오른쪽 패널)에서 더 많은 ALP 양성 세포 (자주색)가 검출 될 수 있음을 보여줍니다.
OVX와 EXD 마우스 사이의 유전자 발현 변화s = "xref"> 24
계층 적 클러스터링은 bMSCs에서 마이크로 어레이에 의해 밝혀진 389 개의 유전자의 발현이 OVX와 EXD로 처리 된 생쥐 에서 생체 내 (총 26,991 개의 유전자) 에서 fold change (> OVX가 아닌 마우스 로 표준화)되었다 ( 그림 3 ). 녹색은 표현이 상향 조절되었음을 나타내고 빨간색은 표현이 하향 조절되었음을 나타냅니다. 같은 그룹에있는 세 개의 샘플이 먼저 함께 클러스터링되어 프로필의 신뢰성있는 품질을 나타냅니다. 도 4 는 생체 내 및 시험 관내 에서 EXD에 의해 표적화 된 중첩 된 신호 전달 경로를 도시한다.

그림 1 : EXD가 뼈 형태에 미치는 영향.
( A ) OVX 및 EXD 처리 마우스의 허리 4 번째 섹션의 H & E 얼룩. ( B) 대조군 OVX 및 EXD- 처리 마우스에서 요추 4 번째 섬유주골의 3 차원 μCT 재구성 영상. ( C ) μCT의 정량. BV : 뼈 부피, TV : 조직 부피, Tb.N : 섬유주 수, Tb.Th : 섬유주 두께, Tb.Sp : 섬유주 간격. 열은 수단 ± SE를 나타냅니다. 그룹당 n = 6. * p <0.05, ** p <0.01 EXD 대 OVX (학생의 t- 검정). ( AC )는 Shufen Liu et al. 24. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2 : EXD가 bMSC 차별화에 미치는 영향.
( A ) bei 후 7 일 동안 배양 한 bMSCs의 이미지OVX 또는 EXD 처리 마우스의 대퇴에서 분리. *는 뚱뚱한 물방울을 나타냅니다. 화살표는 뼈 결절을 나타냅니다. ( B ) 7 일 동안 배양 한 OVX 및 EXD 처리 된 bMSCs의 ALP 염색 (자색은 ALP 양성을 나타낸다). ( C ) ( B )의 정량화. 칼럼은 그룹당 세 접시 (6 마리 마우스)의 평균 ± SE를 나타냅니다. ** p <0.01 EXD 대 OVX (Student 's t-test). ( AC )는 Shufen Liu et al. 24. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
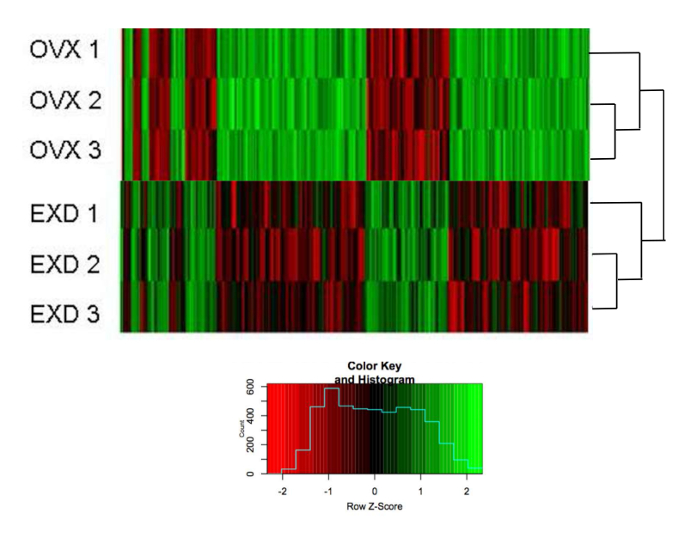
그림 3 : EXD가 유전자 발현 프로파일에 미치는 영향.
OVX 및 EXD bMSC에서 389 유전자 발현의 계층 적 클러스터링 히트 맵 해체 후 7 일째 에 수확 됨. 척도 (작은 이미지)는 비 OVX bMSC에 의해 표준화 된 배수 변화를 나타냅니다. 유전자 목록은 보충 파일 1 에 나와 있다. 이 수치는 Shufen Liu et al. 24. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4 : 생체 내 ( in vivo) 및 체외 ( in vitro) 실험에서 중복 된 신호 전달 경로에 EXD가 미치는 영향.
처음 10 개 는 생체 내 EXD와 KEGG 경로를 기반으로 한 시험관 내 EXD 함유 혈청 에서 역전 된 신호 전달 경로를 중첩 했다 . 경로와 관련된 유전자는 보충 파일 2 에 나와 있습니다./files/ftp_upload/55654/55654fig4large.jpg "target ="_ blank ">이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 종 | 쥐 | 쥐 | 기니피그 | 토끼 | 고양이 | 원숭이 | 개 | 인간 |
| 아르 자형 | 59 | 90 | 99 | 93 | 82 | 111 | 104 | 100 |
표 1 : 다른 종의 R- 인자.
약리학 연구에서 일반적으로 사용되는 8 종의 R 인자. R 인자는 다음과 비례합니다. (몸의 표면적 (m 2 ) / b중량 (kg)) 2/3 .
보충 파일 1.
생체 내에서 EXD 에 의해 구제되는 389 개 이상의 유전자에 대한 정보. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 파일 2.
in vivo 및 in vitro 실험 에서 신호 전달 경로 (KEGG 경로 기반) 및 관련 유전자 에 대한 정보. 이 파일을 다운로드하려면 여기를 클릭하십시오.
토론
최근 몇 년 동안 동부 지역의 임상 환경에서 수천 년 동안 적용 되어온 대체 의학의 한 유형 인 한약에 많은 관심이 쏟아졌습니다. 전통적인 약초 의학은 현대 의학의 "벤치에서 침대로"패턴과는 달리 처음에는 "bed to bench"패턴을 통해 자신의 메커니즘을 설명해야합니다. 이것은 벤치 단계에서 수행 된 검증과 새로 최적화 된 약물의 개발을위한 처리에 이어 수행 될 수 있습니다. 지금까지 전체 수식이나 허브에서 활성 성분을 방출하는 것으로보고 된 몇 가지 추출 방법이 있습니다. 그 중에서도 물 추출이 가장 널리 사용됩니다.
한약의 물 추출에는 4 가지 기본 단계가 있습니다. 첫 번째 단계는 몸을 담글 수 있습니다. 복잡한 한약은 물에서 일정 시간 (일반적으로 0.5 ~ 1 시간) 침수됩니다. 담그는 시간은 원료 약초의 양과 특성에 달려 있습니다. 에생 약초가 완전히 적셔 졌는지 확인하십시오. 모든 조각이나 블록의 중앙 부분을 가려야합니다. 물의 양은 약초의 총량에 달려 있습니다. 때로는 약초의 무게가 얼마나 많은 물을 담그기 위해 필요한지 결정하는 데 사용됩니다. 그러나 허브 밀도는 다양합니다. 몸을 적시는 목적은 모든 약초를 갈아서 다음 단계에서 활성 성분의 방출을 촉진하기 때문에 물의 양에 대한 참조 표준으로 사용하기 위해 약초의 양이 선호됩니다. 두 번째 단계는 요리입니다. 끓기와 서서히 끓는 과정은 수천 년에 걸쳐 발전되어 왔습니다. 조리 시간의 변화는 약, 물리적, 화학적 특성이 다르기 때문에 약초의 종류에 따라 크게 좌우됩니다 12 . 제 지방학은 단시간 (보통 20 분 미만) 동안 조리하는 것이 좋습니다. 반면 방향제는 휘발성 반응을 피하기 위해 첫 번째 끓기 전에 몇 분만 추가해야합니다. 에프또는 강장제 나 약제를 사용하는 경우에는 치료 성분을 추출하기 위해 오랜 시간이 필요합니다. 이 경우 EXD는 수십 년에 걸친 폐경 후 골다공증 치료에 사용됩니다 12 . 전통적인 한약 이론에서이 증후군은 신장과 관련된 결핍에 의한 것으로 생각됩니다. EXD는 주로 신장을 토닝하기 위해 고안되었습니다. 그러므로 EXD는 2 ~ 3 시간 조리하여 EXD가 항 골다공증 효과를 나타낼 수있게했습니다. 세 번째 단계는 여과입니다. 여과는 gavage 바늘이 초본 과립으로 막히는 것을 막는 것을 돕는다. 네 번째 단계는 집중입니다. 위관 영양법의 투여 량은주의 깊게 고려되어야한다. 경구 용 위관 영양법으로 투여되는 10 mL / kg 이상과 같은 큰 부피는 흡수에 관련된 몇 가지 문제를 야기 할 수 있다고보고되어왔다. 예를 들어 십이지장으로의 화합물의 신속한 분지 화 또는 화합물의 수동 역류와 관련된 흡인 성 폐렴 물질식도로 25 . 따라서, 마우스 및 래트를 위해 선택된 부피는 각각 약 7.5 mL / kg 및 5.5 mL / kg이었다.
혈액에서 소화되고 대사 된 EXD의 유효 성분이 원료 추출물과 유사한지를 확인하는 것이 중요합니다. EXD 생물학적 동등성 측면에서, Wu et al. Epimedin A, Epimedin B, Epimedin C, icariin, sagittatoside B, 2 "-O-rhamnosyl icariside II 및 baohuoside I 26의 7 가지 성분을 측정 하였다. Hu et al. 경구 투여 후 래트 플라스마에서 21 가지 화합물 발견 27 . 지금까지 EXD에서 추출한 원료는보고되지 않았습니다. 그러나 icariin과 berberine과 같은 혈액에서 시험 된 유효 성분 중 일부는 비교 관찰 28 을 위해 동물에게 직접 적용되었습니다.
동물 생체를 계산하는 데는 여러 가지 방법이 있습니다2가 투여 량. 약동학이 다른 종에 따라 다르기 때문에 체중에 근거한 전통적인 방법 (mg / kg)은 적절하지 않습니다. 신진 대사율이 개별 동물 크기와 관련이있는 체 표면적 (mg / m 2 )에 근거한 계산이 자주 사용됩니다 29 . 여기에 적용되는 방정식은 신체 표면적과 체중을 모두 고려하여 일반적으로 한약재 30 에서 활용됩니다.
토끼, 기니아 피그, 쥐 및 쥐와 같은 많은 종류의 동물을 약물 함유 혈청 제제로 선택할 수 있습니다. 시험 관내 세포와 동일한 종이 바람직하다. 이 연구에서 쥐는 마우스보다 더 많은 혈청을 제공하고 다른 동물에 비해 종의 관점에서 쥐에 더 가깝기 때문에 쥐를 선택했습니다. 또한 시험 관내 프로토콜 에 나와 있듯이 생체 내 또는 임상에서의 용량 상응 량을 권장합니다. 단정혈청 이온 (1 : 10 권장)은 고려하지 않았습니다. 즉 해당 용량의 10 배는 처리 된 세포 나 장기에 의한 잠재적 인 독성 반응으로 인해 혈청이 제공된 동물에는 적용되지 않습니다 31 . 약물 투여 빈도는 1 일 1 회 3 내지 14 일에서 1 일 2 회 (각 투여 사이 2 시간) 7 , 8 , 32로 다양하다. 수거 시간은 대개 마지막 관리 33 , 34 이후 1 시간에서 2 시간 사이 (6 시간 전)에 발생합니다. 목표는 샘플을 채취 할 때 혈중 약물 농도를 비교적 안정적으로 유지하는 것입니다. 관리 루틴은 생체 내 투여 과정에 따라 주사, 피부 투여 또는 흡입을 포함 할 수있다.
약물 -혈청 함유 혈청은 여전히 논쟁의 여지가있다. 지지자들은 호르몬, 효소, 항체 및 혈청 자체의 보체와 같은 많은 활성 성분의 존재가 결과에 영향을 미치는 예기치 않은 반응을 초래할 수 있다고 생각합니다 36 . 야당은 약물에 의해 생성 된 활성 성분이 불활 화 과정 37 에 의해 제거 될 수도 있다고 믿고있다. 이 균형을 맞추기 위해 사람들은 생리 식염수로 처리 한 동물의 혈청을 사용하도록 대조군 그룹을 설계합니다.
프로토콜에는 몇 가지 제한 사항이 있습니다. 추출물의 품질은 in vivo 및 in vitro 실험 을 시작하기 전에 평가하지 않습니다. 둘째, 허브 - 항생제 상호 작용을 일으킬 수있는 항생제가 배지에 사용되며 추가 검사가 필요합니다. 셋째, 침지 및 끓인 시간은 임상 실험 및 동물 실험에서 얻은 경험을 토대로 결정됩니다. 더 많은 시간을 선택할 수 있습니다 f또는 비교. 몸을 가라 앉히는 시간은 다른 초본 공식에 맞게 수정할 수 있습니다. 동물 투여를위한 투약량은 동물의 종류 및 연령과 체중에 따라 변경 될 수 있습니다. 약물 함유 혈청의 제조 및 투여 루틴을 위해 선택된 동물은 상기 논의 된 바와 같이 변화 될 수있다.
이 프로토콜과 결과는 함께 생체 내 및 시험 관내 연구 에서 한약 섭취를 준비하고 적용하는 예를 제공합니다. 다른 경우에는 약초 특성에 따라 치료 기간, 종 및 관리 과정을 포함하여 세부 사항 중 일부를 최적화해야합니다.
공개
저자는 경쟁적인 금전적 이해 관계가 없다고 선언합니다.
감사의 말
이 작품은 중국 국립 자연 과학 재단 (81573992)의 지원을 받았다. 그들의 언어 편집 지원에 대해 Emily K. Lo와 Kathleen DiNapoli에게 감사드립니다.
자료
| Name | Company | Catalog Number | Comments |
| Curculigo orchioides Gaertn (9 g), Herbaa Epimedii (9 g), Radix Morindae Officinalis (9 g), Radix Angelicae Sinensis (9 g), Cortex Phellodendri (6 g), and Rhizoma Anemarrhenae (6 g) | Kang-qiao Chinese Medicine Yinpian Co. Ltd (Shanghai, CN) | 160922 | EXD components |
| Filter paper | GElifesciences | 99-103-952 | Filter EXD decoction before concentration |
| Imprinting Control Region (ICR) mice | Shanghai Laboratory Animal Center | SCXK 2007-0005 | In vivo study |
| Sprague Dawley rats | Shanghai Laboratory Animal Center | SCXK 2007-0005 | EXD-containing serum preparation |
| Syringe filter | Millipore | SLGP033RB | 0.22 µm |
| gavage needles (10 ml) | Shanghai BO Ge trade sales department | 59104274 | Adminstration of EXD |
| Ketamine (80 mg/kg) | Fujian Gutian Pharma Co. Ltd | H35020148 | Anesthesia |
| Xylazine (10 mg/kg) | Sunway Pharma Co. Ltd | CB07591 | Anesthesia |
| Dulbecco’s modification of Eagle’s medium Dulbecco (DMEM) culture medium | Gibco | 12800-116 | DMEM with 2 mM L-glutamine and without ribonucleosides and ribonucleotides |
| Streptomycin | Sigma | 1277 | 100 µg / ml |
| Penicillin | Sigma | 4687 | 100 µg / ml |
참고문헌
- Zhang, L. G., Ouyang, X. W., Wu, T. T., Ni, L. J., Shi, W. Z. Quantitative evaluation of in vitro effects and interactions of active fractions in a Chinese medicinal formula (Yaotongning Capsule) on rat chondrocytes. J Ethnopharmacol. 155 (3), 1424-1432 (2014).
- Ogawa, Y., Fujii, Y., Sugiyama, R., Konishi, T. The role of the seven crude drug components in the sleep-promoting effect of Yokukansan. J Ethnopharmacol. 177, 19-27 (2016).
- Kim, J. H., Doh, E. J., Lee, G. Evaluation of Medicinal Categorization of Atractylodes japonica Koidz. by Using Internal Transcribed Spacer Sequencing Analysis and HPLC Fingerprinting Combined with Statistical Tools. Evid Based Complement Alternat Med. 2016, 2926819(2016).
- Sheridan, H., et al. The potential of metabolic fingerprinting as a tool for the modernisation of TCM preparations. J Ethnopharmacol. 140 (3), 482-491 (2012).
- Planas, G. M., Kucacute, J. Contraceptive Properties of Stevia rebaudiana. Science. 162 (3857), 1007(1968).
- Tashino, S. "Serum pharmacology" and "serum pharmaceutical chemistry": from pharmacology of Chinese traditional medicines to start a new measurement of drug concentration in blood. Ther Drug Monit Res. 5, 54-64 (1988).
- Cao, Y., Liu, F., Huang, Z., Zhang, Y. Protective effects of Guanxin Shutong capsule drug-containing serum on tumor necrosis factor-alpha-induced endothelial dysfunction through nicotinamide adenine dinucleotide phosphate oxidase and the nitric oxide pathway. Exp Ther Med. 8 (3), 998-1004 (2014).
- Fu, L., et al. Ex Vivo Stromal Cell-Derived Factor 1-Mediated Differentiation of Mouse Bone Marrow Mesenchymal Stem Cells into Hepatocytes Is Enhanced by Chinese Medicine Yiguanjian Drug-Containing Serum. Evid Based Complement Alternat Med. 2016, 7380439(2016).
- Chen, X., et al. Application of serum pharmacology in evaluating the antitumor effect of Fuzheng Yiliu Decoction from Chinese Medicine. Chin J Integr Med. 20 (6), 450-455 (2014).
- Sze, S. C., et al. A novel mechanism: Erxian Decoction, a Chinese medicine formula, for relieving menopausal syndrome. J Ethnopharmacol. 123 (1), 27-33 (2009).
- Sze, S. C., et al. Effects of Erxian decoction, a Chinese medicinal formulation, on serum lipid profile in a rat model of menopause. Chin Med. 6, 40(2011).
- Zhong, L. L., et al. A randomized, double-blind, controlled trial of a Chinese herbal formula (Er-Xian decoction) for menopausal symptoms in Hong Kong perimenopausal women. Menopause. 20 (7), 767-776 (2013).
- Wang, S. W., et al. Steroidogenic effect of Erxian decoction for relieving menopause via the p-Akt/PKB pathway in vitro and in vivo. J Ethnopharmacol. , (2016).
- Lin, L., Wu, S., Tang, J. [Clinical observation and experimental study of the treatment of aplastic anemia by warming and tonifying the spleen and kidney]. Zhong Xi Yi Jie He Za Zhi. 10 (5), 272-274 (1990).
- Nian, H., et al. Antiosteoporotic activity of Er-Xian Decoction, a traditional Chinese herbal formula, in ovariectomized rats. J Ethnopharmacol. 108 (1), 96-102 (2006).
- Qin, L., et al. Antiosteoporotic chemical constituents from Er-Xian Decoction, a traditional Chinese herbal formula. J Ethnopharmacol. 118 (2), 271-279 (2008).
- Xue, L., et al. A HNMR-based metabonomics study of postmenopausal osteoporosis and intervention effects of Er-Xian Decoction in ovariectomized rats. Int J Mol Sci. 12 (11), 7635-7651 (2011).
- Lu, X. N., Xu, X. R., Lin, L. J. [Clinical observation of bushen er'xian decoction in treating premature ovarian failure]. Zhongguo Zhong Xi Yi Jie He Za Zhi. 28 (7), 594-596 (2008).
- Yu, X., et al. Anti-angiogenic activity of Erxian Decoction, a traditional Chinese herbal formula, in zebrafish. Biol Pharm Bull. 35 (12), 2119-2127 (2012).
- Chu, E. S., et al. An in vitro and in vivo investigation of the antimetastatic effects of a Chinese medicinal decoction, erxian decoction, on human ovarian cancer models. Integr Cancer Ther. 12 (4), 336-346 (2013).
- Zhu, Z., Li, L., Jin, X., Fang, J., Zhang, D. Er-Xian Decoction, a traditional Chinese herbal formula, intervening early in hypothalamic-pituitary axis of male rats with delayed puberty. Pharmacogn Mag. 10 (40), 517-521 (2014).
- Miao, M. S. Experimental animals and technology. 1997, Chinese Modical Publisher. Beijing. 145(1997).
- Soleimani, M., Nadri, S. A protocol for isolation and culture of mesenchymal stem cells from mouse bone marrow. Nat Protoc. 4 (1), 102-106 (2009).
- Lu, S., Huang, J., Wang, J., et al. Er-Xian Decoction Stimulates Osteoblastic Differentiation of Bone Mesenchymal Stem Cells in Ovariectomized Mice and Its Gene Profile Analysis. Stem Cells International. 2016, 4079210(2016).
- Turner, P. V., Brabb, T., Pekow, C., Vasbinder, M. A. Administration of substances to laboratory animals: routes of administration and factors to consider. J Am Assoc Lab Anim Sci. 50 (5), 600-613 (2011).
- Wu, C., et al. Simultaneous determination of seven flavonoids in dog plasma by ultra-performance liquid chromatography-tandem mass spectrometry and its application to a bioequivalence study of bioactive components in Herba Epimedii and Er-Xian Decoction. J Pharm Biomed Anal. 54 (1), 186-191 (2011).
- Hu, Y. M., et al. Identification of the major chemical constituents and their metabolites in rat plasma and various organs after oral administration of effective Erxian Decoction (EXD) fraction by liquid chromatography-mass spectrometry. Biomed Chromatogr. 24 (5), 479-489 (2010).
- Xue, L., et al. Effects and interaction of icariin, curculigoside, and berberine in er-xian decoction, a traditional chinese medicinal formula, on osteoclastic bone resorption. Evid Based Complement Alternat Med. , (2012).
- Nair, A. B., Jacob, S. A simple practice guide for dose conversion between animals and human. J Basic Clin Pharm. 7 (2), 27-31 (2016).
- Xu, X., et al. Protective effect of the traditional Chinese medicine xuesaitong on intestinal ischemia-reperfusion injury in rats. Int J Clin Exp Med. 8 (2), 1768-1779 (2015).
- Li, Z., Wang, J. On the methods for Chinese herbs serum pharmcology. Zhong Guo Zhong Yi Yao Xing Xi Za Zhi. 9 (2), 5-6 (2002).
- Jiang, Y. R., et al. Effect of chinese herbal drug-containing serum for activating-blood and dispelling-toxin on ox-LDL-induced inflammatory factors' expression in endothelial cells. Chin J Integr Med. 18 (1), 30-33 (2012).
- Guo, C. Y., Ma, X. J., Liu, Q., Yin, H. J., Shi, D. Z. [Effect of Chinese herbal drug-containing serum for activating blood, activating blood and dispelling toxin on TNF-alpha-induced adherence between endothelial cells and neutrophils and the expression of MAPK pathway]. Zhongguo Zhong Xi Yi Jie He Za Zhi. 35 (2), 204-209 (2015).
- Li, Y., Xia, J. Y., Chen, W., Deng, C. L. Effects of Ling Qi Juan Gan capsule drug-containing serum on PDGF-induced proliferation and JAK/STAT signaling of HSC-T6 cells]. Zhonghua Gan Zang Bing Za Zhi. 21 (9), 663-667 (2013).
- Li, Y. K. [Some issues in methology of Chinese herbs serum pharmcology]. Zhong Yao Xin Yao Yu Lin Chuang Yao Li. 10 (5), 263(1999).
- Zhang, L., et al. [A review of Chinese herbs serum pharmcology methodological study]. Nan Jing Zhong Yi Yao Da Xue Xue Bao. 18 (4), 254(2002).
- Zhang, D. [Issues and strategies for study of serum pharmcology in oncology]. Zhong Yi Yan Jiu. 17 (5), 13-14 (2004).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유