Method Article
Preparazione della medicina a base di erbe: Eruzione di Er-Xian e Serum contenente Er-Xian per
In questo articolo
Riepilogo
Qui presentiamo la preparazione di un decotto er-xiano (EXD) in quattro fasi - immersione, decotto, filtrazione e concentrazione - e dimostrare la somministrazione di un siero preparato con EXD ai ratti. Questi metodi sono applicabili allo studio in vivo e in vitro di decotti a base di erbe come i medicinali cinesi tradizionali.
Abstract
La medicina tradizionale a base di erbe, una medicina alternativa nell'ambiente clinico, ha ricevuto un'attenzione maggiore negli ultimi anni. Prima della consegna al corpo, è necessaria una procedura di estrazione aggiuntiva per liberare i costituenti attivi dalle erbe grezze. La decozione dell'acqua è una procedura di estrazione classica che è ancora ampiamente utilizzata nelle impostazioni cliniche. Qui proponiamo un protocollo dettagliato per la decotto er-xian (EXD) per applicare decotti a base di erbe a studi sperimentali. Viene descritto il calcolo di una dose appropriata per l'animale, nonché le quattro fasi principali di EXD: l'ammollo, la decozione dell'acqua, la filtrazione e la concentrazione. Inoltre, EXD contenente siero viene introdotto nei ratti come mezzo di convalida in vitro . Qui, i ratti sono stati somministrati per via orale con EXD per tre giorni. I campioni di sangue sono stati raccolti, inattivati, centrifugati e filtrati. Il siero, diluito con il mezzo di coltura, può essere utilizzato per trattare cellule o tessuti in vItro. Ad esempio, EXD è stato applicato sia agli studi in vivo che in vitro e ha dimostrato che EXD migliora l'osteogenesi. Questo protocollo può essere utilizzato come riferimento per la preparazione e l'applicazione di medicinali a base di erbe.
Introduzione
L'interesse per lo studio e l'applicazione della medicina tradizionale a base di erbe sta crescendo. Al contrario di farmaci moderni, in cui gli ingredienti chimici sono definiti, le formule a base di erbe hanno alcuni ingredienti sconosciuti e richiedono processi di estrazione per consentire la consegna dei loro composti attivi. Anche se molti studi cercano di selezionare un piccolo composto con una struttura ben nota come rappresentante dell'intera erba o di formula a base di erbe, né le efficienze farmacologiche né i meccanismi possono essere considerati equivalenti 1 , 2 . Mentre l'impronta digitale consente l'analisi dei costituenti delle formule complesse a base di erbe, alcuni componenti non sono ancora chiaramente analizzati, portando ad una sfida quando si combinano tutti gli estratti per lo studio 3 . Le interazioni di numerosi costituenti / estratti mediano gli effetti terapeutici delle medicine a base di erbe. Per mantenere questo vantaggio, il tradizionale estratto forma-decottoIone-è ancora ampiamente utilizzato nella clinica. Poiché la procedura di estrazione ha un grande impatto sull'efficacia terapeutica, è necessario un protocollo standard di decotto acqua tradizionale, specialmente per gli studi in vivo 4 , 5 .
D'altra parte, quando esplora i meccanismi farmacologici, è anche una sfida l'amministrazione di decotti a base di erbe durante studi in vitro o ex vivo . Il concetto di un siero contenente droga fu proposto per la prima volta da Tashino nel 1988 6 . Da allora, un numero crescente di ricercatori lo hanno applicato alla medicina a base di erbe 7 , 8 , 9 . Anche se il metodo del siero contenente farmaci ha alcune limitazioni, come l'influenza di determinate componenti del siero, è ancora considerato un metodo che imitava in modo preciso le condizioni fisiologiche.
La decozione er-xian è stata sviluppata nei primi anni '50 per alleviare i sintomi della menopausa 10 , 11 , 12 , 13 . È stato inoltre applicato al trattamento dell'anemia aplastica 14 , dell'osteoporosi menopausa 15 , 16 , 17 , insufficienza ovarica precoce 18 , cancro mammario 19 , cancro ovarico 20 e pubertà ritardata 21 . Qui presentiamo protocolli dettagliati per la preparazione del decotto er-xian (EXD) e del suo siero contenente droga. Inoltre, descriviamo l'applicazione del siero contenente EXD e EXD ai modelli osteoporotici della menopausa murina.
Un EXD è composto da 9 g ciascuno di Curculigo orchioides Gaertn , Herbaa Epimedii Radix Morindae Officinalis e Radix Angelicae Sinensis e 6 g ciascuno di Cortex Phellodendri e Rhizoma Anemarrhenae per paziente adulto al giorno. La dose equivalente per un topo è 0.1418 EXD / kg / giorno sulla base della seguente equazione 22 : dB = dA * RB / RA * (WA / WB) 1/3 . DA e dB si riferiscono rispettivamente alla dose per peso corporeo (mg / kg) dell'uomo e del mouse. La dose, in mg / kg, è sostituita dal numero di EXD / kg. RA e RB rappresentano rispettivamente il fattore del corpo umano e il fattore del corpo del topo proporzionale alla superficie del corpo (m 2 ) / peso corporeo (kg)) 2/3 (vedi tabella 1 ). WA e WB indicano rispettivamente il peso corporeo (kg) dell'uomo e del mouse.
Protocollo
Il protocollo segue le linee guida per la cura degli animali dell'Università di Medicina tradizionale cinese di Shanghai ed è approvato dall'esperimento animale Comitato di etica degli animali di Shanghai.
1. Protocollo I: preparazione di EXD
- Calcolo
- Amministrare l'EXD ad un gruppo di trattamento di 10 minicenne femminile (CNR) (0.02 kg / mouse), 5 giorni alla settimana per 12 settimane.
NOTA: sono necessari complessivamente 1.702 EXD. Poiché gli EXD sono misurati in incrementi discreti, in pratica reale, amministrare 2 EXDs. - Calcolare il volume di EXD applicato per mouse (V = (0,1418 EXD / kg • giorno) * (0,02 kg / mouse) * 50 mL / EXD = 0,14 mL / mouse • giorno).
- Amministrare l'EXD ad un gruppo di trattamento di 10 minicenne femminile (CNR) (0.02 kg / mouse), 5 giorni alla settimana per 12 settimane.
- ammollo
- Mettete tutte le materie prime di due EXD ( cioè, Curculigo orchioides Gaertn (18 g), Herbaa Epimedii (18 g), Radix Morindae Officinalis (18 g), RAdix Angelicae Sinensis (18 g), Cortex Phellodendri (12 g) e Rhizoma Anemarrhenae (12 g), 96 g in totale) in un contenitore con coperchio.
NOTA: Si consiglia un contenitore in ceramica. - Macerare le erbe crude con 500 ml di acqua distillata per 1 h; L'acqua dovrebbe coprire le erbe di circa un pollice. Lasciate che tutte le erbe abbassino completamente.
- Mettete tutte le materie prime di due EXD ( cioè, Curculigo orchioides Gaertn (18 g), Herbaa Epimedii (18 g), Radix Morindae Officinalis (18 g), RAdix Angelicae Sinensis (18 g), Cortex Phellodendri (12 g) e Rhizoma Anemarrhenae (12 g), 96 g in totale) in un contenitore con coperchio.
- Primo decotto d'acqua
- Scaldare le erbe utilizzando un fornello a gas o un fornello ad induzione ad alta potenza fino a quando l'acqua bolle (circa 5 - 10 min; il tempo dipende dalla potenza termica, dal contenitore e dalla quantità di erbe e acqua). Abbassare il potere a un minimo di zucchero per 2 ore.
- Prima filtrazione
- Coprire un bicchiere di vetro da 500 ml con carta filtro regolare o con garza e cotone. Spegnere con cautela il decotto nel bicchiere attraverso il filtro. Lasciare le erbe nel contenitore.
- Ritorna il residuo vegetale residuo oN la carta filtrante nel contenitore.
- Seconda decotto dell'acqua
- Aggiungere l'acqua distillata al contenitore con le erbe; Lasciate che copri le erbe di circa un pollice.
- Ripetere il passo 1.3.
- Seconda filtrazione
- Ripetere i passaggi 1.4.1 e 1.4.2.
- Versare la seconda decozione nello stesso bicchiere. Mescolare insieme la prima e la seconda decotto.
- Concentrazione
- Mettere il bicchiere su un fornello a gas con la garza di legare senza amianto tra di loro, scaldare la decozione usando un basilico basso e mescolare lentamente e continuamente con una barra di vetro.
- Quando la decozione si riduce a 200 ml, trasferirla in un bicchiere da 500 ml.
- Ripetere il passo 1.7.1 fino a decottare fino a 100 ml.
- Stoccaggio e amministrazione
- Trasferire la decotto concentrata in una bottiglia di vetro sterile. Lasciare raffreddare a temperatura ambienteRe (RT). Conservare a 4 ° C se impiegato entro una settimana oa -70 ° C per la conservazione a lungo termine.
- Utilizzando un ago di gavaggio, somministrare 0,14 ml / mouse del decotto a topi ovariectomizzati (OVX) una volta al giorno, 5 giorni alla settimana per 12 settimane.
2. Protocollo II: Preparazione del siero contenente EXD
- Calcolo
- Calcolare la dose equivalente del ratto (ROSSO) usando 0,15 kg come peso corporeo di ciascun ratto (1 mese): dB = (1/60) * (90/100) * (60 / 0,15) 1/3 = 0,111 EXD / kg / die.
NOTA: Per la preparazione di 100 ml di terreno di coltura (10% di siero contenente EXD) è necessario un totale di 10 ml di siero contenente EXD. Ogni ratto dovrebbe fornire 2 ml di siero. Quindi, 6 ratti (una perdita del 20% è presa in considerazione) sono necessari per l'associazione EXD una volta al giorno per 3 giorni. Il numero di EXD è: (0,111 EXD / kg • giorno) * (0,15 kg / ratto) * (6 ratti) * (3 giorni) = 0,300 EXD. Anche in questo caso, poiché gli EXD sono misurati in incrementi discreti,Utilizzare 1 EXD. - Calcolare il volume di EXD applicato per ratto (v = (0.111 EXD / kg • giorno) * (0.15 kg / ratto) * (50 mL / EXD) = 0.83 mL / ratto • giorno).
- Calcolare la dose equivalente del ratto (ROSSO) usando 0,15 kg come peso corporeo di ciascun ratto (1 mese): dB = (1/60) * (90/100) * (60 / 0,15) 1/3 = 0,111 EXD / kg / die.
- ammollo
- Mettere le materie prime per 1 EXD in un contenitore con coperchio. Macerare le erbe crude in acqua distillata per 1 h; L'acqua dovrebbe coprire le erbe di circa un pollice. Lasciate che tutte le erbe abbassino completamente.
- Primo decotto d'acqua
- Scaldare le erbe utilizzando un fornello ad induzione ad alta potenza fino a quando l'acqua bolle (circa 5 - 10 min; il periodo di tempo dipende dalla potenza termica, dal contenitore e dalla quantità di erbe e acqua). Spegnere l'apparecchio fino a raggiungere un minimo di 2 ore.
- Prima filtrazione
- Coprire un bicchiere di vetro da 500 ml con carta filtro regolare o con garza e cotone. Spegnere con cautela il decotto nel bicchiere attraverso il filtro. Lasciare le erbe nel contenitore.
- Rimettere il residuo vegetale sulla carta filtrante nel contenitore.
- Seconda decotto dell'acqua
- Aggiungere l'acqua distillata al contenitore con le erbe; Lasciate che copri le erbe di circa un pollice.
- Ripetere il passo 2.4.
- Seconda filtrazione
- Ripetere i passaggi 2.5.1 e 2.5.2.
- Versare la seconda decottazione nello stesso bicchiere come nel punto 2.4.1 e mescolare insieme la prima e la seconda decotto.
- Concentrazione
- Mettere il bicchiere su un fornello a gas con la garza di legare senza amianto tra di loro, scaldare la decozione usando un basso affumicatoio e mescolare lentamente e continuamente con una barra di vetro.
- Quando la decozione si riduce a 100 ml, trasferirla in un bicchiere da 100 ml.
- Ripetere il passo 2.7.1 fino a decottare fino a 50 ml.
- Stoccaggio e amministrazione
- Trasferire la decottazione concentrata in uno sterBottiglia di vetro del ile. Lasciare raffreddare a RT. Conservare a 4 ° C se impiegato entro una settimana oa -70 ° C per la conservazione a lungo termine.
- Intragastricamente somministrare 0,83 ml / ratto una volta al giorno per 3 giorni.
- Preparazione del siero contenente EXD
- Anestetizzare i ratti mediante iniezione intraperitoneale di 300 mL / 100 g di 80 mg / kg di ketamina e 10 mg / kg di xilazina a 1 ora dopo l'ultima somministrazione di EXD. Confermare l'anestesia appropriata con il pizzico del piede.
- Incise la pelle e il peritoneo del ratto dall'addome al fondo del torace usando un bisturi (o forbici diritte). Creare un'incisione di lunghezza e profondità rispettivamente di circa 5 cm e 0,5 cm. Spostare la viscera addominale a sinistra usando carta tissue.
- Usando carta tissue, rimuovere il tessuto connettivo dell'arto addominale per esporre chiaramente il vaso.
- Tirate lentamente il sangue dall'arto addominale usando una siringa da 10 ml di 22 gauge. TrasferirloUn tubo sterile da 15 ml dopo aver rimosso l'ago; Un ratto può produrre 8-10 ml di sangue.
NOTA: il ratto dovrebbe essere vivo ( cioè, con l'aorta pulsata) quando inizia il disegno del sangue e morta dopo che il disegno viene completato. - Mescolare il sangue in posizione verticale per 30-60 minuti a camera RT. Centrifugare a 500-600 xg per 20 min. Collocare con cura tutto il supernatante (siero) in un tubo sterile da 50 ml e mescolare insieme tutto il siero (da diversi animali) insieme.
- Effettuare l'inattivazione del calore incubando il siero in un bagno d'acqua di 56 ° C per 30 min. Filtrare il siero utilizzando un filtro a siringa con una membrana idrofila di polietersolfone di pori 0,22 μm. Usare il siero fresco o conservarlo a -20 ° C.
- Controllo della preparazione sierica contenente farmaci (utilizzata nel gruppo di controllo)
- Amministrare ogni ratto con lo stesso volume di soluzione salina (0,83 ml) una volta al giorno per 3 giorni. Gli altri passaggi sono gli stessi del passaggio 2.9.
- Applicazione
- Aggiungere 10 ml di siero contenente EXD o di siero contenente droga ad ogni 100 ml di mezzo, più 1% di penicillina-streptomicina (PS) 23 .
Risultati
L'effetto di EXD sulla densità ossea dei topi OVX
La colorazione ematossilina e eosinica (H & E) della sezione vertebra lombare mostra una maggiore trabecola ossea dopo il trattamento EXD in vivo ( Figura 1A , pannello destro) rispetto a quelli del gruppo OVX ( Figura 1A , pannello a sinistra). Figura 1B mostra le immagini μCT rappresentative del 4 ° lombare in topi OVX ( Figura 1B , pannello sinistro) e topi OVX con trattamento EXD per 12 settimane ( Figura 1B , pannello a destra). Altre ossa trabecolari sono visibili all'interno della vertebra lombare dei topi trattati con EXD rispetto a quelli dei topi OVX di controllo. I dati della imaging μCT indicano un aumento del volume osseo / tessuto osseo (BV / TV), del numero trabecolare (Tb. N) e dello spessore trabecolare (Tb. Th) e della diminuita spaziatura trabecolare (Tb. Sp) del 4 ° lombare Nei topi EXD ( Figura 1C ).
L'effetto di EXD sulla osteogenesi delle cellule staminali mesenchimali ossei (bMSC) da topi OVX
La figura 2 rappresenta il potenziale osteogenico dei bMSCs. Le gocce di grasso (asterisco, forma irregolare di una gocciolina lipidica) vengono automaticamente formate quando i bMSC di topi OVX vengono coltivati per 7 giorni ( Figura 2A , pannello a sinistra). Nei topi trattati con EXD si formano noduli ossee (freccia) invece di una goccia di grasso ( figura 2B , pannello destro). Un test di alcalina fosfatasi (ALP) dimostra che più cellule ALP-positive (viola) possono essere rilevate nei bMSC trattati con EXD ( Figura 2B , pannello destro) rispetto a quelli in bMSC da topi OVX di controllo ( figura 2B , pannello a sinistra).
Le modifiche nell'espressione genica tra topi OVX e EXDs = "xref"> 24
La clusterizzazione gerarchica mostra che l'espressione di 389 geni rivelati da microarray in bMSC è stata modificata in modo piegato (> 1,5, normalizzato da topi non OVX) tra topi trattati con OVX e EXD in vivo (totale: 26.991 geni) ( Figura 3 ). Verde indica che l'espressione è stata regolata, mentre il colore rosso indica che l'espressione è stata ridotta. Tre campioni nello stesso gruppo vengono raggruppati in primo luogo, indicando le qualità affidabili del profilo. La Figura 4 mostra il percorso di segnalazione sovrapposto destinato a EXD, sia in vivo che in vitro .

Figura 1: L'effetto di EXD sulla morfologia ossea.
( A ) la colorazione H & E della 4 ° sezione lombare di topi trattati con OVX e EXD. ( B) immagini ricostruttive tridimensionali μCT dell'osso trabecolare 4 lombare in controllo OVX e topi trattati con EXD. ( C ) Quantificazione di μCT. BV: volume osseo, TV: volume tissutale, Tb.N: numero trabecolare, Tb.Th: spessore trabecolare e Tb.Sp: spaziatura trabecolare. Le colonne rappresentano i mezzi ± SE. N = 6 per gruppo. * P <0,05, ** p <0,01 EXD rispetto a OVX (t-test dell'allievo). ( AC ) sono stati modificati da Shufen Liu et al. 24. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2: L'effetto di EXD sulla differenziazione bMSC.
( A ) Immagini di bMSC coltivate per 7 giorni dopo beiNg isolato dal femore di topi trattati con OVX o EXD. * Indica una goccia di grasso. Una freccia indica un nodulo osseo. ( B ) colorazione ALP di BMSC trattati con OVX e EXD coltivati per 7 giorni (viola rappresenta ALP positivo). ( C ) Quantificazione di ( B ). Le colonne rappresentano i mezzi ± SE da tre piatti (sei topi) per gruppo. ** p <0.01 EXD rispetto a OVX (t-test dell'allievo). ( AC ) sono stati modificati da Shufen Liu et al. 24. Clicca qui per visualizzare una versione più grande di questa figura.
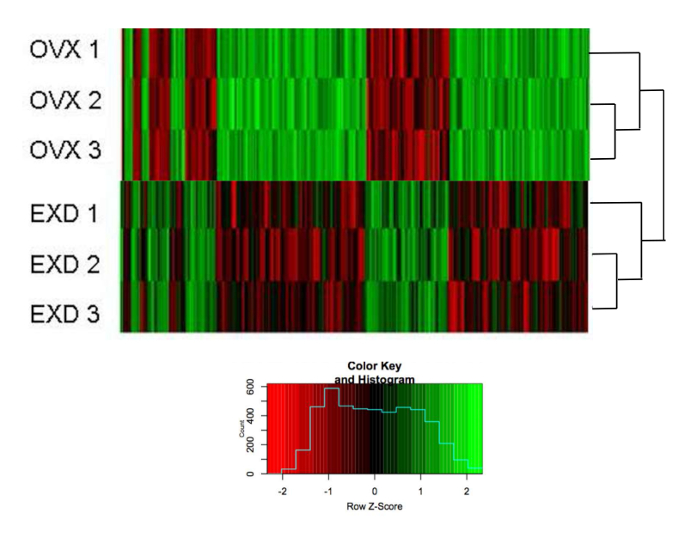
Figura 3: L'effetto di EXD sul profilo di espressione genica.
Calore del clustering gerarchico dell'espressione di 389 geni in OMS e EXMS bMSCs Raccolti nel 7 ° giorno post-dissociazione. La scala (piccola immagine) indica le modifiche piegate normalizzate da bMSC non OVX. L'elenco dei geni è fornito nel Supplementare File 1 . La figura è stata modificata da Shufen Liu et al. 24. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 4: L'effetto di EXD sul percorso di segnalazione sovrapposta in esperimenti in vivo e in vitro .
I primi 10 percorsi di segnalazione sovrapposti che sono invertiti da EXD in vivo e nel siero contenente EXD in vitro in base al percorso KEGG. I geni relativi ai percorsi sono mostrati nel Supplementare File 2 ./files/ftp_upload/55654/55654fig4large.jpg "target =" _ blank "> Fare clic qui per visualizzare una versione più grande di questa figura.
| Specie | Topo | Ratto | porcellino d'India | coniglio | Gatto | Scimmia | Cane | Umano |
| R | 59 | 90 | 99 | 93 | 82 | 111 | 104 | 100 |
Tabella 1: fattore R in diverse specie.
Il fattore R in 8 specie che sono comunemente usati nella ricerca farmacologica. Il fattore R è proporzionale a: (superficie del corpo (m 2 ) / bPeso ody (kg)) 2/3 .
File aggiuntivo 1.
Informazioni su 389 geni sovraordinati o downregulated ≥1,5 volte ma sono salvati da EXD in vivo . Clicca qui per scaricare questo file.
File aggiuntivo 2.
Informazioni sul percorso di segnalazione (basato sul percorso KEGG) e sui geni correlati in entrambi gli esperimenti in vivo e in vitro . Clicca qui per scaricare questo file.
Discussione
Negli ultimi anni, più attenzione è stata prestata alle medicine a base di erbe, un tipo di medicina alternativa che è stato applicato nel contesto clinico nel mondo orientale per migliaia di anni. Diverso dal modello "banco a letto" della medicina moderna, la medicina tradizionale a base di erbe richiede innanzitutto il modello "letto a panca" per spiegare i propri meccanismi. Ciò può essere seguito dalla convalida eseguita in fase di panificazione e di elaborazione per lo sviluppo di nuovi farmaci ottimizzati. Finora, esistono diversi metodi di estrazione che sono stati riportati ai componenti attivi di rilascio da formule intere o erbe. Tra questi, l'estrazione dell'acqua è la più ampiamente utilizzata.
L'estrazione dell'acqua delle medicine a base di erbe ha quattro fasi fondamentali. Il primo passo è immersione. Una medicina vegetale complessa viene macerata in acqua per un periodo di tempo, di solito da 0,5 a 1 h. L'intervallo di tempo per l'ammollo dipende dalla quantità e dalla proprietà delle erbe crude. AAssicurarsi che le erbe grezze siano accuratamente bagnate, il centro di ogni pezzo o blocco dovrebbe essere ripiegato. Il volume dell'acqua dipende dal volume totale delle erbe. A volte, il peso delle erbe viene utilizzato per determinare quanta acqua è necessaria per l'ammollo. Tuttavia, le densità di erbe variano notevolmente. Poiché lo scopo dell'assorbimento è quello di macerare tutte le erbe, facilitando il rilascio dei componenti attivi durante le seguenti fasi, il volume delle erbe è preferito per essere utilizzato come riferimento di riferimento per il volume d'acqua. Il secondo passo è la cottura. I processi di ebollizione e di raffreddamento sono stati sviluppati per migliaia di anni. La variazione del tempo di cottura dipende soprattutto dal tipo di erbe a causa delle diverse caratteristiche fisiche, chimiche e farmacologiche 12 . Le diaforetiche si suggeriscono di cucinare per un breve periodo di tempo, di solito meno di 20 minuti, mentre gli aromi vanno aggiunti solo pochi minuti prima della prima bollitura per evitare reazioni volatili. FO erbe toniche, è necessario un lungo periodo di tempo per eliminare i loro componenti terapeutici. In questo caso, EXD è usato per il trattamento dell'osteoporosi postmenopausale nei decenni 12 . Nella teoria della medicina tradizionale cinese, questa sindrome è considerata causata da un deficit renale. L'EXD è principalmente progettato per tonificare il rene. Pertanto, l'EXD è stato cotto per 2 - 3 h per consentire all'ESD di esercitare gli effetti anti-osteoporotici 15 . Il terzo passo è la filtrazione. La filtrazione aiuta a prevenire l'intasamento degli aghi del gavage con i granuli a base di erbe. Il quarto passo è la concentrazione. Il volume della somministrazione di gavage dovrebbe essere considerato attentamente. È stato segnalato che grandi volumi, ad esempio 10 mL / kg o più, somministrati per somministrazione orale possono provocare diversi problemi legati all'assorbimento, tra cui la rapida scorrimento dei composti alla duodenum o alla polmonite di aspirazione associata al reflusso passivo del materiaL nell'esofago 25 . Così, i volumi scelti per i topi e topi erano rispettivamente circa 7,5 ml / kg e 5,5 ml / kg.
È importante confermare se i componenti efficaci del digestato e del metabolismo EXD nel sangue sono simili a quelli dell'estratto crudo. In termini di bioequivalenza EXD, Wu et al. Ha riportato la determinazione di 7 componenti nel plasma del cane: epimedina A, epimedina B, epimedina C, icariina, sagittatoside B, 2 "-O-rhamnosyl icariside II e baohuoside I 26 . Hu et al. Ha trovato 21 composti nel plasma del topo dopo somministrazione orale 27 . Finora, l'estratto crudo da EXD non è stato segnalato. Tuttavia, alcuni dei componenti efficaci testati nel sangue, come l'icariina e la berberina, sono stati direttamente applicati agli animali per l'osservazione comparativa 28 .
Ci sono diversi approcci per calcolare il bioe animaleDose quivalente. Il metodo tradizionale basato sul peso corporeo (mg / kg) non è appropriato perché la farmacocinetica varia in diverse specie. Il calcolo basato sulla superficie corporea (mg / m 2 ), in cui il tasso metabolico è correlato alla dimensione dell'animale individuale, viene spesso utilizzato 29 . L'equazione applicata qui tiene conto sia della superficie del corpo che del peso corporeo ed è comunemente utilizzata nella medicina cinese tradizionale 30 .
Molti tipi di animali, come conigli, cavie, ratti e topi, possono essere scelti per la preparazione del siero contenente farmaci. È preferibile la stessa specie di quella delle cellule in vitro trattate. In questo studio, i ratti sono stati scelti perché forniscono più siero rispetto ai topi e sono più vicini ai topi in termini di specie rispetto ad altri animali. Inoltre, è raccomandato l'equivalente della dose in uso in vivo o in clinica, come dimostrato dal protocollo in vitro . Il dilutoIone di siero (1:10 è raccomandato) non è preso in considerazione; Cioè 10 volte la dose equivalente non viene applicata agli animali provenienti dal siero a causa della reazione tossica potenziale causata da cellule o organi trattati 31 . La frequenza di somministrazione di farmaci varia da una volta al giorno per 3-14 giorni a due volte al giorno (2 ore tra ogni somministrazione) 7 , 8 , 32 . Il tempo di raccolta di solito si verifica tra le ore 1 e 2 (prima dell'ora 6) dopo l'ultima amministrazione 33 , 34 . L'obiettivo è mantenere la concentrazione del farmaco nel sangue relativamente stabile e al suo livello di picco quando i campioni sono raccolti 35 . Le routine di somministrazione possono includere iniezione, somministrazione della pelle o inalazione, in accordo con le routine di somministrazione in vivo .
L'inattivazione del farmaco-Contenente siero è ancora controverso. I sostenitori ritengono che la presenza di molti componenti attivi, come gli ormoni, gli enzimi, gli anticorpi e gli integratori nel siero stesso, possono determinare reazioni inattese che influenzino i risultati 36 . L'opposizione ritiene che anche i componenti attivi prodotti dalle droghe possano essere rimossi dal processo di inattivazione 37 . Per equilibrare, la gente progetta il gruppo di controllo in modo tale che si utilizzi il siero da animali trattati con soluzione salina.
Ci sono alcune limitazioni al protocollo. La qualità dell'estratto non viene valutata prima di iniziare in vivo e sperimentare in vitro . In secondo luogo, gli antibiotici vengono usati nel terreno di coltura, che possono causare interazioni di erbe e richiedono ulteriori test. In terzo luogo, il tempo di immersione e di raffreddamento sono determinati sulla base dell'esperienza acquisita dalla pratica clinica e dalla sperimentazione animale. È possibile scegliere più periodi di tempo fO il confronto. I tempi di ammollo e di raffreddamento possono essere modificati per diverse formule a base di erbe. Il volume di decozione per l'amministrazione animale può essere modificato in base alla specie, all'età e al peso dell'animale. L'animale scelto per la preparazione di siero contenente farmaci e per le routine di somministrazione può essere modificato, come discusso in precedenza.
Considerati insieme, il protocollo ei risultati forniscono un esempio per la preparazione e l'applicazione della decozione a base di erbe in studi in vivo e in vitro . In diversi casi, alcuni dei dettagli devono essere ottimizzati, compresi i periodi di trattamento, le specie e le routine di somministrazione, in base alle caratteristiche a base di erbe.
Divulgazioni
Gli autori dichiarano di non avere interessi finanziari concorrenti.
Riconoscimenti
Questo lavoro è stato sostenuto dalla National Science Foundation della Cina (81573992). Ringraziamo Emily K. Lo e Kathleen DiNapoli per la loro assistenza per la modifica del linguaggio.
Materiali
| Name | Company | Catalog Number | Comments |
| Curculigo orchioides Gaertn (9 g), Herbaa Epimedii (9 g), Radix Morindae Officinalis (9 g), Radix Angelicae Sinensis (9 g), Cortex Phellodendri (6 g), and Rhizoma Anemarrhenae (6 g) | Kang-qiao Chinese Medicine Yinpian Co. Ltd (Shanghai, CN) | 160922 | EXD components |
| Filter paper | GElifesciences | 99-103-952 | Filter EXD decoction before concentration |
| Imprinting Control Region (ICR) mice | Shanghai Laboratory Animal Center | SCXK 2007-0005 | In vivo study |
| Sprague Dawley rats | Shanghai Laboratory Animal Center | SCXK 2007-0005 | EXD-containing serum preparation |
| Syringe filter | Millipore | SLGP033RB | 0.22 µm |
| gavage needles (10 ml) | Shanghai BO Ge trade sales department | 59104274 | Adminstration of EXD |
| Ketamine (80 mg/kg) | Fujian Gutian Pharma Co. Ltd | H35020148 | Anesthesia |
| Xylazine (10 mg/kg) | Sunway Pharma Co. Ltd | CB07591 | Anesthesia |
| Dulbecco’s modification of Eagle’s medium Dulbecco (DMEM) culture medium | Gibco | 12800-116 | DMEM with 2 mM L-glutamine and without ribonucleosides and ribonucleotides |
| Streptomycin | Sigma | 1277 | 100 µg / ml |
| Penicillin | Sigma | 4687 | 100 µg / ml |
Riferimenti
- Zhang, L. G., Ouyang, X. W., Wu, T. T., Ni, L. J., Shi, W. Z. Quantitative evaluation of in vitro effects and interactions of active fractions in a Chinese medicinal formula (Yaotongning Capsule) on rat chondrocytes. J Ethnopharmacol. 155 (3), 1424-1432 (2014).
- Ogawa, Y., Fujii, Y., Sugiyama, R., Konishi, T. The role of the seven crude drug components in the sleep-promoting effect of Yokukansan. J Ethnopharmacol. 177, 19-27 (2016).
- Kim, J. H., Doh, E. J., Lee, G. Evaluation of Medicinal Categorization of Atractylodes japonica Koidz. by Using Internal Transcribed Spacer Sequencing Analysis and HPLC Fingerprinting Combined with Statistical Tools. Evid Based Complement Alternat Med. 2016, 2926819 (2016).
- Sheridan, H., et al. The potential of metabolic fingerprinting as a tool for the modernisation of TCM preparations. J Ethnopharmacol. 140 (3), 482-491 (2012).
- Planas, G. M., Kucacute, J. Contraceptive Properties of Stevia rebaudiana. Science. 162 (3857), 1007 (1968).
- Tashino, S. "Serum pharmacology" and "serum pharmaceutical chemistry": from pharmacology of Chinese traditional medicines to start a new measurement of drug concentration in blood. Ther Drug Monit Res. 5, 54-64 (1988).
- Cao, Y., Liu, F., Huang, Z., Zhang, Y. Protective effects of Guanxin Shutong capsule drug-containing serum on tumor necrosis factor-alpha-induced endothelial dysfunction through nicotinamide adenine dinucleotide phosphate oxidase and the nitric oxide pathway. Exp Ther Med. 8 (3), 998-1004 (2014).
- Fu, L., et al. Ex Vivo Stromal Cell-Derived Factor 1-Mediated Differentiation of Mouse Bone Marrow Mesenchymal Stem Cells into Hepatocytes Is Enhanced by Chinese Medicine Yiguanjian Drug-Containing Serum. Evid Based Complement Alternat Med. 2016, 7380439 (2016).
- Chen, X., et al. Application of serum pharmacology in evaluating the antitumor effect of Fuzheng Yiliu Decoction from Chinese Medicine. Chin J Integr Med. 20 (6), 450-455 (2014).
- Sze, S. C., et al. A novel mechanism: Erxian Decoction, a Chinese medicine formula, for relieving menopausal syndrome. J Ethnopharmacol. 123 (1), 27-33 (2009).
- Sze, S. C., et al. Effects of Erxian decoction, a Chinese medicinal formulation, on serum lipid profile in a rat model of menopause. Chin Med. 6, 40 (2011).
- Zhong, L. L., et al. A randomized, double-blind, controlled trial of a Chinese herbal formula (Er-Xian decoction) for menopausal symptoms in Hong Kong perimenopausal women. Menopause. 20 (7), 767-776 (2013).
- Wang, S. W., et al. Steroidogenic effect of Erxian decoction for relieving menopause via the p-Akt/PKB pathway in vitro and in vivo. J Ethnopharmacol. , (2016).
- Lin, L., Wu, S., Tang, J. [Clinical observation and experimental study of the treatment of aplastic anemia by warming and tonifying the spleen and kidney]. Zhong Xi Yi Jie He Za Zhi. 10 (5), 272-274 (1990).
- Nian, H., et al. Antiosteoporotic activity of Er-Xian Decoction, a traditional Chinese herbal formula, in ovariectomized rats. J Ethnopharmacol. 108 (1), 96-102 (2006).
- Qin, L., et al. Antiosteoporotic chemical constituents from Er-Xian Decoction, a traditional Chinese herbal formula. J Ethnopharmacol. 118 (2), 271-279 (2008).
- Xue, L., et al. A HNMR-based metabonomics study of postmenopausal osteoporosis and intervention effects of Er-Xian Decoction in ovariectomized rats. Int J Mol Sci. 12 (11), 7635-7651 (2011).
- Lu, X. N., Xu, X. R., Lin, L. J. [Clinical observation of bushen er'xian decoction in treating premature ovarian failure]. Zhongguo Zhong Xi Yi Jie He Za Zhi. 28 (7), 594-596 (2008).
- Yu, X., et al. Anti-angiogenic activity of Erxian Decoction, a traditional Chinese herbal formula, in zebrafish. Biol Pharm Bull. 35 (12), 2119-2127 (2012).
- Chu, E. S., et al. An in vitro and in vivo investigation of the antimetastatic effects of a Chinese medicinal decoction, erxian decoction, on human ovarian cancer models. Integr Cancer Ther. 12 (4), 336-346 (2013).
- Zhu, Z., Li, L., Jin, X., Fang, J., Zhang, D. Er-Xian Decoction, a traditional Chinese herbal formula, intervening early in hypothalamic-pituitary axis of male rats with delayed puberty. Pharmacogn Mag. 10 (40), 517-521 (2014).
- Miao, M. S. . Experimental animals and technology. 1997, 145 (1997).
- Soleimani, M., Nadri, S. A protocol for isolation and culture of mesenchymal stem cells from mouse bone marrow. Nat Protoc. 4 (1), 102-106 (2009).
- Lu, S., Huang, J., Wang, J., et al. Er-Xian Decoction Stimulates Osteoblastic Differentiation of Bone Mesenchymal Stem Cells in Ovariectomized Mice and Its Gene Profile Analysis. Stem Cells International. 2016, 4079210 (2016).
- Turner, P. V., Brabb, T., Pekow, C., Vasbinder, M. A. Administration of substances to laboratory animals: routes of administration and factors to consider. J Am Assoc Lab Anim Sci. 50 (5), 600-613 (2011).
- Wu, C., et al. Simultaneous determination of seven flavonoids in dog plasma by ultra-performance liquid chromatography-tandem mass spectrometry and its application to a bioequivalence study of bioactive components in Herba Epimedii and Er-Xian Decoction. J Pharm Biomed Anal. 54 (1), 186-191 (2011).
- Hu, Y. M., et al. Identification of the major chemical constituents and their metabolites in rat plasma and various organs after oral administration of effective Erxian Decoction (EXD) fraction by liquid chromatography-mass spectrometry. Biomed Chromatogr. 24 (5), 479-489 (2010).
- Xue, L., et al. Effects and interaction of icariin, curculigoside, and berberine in er-xian decoction, a traditional chinese medicinal formula, on osteoclastic bone resorption. Evid Based Complement Alternat Med. , (2012).
- Nair, A. B., Jacob, S. A simple practice guide for dose conversion between animals and human. J Basic Clin Pharm. 7 (2), 27-31 (2016).
- Xu, X., et al. Protective effect of the traditional Chinese medicine xuesaitong on intestinal ischemia-reperfusion injury in rats. Int J Clin Exp Med. 8 (2), 1768-1779 (2015).
- Li, Z., Wang, J. On the methods for Chinese herbs serum pharmcology. Zhong Guo Zhong Yi Yao Xing Xi Za Zhi. 9 (2), 5-6 (2002).
- Jiang, Y. R., et al. Effect of chinese herbal drug-containing serum for activating-blood and dispelling-toxin on ox-LDL-induced inflammatory factors' expression in endothelial cells. Chin J Integr Med. 18 (1), 30-33 (2012).
- Guo, C. Y., Ma, X. J., Liu, Q., Yin, H. J., Shi, D. Z. [Effect of Chinese herbal drug-containing serum for activating blood, activating blood and dispelling toxin on TNF-alpha-induced adherence between endothelial cells and neutrophils and the expression of MAPK pathway]. Zhongguo Zhong Xi Yi Jie He Za Zhi. 35 (2), 204-209 (2015).
- Li, Y., Xia, J. Y., Chen, W., Deng, C. L. Effects of Ling Qi Juan Gan capsule drug-containing serum on PDGF-induced proliferation and JAK/STAT signaling of HSC-T6 cells]. Zhonghua Gan Zang Bing Za Zhi. 21 (9), 663-667 (2013).
- Li, Y. K. [Some issues in methology of Chinese herbs serum pharmcology]. Zhong Yao Xin Yao Yu Lin Chuang Yao Li. 10 (5), 263 (1999).
- Zhang, L., et al. [A review of Chinese herbs serum pharmcology methodological study]. Nan Jing Zhong Yi Yao Da Xue Xue Bao. 18 (4), 254 (2002).
- Zhang, D. [Issues and strategies for study of serum pharmcology in oncology]. Zhong Yi Yan Jiu. 17 (5), 13-14 (2004).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon