Method Article
Um Modelo de Ferimento de Placa de Crescimento Tibial de Rato para Caracterizar Mecanismos de Reparação e Avaliar Estratégias de Regeneração de Placas de Crescimento
Neste Artigo
Resumo
A placa de crescimento é uma região cartilaginosa em ossos longos das crianças, onde ocorre crescimento longitudinal. Quando feridos, o tecido ósseo pode formar e prejudicar o crescimento. Descrevemos um modelo de rato de lesão de placa de crescimento que leva ao tecido de reparo ósseo, permitindo o estudo de mecanismos de reparação e estratégias de regeneração de placas de crescimento.
Resumo
Um terço de todas as fraturas pediátricas envolvem a placa de crescimento e podem resultar em comprometimento do crescimento ósseo. A placa de crescimento (ou fisica) é o tecido da cartilagem encontrado no final de todos os ossos longos em crianças que é responsável pelo crescimento ósseo longitudinal. Uma vez danificado, o tecido da cartilagem dentro da placa de crescimento pode sofrer ossificação prematura e levar ao tecido de reparo ósseo indesejado, que forma uma "barra óssea". Em alguns casos, esta barra óssea pode resultar em deformidades do crescimento ósseo, como deformidades angulares, ou pode interromper completamente o crescimento ósseo longitudinal. Atualmente, não há tratamento clínico que possa consertar completamente uma placa de crescimento lesionada. O uso de um modelo animal de lesão de placa de crescimento para entender melhor os mecanismos subjacentes à formação de barras ósseas e identificar maneiras de inibi-lo é uma ótima oportunidade para desenvolver melhores tratamentos para lesões de placas de crescimento. Este protocolo descreve como perturbar a placa de crescimento tibial proximal do rato usando um defeito do furo de perfuração. Essa smaO modelo animal produz de forma confiável uma barra óssea e pode resultar em deformidades de crescimento semelhantes às observadas em crianças. Este modelo permite a investigação dos mecanismos moleculares da formação de barras ósseas e serve como um meio para testar possíveis opções de tratamento para lesões de placas de crescimento.
Introdução
As lesões da placa de crescimento representam 30% de todas as fraturas pediátricas e podem resultar em comprometimento do crescimento ósseo 1 . Além das fraturas, as lesões na placa de crescimento podem ser causadas por outras etiologias, incluindo osteomielite 2 , tumores ósseos primários 3 , radiação e quimioterapia 4 e danos iatrogênicos 5 . A placa de crescimento (ou physis) é uma região de cartilagem no final dos ossos longos das crianças que é responsável pelo crescimento ósseo longitudinal. Ele dirige o alongamento ósseo através da ossificação endochondral; Os condrócitos sofrem proliferação e hipertrofia e são então remodelados por osteoblastos recebidos para formar osso trabecular 6 . A placa de crescimento também é uma área fraca do esqueleto em desenvolvimento, tornando-se propenso a ferimentos. A principal preocupação com as fraturas ou lesões de placas de crescimento é que o tecido de cartilagem danificado dentro da placa de crescimento pode serE substituído por tecido de reparo ósseo indesejado, também conhecido como "barra óssea". Dependendo do seu tamanho e localização dentro da placa de crescimento, a barra óssea pode levar a deformidades angulares ou prisão de crescimento completa, uma seqüela devastadora para crianças pequenas que ainda não atingiram a altura total 7 .
Atualmente, não há tratamento que possa consertar completamente uma placa de crescimento lesionada. Uma vez que a barra óssea se forma, o clínico deve decidir se remove ou não cirurgicamente 8 . Pacientes com pelo menos 2 anos ou 2 cm de crescimento esquelético restante e com uma barra óssea que abrange menos de 50% da área da placa de crescimento são geralmente candidatos à ressecção de barra óssea 8 . A remoção cirúrgica da barra óssea é freqüentemente seguida pela interposição de um enxerto de gordura autóloga para evitar a reforma do tecido ósseo e para permitir que a placa de crescimento não ferida circundante restaure o crescimento. No entanto, essas técnicas são problemáticas.Ematic e muitas vezes falham, levando à recorrência da barra óssea e ao contínuo efeito negativo sobre o crescimento 9 . Existe uma necessidade crítica de desenvolver tratamentos eficazes que não apenas evitam a formação de barras ósseas, mas também regeneram a cartilagem da placa de crescimento, restaurando o alongamento ósseo normal.
Os mecanismos moleculares que subjazem a formação da barra óssea ainda não foram completamente esclarecidos. Uma maior compreensão desses mecanismos biológicos pode levar a intervenções terapêuticas mais eficazes para crianças que sofrem de lesões de placas de crescimento. Uma vez que o estudo desses mecanismos em seres humanos é difícil, utilizaram-se modelos animais, especialmente o modelo de ratos de lesão de placa de crescimento 10 , 11 , 12 , 13 , 14 , 15 , 16 . O método apresentado nesteO papel descreve como um defeito no orifício de perfuração na placa de crescimento tibial do rato leva a um tecido de reparo previsível e reproduzível que começa a ossificação logo que 7 dias após a lesão e forma uma barra óssea totalmente madura com remodelação aos 28 dias após a lesão 10 . Isto proporciona um modelo animal pequeno in vivo no qual estudar os mecanismos biológicos da formação de barras ósseas, bem como avaliar novas terapias que possam impedir a barra óssea e / ou regenerar a cartilagem da placa de crescimento. Por exemplo, este modelo pode ser usado para testar biomateriais condrogênicos que podem regenerar a cartilagem de placas de crescimento e oferecer tratamento valioso para crianças que sofrem de lesões de placas de crescimento. As técnicas apresentadas neste artigo descreverão os métodos cirúrgicos utilizados para produzir a lesão da placa de crescimento e a subsequente entrega de biomateriais no local da lesão. Também discutiremos métodos para avaliar a formação de barras ósseas e reparar tecidos.
Protocolo
Todos os procedimentos animais devem ser aprovados pelo Comitê Institucional de Cuidados e Uso Animal (IACUC). O protocolo animal para o seguinte procedimento foi aprovado pela Universidade de Colorado Denver IACUC.
1. Obter ratos
NOTA: A menos que desejem animais geneticamente modificados, são necessários ratos de Sprague-Dawley imaturamente esqueletais de 6 semanas no momento da cirurgia. Podem ser utilizadas outras cepas; No entanto, a maioria dos estudos publicados foram realizados em ratos Sprague-Dawley.
2. Preparação de suprimentos cirúrgicos
- Autoclave pacotes de suprimentos cirúrgicos que incluem um dos seguintes: # 3 alça do bisturí, suporte da agulha, Adson fórceps e tiras de íris.
- Autoclave os mandris de perfuração sem chave. Os mandris de broca podem ser esterilizados em perolas entre cirurgias de animais quando operam em múltiplos animais.
NOTA: Regras locais de IACUC relativas ao uso de cirurgiões estérilAs ferramentas científicas em múltiplos animais devem ser respeitadas. Por exemplo, a Universidade de Colorado Denver IACUC permite que um conjunto de ferramentas cirúrgicas seja usado em até 5 animais antes da descontinuação. Além disso, as ferramentas cirúrgicas devem ser esterilizadas por calor usando um esterilizador de contas entre animais. Serão utilizados pacotes cirúrgicos esterilizados adicionais para qualquer animal adicional. - Autoclave pinos Steinmann de 5 cm, um para cada animal.
NOTA: Para reduzir o risco de infecção, os pinos Steinmann não devem ser utilizados para múltiplos animais. - Autoclave feijões dentais de 1,8 mm, um para cada animal.
NOTA: Para reduzir o risco de infecção, as fresas dentárias não devem ser usadas para múltiplos animais. - Autoclave um aplicador de grampo de ferida, se aplicável. Alternativamente, suturas enterradas podem ser usadas para fechar a camada cutânea. Veja o passo 7.3.
- Se possível, esterilize uma broca rotativa usando irradiação ou esterilização de gás.
- Coletar os seguintes suprimentos adicionais: máquina de barbear elétrica, steSuturas de ácido poliglicólico de rile 3-0, gaze estéril, povidona-iodo, solução salina estéril, seringas esterilizadas de 10 mL, agulhas esterilizadas de calibre 23, cotonete de álcool isopropílico, isoflurano, calibres, analgésicos pós-cirúrgicos ( por exemplo, AINEs e buprenorfina), Cortinas cirúrgicas estéreis, luvas cirúrgicas estéreis, lâminas de bisturi estéril # 15, clipes de ferida estéril, máquina de anestesia, esterilizador de contas, almofada de aquecimento e capas inferiores absorventes.
3. Anestesia e preparação de animais
- Anestesiar o animal, introduzindo-o numa câmara de indução de 1 a 2 L recebendo fluxo de oxigênio de 1 L / min com 5% de isoflurano a partir de um sistema de vaporização com um sistema de eliminação passiva.
NOTA: A exposição a 5% de isoflurano deve anestesiar ratos de 6 semanas de idade dentro de 5 min. - Mova o animal para o local cirúrgico e mantenha o animal sob anestesia com 2 a 3% de isoflurano usando um cone do nariz para o restante do procedimento. Coloque o animal em decúbito dorsal em uma almofada de aquecimento e absorvaUnderpad secundário.
NOTA: O animal não precisa ser fixado na mesa cirúrgica. Segurar a perna como especificado nas etapas abaixo é um método de estabilização suficiente.
NOTA: Todos os procedimentos subseqüentes devem ser feitos com o animal sob anestesia. 2 - 3% de isoflurano deve ser suficiente para manter a anestesia em ratos a esta idade. Isso pode ser confirmado testando o reflexo de retirada bípede. - Administrar analgésicos intra-operatórios de acordo com as políticas aprovadas pela instituição ( por exemplo, buprenorfina a 0,05 mg / kg e carprofeno a 5 mg / kg).
4. Preparação do Tibia para Cirurgia
- Raspe a (s) perna (s) traseira (s) do maléolo medial para a pélvis com uma máquina de barbear elétrica.
- Medir e registrar o comprimento tibial do platô tibial anterior para o lado inferior do maléolo medial usando compassos de calibre. Alternativamente, mede todo o comprimento da tíbia usando o raio X ou o microCT 11 Sup> , 12 , 14 . Opcionalmente, mede as dimensões da placa de crescimento antes da cirurgia usando raios-X ou microcT.
- Limpe o local cirúrgico limpando a perna inteira, o abdômen e os órgãos genitais com cotonete com álcool e, em seguida, com gaze com povidona e iodo.
NOTA: Para minimizar o risco de infecção, todos os procedimentos subseqüentes, até o animal ser removido da anestesia (passo 7.4), devem ser feitos sob condições estéreis. Todos os materiais cirúrgicos devem ser acessados usando técnica estéril. O uso de um assistente cirúrgico é altamente recomendado para manter a esterilidade durante toda a cirurgia. - Usando luvas cirúrgicas estéril, coloque uma cobertura cirúrgica estéril fenestrado sobre o animal, deixando a perna exposta através da fenestração central.
5. Procedimento cirúrgico para acessar a placa de crescimento
_upload / 55571 / 55571fig1.jpg "/>
Figura 1: Visão geral do procedimento cirúrgico.
A) Localização de vários marcadores anatômicos usados para criar uma lesão bem sucedida na placa de crescimento. A cápsula do joelho é imediatamente posterior à rótula (branca), separando a tíbia do fêmur. A placa de crescimento tibial (vermelho escuro) pode ser vista inferior à rótula e contornar a tíbia. A placa de crescimento proximal é um plano principalmente plano, exceto para o quarto anterior que forma um plano diagonal. A interseção destes dois planos forma o ângulo da placa de crescimento, que é usado para a angulação de perfuração apropriada. A inserção semitendinosa é a inserção do músculo quadríceps na parte posterior da tíbia. B) Incisão através do aspecto anterior-medial dos tecidos moles tibiais para acessar o osso cortical. C) Localização da janela cortical usando o alinhamento com a inserção distal semitendinoso como ponto de referência. D) AvaliandoA profundidade da lesão alinhando o chanfro na broca dental com a janela cortical.
- Faça uma incisão de ~ 1 cm através da pele ao longo do aspecto medial anterior da tíbia proximal usando uma alça de bisturi # 3 e uma lâmina # 15, começando na extremidade distal do côndilo femoral medial ( Figura 1A ).
- Puxe a pele contra o osso subjacente e segure firmemente a perna enquanto faz a incisão.
NOTA: Isso manterá a incisão da pele no local desejado e ajudará na criação de uma incisão limpa. Não pressione muito firmemente com o bisturi para evitar perfurar a cápsula do joelho, o que resultaria em hemorragia profusa e tornará os passos restantes difíceis.
- Puxe a pele contra o osso subjacente e segure firmemente a perna enquanto faz a incisão.
- Anote os marcadores anatômicos importantes, incluindo: 1) a placa de crescimento, 2) o ângulo da placa de crescimento, 3) a cápsula do joelho e 4) a inserção semitendinosa ( Figura 1A ).
- Usando o bisturi, faça uma incisão de ~ 0,5 cm através daE fascia e tecidos moles no aspecto medial-anterior da tíbia proximal, desde a placa de crescimento até o final da incisão cutânea ( Figura 1B ).
- Dispare ou raspe delicadamente a fáscia e os tecidos moles da tíbia usando o bisturi ( Figura 1B ).
NOTA: É importante remover ou raspar o menor tecido macio possível da tíbia para não interferir nas etapas de perfuração. - Perfure uma janela cortical através do osso cortical tibial na diáfise com um pino Steinmann ligado a uma ferramenta rotativa a 10.000 RPM (baixa velocidade da ferramenta rotativa especificada na seção de materiais). Crie a janela cortical de modo que alinhe com a inserção distal semitendinoso ( Figura 1C ).
- Segure a broca perpendicular à diáfise tibial e faça uma broca lentamente, com cuidado para não perfurar o outro lado da diáfise; A janela cortical precisa ser de apenas 2 mm de profundidade e será feita quando nãoA resistência é sentida.
- Como acima, segure firmemente a perna com a outra mão.
NOTA: Uma rotina dental pode ser usada para esta etapa. No entanto, se uma broca dental for usada, a perna deve ser mantida com muita firmeza para fazer uma janela cortical limpa e garantir que a broca segure e corta o osso no local desejado. Um pino Steinmann é recomendado para este passo, dada a sua capacidade de corte muito superior.
- Dab a janela cortical com gaze, como um sangramento leve é esperado.
6. Criando a ferida da placa de crescimento
- Crie uma ferida do furo através da placa de crescimento central usando uma fresa dental de 1,8 mm anexada a uma ferramenta rotativa.
NOTA: A profundidade, ângulo e direção adequados são críticos na interrupção da placa de crescimento central ( Figura 1C e D ). As instruções para atingir a profundidade, o ângulo e a direção adequados são indicadas a seguir.- Para medir a profundidade apropriada usando a broca dental, begiN alinhando o final da broca dental com a tíbia proximal, onde o semitendinoso cruza a cápsula do joelho ( Figura 1C ).
- Com o fim da fresta dental na cápsula do joelho, siga o eixo da roda ao longo do semitendinoso e tome nota de onde a borracha se alinha com a janela cortical. Esta é a profundidade apropriada para a bur para interromper completamente a placa de crescimento sem interromper a superfície articular ( Figura 1C ).
NOTA: A broca dental é usada para medir a profundidade apropriada. A marca pode ser marcada com um marcador permanente no local onde ele alinha com a janela cortical para fazer referência à profundidade durante a perfuração. No entanto, se os marcadores anatômicos e o protocolo acima são intimamente referenciados, o primeiro bisel nas brocas dentárias especificadas aqui (FG6) alinhará adequadamente com a janela cortical (como visto na Figura 1C ). - Para atingir o ângulo de perfuração apropriado, segure a ferramenta rotativa em um ângulo de menos tHan 30 ° em relação à diáfise tibial.
NOTA: Esta é uma aproximação visual. - Para atingir a direção adequada da broca, apontar para o ângulo da placa de crescimento ( Figura 1C ). Desenhe uma linha visual ao longo da broca dental para o ângulo da placa de crescimento para ajudar na criação de um defeito central.
- Ligue a ferramenta rotativa para 10 000 RPM (baixa velocidade da ferramenta rotativa especificada na seção de materiais) antes de entrar na janela cortical.
- Com a ferramenta rotativa em um ângulo e sentido apropriados, entre na janela cortical e empurre a ferramenta rotativa até que o marcador da fresta fique alinhado com a janela cortical. Uma vez que a profundidade adequada é alcançada, remova a ferramenta rotativa.
NOTA: Execute a interrupção da placa de crescimento em um movimento rápido, usando um tempo mínimo com a fresa na placa de crescimento para criar uma lesão limpa. Isso é importante para análise de dados.
- Dab a janela cortical com gaze para ~ 30 s, como o sangramento é esperado.
- Assegure a profundidade apropriada da lesão novamente medindo o comprimento da fresta (etapa 6.1.2).
- Insira a fresta na trilha de perfuração (com a ferramenta rotativa desligada) e alinhe a fresta marcada com a janela cortical ( Figura 1D ).
- Se a profundidade for inadequada, ligue a ferramenta rotativa e pressione a profundidade desejada.
NOTA: Embora uma segunda rodada de perfuração não seja ideal, a interrupção total da placa de crescimento é primordial para o desenvolvimento da barra óssea. - Enxaguar a broca com ~ 3 mL de solução salina estéril usando uma seringa de 10 mL e uma agulha de calibre 23.
- Secar a ferida com gaze.
7. Procedimentos pós-lesão
- Se estiver avaliando um tratamento com placa de crescimento com base em biomateriais, injete o biomaterial através da trilha de perfuração no local da lesão usando uma agulha de tamanho apropriado (calibre de 18 a 26, dependendo da viscosidade do biomaterial).
NOTA: O volume da lesão da placa de crescimento é ~ 3 & #181; L, eo volume da broca é de ~ 20 μL. O volume máximo de material que pode ser injetado na lesão da placa de crescimento e na trilha de perfuração é entre 20 e 25 μL. - Feche a ferida suturando a fáscia com suturas de ácido poliglicólico 3-0. Aplique cera óssea sobre a janela cortical para isolar o osso subjacente (opcional).
- Feche a incisão da pele com suturas enterradas ou clipes de ferida.
NOTA: Os clipes de feridas são recomendados, pois o animal irá arranhar o local de lesão e pode abrir a ferida. - Remova o animal da anestesia com isoflurano, coloque-o em um cobertor de aquecimento e monitore-o até que esteja acordado.
- Para reduzir o risco de infecção, coloque o animal em uma nova gaiola contendo roupa de cama seca e autoclavada.
- Permitir que o animal carregue peso pós-operatório.
- Monitore o animal a cada 12 h por 72 h após a cirurgia para verificar sinais de infecção, para garantir que os clipes da ferida permaneçam no lugar e para administrar o pós-operatórioE analgésicos de acordo com as políticas aprovadas pela instituição ( por exemplo, buprenorfina a 0,05 mg / kg a cada 12 h durante 36 h e carprofeno a 5 mg / kg a cada 24 h por 72 h).
- Remova os grampos da ferida 10 a 14 dias após a cirurgia sob anestesia.
Resultados
A lesão bem sucedida da placa de crescimento usando este método envolve a ruptura do centro da placa de crescimento tibial sem interromper a superfície da cartilagem articular. O tecido de reparo ósseo foi relatado para começar em aproximadamente 7 dias após a lesão e se torna totalmente desenvolvido por 28 dias após a lesão 13 , conforme visualizado pela microcopiografia computadorizada (micro CT) ( Figura 2 ). Embora esses pontos de tempo tenham sido escolhidos aqui para exibir o início e a maturação da formação óssea com base em dados publicados anteriormente, outros pontos de tempo podem ser usados para investigar as várias etapas do processo de reparo, do dia 1 a 6 meses após a cirurgia 17 . A Tabela 1 fornece uma visão geral da formação do volume ósseo em placas de crescimento de ratos cirurgicamente feridas 28 dias após a cirurgia de três corridas independentes, fornecendo (1) a fração do volume ósseo em toda a placa de crescimento e (2) a boFração de volume ne dentro da área de tecido de reparo apenas 15 . Os dados são relatados como a porcentagem média ± o desvio padrão e indicam que foram obtidos resultados similares entre as corridas independentes. A diferença entre as diferentes corridas foi analisada por uma análise de variância unidirecional (ANOVA) e não mostra diferença estatisticamente significativa entre as corridas, sugerindo a reprodutibilidade do modelo. A hematoxilina azul de Alcian (ABH) com Contterstain de Laranja G / Eosina 18 foi utilizada para mostrar histologicamente uma variedade de tecidos de reparação em diferentes estágios de formação de barra óssea ( Figura 2 ). Utilizando esta mancha histológica, diferentes tipos de tecido de reparação, incluindo mesentimais, cartilaginosas, trabéculas ósseas e medula óssea, podem ser identificados e quantificados 16 .
Vários problemas podem surgir de seguir incorretamente os procedimentos acima. Uma insuficiência A profundidade de perfuração nt não irá interromper a placa de crescimento, o que resultará em pouca ou nenhuma formação de barras ósseas. A ruptura da superfície da cartilagem articular cria uma lesão maior que pode introduzir a cartilagem articular no local da lesão da placa de crescimento, complicando o processo de cicatrização ( Figura 3A ). A interrupção da placa de crescimento em um ângulo ou direção inadequada resulta em lesão não central ( Figura 3B ). Neste caso, a formação da barra óssea ainda ocorrerá, embora seja lateral ou medial para a localização desejada. Em geral, o tecido de reparo formado após a lesão da placa de crescimento pode ser analisado de várias maneiras, incluindo microCT, PCR quantitativo, coloração histológica e imuno-histoquímica. Além das medidas histológicas e moleculares, o comprimento dos membros e as medidas da placa de crescimento fornecem uma medida importante do crescimento ósseo completo. Os membros afetados foram relatados como experimentando redução de crescimento em comparação com membros de controle não feridos> 13. O comprimento do membro pode ser medido em diferentes pontos de tempo ao longo do estudo usando imagens de microCT para investigar as discrepâncias do comprimento dos membros 14 . Exemplos de pontos de tempo anteriormente utilizados incluem 28 dias e 56 dias após a lesão. As medidas da placa de crescimento, incluindo a altura total, alturas zonais e formação de amarração, também podem fornecer informações importantes sobre o processo de reparo tecidual 13 , 14 , 15 . Idealmente, um deve levar os comprimentos dos membros e as medidas da placa de crescimento antes da cirurgia para ter um valor basal. Para elucidar ainda mais os mecanismos biológicos ou para testar a eficácia de um tratamento, os grupos de controle apropriados devem ser projetados e incluem membros e membros não afetados submetidos à cirurgia, mas não tratados.
Os biomateriais também podem ser testados neste modelo de lesão de placa de crescimento. Como exemplo, um chiO microgel 19 foi injetado no local de lesão da placa de crescimento, como descrito no passo 7.1, e é claramente visto no local da lesão na Figura 4 . A análise subsequente pode envolver a determinação dos efeitos do biomaterial na composição do tecido de reparação, comprimento do membro e medidas da placa de crescimento, conforme discutido anteriormente.
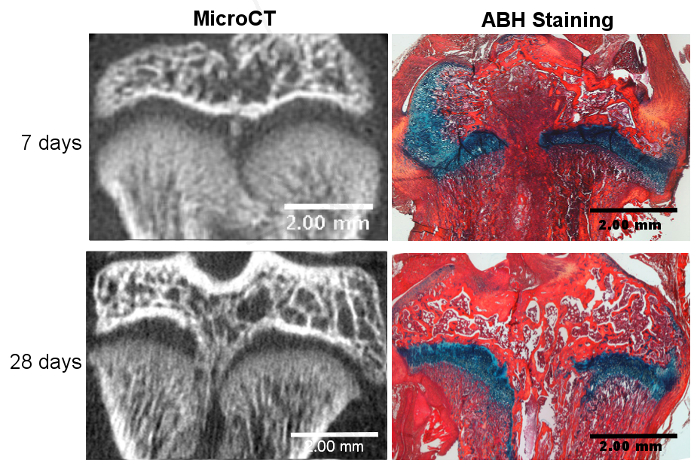
Figura 2. Perturbação bem sucedida da placa de crescimento e Formação Bony Bar.
A formação de barras ásperas é observada aos 7 dias pós-lesão com microCT e confirmada através da coloração com hematoxilina azul Alcian (ABH). A barra óssea está totalmente madura no dia 28 pós-lesão, como se observa com coloração com microCT e ABH. Clique aqui para ver uma versão maior dessa figura.
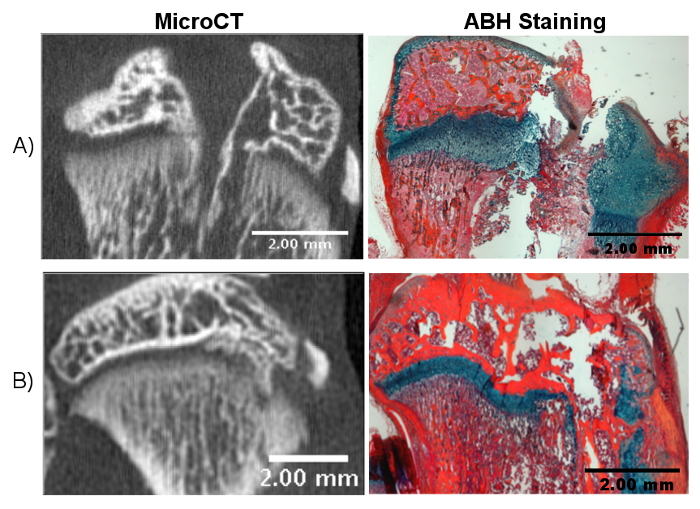
Figura 3. Resultados Potenciais de Perfuração Incorreta.
A) A perfuração muito distante através da tíbia pode perturbar a superfície articular, o que complica o processo de cicatrização e pode levar a resultados inconclusivos. B) A angulação incorreta da broca pode levar a uma lesão na placa de crescimento não central. Clique aqui para ver uma versão maior dessa figura.
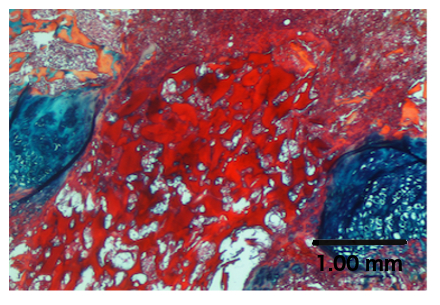
Figura 4. Tratamento de uma lesão em placa de crescimento com um biomaterial.
A coloração de ABH mostra o microgel de quitosana na placa de crescimento ferida.
| Métrica | Corrida 1 | Corrida 2 | Executar 3 | Valor P |
| Fração de volume ósseo em toda a placa de crescimento | 9,76 +/- 3,81% | 10,52 +/- 4,06% | 11,93 +/- 2,04% | 0,5493 |
| Fração de volume de osso dentro da área de tecido de reparo | 41,5 +/- 8,33% | 46,08 +/- 10,12% | 46,77 +/- 8,14% | 0,5128 |
Tabela 1. Dados de fração de volume ósseo.
Os dados eram de imagens de micro CT em 28 dias pós-lesão em ratos não tratados de três corridas independentes.
Discussão
Um modelo de animal de lesão de placa de crescimento aumenta muito a nossa compreensão dos mecanismos biológicos desta lesão, potencialmente levando a intervenções terapêuticas mais eficazes para crianças que sofrem de lesões de placas de crescimento. Para criar com sucesso uma barra óssea e estudar a sua formação in vivo usando o modelo apresentado neste trabalho, é fundamental interromper a placa de crescimento através da perfuração até uma profundidade suficiente, sem perturbar a cartilagem articular. A variação na implementação cirúrgica entre animais e, em menor grau, a variação nos marcadores anatômicos pode levar a resultados problemáticos. Recomendamos praticar os procedimentos descritos acima em animais cadavéricos para garantir danos bem sucedidos na placa de crescimento antes de realizar o procedimento para estudos em animais vivos. Enquanto os animais cadáveres não possuem flexibilidade do tecido e não sangram, o procedimento de lesão da placa de crescimento e as características anatômicas desses animais serão semelhantes aos dos animais vivos. FurtAlém disso, a placa de crescimento tibial cadavérico pode ser dissecada facilmente, pois a epífise se separa da metafise através da aplicação de força leve e a localização do furo pode ser observada. Esta análise rápida permite modificações técnicas para aprender a profundidade adequada da perfuração e angulação em animais cadavéricos, sem necessidade de imagem.
Deve notar-se que existem outros modelos animais de lesão de placa de crescimento. Um defeito transfisário semelhante foi realizado no mouse e levou à formação de barra óssea 20 . Apesar de seu tamanho menor, também pode ser usado para estudar os mecanismos envolvidos na formação de barras ósseas. Coleman et al . Relatou outro modelo de rato de crescimento de placa de crescimento válido, onde um defeito transfisário central foi criado no fêmur distal através da perfuração através da cartilagem articular 21 . Esta abordagem também levou à formação de uma barra óssea e distorções do comprimento do membro, como naModelo apresentado aqui. Outros modelos animais de lesão e tratamento da placa de crescimento incluíram coelhos 22 , porcos 23 e ovelhas 24 . Enquanto os modelos de lesões de animais maiores podem representar mais estreitamente lesões clínicas, o modelo de rato é útil para pesquisas sobre os mecanismos biológicos das lesões físicas. Por exemplo, o modelo de rato apresentado aqui tem sido amplamente utilizado para investigar os mecanismos moleculares de lesão física e o processo de formação da barra óssea 10 , 11 , 12 , 13 , 14 , 15 , 16 . Além disso, o modelo do rato pode ser usado para testar vários tratamentos physeal antes de se mudar para modelos animais maiores. No entanto, um desafio deste modelo de rato de lesão de placa de crescimento é que a perfuração é feita dentro do osso, maNão é possível observar onde o furo está localizado dentro da placa de crescimento. Assim, a interrupção bem sucedida da placa de crescimento em animais vivos só pode ser confirmada usando técnicas de imagem no momento da cirurgia ou avaliando a formação de barra óssea entre 7 a 28 dias após a cirurgia. Com a prática, pode-se conseguir um alto grau de sucesso na obtenção de formação de barra óssea, mas estudos iniciais podem resultar em uma série de animais que não possuem a formação de uma barra óssea, devido a uma placa de crescimento não ferida ou a uma ruptura insuficiente do crescimento Prato.
Outra limitação deste modelo é que as feridas no furo não representam lesões de placas de crescimento normais em crianças, o que geralmente ocorre devido à fratura 25 . As fraturas dentro da placa de crescimento podem ser classificadas usando o sistema de classificação Salter-Harris 26 . As fracturas de chapa de crescimento tipo III e tipo IV contribuem mais comumente para as lesões físicas que levamA formação de barras ósseas. O tipo de lesão de placa de crescimento apresentado aqui relaciona-se mais estreitamente com uma lesão de placa de crescimento de tipo VI, uma classe de lesão rara em que a fisula é removida por uma ferida de trauma ou punção. No entanto, uma vez que os mecanismos fisiopatológicos subjacentes à formação da barra óssea após a lesão da placa de crescimento permanecem evasivos, o modelo de rato continua importante para descobrir este processo, a fim de desenvolver novas opções de tratamento para crianças que sofrem de todos os tipos de lesões de placas de crescimento. O método aqui descrito cria de forma confiável uma barra óssea e pode ser usado para estudar múltiplos aspectos do processo de reparação de feridas em placas de crescimento in vivo 17 , 27 , 28 , 29 , 30 , 31 , 32 . Também foi demonstrado que este modelo de rato resulta em crescimento tibial reduzido após a placa de crescimento emJúri 13 , o que torna um modelo animal ainda mais interessante para testar novas opções de tratamento que levam à regeneração da placa de crescimento e à restauração potencial da alongamento ósseo.
Em conclusão, este artigo detalha os métodos para criar um modelo de lesão de placa de crescimento com o qual investigar a formação de barra óssea e potenciais tratamentos para lesões de placas de crescimento in vivo. Este modelo de rato permite estudos relativamente baratos e rápidos, uma vez que uma barra óssea está totalmente madura 28 dias após a lesão da placa de crescimento. Além de desenvolver a nossa compreensão dos mecanismos moleculares da formação de barras ósseas in vivo , este modelo pode ser usado para testar biomateriais que inibem a formação de barras ósseas e estimulam a regeneração da cartilagem em placas de crescimento.
Divulgações
Os autores não têm nada a divulgar.
Agradecimentos
Os autores reconhecem o apoio financeiro do Instituto Nacional de Artrite e Doenças Musculoesqueléticas e de Pele dos Institutos Nacionais de Saúde (NIH) sob o número de prêmio R03AR068087, o Fundo de Enriquecimento Acadêmico da Faculdade de Medicina da Universidade do Colorado e o Centro Gates para Medicina Regenerativa . Este trabalho também foi apoiado pelo NIH / NCATS Colorado CTSA Grant Number UL1 TR001082. O conteúdo é de responsabilidade exclusiva dos autores e não representa necessariamente os pontos de vista oficiais do NIH.
Materiais
| Name | Company | Catalog Number | Comments |
| Scalpel handle | McKesson | MCK42332500 | |
| Needle holder | Stoelting | RS-7824 | |
| Adson tissue forceps | Sklar | 50-3048 | |
| Iris Scissors | Sklar | 47-1246 | |
| Rotary Tool | Dremel | 7700 | Variable speed rotary tool |
| Keyless Rotary Tool Chuck | Dremel | 4486 | |
| Dental Burs | Dental Burs USA | FG6 | Round carbide bur, ≤2mm |
| Steinmann pins | Simpex Medical | T-078 | |
| Hair clippers | Wahl | 5537N | |
| 3-0 PGA surutes | Oasis | MV-J398-V | |
| Sterile gauze 2 x 2" | Covidien | 441211 | |
| Povidone Iodine | McKesson | 922-00801 | |
| Sterile saline | Vetone | 510224 | |
| 10 mL luer lock syringe | Becton Dickinson | 309604 | |
| 23 gauge needle | Becton Dickinson | 305145 | |
| Isopropyl alcohol pads | Dynarex | 1113 | |
| Isoflurane | IsoFlo | 30125-2 | |
| Caliper | Mitutoyo | 500-196-30 | |
| Carprofen | Rimadyl | 27180 | |
| Buprenorphine | Par Pharmaceuticals Inc | NDC 42023-179 | |
| Fenestrated Surgical Drape | McKesson | 25-517 | |
| Surgical Gloves | Uline | S-20204 | |
| #15 Scalpel Blade | Aven | 44044 | |
| 9 mm wound clips | Fine Science Tools | 12032-09 | |
| Reflex clip applier | World Precision Instruments | 500345 | |
| Absorbant underpads | McKesson | MON 43723110 | |
| Tec 3 Iso Vaporizer | VetEquip | 911103 | |
| Germinator 500 | Braintree Scientific | GER 5287-120V | |
| Warm water recirculator | Kent Scientific | TP-700 | |
| Absorbent Underpads | Medline Industries | MSC281230 |
Referências
- Mann, D. C., Rajmaira, S. Distribution of physeal and nonphyseal fractures in 2,650 long-bone fractures in children aged 0-16 years. J Pediatr Orthop. 10 (6), 713-716 (1990).
- Browne, L. P., et al. Community-acquired staphylococcal musculoskeletal infection in infants and young children: necessity of contrast-enhanced MRI for the diagnosis of growth cartilage involvement. AJR Am J Roentgenol. 198 (1), 194-199 (2012).
- Weitao, Y., Qiqing, C., Songtao, G., Jiaqiang, W. Epiphysis preserving operations for the treatment of lower limb malignant bone tumors. Eur J Surg Oncol. 38 (12), 1165-1170 (2012).
- Butler, M. S., Robertson, W. W., Rate, W., D'Angio, G. J., Drummond, D. S. Skeletal sequelae of radiation therapy for malignant childhood tumors. Clin Orthop Relat Res. (251), 235-240 (1990).
- Shapiro, F. Longitudinal growth of the femur and tibia after diaphyseal lengthening. J Bone Joint Surg Am. 69 (5), 684-690 (1987).
- Kronenberg, H. M. Developmental regulation of the growth plate. Nature. 423 (6937), 332-336 (2003).
- Dodwell, E. R., Kelley, S. P. Physeal fractures: basic science, assessment and acute management. Orthopaedics and Trauma. 25 (5), 377-391 (2011).
- Khoshhal, K. I., Kiefer, G. N. Physeal bridge resection. J Am Acad Orthop Surg. 13 (1), 47-58 (2005).
- Hasler, C. C., Foster, B. K. Secondary tethers after physeal bar resection: a common source of failure. Clin Orthop Relat Res. (405), 242-249 (2002).
- Xian, C. J., Zhou, F. H., McCarty, R. C., Foster, B. K. Intramembranous ossification mechanism for bone bridge formation at the growth plate cartilage injury site. J Orthop Res. 22 (2), 417-426 (2004).
- Chen, J., et al. Formation of tethers linking the epiphysis and metaphysis is regulated by vitamin d receptor-mediated signaling. Calcif Tissue Int. 85 (2), 134-145 (2009).
- Coleman, R. M., Schwartz, Z., Boyan, B. D., Guldberg, R. E. The therapeutic effect of bone marrow-derived stem cell implantation after epiphyseal plate injury is abrogated by chondrogenic predifferentiation. Tissue Eng Part A. 19 (3-4), 475-483 (2013).
- Chung, R., Foster, B. K., Xian, C. J. The potential role of VEGF-induced vascularisation in the bony repair of injured growth plate cartilage. J Endocrinol. 221 (1), 63-75 (2014).
- Coleman, R. M., et al. Characterization of a small animal growth plate injury model using microcomputed tomography. Bone. 46 (6), 1555-1563 (2010).
- Macsai, C. E., Hopwood, B., Chung, R., Foster, B. K., Xian, C. J. Structural and molecular analyses of bone bridge formation within the growth plate injury site and cartilage degeneration at the adjacent uninjured area. Bone. 49 (4), 904-912 (2011).
- Su, Y. W., et al. Neurotrophin-3 Induces BMP-2 and VEGF Activities and Promotes the Bony Repair of Injured Growth Plate Cartilage and Bone in Rats. J Bone Miner Res. , (2016).
- Zhou, F. H., Foster, B. K., Sander, G., Xian, C. J. Expression of proinflammatory cytokines and growth factors at the injured growth plate cartilage in young rats. Bone. 35 (6), 1307-1315 (2004).
- Sayers, D., Volpin, G., Bentley, G. The demonstration of bone and cartilage remodelling using alcian blue and hematoxylin. Biotechnic & Histochemistry. 63 (1), 59-63 (1988).
- Riederer, M. S., Requist, B. D., Payne, K. A., Way, J. D., Krebs, M. D. Injectable and microporous scaffold of densely-packed, growth factor-encapsulating chitosan microgels. Carbohydrate Polymers. 152, 792-801 (2016).
- Lee, M. A., Nissen, T. P., Otsuka, N. Y. Utilization of a murine model to investigate the molecular process of transphyseal bone formation. J Pediatr Orthop. 20 (6), 802-806 (2000).
- Coleman, R. M., et al. Characterization of a small animal growth plate injury model using microcomputed tomography. Bone. 46 (6), 1555-1563 (2010).
- Lee, S. U., Lee, J. Y., Joo, S. Y., Lee, Y. S., Jeong, C. Transplantation of a Scaffold-Free Cartilage Tissue Analogue for the Treatment of Physeal Cartilage Injury of the Proximal Tibia in Rabbits. Yonsei Med J. 57 (2), 441-448 (2016).
- Planka, L., et al. Nanotechnology and mesenchymal stem cells with chondrocytes in prevention of partial growth plate arrest in pigs. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub. 156 (2), 128-134 (2012).
- Hansen, A. L., et al. Growth-plate chondrocyte cultures for reimplantation into growth-plate defects in sheep. Characterization of cultures. Clin Orthop Relat Res. (256), 286-298 (1990).
- Cepela, D. J., Tartaglione, J. P., Dooley, T. P., Patel, P. N. Classifications In Brief: Salter-Harris Classification of Pediatric Physeal Fractures. Clin Orthop Relat Res. , (2016).
- Salter, R. B., Harris, W. R. Injuries Involving the Epiphyseal Plate. The Journal of Bone & Joint Surgery. 83 (11), 1753 (2001).
- Chung, R., Foster, B. K., Zannettino, A. C., Xian, C. J. Potential roles of growth factor PDGF-BB in the bony repair of injured growth plate. Bone. 44 (5), 878-885 (2009).
- Fischerauer, E., Heidari, N., Neumayer, B., Deutsch, A., Weinberg, A. M. The spatial and temporal expression of VEGF and its receptors 1 and 2 in post-traumatic bone bridge formation of the growth plate. J Mol Histol. 42 (6), 513-522 (2011).
- Chung, R., Cool, J. C., Scherer, M. A., Foster, B. K., Xian, C. J. Roles of neutrophil-mediated inflammatory response in the bony repair of injured growth plate cartilage in young rats. J Leukoc Biol. 80 (6), 1272-1280 (2006).
- Chung, R., et al. Roles of Wnt/beta-catenin signalling pathway in the bony repair of injured growth plate cartilage in young rats. Bone. 52 (2), 651-658 (2013).
- Zhou, F. H., Foster, B. K., Zhou, X. F., Cowin, A. J., Xian, C. J. TNF-alpha mediates p38 MAP kinase activation and negatively regulates bone formation at the injured growth plate in rats. J Bone Miner Res. 21 (7), 1075-1088 (2006).
- Arasapam, G., Scherer, M., Cool, J. C., Foster, B. K., Xian, C. J. Roles of COX-2 and iNOS in the bony repair of the injured growth plate cartilage. J Cell Biochem. 99 (2), 450-461 (2006).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados