Method Article
Ein Ratten-Tibia-Wachstumsplatten-Verletzungsmodell, um Reparaturmechanismen zu charakterisieren und Wachstumsplatten-Regenerationsstrategien zu bewerten
In diesem Artikel
Zusammenfassung
Die Wachstumsplatte ist eine knorpelige Region in den langen Knochen der Kinder, wo Längswachstum auftritt. Bei Verletzung kann das Knochengewebe das Wachstum formen und beeinträchtigen. Wir beschreiben ein Rattenmodell der Wachstumsplattenverletzung, die zu knöchernem Reparaturgewebe führt und das Studium von Reparaturmechanismen und Wachstumsplattenregenerationsstrategien ermöglicht.
Zusammenfassung
Ein Drittel aller pädiatrischen Frakturen beinhaltet die Wachstumsplatte und kann zu einem beeinträchtigten Knochenwachstum führen. Die Wachstumsplatte (oder Physis) ist Knorpelgewebe, das am Ende aller langen Knochen bei Kindern gefunden wird, die für das Längsknochenwachstum verantwortlich ist. Einmal beschädigt, kann Knorpelgewebe innerhalb der Wachstumsplatte vorzeitige Verknöcherung erfahren und zu unerwünschtem knöchernem Reparaturgewebe führen, das einen "knöchernen Stab" bildet. In einigen Fällen kann dieser knöcherne Stab zu Knochenwachstumsdeformitäten führen, wie z. B. Winkeldeformitäten, oder er kann das langsame Knochenwachstum vollständig stoppen. Es gibt derzeit keine klinische Behandlung, die eine verletzte Wachstumsplatte vollständig reparieren kann. Mit einem Tier-Modell der Wachstumsplatte Verletzung besser zu verstehen, die Mechanismen zugrunde liegenden Knochenbildung und zu identifizieren Möglichkeiten, um es zu hemmen ist eine großartige Gelegenheit, um bessere Behandlungen für Wachstumsplatten Verletzungen zu entwickeln. Dieses Protokoll beschreibt, wie man die Ratten proximale Tibia-Wachstumsplatte unter Verwendung eines Bohrlochdefekts stört. Dieses smaDas Tiermodell produziert zuverlässig einen knöchernen Stab und kann zu Wachstumsdeformitäten führen, die denen ähnlich sind, die bei Kindern gesehen werden. Dieses Modell ermöglicht die Untersuchung der molekularen Mechanismen der Knochenbarrenbildung und dient als Mittel, um mögliche Behandlungsmöglichkeiten für Wachstumsplattenverletzungen zu testen.
Einleitung
Wachstumsplattenverletzungen machen 30% aller pädiatrischen Frakturen aus und können zu einem beeinträchtigten Knochenwachstum führen 1 . Zusätzlich zu Frakturen können Wachstumsplattenverletzungen durch andere Ätiologien verursacht werden, einschließlich Osteomyelitis 2 , primäre Knochentumore 3 , Strahlung und Chemotherapie 4 und iatrogene Schäden 5 . Die Wachstumsplatte (oder Physis) ist eine Knorpelregion am Ende der Kinderknochen, die für das Knochenwachstum verantwortlich ist. Es fährt die Knochendehnung durch endochondrale Verknöcherung; Chondrozyten unterziehen sich der Proliferation und Hypertrophie und werden dann durch ankommende Osteoblasten umgebaut, um den Trabekelknochen zu bilden 6 . Die Wachstumsplatte ist auch eine schwache Fläche des sich entwickelnden Skeletts, so dass es anfällig für Verletzungen ist. Die Hauptanliegen bei Wachstumsplattenbrüchen oder -verletzungen ist, dass das beschädigte Knorpelgewebe innerhalb der Wachstumsplatte b kannE ersetzt durch unerwünschtes knöchernes Reparaturgewebe, auch bekannt als "knöcherne Stange". Abhängig von seiner Größe und Lage innerhalb der Wachstumsplatte kann der knöcherne Stab zu kantigen Deformitäten oder komplettem Wachstumsstillstand führen, eine verheerende Folge für kleine Kinder, die noch nicht ihre volle Höhe erreicht haben 7 .
Es gibt derzeit keine Behandlung, die eine verletzte Wachstumsplatte vollständig reparieren kann. Sobald sich die knöcherne Stange bildet, muss der Kliniker entscheiden, ob er ihn chirurgisch entfernen soll oder nicht. Patienten mit mindestens 2 Jahren oder 2 cm Skelettwachstum verbleibend und mit einem knöchernen Stab, der weniger als 50% des Wachstumsplattenbereichs überspannt, sind in der Regel Kandidaten für knöcherne Raffinierung 8 . Die chirurgische Entfernung des knöchernen Stabes folgt oftmals der Zwischenlage eines autologen Fett-Transplantats, um eine Reformierung des knöchernen Gewebes zu verhindern und die umgebende unverletzte Wachstumsplatte zu ermöglichen, das Wachstum wiederherzustellen. Diese Techniken sind jedoch problEmatic und oft scheitern, was zu knöcherne Bar Wiederholung und weiterhin negative Auswirkungen auf das Wachstum 9 . Es besteht ein kritischer Bedarf, effektive Behandlungen zu entwickeln, die nicht nur die Knochenbildung verhindern, sondern auch den Wachstumsplattenknorpel regenerieren und so die normale Knochendehnung wiederherstellen.
Die molekularen Mechanismen, die der Knochenbarren zugrunde liegen, müssen noch vollständig aufgeklärt werden. Ein besseres Verständnis dieser biologischen Mechanismen könnte zu effektiveren therapeutischen Interventionen für Kinder führen, die an Wachstumsplattenverletzungen leiden. Da das Studium dieser Mechanismen beim Menschen schwierig ist, wurden Tiermodelle verwendet, insbesondere das Rattenmodell der Wachstumsplattenverletzung 10 , 11 , 12 , 13 , 14 , 15 , 16 . Die hier dargestellte MethodePapier beschreibt, wie ein Bohrlochdefekt in der Ratten-Tibia-Wachstumsplatte zu vorhersagbarem und reproduzierbarem Reparaturgewebe führt, das erst sieben Tage nach der Verletzung eine Verknöcherung beginnt und bei 28 Tagen nach Verletzung eine vollständig ausgereifte Knochenstange bildet. Dies stellt ein kleines Tier- In-vivo- Modell zur Verfügung, in dem die biologischen Mechanismen der Knochenbarrenbildung untersucht werden können, sowie um neuartige Therapien zu bewerten, die den knöchernen Stab verhindern und / oder den Wachstumsplattenknorpel regenerieren können. Zum Beispiel kann dieses Modell verwendet werden, um chondrogene Biomaterialien zu testen, die Wachstumsplattenknorpel regenerieren und eine wertvolle Behandlung für Kinder mit Wachstumsplattenverletzungen bieten können. Die in diesem Papier vorgestellten Techniken beschreiben die chirurgischen Methoden, die zur Herstellung der Verletzung der Wachstumsplatte und der späteren Zufuhr von Biomaterialien zur Verletzungsstelle verwendet werden. Wir werden auch Methoden diskutieren, um die Knochenbildung zu beurteilen und das Gewebe zu reparieren.
Protokoll
Alle Tierverfahren müssen vom örtlichen Institutionellen Tierpflege- und -ausschuss (IACUC) genehmigt werden. Das Tierprotokoll für das folgende Verfahren wurde von der University of Colorado Denver IACUC genehmigt.
1. Ratten erhalten
HINWEIS: Sofern nicht genetisch veränderte Tiere gewünscht sind, werden zum Zeitpunkt der Operation 6 Wochen alte, skelettartig unreife Sprague-Dawley-Ratten benötigt. Andere Stämme könnten potentiell verwendet werden; Allerdings wurde die Mehrheit der veröffentlichten Studien an Sprague-Dawley-Ratten durchgeführt.
2. Vorbereitung der chirurgischen Versorgung
- Autoklav chirurgische Versorgung Packs, die jeweils eine der folgenden: # 3 Skalpell Griff, Nadelhalter, Adson Pinzette und Iris Schere gehören.
- Autoklav die Schnellspannbohrfutter. Bohrfutter können Perlen sterilisiert werden zwischen Tieroperationen bei Betrieb auf mehrere Tiere.
HINWEIS: Lokale IACUC-Regeln für die Verwendung von sterilem SurgIcal Werkzeuge an mehreren Tieren müssen eingehalten werden. Zum Beispiel ermöglicht die University of Colorado Denver IACUC, dass ein chirurgisches Werkzeugset auf bis zu 5 Tiere vor ihrem Absetzen verwendet wird. Darüber hinaus müssen chirurgische Werkzeuge mit einem Wulst-Sterilisator zwischen Tieren hitzsterilisiert werden. Zusätzliche sterile chirurgische Packungen müssen für weitere Tiere verwendet werden. - Autoklav 5-cm Steinmann Stifte, eine für jedes Tier.
HINWEIS: Um das Infektionsrisiko zu reduzieren, dürfen die Steinmann-Stifte nicht für mehrere Tiere verwendet werden. - Autoklav 1.8-mm Dentalbohrer, eine für jedes Tier.
HINWEIS: Um das Infektionsrisiko zu reduzieren, dürfen die Dentalbohrer nicht für mehrere Tiere verwendet werden. - Autoklavieren Sie gegebenenfalls einen Wundclip-Applikator. Alternativ können vergrabene Nähte verwendet werden, um die Hautschicht zu schließen. Siehe Schritt 7.3.
- Wenn möglich, sterilisieren Sie einen Rotationsbohrer mit Bestrahlung oder Gassterilisation.
- Sammeln Sie die folgenden zusätzlichen Lieferungen: Elektrorasierer, steRile 3-0 Polyglykolsäure-Nähte, sterile Gaze, Povidon-Iod, sterile Kochsalzlösung, sterile 10-ml-Spritzen, sterile 23-Gauge-Nadeln, Isopropylalkohol-Tupfer, Isofluran, Bremssättel, postoperative Analgetika ( zB NSAIDs und Buprenorphin), Sterile chirurgische Vorhänge, sterile chirurgische Handschuhe, sterile # 15 Skalpellklingen, sterile Wundclips, Anästhesiemaschine, Perlensterilisator, wärmende Auflage und saugfähige Unterlagen.
3. Anästhesie und Vorbereitung der Tiere
- Anästhesieren des Tieres durch Einführen in eine 1- bis 2-L-Induktionskammer, die 1 l / min Sauerstoffströmung mit 5% Isofluran aus einem Verdampfungssystem mit einem passiven Spülsystem aufnimmt.
HINWEIS: Die Exposition gegenüber 5% Isofluran sollte 6 Wochen alte Ratten innerhalb von 5 min betäuben. - Bewegen Sie das Tier an die chirurgische Stelle und pflegen Sie das Tier unter Anästhesie mit 2 - 3% Isofluran mit einem Nasenkonus für den Rest des Verfahrens. Setzen Sie das Tier auf eine wärmende Auflage und ein absorbierenUnter underpad
HINWEIS: Das Tier muss nicht an den chirurgischen Tisch befestigt werden. Das Halten des Beines, wie in den folgenden Schritten angegeben, ist eine ausreichende Methode der Stabilisierung.
ANMERKUNG: Alle nachfolgenden Verfahren sind mit dem Tier unter Anästhesie durchzuführen. 2 - 3% Isofluran sollte ausreichen, um die Anästhesie bei Ratten in diesem Alter zu erhalten. Dies kann durch die Prüfung des bipedalen Entnahmereflexes bestätigt werden. - Verabreichung von intraoperativen Analgetika nach institutionell zugelassenen Maßnahmen ( zB Buprenorphin bei 0,05 mg / kg und Carprofen bei 5 mg / kg).
4. Vorbereitung der Tibia zur Chirurgie
- Riechen Sie die ganzen Hinterbeine vom medialen Malleolus zum Becken mit einem elektrischen Rasierer.
- Messen und Aufzeichnen der tibialen Länge vom vorderen Tibiaplateau bis zur unteren Seite des medialen Malleolus mit Bremssätteln. Alternativ messen Sie die gesamte Tibia-Länge mit Röntgen oder MikroCT 11 Sup> , 12 , 14 . Gegebenenfalls messen Sie die Wachstumsplattenabmessungen vor der Operation mit Röntgen oder MikroCT.
- Reinigen Sie die chirurgische Stelle, indem Sie das gesamte Bein, den Bauch und die Genitalien mit Alkoholtupfern und dann mit Povidon-Jod-getränkten Gaze abwischen.
HINWEIS: Um das Infektionsrisiko zu minimieren, müssen alle nachfolgenden Verfahren, bis das Tier aus der Anästhesie entfernt wird (Schritt 7.4), unter sterilen Bedingungen durchgeführt werden. Alle chirurgischen Materialien müssen mit steriler Technik zugänglich sein. Die Verwendung eines chirurgischen Assistenten wird dringend empfohlen, um die Sterilität während der Operation zu erhalten. - Tragen sterile chirurgische Handschuhe, legen Sie eine fenestrierte sterile chirurgische Abdeckung über das Tier, so dass das Bein (s) durch die zentrale Fenestration ausgesetzt.
5. Chirurgische Vorgehensweise, um auf die Wachstumsplatte zuzugreifen
_upload / 55571 / 55571fig1.jpg "/>
Abbildung 1: Überblick über die chirurgische Vorgehensweise.
A) Ort der verschiedenen anatomischen Marker verwendet, um eine erfolgreiche Wachstumsplatte Verletzung zu schaffen. Die Kniekapsel ist unmittelbar hinter der Kniescheibe (weiß) und trennt die Tibia vom Femur. Die tibiale Wachstumsplatte (dunkelrot) ist unterhalb der Kniescheibe und der Umgehung der Tibia zu sehen. Die proximale Wachstumsplatte ist eine meist flache Ebene, mit Ausnahme des vorderen Viertels, das eine diagonale Ebene bildet. Der Schnittpunkt dieser beiden Ebenen bildet den Wachstumsplattenwinkel, der für eine geeignete Bohrwinkelung verwendet wird. Die Semitendinosus-Insertion ist, wo die Quadrizeps-Muskeln in die hintere Tibia einfügen. B) Inzision durch den anterior-medialen Aspekt der tibialen Weichgewebe, um auf den kortikalen Knochen zuzugreifen. C) Ort des kortikalen Fensters mit Ausrichtung mit der distalen semitendinosus Einfügung als Referenzpunkt. D) AuswertungDie Tiefe der Verletzung durch Ausrichtung der Abschrägung auf die Zahnbürste mit dem kortikalen Fenster.
- Machen Sie einen ~ 1-cm-Schnitt durch die Haut entlang des medial-anterioren Aspekts der proximalen Tibia mit einem # 3-Skalpell-Griff und einer # 15-Klinge, beginnend am distalen Ende des medialen Femur-Kondylus ( Abbildung 1A ).
- Ziehen Sie die Haut fest gegen den darunter liegenden Knochen und halten Sie das Bein fest, während Sie den Schnitt machen.
HINWEIS: Dies wird den Hautschnitt an der gewünschten Stelle behalten und hilft bei der Erstellung eines sauberen Schnittes. Drücken Sie nicht zu fest mit dem Skalpell, um zu vermeiden, dass die Kniekapsel geputzt wird, was zu reichlichen Blutungen führen würde und die restlichen Schritte schwierig machen wird.
- Ziehen Sie die Haut fest gegen den darunter liegenden Knochen und halten Sie das Bein fest, während Sie den Schnitt machen.
- Kenntnis von wichtigen anatomischen Markern, darunter: 1) die Wachstumsplatte, 2) der Wachstumsplattenwinkel, 3) die Kniekapsel und 4) die Semitendinosus-Insertion ( Abbildung 1A ).
- Mit dem Skalpell, machen Sie einen ~ 0,5-cm-Schnitt durch thE Fascia und Weichgewebe auf dem medial-anterioren Aspekt der proximalen Tibia, von der Wachstumsplatte bis zum Boden des Hautschnittes ( Abbildung 1B ).
- Die Faszie und das weiche Gewebe aus der Tibia mit dem Skalpell vorsichtig zerlegen oder kratzen ( Abb. 1B ).
HINWEIS: Es ist wichtig, so viel weiches Gewebe aus der Tibia zu entfernen oder zu kratzen, um die Bohrschritte nicht zu stören. - Bohren Sie ein kortikales Fenster durch den Tibia-Kortikalis an der Diaphyse mit einem Steinmann-Stift, der an einem Drehwerkzeug mit 10.000 U / min befestigt ist (niedrige Geschwindigkeit des Drehwerkzeugs im Materialbereich). Erstellen Sie das kortikale Fenster so, dass es mit der distalen Semitendinosus-Insertion übereinstimmt ( Abbildung 1C ).
- Halten Sie den Bohrer senkrecht zur Tibia-Diaphyse und bohren Sie langsam, wobei darauf achten, nicht durch die andere Seite der Diaphyse zu bohren; Das kortikale Fenster muss nur 2 mm Tiefe sein und wird gemacht, wenn neinWiderstand wird gefühlt
- Wie oben, halten Sie das Bein fest mit der anderen Hand.
HINWEIS: Für diesen Schritt kann ein Zahnbürste verwendet werden. Wenn jedoch eine Zahnbürste verwendet wird, muss das Bein sehr fest gehalten werden, um ein sauberes kortikales Fenster zu machen und um sicherzustellen, dass der Bur packt und den Knochen an der gewünschten Stelle schneidet. Ein Steinmann-Pin wird für diesen Schritt empfohlen, da er seine hervorragende Schneidfähigkeit besitzt.
- Dab das kortikale Fenster mit Gaze, da leichte Blutungen erwartet werden.
6. Schaffung der Wachstumsplatte Verletzung
- Erstellen Sie eine Bohrlochverletzung durch die zentrale Wachstumsplatte mit einem 1,8-mm-Zahnbolzen, der an einem Drehwerkzeug befestigt ist.
HINWEIS: Die richtige Tiefe, Winkel und Richtung sind bei der Störung der zentralen Wachstumsplatte kritisch ( Abbildung 1C und D ). Anleitungen zur Erreichung der geeigneten Tiefe, Winkel und Richtung sind unten angegeben.- Um die passende Tiefe mit der Zahnbürste zu messen, begiN durch Ausrichten des Endes der Zahnbürste mit der proximalen Tibia, wo der Semitendinosus die Kniekapsel kreuzt ( Abb. 1C ).
- Mit dem Ende der Zahnbürste an der Kniekapsel, folgen Sie dem Beinschaft entlang der Semitendinosus und beachten Sie, wo die Bucht mit dem kortikalen Fenster übereinstimmt. Dies ist die geeignete Tiefe für die Bohrung, um die Wachstumsplatte vollständig zu stören, ohne die Gelenkfläche zu stören ( Fig. 1C ).
HINWEIS: Die Zahnbürste dient zur Messung der entsprechenden Tiefe. Die Bohrkrone kann mit einer permanenten Markierung an der Stelle markiert werden, an der sie sich mit dem kortikalen Fenster ausrichtet, um die Tiefe während des Bohrens zu verweisen. Wenn jedoch die anatomischen Marker und das obige Protokoll genau referenziert werden, wird die erste Abschrägung auf die hier angegebenen Dentalbohrer (FG6) in geeigneter Weise mit dem kortikalen Fenster ausgerichtet (siehe Abbildung 1C ). - Um den entsprechenden Bohrwinkel zu erreichen, halten Sie das Drehwerkzeug in einem Winkel von weniger tHan 30 ° in Bezug auf die tibiale Diaphyse.
HINWEIS: Dies ist eine visuelle Annäherung. - Um die entsprechende Bohrrichtung zu erreichen, zielen Sie auf den Wachstumsplattenwinkel ( Abbildung 1C ). Zeichnen Sie eine visuelle Linie entlang der Zahnbürste auf den Wachstumsplattenwinkel, um bei der Erstellung eines zentralen Defekts zu helfen.
- Drehen Sie das Drehwerkzeug auf 10.000 U / min (niedrige Drehzahl des im Werkzeugbereich angegebenen Drehwerkzeuges), bevor Sie das Kortikalfenster betreten.
- Mit dem Drehwerkzeug in einem geeigneten Winkel und Richtung, geben Sie das kortikale Fenster und drücken Sie das Drehwerkzeug, bis die Bur Marker mit dem kortikalen Fenster ausgerichtet ist. Sobald die richtige Tiefe erreicht ist, entfernen Sie das Drehwerkzeug.
HINWEIS: Führen Sie die Aufprallplatte Unterbrechung in einer, schnelle Bewegung, mit minimaler Zeit mit dem Bur in der Wachstumsplatte, um eine saubere Verletzung zu schaffen. Dies ist wichtig für die Datenanalyse.
- Dab das kortikale Fenster mit Gaze für ~ 30 s, da Blutungen erwartet wird.
- Achten Sie auf die entsprechende Verletzungsstufe, indem Sie die Bohrungslänge erneut messen (Schritt 6.1.2).
- Setzen Sie den Bohrer in die Bohrleiste ein (mit dem Drehwerkzeug aus) und richten Sie die markierte Bohrung mit dem kortikalen Fenster aus ( Abbildung 1D ).
- Wenn die Tiefe unzureichend ist, drehen Sie das Drehwerkzeug auf und drücken Sie auf die gewünschte Tiefe.
ANMERKUNG: Obwohl eine zweite Bohrungsrunde nicht ideal ist, ist das Wachstumsplatte völlig unaufhörlich für die Entwicklung des knöchernen Stabes. - Spülen Sie die Bohrspur mit ~ 3 ml steriler Kochsalzlösung mit einer 10-ml-Spritze und einer 23-Gauge-Nadel.
- Die Wunde mit Gaze trocknen
7. Nachverletzungsverfahren
- Bei der Auswertung einer Biomaterial-basierten Wachstumsplattenbehandlung wird das Biomaterial durch die Bohrspur in die Verletzungsstelle mit einer entsprechend bemessenen Nadel (18- bis 26-gauge, abhängig von der Biomaterial-Viskosität) injiziert.
HINWEIS: Das Volumen der Wachstumsplattenverletzung ist ~ 3 & #181, L, und das Volumen der Bohrspur beträgt ~ 20 μl. Das maximale Materialvolumen, das in die Wachstumsplattenverletzung und die Bohrspur injiziert werden kann, liegt zwischen 20 und 25 μl. - Schließen Sie die Wunde, indem Sie die Faszie mit 3-0 Polyglykolsäure-Nähten sägen. Wenden Sie Knochenwachs über das kortikale Fenster an, um den darunter liegenden Knochen zu isolieren (optional).
- Schließen Sie den Hautschnitt mit vergrabenen Nähten oder Wundclips.
HINWEIS: Wundclips werden empfohlen, da das Tier an der Verletzungsstelle kratzen und die Wunde öffnen kann. - Entfernen Sie das Tier aus der Isofluran-Anästhesie, legen Sie es auf eine wärmende Decke und überwachen Sie es, bis es wach ist.
- Um das Infektionsrisiko zu reduzieren, legen Sie das Tier in einen neuen Käfig mit trockenen, autoklavierten Bettwäsche.
- Erlauben Sie dem Tier, das Gewicht nach der Operation zu tragen.
- Überwachen Sie das Tier alle 12 h für 72 h nach der Operation, um auf Anzeichen einer Infektion zu überprüfen, um sicherzustellen, dass die Wundclips bestehen bleiben und postoperativ zu verwalten( ZB Buprenorphin bei 0,05 mg / kg alle 12 h für 36 h und Carprofen bei 5 mg / kg alle 24 h für 72 h).
- Entfernen Sie die Wundclips 10 - 14 Tage nach der Operation unter Anästhesie.
Ergebnisse
Eine erfolgreiche Wachstumsplattenverletzung mit dieser Methode beinhaltet die Störung des Zentrums der Tibia-Wachstumsplatte, ohne die Gelenkknorpeloberfläche zu stören. Bei knöchernem Reparaturgewebe wurde berichtet, dass es etwa 7 Tage nach der Verletzung anfängt und durch 28 Tage nach der Verletzung 13 vollständig entwickelt wird, wie durch Mikro-Computertomographie (Mikro-CT) sichtbar gemacht ( Abbildung 2 ). Obwohl diese Zeitpunkte hier gewählt wurden, um den Beginn und die Reifung der Knochenbildung auf der Grundlage vorher veröffentlichter Daten anzuzeigen, können andere Zeitpunkte verwendet werden, um die verschiedenen Stadien des Reparaturprozesses von Tag 1 bis 6 Monaten nach der Operation zu untersuchen. Tabelle 1 gibt einen Überblick über die Knochenvolumenbildung innerhalb der chirurgisch verletzten Rattenwachstumsplatten 28 Tage nach der Operation aus drei unabhängigen Durchläufen durch Bereitstellung (1) des Knochenvolumenanteils innerhalb der gesamten Wachstumsplatte und (2) der boNe Volumenanteil innerhalb des Reparaturgewebebereichs nur 15 . Die Daten werden als mittlere prozentuale ± die Standardabweichung angegeben und zeigen, dass ähnliche Ergebnisse zwischen den unabhängigen Läufen erzielt wurden. Die Abweichung zwischen den verschiedenen Läufen wurde durch eine Einweganalyse der Varianz (ANOVA) analysiert und zeigt keinen statistisch signifikanten Unterschied zwischen den Läufen, was auf die Reproduzierbarkeit des Modells hindeutet. Alcian-Blau-Hämatoxylin (ABH) mit Orangen-G / Eosin-Gegenfleck 18 wurde verwendet, um eine Vielzahl von Reparaturgeweben in verschiedenen Stadien der Knochenbarformation histologisch zu zeigen ( Abbildung 2 ). Mit diesem histologischen Fleck können verschiedene Arten von Reparaturgewebe, einschließlich mesenchymaler, knorpelartiger, knöcherner Trabekel und Knochenmark, identifiziert und quantifiziert werden.
Mehrere Probleme können sich aus falsch nach den oben genannten Verfahren ergeben. Ein insufficie Die Bohrtiefe wird die Wachstumsplatte nicht stören, was zu einer geringen oder gar keinen Knochenbildung führt. Eine Unterbrechung der Gelenkknorpeloberfläche schafft eine größere Verletzung, die Gelenkknorpel in die Wachstumsplattenverletzungsstelle einführen kann, was den Heilungsprozess kompliziert ( Fig. 3A ). Das Unterbrechen der Wachstumsplatte bei einem unangemessenen Winkel oder einer Richtung führt zu einer nicht-zentralen Verletzung ( Abbildung 3B ). In diesem Fall wird noch eine knöcherne Stabbildung auftreten, obwohl sie lateral oder medial an der gewünschten Stelle sein wird. Insgesamt kann das nach der Wachstumsplattenverletzung gebildete Reparaturgewebe auf vielfältige Weise analysiert werden, einschließlich microCT, quantitativer PCR, histologischer Färbung und Immunhistochemie. Neben histologischen und molekularen Messungen bieten Gliedmaßenlängen- und Wachstumsplattenmessungen ein wichtiges Maß für das gesamte Knochenwachstum. Betroffene Gliedmaßen wurden berichtet, um eine Wachstumsreduktion im Vergleich zu unverletzten Kontrollgliedern zu erfahren> 13 Die Gliedmaßenlänge kann während des gesamten Verlaufs der Studie mit Hilfe von microCT-Bildern zu verschiedenen Zeitpunkten gemessen werden, um die Längenunterschiede zu untersuchen. 14 Beispiele für Zeitpunkte, die bisher verwendet wurden, beinhalten 28 Tage und 56 Tage nach der Verletzung. Wachstumsplattenmessungen, einschließlich der Gesamthöhe, der Zonenhöhen und der Tetherbildung, können auch wichtige Informationen über den Gewebereparaturprozess 13 , 14 , 15 liefern. Idealerweise sollte man Gliedmaßen Längen und Wachstumsplatten Messungen vor der Operation, um einen Baseline-Wert haben. Um die biologischen Mechanismen weiter zu erforschen oder die Wirksamkeit einer Behandlung zu testen, sollten geeignete Kontrollgruppen entworfen und unberührte Gliedmaßen und Gliedmaßen, die operiert wurden, aber unbehandelt bleiben.
Biomaterialien können auch in diesem Wachstumsplattenverletzungsmodell getestet werden. Als Beispiel, ein chiTosan-Mikrogel 19 wurde in die Wachstumsplatten-Verletzungsstelle injiziert, wie in Schritt 7.1 beschrieben, und es ist deutlich an der Verletzungsstelle in 4 zu sehen . Die anschließende Analyse kann die Bestimmung der Wirkungen des Biomaterials auf die Reparaturgewebezusammensetzung, die Gliedmaßenlänge und die Wachstumsplattenmessungen, wie oben diskutiert, beinhalten.
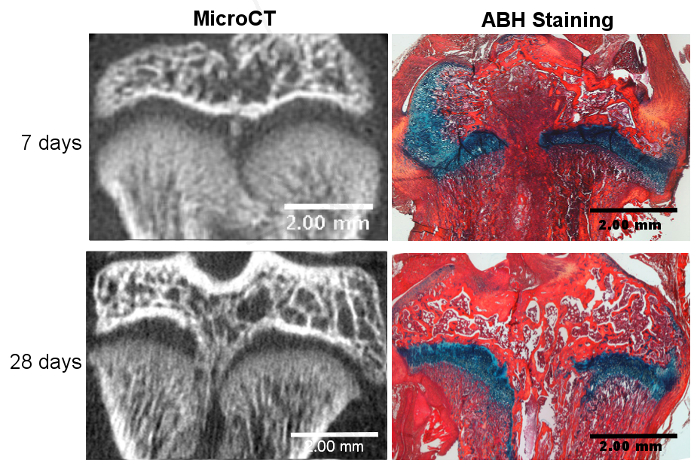
Abbildung 2. Erfolgreiche Wachstumsplattenstörung und knöcherne Stabbildung.
Knöcherne Barbildung wird bei 7 Tagen nach der Verletzung mit microCT gesehen und bestätigt durch Alcian Blue Hämatoxylin (ABH) Färbung. Der knöcherne Stab ist bei Tag 28 nach der Verletzung voll ausgereift, wie bei microCT und ABH-Färbung gesehen. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
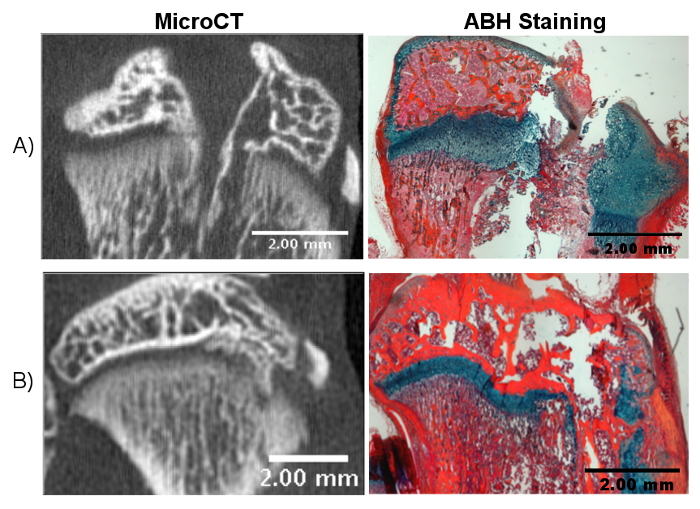
Abbildung 3. Mögliche Ergebnisse der falschen Bohrung.
A) Das Bohren zu weit durch die Tibia kann die Gelenkfläche stören, was den Heilungsprozess erschwert und zu unklaren Ergebnissen führen kann. B) Falsche Winkelung des Bohrers kann zu einer nicht-zentralen Wachstumsplattenverletzung führen. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
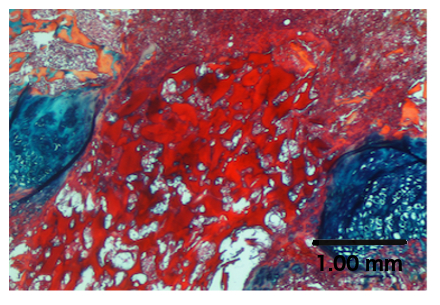
Abbildung 4. Behandlung einer Wachstumsplattenverletzung mit einem Biomaterial.
ABH-Färbung zeigt das Chitosan-Mikrogel in der verletzten Wachstumsplatte.
| Metrisch | Führen Sie 1 aus | Führen Sie 2 aus | Lauf 3 laufen | P-Wert |
| Knochen Volumen Fraktion innerhalb der gesamten Wachstumsplatte | 9,76 +/- 3,81% | 10,52 +/- 4,06% | 11,93 +/- 2,04% | 0,5493 |
| Knochenvolumenanteil im Reparaturgewebebereich | 41,5 +/- 8,33% | 46,08 +/- 10,12% | 46,77 +/- 8,14% | 0,5128 |
Tabelle 1. Knochenvolumen-Fraktionsdaten.
Die Daten stammen aus Mikro-CT-Bildern bei 28 Tagen nach der Verletzung bei unbehandelten Ratten aus drei unabhängigen Läufen.
Diskussion
Ein Wachstumsplattenverletzungs-Tiermodell fügt unserem Verständnis der biologischen Mechanismen dieser Verletzung weitgehend hinzu, was möglicherweise zu effektiveren therapeutischen Interventionen für Kinder führt, die unter Verletzungen von Wachstumsplatten leiden. Um eine knöcherne Stange erfolgreich zu erstellen und ihre Entstehung in vivo unter Verwendung des in dieser Arbeit vorgestellten Modells zu studieren, ist es entscheidend, die Wachstumsplatte durch Bohren in einer ausreichenden Tiefe zu stören, ohne den Gelenkknorpel zu stören. Variation in der chirurgischen Umsetzung unter den Tieren und in geringerem Maße die Variation der anatomischen Marker kann zu problematischen Ergebnissen führen. Wir empfehlen, die oben beschriebenen Verfahren auf kadaverischen Tieren zu praktizieren, um eine erfolgreiche Verletzung der Wachstumsplatte zu gewährleisten, bevor das Verfahren für lebende Tierstudien durchgeführt wird. Während kadaverische Tiere fehlende Gewebe-Biegsamkeit und nicht bluten, wird das Wachstumsplattenverletzungsverfahren und anatomische Merkmale auf diesen Tieren ähnlich denen von lebenden Tieren sein. FurtHermore kann die kadaverische tibiale Wachstumsplatte leicht zerlegt werden, da sich die Epiphyse von der Metaphyse durch die Anwendung der Lichtkraft trennt und die Lage des Bohrlochs beobachtet werden kann. Diese schnelle Analyse ermöglicht die Technik Modifikationen, um die richtige Bohrtiefe und Winkelung auf kadaverischen Tieren zu lernen, ohne die Notwendigkeit der Bildgebung.
Es ist zu beachten, dass andere Tiermodelle der Wachstumsplattenverletzung existieren. Ein ähnlicher transpysealer Defekt wurde in der Maus durchgeführt und führte zur Knochenbildung 20 . Trotz seiner kleineren Größe kann es auch verwendet werden, um die Mechanismen zu untersuchen, die an der Knochenbildung beteiligt sind. Coleman et al . Berichtete über ein anderes gültiges Rattenmodell der Wachstumsplattenverletzung, bei dem ein zentraler Transparktfehler im distalen Oberschenkel durch Bohren durch den Gelenkknorpel 21 erzeugt wurde . Dieser Ansatz führte auch zur Bildung einer knöchernen Bar und Gliedmaßenlänge Ungleichungen, wie in derModell hier vorgestellt Andere Tiermodelle der Wachstumsplattenverletzung und -behandlung beinhalten Kaninchen 22 , Schweine 23 und Schafe 24 . Während größere Tierverletzungsmodelle eher klinische Verletzungen darstellen können, ist das Rattenmodell für die Erforschung der biologischen Mechanismen von Physealverletzungen nützlich. Beispielsweise wurde das hier vorgestellte Rattenmodell ausgiebig verwendet, um molekulare Mechanismen der physealen Verletzung und des Knochenstabbildungsprozesses 10 , 11 , 12 , 13 , 14 , 15 , 16 zu untersuchen . Darüber hinaus kann das Rattenmodell verwendet werden, um verschiedene physeale Behandlungen zu testen, bevor es zu größeren Tiermodellen bewegt. Allerdings ist eine Herausforderung dieses Rattenmodells der Wachstumsplattenverletzung, dass das Bohren innerhalb des Knochens erfolgt, maKönig es unmöglich zu beobachten, wo das Bohrloch befindet sich innerhalb der Wachstumsplatte. So kann eine erfolgreiche Unterbrechung der Wachstumsplatte bei lebenden Tieren nur mit bildgebenden Verfahren zum Zeitpunkt der Operation oder durch die Beurteilung der Knochenbildung zwischen 7 und 28 Tagen nach der Operation bestätigt werden. Mit der Praxis kann ein hohes Maß an Erfolg bei der Erzielung einer Knochenbarrenbildung erreicht werden, aber frühe Studien können zu einer Anzahl von Tieren führen, denen die Bildung eines knöchernen Stabes fehlt, und zwar entweder aufgrund einer unverletzten Wachstumsplatte oder einer unzureichenden Unterbrechung des Wachstums Teller.
Eine weitere Einschränkung dieses Modells ist, dass Bohrlochverletzungen keine normalen Wachstumsplattenverletzungen bei Kindern darstellen, die in der Regel aufgrund von Frakturen auftreten 25 . Frakturen innerhalb der Wachstumsplatte können nach dem Salter-Harris-Klassifikationssystem 26 klassifiziert werden. Typ III und Typ IV Wachstumsplattenbrüche am häufigsten zu den physealen Verletzungen führen, die führenZur knöchernen barbildung Der hier vorgestellte Wachstumsplattenverletzungstyp bezieht sich am engsten auf eine Verletzung des Typs VI-Wachstumsplatte, eine seltene Verletzungsklasse, bei der die Physis durch eine Trauma oder eine Punktion gewickelt wird. Da jedoch die pathophysiologischen Mechanismen, die der Knochenbarrenbildung nach der Verletzung der Wachstumsplatte zugrunde liegen, weiterhin schwer bleiben, bleibt das Rattenmodell wichtig, um diesen Prozess aufzudecken, um neuartige Behandlungsmöglichkeiten für Kinder zu entwickeln, die unter allen Arten von Wachstumsplattenverletzungen leiden. Die hier beschriebene Methode erzeugt zuverlässig einen knöchernen Stab und kann verwendet werden, um mehrere Aspekte des Herstellungsprozesses der Wachstumsplattenverletzung in vivo 17 , 27 , 28 , 29 , 30 , 31 , 32 zu untersuchen . Es wurde auch gezeigt, dass dieses Rattenmodell zu einem reduzierten tibialen Wachstum nach der Wachstumsplatte führtJury 13 , die es zu einem noch interessanteren Tiermodell macht, um neuartige Behandlungsmöglichkeiten zu testen, die zur Wachstumsplattenregeneration und der möglichen Wiederherstellung der Knochendehnung führen.
Abschließend enthält dieses Papier die Methoden, um ein Wachstumsplattenverletzungsmodell zu schaffen, mit dem die Knochenbildung und die möglichen Behandlungen für Wachstumsplattenverletzungen in vivo untersucht werden können. Dieses Rattenmodell ermöglicht relativ preiswerte und schnelle Studien, da ein knöcherner Stab 28 Tage nach der Verletzung der Wachstumsplatte vollständig ausgereift ist. Zusätzlich zur Entwicklung unseres Verständnisses der molekularen Mechanismen der Knochenstabbildung in vivo kann dieses Modell verwendet werden, um Biomaterialien zu testen, die die Knochenbildung verhindern und die Wachstumsplattenknorpelregeneration fördern.
Offenlegungen
Die Autoren haben nichts zu offenbaren.
Danksagungen
Die Autoren bestätigen die Unterstützung durch das Nationale Institut für Arthritis und Muskel-Skelett- und Hautkrankheiten der National Institutes of Health (NIH) unter der Auszeichnungsnummer R03AR068087, dem Akademischen Anreicherungsfonds der University of Colorado School of Medicine und dem Gates Center for Regenerative Medicine . Diese Arbeit wurde auch von NIH / NCATS Colorado CTSA Grant Nummer UL1 TR001082 unterstützt. Der Inhalt ist die alleinige Verantwortung der Autoren und stellt nicht unbedingt offizielle NIH-Ansichten dar.
Materialien
| Name | Company | Catalog Number | Comments |
| Scalpel handle | McKesson | MCK42332500 | |
| Needle holder | Stoelting | RS-7824 | |
| Adson tissue forceps | Sklar | 50-3048 | |
| Iris Scissors | Sklar | 47-1246 | |
| Rotary Tool | Dremel | 7700 | Variable speed rotary tool |
| Keyless Rotary Tool Chuck | Dremel | 4486 | |
| Dental Burs | Dental Burs USA | FG6 | Round carbide bur, ≤2mm |
| Steinmann pins | Simpex Medical | T-078 | |
| Hair clippers | Wahl | 5537N | |
| 3-0 PGA surutes | Oasis | MV-J398-V | |
| Sterile gauze 2 x 2" | Covidien | 441211 | |
| Povidone Iodine | McKesson | 922-00801 | |
| Sterile saline | Vetone | 510224 | |
| 10 mL luer lock syringe | Becton Dickinson | 309604 | |
| 23 gauge needle | Becton Dickinson | 305145 | |
| Isopropyl alcohol pads | Dynarex | 1113 | |
| Isoflurane | IsoFlo | 30125-2 | |
| Caliper | Mitutoyo | 500-196-30 | |
| Carprofen | Rimadyl | 27180 | |
| Buprenorphine | Par Pharmaceuticals Inc | NDC 42023-179 | |
| Fenestrated Surgical Drape | McKesson | 25-517 | |
| Surgical Gloves | Uline | S-20204 | |
| #15 Scalpel Blade | Aven | 44044 | |
| 9 mm wound clips | Fine Science Tools | 12032-09 | |
| Reflex clip applier | World Precision Instruments | 500345 | |
| Absorbant underpads | McKesson | MON 43723110 | |
| Tec 3 Iso Vaporizer | VetEquip | 911103 | |
| Germinator 500 | Braintree Scientific | GER 5287-120V | |
| Warm water recirculator | Kent Scientific | TP-700 | |
| Absorbent Underpads | Medline Industries | MSC281230 |
Referenzen
- Mann, D. C., Rajmaira, S. Distribution of physeal and nonphyseal fractures in 2,650 long-bone fractures in children aged 0-16 years. J Pediatr Orthop. 10 (6), 713-716 (1990).
- Browne, L. P., et al. Community-acquired staphylococcal musculoskeletal infection in infants and young children: necessity of contrast-enhanced MRI for the diagnosis of growth cartilage involvement. AJR Am J Roentgenol. 198 (1), 194-199 (2012).
- Weitao, Y., Qiqing, C., Songtao, G., Jiaqiang, W. Epiphysis preserving operations for the treatment of lower limb malignant bone tumors. Eur J Surg Oncol. 38 (12), 1165-1170 (2012).
- Butler, M. S., Robertson, W. W., Rate, W., D'Angio, G. J., Drummond, D. S. Skeletal sequelae of radiation therapy for malignant childhood tumors. Clin Orthop Relat Res. (251), 235-240 (1990).
- Shapiro, F. Longitudinal growth of the femur and tibia after diaphyseal lengthening. J Bone Joint Surg Am. 69 (5), 684-690 (1987).
- Kronenberg, H. M. Developmental regulation of the growth plate. Nature. 423 (6937), 332-336 (2003).
- Dodwell, E. R., Kelley, S. P. Physeal fractures: basic science, assessment and acute management. Orthopaedics and Trauma. 25 (5), 377-391 (2011).
- Khoshhal, K. I., Kiefer, G. N. Physeal bridge resection. J Am Acad Orthop Surg. 13 (1), 47-58 (2005).
- Hasler, C. C., Foster, B. K. Secondary tethers after physeal bar resection: a common source of failure. Clin Orthop Relat Res. (405), 242-249 (2002).
- Xian, C. J., Zhou, F. H., McCarty, R. C., Foster, B. K. Intramembranous ossification mechanism for bone bridge formation at the growth plate cartilage injury site. J Orthop Res. 22 (2), 417-426 (2004).
- Chen, J., et al. Formation of tethers linking the epiphysis and metaphysis is regulated by vitamin d receptor-mediated signaling. Calcif Tissue Int. 85 (2), 134-145 (2009).
- Coleman, R. M., Schwartz, Z., Boyan, B. D., Guldberg, R. E. The therapeutic effect of bone marrow-derived stem cell implantation after epiphyseal plate injury is abrogated by chondrogenic predifferentiation. Tissue Eng Part A. 19 (3-4), 475-483 (2013).
- Chung, R., Foster, B. K., Xian, C. J. The potential role of VEGF-induced vascularisation in the bony repair of injured growth plate cartilage. J Endocrinol. 221 (1), 63-75 (2014).
- Coleman, R. M., et al. Characterization of a small animal growth plate injury model using microcomputed tomography. Bone. 46 (6), 1555-1563 (2010).
- Macsai, C. E., Hopwood, B., Chung, R., Foster, B. K., Xian, C. J. Structural and molecular analyses of bone bridge formation within the growth plate injury site and cartilage degeneration at the adjacent uninjured area. Bone. 49 (4), 904-912 (2011).
- Su, Y. W., et al. Neurotrophin-3 Induces BMP-2 and VEGF Activities and Promotes the Bony Repair of Injured Growth Plate Cartilage and Bone in Rats. J Bone Miner Res. , (2016).
- Zhou, F. H., Foster, B. K., Sander, G., Xian, C. J. Expression of proinflammatory cytokines and growth factors at the injured growth plate cartilage in young rats. Bone. 35 (6), 1307-1315 (2004).
- Sayers, D., Volpin, G., Bentley, G. The demonstration of bone and cartilage remodelling using alcian blue and hematoxylin. Biotechnic & Histochemistry. 63 (1), 59-63 (1988).
- Riederer, M. S., Requist, B. D., Payne, K. A., Way, J. D., Krebs, M. D. Injectable and microporous scaffold of densely-packed, growth factor-encapsulating chitosan microgels. Carbohydrate Polymers. 152, 792-801 (2016).
- Lee, M. A., Nissen, T. P., Otsuka, N. Y. Utilization of a murine model to investigate the molecular process of transphyseal bone formation. J Pediatr Orthop. 20 (6), 802-806 (2000).
- Coleman, R. M., et al. Characterization of a small animal growth plate injury model using microcomputed tomography. Bone. 46 (6), 1555-1563 (2010).
- Lee, S. U., Lee, J. Y., Joo, S. Y., Lee, Y. S., Jeong, C. Transplantation of a Scaffold-Free Cartilage Tissue Analogue for the Treatment of Physeal Cartilage Injury of the Proximal Tibia in Rabbits. Yonsei Med J. 57 (2), 441-448 (2016).
- Planka, L., et al. Nanotechnology and mesenchymal stem cells with chondrocytes in prevention of partial growth plate arrest in pigs. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub. 156 (2), 128-134 (2012).
- Hansen, A. L., et al. Growth-plate chondrocyte cultures for reimplantation into growth-plate defects in sheep. Characterization of cultures. Clin Orthop Relat Res. (256), 286-298 (1990).
- Cepela, D. J., Tartaglione, J. P., Dooley, T. P., Patel, P. N. Classifications In Brief: Salter-Harris Classification of Pediatric Physeal Fractures. Clin Orthop Relat Res. , (2016).
- Salter, R. B., Harris, W. R. Injuries Involving the Epiphyseal Plate. The Journal of Bone & Joint Surgery. 83 (11), 1753 (2001).
- Chung, R., Foster, B. K., Zannettino, A. C., Xian, C. J. Potential roles of growth factor PDGF-BB in the bony repair of injured growth plate. Bone. 44 (5), 878-885 (2009).
- Fischerauer, E., Heidari, N., Neumayer, B., Deutsch, A., Weinberg, A. M. The spatial and temporal expression of VEGF and its receptors 1 and 2 in post-traumatic bone bridge formation of the growth plate. J Mol Histol. 42 (6), 513-522 (2011).
- Chung, R., Cool, J. C., Scherer, M. A., Foster, B. K., Xian, C. J. Roles of neutrophil-mediated inflammatory response in the bony repair of injured growth plate cartilage in young rats. J Leukoc Biol. 80 (6), 1272-1280 (2006).
- Chung, R., et al. Roles of Wnt/beta-catenin signalling pathway in the bony repair of injured growth plate cartilage in young rats. Bone. 52 (2), 651-658 (2013).
- Zhou, F. H., Foster, B. K., Zhou, X. F., Cowin, A. J., Xian, C. J. TNF-alpha mediates p38 MAP kinase activation and negatively regulates bone formation at the injured growth plate in rats. J Bone Miner Res. 21 (7), 1075-1088 (2006).
- Arasapam, G., Scherer, M., Cool, J. C., Foster, B. K., Xian, C. J. Roles of COX-2 and iNOS in the bony repair of the injured growth plate cartilage. J Cell Biochem. 99 (2), 450-461 (2006).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten