Method Article
Quantificação rápida de blastogénese induzida por Mitogénio em linfócitos T para identificar drogas imunomoduladoras
Neste Artigo
Resumo
T-lymphocyte mitogenesis is accompanied by blastogenic transformation, whereupon the cell volume enlarges before cell division. Here, we describe a method to quantify blastogenesis in T lymphocytes using an automated cell counter with the capability of measuring cell diameters.
Resumo
A proliferação de linfócitos em resposta a estimulação mitogénica antigénico ou é um fenómeno facilmente quantificável útil para a imunomodulação de teste (isto é, imunossupressor ou imunoestimulador) compostos químicos e biológicos. Um dos primeiros passos na mitogénese é alargamento célula ou transformação blastogênica, após o que os aumentos de volume da célula antes da divisão. É geralmente detectáveis nas primeiras várias horas de estimulação dos linfócitos T. Aqui, nós descrevemos um método rápido para quantificar a blastogénese de linfócitos T isolados a partir de baços de ratinho e células mononucleares de sangue periférico humano (PBMC), utilizando um contador de células automatizado. Vários ensaios de proliferação comumente usados para a maior parte são trabalhosos e só refletir o efeito da população em geral, em vez de efeitos celulares individuais dentro de uma população. Em contraste, o ensaio de contador de células automatizado apresentada fornece medições rápidas, directos, e precisas de diâmetros de células que podem serutilizado para avaliar a eficácia de vários mitogénios e imunomoduladores in vitro.
Introdução
Os linfócitos T são as células primárias responsáveis pela imunidade adaptativa em mamíferos. Sabe-se que eles respondem a péptidos antigénicos específicos apresentados por moléculas MHC na superfície de células apresentadoras de antigénio. Após a activação de um receptor de células T cognatos (TCR), a célula aumenta em um processo denominado transformação blastogênica, ou blastogénese. Este processo é detectável no primeiro ~ 6 horas após o estímulo é aplicado um. Durante blastogénese, os volumes de células T individuais aumentam de 2 a 4 vezes 06/02. Os linfócitos começam a proliferar num processo chamado de expansão clonal, a finalidade das quais consiste em gerar tantos clones de TCR-rolamento células específicas de antigénio quanto possível. As células descendentes, em seguida, exercer a sua função imunológica através da diferenciação em citotóxico (CD8 +) ou helper (CD4 +) linfócitos T efetoras. Assim, os linfócitos T naive em sangue humano ou de rato estão na fase G 0 (repouso) da célulaciclo e apoio mínimo atividade metabólica. Após a exposição a antigénios ou mitogénios, células T reentrar no ciclo celular, com uma estimulação concomitante da síntese de proteínas de transcrição e 7-10. Mitogénios, tais como de forbol 12-miristato 13-acetato (PMA) e ionomicina estimular os linfócitos através da activação da proteína quinase C (PKC) e Ca 2+ dependente de vias de sinalização 1. A activação de células T com PMA / ionomicina ignora os passos de sinalização de TCR.
Em ensaios de proliferação in vitro são amplamente utilizados para a finalidade de avaliar a função dos linfócitos e a resposta a estímulos. leituras proliferação, são tipicamente tomados de um a três dias após o início da estimulação de células T e reflectem o estado colectivo de centenas ou milhares de células. A potência de vários mitogénios e drogas imunomoduladoras in vitro pode ser avaliada por simplesmente medir as taxas de proliferação na presença destes compostos. Algumas delas umssays e suas limitações são discutidos abaixo.
Para a contagem do número de células directa, o processo é demorado, com uma elevada probabilidade de erros do operador.
Para a síntese de ADN, o ensaio de incorporação de 3H-timidina mede a síntese de ADN, mas a sua principal limitação é a sua radiotoxicidade. Uma alternativa é não-radioactivos de BrdU, mas a gama de resposta linear para o crescimento celular é limitado, e o tratamento com anticorpo é necessário, o que aumenta o número de passos no procedimento 11,12.
Para a actividade metabólica, sais de tetrazólio (MTT, MTS, XTT, e WST-1) e resazurina ensaios colorimétricos à base de corantes reportar o estado metabólico geral de dividir as populações de células. No entanto, o MTT não é solúvel no meio de cultura, que requer etapas de lavagem adicionais, incorporando assim erros na medição; XTT precisa de componentes adicionais para reduzir de forma eficiente; MTS-, WST-1, e com base em medições de resazurina são afectared por o pH do meio de cultura e os seus componentes de soro, albumina ou vermelho de fenol 13-16. Estes ensaios não medem o número real de células viáveis mas sim estimar as atividades das enzimas combinadas. Portanto, a taxa de proliferação celular não pode ser determinada com precisão por meio de ensaios metabólicos devido à correlação não linear entre o número de células e redução de corante 12,17.
Para medir a concentração de ATP, de células T induzida por activação aumenta em ATP correlacionam-se com a proliferação. No entanto, a elevação de ATP intracelular é um dos passos iniciais da activação de células T; muitos passos para trás é a proliferação actual 17,18.
Para o ensaio de diluição de corante, CFSE corante fluorescente manchas células por ligação covalente a proteínas intracelulares. O corante apresenta uma diminuição dependente da proliferação da intensidade de fluorescência, que podem rastrear o número de divisões celulares. Contudo, devido à marcação de proteínas covalentes, as funções destasproteínas pode ser comprometida. O corante é tóxico para as células a concentrações mais elevadas. Em concentrações mais baixas de corante, no entanto, a intensidade de fluorescência inicial é reduzido, diminuindo o número de divisões celulares, que podem ser rastreados. Além disso, após marcação com CFSE, há uma proliferação independente ~ perda de 50% de fluorescência inicial durante o primeiro período de 24 a 48 horas, o que limita a gama dinâmica deste ensaio 19,20.
A maioria destes ensaios refletem o estado colectiva de grandes números de células e requerem o tratamento das células com corantes fluorescentes. As células apoptóticas e necróticas também pode contribuir para estas medições, a menos que sejam removidos a partir da análise por coloração com produtos químicos ou anticorpos.
Linfócitos blastogénese pode ser avaliada por uma variedade de métodos, tais como a microscopia óptica ou citometria de fluxo 4,21,22. Aqui, nós descrevemos um método rápido para a medição dos tamanhos de células T utilizando umN contador de células automatizado, que recolhe imagens de células em tempo real que são armazenados e podem ser re-analisadas em um momento posterior. Para além das medições de tamanho, este dispositivo fornece o número de células precisas e a percentagem de células viáveis, como determinado por exclusão com corante azul de tripano. O dispositivo utilizado neste protocolo está disponível comercialmente, bem como o fabricante testou a precisão do instrumento utilizando três instrumentos diferentes e vários controles de concentração e viabilidade. Os resultados destes estudos demonstraram um coeficiente de variância que foi geralmente inferior a 6%. Como observado no protocolo, o dispositivo é calibrado em uma base regular com 6 mm e 8 mm de diâmetro esferas de poliestireno. As vantagens da utilização de um contador de células para diferenciar entre células T em repouso e linfoblastos T com base no diâmetro da célula é a facilidade de utilização e a natureza automatizado de análise. O software é capaz de desenhar um círculo em torno de cada célula e calcular o diâmetro celular. Além disso, o imas idades são visíveis para o operador, que pode verificar a precisão do instrumento na identificação das células e corretamente desenhar um círculo em torno deles. Em termos de limitações, o instrumento não per se pode diferenciar entre detritos e células; Portanto, é importante que o operador visualiza cada imagem, uma vez que está a ser processado. Existe um potencial para a incorporação de bolhas de ar, o qual vai diminuir o número de campos utilizáveis para análise; no entanto, isso é raro se a manutenção regular de lavagem é realizada.
Neste estudo, grupos de linfócitos T do baço foram estimuladas com ionomicina e aumentando as concentrações de PMA durante 12-48 hr. concentrações PMA tão baixas quanto 2 ng tanto uma resposta blastogênica / induzido ml robusto e proliferação significativa. As medições dos efeitos de várias drogas, tais como o imunossupressores ciclosporina A (CsA), FK506 (tacrolimus), e rapamicina (sirolimus), bem como bloqueadores de canais de iões de eléctrico 34 e FTY720 (fingolimod), em blastogênese demonstrou boa concordância com efeitos informados sobre a proliferação. A resposta blastogênica de PBMC humanas a / estimulação de células T com PMA e ionomicina com murino anti-CD3 e anti-CD28-esferas magnéticas revestidas com anticorpo foram também medidos.
O ensaio contador de células quantifica tanto blastogénese e a taxa de proliferação (densidade celular) simultaneamente, mas separadamente, ao contrário dos métodos acima referidos, que se parecem a uma combinação destes efeitos. O protocolo apresentado proporciona uma técnica rápida e fiável para avaliar a potência de agentes mitogénicos e imunomoduladores.
Protocolo
Todos os experimentos são realizados em conformidade com os protocolos aprovados pelo Conselho Animal Care Universidade Lab e Comitê de Uso e Institutional Review Estado Wright.
NOTA: PBMC humanas são isoladas por Ficoll a centrifugação em gradiente de densidade método 5.
1. Spleen Colheita
- Casa adulto ratinhos ICR do sexo feminino em condições de laboratório padrão com os alimentos, água, e requisitos de cama específicos para a espécie.
NOTA: Os animais tinham uma idade média de 2,9 meses e peso médio de 30,4 g no momento da eutanásia. - Na data de isolamento (DOI), sacrificar os animais individualmente, sem outros animais da mesma espécie presentes. Fazer todos os esforços para garantir o mínimo de stress para o mouse. Eutanásia usando CO 2 com deslocamento cervical secundário para garantir a morte.
- Colocar o animal, ainda dentro da gaiola de transferência, para a câmara de CO 2 e STArt o fluxo de 5 l / min. Esta taxa de fluxo desloca o oxigênio na recomendado 10-30% por min.
- Depois de o animal está inconsciente, aumentar a taxa de fluxo de CO 2 a 15 L / min. Verifique o animal para a cessação da respiração e deixar na câmara para um adicional de 2 min.
- Aplicar deslocamento cervical com força de distração para garantir a morte.
- Colheita do baço a partir do animal utilizando uma técnica asséptica dentro de 10 min de morte.
- Esterilizar dois conjuntos de tesouras e pinças para a remoção do baço em uma autoclave forno antes da sua utilização. Esterilizar a superfície da dissecção através da aplicação de 70% de etanol.
- Aplicar 70% de etanol para o abdômen mouse. Usando um conjunto de tesouras e pinças, fazer um corte na pele e da pele do lado esquerdo do abdômen, em seguida, puxe para fora e descascar a pele para revelar o peritônio. Uma vez expostos, aplique a solução de clorexidina 4% antes de abrir o peritônio.
- Usando a segunda série de scissors e fórceps, fazer uma de 2 a 3 cm corte ao longo do abdômen central. Abra o peritônio e remover o baço cortando-se anexos viscerais e excesso de gordura. Colocar o baço em solução salina tamponada com fosfato de Dulbecco (DPBS).
2. Preparação de-primas Esplen�itos
NOTA: Executar todas as etapas em um gabinete de fluxo laminar biossegurança, utilizando técnica asséptica.
- Embeber os baços colhidos em 10 ml de H desionizada estéril 2 O durante 5 minutos numa placa de cultura de 10 cm a lisar os eritrócitos de superfície.
NOTA: Este passo pode ser omitido se o baço foi danificado durante o isolamento. - Para liberar os esplenócitos, esmagar os baços entre duas lâminas de vidro esterilizados (lado fosco de frente para o baço) sobre um prato de cultura fresco 10 cm. Misturar com 10 ml de meio RPMI-1640 suplementado com 10% de soro fetal bovino, 2 mM de L-glutamina, 50 lU / ml de penicilina, e 50 ug / ml de estreptomicina (abaixo referido ums RPMI completo).
- Filtrar as células através de um coador de células de nylon estéril de 40 um para uma nova placa de cultura de 10 centímetros para remover o tecido conjuntivo e os detritos.
- Lisar as restantes eritrócitos pela adição de 20 ml de tampão de lise de RBC compostas de 155 mM de NH4Cl, 10 mM de NaHCO3, e EDTA 0,1 mM a pH 7,4 e ~ 300 mOsm / L.
NOTA: A osmolalidade é medido por um ponto de congelação ou um osmómetro de pressão de vapor.- Transferir as células a partir da placa de 10 cm para um tubo de 50 ml e centrifugar a 250 xg durante 10 minutos (4 ° C).
- Remover o sobrenadante, adicionar 20 ml de tampão de lise de RBC, e re-suspender as células peletizadas por pipetagem.
- Incubar à temperatura ambiente no tampão de lise durante 10 min com agitação suave.
- Centrifugar durante 10 minutos a 250 xg (4 ° C) para sedimentar as células. Decantar o tampão de lise.
- Re-suspender as células em 10 ml de RPMI completo e centrifugar novamente (250 xg, 10 min, 4 ° C). Discoard o sobrenadante.
- Re-suspender os esplenócitos em 2 ml de RPMI completo aquecido a 37 ° C durante a transferência para a coluna de fibras de lã de nylon.
3. Purificação de linfócitos T
- Lavam-se as colunas de lã de nylon duas vezes com 5 ml de meio RPMI completo. Incubar a 37 ° C numa incubadora de CO2 a 5% de cultura de células durante 1 h.
NOTA: É imperativo manter a lã de nylon molhado durante a duração da experiência e de usar RPMI completo aquecido a 37 ° C durante todos os passos de isolamento de lã de nylon. - Adicionar esplenócitos isolados para a coluna e incuba-se durante 1 h para permitir que as células B, f ibroblastos, células acessórias e de aderir à lã de nylon.
- Adicionar 2 ml de meio RPMI contendo os esplenócitos na coluna e passar através até ao topo da lã de nylon é atingido.
- Adicionar 2 ml de RPMI completo aquecido a 37 ° C no topo da lã de nylon e passar o meio através da lãaté que o nível do líquido atinge a superfície de topo.
- Adicionar 3 ml de RPMI morno completa para a coluna de modo a cobrir totalmente a lã de nylon.
- Incubar a coluna carregada não perturbadas num banho a 37 ° C, 5% de CO 2 incubadora de cultura de células durante 1 h.
- Elui-se as células por lavagem da coluna duas vezes com 5 ml de meio RPMI completo. Realizar uma lavagem adicional das células eluídas por centrifugação.
- Encher a coluna ao topo 2 vezes com meio RPMI completo e permitir que a solução na coluna a fluir através num tubo de 50 ml estéril.
NOTA: Evitar tocando ou batendo a coluna, que pode desalojar as células B, células acessórias, fibroblastos e que aderem à lã de nylon. - Recolher a fracção de rotação e de fluxo a 250 xg durante 10 minutos (4 ° C) para sedimentar as células. Lavar uma vez com 10 ml de RPMI completo. Agregar as células novamente (250 xg, 10 min, 4 ° C) e re-suspender em 2 ml de RPMI completo.
- Meça a c Ell densidade utilizando um hemocitómetro e diluídas em meio RPMI completo com 0,5 x 10 6 células / ml.
- Semente 1 ou 2 mL de alíquotas de células em cada poço de uma placa de cultura celular de 24 ou 6 cavidades, respectivamente, e a cultura das células a 37 ° C com 5% de CO 2.
NOTA: 1 mM de 1,4-ditiotreitol (DTT) pode ser adicionado a cada poço, nesta fase, para melhorar a sobrevivência de células-T. - Opcional: confirmam a eficiência do protocolo de isolamento por citometria de fluxo. Este protocolo normalmente produz ~ 80% dos linfócitos T 23.
NOTA: Nylon células purificadas de lã conter cerca de 50% de CD4 + e 23% de células T CD8 +. Para a purificação de células CD4 + e CD8 + Além disso, um único passo de depleção imunomagnética pode ser realizada utilizando-se oito anticorpos e esferas magnéticas 24. Alternativamente, mais puro CD4 + e as populações de células T CD8 + podem ser isoladas por selecção positiva ou negativa com anticorpos específicos.
- Encher a coluna ao topo 2 vezes com meio RPMI completo e permitir que a solução na coluna a fluir através num tubo de 50 ml estéril.
- Activar linfócitos T no prazo de 24 horas de isolamento por meio da adição de PMA e ionomicina sal de cálcio ou de esferas magnéticas revestidas com anticorpos anti-CD28 23,25,26 anti-CD3 e. Adicione drogas experimentais (por exemplo, ciclosporina, FK506, rapamicina, TRAM-34, e FTY720) no momento da ativação.
NOTA: Aqui, as concentrações de PMA variou de 2 a 250 ng / ml, e a concentração de ionomicina foi mantida a 250 nm. Se possível, diluições devem ser preparados a partir de alíquotas de estoque de cada droga de modo a que o volume adicionado a cada poço de células é ≥1 ul para assegurar a reprodutibilidade. O esferas magnéticas anti-CD3 / anti-CD28-revestidos são adicionadas a uma razão de 1: 1 do grânulo-a-célula. O aumento do número de grânulos por célula (isto é, a proporção do grânulo-a-célula) vai aumentar a intensidade de estimulação 25,26. As esferas são lavadas e re-suspensas em meio RPMI completo antes da sua adição às células. Note-se que tripanoazul mancha as esferas. - Cultura das células durante 12-72 horas a 37 ° C com 5% de CO 2 antes da análise com o contador de células automatizado.
5. Automated celular Coleção Contador de dados
- Antes de executar o exemplo, certifique-se de que as células são delicadamente misturadas com uma pipeta sorológica para evitar grumos. Isto é particularmente importante para os linfócitos activados devido a sua maior adesividade.
- Para culturas que são activadas com os grânulos de anti-CD3 / CD28, depois de pipetar, transferir a amostra para um tubo de centrífuga de 1,5 ml ou de 2 ml. Separar as contas, mantendo o tubo em um ímã para 1-2 min. Utilizar o sobrenadante contendo as células para análise.
NOTA: analisar tanto as células em repouso e activados dentro de 1 h para dar conta qualquer pré-activação das células em repouso por soro presente no meio de cultura. Após 12 h de PMA / ionomicina estimulação, um pequeno aumento no tamanho da célula era detectável (Figura 2 ). Em 72 h, sem aumento do tamanho celular significativa quando comparado com o observado 48 horas (dados não mostrados).
- Para culturas que são activadas com os grânulos de anti-CD3 / CD28, depois de pipetar, transferir a amostra para um tubo de centrífuga de 1,5 ml ou de 2 ml. Separar as contas, mantendo o tubo em um ímã para 1-2 min. Utilizar o sobrenadante contendo as células para análise.
- Transferir 1 ml da suspensão de células para um recipiente de amostra e executá-lo através do contador de células automatizado de acordo com as instruções do manual.
NOTA: Para cada um dos ensaios, um mínimo de 1 ml (máximo de 2 ml) de cultura de células deve ser usado. O contador de células automatizado utiliza uma seringa para misturar com azul de tripano a suspensão de células e passa-se a mistura azul de tripano de células-ao longo de um campo que é representada por imagem e analisados pelo software. O software detecta células coradas de azul tripano, desenha um círculo em torno de cada célula, e determina o diâmetro. 100 imagens são recolhidas a partir de cada amostra, e a viabilidade celular e tamanhos são determinados. O limiar de detecção do contador de células usado aqui tem um limite inferior de 5 uM. - Transferência de dados de cada corrida para uma planilha para análise posterior.
- Calibra-se o dispositivo numa base regular usando uma 1ml de amostra de 6 ^ m e 8 um diâmetro de grânulos de poliestireno.
NOTA: Os tamanhos do grânulo reais medidos pelo fabricante para cada lote deve ser usado, não o tamanho nominal. 6 e 8 mm grânulos são convenientes porque estes diâmetros são perto dos diâmetros esperados de descanso e células T ativadas (ver Figura 1).
6. Dados e Análise Estatística
- Analisar os dados utilizando software estatístico e gráficos apropriado.
NOTA: A folha de cálculo, para cada experiência contém o número de células com cada diâmetro (gama: 5 um a 70 um). As células acima de um diâmetro de 17 | iM são removidos a partir da análise para excluir as partículas de poeira e pequenas bolhas, as quais podem ser lidas como células viáveis pelo instrumento. - Realizar teste de hipóteses utilizando o teste t de Welch para conjuntos de dados com variância desigual; resultados são considerados estatisticamente significativos se p <0,001. A fórmula usada foi,

Onde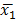 e
e 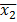 são médias amostrais,
são médias amostrais,  e
e 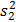 são variações de amostra e
são variações de amostra e 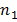 e
e  são tamanhos de amostra para cada conjunto de dados. O número de graus de liberdade é estimativa conservadora, usando o menor dos dois tamanhos de amostra para cada comparação. Os gráficos de barras são apresentados como a média ± SEM.
são tamanhos de amostra para cada conjunto de dados. O número de graus de liberdade é estimativa conservadora, usando o menor dos dois tamanhos de amostra para cada comparação. Os gráficos de barras são apresentados como a média ± SEM.
7. baço de linfócitos T ensaio de proliferação
- Medir a proliferação de células T utilizando um ensaio de proliferação ou MTS-leitor de placas colorimétrico baseado em MTT.
NOTA: O ensaio é a based em composto MTS tetrazólio (reagente de Owen) redução ao produto formazan solúvel, provavelmente por NADPH ou NADH produzido em células metabolicamente ativas por enzimas desidrogenases. - Contagem de células T purificadas com um hemocitómetro e re-suspender-los em completo RPMI-1640 a uma densidade final de 1 x 10 6 células / ml.
NOTA: DTT 1 mM pode ser adicionado às células nesta fase. - Activa as células com PMA e ionomicina, juntamente com os medicamentos de teste, caso seja necessário, e misturar suavemente (similar ao passo 4).
- Placa 100 uL de células em cada poço de uma cultura de células de placa tratada de 96 cavidades e incubar a 37 ° C com 5% de CO 2 durante 48 horas. Adicionar 100 ul de meio RPMI-1640 sem células para um poço para se obter uma leitura da absorvância do fundo.
- Adicionar 20 ul de reagente à base de MTS a cada poço e incubar a 37 ° C com 5% de CO 2 durante 4 horas.
- Efectuar as medições de absorvância a 490 nm utilizando um leitor de placas. a umbsorbance medições correspondem ao número de células metabolicamente activas em cada poço.
NOTA: Subtrair os níveis de fundo, se necessário. Os valores de absorvância de fundo depender do tipo de meio de cultura, soro, pH externo, e a duração da exposição de reagente MTS para luz. reagentes baseados em MTS são sensíveis à luz, e exposição à luz durante várias horas pode resultar em maiores valores de absorção de fundo.
Resultados
Utilizou-se este ensaio para comparar a formação de explosão durante a estimulação de linfócitos com PMA, um éster de forbol, e ionomicina, um ionóforo de cálcio. A Figura 1A mostra a distribuição de diâmetros de repouso e de células T do baço activadas farmacologicamente frequência. O tratamento das células com PMA / ionomicina durante ~ 2 dias resultou numa alteração significativa na média da direcção de distribuição de diâmetros maiores (ver, por exemplo de referência 4). O número de células com diâmetros menores foi assim reduzida. A fim de verificar que o nosso dispositivo relatou os diâmetros corretos, foram realizadas duas calibrações com esferas de poliestireno de 6 mm e 8 mm diâmetros (ver Tabela de Materiais). Figuras 1B e 1C mostram leituras a partir de células T ativadas sobrepostas com um 8 mm células T normais e descansando sobrepostas com uma padrão de 6 mm. Figura1D mostra os tamanhos de controle de contas relatadas pelo fabricante plotados contra os diâmetros médios medidos com o nosso contador de células automatizado. Verificou-se que o tamanho de 6 uM foi ligeiramente sobrestimada nas nossas medições, provavelmente devido ao limite de medição do instrumento tendo um limite inferior de 5 uM. No entanto, o desvio padrão dos diâmetros de grânulo calculados a partir das medições contador de células foi de acordo com o desvio padrão relatado pelo fabricante. Conclui-se a partir destas experiências que este dispositivo pode ser usado com fiabilidade para comparar tamanhos de repouso e de células T de rato estimuladas por mitogénio e que o dispositivo pode medir com precisão os diâmetros celulares reais.
Em seguida, procedeu-se testar a dependência do aumento de diâmetro médio da concentração de PMA e descobriram que, a uma concentração fixa de ionomicina 250 nM, o efeito de PMA foi não significativamente alterada pela elevando a sua concentração fROM de 2 a 250 ng / ml (Figura 2A). Usando o ensaio à base de MTS, foi medida a proliferação de células T a 50 e 250 ng / ml de PMA e não encontrou nenhuma diferença apreciável (Figura 2C), em acordo com os nossos dados relativos ao diâmetro da célula. Os medicamentos inibidores da calcineurina ciclosporina A (300 nM) e FK506 (1 nM) suprimiu tanto blastogénese (Figura 2B) e a proliferação (Figura 2C). A inibição não foi completa em ambos os casos, no entanto. As medições realizadas após 12 horas com PMA / ionomicina adição mostrou um aumento de 7,2% e 6,8% de diâmetro por 50 ng / mL e 250 ng / ml de PMA, respectivamente (Figura 2D). Tamanho aumenta a estas duas concentrações não foram significativamente diferentes, como foi o caso de 48 h de estimulação (comparar a Figura 2A).
Os dados relativos ao diâmetro das células coletadas de descanso e células T ativadas após 48 horas de PMA / ionomicina estimulação estão resumidos na Tabela 1. A área de superfície média e do volume de células T em repouso esplénicas de ratinho ICR foram 151,4 uM 2 e 1,9 x 10 -4 nl, respectivamente. A área de superfície média e do volume das células T activadas foram 300,6 uM 2 e 5,9 x 10 -4 nl, respectivamente. O aumento do diâmetro médio geral para todas as células activadas era 40,92% (Tabela 1).
Nós também testamos outros compostos químicos relatados para ser imunossupressores: ciclosporina, FK506, rapamicina, FTY720 e TRAM-34. Na Figura 3, as medições do tamanho celular obtido no repouso e activados células T na ausência e na presença de estas drogas são mostrados. CsA e FK506, que têm como alvo o factor nuclear dependente da calcineurina de células T activadas (NFAT) 27,28, foram os mais potentes, inibindo a resposta blastogênica por quase 72% (Figura 3A e 3B). Curiosamente, comaumento das concentrações de PMA, a potência de CsA e FK506 caiu ligeiramente, embora não houvesse nenhum aumento adicional diâmetro de célula na ausência destas drogas (Figura 2A e 2B). A rapamicina, um imunossupressor que inibe alvo da rapamicina em mamíferos (mTOR) 29,30, teve um efeito moderado, mas estatisticamente significativa (Figura 3A, 3B e 3C). FTY720 é um agonista do receptor da esfingosina 1-fosfato que inibe a saída de linfócitos em circulação 31 e foi recentemente encontrado para inibir TRPM7, um canal de cátions altamente expressa em linfócitos T 32. Ambos FTY720 e rapamicina teve um efeito comparável em blastogénese, reduzindo-o a partir da média de um aumento de 52% no diâmetro de aproximadamente 34% (Figura 3A e 3B). Tram-34 é um bloqueador do canal de potássio activado com cálcio KCa3.1 33. Testado a 700 nm, TRAM-34 foi ineficaz nas células T de murino, iN acordo com um estudo recente proliferação de células T humano; sua potência pode depender da natureza e da força de estimulação mitogénica 34 (Figura 3A e 3B). 700 nM Tram-34 foi eficaz no bloqueio dos canais KCa3.1 nas nossas experiências electrofisiologia patch clamp (dados não mostrados). Esta comparação foi feita entre repouso e as células expostas à droga em vários ensaios dentro da mesma experiência com 48 hr. Quando a rapamicina e CsA foram usados em conjunto, blastogénese foi completamente inibida (Figura 3C).
A activação de células T de murídeo com anti-CD3 / anti-esferas magnéticas revestidas com CD28 durante 72 h, produziu um aumento de 27% no diâmetro médio, o que foi reduzido para 5%, na presença de CsA (Figura 3D). células mononucleares humanos após PMA / ionomicina activação durante 48 h com aumento do diâmetro por 33%, e de activação na presença de CsA reduziu a resposta a 23% ( Figura 4).
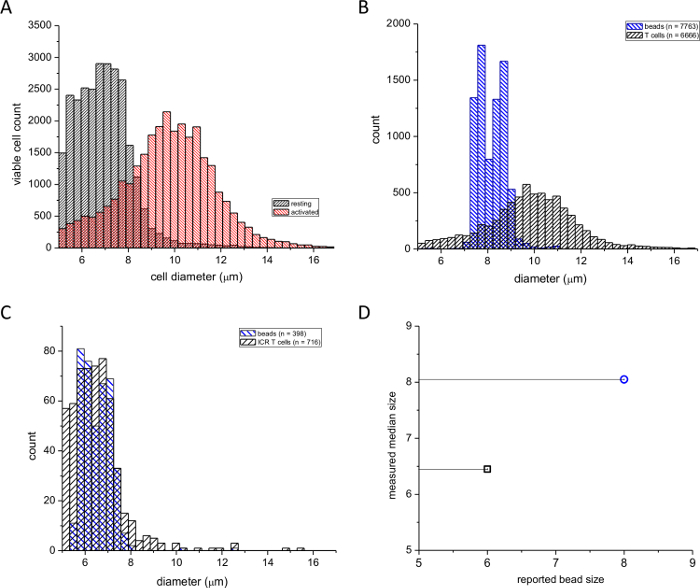
Figura 1: As distribuições de freqüência de diâmetros de células T esplénicas de ratinho. (A) colunas pretas indicam repouso e colunas vermelhas indicam células PMA / ionomicina-ativados (48 h). (B) As distribuições de células T esplénicas activadas, sobreposto, um padrão de calibração de tamanho de partícula de 8 um. (C) As distribuições de células T em repouso, sobreposto, um padrão de calibração de 6 um. Os números de células e de grânulos utilizados são indicados em caixas. (D) o diâmetro médio medido pelo contador de células em função do diâmetro do grânulo relatado pelo fabricante. Por favor clique aqui para ver uma versão maior desta figura.
dentro-page = "1"> 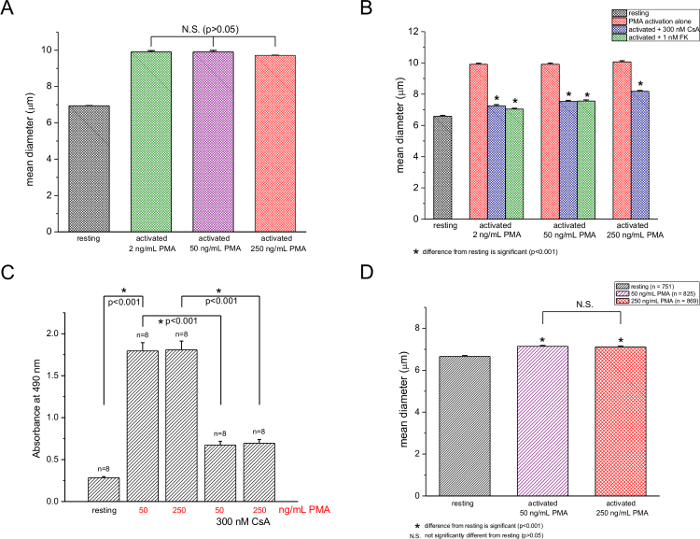
Figura 2: Dependência da activação de células T de murideo, a concentração de PMA. (A) os diâmetros médios das células T, quer não tratadas ou tratadas com 2, 50, e 250 ng / ml de PMA a uma concentração fixa de ionomicina (250 nM). Medições (B) contador de células de repouso e (2, 50, 250 ng / ml de PMA) células T activadas na ausência e na presença de 300 nM de CsA ou FK506 1 nM. (C) ensaio de proliferação de MTS a 50 e 250 ng / ml de PMA com 250 nM de ionomicina na ausência e na presença de 300 nM de CsA. diferenças significativas (p <0,001) são indicados com asteriscos. n é o número total de ensaios. Os dados são a partir de células isoladas a partir de 3 ratos. (D) O diâmetro celular de repouso e de células T activadas (250 ng / ml de PMA e ionomicina 250 nM) 12 h após a activação, na ausência e presença de 300 nM de CsA. pload / 55212 / 55212fig2large.jpg "target =" _ blank "> Clique aqui para ver uma versão maior desta figura.
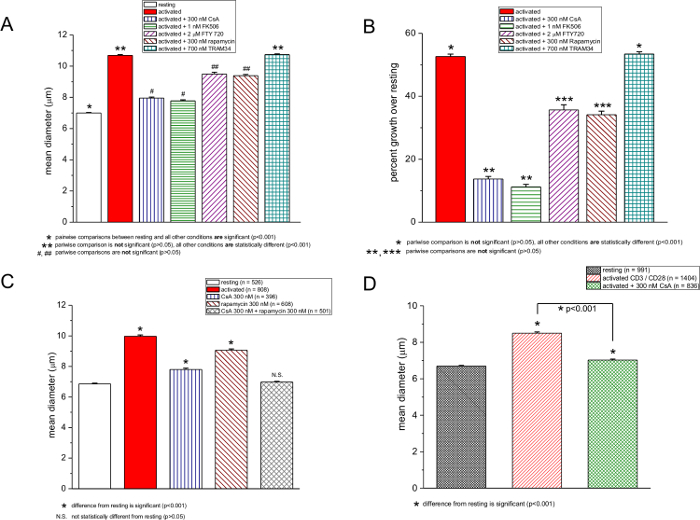
Figura 3: Efeitos da CsA, FK506, FTY720, rapamicina, e TRAM-34 no tamanho da célula. (A e C) os diâmetros médios das células T de murino ionomicina-activados com PMA / repouso e na ausência e presença de drogas. As concentrações são mostrados na caixa. (B) dados de um expresso como a percentagem de aumento sobre o diâmetro de células T em repouso. a activação dos linfócitos foi realizada com 250 ng / ml de PMA e ionomicina 250 nM, e as medições foram realizadas após 48 horas. (D) as medições contador de células de repouso e anti-CD3 / células T activadas por CD28, 72 h após a activação, na ausência e presença de 300 nM de CsA.rge.jpg "target =" _ blank "> Clique aqui para ver uma versão maior desta figura.

Figura 4: blastogénese em PBMCs humanos após estimulação mitogénio. (A) colunas pretas indicam repouso e colunas vermelhas indicam PBMC ativadas. (B) diâmetros médios de descanso e PBMC ativadas na ausência e na presença de 300 nM CsA. As células foram activadas com 250 ng / ml de PMA e ionomicina 250 nM, e as medições foram realizadas após 48 horas de activação. Por favor clique aqui para ver uma versão maior desta figura.
| column1 | Em repouso | ativado | CsA 100 nM | CsA 200 nM |
| Diâmetro médio | 6,94 mm | 9,78 mm | 8.19 mm | 7,92 mm |
| Aumento médio de diâmetro | 40,92% | 17.88% | 14,09% | |
| Área superficial média | 151.37 μm² | 300.61 μm² | 210.56 μm² | 197.22 μm² |
| Aumento médio na área de superfície | 98,59% | 39.00% | 30.16% |
Tabela 1: Resumo do diâmetro médio de célula e aumentos relativos na área de superfície. As medições foram realizadas 48 horas após a activação com 250 ng / ml de PMA e ionomicina 250 nM.
Discussão
Aqui, nós descrevemos uma técnica rápida para a detecção e quantificação de transformação blástica de células T utilizando um contador de células automatizado. Sob as nossas condições (250 ng / ml de PMA e ionomicina 250 nM de estimulação), a área de superfície celular foi aumentada de duas vezes o volume e três vezes após 48 horas de activação. O ensaio não é suficientemente sensível para detectar a detonação durante as primeiras 12 horas de activação, em que o volume da célula aumentou apenas 1,25 vezes em comparação com repouso (Figura 2D). Um mecanismo mais fisiologicamente relevante de activação de células T utilizando anticorpo anti-CD3 e anti-CD28 esferas magnéticas revestidas com anticorpo produzido uma resposta blastogênica significativa, com um aumento médio de 2,3 vezes em volume (72 h após a activação, a Figura 3D). Células mononucleares humanas mostrou uma alteração de 2,6 vezes em volume durante a PMA / ionomicina estimulação durante 48 horas (Figura 4). O diâmetro médio das células T ICR rato do baço e do volume foram determinados como sendo6,9 uM e 1,9 x 10 -4 nl, respectivamente. PBMC humanas (a partir de um dador saudável) tinha um diâmetro médio de 7,7 ^ m e um volume médio de 2,7 x 10 -4 nl. Usando este protocolo, que também testadas concentrações de PMA para aumentar a sua capacidade de activar as células T. Estes resultados de uma única célula foram consistentes com os ensaios de proliferação realizados em concentrações semelhantes PMA.
Vários compostos relatados para afectar a proliferação de células foram testados: FTY720 31,32; o imunossupressores ciclosporina A, FK506, rapamicina e 27,28; e TRAM-34, um bloqueador de canais de KCa3.1 activados pelo cálcio 33,35. Descobrimos que, nas concentrações testadas, os inibidores mais potentes da blastogênese foram CsA e FK506. A rapamicina teve um efeito supressor mais pequeno, mas estatisticamente significativo sobre a blastogénese. Tram-34, por outro lado, não afectou a blastogénese.
CsA suprimida tanto blastogénese e proliferation, mas não completamente (Figura 2B e 2C), o que demonstra que a medição contador de células automatizado é uma boa correlação da eficiência de drogas na proliferação de células-T. Na presença de rapamicina juntamente com CsA, blastogénese foi completamente inibida, o que sugere que as vias de NFAT- e mTOR mediadas em combinação pode inteiramente responsáveis por alargamento de células T mediante a estimulação mitogénica com PMA / ionomicina (Figura 3C).
A gama dinâmica de alguns ensaios de proliferação é limitada (ver Figura 2). Os ensaios de proliferação, tais como a que temos utilizado (Figura 2C), relatam um sinal que inclui contribuições de células apoptóticas e necróticas. medições automatizadas de mudança de diâmetro não têm essa limitação, como as medições referem-se a células viáveis apenas. A viabilidade celular é avaliada pela exclusão do corante azul de tripano de células saudáveis, viáveis. Em medições de tamanho, usando a frentedispersão de luz em citometria de fluxo discriminação celular gibão pode ser problemático 22. Nas medições de contador de células automatizado, não foi encontrado população dupleto (Figura 1). Além disso, a medição foi suficientemente preciso para distinguir entre os efeitos de 100 e 200 nM de ciclosporina (Tabela 1) e para detectar blastogénese dentro de 12 h de estimulação mitogénica (Figura 2D).
Este novo ensaio é particularmente útil para um pequeno número de amostras. Até 15 amostras podem ser medidos em 1 h. No entanto, o ensaio tem as suas limitações, a maioria dos quais pode ser mitigados. Mesmo que pode resolver eficazmente diferença pequena (<1 mm) de diâmetro de células, o modelo de máquina, usado tem um limite inferior de detecção de 5 uM. Este limite pode causar a superestimação do tamanho das células muito pequenas, uma vez que efetivamente exclui todas as células com diâmetros menores. No entanto, os modelos mais recentes do contador de células têm limiar de detecçãoidade de ~ 2 mm, que deve aliviar este problema. Se houver demasiada detritos na amostra, o instrumento trata-los como células viáveis. Além disso, as bolhas de ar podem ocasionalmente entrar na célula de fluxo e causar distorção das imagens das células capturadas pela máquina. A distorção não pareceu afectar a determinação da viabilidade, mas pode afectar os diâmetros medidos. Portanto, recomenda-se que todas as imagens devem ser verificados pelo experimentador para as bolhas de ar antes de os dados de cada ensaio são aceites para análise. Uma vez que o software só chama círculos em torno das células, diâmetros de células não esféricas podem ser inclinada na direcção do eixo longo, tornando o ensaio menos adequados para células não esféricas.
Este ensaio é rápido, tendo cerca de quatro minutos por amostra, em comparação com os ensaios de proliferação, as quais requerem algumas horas. A coleta de dados também é bastante simples utilizando o software incluído com o dispositivo. O software pode exportar dados de medição para um spreadsheet para análise. Finalmente, é uma única célula, em oposição a uma população, de medição; tanto blastogénese e proliferação são medidos; e distingue entre células viáveis e mortas simultaneamente. Ele pode ser usado para avaliar várias estirpes de ratinho quanto à sua capacidade para montar uma resposta imune. O ensaio também pode ser utilizado com êxito para a medição de blastogénese de células T de dadores humanos (Figura 4), e que também pode ser usado em outros tipos de células.
Aumento do volume celular são conhecidos por contribuir para a regulação do metabolismo: inchaço celular estimula a síntese de glicogênio induzida por glutamina e lipogênese em hepatócitos 36,37. Neutrófilos exibir aumentos de volume associado com a migração de 35-60%, enquanto agentes quimiotáticos induzir 10-15% inchaço 38-40. O ensaio corrente podem potencialmente ser utilizados para estudar estes processos.
Divulgações
The authors have no competing financial interests.
Agradecimentos
We thank Lucile Wrenshall for the use of the plate reader, Nancy Bigley for useful discussion, and Tom Brown for the gift of ICR mice. This work was funded by grant 1R01AI114804 from the National Institute of Allergy and Infectious Diseases and by WSU Faculty Development funds (to J.A.K.). J.N.G. was supported in part by the National Institute of General Medical Sciences grant R25GM090122.
Materiais
| Name | Company | Catalog Number | Comments |
| RPMI-1640 | Lonza | BW12-702F | |
| 40 μm nylon cell strainers | Thermo Fisher Scientific | 22363547 | |
| nylon wool fiber columns | Polysciences, Inc. | 21759-1 | |
| 50 ml conical tubes | The Lab Depot | TLD431697 | |
| 6-well cell culture treated plates | USA Scientific | CC7682-7506 | |
| 96-well cell culture treated plates | Thermo Fisher Scientific | 130188 | |
| Dimethyl sulfoxide (DMSO) | Fisher BioReagents | BP231-100 | |
| CellTiter 96 AQueous One Solution Cell Proliferation Assay | Promega | G3582 | MTS based assay |
| Cyclosporine A | Sigma-Aldrich | 30024 | |
| FK506 | Cayman Chemical Company | 104987-11-3 | |
| Rapamycin | Santa Cruz Biotechnology | sc-3504 | |
| TRAM-34 | Sigma-Aldrich | T6700 | |
| FTY720 | Sigma-Aldrich | SML0700 | |
| Dynabeads Mouse T-Activator CD3/CD28 | Gibco | 11456D | |
| Phorbol 12-myristate 13-acetate (PMA) | Acros Organics | 356150010 | |
| Ionomycin calcium salt | Sigma-Aldrich | I0634 | |
| Penicillin-Streptomycin | MP Biomedicals | ICN1670049 | 100x stock |
| Dulbecco’s phosphate buffered saline (DPBS) | HyClone | SH30378.02 | 10x stock |
| 1,4-dithiothreitol (DTT) | Research Products International | 12/3/3483 | reducing agent |
| 8 µm micro particle size standard | Sigma-Aldrich | 84192-5ML-F | Actual 8.02 µm |
| 6 µm micro particle size standard | Sigma-Aldrich | 89756-5ML-F | Actual 6.084 µm |
| Single magnetic separation stand for 1.5 - 2 ml tube | V&P Scientific, Inc. | VP772F5 | |
| Cell culture incubator | Forma Scientific | 3110 | |
| Synergy H1 hybrid reader | Bio Tek | BTH1M | |
| Vi-CELL cell viability analyzer | Beckman Coulter | 731050 |
Referências
- Weiss, A., Samelson, L. E., Paul, W. E. T-lymphocyte activation. Fundamental Immunology. , 321-364 (2003).
- Gergely, P., Ernberg, I., Klein, G., Steinitz, M. Blastogenic response of purified human T-lymphocyte populations to Epstein-Barr virus (EBV). Clin Exp Immunol. 30 (3), 347-353 (1977).
- Sanderson, R. J., Rulon, K., Groeneboer, E. G., Talmage, D. W. The response of murine splenic lymphocytes to concanavalin A and to co-stimulator. J Immunol. 124 (1), 207-214 (1980).
- Decoursey, T. E., Chandy, K. G., Gupta, S., Cahalan, M. D. Mitogen induction of ion channels in murine T lymphocytes. J Gen Physiol. 89 (3), 405-420 (1987).
- Nibbering, P. H., Zomerdijk, T. P., Tilburg, A. J., Furth, R. V. Mean cell volume of human blood leucocytes and resident and activated murine macrophages. J Immunol Methods. 129 (1), 143-145 (1990).
- Segel, G. B., Cokelet, G. R., Lichtman, M. A. The measurement of lymphocyte volume: importance of reference particle deformability and counting solution tonicity. Blood. 57 (5), 894-899 (1981).
- Cooper, H. L., Braverman, R. Protein synthesis in resting and growth-stimulated human peripheral lymphocytes. Evidence for regulation by a non-messenger RNA. Exp Cell Res. 127 (2), 351-359 (1980).
- Cooper, H. L., Braverman, R. Close correlation between initiator methionyl-tRNA level and rate of protein synthesis during human lymphocyte growth cycle. J Biol Chem. 256 (14), 7461-7467 (1981).
- Teague, T. K., et al. Activation changes the spectrum but not the diversity of genes expressed by T cells. Proc Natl Acad Sci U S A. 96 (22), 12691-12696 (1999).
- Tzur, A., Kafri, R., Lebleu, V. S., Lahav, G., Kirschner, M. W. Cell growth and size homeostasis in proliferating animal cells. Science. 325 (5937), 167-171 (2009).
- Messele, T., et al. Nonradioactive techniques for measurement of in vitro T-cell proliferation: alternatives to the [3H]thymidine incorporation assay. Clin Diagn Lab Immunol. 7 (4), 687-692 (2000).
- Maghni, K., Nicolescu, O. M., Martin, J. G. Suitability of cell metabolic colorimetric assays for assessment of CD4+ T cell proliferation: comparison to 5-bromo-2-deoxyuridine (BrdU) ELISA. J Immunol Methods. 223 (2), 185-194 (1999).
- Weichert, H., Blechschmidt, I., Schröder, S., Ambrosius, H. The MTT-assay as a rapid test for cell proliferation and cell killing: application to human peripheral blood lymphocytes (PBL). Allerg Immunol (Leipz). 37 (3-4), 139-144 (1991).
- Huang, K. T., Chen, Y. H., Walker, A. M. Inaccuracies in MTS assays: major distorting effects of medium, serum albumin, and fatty acids. Biotechniques. 37 (3), 410-412 (2004).
- Rampersad, S. N. Multiple applications of Alamar Blue as an indicator of metabolic function and cellular health in cell viability bioassays. Sensors (Basel). 12 (9), 12347-12360 (2012).
- Quent, V. M., Loessner, D., Friis, T., Reichert, J. C., Hutmacher, D. W. Discrepancies between metabolic activity and DNA content as tool to assess cell proliferation in cancer research. J Cell Mol Med. 14 (4), 1003-1013 (2010).
- Augustine, N. H., Pasi, B. M., Hill, H. R. Comparison of ATP production in whole blood and lymphocyte proliferation in response to phytohemagglutinin. J Clin Lab Anal. 21 (5), 265-270 (2007).
- Sottong, P. R., Rosebrock, J. A., Britz, J. A., Kramer, T. R. Measurement of T-lymphocyte responses in whole-blood cultures using newly synthesized DNA and ATP. Clin Diagn Lab Immunol. 7 (2), 307-311 (2000).
- Wallace, P. K., Muirhead, K. A. Cell tracking 2007: a proliferation of probes and applications. Immunol Invest. 36 (5-6), 527-561 (2007).
- Quah, B. J., Warren, H. S., Parish, C. R. Monitoring lymphocyte proliferation in vitro and in vivo with the intracellular fluorescent dye carboxyfluorescein diacetate succinimidyl ester. Nat Protoc. 2 (9), 2049-2056 (2007).
- Teague, T. K., Munn, L., Zygourakis, K., Mcintyre, B. W. Analysis of lymphocyte activation and proliferation by video microscopy and digital imaging. Cytometry. 14 (7), 772-782 (1993).
- Böhmer, R. M., Bandala-Sanchez, E., Harrison, L. C. Forward light scatter is a simple measure of T-cell activation and proliferation but is not universally suited for doublet discrimination. Cytometry A. 79 (8), 646-652 (2011).
- Lee, J., Sadelain, M., Brentjens, R. Retroviral transduction of murine primary T lymphocytes. Methods Mol Biol. 506, 83-96 (2009).
- Gunzer, M., Weishaupt, C., Planelles, L., Grabbe, S. Two-step negative enrichment of CD4+ and CD8+ T cells from murine spleen via nylon wool adherence and an optimized antibody cocktail. J Immunol Methods. 258 (1-2), 55-63 (2001).
- Trickett, A., Kwan, Y. L. T cell stimulation and expansion using anti-CD3/CD28 beads. J Immunol Methods. 275 (1-2), 251-255 (2003).
- Pène, J., Rahmoun, M., Temmerman, S., Yssel, H. Use of anti-CD3/CD28 mAb coupled magnetic beads permitting subsequent phenotypic analysis of activated human T cells by indirect immunofluorescence. J Immunol Methods. 283 (1-2), 59-66 (2003).
- Sigal, N. H., Dumont, F. J. Cyclosporin A, FK-506, and rapamycin: pharmacologic probes of lymphocyte signal transduction. Annu Rev Immunol. 10 (1), 519-560 (1992).
- Fruman, D. A., Klee, C. B., Bierer, B. E., Burakoff, S. J. Calcineurin phosphatase activity in T lymphocytes is inhibited by FK 506 and cyclosporin A. Proc Natl Acad Sci U S A. 89 (9), 3686-3690 (1992).
- Pollizzi, K. N., Waickman, A. T., Patel, C. H., Sun, I. H., Powell, J. D. Cellular size as a means of tracking mTOR activity and cell fate of CD4+ T Cells upon antigen recognition. PLoS One. 10 (4), e0121710 (2015).
- Pollizzi, K. N., Powell, J. D. Regulation of T cells by mTOR: the known knowns and the known unknowns. Trends Immunol. 36 (1), 13-20 (2015).
- Mandala, S., et al. Alteration of lymphocyte trafficking by sphingosine-1-phosphate receptor agonists. Science. 296 (5566), 346-349 (2002).
- Qin, X., et al. Sphingosine and FTY720 are potent inhibitors of the transient receptor potential melastatin 7 (TRPM7) channels. Br J Pharmacol. 168 (6), 1294-1312 (2013).
- Wulff, H., Kolski-Andreaco, A., Sankaranarayanan, A., Sabatier, J. M., Shakkottai, V. Modulators of small- and intermediate-conductance calcium-activated potassium channels and their therapeutic indications. Curr Med Chem. 14 (13), 1437-1457 (2007).
- Petho, Z., et al. The anti-proliferative effect of cation channel blockers in T lymphocytes depends on the strength of mitogenic stimulation. Immunol Lett. 171, 60-69 (2016).
- Wulff, H., et al. Design of a potent and selective inhibitor of the intermediate-conductance Ca2+-activated K+ channel, IKCa1: a potential immunosuppressant. Proc Natl Acad Sci USA. 97 (14), 8151-8156 (2000).
- Lang, F., et al. Functional significance of cell volume regulatory mechanisms. Physiol Rev. 78 (1), 247-306 (1998).
- Hue, L. Control of liver carbohydrate and fatty acid metabolism by cell volume. Biochem Soc Trans. 22 (2), 505-508 (1994).
- O'Flaherty, J. T., Kreutzer, D. L., Ward, P. A. Neutrophil aggregation and swelling induced by chemotactic agents. J Immunol. 119 (1), 232-239 (1977).
- Hsu, L. S., Becker, E. L. Volume changes induced in rabbit polymorphonuclear leukocytes by chemotactic factor and cytochalasin B. Am J Pathol. 81 (1), 1-14 (1975).
- Rosengren, S., Henson, P. M., Worthen, G. S. Migration-associated volume changes in neutrophils facilitate the migratory process in vitro. Am J Physiol. 267, C1623-C1632 (1994).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados