Method Article
Quantification rapide de blastogenesis mitogene induite dans les lymphocytes T pour l'identification des médicaments immunomodulateurs
Dans cet article
Résumé
T-lymphocyte mitogenesis is accompanied by blastogenic transformation, whereupon the cell volume enlarges before cell division. Here, we describe a method to quantify blastogenesis in T lymphocytes using an automated cell counter with the capability of measuring cell diameters.
Résumé
La prolifération des lymphocytes en réponse à antigéniques ou la stimulation mitogénique est un phénomène facilement quantifiable utile pour les tests immunomodulateur (c. -à- immunosuppressive ou immunostimulante) composés chimiques et biologiques. L'une des premières étapes lors de la mitogenèse est l'élargissement de la cellule ou la transformation blastogénique, après quoi le volume cellulaire augmente avant la division. Il est habituellement détectable dans les premières heures de stimulation des lymphocytes T. Ici, nous décrivons une méthode rapide pour quantifier les lymphocytes T dans blastogenèse isolés à partir de rates de souris et des cellules mononucléées périphériques humaines du sang (PBMC) en utilisant un compteur de cellules automatisé. Divers tests de prolifération couramment utilisés pour la plupart sont laborieux et ne reflètent que l'effet global de la population plutôt que des effets cellulaires individuels au sein d'une population. En revanche, le dosage automatique de compteur de cellule présenté fournit des mesures directes, rapides et précises des diamètres de cellules qui peuvent êtreutilisé pour évaluer l'efficacité de divers mitogènes et médicaments immunomodulateurs in vitro.
Introduction
Les lymphocytes T sont les cellules primaires responsables de l'immunité adaptative chez les mammifères. Il est connu qu'ils répondent à des peptides antigéniques spécifiques présentés par les molécules du CMH sur la surface des cellules présentatrices d'antigène. Lors de l'activation d'un récepteur de lymphocytes T apparenté (RCT), la cellule élargit dans un processus appelé transformation blastogène ou blastogénèse. Ce processus est détectable dans le ~ 6 premières heures après le stimulus est appliqué 1. Au cours de la blastogenèse, les volumes des cellules T individuelles augmentent de 2 à 4 fois 2-6. Les lymphocytes commencent à proliférer dans un processus appelé expansion clonale, dont le but est de générer autant de clones des cellules portant des TCR spécifiques d'un antigène que possible. Les cellules de la descendance exercent alors leur fonction immunologique par différenciation en cytotoxiques (CD8 +) ou helper (CD4 +) lymphocytes T effecteurs. Ainsi, les lymphocytes T naïfs dans le sang humain ou de souris sont dans la phase G 0 ( au repos) de la cellulele cycle et le soutien de l'activité métabolique minimale. Lors de l' exposition à des antigènes ou des mitogenes, des lymphocytes T rentrent dans le cycle cellulaire, avec une stimulation simultanée de la transcription et la synthèse protéique 7-10. Mitogenes, tels que le phorbol 12-myristate 13-acétate (PMA) et l' ionomycine stimuler les lymphocytes via l'activation de la protéine kinase C (PKC) et la signalisation de Ca2 + -dépendante voies 1. L'activation des cellules par le PMA / ionomycine T contourne les étapes de signalisation du TCR.
La prolifération des essais in vitro sont largement utilisés dans le but d'évaluer la fonction des lymphocytes et la réponse à des stimuli. lectures de prolifération sont généralement pris un à trois jours après le début de la stimulation des cellules T et reflètent l'état collectif de centaines ou de milliers de cellules. La puissance des divers mitogenes et immunomodulateurs in vitro peut être évalué simplement en mesurant le taux de prolifération en présence de ces composés. Certains d'entre eux unssays et leurs limites sont discutés ci-dessous.
Pour directement le nombre de cellules de comptage, la procédure prend du temps, avec une forte probabilité d'erreurs de l'opérateur.
Pour la synthèse de l'ADN, le dosage de l'incorporation de 3H-thymidine mesure la synthèse d'ADN, mais sa limitation majeure est sa radiotoxicité. Une alternative non radioactif est BrdU, mais la plage de réponse linéaire de la croissance cellulaire est limitée, et le traitement de l' anticorps est nécessaire, ce qui augmente le nombre d'étapes dans la procédure 11,12.
Pour l'activité métabolique, sels de tétrazolium (MTT, MTS, XTT, et WST-1) et résazurine essais colorimétriques à base de colorants signalent l'état métabolique général de la division des populations cellulaires. Cependant, le MTT est pas soluble dans le milieu de culture, ce qui nécessite des étapes de lavage supplémentaires, incorporant ainsi des erreurs dans la mesure; XTT a besoin de composants supplémentaires pour réduire efficacement; MTS-, WST-1-, et des mesures sur la base résazurine-sont affectenté par le milieu de culture et de son pH du sérum de composants, l' albumine ou le rouge de phénol 13-16. Ces essais ne mesurent pas le nombre réel de cellules viables, mais plutôt d'estimer les activités combinées de l'enzyme. Par conséquent, le taux de prolifération ne peut pas être déterminé avec précision par des analyses métaboliques , en raison de la corrélation non linéaire entre le nombre de cellules et la réduction du colorant 12,17.
Pour mesurer la concentration d'ATP, l'augmentation induite par activation des lymphocytes T dans l'ATP en corrélation avec la prolifération. Cependant, l'élévation de l'ATP intracellulaire est une des étapes initiales de l'activation des lymphocytes T; de nombreuses étapes est derrière la prolifération réelle 17,18.
Pour l'essai de dilution de colorant, colorant fluorescent CFSE colore les cellules en se liant de façon covalente à des protéines intracellulaires. Le colorant montre une diminution de la prolifération dépendante de l'intensité de fluorescence, qui permet de suivre le nombre de divisions cellulaires. Toutefois, en raison covalente marquage des protéines, des fonctions de celles-ciles protéines peuvent être compromises. Le colorant est toxique pour les cellules à des concentrations plus élevées. À des concentrations de colorant plus basses, toutefois, l'intensité de fluorescence initiale est réduite, ce qui diminue le nombre de divisions cellulaires qui peuvent être suivis. En outre, après marquage avec CFSE, il y a une perte de 50% de la prolifération indépendante ~ de fluorescence initiale au cours de la première période de 24 à 48 heures, ce qui limite la plage dynamique de ce test 19,20.
La plupart de ces essais reflètent l'état collectif d'un grand nombre de cellules et nécessitent le traitement des cellules avec des colorants fluorescents. Les cellules nécrotiques et apoptotiques peuvent également contribuer à ces mesures, à moins qu'ils ne soient retirés de l'analyse par coloration avec des produits chimiques ou des anticorps.
Blastogenèse lymphocytaire peut être évaluée par une variété de méthodes, telles que la microscopie optique , cytométrie de flux ou 4,21,22. Ici, nous décrivons une méthode rapide pour la mesure des tailles des cellules T en utilisant unn automatisé compteur de cellules, qui recueille des images de cellules en temps réel qui sont stockés et peuvent être ré-analysés à un moment ultérieur. En plus des mesures de taille, cet appareil fournit des numéros de cellules précises et le pourcentage de cellules viables, tel que déterminé par trypan exclusion du bleuissement. Le dispositif utilisé dans ce protocole est disponible dans le commerce, et le fabricant a testé la précision de l'instrument à l'aide de trois instruments différents et plusieurs contrôles de concentration et de viabilité. Les résultats de ces études ont démontré un coefficient de variance qui est généralement inférieure à 6%. Comme il est indiqué dans le protocole, le dispositif est calibré sur une base régulière avec 6 pm et 8 pm perles diamètre de polystyrène. Les avantages de l'utilisation d'un compteur de cellules pour différencier les cellules T au repos et T lymphoblastes en fonction du diamètre des cellules est la facilité d'utilisation et de la nature automatisée de l'analyse. Le logiciel est capable de tracer un cercle autour de chaque cellule et en calculant le diamètre des cellules. En outre, l'imâges sont visibles à l'opérateur, qui peut vérifier l'exactitude de l'instrument dans l'identification des cellules et correctement tracer un cercle autour d'eux. En termes de limitations, l'instrument ne peut pas en soi une distinction entre les débris et les cellules; Par conséquent, il est important que l'opérateur visualise chaque image telle qu'elle est traitée. Il y a une possibilité d'incorporer des bulles d'air, ce qui réduit le nombre de champs utilisables pour l'analyse; cependant, ce qui est rare si l'entretien régulier de rinçage est effectuée.
Dans cette étude, des groupes de lymphocytes T spléniques ont été stimulées par l'ionomycine et l'augmentation des concentrations de PMA pendant 12 à 48 heures. Les concentrations de PMA aussi faibles que 2 ng / ml, induit à la fois une réponse blastogénique solide et une prolifération significative. Les mesures des effets de plusieurs médicaments, tels que la cyclosporine immunosuppresseur A (CsA), le FK506 (tacrolimus), et la rapamycine (sirolimus), ainsi que des bloqueurs de canaux ioniques TRAM-34 et FTY720 (fingolimod), sur blastogenesis a démontré un bon accord avec les effets signalés sur la prolifération. La réponse blastogénique des PBMC humaines au PMA / ionomycine et la stimulation des lymphocytes T de souris avec un anticorps anti-CD3 et anti-CD28 billes magnétiques revêtues d'anticorps ont également été mesurés.
Le compteur de cellules test quantifie blastogenesis et le taux de prolifération (densité cellulaire) simultanément mais séparément, contrairement aux méthodes mentionnées ci-dessus, qui ressemblent à une combinaison de ces effets. Le protocole présenté fournit une technique rapide et robuste pour l'évaluation de l'activité des agents mitogenes et immunomodulatrices.
Protocole
Toutes les expériences sont réalisées conformément aux protocoles approuvés par le Conseil de l'Université Lab Animal Care et l'utilisation Comité et Institutional Review Wright State.
REMARQUE: Les PBMC humaines sont isolées par gradient de densité de Ficoll procédé de centrifugation 5.
1. Spleen Récolte
- Maison adultes de souris ICR femelles dans des conditions de laboratoire standard avec les aliments, l' eau, les exigences et de literie spécifiques à l'espèce.
NOTE: Les animaux avaient un âge moyen de 2,9 mois et un poids moyen de 30,4 g au moment de l'euthanasie. - À la date de l'isolement (DOI), euthanasier les animaux individuellement sans autres animaux conspécifiques présents. Faire tous les efforts pour assurer un minimum de stress à la souris. Euthanasier utilisant le CO 2 à la dislocation cervicale secondaire pour assurer la mort.
- Placez l'animal, toujours à l' intérieur de la cage de transfert, dans la chambre de CO 2 et de statempérature ambiante, le flux de gaz à 5 L / min. Ce débit déplace l'oxygène à la recommandation 10-30% par min.
- Après que l'animal est inconscient, d' augmenter le débit de CO 2 et 15 L / min. Vérifiez l'animal à l'arrêt de la respiration et de laisser dans la chambre pendant 2 min.
- Appliquer dislocation cervicale avec une force de distraction pour assurer la mort.
- Récolter la rate de l'animal en utilisant une technique aseptique à moins de 10 min de la mort.
- Stériliser les deux ensembles de ciseaux et des pinces pour l'ablation de la rate dans un four autoclave avant utilisation. Stériliser la surface de dissection par application d'éthanol à 70%.
- Appliquer 70% d'éthanol dans l'abdomen de la souris. L'utilisation d'un ensemble de ciseaux et des pinces, faire une coupe dans la fourrure et de la peau à partir du côté gauche de l'abdomen, puis tirer à part et peler la peau pour révéler le péritoine. Une fois exposée, appliquer une solution de chlorhexidine à 4% avant l'ouverture du péritoine.
- Utilisation de la deuxième série de sciencessors et forceps, faire un 2 à 3 cm découpe le long de l'abdomen central. Ouvrez le péritoine et enlever la rate en coupant les attachements viscéraux et l'excès de graisse. Placer la rate dans un tampon phosphate salin de Dulbecco (DPBS).
2. Préparation des premières splénocytes
REMARQUE: Effectuer toutes les étapes sous une armoire flux de biosécurité laminaire en utilisant une technique aseptique.
- Faire tremper les rates récoltées dans 10 ml de désionisée H 2 O stérile pendant 5 min dans une boîte de culture de 10 cm pour lyser les érythrocytes de surface.
REMARQUE: Cette étape peut être omise si la rate a été endommagé lors de l'isolement. - Pour libérer les splénocytes, écraser les rates entre deux lames de verre stérilisés (côté givré face à la rate) sur une boîte de culture de 10 cm frais. Mélanger avec 10 ml de RPMI-1640 supplémenté avec 10% de sérum bovin fœtal, 2 mM de L-glutamine, 50 UI / ml de pénicilline et 50 pg / ml de streptomycine (ci-après fait référence à uns RPMI complet).
- Filtrer les cellules à travers une cellule de 40 um nylon filtre stérile dans une nouvelle boîte de culture de 10 cm pour retirer le tissu conjonctif et les débris.
- Lyser les globules rouges restants de : en ajoutant 20 ml de tampon de lyse RBC composée de 155 mM de NH4CI, 10 mM de NaHCO 3 et 0,1 mM d' EDTA à pH 7,4 et ~ 300 mOsm / L.
NOTE: L'osmolalité est mesurée par un point de congélation ou d'un osmomètre à pression de vapeur.- Transférer les cellules de la plaque de 10 cm dans un tube conique de 50 ml et on centrifuge à 250 g pendant 10 min (4 ° C).
- Retirer le surnageant, ajouter 20 ml de tampon de lyse RBC, et remettre en suspension les cellules sédimentées par pipetage.
- Incuber à température ambiante dans le tampon de lyse pendant 10 min avec doux balancement.
- Centrifuger pendant 10 min à 250 x g (4 ° C) pour sédimenter les cellules. Verser le tampon de lyse.
- Remettre en suspension les cellules dans 10 ml de RPMI complet et centrifuger à nouveau (250 xg, 10 min, 4 ° C). Disqueard le surnageant.
- Remettre en suspension les splénocytes dans 2 ml de RPMI complet chauffé à 37 ° C pour transvaser dans la colonne de nylon de fibres de laine.
3. Purification de lymphocytes T
- Laver les colonnes de laine de nylon à deux reprises avec 5 ml de RPMI complet. Incuber à 37 ° C dans une culture cellulaire CO 2 incubateur à 5% pendant 1 heure.
NOTE: Il est impératif de maintenir la laine de nylon humide pendant toute la durée de l'expérience et d'utiliser RPMI complet chauffé à 37 ° C pour toutes les étapes d'isolation de laine de nylon. - Ajouter des splénocytes isolés à la colonne et on incube pendant 1 heure pour permettre aux cellules B, les fibroblastes et les cellules accessoires à adhérer à la laine de nylon.
- Ajouter 2 ml de RPMI contenant les splénocytes dans la colonne et passe à travers jusqu'à ce que la partie supérieure de la laine de nylon est atteinte.
- Ajouter 2 ml de RPMI complet chauffé à 37 ° C au-dessus de la laine de nylon et de passer le milieu à travers la lainejusqu'à ce que le niveau du liquide atteint la surface supérieure.
- Ajouter 3 ml de chaud RPMI complet à la colonne pour couvrir complètement la laine de nylon.
- Incuber la colonne chargée non perturbée dans un 37 ° C, 5% de CO 2 incubateur de culture cellulaire pendant 1 h.
- Éluer les cellules par lavage de la colonne deux fois avec 5 ml de RPMI complet. Effectuer un lavage supplémentaire des cellules éluées par centrifugation.
- Remplir la colonne 2 derniers fois avec RPMI complet et laisser la solution dans la colonne de circuler à travers dans un tube conique stérile de 50 ml.
REMARQUE: Évitez taraudage ou de heurter la colonne, qui peut déloger les cellules B, les cellules accessoires, et les fibroblastes adhérant à la laine de nylon. - Recueillir la fraction et de spin accréditives à 250 xg pendant 10 min (4 ° C) pour sédimenter les cellules. Laver une fois avec 10 ml de RPMI complet. Sédimenter les cellules à nouveau (250 x g, 10 min, 4 ° C) et remettre en suspension dans 2 ml de RPMI complet.
- Mesurer la c densité ell utilisant un hémocytomètre et on dilue dans du RPMI complet à 0,5 x 10 6 cellules / ml.
- Semences 1 ou aliquotes de 2 ml de cellules dans chaque puits d'une plaque de culture cellulaire 24 ou 6 puits, respectivement, et la culture des cellules à 37 ° C avec 5% de CO 2.
NOTE: 1 mM de 1,4-dithiothréitol (DTT) peut être ajouté à chaque puits à ce stade pour améliorer la survie des cellules T. - Facultatif: Confirmez l'efficacité du protocole d'isolement par cytométrie de flux. Ce protocole donne normalement ~ 80% des lymphocytes T 23.
NOTE: les cellules de laine purifiée nylon contiennent environ 50% CD4 + et 23% cellules CD8 +. Pour purifier les cellules CD4 + et CD8 + en outre les sous - populations, une seule étape de déplétion immunomagnétique peut être réalisée à l' aide de huit anticorps et des billes magnétiques 24. En variante, plus pur CD4 + et les populations de lymphocytes T CD8 + peuvent être isolées par sélection positive ou négative avec des anticorps spécifiques.
- Remplir la colonne 2 derniers fois avec RPMI complet et laisser la solution dans la colonne de circuler à travers dans un tube conique stérile de 50 ml.
- Activer les lymphocytes T dans les 24 heures d'isolement par l'ajout de PMA et ionomycine sel de calcium ou de billes magnétiques recouvertes d'anti-CD28 des anticorps anti-CD3 23,25,26 et. Ajouter des médicaments expérimentaux (par exemple, CsA, FK506, la rapamycine, TRAM-34, et FTY720) au moment de l' activation.
Remarque: ici, les concentrations de PMA varie de 2 à 250 ng / ml, et la concentration ionomycine a été maintenue à 250 nm. Si possible, les dilutions doivent être préparées à partir de stocks aliquotes de chaque médicament de telle sorte que le volume ajouté à chaque puits de cellules est ≥1 ul pour assurer la reproductibilité. des billes magnétiques anti-CD3 / anti-CD28 enrobées sont ajoutées à un rapport 1: 1 bourrelet à cellule. L' augmentation du nombre de billes par cellule (ie, le rapport bourrelet à cellule) va augmenter l'intensité de la stimulation 25,26. Les billes sont lavées et remises en suspension dans RPMI complet avant leur addition aux cellules. On notera que trypanbleu colore les perles. - La culture des cellules pendant 12-72 heures à 37 ° C avec 5% de CO 2 avant l' analyse avec le compteur de cellules automatisé.
5. Cellule automatisée Collection Compteur de données
- Avant d' exécuter l'exemple, assurez - vous que les cellules sont mélangés doucement avec une pipette sérologique pour éviter les grumeaux. Ceci est particulièrement important pour les lymphocytes activés en raison de leur adhésivité accrue.
- Pour les cultures qui sont activées avec des billes anti-CD3 / CD28, après le pipetage, le transfert de l'échantillon dans un tube de centrifugeuse de 1,5 ml ou 2 ml. Séparer les perles en gardant le tube sur un aimant pendant 1-2 min. Utiliser le surnageant contenant les cellules pour l'analyse.
Remarque: analyser les deux cellules au repos et activés à moins de 1 heure pour prendre en compte tout pré-activation des cellules au repos par le sérum présent dans le milieu de culture. Après 12 h de PMA / ionomycine stimulation, une légère augmentation de la taille des cellules était détectable (Figure 2 ). À 72 h, aucune augmentation significative de la taille des cellules par rapport à 48 h a été observée (données non présentées).
- Pour les cultures qui sont activées avec des billes anti-CD3 / CD28, après le pipetage, le transfert de l'échantillon dans un tube de centrifugeuse de 1,5 ml ou 2 ml. Séparer les perles en gardant le tube sur un aimant pendant 1-2 min. Utiliser le surnageant contenant les cellules pour l'analyse.
- Transfert 1 ml de la suspension cellulaire dans un échantillon tasse et le lancer à travers le compteur de cellules automatisé selon les instructions du manuel.
NOTE: Pour chacun des essais, un minimum de 1 ml (maximum de 2 ml) de la culture cellulaire doit être utilisée. Le compteur de cellules automatisé utilise une seringue pour mélanger bleu trypan avec la suspension cellulaire et passe le mélange bleu-trypan cellule sur un champ qui est imagée et analysé par le logiciel. Le logiciel détecte les cellules colorées en bleu trypan, dessine un cercle autour de chaque cellule, et qui détermine le diamètre. 100 images sont prélevées dans chaque échantillon et la viabilité des cellules et les dimensions sont déterminées. Le seuil de détection du compteur cellulaire utilisé ici a une limite inférieure de 5 um. - Transfert des données de chaque parcours vers un tableur pour une analyse ultérieure.
- Calibrer l'appareil sur une base régulière en utilisant un 1ml échantillon de 6 pm et 8 pm perles diamètre de polystyrène.
REMARQUE: Les tailles de perles réelles mesurées par le fabricant pour chaque lot doit être utilisé, pas la taille nominale. 6 et 8 um perles sont pratiques parce que ces diamètres sont proches des diamètres attendus de repos et les cellules T activées (voir Figure 1).
6. Les données et l'analyse statistique
- Analyser les données en utilisant un logiciel statistique et graphique approprié.
NOTE: La feuille de calcul pour chaque exécution contient le nombre de cellules avec chaque diamètre (plage: 5 um à 70 um). Les cellules au-dessus d'un diamètre de 17 um sont retirés de l'analyse d'exclure les particules de poussière et de petites bulles, qui peuvent être lues comme des cellules viables par l'instrument. - Effectuer l'hypothèse d'essai utilisant le test t de Welch pour les ensembles de données avec une variance inégale; les résultats sont considérées comme statistiquement significatives si p <0,001. La formule utilisée était,

où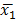 et
et 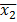 sont des moyens échantillons,
sont des moyens échantillons,  et
et 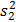 sont variances échantillon, et
sont variances échantillon, et 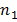 et
et  sont la taille des échantillons pour chaque ensemble de données. Le nombre de degrés de liberté est une estimation prudente en utilisant la plus petite des deux tailles d'échantillon pour chaque comparaison. Les graphiques à barres sont présentées comme la moyenne ± SEM.
sont la taille des échantillons pour chaque ensemble de données. Le nombre de degrés de liberté est une estimation prudente en utilisant la plus petite des deux tailles d'échantillon pour chaque comparaison. Les graphiques à barres sont présentées comme la moyenne ± SEM.
7. splénique T-lymphocyte Essai de prolifération
- Mesurer la prolifération des lymphocytes T en utilisant une plaque ou MTS- dosage colorimétrique lecteur de prolifération à base de MTT.
NOTE: L'essai est la based sur le composé tétrazolium MTS (réactif d'Owen) de réduction de produit de formazan soluble, probablement par le NADPH ou NADH produit dans des cellules métaboliquement actives par des enzymes déshydrogénase. - Compter les cellules T purifiées avec un hémocytomètre et remettre en suspension les dans RPMI-1640 complet à une densité finale de 1 x 10 6 cellules / ml.
REMARQUE: DTT 1 mM peut être ajouté aux cellules à ce stade. - Activer les cellules avec PMA et ionomycine avec des médicaments d'essai, le cas échéant, et mélanger doucement (similaire à l'étape 4).
- Plaque 100 pi de cellules dans chaque puits d'une plaque de culture cellulaire traitée à 96 puits et incuber à 37 ° C avec 5% de CO2 pendant 48 heures. Ajouter 100 pi de milieu RPMI-1640 sans cellules dans un puits pour obtenir une lecture de l'absorbance de fond.
- Ajouter 20 ul de réactif à base de MTS à chaque puits et incuber à 37 ° C avec 5% de CO 2 pendant 4 heures.
- Prendre des mesures d'absorbance à 490 nm en utilisant un lecteur de plaque. Le ALes mesures de bsorbance correspondent au nombre de cellules métaboliquement actives dans chaque puits.
NOTE: Soustraire les niveaux de fond si nécessaire. Les valeurs d'absorbance de fond dépendent du type de milieu de culture, le sérum, le pH externe, et la durée de l'exposition au réactif MTS à la lumière. réactifs à base de MTS sont sensibles à la lumière, et l'exposition à la lumière pendant plusieurs heures peuvent entraîner une hausse des valeurs d'absorbance de fond.
Résultats
Nous avons utilisé ce test pour comparer la formation blastique des lymphocytes lors d'une stimulation par le PMA, un ester de phorbol et ionomycine, un ionophore du calcium. La figure 1A montre la distribution des fréquences des diamètres de repos et les cellules T spléniques activées sur le plan pharmacologique. Le traitement des cellules avec PMA / ionomycine pendant ~ 2 jours a donné lieu à un changement important dans la médiane de la distribution vers des diamètres plus grands (voir, par exemple la référence 4). Le nombre de cellules avec des diamètres plus petits a été réduite en conséquence. Afin de vérifier que notre dispositif rapporté les diamètres corrects, nous avons effectué deux étalonnages avec des billes de polystyrène de 6 pm et 8 pm diamètres (voir le tableau Matériaux). Les figures 1B et 1C montrent des lectures à partir de cellules T activées superposées avec un 8 pm cellules T standard et reposant superposées à une norme de 6 pm. Figure1D montre les tailles de contrôle de perles rapportées par le fabricant complotèrent contre les diamètres médians mesurés avec notre compteur de cellules automatisé. Il est apparu que la taille de 6 pm est légèrement surestimé dans nos mesures, probablement en raison du seuil de mesure de l'instrument ayant une limite inférieure de 5 um. Cependant, l'écart-type des diamètres des perles calculés à partir des mesures de comptage de cellules est en accord avec l'écart-type rapporté par le fabricant. Nous concluons de ces expériences que ce dispositif peut être utilisé de manière fiable pour comparer le repos et la souris tailles T-cellulaires stimulées par un mitogene et que le dispositif peut mesurer avec précision les diamètres cellulaires réels.
Nous avons ensuite procédé pour tester la dépendance de l'augmentation de diamètre moyen de la concentration PMA et a constaté que, à une concentration fixe ionomycine de 250 nM, l'effet PMA n'a pas été significativement modifiée par l'élévation de sa concentration fROM 2 à 250 ng / ml (figure 2A). En utilisant l'essai à base de MTS, on a mesuré la prolifération des cellules T à 50 et 250 ng ml de PMA / et on a trouvé aucune différence notable (figure 2C), en accord avec les données de diamètre des cellules. Les médicaments inhibiteurs de la calcineurine ciclosporine A (300 nM) et FK506 (1 nM) a supprimé à la fois blastogenèse (figure 2B) et de la prolifération (figure 2C). Inhibition n'a cependant pas été complète dans les deux cas,. Les mesures effectuées 12 heures après PMA / ionomycine outre montré une augmentation de 7,2% et 6,8% de diamètre pour 50 ng / ml et 250 ng / ml de PMA, respectivement (figure 2D). La taille augmente à ces deux concentrations ne sont pas significativement différentes, comme ce fut le cas pour 48 stimulation h (comparer à la figure 2A).
Les données de diamètre des cellules recueillies à partir de repos et les cellules T activées après 48 h de PMA / ionomycine stimulation sont résumés dans Tableau 1. La surface spécifique et le volume moyen des cellules T au repos spléniques de souris ICR ont été 151,4 um 2 et 1,9 x 10 -4 nl, respectivement. La surface spécifique et le volume moyen des lymphocytes T activés étaient 300,6 um 2 et 5,9 x 10 -4 nl, respectivement. L'augmentation du diamètre moyen global pour l' ensemble des cellules activées était 40,92% (tableau 1).
Nous avons également testé d'autres composés chimiques déclarés comme immunosuppresseur: CsA, FK506, la rapamycine, FTY720 et TRAM-34. Sur la figure 3, les mesures de la taille des cellules obtenues au repos et les cellules T activées en présence et en absence de ces drogues sont montrées. CsA et de FK506, qui ciblent le facteur nucléaire calcineurine dépendant des lymphocytes T activés (27,28) NFAT, étaient les plus puissants, ce qui inhibe la réponse blastogénique de près de 72% (figure 3A et 3B). Fait intéressant, avecconcentrations de PMA a augmenté, la puissance de CsA et FK506 ont légèrement diminué, même si il n'y avait pas d' augmentation supplémentaire de diamètre des cellules en l'absence de ces médicaments (figure 2A et 2B). La rapamycine, un immunosuppresseur qui inhibe la cible mammalienne de la rapamycine (mTOR) 29,30, a eu un effet modéré mais statistiquement significative (figure 3A, 3B et 3C). FTY720 est une sphingosine 1-phosphate agoniste du récepteur qui inhibe la sortie des lymphocytes en circulation 31 et a été récemment révélé inhiber TRMP7, un canal de cation fortement exprimé dans les lymphocytes T 32. À la fois FTY720 et de la rapamycine ont un effet comparable sur la blastogénèse, réduisant de la moyenne d'une augmentation de 52% de diamètre à environ 34% (figure 3A et 3B). TRAM-34 est un inhibiteur du canal potassique activé par le calcium KCa3.1 33. Testé à 700 nM, TRAM-34 a été inefficace dans les cellules T murines, in Conformément à une récente étude de prolifération des cellules T humaines; son activité peut dépendre de la nature et l' intensité de la stimulation mitogene 34 (figure 3A et 3B). 700 nm TRAM-34 était efficace dans le blocage des canaux de KCa3.1 dans nos expériences électrophysiologiques de patch-clamp (données non présentées). Cette comparaison a été faite entre le repos et les cellules de drogue exposées dans plusieurs essais au sein de la même expérience à 48 h. Lors de la rapamycine et de la CsA ont été utilisés ensemble, blastogenèse est complètement inhibée (figure 3C).
L' activation des lymphocytes T de souris avec des anti-CD3 / billes magnétiques anti-CD28 revêtu pendant 72 heures a produit une augmentation de 27% du diamètre moyen, qui a été réduite à 5% en présence de CsA (figure 3D). Des cellules mononucléaires humaines sur PMA / ionomycine activation pendant 48 heures a augmenté le diamètre de 33%, et l'activation en présence de CsA a diminué la réponse à 23% ( Figure 4).
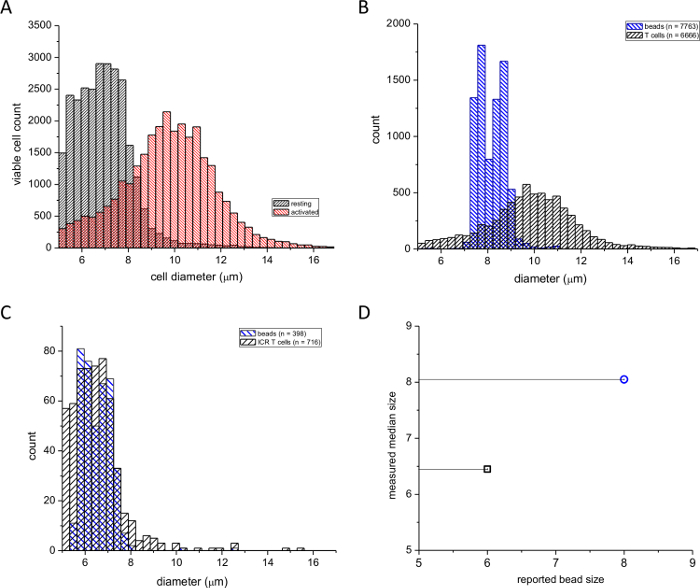
Figure 1: Les distributions de fréquences des diamètres de cellules T spléniques murins. (A) des colonnes noires indiquent le repos et les colonnes rouges indiquent / ionomycine activés (48 h) , les cellules PMA. (B) Les distributions de cellules T spléniques activées superposées sur une calibration taille de particules standard de 8 pm. (C) Les distributions de lymphocytes T au repos superposées sur une norme d'étalonnage de 6 pm. Les nombres de cellules et les billes utilisées sont indiquées dans les cases. (D) le diamètre médian mesuré par le compteur de cellules tracée par rapport au diamètre du bourrelet rapporté par le fabricant. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
dans les pages = "1"> 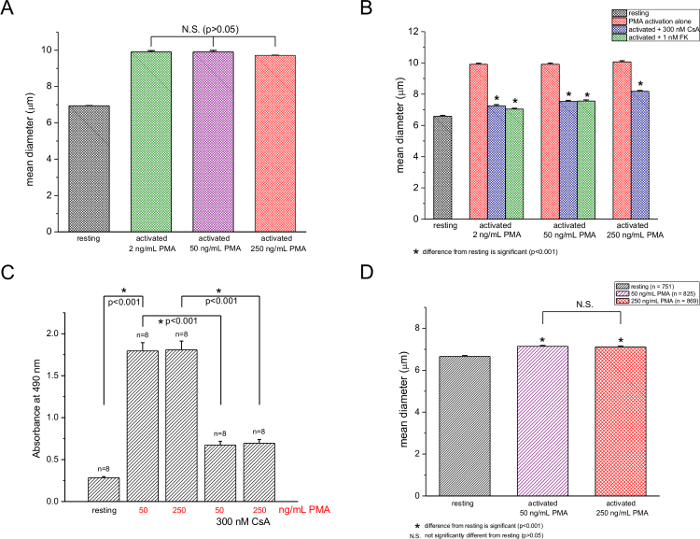
Figure 2: Influence de souris activation des lymphocytes T de la concentration de PMA. (A) un diamètre moyen de cellules T non traitées ou traitées avec 2, 50 et 250 ng / ml de PMA à une concentration fixe d' ionomycine (250 nm). (B) contre Cell mesures de repos et activés (2, 50, 250 ng / ml de PMA) des cellules T en l'absence et la présence de 300 nM CsA ou 1 nM FK506. (C) de MTS essai de prolifération de 50 et 250 ng / ml de PMA à 250 nM ionomycine en l'absence et en présence de 300 nM CsA. Des différences significatives (p <0,001) sont indiqués par des astérisques. n est le nombre total d'essais. Les données proviennent de cellules isolées à partir de 3 souris. (D) des diamètres de cellules de repos et les cellules T activées (250 ng / ml de PMA et 250 nM ionomycine) 12 heures après l' activation en l'absence et la présence de 300 nM CsA. pload / 55212 / 55212fig2large.jpg "target =" _ blank "> S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
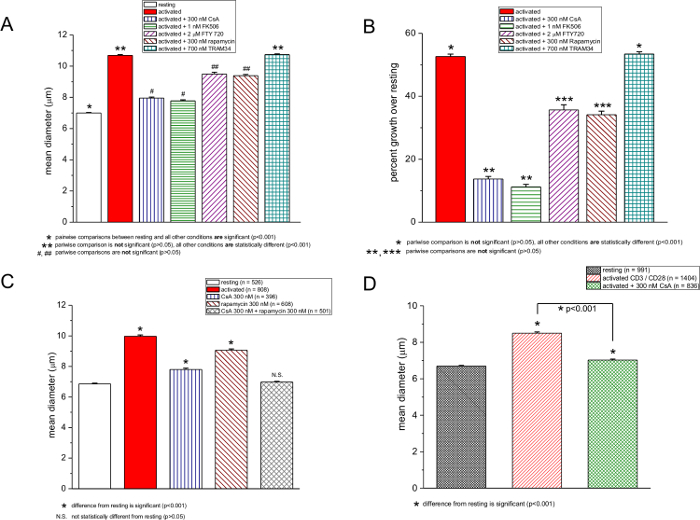
Figure 3: Effets de la CsA, FK506, FTY720, rapamycine et TRAM-34 sur la taille des cellules. (A et C) , des diamètres moyens de repos et des cellules murines T activés par PMA ionomycine / en l'absence et en présence de la drogue. Les concentrations sont indiquées dans la boîte. (B) des données d'une part à l'augmentation pour cent par rapport au diamètre des cellules T au repos. l'activation lymphocytaire a été réalisée avec 250 ng / ml de PMA et ionomycine 250 nm, et les mesures ont été prises après 48 h. (D) Compteur de cellules mesures de repos et anti-CD3 / CD28 des cellules T activées, 72 heures après son activation en l'absence et en présence de 300 nM CsA.rge.jpg "target =" _ blank "> S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.

Figure 4: blastogenesis dans les CMSP humaines lors de la stimulation mitogene. (A) des colonnes noires indiquent le repos et les colonnes rouges indiquent CMSP activées. (B) des diamètres moyens de repos et CMSP activées en l'absence et la présence de 300 nM CsA. Les cellules ont été activées avec 250 ng / ml de PMA et ionomycine 250 nm, et les mesures ont été prises après 48 h d'activation. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
| column1 | Repos | Activé | 100 nM CsA | CsA 200 nm |
| Diamètre moyen | 6.94 pm | 9.78 pm | 8.19 pm | 7.92 pm |
| Augmentation moyenne Diamètre | 40,92% | 17,88% | 14,09% | |
| Moyenne Surface | 151.37 μm² | 300.61 μm² | 210,56 μm² | 197.22 μm² |
| Augmentation moyenne dans la zone de surface | 98,59% | 39.00% | 30.16% |
Tableau 1: Sommaire du diamètre moyen des cellules et des augmentations relatives à la surface. Les mesures ont été effectuées 48 heures après l'activation avec 250 ng / ml de PMA et 250 nM ionomycine.
Discussion
Ici, nous décrivons une méthode pour la détection rapide et la quantification de la transformation des lymphocytes T blastogénique en utilisant un compteur de cellules automatisé. Dans nos conditions (250 ng / ml de PMA et ionomycine 250nM stimulation), la zone de surface cellulaire a été augmenté deux fois et le volume de trois fois après 48 heures d'activation. Le dosage est suffisamment sensible pour détecter dynamitage pendant les 12 premières heures d'activation, où le volume cellulaire augmenté que de 1,25 fois par rapport au repos (figure 2D). Un mécanisme plus physiologiquement pertinents de l' activation des cellules T en utilisant anti-CD3 et anti-CD28 billes magnétiques recouvertes d' anticorps produit une réponse blastogénique significative, avec une augmentation moyenne de 2,3 fois en volume (72 heures après l' activation, la figure 3D). Cellules mononucléaires humaines ont montré un changement de 2,6 fois en volume lors de PMA / ionomycine stimulation pendant 48 heures (Figure 4). Le diamètre moyen des cellules T ICR splénique de la souris et le volume ont été jugées6,9 um et 1,9 x 10 -4 nl, respectivement. CMSP humaines (d'un donneur sain) avaient un diamètre moyen de 7,7 pm et un volume moyen de 2,7 x 10 -4 nl. En utilisant ce protocole, nous avons également testé l'augmentation des concentrations de PMA pour leur capacité à activer les cellules T. Ces résultats unicellulaires étaient compatibles avec les essais de prolifération effectués à des concentrations similaires PMA.
Plusieurs composés signalés à affecter la prolifération cellulaire ont été testés: FTY720 31,32; l'immunosuppresseur de la cyclosporine A, le FK506 et la rapamycine 27,28; et TRAM-34, un bloqueur des canaux de KCa3.1 activés par le calcium 33,35. Nous avons constaté que, aux concentrations testées, les inhibiteurs les plus puissants de blastogenesis étaient CsA et FK506. La rapamycine a eu un effet plus faible mais statistiquement significative suppressif sur blastogenesis. TRAM-34, d'autre part, n'a pas d'incidence sur la blastogénèse.
CsA a supprimé à la fois blastogenèse et proliferation, mais pas complètement (figure 2B et 2C), ce qui démontre que la mesure automatisée de comptage de cellules est une bonne corrélation de l' efficacité du médicament dans la prolifération des lymphocytes T. En présence de rapamycine avec la CsA, blastogenèse est complètement inhibée, ce qui suggère que les voies NFAT- et mTOR médiées en combinaison puissent pleinement compte de l' élargissement des lymphocytes T lors de la stimulation mitogene par PMA / ionomycine (figure 3C).
La gamme dynamique de certains tests de prolifération est limitée (voir la figure 2). Les tests de prolifération, tels que celui que nous avons utilisé (figure 2C), signaler un signal qui inclut des contributions provenant de cellules apoptotiques et nécrotiques. Mesures automatiques de changement de diamètre ne sont pas cette limitation, que les mesures se rapportent à des cellules viables seulement. La viabilité cellulaire est évaluée par l'exclusion des taches bleu trypan à partir de cellules saines et viables. Dans les mesures de taille, en utilisant l'avantdiffusion de la lumière en cytométrie en flux discrimination de cellules doublet peut être problématique 22. Dans les mesures de compteur de cellules automatisé, aucune population doublet a été trouvé (figure 1). En outre, la mesure est suffisamment précise pour établir une distinction entre les effets de 100 et 200 nm ciclosporine (tableau 1) et pour détecter la blastogenèse dans les 12 heures de stimulation mitogénique (figure 2D).
Ce nouvel essai est particulièrement utile pour de petits nombres d'échantillons. Jusqu'à 15 échantillons peuvent être mesurés en 1 h. Cependant, le test a ses limites, dont la plupart peuvent être atténués. Même si elle peut résoudre efficacement de petite taille (<1 pm) différence de diamètre de la cellule, le modèle de la machine, nous avons utilisé a un seuil de détection inférieure de 5 um. Cette limite peut entraîner la surestimation de très petites tailles de cellules, car il exclut effectivement toutes les cellules avec des diamètres plus petits. Cependant, les nouveaux modèles de compteur de cellules ont réflâgés de ~ 2 um, ce qui devrait atténuer ce problème. S'il y a trop de débris dans l'échantillon, l'instrument les traite comme des cellules viables. En outre, des bulles d'air peuvent parfois entrer dans la cellule d'écoulement et provoque une distorsion des images de cellules capturées par l'appareil. La déformation ne semble pas affecter la détermination de la viabilité, mais elle peut affecter les diamètres mesurés. Par conséquent, il est recommandé que toutes les images soient vérifiées par l'expérimentateur de bulles d'air avant que les données de chaque essai sont acceptées pour l'analyse. Étant donné que le logiciel ne dessine des cercles autour des cellules, des diamètres de cellules non-sphériques peuvent être biaisés vers l'axe long, rendant le dosage moins approprié pour les cellules non-sphériques.
Ce test est rapide, prenant environ 4 min par échantillon, par rapport à des essais de prolifération, qui nécessitent quelques heures. La collecte des données est également assez simple en utilisant le logiciel fourni avec l'appareil. Le logiciel peut exporter des données de mesure à un spreadsheet pour l'analyse. Enfin, il est une cellule unique, par opposition à une population de mesure; à la fois blastogenesis et la prolifération sont mesurées; et il établit une distinction entre les cellules viables et mortes simultanément. Il peut être utilisé pour évaluer les différentes souches de souris pour leur capacité à monter une réponse immunitaire. Le dosage peut également être utilisé avec succès pour la mesure de la blastogenèse des cellules provenant de donneurs humains (figure 4) T, et il peut également être utilisé dans d' autres types cellulaires.
Volume cellulaire augmente sont connus pour contribuer à la régulation du métabolisme: gonflement des cellules stimule la synthèse du glycogène induite par la glutamine et la lipogenèse dans les hépatocytes 36,37. Neutrophiles afficher le volume augmente de migration associée de 35-60%, tandis que les agents chimiotactiques induisent 10-15% gonflement 38-40. Le test actuel peut potentiellement être utilisé pour étudier ces processus.
Déclarations de divulgation
The authors have no competing financial interests.
Remerciements
We thank Lucile Wrenshall for the use of the plate reader, Nancy Bigley for useful discussion, and Tom Brown for the gift of ICR mice. This work was funded by grant 1R01AI114804 from the National Institute of Allergy and Infectious Diseases and by WSU Faculty Development funds (to J.A.K.). J.N.G. was supported in part by the National Institute of General Medical Sciences grant R25GM090122.
matériels
| Name | Company | Catalog Number | Comments |
| RPMI-1640 | Lonza | BW12-702F | |
| 40 μm nylon cell strainers | Thermo Fisher Scientific | 22363547 | |
| nylon wool fiber columns | Polysciences, Inc. | 21759-1 | |
| 50 ml conical tubes | The Lab Depot | TLD431697 | |
| 6-well cell culture treated plates | USA Scientific | CC7682-7506 | |
| 96-well cell culture treated plates | Thermo Fisher Scientific | 130188 | |
| Dimethyl sulfoxide (DMSO) | Fisher BioReagents | BP231-100 | |
| CellTiter 96 AQueous One Solution Cell Proliferation Assay | Promega | G3582 | MTS based assay |
| Cyclosporine A | Sigma-Aldrich | 30024 | |
| FK506 | Cayman Chemical Company | 104987-11-3 | |
| Rapamycin | Santa Cruz Biotechnology | sc-3504 | |
| TRAM-34 | Sigma-Aldrich | T6700 | |
| FTY720 | Sigma-Aldrich | SML0700 | |
| Dynabeads Mouse T-Activator CD3/CD28 | Gibco | 11456D | |
| Phorbol 12-myristate 13-acetate (PMA) | Acros Organics | 356150010 | |
| Ionomycin calcium salt | Sigma-Aldrich | I0634 | |
| Penicillin-Streptomycin | MP Biomedicals | ICN1670049 | 100x stock |
| Dulbecco’s phosphate buffered saline (DPBS) | HyClone | SH30378.02 | 10x stock |
| 1,4-dithiothreitol (DTT) | Research Products International | 12/3/3483 | reducing agent |
| 8 µm micro particle size standard | Sigma-Aldrich | 84192-5ML-F | Actual 8.02 µm |
| 6 µm micro particle size standard | Sigma-Aldrich | 89756-5ML-F | Actual 6.084 µm |
| Single magnetic separation stand for 1.5 - 2 ml tube | V&P Scientific, Inc. | VP772F5 | |
| Cell culture incubator | Forma Scientific | 3110 | |
| Synergy H1 hybrid reader | Bio Tek | BTH1M | |
| Vi-CELL cell viability analyzer | Beckman Coulter | 731050 |
Références
- Weiss, A., Samelson, L. E., Paul, W. E. T-lymphocyte activation. Fundamental Immunology. , 321-364 (2003).
- Gergely, P., Ernberg, I., Klein, G., Steinitz, M. Blastogenic response of purified human T-lymphocyte populations to Epstein-Barr virus (EBV). Clin Exp Immunol. 30 (3), 347-353 (1977).
- Sanderson, R. J., Rulon, K., Groeneboer, E. G., Talmage, D. W. The response of murine splenic lymphocytes to concanavalin A and to co-stimulator. J Immunol. 124 (1), 207-214 (1980).
- Decoursey, T. E., Chandy, K. G., Gupta, S., Cahalan, M. D. Mitogen induction of ion channels in murine T lymphocytes. J Gen Physiol. 89 (3), 405-420 (1987).
- Nibbering, P. H., Zomerdijk, T. P., Tilburg, A. J., Furth, R. V. Mean cell volume of human blood leucocytes and resident and activated murine macrophages. J Immunol Methods. 129 (1), 143-145 (1990).
- Segel, G. B., Cokelet, G. R., Lichtman, M. A. The measurement of lymphocyte volume: importance of reference particle deformability and counting solution tonicity. Blood. 57 (5), 894-899 (1981).
- Cooper, H. L., Braverman, R. Protein synthesis in resting and growth-stimulated human peripheral lymphocytes. Evidence for regulation by a non-messenger RNA. Exp Cell Res. 127 (2), 351-359 (1980).
- Cooper, H. L., Braverman, R. Close correlation between initiator methionyl-tRNA level and rate of protein synthesis during human lymphocyte growth cycle. J Biol Chem. 256 (14), 7461-7467 (1981).
- Teague, T. K., et al. Activation changes the spectrum but not the diversity of genes expressed by T cells. Proc Natl Acad Sci U S A. 96 (22), 12691-12696 (1999).
- Tzur, A., Kafri, R., Lebleu, V. S., Lahav, G., Kirschner, M. W. Cell growth and size homeostasis in proliferating animal cells. Science. 325 (5937), 167-171 (2009).
- Messele, T., et al. Nonradioactive techniques for measurement of in vitro T-cell proliferation: alternatives to the [3H]thymidine incorporation assay. Clin Diagn Lab Immunol. 7 (4), 687-692 (2000).
- Maghni, K., Nicolescu, O. M., Martin, J. G. Suitability of cell metabolic colorimetric assays for assessment of CD4+ T cell proliferation: comparison to 5-bromo-2-deoxyuridine (BrdU) ELISA. J Immunol Methods. 223 (2), 185-194 (1999).
- Weichert, H., Blechschmidt, I., Schröder, S., Ambrosius, H. The MTT-assay as a rapid test for cell proliferation and cell killing: application to human peripheral blood lymphocytes (PBL). Allerg Immunol (Leipz). 37 (3-4), 139-144 (1991).
- Huang, K. T., Chen, Y. H., Walker, A. M. Inaccuracies in MTS assays: major distorting effects of medium, serum albumin, and fatty acids. Biotechniques. 37 (3), 410-412 (2004).
- Rampersad, S. N. Multiple applications of Alamar Blue as an indicator of metabolic function and cellular health in cell viability bioassays. Sensors (Basel). 12 (9), 12347-12360 (2012).
- Quent, V. M., Loessner, D., Friis, T., Reichert, J. C., Hutmacher, D. W. Discrepancies between metabolic activity and DNA content as tool to assess cell proliferation in cancer research. J Cell Mol Med. 14 (4), 1003-1013 (2010).
- Augustine, N. H., Pasi, B. M., Hill, H. R. Comparison of ATP production in whole blood and lymphocyte proliferation in response to phytohemagglutinin. J Clin Lab Anal. 21 (5), 265-270 (2007).
- Sottong, P. R., Rosebrock, J. A., Britz, J. A., Kramer, T. R. Measurement of T-lymphocyte responses in whole-blood cultures using newly synthesized DNA and ATP. Clin Diagn Lab Immunol. 7 (2), 307-311 (2000).
- Wallace, P. K., Muirhead, K. A. Cell tracking 2007: a proliferation of probes and applications. Immunol Invest. 36 (5-6), 527-561 (2007).
- Quah, B. J., Warren, H. S., Parish, C. R. Monitoring lymphocyte proliferation in vitro and in vivo with the intracellular fluorescent dye carboxyfluorescein diacetate succinimidyl ester. Nat Protoc. 2 (9), 2049-2056 (2007).
- Teague, T. K., Munn, L., Zygourakis, K., Mcintyre, B. W. Analysis of lymphocyte activation and proliferation by video microscopy and digital imaging. Cytometry. 14 (7), 772-782 (1993).
- Böhmer, R. M., Bandala-Sanchez, E., Harrison, L. C. Forward light scatter is a simple measure of T-cell activation and proliferation but is not universally suited for doublet discrimination. Cytometry A. 79 (8), 646-652 (2011).
- Lee, J., Sadelain, M., Brentjens, R. Retroviral transduction of murine primary T lymphocytes. Methods Mol Biol. 506, 83-96 (2009).
- Gunzer, M., Weishaupt, C., Planelles, L., Grabbe, S. Two-step negative enrichment of CD4+ and CD8+ T cells from murine spleen via nylon wool adherence and an optimized antibody cocktail. J Immunol Methods. 258 (1-2), 55-63 (2001).
- Trickett, A., Kwan, Y. L. T cell stimulation and expansion using anti-CD3/CD28 beads. J Immunol Methods. 275 (1-2), 251-255 (2003).
- Pène, J., Rahmoun, M., Temmerman, S., Yssel, H. Use of anti-CD3/CD28 mAb coupled magnetic beads permitting subsequent phenotypic analysis of activated human T cells by indirect immunofluorescence. J Immunol Methods. 283 (1-2), 59-66 (2003).
- Sigal, N. H., Dumont, F. J. Cyclosporin A, FK-506, and rapamycin: pharmacologic probes of lymphocyte signal transduction. Annu Rev Immunol. 10 (1), 519-560 (1992).
- Fruman, D. A., Klee, C. B., Bierer, B. E., Burakoff, S. J. Calcineurin phosphatase activity in T lymphocytes is inhibited by FK 506 and cyclosporin A. Proc Natl Acad Sci U S A. 89 (9), 3686-3690 (1992).
- Pollizzi, K. N., Waickman, A. T., Patel, C. H., Sun, I. H., Powell, J. D. Cellular size as a means of tracking mTOR activity and cell fate of CD4+ T Cells upon antigen recognition. PLoS One. 10 (4), e0121710 (2015).
- Pollizzi, K. N., Powell, J. D. Regulation of T cells by mTOR: the known knowns and the known unknowns. Trends Immunol. 36 (1), 13-20 (2015).
- Mandala, S., et al. Alteration of lymphocyte trafficking by sphingosine-1-phosphate receptor agonists. Science. 296 (5566), 346-349 (2002).
- Qin, X., et al. Sphingosine and FTY720 are potent inhibitors of the transient receptor potential melastatin 7 (TRPM7) channels. Br J Pharmacol. 168 (6), 1294-1312 (2013).
- Wulff, H., Kolski-Andreaco, A., Sankaranarayanan, A., Sabatier, J. M., Shakkottai, V. Modulators of small- and intermediate-conductance calcium-activated potassium channels and their therapeutic indications. Curr Med Chem. 14 (13), 1437-1457 (2007).
- Petho, Z., et al. The anti-proliferative effect of cation channel blockers in T lymphocytes depends on the strength of mitogenic stimulation. Immunol Lett. 171, 60-69 (2016).
- Wulff, H., et al. Design of a potent and selective inhibitor of the intermediate-conductance Ca2+-activated K+ channel, IKCa1: a potential immunosuppressant. Proc Natl Acad Sci USA. 97 (14), 8151-8156 (2000).
- Lang, F., et al. Functional significance of cell volume regulatory mechanisms. Physiol Rev. 78 (1), 247-306 (1998).
- Hue, L. Control of liver carbohydrate and fatty acid metabolism by cell volume. Biochem Soc Trans. 22 (2), 505-508 (1994).
- O'Flaherty, J. T., Kreutzer, D. L., Ward, P. A. Neutrophil aggregation and swelling induced by chemotactic agents. J Immunol. 119 (1), 232-239 (1977).
- Hsu, L. S., Becker, E. L. Volume changes induced in rabbit polymorphonuclear leukocytes by chemotactic factor and cytochalasin B. Am J Pathol. 81 (1), 1-14 (1975).
- Rosengren, S., Henson, P. M., Worthen, G. S. Migration-associated volume changes in neutrophils facilitate the migratory process in vitro. Am J Physiol. 267, C1623-C1632 (1994).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon