Method Article
La quantificazione rapida di Mitogen indotta blastogenesi in linfociti T per l'identificazione farmaci immunomodulatori
In questo articolo
Riepilogo
T-lymphocyte mitogenesis is accompanied by blastogenic transformation, whereupon the cell volume enlarges before cell division. Here, we describe a method to quantify blastogenesis in T lymphocytes using an automated cell counter with the capability of measuring cell diameters.
Abstract
Proliferazione dei linfociti in risposta alla stimolazione antigenica o mitogenica è un fenomeno facilmente quantificabile utile per i test immunomodulanti (vale a dire, immunosoppressive o immunostimolante) composti chimici e biologici. Uno dei primi passi durante mitogenesi è l'allargamento delle cellule o trasformazione blastogenic, dopo di che il volume delle cellule aumenta prima divisione. Di solito è rilevabile nelle prime ore di stimolazione dei linfociti T. Qui, descriviamo un metodo rapido per quantificare blastogenesi in T linfociti isolati da milze di topo e cellule mononucleari del sangue periferico (PBMC) utilizzando un contatore di cellule automatizzato. Vari saggi di proliferazione comunemente utilizzati per la maggior parte sono laboriosi e riflettono soltanto l'effetto popolazione anziché effetti cellulari individuali all'interno di una popolazione. Al contrario, il saggio contatore automatico di cellule presentato fornisce misure veloci, diretti e precisi di diametri cellulari che possono essereutilizzato per valutare l'efficacia di vari mitogeni e farmaci immunomodulatori in vitro.
Introduzione
I linfociti T sono le cellule principali responsabili dell'immunità adattativa nei mammiferi. È noto che rispondono a specifici peptidi antigenici presentati da molecole MHC sulla superficie delle cellule presentanti l'antigene. All'attivazione di un recettore delle cellule T cognate (TCR), la cella allarga in un processo chiamato trasformazione blastogenic o blastogenesi. Questo processo è rilevabile nella prima ~ 6 ore dopo lo stimolo viene applicato 1. Durante blastogenesi, i volumi delle singole cellule T aumentano da 2 a 4 volte 2-6. Linfociti cominciano a proliferare in un processo chiamato espansione clonale, il cui scopo è quello di generare molti cloni di TCR-cuscinetto cellule antigene-specifiche come possibile. Le cellule progenie poi esercitano la loro funzione immunologica differenziando in citotossici (CD8 +) o helper (CD4 +) effettrici linfociti T. Così, naive linfociti T nel sangue umano o il mouse sono in fase G 0 (riposo) della cellaCiclo e un supporto minimo l'attività metabolica. Dopo l'esposizione agli antigeni o mitogeni, cellule T rientrano il ciclo cellulare, con una concomitante stimolazione della trascrizione e sintesi proteica 7-10. Mitogeni, come forbolo 12-miristato 13-acetato (PMA) e ionomicina stimolare i linfociti attraverso l'attivazione di proteina chinasi C (PKC) e Ca 2+ -dipendente vie di segnalazione 1. L'attivazione delle cellule T con PMA / ionomicina ignora i passi di segnalazione TCR.
In proliferazione vitro sono ampiamente utilizzati ai fini della valutazione della funzione dei linfociti e risposta agli stimoli. letture proliferazione sono tipicamente presi uno a tre giorni dopo l'inizio della stimolazione delle cellule T e riflettono lo stato collettivo di centinaia o migliaia di cellule. La potenza di vari mitogeni e farmaci immunomodulanti in vitro può essere valutata misurando semplicemente tassi di proliferazione in presenza di questi composti. Alcuni di questi unssays e le relative limitazioni sono discussi di seguito.
Per il conteggio diretto numero di cellulare, la procedura richiede molto tempo, con un'alta probabilità di errori da parte dell'operatore.
Per la sintesi del DNA, il saggio di incorporazione di 3H-timidina misura la sintesi del DNA, ma il suo limite maggiore è la sua radiotossicità. Un'alternativa non radioattivo è BrdU, ma il range della risposta lineare per la crescita cellulare è limitata, ed è necessario un trattamento anticorpale, che aumenta il numero di passi nella procedura di 11,12.
Per l'attività metabolica, sali di tetrazolio (MTT, MTS, XTT e WST-1) e resazurina test colorimetrici a base di coloranti segnalano lo stato metabolico generale dividendo popolazioni cellulari. Tuttavia, MTT non è solubile nel mezzo di coltura, da lavaggi addizionali, integrando così errori nella misurazione; XTT ha bisogno di componenti aggiuntivi per ridurre in modo efficiente; MTS-, WST-1-, e le misurazioni resazurina-based sono influiscecato dalla cultura medio pH e la sua componenti del siero, albumina o rosso fenolo 13-16. Questi test non misurano il numero effettivo di cellule vitali, ma piuttosto stimano le attività enzimatiche combinate. Pertanto, il tasso di proliferazione non può essere determinato con precisione mediante saggi metabolici a causa della correlazione non lineare tra numero di cellule e la riduzione dye 12,17.
Per la misura di concentrazione di ATP, gli aumenti di attivazione indotta cellule T in ATP in correlazione con la proliferazione. Tuttavia, elevazione di ATP intracellulare è una delle fasi iniziali di attivazione delle cellule T; molti passi dietro è la proliferazione attuale 17,18.
Per il saggio di diluizione colorante, colorante fluorescente CFSE macchie cellule covalentemente legame alle proteine intracellulari. Il colorante presenta un decremento di proliferazione-dipendente di intensità fluorescente, che può tenere traccia del numero di divisioni cellulari. Tuttavia, a causa di etichettatura proteine covalente, le funzioni di questiproteine possono essere compromessi. Il colorante è tossico per le cellule a concentrazioni più elevate. A concentrazioni di colorante inferiori, tuttavia, l'intensità iniziale fluorescenza viene ridotto, diminuendo il numero di divisioni cellulari che possono essere monitorati. Inoltre, dopo marcatura con CFSE, c'è una proliferazione indipendente ~ perdita del 50% della fluorescenza iniziale durante il primo periodo di 24 a 48 ore, che limita la gamma dinamica di questo test 19,20.
La maggior parte di questi saggi riflettono lo stato collettivo di un gran numero di cellule e richiedono il trattamento delle cellule con coloranti fluorescenti. cellule necrotiche e apoptotiche potrebbe anche contribuire a queste misurazioni, se non sono rimossi dall'analisi mediante colorazione con prodotti chimici o anticorpi.
Linfociti blastogenesi può essere valutato da una varietà di metodi, come la microscopia ottica o citometria a flusso 4,21,22. Qui, descriviamo un metodo rapido per misurare la dimensione delle cellule T mediante unn automatizzato contatore di cellule, che raccoglie le immagini delle cellule in tempo reale che vengono memorizzati e possono essere nuovamente analizzati in un secondo momento. Oltre a misure di formato, questo dispositivo fornisce il numero di cellule precisi e la percentuale di cellule vitali, come determinato dal esclusione trypan colorazione blu. Il dispositivo utilizzato in questo protocollo è disponibile in commercio, e il produttore testato la precisione dello strumento utilizzando tre diversi strumenti e diversi controlli di concentrazione e vitalità. I risultati di questi studi hanno dimostrato un coefficiente di variazione che era generalmente inferiore al 6%. Come notato nel protocollo, il dispositivo è calibrato su base regolare con 6 micron e 8 micron di diametro perle di polistirene. I vantaggi di utilizzare un contatore di cellule di distinguere tra cellule T quiescenti e linfoblasti T basato su diametro cellulare è la facilità d'uso e la natura automatizzata delle analisi. Il software è in grado di disegnare un cerchio intorno a ogni cella e calcolando il diametro delle cellule. Inoltre, l'imetà sono visibili all'operatore, che può verificare l'accuratezza dello strumento per identificare le cellule e corretto disegnare un cerchio intorno a loro. In termini di limitazioni, lo strumento di per sé non può distinguere tra i detriti e le cellule; Pertanto, è importante che l'operatore visualizza ogni immagine mentre viene elaborato. Esiste la possibilità per incorporare bolle d'aria, che diminuirà il numero di campi utilizzabili per l'analisi; tuttavia, questo è raro, se viene eseguita la manutenzione regolare lavaggio.
In questo studio, gruppi di linfociti T splenici sono state stimolate con ionomicina e concentrazioni crescenti di PMA per 12-48 ore. concentrazioni PMA a partire da 2 ng / ml indotto sia una robusta risposta blastogenic e la proliferazione significativo. Le misurazioni degli effetti dei diversi farmaci, come ad esempio la immunosoppressori ciclosporina A (CsA), FK506 (tacrolimus), e rapamicina (sirolimus), così come bloccanti dei canali di ioni TRAM-34 e FTY720 (fingolimod), su blastogenesi dimostrato un buon accordo con effetti riportati sulla proliferazione. La risposta blastogenic di PBMC umani a / stimolazione PMA ionomicina e murine cellule T con anti-CD3 e perline legate agli anticorpi anti-CD28 magnetici sono stati misurati.
Il test contatore di cellule quantifica sia blastogenesi e il tasso di proliferazione (densità delle celle) contemporaneamente ma separatamente, a differenza dei metodi di cui sopra, che guardano una combinazione di questi effetti. Il protocollo presentato fornisce una tecnica rapida e robusta per valutare la potenza di agenti mitogeni e immunomodulatori.
Protocollo
Tutti gli esperimenti sono eseguiti secondo protocolli approvati dal Consiglio dell'Università Lab cura degli animali e del Comitato uso e Institutional Review Wright State.
NOTA: PBMC umani sono isolati dal gradiente di densità metodo di centrifugazione Ficoll 5.
1. Milza Harvest
- Casa adulto topi ICR femminili in condizioni di laboratorio standard, con il cibo, l'acqua, e le esigenze di biancheria da letto specifici per la specie.
NOTA: animali avevano un'età media di 2,9 mesi e un peso medio di 30,4 g al momento dell'eutanasia. - Alla data di isolamento (DOI), eutanasia gli animali singolarmente, senza altri animali presenti conspecifici. Fare tutti gli sforzi per garantire il minimo stress al mouse. Euthanize utilizzando CO 2 con dislocazione cervicale secondario per assicurare la morte.
- Posto l'animale, ancora all'interno della gabbia di trasferimento, nella camera di CO 2 e start il flusso di gas a 5 L / min. Tale portata sposta ossigeno alla raccomandata 10-30% per min.
- Dopo l'animale è inconscia, aumentare il flusso di CO 2 a 15 L / min. Controllare l'animale per cessazione della respirazione e lasciare nella camera per altri 2 minuti.
- Applicare dislocazione cervicale con una forza di distrazione per assicurare la morte.
- Raccolto la milza dall'animale con tecnica asettica entro 10 minuti della morte.
- Sterilizzare due serie di forbici e pinze per la rimozione della milza in autoclave forno prima dell'uso. Sterilizzare la superficie dissezione applicando il 70% di etanolo.
- Applicare 70% etanolo all'addome mouse. Utilizzando una serie di forbici e pinze, fare un taglio nella pelliccia e la pelle dal lato sinistro dell'addome, poi tirare a parte e buccia indietro la pelle per rivelare il peritoneo. Dopo l'esposizione, applicare la soluzione di clorexidina al 4% prima di aprire il peritoneo.
- Utilizzando la seconda serie di scissors e pinze, fare un taglio di 2 o 3 cm lungo l'addome centrale. Aprire il peritoneo e rimuovere la milza tagliando via allegati viscerali e grassi in eccesso. Posizionare la milza in tampone fosfato salina Dulbecco (DPBS).
2. Preparazione di prime splenociti
NOTA: eseguire tutti i passi sotto un armadietto flusso laminare biosicurezza con tecnica asettica.
- Impregnano le milze raccolti in 10 ml di H deionizzata sterile 2 O per 5 minuti in un piatto di coltura 10 cm a lisare gli eritrociti superficiali.
NOTA: Questo passaggio può essere omesso se la milza è stato danneggiato durante l'isolamento. - Per lo sblocco dei splenociti, schiacciare la milza tra due vetrini sterilizzati (lato smerigliato di fronte alla milza) nel corso di un fresco 10 centimetri piatto di coltura. Mescolare con 10 ml di RPMI-1640 supplementato con 10% siero bovino fetale, 2 mM L-glutammina, 50 IU / ml di penicillina, e 50 ug / ml streptomicina (di seguito denominato uns RPMI completo).
- Filtrare le cellule attraverso una sterile 40 pm colino cella nylon in un nuovo piatto cultura 10 cm a rimuovere il tessuto connettivo e detriti.
- Lyse rimanenti eritrociti aggiungendo 20 ml di tampone di lisi RBC composti di 155 mM NH 4 Cl, 10 mM NaHCO 3, e 0,1 mM EDTA a pH 7,4 e ~ 300 mOsm / L.
NOTA: Osmolalità viene misurata da un punto di congelamento o osmometro pressione di vapore.- Trasferire le cellule dalla piastra 10 cm ad un tubo da 50 ml e centrifugare a 250 xg per 10 min (4 ° C).
- Rimuovere il surnatante, aggiungere 20 ml di tampone di lisi RBC, e risospendere le cellule pellet pipettando.
- Incubare a temperatura ambiente in tampone di lisi per 10 min con dolce dondolio.
- Centrifugare per 10 min a 250 xg (4 ° C) per sedimentare le cellule. Eliminare il tampone di lisi.
- Risospendere le cellule in 10 ml di RPMI completo e centrifugare di nuovo (250 XG, 10 min, 4 ° C). DiscoARD Le surnatante.
- Risospendere le splenociti in 2 ml di RPMI completo riscaldato a 37 ° C per il trasferimento alla colonna nylon fibra di lana.
3. Purificazione di Linfociti T
- Lavare le colonne di lana di nylon due volte con 5 ml di RPMI completo. Incubare a 37 ° C in un CO 2 cella cultura incubatore 5% per 1 ora.
NOTA: E 'indispensabile per mantenere la lana nylon bagnato per la durata dell'esperimento e di utilizzare RPMI completo riscaldato a 37 ° C per tutte le fasi di isolamento lana nylon. - Aggiungere splenociti isolati alla colonna e incubare per 1 ora per permettere alle cellule B, fibroblasti e cellule accessorie di aderire alla lana nylon.
- Aggiungere 2 ml di RPMI contenenti splenociti nella colonna e passare attraverso fino a raggiungere la parte superiore della lana nylon.
- Aggiungere 2 ml di RPMI completo riscaldato a 37 ° C sulla parte superiore della lana nylon e passare il mezzo attraverso la lanafino a quando il livello del liquido raggiunge la superficie superiore.
- Aggiungere 3 ml di RPMI completo caldo alla colonna di coprire completamente la lana nylon.
- Incubare la colonna caricata indisturbato a 37 ° C, 5% CO 2 cella cultura incubatore per 1 ora.
- Eluire le cellule lavando la colonna due volte con 5 ml di RPMI completo. Eseguire un lavaggio supplementare delle cellule eluiti mediante centrifugazione.
- Riempire la colonna per le prime 2 volte con RPMI completo e lasciare che la soluzione nella colonna di fluire attraverso in un tubo da 50 ml sterile.
NOTA: Evitare di toccare o urtare la colonna, che può rimuovere le cellule B, cellule accessorie, e fibroblasti che aderiscono alla lana di nylon. - Raccogliere la frazione di flusso passante e far girare a 250 xg per 10 min (4 ° C) per agglomerare le cellule. Lavare una volta con 10 ml di RPMI completo. Agglomerare le cellule di nuovo (250 xg, 10 min, 4 ° C) e risospendere in 2 ml di RPMI completo.
- Misurare la c Densità ell utilizzando un emocitometro e diluire in RPMI completo e 0,5 x 10 6 cellule / ml.
- Seme 1 o 2 ml di cellule in ciascun pozzetto di una piastra di coltura cellulare 24 o 6 pozzetti, rispettivamente, e coltura le cellule a 37 ° C con 5% di CO 2.
NOTA: 1 mM 1,4-ditiotreitolo (DTT) può essere aggiunto a ciascun pozzetto in questa fase per migliorare la sopravvivenza delle cellule T. - Opzionale: Verificare l'efficienza del protocollo di isolamento mediante citometria di flusso. Questo protocollo produce normalmente ~ 80% linfociti T 23.
NOTA: le cellule di lana-purificato Nylon contengono circa il 50% CD4 + e il 23% di cellule CD8 +. Per purificare il CD4 + e CD8 + sottopopolazioni inoltre, un solo passo deplezione immunomagnetica può essere eseguita utilizzando otto anticorpi e sfere magnetiche 24. In alternativa, CD8 popolazioni di cellule T + pura CD4 + e possono essere isolati mediante selezione positiva o negativa con anticorpi specifici.
- Riempire la colonna per le prime 2 volte con RPMI completo e lasciare che la soluzione nella colonna di fluire attraverso in un tubo da 50 ml sterile.
- Attiva linfociti T entro 24 ore di isolamento attraverso l'aggiunta di PMA e ionomicina sale di calcio o sfere magnetiche rivestite con anti-CD3 e anti-CD28 23,25,26. Aggiungere farmaci sperimentali (ad esempio, CSA, FK506, rapamicina, TRAM-34, e FTY720) al momento dell'attivazione.
NOTA: Qui, concentrazioni PMA varia da 2 a 250 ng / ml, e la concentrazione ionomicina è stata mantenuta a 250 nM. Se possibile, diluizioni devono essere preparate a magazzino aliquote di ciascun farmaco in modo che il volume aggiunto a ciascun pozzetto di cellule è ≥1 microlitri di garantire la riproducibilità. sfere magnetiche L'anti-CD3 / anti-CD28 rivestite vengono aggiunti in un rapporto 1: 1 bead-cellula. Aumentando il numero di perline per cellula (cioè, il rapporto tallone-cellula) aumenta l'intensità della stimolazione 25,26. Le perle vengono lavate e risospese in RPMI completo prima della loro aggiunta alle cellule. Si noti che trypanblu colora le perline. - Cultura le cellule per 12-72 ore a 37 ° C con 5% di CO 2 prima dell'analisi con il contatore automatico di cellule.
5. cellulare Automated Data Collection Contatore
- Prima di eseguire l'esempio, fare in modo che le cellule sono mescolate delicatamente con una pipetta sierologica per evitare grumi. Ciò è particolarmente importante per linfociti attivati a causa della loro maggiore adesività.
- Per le culture che si attivano con perline anti-CD3 / CD28, dopo aver pipettato, trasferire il campione in una provetta da centrifuga da 1,5 ml o 2 ml. Separare le perline mantenendo il tubo su un magnete per 1-2 min. Utilizzare il surnatante contenente le cellule per l'analisi.
NOTA: analizzare sia cellule quiescenti e attivati entro 1 ora per tenere conto di eventuali pre-attivazione delle cellule quiescenti dal siero presente nel mezzo di coltura. Dopo 12 ore di PMA / ionomicina stimolazione, un piccolo aumento delle dimensioni delle cellule è stato rilevato (Figura 2 ). A 72 ore, senza aumento significativo dimensione della cella rispetto al stata osservata 48 ore (dati non mostrati).
- Per le culture che si attivano con perline anti-CD3 / CD28, dopo aver pipettato, trasferire il campione in una provetta da centrifuga da 1,5 ml o 2 ml. Separare le perline mantenendo il tubo su un magnete per 1-2 min. Utilizzare il surnatante contenente le cellule per l'analisi.
- Trasferire 1 ml della sospensione cellulare in una coppetta campione ed eseguirlo attraverso il contatore di cellule automatizzato in base alle istruzioni riportate nel manuale.
NOTA: Per ciascuna delle prove, deve essere utilizzato un minimo di 1 ml (massimo 2 ml) di coltura cellulare. Il contatore automatico di cellule utilizza una siringa per mescolare trypan blu con la sospensione cellulare e passa la miscela blu cellula-trypan su un campo immaginata e analizzati dal software. Il software rileva Trypan cellule blu macchiato, disegna un cerchio attorno ad ogni cella, e determina il diametro. 100 immagini sono raccolti da ciascun campione, e la vitalità delle cellule e le dimensioni sono determinati. La soglia di rilevamento del contatore cella utilizzata qui ha un limite inferiore di 5 um. - Trasferire i dati da ogni esecuzione di un foglio di calcolo per ulteriori analisi.
- Calibrare il dispositivo su una base regolare con un 1ml campione di 6 micron e 8 micron di diametro perle di polistirene.
NOTA: Le dimensioni di perline reali misurati dal costruttore per ciascun lotto dovrebbero essere usate, non la dimensione nominale. 6 e 8 micron perle sono convenienti perché questi diametri sono vicini ai diametri attesi di riposo e le cellule T attivate (vedi Figura 1).
6. I dati e l'analisi statistica
- Analizzare i dati utilizzando il software di statistica e grafica appropriata.
NOTA: Il foglio di calcolo per ogni esecuzione contiene il numero di cellule con ogni diametro (range: 5 micron a 70 micron). Le cellule sopra diametro 17 micron vengono rimossi dall'analisi di escludere particelle di polvere e piccole bolle, che possono essere letti cellule vive dallo strumento. - Eseguire ipotesi test con t-test di Welch per i set di dati con varianza disuguale; risultati sono considerati statisticamente significativi se p <0.001. La formula utilizzata è stata,

dove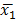 e
e 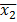 sono medie campionarie,
sono medie campionarie,  e
e 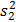 sono variazioni del campione, e
sono variazioni del campione, e 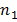 e
e  sono le dimensioni del campione per ogni set di dati. Il numero di gradi di libertà è conservativamente stimato utilizzando la più piccola delle due dimensioni del campione per ogni confronto. grafici a barre sono presentati come media ± SEM.
sono le dimensioni del campione per ogni set di dati. Il numero di gradi di libertà è conservativamente stimato utilizzando la più piccola delle due dimensioni del campione per ogni confronto. grafici a barre sono presentati come media ± SEM.
7. milza T-proliferazione dei linfociti Assay
- Misurare la proliferazione delle cellule T utilizzando un MTS- o piastra colorimetrica saggio lettore proliferazione MTT-based.
NOTA: Il test è di based composti MTS tetrazolio (reagente di Owen) riduzione al prodotto formazano solubile, probabilmente da NADPH o NADH prodotto in cellule metabolicamente attive da enzimi deidrogenasi. - Contare le cellule T purificate con un emocitometro e risospendere in completo RPMI-1640 ad una densità finale di 1 x 10 6 cellule / ml.
NOTA: 1 mM DTT può essere aggiunto alle cellule in questa fase. - Attivare le cellule con PMA e ionomicina insieme a farmaci di prova, se necessario, e mescolare delicatamente (simile al punto 4).
- Piatto 100 microlitri di cellule in ciascun pozzetto di una piastra trattata coltura cellulare a 96 pozzetti e incubare a 37 ° C con 5% di CO 2 per 48 ore. Aggiungere 100 pl di mezzi RPMI-1640 senza cellule in un pozzetto per ottenere una lettura dello sfondo assorbanza.
- Aggiungere 20 ml di reagente di MTS basata in ciascun pozzetto ed incubare a 37 ° C con 5% di CO 2 per 4 ore.
- Prendere le misure di assorbanza a 490 nm con un lettore di piastre. L'amisurazioni bsorbance corrispondono al numero di cellule metabolicamente attive in ciascun pozzetto.
NOTA: Sottrarre livelli di base, se necessario. I valori di assorbanza di fondo dipendono dal tipo di terreno di coltura, siero, pH esterna, e la durata dell'esposizione reagente MTS alla luce. reagenti MTS-based sono sensibili alla luce, e l'esposizione alla luce per diverse ore possono provocare sfondo elevati valori di assorbanza.
Risultati
Abbiamo usato questo test per confrontare la formazione di esplosione dei linfociti durante la stimolazione con PMA, un estere forbolo, e ionomicina, un ionoforo del calcio. La figura 1A mostra la distribuzione di frequenza dei diametri di riposo e le cellule della milza T farmacologicamente attivi. Il trattamento delle cellule con PMA / ionomicina per ~ 2 giorni comportato un cambiamento significativo nella mediana della distribuzione verso diametri più grandi (vedi, per esempio di riferimento 4). Il numero di cellule con diametri inferiori è stata di conseguenza ridotto. Al fine di verificare che il nostro dispositivo ha segnalato i diametri corretti, abbiamo eseguito due tarature con perle di polistirene di 6 micron e 8 micron di diametro (vedi Materiali Tavolo). Le figure 1B e 1C mostrano le letture da cellule T attivate sovrapposte con un 8 micron celle standard e di riposo T sovrapposti con uno standard di 6 micron. figura1D mostra le dimensioni Sfera di controllo riportati dal produttore tracciati contro i diametri medi misurati con il nostro contatore di cellule automatizzato. Sembrava che la dimensione 6 micron era leggermente sovrastimato nostre misurazioni, probabilmente a causa della soglia di misurazione dello strumento avente un limite inferiore di 5 um. Tuttavia, la deviazione standard dei diametri tallone calcolate dalle misurazioni contatore cella era in accordo con la deviazione standard riportato dal produttore. Concludiamo da questi esperimenti che questo dispositivo può essere utilizzato in modo affidabile per confrontare topo dimensioni delle cellule T mitogeni stimolata riposo e e che il dispositivo è in grado di misurare con precisione i diametri cellulari attuali.
Si è quindi proceduto a testare la dipendenza dell'aumento diametro medio sulla concentrazione PMA e abbiamo scoperto che, in un determinato ionomicina concentrazione di 250 nM, l'effetto PMA non era significativamente cambiato elevando sua concentrazione from 2 a 250 ng / ml (Figura 2A). Utilizzando il saggio MTS-based, abbiamo misurato la proliferazione delle cellule T a 50 e 250 ng / ml PMA e abbiamo trovato alcuna differenza apprezzabile (Figura 2C), in accordo con i nostri dati diametro delle cellule. L'farmaci inibitori della calcineurina ciclosporina A (300 Nm) e FK506 (1 Nm) soppresso sia blastogenesi (Figura 2B) e la proliferazione (Figura 2C). L'inibizione non era completa in entrambi i casi, tuttavia. Le misure effettuate 12 ore dopo PMA / aggiunta ionomicina mostrato un aumento del 7,2% e 6,8% di diametro per 50 ng / ml e 250 ng / ml PMA, rispettivamente (Figura 2D). Dimensione aumenta a queste due concentrazioni non erano significativamente differenti, come è avvenuto per 48 ore la stimolazione (confrontare Figura 2A).
I dati raccolti da cellule diametro di riposo e le cellule T attivate dopo 48 ore di PMA / stimolazione ionomicina sono riassunti nella Tabella 1. La superficie media e il volume di riposo cellule T spleniche ICR topo erano 151,4 micron 2 e 1,9 x 10 -4 nl, rispettivamente. La superficie media e volume delle cellule T attivate erano 300,6 micron 2 e 5,9 x 10 -4 nl, rispettivamente. L'aumento del diametro medio generale per tutte le celle attivate era 40.92% (Tabella 1).
Abbiamo anche testato altri composti chimici segnalati per essere immunosoppressiva: CsA, FK506, rapamicina, FTY720, e TRAM-34. In figura 3, misurazione delle dimensioni delle cellule ottenute in riposo e cellule T attivate in assenza e presenza di questi farmaci sono mostrati. CSA e FK506, che prendono di mira il fattore nucleare calcineurina-dipendente delle cellule T attivate (NFAT) 27,28, sono stati i più potenti, inibendo la risposta blastogenic di quasi il 72% (Figura 3A e 3B). È interessante notare che, conaumento delle concentrazioni PMA, la potenza di CSA e FK506 sceso leggermente, anche se non vi era alcuna ulteriore aumento del diametro delle cellule, in assenza di questi farmaci (Figura 2a e 2b). Rapamicina, un immunosoppressore che inibisce bersaglio della rapamicina nei mammiferi (mTOR) 29,30, aveva una moderata ma statisticamente significativo effetto (Figura 3A, 3B e 3C). FTY720 è un sfingosina 1-fosfato agonista del recettore dei linfociti che inibisce l'uscita in circolazione 31 ed è stato recentemente trovato per inibire TRPM7, un canale cationico altamente espresso nei linfociti T 32. Sia FTY720 e rapamicina avuto un effetto analogo sulla blastogenesi, riducendola dalla media di un aumento del 52% del diametro a circa il 34% (Figura 3A e 3B). TRAM-34 è un bloccante del canale del potassio calcio-attivato KCa3.1 33. Testato a 700 nm, TRAM-34 era inefficace nelle cellule T murine, in accordo con un recente studio proliferazione delle cellule T umane; la sua potenza può dipendere dalla natura e la forza della stimolazione mitogenica 34 (Figure 3A e 3B). 700 nm TRAM-34 è stato efficace nel bloccare i canali KCa3.1 nei nostri esperimenti di elettrofisiologia patch clamp (dati non riportati). Questo confronto è stato effettuato tra il riposo e le cellule di droga-esposti a prove multiple all'interno dello stesso esperimento a 48 ore. Quando rapamicina e CsA sono stati utilizzati insieme, blastogenesi era completamente inibita (Figura 3C).
L'attivazione delle cellule T murine con anti-CD3 / biglie magnetiche anti-CD28-rivestite per 72 ore ha prodotto un aumento del 27% del diametro medio, che è stato ridotto al 5% in presenza di CsA (Figura 3D). cellule mononucleate umane su PMA / attivazione ionomicina per 48 ore aumentati di diametro del 33%, e l'attivazione in presenza di CsA diminuita risposta al 23% ( Figura 4).
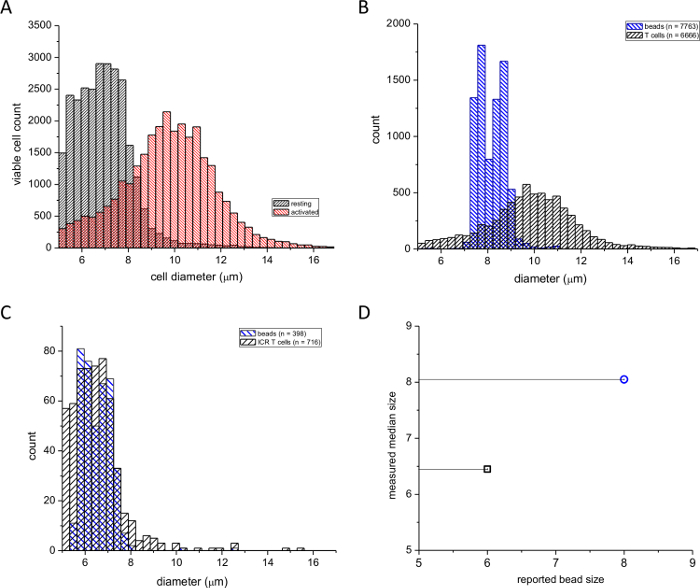
Figura 1: distribuzioni di frequenza dei murini diametri T-cellule della milza. (A) Colonne nere indicano riposo e colonne rosse indicano ionomicina attivati cellule (48 hr) PMA /. (B) Distribuzione di cellule T attivate milza sovrapposte dimensione della particella standard di calibrazione 8 micron. (C) Distribuzione di cellule T sovrapposto uno standard di calibrazione 6 micron riposo. Il numero di cellule e perline utilizzate sono indicate in scatole. (D) mediana diametro misurato dal contatore di cellule tracciato rispetto al diametro del branello riportato dal produttore. Clicca qui per vedere una versione più grande di questa figura.
entro-page = "1"> 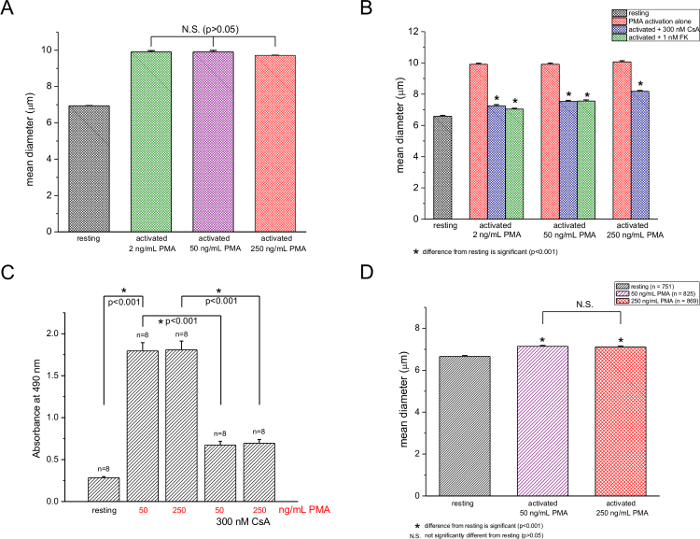
Figura 2: Dipendenza del murino attivazione delle cellule T sulla concentrazione PMA. (A) diametro medio di cellule T sia non trattate o trattate con 2, 50, e 250 ng / ml PMA ad un fisso ionomicina concentrazione (250 nM). Misure (B) contatore di cellule di riposo e attivati (2, 50, 250 ng / ml PMA), le cellule T in assenza e presenza di 300 Nm CsA o 1 nM FK506. (C) MTS saggio di proliferazione a 50 e 250 ng / ml PMA con 250 nM ionomicina in assenza e in presenza di 300 nM CsA. Differenze significative (p <0.001) sono indicati con un asterisco. n è il numero totale di prove. I dati sono da cellule isolate da 3 topi. (D) diametri cellulari di riposo e le cellule T attivate (250 ng / ml PMA e 250 Nm ionomicina) 12 ore dopo l'attivazione in assenza e in presenza di 300 Nm CsA. PLOAD / 55212 / 55212fig2large.jpg "target =" _ blank "> Clicca qui per vedere una versione più grande di questa figura.
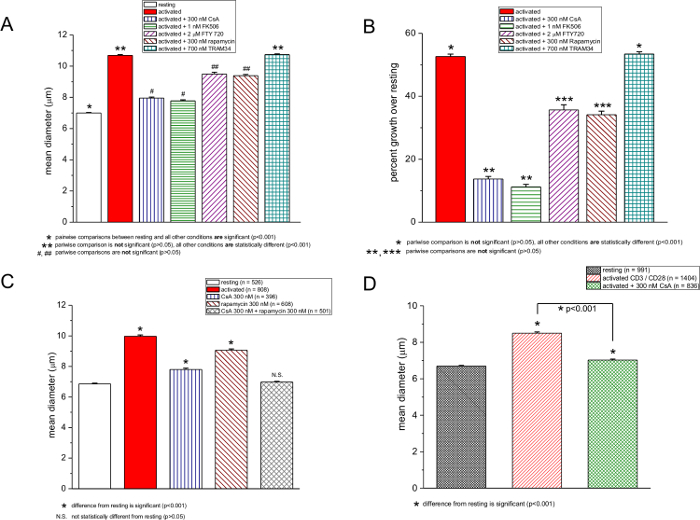
Figura 3: Effetti della CsA, FK506, FTY720, rapamicina, e TRAM-34 sulla dimensione della cella. (A e C) diametri medi delle cellule murine T ionomicina-attivati PMA / riposo e in assenza e presenza di farmaci. Le concentrazioni sono mostrati nella casella. (B) i dati da un espresso come aumento percentuale nel diametro riposo T-cellule. attivazione dei linfociti è stata eseguita con 250 ng / ml PMA e 250 Nm ionomicina, e le misure sono state prese dopo 48 ore. (D) misurazioni contaglobuli di riposo e anti-CD3 / cellule T CD28-attivati, 72 ore dopo l'attivazione in assenza e in presenza di 300 nM CsA.rge.jpg "target =" _ blank "> Clicca qui per vedere una versione più grande di questa figura.

Figura 4: blastogenesi in PBMC umani su stimolo mitogeno. (A) Colonne nere indicano il riposo e le colonne rosse indicano PBMC attivati. (B) diametri medi di riposo e PBMC attivati in assenza e in presenza di 300 Nm CsA. Le cellule sono state attivate con 250 ng / ml PMA e 250 Nm ionomicina, e le misure sono state prese dopo 48 ore di attivazione. Clicca qui per vedere una versione più grande di questa figura.
| Colonna1 | Riposo | Attivato | CsA 100 nM | CsA 200 Nm |
| diametro medio | 6.94 micron | 9.78 micron | 8.19 micron | 7.92 micron |
| Aumento medio Diametro | 40.92% | 17.88% | 14.09% | |
| Superficie media | 151.37 μm² | 300.61 μm² | 210.56 μm² | 197.22 μm² |
| Aumento medio Superficie | 98.59% | 39.00% | 30.16% |
Tabella 1: Sintesi del diametro medio delle cellule e relativi aumenti di superficie. Le misurazioni sono state effettuate 48 ore dopo l'attivazione con 250 ng / ml PMA e 250 Nm ionomicina.
Discussione
Qui, descriviamo una tecnica per la rapida individuazione e la quantificazione delle cellule T trasformazione blastogenic utilizzando un contatore di cellule automatizzato. Nelle nostre condizioni (250 ng / ml di PMA e 250 nM ionomicina stimolazione), la superficie delle cellule è stata aumentata a due volte e il volume tre volte dopo 48 ore di attivazione. Il saggio è sufficientemente sensibile per rivelare sabbiatura durante le prime 12 ore di attivazione, in cui il volume delle cellule aumentato solo 1,25 volte rispetto a riposo (Figura 2D). Un meccanismo più fisiologicamente rilevanti di attivazione delle cellule T con anti-CD3 e anti-CD28 sfere magnetiche rivestite di anticorpi ha prodotto una risposta blastogenic significativa, con un aumento medio di 2,3 volte in termini di volume (72 ore dopo l'attivazione, Figura 3D). Cellule mononucleate umane hanno mostrato una variazione 2,6 volte in volume alla PMA / ionomicina stimolazione per 48 ore (Figura 4). Il diametro medio delle cellule T ICR del mouse della milza e il volume sono stati determinati per essere6.9 micron e 1,9 x 10 -4 nl rispettivamente. PBMC umane (da un donatore sano) avevano un diametro medio di 7,7 micron e un volume medio di 2,7 x 10 -4 nl. Usando questo protocollo, abbiamo provato anche le concentrazioni di PMA in aumento per la loro capacità di attivare le cellule T. Questi risultati monocellulari erano coerenti con saggi di proliferazione eseguite a concentrazioni simili PMA.
Diversi composti riportati di influenzare la proliferazione cellulare sono stati testati: FTY720 31,32; il immunosoppressori ciclosporina A, FK506, e rapamicina 27,28; e TRAM-34, un bloccante dei canali del calcio KCa3.1 attivati 33,35. Abbiamo trovato che, alle concentrazioni testate, gli inibitori più potenti del blastogenesi erano CSA e FK506. Rapamicina ha avuto un effetto soppressivo più piccolo, ma statisticamente significativo sulla blastogenesi. TRAM-34, invece, non ha influenzato blastogenesi.
CsA soppressa sia blastogenesi e proliferation, ma non completamente (Figura 2B e 2C), dimostrando che misura automatizzata contaglobuli è una buona correlazione di efficacia del farmaco nella proliferazione delle cellule T. In presenza di rapamicina insieme con CsA, blastogenesi era completamente inibita, suggerendo che i percorsi NFAT- e mTOR-mediate in combinazione possono completamente spiegare l'allargamento delle cellule T dopo stimolazione mitogenica con PMA / ionomicina (Figura 3C).
La gamma dinamica di alcuni saggi di proliferazione è limitata (vedere Figura 2). Saggi di proliferazione, come quella che abbiamo usato (Figura 2C), segnalare un segnale che include contributi di cellule apoptotiche e necrotiche. misure di modifica del diametro automatizzate non hanno questa limitazione, in quanto le misure riguardano solo le cellule vitali. La vitalità cellulare è valutata dal esclusione trypan macchia blu da sani, cellule vitali. In misurazione delle dimensioni, utilizzando in avantidiffusione della luce in citometria a flusso discriminazione cella doppietto può essere problematico 22. Nelle misurazioni automatiche contaglobuli, nessuna popolazione doppietto stata trovata (Figura 1). Inoltre, la misura era sufficientemente preciso per distinguere tra gli effetti di 100 e 200 nM ciclosporina (Tabella 1) e per rilevare blastogenesi entro 12 ore di stimolazione mitogenica (Figura 2D).
Questo nuovo test è particolarmente utile per un piccolo numero di campioni. Fino a 15 campioni possono essere misurati in 1 ora. Tuttavia, il saggio ha i suoi limiti, molte delle quali possono essere attenuati. Anche se può risolvere efficacemente piccola differenza (<1 micron) di diametro cella, il modello di macchina abbiamo usato ha una soglia inferiore di rilevazione di 5 micron. Questo limite può causare la sovrastima di piccolissime dimensioni delle celle, poiché esclude efficacemente tutte le celle con diametri inferiori. Tuttavia, i modelli più recenti del contatore di cellule hanno rilevazione sogliaolds di ~ 2 micron, che dovrebbe alleviare questo problema. Se c'è troppa detriti nel campione, lo strumento li tratta cellule vive. Inoltre, le bolle d'aria possono occasionalmente entrare nella cella di flusso e causare la distorsione delle immagini di cellule catturate dalla macchina. La distorsione non sembra influenzare la determinazione della vitalità, ma può influenzare i diametri misurati. Pertanto, si raccomanda che tutte le immagini essere controllati dallo sperimentatore bolle d'aria prima che i dati di ogni prova sono accettati per l'analisi. Poiché il software disegna solo cerchi intorno alle cellule, diametri di cellule non sferiche possono essere inclinata verso l'asse lungo, rendendo il dosaggio meno adatto per cellule non sferiche.
Questo test è rapido, prendendo circa 4 min per campione, rispetto ai saggi di proliferazione, che richiedono poche ore. La raccolta dei dati è anche piuttosto semplice utilizzando il software fornito con il dispositivo. Il software è in grado di esportare i dati di misura ad un spreadsheet per l'analisi. Infine, si tratta di una cella singola, al contrario di una popolazione di misura; sia blastogenesi e la proliferazione sono misurati; e distingue tra cellule vitali e morti allo stesso tempo. Può essere utilizzato per valutare vari ceppi di topi per la loro capacità di produrre una risposta immunitaria. Il dosaggio può anche essere utilizzato con successo per la misura della blastogenesi in cellule T da donatori umani (Figura 4), e può essere utilizzato anche in altri tipi di cellule.
Aumenta il volume delle cellule sono noti per contribuire alla regolazione del metabolismo: gonfiore delle cellule stimola la sintesi del glicogeno glutammina-indotta e la lipogenesi in epatociti 36,37. I neutrofili mostrano migrazione associata volume aumenta di 35-60%, mentre gli agenti chemiotattici inducono il 10-15% gonfiore 38-40. Il dosaggio corrente può potenzialmente essere usato per studiare questi processi.
Divulgazioni
The authors have no competing financial interests.
Riconoscimenti
We thank Lucile Wrenshall for the use of the plate reader, Nancy Bigley for useful discussion, and Tom Brown for the gift of ICR mice. This work was funded by grant 1R01AI114804 from the National Institute of Allergy and Infectious Diseases and by WSU Faculty Development funds (to J.A.K.). J.N.G. was supported in part by the National Institute of General Medical Sciences grant R25GM090122.
Materiali
| Name | Company | Catalog Number | Comments |
| RPMI-1640 | Lonza | BW12-702F | |
| 40 μm nylon cell strainers | Thermo Fisher Scientific | 22363547 | |
| nylon wool fiber columns | Polysciences, Inc. | 21759-1 | |
| 50 ml conical tubes | The Lab Depot | TLD431697 | |
| 6-well cell culture treated plates | USA Scientific | CC7682-7506 | |
| 96-well cell culture treated plates | Thermo Fisher Scientific | 130188 | |
| Dimethyl sulfoxide (DMSO) | Fisher BioReagents | BP231-100 | |
| CellTiter 96 AQueous One Solution Cell Proliferation Assay | Promega | G3582 | MTS based assay |
| Cyclosporine A | Sigma-Aldrich | 30024 | |
| FK506 | Cayman Chemical Company | 104987-11-3 | |
| Rapamycin | Santa Cruz Biotechnology | sc-3504 | |
| TRAM-34 | Sigma-Aldrich | T6700 | |
| FTY720 | Sigma-Aldrich | SML0700 | |
| Dynabeads Mouse T-Activator CD3/CD28 | Gibco | 11456D | |
| Phorbol 12-myristate 13-acetate (PMA) | Acros Organics | 356150010 | |
| Ionomycin calcium salt | Sigma-Aldrich | I0634 | |
| Penicillin-Streptomycin | MP Biomedicals | ICN1670049 | 100x stock |
| Dulbecco’s phosphate buffered saline (DPBS) | HyClone | SH30378.02 | 10x stock |
| 1,4-dithiothreitol (DTT) | Research Products International | 12/3/3483 | reducing agent |
| 8 µm micro particle size standard | Sigma-Aldrich | 84192-5ML-F | Actual 8.02 µm |
| 6 µm micro particle size standard | Sigma-Aldrich | 89756-5ML-F | Actual 6.084 µm |
| Single magnetic separation stand for 1.5 - 2 ml tube | V&P Scientific, Inc. | VP772F5 | |
| Cell culture incubator | Forma Scientific | 3110 | |
| Synergy H1 hybrid reader | Bio Tek | BTH1M | |
| Vi-CELL cell viability analyzer | Beckman Coulter | 731050 |
Riferimenti
- Weiss, A., Samelson, L. E., Paul, W. E. T-lymphocyte activation. Fundamental Immunology. , 321-364 (2003).
- Gergely, P., Ernberg, I., Klein, G., Steinitz, M. Blastogenic response of purified human T-lymphocyte populations to Epstein-Barr virus (EBV). Clin Exp Immunol. 30 (3), 347-353 (1977).
- Sanderson, R. J., Rulon, K., Groeneboer, E. G., Talmage, D. W. The response of murine splenic lymphocytes to concanavalin A and to co-stimulator. J Immunol. 124 (1), 207-214 (1980).
- Decoursey, T. E., Chandy, K. G., Gupta, S., Cahalan, M. D. Mitogen induction of ion channels in murine T lymphocytes. J Gen Physiol. 89 (3), 405-420 (1987).
- Nibbering, P. H., Zomerdijk, T. P., Tilburg, A. J., Furth, R. V. Mean cell volume of human blood leucocytes and resident and activated murine macrophages. J Immunol Methods. 129 (1), 143-145 (1990).
- Segel, G. B., Cokelet, G. R., Lichtman, M. A. The measurement of lymphocyte volume: importance of reference particle deformability and counting solution tonicity. Blood. 57 (5), 894-899 (1981).
- Cooper, H. L., Braverman, R. Protein synthesis in resting and growth-stimulated human peripheral lymphocytes. Evidence for regulation by a non-messenger RNA. Exp Cell Res. 127 (2), 351-359 (1980).
- Cooper, H. L., Braverman, R. Close correlation between initiator methionyl-tRNA level and rate of protein synthesis during human lymphocyte growth cycle. J Biol Chem. 256 (14), 7461-7467 (1981).
- Teague, T. K., et al. Activation changes the spectrum but not the diversity of genes expressed by T cells. Proc Natl Acad Sci U S A. 96 (22), 12691-12696 (1999).
- Tzur, A., Kafri, R., Lebleu, V. S., Lahav, G., Kirschner, M. W. Cell growth and size homeostasis in proliferating animal cells. Science. 325 (5937), 167-171 (2009).
- Messele, T., et al. Nonradioactive techniques for measurement of in vitro T-cell proliferation: alternatives to the [3H]thymidine incorporation assay. Clin Diagn Lab Immunol. 7 (4), 687-692 (2000).
- Maghni, K., Nicolescu, O. M., Martin, J. G. Suitability of cell metabolic colorimetric assays for assessment of CD4+ T cell proliferation: comparison to 5-bromo-2-deoxyuridine (BrdU) ELISA. J Immunol Methods. 223 (2), 185-194 (1999).
- Weichert, H., Blechschmidt, I., Schröder, S., Ambrosius, H. The MTT-assay as a rapid test for cell proliferation and cell killing: application to human peripheral blood lymphocytes (PBL). Allerg Immunol (Leipz). 37 (3-4), 139-144 (1991).
- Huang, K. T., Chen, Y. H., Walker, A. M. Inaccuracies in MTS assays: major distorting effects of medium, serum albumin, and fatty acids. Biotechniques. 37 (3), 410-412 (2004).
- Rampersad, S. N. Multiple applications of Alamar Blue as an indicator of metabolic function and cellular health in cell viability bioassays. Sensors (Basel). 12 (9), 12347-12360 (2012).
- Quent, V. M., Loessner, D., Friis, T., Reichert, J. C., Hutmacher, D. W. Discrepancies between metabolic activity and DNA content as tool to assess cell proliferation in cancer research. J Cell Mol Med. 14 (4), 1003-1013 (2010).
- Augustine, N. H., Pasi, B. M., Hill, H. R. Comparison of ATP production in whole blood and lymphocyte proliferation in response to phytohemagglutinin. J Clin Lab Anal. 21 (5), 265-270 (2007).
- Sottong, P. R., Rosebrock, J. A., Britz, J. A., Kramer, T. R. Measurement of T-lymphocyte responses in whole-blood cultures using newly synthesized DNA and ATP. Clin Diagn Lab Immunol. 7 (2), 307-311 (2000).
- Wallace, P. K., Muirhead, K. A. Cell tracking 2007: a proliferation of probes and applications. Immunol Invest. 36 (5-6), 527-561 (2007).
- Quah, B. J., Warren, H. S., Parish, C. R. Monitoring lymphocyte proliferation in vitro and in vivo with the intracellular fluorescent dye carboxyfluorescein diacetate succinimidyl ester. Nat Protoc. 2 (9), 2049-2056 (2007).
- Teague, T. K., Munn, L., Zygourakis, K., Mcintyre, B. W. Analysis of lymphocyte activation and proliferation by video microscopy and digital imaging. Cytometry. 14 (7), 772-782 (1993).
- Böhmer, R. M., Bandala-Sanchez, E., Harrison, L. C. Forward light scatter is a simple measure of T-cell activation and proliferation but is not universally suited for doublet discrimination. Cytometry A. 79 (8), 646-652 (2011).
- Lee, J., Sadelain, M., Brentjens, R. Retroviral transduction of murine primary T lymphocytes. Methods Mol Biol. 506, 83-96 (2009).
- Gunzer, M., Weishaupt, C., Planelles, L., Grabbe, S. Two-step negative enrichment of CD4+ and CD8+ T cells from murine spleen via nylon wool adherence and an optimized antibody cocktail. J Immunol Methods. 258 (1-2), 55-63 (2001).
- Trickett, A., Kwan, Y. L. T cell stimulation and expansion using anti-CD3/CD28 beads. J Immunol Methods. 275 (1-2), 251-255 (2003).
- Pène, J., Rahmoun, M., Temmerman, S., Yssel, H. Use of anti-CD3/CD28 mAb coupled magnetic beads permitting subsequent phenotypic analysis of activated human T cells by indirect immunofluorescence. J Immunol Methods. 283 (1-2), 59-66 (2003).
- Sigal, N. H., Dumont, F. J. Cyclosporin A, FK-506, and rapamycin: pharmacologic probes of lymphocyte signal transduction. Annu Rev Immunol. 10 (1), 519-560 (1992).
- Fruman, D. A., Klee, C. B., Bierer, B. E., Burakoff, S. J. Calcineurin phosphatase activity in T lymphocytes is inhibited by FK 506 and cyclosporin A. Proc Natl Acad Sci U S A. 89 (9), 3686-3690 (1992).
- Pollizzi, K. N., Waickman, A. T., Patel, C. H., Sun, I. H., Powell, J. D. Cellular size as a means of tracking mTOR activity and cell fate of CD4+ T Cells upon antigen recognition. PLoS One. 10 (4), e0121710 (2015).
- Pollizzi, K. N., Powell, J. D. Regulation of T cells by mTOR: the known knowns and the known unknowns. Trends Immunol. 36 (1), 13-20 (2015).
- Mandala, S., et al. Alteration of lymphocyte trafficking by sphingosine-1-phosphate receptor agonists. Science. 296 (5566), 346-349 (2002).
- Qin, X., et al. Sphingosine and FTY720 are potent inhibitors of the transient receptor potential melastatin 7 (TRPM7) channels. Br J Pharmacol. 168 (6), 1294-1312 (2013).
- Wulff, H., Kolski-Andreaco, A., Sankaranarayanan, A., Sabatier, J. M., Shakkottai, V. Modulators of small- and intermediate-conductance calcium-activated potassium channels and their therapeutic indications. Curr Med Chem. 14 (13), 1437-1457 (2007).
- Petho, Z., et al. The anti-proliferative effect of cation channel blockers in T lymphocytes depends on the strength of mitogenic stimulation. Immunol Lett. 171, 60-69 (2016).
- Wulff, H., et al. Design of a potent and selective inhibitor of the intermediate-conductance Ca2+-activated K+ channel, IKCa1: a potential immunosuppressant. Proc Natl Acad Sci USA. 97 (14), 8151-8156 (2000).
- Lang, F., et al. Functional significance of cell volume regulatory mechanisms. Physiol Rev. 78 (1), 247-306 (1998).
- Hue, L. Control of liver carbohydrate and fatty acid metabolism by cell volume. Biochem Soc Trans. 22 (2), 505-508 (1994).
- O'Flaherty, J. T., Kreutzer, D. L., Ward, P. A. Neutrophil aggregation and swelling induced by chemotactic agents. J Immunol. 119 (1), 232-239 (1977).
- Hsu, L. S., Becker, E. L. Volume changes induced in rabbit polymorphonuclear leukocytes by chemotactic factor and cytochalasin B. Am J Pathol. 81 (1), 1-14 (1975).
- Rosengren, S., Henson, P. M., Worthen, G. S. Migration-associated volume changes in neutrophils facilitate the migratory process in vitro. Am J Physiol. 267, C1623-C1632 (1994).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon