Method Article
Monitoramento retículo endoplasmático homeostase do cálcio Usando um
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Endoplasmic reticulum calcium homeostasis is disrupted in diverse pathologies. A secreted ER calcium monitoring protein (SERCaMP) reporter can be used to detect disruptions in the ER calcium store. This protocol describes the use of a Gaussia luciferase SERCaMP to examine ER calcium homeostasis in vitro and in vivo.
Resumo
O retículo endoplasmático (ER) contém o mais alto nível de cálcio intracelular, com concentrações de aproximadamente 5000 vezes maior do que os níveis citoplasmáticos. Um controlo apertado sobre ER cálcio é imprescindível para o dobramento de proteínas, modificação e tráfico. Perturbações para Er cálcio podem resultar na activação da resposta proteína desdobrada, um mecanismo de resposta de stress do ER de três pinos, e contribuir para a patogénese de uma variedade de doenças. A capacidade de controlar alterações ER cálcio durante o início e progressão da doença é importante, em princípio, no entanto, um desafio na prática. Métodos actualmente disponíveis para o monitoramento ER cálcio, tais como corantes e proteínas fluorescentes dependentes de cálcio, têm fornecido uma visão sobre a dinâmica ER cálcio nas células, porém essas ferramentas não são adequados para estudos in vivo. O nosso laboratório demonstrou que uma modificação para o terminal carboxi de Gaussia luciferase confere secreção do repórter em resposta aDepleção de cálcio ER. Os métodos para a utilização de uma base de luciferase, proteína secretada ER monitorização de cálcio (SERCaMP) in vitro e in vivo em aplicações são aqui descritos. Este vídeo destaca injeções hepáticas, manipulação farmacológica de Gluc-SERCaMP, coleta e processamento do sangue e os parâmetros de ensaio para acompanhamento longitudinal de ER cálcio.
Introdução
O funções em muitas capacidades celulares, incluindo o dobramento de proteínas, a secreção de proteínas, a homeostase lipídica e de sinalização intracelular 1 retículo endoplasmático (ER). Central para a função ER normal é manter as concentrações de cálcio luminais em ~ 5.000 vezes aqueles encontrados no citoplasma 2-4. Este processo intensivo de energia é regulada pela ATPase sarco / retículo endoplasmático de cálcio (SERCA), uma bomba que move íons de cálcio para o ER. O efluxo de cálcio do RE é mediada principalmente pela rianodina (RyR) e trifosfato de inositol (IP3R receptores). Uma vez que muitos processos de ER são dependentes de cálcio, interrompendo o armazenamento pode levar ao estresse ER e eventual morte celular.
ER desregulação de cálcio tem sido observada em doenças, incluindo cardiomiopatia, diabetes, doença de Alzheimer, doença de Parkinson e 5. Devido à natureza progressiva destas doenças, tem sido um desafio para delinear a causa-efeito relação entre patogênese e alterações na loja ER cálcio. Uma série de tecnologias têm permitido avanços significativos em nossa compreensão da dinâmica ER cálcio, incluindo corantes e indicadores de cálcio geneticamente codificados (Gecis). Corantes de cálcio de baixa afinidade, que aumentam em fluorescência quando ligados a Ca2 +, podem ser carregados em células para examinar compartimentos subcelulares com elevadas concentrações de cálcio 6. Gecis, tal como Catcher D1ER e permitir o monitoramento das flutuações de cálcio com um controle mais preciso da localização subcelular 7-9. Recentemente, uma outra classe de Gecis chamados indicadores de proteína encapsulada em organelo medição de cálcio (cepia) foram descritos 10. Uma terceira abordagem combinando genética e pequena molécula química é-esterase alvo corante de carga (TED), que utiliza um carboxilesterase geneticamente codificado (voltado para o ER) com um corante à base de cálcio éster 11.
Enquanto o AFORementioned abordagens têm forças e fraquezas inerentes, podem fornecer informações valiosas sobre a dinâmica do cálcio ER através de medições agudos de fluorescência. Eles são, no entanto, não é óptima para os estudos longitudinais muitas vezes necessários para investigar a progressão da doença. Com o objectivo de conceber um método para controlar a dinâmica de cálcio durante grandes períodos de tempo, foram identificados e desenvolvida uma modificação da proteína para criar as proteínas secretadas de monitorização de cálcio ER (SERCaMPs) 12.
SERCaMP contorna várias limitações associadas com outras metodologias, através de uma abordagem minimamente invasiva para interrogar repetidamente o armazenamento de cálcio ER. Temos anteriormente demonstrado que o péptido carboxi-terminal ASARTDL (alanina-serina-alanina-arginina-treonina-leucina-ácido aspártico) é suficiente para promover a retenção no ER; no entanto, em condições que causam decréscimos em ER de cálcio, a sequência do péptido não é mais capaz de reter ER localization e a proteína é secretada 13. A base da tecnologia SERCaMP é o apêndice da ASARTDL ao terminal carboxi de uma proteína segregada (por exemplo, luciferase Gaussia, ou Gluc) de tal modo que a secreção é desencadeada pela depleção de cálcio ER, criando, assim, um repórter robusta de ER desregulação de cálcio 12. A expressão de glic-SERCaMP através de métodos transgénicos permite fluidos biológicos, incluindo meio de cultura celular e de plasma para ser analisado para alterações na actividade gluc como um indicador da homeostase do cálcio ER. O método tem aplicações para o estudo longitudinal de alterações progressivas na loja ER cálcio tanto in vitro como in vivo. O protocolo seguinte é escrito como um esboço geral para a utilização de base SERCaMP-Gluc para estudar a homeostase do cálcio ER, mas o protocolo pode servir como um guia para SERCaMPs repórter alternativos.
Protocolo
1. Ensaio In Vitro: Detecção SERCaMP de lançamento de uma linha celular SH-SY5Y Estável
- Placa SH-SY5Y-gluc-ASARTDL (SERCaMP) em placas de cultura de tecidos tratados com 150.000 células por cm2 de área de superfície. Para placas de 96 cavidades, por exemplo, sementes de 50.000 células por poço (Figura 1A). Crescer as células SH-SY5Y em DMEM (alto teor de glucose, GlutaMAX, piruvato) + 10% de soro de crescimento bovina + 1x penicilina / estreptomicina.
- As células da passagem até 15 vezes (Figura 1B). Número passagem superior não foi testado.
- E volta para as células incubadora humidificada a 37 ° C com 5,5% de CO 2 e incubar durante a noite.
- Antes do tratamento experimental (s), recolher uma amostra de linha de base para cada poço de transferência de 5 ul de sobrenadante de cultura a uma opaco paredes placa de 96 poços. Antes de coletar, bata suavemente a placa de todos os lados e agite para evitar os efeitos da inclinação. Selar a placa opaca com um adesivo sfolha de Ealing e armazenar a 4 ° C até à hora de ensaio enzimático.
Nota: Segregada glic-SERCaMP é muito estável em meio de cultura celular. Nós anteriormente relatado de aproximadamente 5-10% da actividade gluc foi perdido após uma incubação de 72 h a 37 ° C (incubado em células SH-SY5Y) 12. - Tratar as células como desejado para examinar a depleção de cálcio ER (por exemplo, do meio ambiente, farmacológico, as manipulações genéticas). Evitar longa exposição ao ambiente externo (fora da incubadora controlada) como alterações no pH irá ocorrer rapidamente em CO2 atmosférico. Adicionar HEPES ao meio de cultura a 20 mM, para estabilizar o pH 14, se forem necessárias manipulações prolongados. Evite a exposição à luz ao usar HEPES no meio de cultura 15.
- Controlo positivo: Tratar as células com 100 nM thapsigargin (Tg) ou ácido ciclopiazônico 50 mM (CPA) para 4-6 hr para experimentos em células SH-SY5Y. Resposta máxima em outras linhas de células podem exigir incubações mais longas ou concen diferentetrações de compostos.
- Controle negativo: meio de cultura Collect a partir de células SH-SY5Y parentais. Na nossa experiência, a luminescência fundo para este ensaio é de menos de 0,05% de secreção basal a partir de células SH-SY5Y-gluc-SERCaMP estáveis.
- Recolha e armazenamento de amostras de 5 mL de mídia condicionado nas timepoints desejados, conforme descrito na etapa 1.2.
- Avaliar a atividade enzimática no meio como descrito na Seção 5.
- Examine Gluc intracelular por immunoblot ou ensaio de luminescência.
- Para imunotransferência: As células em tampão de lise RIPA modificado contendo 50 mM de Tris (pH 7,4), NaCl 150 mM, desoxicolato de sódio 0,25%, EDTA 1 mM, NP40 a 1% e inibidores de protease. Separado em gel de SDS-poliacrilamida e transferência para uma membrana de PVDF 0.20 uM. Incubar com anticorpo gluc membrana (1: 2000 de diluição) durante a noite a 4 ° C. Execute incubação de anticorpos e de membrana lavagens secundárias, conforme o protocolo definido pelo usuário para reagente de detecção de escolha.
- Paraensaio de luminescência (Figura 2): execute os seguintes passos no gelo:
- Remover todo o meio dos poços da placa de cultura de tecido e lavar com 200 jil de PBS frio.
- Adicionar 75 ul de tampão de lise contendo Tris 50 mM (pH 7,5), NaCl 150 mM, NP40 a 1% e inibidores da protease a cada poço.
- Girar a placa num agitador orbital (120 rpm) a 4 ° C durante 20 min.
- Pipeta suavemente o ligado cima e para baixo usando uma pipeta multicanal, evitando bolhas de ar. Transferir 5 mL de ligado a uma placa opaca e avaliar luminescência conforme descrito na Seção 5.
2. Ensaio In Vitro: A transfecção transiente de células imortalizadas com SERCaMP
Nota: Temos observado que os procedimentos de transfecção transiente pode induzir estresse celular e diminuir o subsequente resposta Gluc-SERCaMP. A seguinte abordagem foi desenvolvida para minimizar transfecção eff ECTS em células SH-SY5Y. Optimização do presente processo (incluindo a escolha do reagente de transfecção) para linhas celulares alternativos pode ser necessária. Quando possível, é recomendado o uso de linhas celulares estáveis ou métodos de transdução viral delineados nas secções 1 e 3, respectivamente.
- Placa de células SH-SY5Y numa placa de 100 mm a 4 x 10 6 células. Este prato vai ser suficiente para re-semente de cerca de 300 poços (96 formato de placa de poço) seguindo o procedimento de transfecção.
- Transfectar células com reagente Xfect utilizando 20 ug de ADN de plasmídeo (que codifica glic-SERCaMP) e 6 uL de reagente Xfect. DNA escala e reagente Xfect em conformidade para recipientes de cultura maiores ou menores.
- Retorno células para incubadora durante 48 horas.
- Tripsinizar as células e propagar novamente para placas de 96 poços a 60.000 células por poço. Siga os passos subsequentes descritos na Seção 1.
3. In Vitro Ensaio: Viral Expression mediada pelo vetor de Gluc-SERCaMP
tenda "> Nota: viral adeno-associado (AAV) vector embalagem 16 e 12 de purificação e produção de lentivírus 13 têm sido relatados previamente.- Titer-gluc SERCaMP AAV utilizando os seguintes iniciadores e sondas: iniciador de sentido directo, 5'-CACGCCCAAGATGAAGAAGT-3 '; iniciador de sentido reverso, 5'-GAACCCAGGAATCTCAGGAATG-3 '; sonda (5'-FAM-6 / 3'-BHQ-1 marcado), 5'-TACGAAGGCGACAAAGAGTCCGC-3 'para a PCR quantitativa.
- Preparar a curva padrão por linearização de um plasmídeo contendo gluc e purificação do ADN utilizando um spin-coluna (por exemplo, Machery-Nagel NucleoSpin Gel de PCR e de limpeza). Quantificar o ADN por separação num gel de agarose ao lado de uma escada de massa. Preparar diluições 1:10 de DNA a partir de 100 pg / ml a 10 fg / ml em PBS. Calcular as cópias / ml de DNA de plasmídeo Gluc em cada uma das concentrações com base no peso molecular do plasmídeo.
- Dilui-se os estoques de AAV em PBS (diluição apropriado será dependenteparâmetros de preparação viral e determinado empiricamente).
- Executar a reacção de PCR num sistema de PCR em tempo real usando as seguintes condições: 95 ° C x 5 min, 94 ° C x 20 seg, e 60 ° C x 1 min durante 41 ciclos. Calcular cópias / ml utilizando a curva padrão.
- Lentivírus título com um p24-X kit Lenti titulação rápida. Descongelar lentivirais alíquotas em gelo e diluir a proteína p24 de controlo em meio SH-SY5Y.
- Dilui-se a lentivírus de tal modo que ele irá cair sobre a curva padrão (por exemplo, 1: 20000 ou 1: 100.000). O factor de diluição necessária irá variar de acordo com os parâmetros da preparação lentivirais e deve ser determinada empiricamente. Siga as instruções do fabricante para todas as etapas subseqüentes.
- Células de placa para placas de 96 poços. Para as células SH-SY5Y, chapeamento procedimentos descritos na Seção 1 pode ser seguido. Por neurónios corticais primários de ratos, as células devem ser isoladas e cultivadas em placas revestidas de forma adequadas previamente descrito 16. Manter neurónios corticais primárias de rato em meio Neurobasal suplementado com B27 1x e 500 uM de L-glutamina. Realizar trocas meio médio em dias alternados.
- Transduzir as células com vírus. O objetivo de transdução viral é conseguir a baixa expressão de nível, como Gaussia luciferase fornece sinal robusto.
- De AAV de transdução de células SH-SY5Y: transdução no dia seguinte chapeamento. Diluir AAV a 6,0 x 10 7 vg / mL em tampão de diluição de AAV (PBS + 0,5 mM MgCl2). Adicionam-se 5 ul de AAV diluída (3,0 x 10 8 VG; MOI de aproximadamente 6000) por poço da placa de 96 poços (Figura 3A). Use 10% de alvejante para inativar resíduos vetor viral.
- De AAV de transdução de neurónios corticais de rato primários: transduzir 6-8 dias após o plaqueamento. Diluir AAV a 4,0 x 10 6 vg / mL em tampão de diluição de AAV. Adicionar 5 uL de AAV diluída (2,0 x 10 7 VG; MOI de aproximadamente 350) por poço dePlaca de 96 poços (Figura 3B). A MOI óptimo deve ser determinado empiricamente para outros tipos de células. Use 10% de alvejante para inativar resíduos vetor viral.
- Transdução lentiviral de células SH-SY5Y: transdução no dia seguinte chapeamento. Diluir lentivírus a 20 pg / mL de p24 (concentração determinada utilizando o kit de titulação) em solução salina equilibrada de Hank. Adicionar 5 uL de vírus diluído por poço (100 pg de p24, equivalente a 1.250.000 partículas lentivirais, ou ~ 1250 IFUs) de uma placa de 96 poços contendo 100 uL de volume. Dimensione adequadamente para formatos maiores. Use 10% de alvejante para inativar resíduos viral.
- Recolha de uma amostra pré-tratamento do meio e iniciar tratamentos experimentais 48 h (SH-SY5Y) ou 5-7 dias (rato primários neurónios corticais) após transdução.
4. Ensaio In Vivo SERCaMP
Nota: Antes de realizar quaisquer procedimentos com animais não se esqueça de obter a devida aprovação através da sua instituição. Tudocirurgias de sobrevivência são para ser feito em condições estéreis com anestesia adequada. Todos os procedimentos descritos abaixo foram aprovados e estão em conformidade com as diretrizes do NIH ACUC.
- Instrumentos cirúrgicos autoclave antes do início da cirurgia (121 ° C, 30 minutos de esterilização, o tempo de secagem de 20 minutos). Limpe todos os instrumentos de uma ultrasonicator imediatamente a seguir todos os procedimentos e antes da autoclavagem. Manter condições estéreis durante a cirurgia sobrevivência. Para cirurgias que requerem vários animais, limpar instrumentos cirúrgicos com 70% de álcool, ultrasonicate e talão esterilizar entre ratos. Consulte a Lista de Materiais para instrumentos necessários.
- Prepare rato para a cirurgia. Aqui usamos Sprague-Dawley machos (180-200 g).
- Anestesiar ratos utilizando isoflurano gás durante 3 min (4-5% de isoflurano entregue a 1.000 cc / min), seguido de injecções intraperitoneais de xilazina (8 mg / kg) e cetamina (80 mg / kg). Aplicar pomada oftálmica para proteger córneas de secar. Bcirurgia egin uma vez que o rato está profundamente anestesiado como demonstrado pela ausência de reflexo de retirada seguinte cauda ou pé pitada.
- Raspar a região do abdômen ligeiramente abaixo das costelas (baixo região torácica) para a região abdominal média. Esfregue a área cirúrgica três vezes, alternando 70% de álcool e Betadine matagal. Coloque rato em decúbito dorsal na área cirúrgica esterilizada com campos cirúrgicos estéreis.
- Diluir AAV-gluc-SERCaMP a 7,6 x 10 9 vg / ml (concentração final). Misturar bem invertendo o tubo.
Nota: Faixa de concentração pode variar viral (Figura 4).- Pipetar 105 l de AAV diluída num prato esterilizado. Utilize uma agulha de calibre 30 para recolher o vírus para uma seringa.
- Realizar a cirurgia para expor o fígado e injetar AAV-Gluc-SERCaMP.
- Antes de se fazer uma incisão no abdómen, aplicar bupivacaína a 0,25% para a área da incisão. Usando um bisturi, fazer uma incisão horizontal abaixo da caixa torácica (apmadamente 2-3 cm). Blunt dissecar para separar o tecido conjuntivo da hipoderme.
- Corte músculo abdominal, expondo o lóbulo medial direito de fígado.
Nota: lóbulos adicionais podem ser injetados com base na aplicação final. - Coloque o animal sob microscópio cirúrgico e ajustar para obter lóbulo medial direito de fígado no campo de visão. Injetar vírus no parênquima do lobo medial; 3 locais diferentes, cerca de 33 mL por local.
Nota: Deixar agulha no tecido durante 5-10 segundos após a injecção para garantir a entrega de todo o volume de injecção. - Suturar o músculo abdominal e pele separadamente e adicionar Neosporin usando algodão aplicador com ponta. Coloque rato numa câmara de recuperação até que a consciência é recuperada e rato é capaz de manter a posição vertical. Não deixe de rato (s) sem vigilância até que tenha recuperado a consciência suficiente para manter decúbito esternal. Casa isoladamente até que a incisão foi curado e suturas foram removidas (7-14 dias).
Nota: De acordo com as diretrizes do NIH pós-cirúrgicas, manter registro cirúrgico. Anotar cartão de gaiola com procedimento, data, identificação do experimento, o peso corporal e dia da cirurgia. Dor / desconforto, a produção de fezes, atividade e consumo de alimentos e água estão a ser monitorado e registrado 3 dias pós-cirurgia. Analgesia pós-operatória é fornecido pela adição de acetaminofeno para a água potável (450 mg / 100 cc), embora nós normalmente não observar sinais de dor ou desconforto após a cirurgia.
- Comece a coleta de sangue da cauda 4-7 dias após a injeção. Prepare tubos de coleta de sangue por meio de rotulagem e pré-pesagem. Adicionar 50 uL de heparina (1000 U / ml) a cada tubo.
- Ponto de rato na câmara de anestesia de isoflurano durante 3 min (4-5% de isoflurano entregue a 1.000 cc / min). Remover rato da câmara e coloque no cone do nariz (2-3% isoflurano entregue em 500 cc / min). A coleta de sangue pode começar uma vez que o rato está profundamente anestesiados como demonstrado pela ausência de reflexo de retirada seguinte cauda piNCH.
- Usando uma tesoura esterilizada cortar ponta da cauda (1-2 mm) e coletar sangue gota a gota, em pré-cheia tubo de heparina. Recolha de sangue até o volume atinge maior do que 2: 1 a relação de heparina no sangue (> 100 mL de sangue / 50 uL de heparina). Volumes de colheita de sangue pode ser ajustada com base no projeto experimental. Use um aplicador de algodão molhado para aplicar o pó styptic para a cauda para parar o sangramento.
- Tubos de sangue da loja, a 4 ° C, se a recolha de amostras subsequentes. Limpe a tesoura com almofada de etanol e talão esterilizar entre coleções.
- Pesar tubos de coleta e ajuste com heparina para obter proporção 2: 1 (sangue: heparina). Este passo irá normalizar a quantidade de heparina em cada amostra (Tabela 1).
- Tubos de centrífuga a 2000 xg durante 5 min a 4 ° C. Transferir o sobrenadante (plasma) para um tubo fresco e armazenar a -80 ° C até à hora de ensaio de luciferase (seção 5).
Nota: o armazenamento de amostras a 4 ° C até 72 horas antes do ensaio enzimático tem minimal efeito sobre luminescência (Figura 5A). Até 3 ciclos de congelação-descongelação de amostras de plasma não têm efeito sobre luminescência (Figura 5B).
- Administração tapsigargina (controlo positivo):
- Prepare tapsigargina por diluição em etanol a uma concentração final de 2,5 mg / ml. Injectar thapsigargin a 1 mg / kg ip na parte inferior do abdômen.
Nota: tapsigargina aumenta induzida pela trombina coagulação das plaquetas 17 e pode fazer a coleta de sangue da cauda mais difícil.
- Prepare tapsigargina por diluição em etanol a uma concentração final de 2,5 mg / ml. Injectar thapsigargin a 1 mg / kg ip na parte inferior do abdômen.
- Gaussia ensaio de luciferase:
- Descongelar as amostras de plasma em gelo.
Nota: Para os estudos longitudinais, degelo e realizar ensaio de luminescência para todas as amostras timepoint no mesmo dia (usando preparação única de substrato). - Transferência de 10 ul de plasma a uma placa com paredes opacas e medir a atividade enzimática como descrito na seção 5. Execute 3-4 repetições técnicas de cada amostra de plasma.
- Descongelar as amostras de plasma em gelo.
- Euthanasiuma
Nota: A vantagem da tecnologia SERCaMP é a capacidade de se longitudinalmente monitor de ER cálcio. Dependendo dos parâmetros experimentais e endpoint análises, os animais são de ser sacrificados por medidas adequadas para endpoint analisa e em conformidade com orientações ACUC institucionais.
5. Ensaio de luminescência
- Prepare soluções coelenterazina (CTZ), diluindo o composto em metanol acidificado (30 mL de 10 N de HCl a 3 ml de metanol) a 20 mM. Preparar alíquotas de uso único e armazenar a -80 ° C.
- Prepara-se o substrato de trabalho no dia do ensaio.
- Para ensaios in vitro, diluir coelenterazina a 8 uM em PBS, por exemplo, adicionar 10 ul de estoque de 20 mM a CTZ 25 ml de PBS (Figura 6A, B).
- Para ensaios in vivo, diluir coelenterazina para 100 M em PBS, ácido ascórbico 500 mM, NaCl 5.
- Incubar CTZ preparado para, pelo menos, 30 minà temperatura ambiente antes de iniciar o ensaio.
Nota: Esta etapa é muitas vezes incluído em Gaussia ensaios de luciferase, pois há relatos de decadência substrato rápido durante o primeiro 30 minutos após a preparação. Não observamos este efeito em nosso sistema (Figura 6C); no entanto, que muitas vezes incluem o passo de incubação que temos encontrado nenhum impacto negativo sobre o ensaio. - Usar um leitor de placas que é capaz de monitorizar a bioluminescência e equipado com um injector de substrato. Prime as linhas com substrato.
Nota: O substrato inicial através das linhas pode ser propenso à degradação. Para evitar leituras artificialmente baixos para amostras iniciais, injetar 20-30 poços vazios (que carregam um prato vazio no leitor) antes de medir amostras experimentais. - Injectar 100 ul de substrato para os poços, agitar velocidade média durante 5 segundos, e medir a emissão de luz. Para o leitor de placas Biotek Sinergia II, integrar a emissão de luz ao longo de 0,5 segundos (amostras in vitro) e 5 segundos (emamostras in vivo) para a etapa de leitura. Otimizar os parâmetros de leitor de placas para o desempenho do ensaio ideal.
Nota: exposições Gaussia luciferase cinética flash com deterioração rápida do sinal (em comparação a brilhar cinética observadas com outros luciferases). A cinética em flash de Gluc é influenciada por soro em meio de cultura de células (Figura 7A), destacando a importância de controlar a composição do meio através de amostras. Devido à rápida decomposição de luminescência após a adição de substrato (cinética de flash), o tempo entre Inject e ler passos deve ser uniforme para todas as amostras. O leitor de placas deve ser definido para injetar substrato para um bem, espere um tempo fixo (por exemplo, usamos um passo trepidação 5 seg), e ler muito bem. A adição de substrato a uma placa inteira antes de leitura apresenta um desafio significativo, a menos que de substrato pode ser adicionado a todas as cavidades ao mesmo tempo. Se um injector não está disponível, o problema pode ser parcialmente contornadas por incubação da placa durante 10 min entre o substrato adição e medição (evitando assim a parte íngreme da curva de decaimento) (Figura 7B). - Repetir a injecção, o tempo de espera, e ler passos para cada poço na placa.
Resultados
O método Gluc-SERCaMP permite a avaliação da homeostase do cálcio ER por amostragem líquidos extracelulares. Vários controlos podem ser incluídos no desenho experimental para melhorar a interpretação dos resultados. Em primeiro lugar, a utilização de um repórter constitutivamente segregada (por exemplo, sem a glic ASARTDL C-terminal ou "n-gluc Tag") podem ser empregues para avaliar os efeitos dos tratamentos experimentais sobre a via secretora (secreção celular global) e de expressão do transgene. Por exemplo, um aumento nos níveis extracelulares de ambos glic-SERCaMP e glic-Tag n seria considerado um resultado ambíguo. Alternativamente, um aumento na secreção de glic-SERCaMP com uma correspondente falta de glic-n resposta Tag suporta um evento dependente ER cálcio (Figura 8). A secreção de glic-SERCaMP em resposta a depleção de cálcio ER pode ser adicionalmente avaliada medindo intracelular Gluc, embora esta se limita a um único ponto de tempo, como é requerido de lise. Int racellular glic-SERCaMP irá diminuir em resposta a depleção de cálcio do ER, tal como é progressivamente segregada, e o extracelular: rácio intracelular (calculado para cada poço individual) vai aumentar (Figura 2B). O extracelular: rácio intracelular é útil para controlar as variações de expressão do transgene.
Moduladores farmacológicos da loja ER de cálcio pode ser utilizado para confirmar a contribuição de ER a libertação de cálcio em SERCaMP novos paradigmas. Dantroleno, um antagonista RyR, é conhecida por estabilizar cálcio ER, o que deve reduzir ou inibir a libertação de SERCaMP em resposta a Tg (Figura 8B). Recomenda-se, quando possível, para testar outros compostos que afectam o fluxo de cálcio ER (por exemplo Xestospongin C, 4-cloro-m-cresol) em paradigmas experimentais que empregam novos SERCaMP. Esses estudos são muitas vezes um desafio in vivo, mas pode ser viável em modelos de cultura de tecido correspondente.
"> Para estudos in vitro utilizando SERCaMP baseado em Gluc, é recomendado para calcular respostas sobre placas individuais em relação ao controle (s). A resposta 'induzida tratamento" pode ser avaliada através da timecourse por meio de mudanças em resposta relativa em relação ao controlo ( para entre-plate comparações). Não é aconselhável para comparar números brutos em vários pratos, devido à deterioração de substrato, o que pode levar a alterações nos valores brutos entre timepoints (Figura 6C). Fazendo comparações relativas dentro de uma placa minimiza esse efeito (Figura 6D). Um exemplo de dados para análise in vitro induzida por Tg SERCaMP experiência de libertação é apresentada na Figura 9.Para os estudos in vivo utilizando Gluc-SERCaMP, os dados devem ser avaliados de forma independente para cada animal, com cada animal que serve como seu próprio controle "pré-tratamento". Isso é necessário para explicar a variabilidade na transgene delivery e expressão entre animais (Figura 4A).
A magnitude das respostas SERCaMP irá ser afectada por uma variedade de factores, muitos dos quais estão relacionados com a saúde da linha de base das células e podem ser directamente controlados pelo investigador. Para máxima capacidade de resposta SERCaMP, é imperativo para optimizar as condições que favorecem a homeostase basal ER cálcio. Isto inclui células de sementeira com uma densidade óptima e utilizando os títulos virais baixos. Diferentes tipos de células e tecidos podem ter requisitos adicionais, que devem ser determinadas empiricamente.
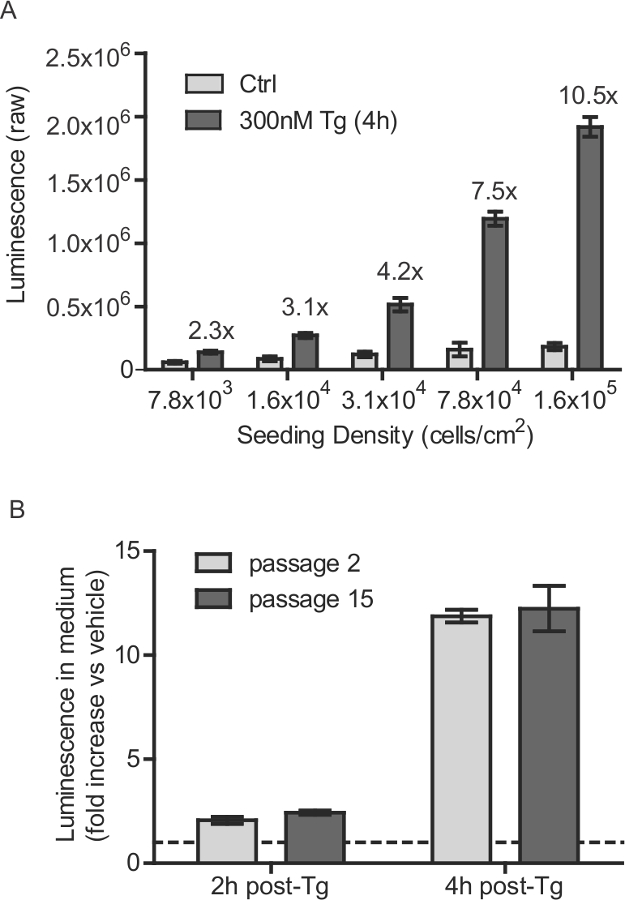
Figura 1:. Estável SH-SY5Y linha de células de densidade de sementeira e considerações número de passagem (a) células SH-SY5Y-gluc-SERCaMP foram inoculadas a várias densidades e incubou-se durante 40 h. Segregada glic-SERCaMP foi medida 4 horas depois do tratamento com 300 nM O Tgcontrolo do veículo R (média ± DP, n = 6). Aumento induzido por tapsigargina na secreção de glic-SERCaMP é indicado para cada densidade de células. Células (B) SH-SY5Y-Gluc-SERCaMP na passagem número 2 e 15 foram examinados para a secreção induzida por thapsigargin. As células foram tratadas com 100 nM de Tg durante 2 horas ou 4 horas, e a actividade gluc secretada foi normalizada para os controlos tratados com veículo (média ± DP, n = 4, nenhum efeito significativo de passagem factor, 2-way ANOVA). A linha tracejada indica y = 1. Por favor, clique aqui para ver uma versão maior desta figura.
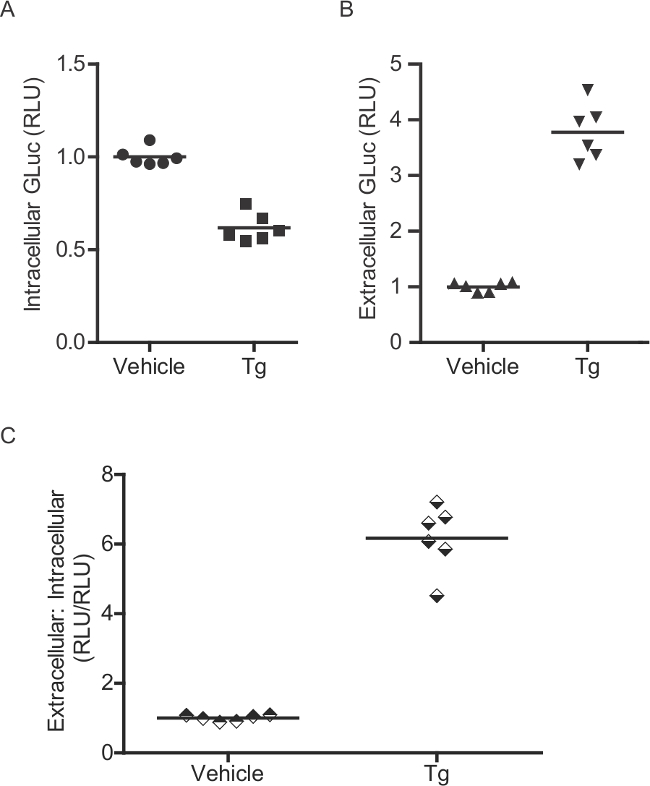
Figura 2:. Ensaio enzimático para a medição de glic-SERCaMP intracelular (A) e intracelular (B) actividade enzimática extracelular gluc foi avaliada em ratos CR primárioneurônios ticos (transduzidas com AAV-Gluc-SERCaMP). Seis dias após a transdução, as células foram tratadas com 60 nM de tapsigargina durante 4 h. Como glic-ASARTDL acumula-se no meio, diminuições correspondentes nos níveis intracelulares são observados. (C) Um rácio de extracelular: gluc actividade intracelular pode ser calculada para cada poço individual.

Figura 3:. AAV-gluc-ASARTDL título contra a resposta induzida por tapsigargina em células SH-SY5Y e de rato neurónios corticais primárias (A) células SH-SY5Y foram semeadas em placas de 96 poços a 5 x 10 4 culas por po e deixadas aderir durante a noite. As células foram transduzidas com o indicada multiplicidade de infecção (MOI), incubadas durante 48 hr e, em seguida, tratada com 300 nM de Tg ou veículo. A luminescência foi medido no meio após 8 h (média ± SEM, n = 3). * P <0,05, Multestes t tiple (correção Holm-Sidak). (B) Rat neurônios corticais primárias foram transduzidas em div8 com AAV-Gluc-ASARTDL no MOI indicado (calculada com 60.000 células por poço aproximação no momento da transdução). Cinco dias após a transdução, as células foram tratadas com 100 nM de Tg ou de controlo de veículo e de luminescência no meio foi medida após 8 h (média ± SEM, n = 6). * P <0,05, vários testes t (correcção Holm-Sidak).
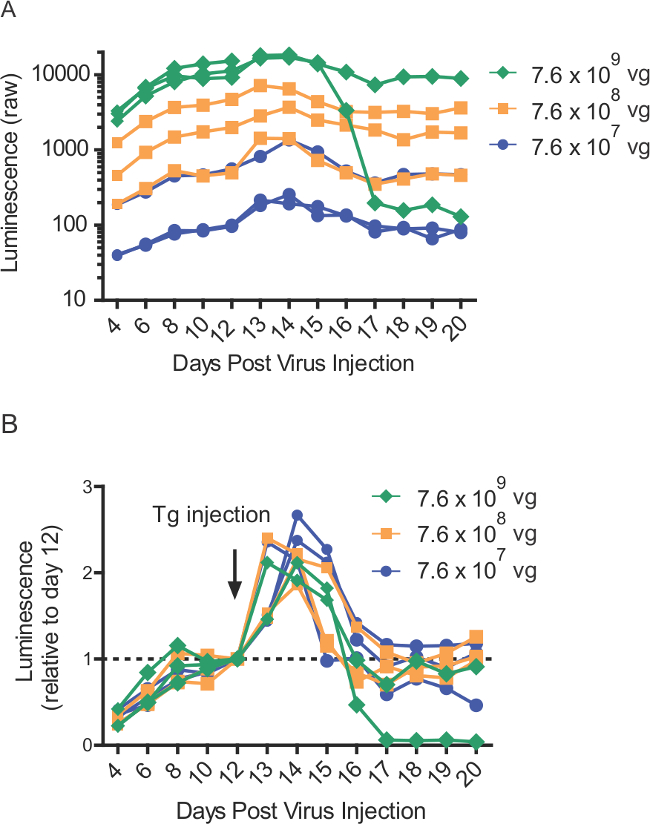
Figura 4:. Tapsigargina-induzida liberação Gluc-SERCaMP em sangue após injecções intra-hepática mais de gama de títulos virais (A) os valores de luminescência-primas de ratos (n = 8) intrahepatically injetados com diferentes títulos de AAV-Gluc-ASARTDL. Tapsigargina (1 mg / kg) de injecção (ip) foi administrada no dia 12. Recolheu-se sangue em pontos de tempo indicados e armazenou-se a -80 & #176; C até à altura do ensaio. (B) a partir de valores de luminescência normalizadas painel A, demonstrando a resposta SERCaMP induzida por tapsigargina em ratos (n = 8) que expressam várias quantidades de AAV-gluc-ASARTDL.

Figura 5:. Manuseamento e armazenamento de amostras de plasma glic-SERCaMP (in vivo) (A) O plasma foi recolhido de ratos intrahepatically expressando glic-SERCaMP (n = 10), aliquotado e armazenado a -80 ° C até à altura de ensaios. Os tubos foram removidos a partir de -80 ° C e armazenado a 4 ° C durante períodos de tempo indicados antes da medição da luminescência (média ± DP). (B) Efeito de múltiplos de congelamento / degelo de amostras de plasma em Gluc atividade enzimática. As amostras de plasma recolhidas a partir de ratos que expressam intrahepatically AAV-gluc-SERCaMP (n = 10) foram submetidos ao número indicadode ciclos de congelamento e descongelamento e testada por luminescência (média ± DP).

Figura 6:. Preparar substrato coelenterazina para ensaios de glic-SERCaMP médio (A) de cultura foi recolhido a partir de SH-SY5Y-gluc-SERCaMP linhas de células tratadas com 300 nM de Tg (ou de controlo de veículo) durante 5 h. Gluc actividade no meio foi avaliada por injecção de PBS + várias concentrações de coelenterazina (média ± DP, n = 6). (B) a partir de valores de luminescência painel A foram normalizados para controlo tratado com veículo em cada concentração de substrato para avaliar o efeito induzido por tapsigargina. (C) Substrato cárie ao longo de várias horas. A luminescência a partir de uma quantidade conhecida de gluc recombinante (ou 0,1 ng 0,02 ng) foi medida ao longo de várias horas após a preparação de substrato (média ± DP, n = 4). (D) Enquanto a luminescência cru para o recombinanteGluc diminuiu ao longo do tempo devido à deterioração do substrato, a diferença de dobragem nas amostras (tal como determinado por luminescência) foi mantida.
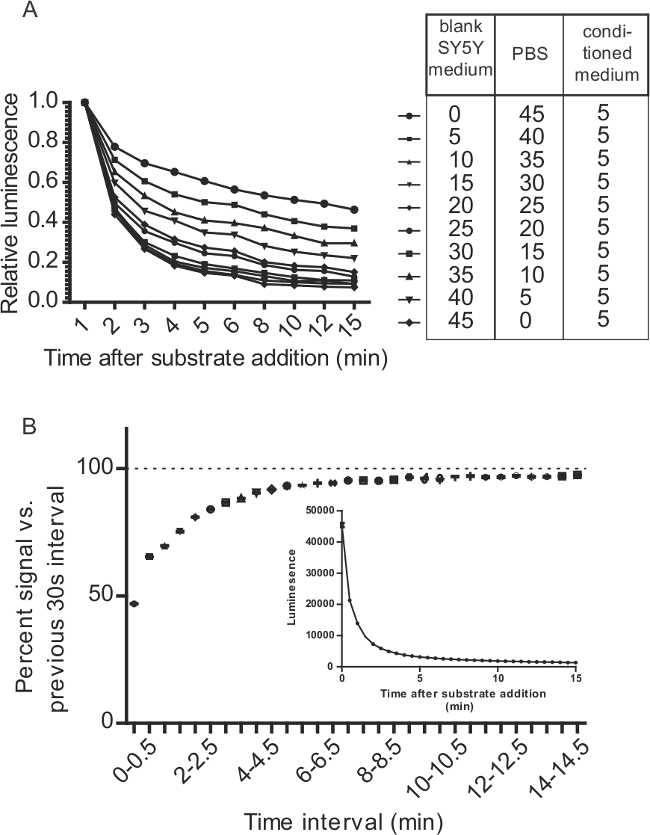
Figura 7:. Considerações para ensaios Gluc-SERCaMP relacionados à cinética de reação Gluc / CTZ (A) O meio de cultura altera a decadência do sinal Gluc / CTZ. 5 ul de sobrenadante contendo glic-SERCaMP foi misturado com razões variáveis de PBS e meio de cultura. 100 ul de substrato (15 uM ctz em ácido ascórbico + 500 mM PBS) foi adicionado a 50 ul de amostra, que foi diluído como descrito na tabela. A emissão de luz foi monitorizada ao longo de 15 min. (B) 5 mL de meio foi recolhido a partir de células SH-SY5Y-gluc-ASARTDL e 100 ul de substrato (8 uM em PBS + CTZ mM de NaCl 5) foi adicionado. A luminescência foi medida imediatamente após a adição do substrato (t = 0) e a cada 30 seg durante ao longo de 15 min (± SD, n = 12). Os dados são representados como o sinal por cento em relação ao anterior intervalo de 30 s para avaliar a taxa de decomposição. O gráfico inserido mostra os dados em bruto de luminescência.

Figura 8:. Corroboração farmacológico a depleção de cálcio ER (A) Efeito de 100 nM de tapsigargina sobre a secreção de gluc foi examinada para glic-ASARTDL e glic-n controle Tag (média ± DP, n = 6). (B) Estabilizar cálcio ER com dantrolene (RyR antagonista) inibe a liberação SERCaMP induzida por Tg. As células foram pré-tratadas com as concentrações indicadas de dantroleno, durante 30 minutos ou 16 horas antes da adição de 100 nM de tapsigargina. Gluc actividade no meio foi medida após 4 h (média ± DP, n = 6).
99fig9.jpg "/>
Figura 9:. Resultados representativos Mock para o ensaio Gluc-SERCaMP Nota do veículo valores tratados pode diminuir entre placas, devido ao substrato quebra (dependente do intervalo de tempo entre a leitura de placas individuais). Para ter em conta este efeito, o efeito de um tratamento específico é calculado de forma independente para cada placa e esta relação é comparada entre as placas.
| Encontro | Rato | Tubo de massa (mg) | A heparina de volume (ml) | A heparina densidade (g / ml) | massa heparina (mg) | Massa de tubo + heparina (mg) | Massa total após a coleta de sangue (mg) | Massa de sangue coletadas (mg) | Sangue Densidade (g / ml) | Sangue volume calculado (ul) | Volume de heparina necessária para 2: 1 proporção | ml de heparina adicional para adicionar antes de spin |
| 01.01.15 | SD machos | 1135,9 | 50 | 1.117 | 55.83 | 1.191,73 | 1.317,70 | 125,97 | 1.05 | 119,97 | 59,98 | 9.98 |
Tabela 1:. Sangue coleção de tabela Exemplo de log de coleta de sangue para estudos SERCaMP.
Discussão
Este protocolo destaca o in vitro e in vivo da utilidade glic-SERCaMP para monitorar a depleção de cálcio ER. Embora a modificação de proteínas para gerar SERCaMP parece generalizar a outras proteínas repórter 12, optamos Gaussia luciferase por sua robusta (200-1.000 maior vezes) bioluminescência em comparação com outras luciferases 18. Nós demonstramos detectável libertação induzida por thapsigargin Gluc-SERCaMP através de uma gama de doses 100 vezes de vírus Gluc-SERCaMP entregue a ratos primário neurônios corticais, células SH-SY5Y e fígado de rato (Figuras 3 e 4). Nós anteriormente descrita a geração de uma linha celular estavelmente transfectada expressando glic-ASARTDL e demonstrou que apenas 20 células de uma população de 5 x 10 4 células não marcados podem relatar um tapsigargina induzida resposta 12. Aqui, mostramos que a linha de células estável pode reportar de forma consistente resposta induzida-Tg para as passagens 15, o mais analyzEd, indicando que a expressão contínua do repórter ao longo do tempo não tem impacto sobre a sua capacidade de ser libertado em resposta a depleção de cálcio ER (Figura 1). Os nossos dados indicam que glic-SERCaMP é realizada principalmente no RE de uma célula até um tempo de esgotamento de cálcio ER quando é segregada. Em condições "normais", há uma baixa secreção basal que permite o estabelecimento de linha de base ER homeostase do cálcio 12. Após a depleção de cálcio ER por tapsigargina, níveis de mudança luminescência intracelular e extracelular em sentidos opostos. Isto pode ser expresso como uma razão para indicar uma mudança na distribuição em estado estacionário do sensor (Figura 2). É importante notar, como libertação SERCaMP é modulada pela expressão do receptor KDEL 12, a magnitude de libertação pode variar dependendo do tipo de célula. Nós prevemos que a substituição de 'ASARTDL' com sequências carboxi-terminal KDEL-como suplentes podem ser necessários para alcançar maxiMal SERCaMP resposta de uma célula ou tecido tipo específico.
Para ensaios in vitro, de níveis extracelular glic-SERCaMP irá acumular ao longo do tempo devido à estabilidade do repórter secretada; que relatou uma diminuição aproximada de 5-10% da atividade após 72 h 12. Como tal, a troca de meio antes de se iniciar um efeito farmacológico ou desafio genética para a homeostase do cálcio ER pode ser necessário para reduzir o sinal de fundo devido à acumulação de sensor. Em contraste, a semi-vida de glic-SERCAMP in vivo é 3,5-4,7 min 12 indicando sinal no plasma representa um recente libertação do repórter para o sangue circulante. Uma vez no sangue ex vivo e é processado ao plasma, no entanto, glic-SERCaMP é muito estável (Figura 5).
Para as metodologias descritas, médio ou plasma é transferido para placas de 96 poços opaca antes ensaios enzimáticos. Dois fatores importantes a considerar quando se utiliza repórter baseado em Glucs são cinética de flash da enzima e do substrato repartição coelenterazina. Leitores de placas equipadas com injectores são os mais adequados para a execução de Gluc ensaios enzimáticos para normalizar o tempo entre a adição do substrato e medições de luminescência. As propriedades químicas de coelenterazina torná-lo propenso a decadência, o que impede comparação de valores de luminescência matérias medidas em momentos diferentes após a preparação do substrato. Fold diferenças entre as amostras, no entanto, são mantidos (Figura 6), permitindo que a diferença relativa entre o controlo e amostras experimentais a ser rastreado ao longo da duração das experiências (Figura 9).
A capacidade para monitorizar as flutuações ER cálcio in vivo é vantajosa quando se investiga doenças progressivas. Enquanto que outros métodos, tais como corantes fluorescentes citoplasmáticos, são adequados para estudos in vitro aguda, um repórter SERCaMP é o primeiro a permitir a monitorização de cálcio ER longitudinal. Our protocolo descreve injeções hepáticas diretos de AAV-Gluc-SERCaMP. Nós detectamos níveis estáveis de Gluc-SERCaMP em circulação de animais não impugnadas por 56 dias após a injecção (último ponto de tempo testado até agora) e prever experimentos mais longos são possíveis 12. Os vectores de AAV são de pequena dimensão, medindo cerca de 20 nm de diâmetro, e colocam requisitos mínimos de segurança biológica 19. Para contornar a conversão do genoma de AAV de cadeia simples ao ADN de cadeia dupla, o AAV-SERCaMP foi empacotado como um serotipo de AAV-1 de cadeia dupla, vector 20. Serotipo do AAV-1 tem sido mostrado para transduzir eficazmente os fígados de ratos 19,21; No entanto, a ressalva de a técnica de injecção é o potencial para o vírus de viajar para outros tecidos em todo o corpo. Embora o vector foi injectado directamente para o fígado, a metodologia tal como apresentada não pode discernir a fonte de libertação SERCaMP, e, portanto, é possível que outros tecidos do que o fígado pode contribuir para a glic-SERCsinal AMP. Manipulações genéticas futuras irá restringir a expressão para segmentar tipos de tecidos. Por exemplo, linhas de driver específicos de tecidos Cre cruzado com uma Cre-dependente glic-SERCaMP permitirão o controlo específico de tecido de ER de cálcio através de amostragem de plasma.
A técnica descrita utiliza in vivo títulos virais baixos devido à natureza sólida do repórter. Libertação glic-SERCaMP pode ser detectado a partir de uma gama de 7,6 viral x 10 7 a 7,6 x VG 10 VG 9 (Figura 4). Esse intervalo é 4-400 vezes menor do que o relatado em trabalhos anteriores utilizando injeções de base viral luciferase de pirilampo do fígado 19. Em concentrações mais elevadas, observou-se uma perda de expressão detectável ao longo do tempo, o que é possivelmente devido a uma resposta imune do animal para o transgene 22. Títulos mais elevados de vírus deve ser evitado sempre que possível devido ao aumento da probabilidade de perda de sinal. Títulos mais baixos do que aqueles apresentados não seren testado. Este protocolo descreve injecções de AAV-gluc-SERCaMP em fígado; abordagens semelhantes estão em teoria viável para outros tipos de tecidos. Parâmetros tais como a concentração do serotipo viral e tem de ser optimizada para a expressão suficiente em outros tecidos.
Devido à natureza robusta do repórter, pequenos volumes de sangue (100-150 uL) podem ser recolhidos a partir de recortes de cauda, para permitir que toda a colecções repetidas experiências. Este foi útil para caracterização longitudinal de liberação Gluc-SERCaMP em resposta a thapsigargin, onde observou-se níveis elevados após a administração thapsigargin seguido por um retorno aos níveis basais (Figura 4). Manuseio correto das amostras de plasma seguintes coleta de sangue também é importante. Como tal, nós demonstramos que SERCaMP é estável no plasma armazenado a 4 ° C até 72 horas antes do ensaio enzimático (Figura 5). Além disso, as amostras de plasma podem sofrer pelo menos três congelamento / tHaw ciclos com um efeito mínimo sobre luminescência (Figura 5). Na prática, armazenar todas as amostras a -80 ° C, evitar desnecessária ciclos de congelamento e descongelamento antes da avaliação ensaio enzimático, e analisar todas as amostras de uma experiência ao mesmo tempo.
ER depleção de cálcio está implicado na patogénese de uma variedade de doenças. Muitas vezes, é pensado para ser um evento a montante que impede as funções celulares e conduz à activação da resposta de proteína desdobrada (UPR). O UPR é uma resposta adaptativa empregada pela ER para restabelecer condições homeostáticas 5. Estados crônicos de estresse ER exceder a capacidade do UPR para restaurar a homeostase, em última análise, levando à morte celular. ER stress e ER desregulação de cálcio são observadas em doenças tais como a diabetes de tipo 1, nefropatia diabética, doenças neurodegenerativas e cardiovasculares dieases 5. A relação entre a desregulação de cálcio e patogénese da doença, no entanto, é difficult para delinear. A tecnologia SERCaMP tem o potencial para rastrear este processo ao longo da vida de um animal, proporcionando assim uma visão sobre o desenvolvimento e progressão da doença. Além disso, a avaliação de potenciais agentes terapêuticos destinados a prevenir ou corrigir desregulação cálcio ER pode ser avaliada através da utilização de SERCaMP. Finalmente, a identificação de doenças em que ocorre a libertação glic-SERCaMP oferece a oportunidade de manipular e empregam proteínas terapêuticas segregadas ou péptidos como SERCaMPs como um meio de terapia de genes regulados doença.
Divulgações
The authors have nothing to disclose.
Agradecimentos
This work was supported by the Intramural Research Program at the National Institute on Drug Abuse. We thank Doug Howard, Chris Richie, Lowella Fortuno, and Josh Hinkle for their contributions to developing this method.
Materiais
| Name | Company | Catalog Number | Comments |
| 1.5 ml tubes | Fisher | 02-682-550 | |
| 10% NP-40 solution | Pierce | 28324 | for intracellular GLuc assays |
| 1 ml luer-lok syringes | Fisher | 14-823-30 | |
| 200 microliter filter tips | Rainin | RT-L200F | |
| 3-0 surgical sutures | Fisher | NC9598192 | |
| 30 G needles | Fisher Scientific | 14-821-13A | |
| Adhesive microplate sealing sheets | Thermo | AB-0558 | |
| Alcohol prep pads | Fisher | 22-246-073 | |
| Anesthesia Auto Flow System | E-Z Anesthesia | EZ-AF9000 | |
| Animal recovery chamber | Lyon Vet | ICU-912-004 | |
| B27 supplement | Life Technologies | 17504-044 | |
| Betadine solution | Fisher | NC9386574 | |
| Bleach | Clorox | n/a | |
| Bovine growth serum | Thermo | SH30541.03 | |
| Coelenterazine, Native | Regis Technologies | 1-361204-200 | |
| Cotton tipped applicators | Puritan | 806-WC | |
| Cutting needles 3/8 circle sutures | WPI | 501803 | |
| Digital ultrasconic cleaner | Fisher Scientific | FS60D | |
| DMEM high glucose, GlutaMAX, pyruvate | Life Technologies | 10569-010 | |
| DNA mass ladder | Life Technologies | 10496-016 | |
| Gaussia luciferase (recombinant protein) | Nanolight | 321-100 | |
| Gaussia luciferase antibody (for WB, ICC, or IHC) | New England Biolabs | E8023S | 1:2,000 (WB) |
| Germinator 500 | CellPoint Scientific | DS-401 | |
| Gluc assay plates (96 well, opaque) | Fisher | 07-200-589 | |
| Hank's balanced salt solution | Life Technologies | 14175-095 | |
| Heparin | Allmedtech | 63323-276-02 | |
| Isoflurane | Butler Schein | 29404 | |
| Ketamine | Henry Schein | 995-2949 | |
| Kwik Stop Styptic powder | Butler Schein | 5867 | |
| L-glutamine | Sigma | G8540 | |
| Methanol | Fisher | a452-4 | |
| Microfuge 22R Centrifuge | Bekman Colter | 368831 | |
| Neosporin | Fisher | 19-898-143 | |
| Neurobasal medium | Life Technologies | 21103049 | |
| Nikon Stereoscope | Nikon | SMZ745T | |
| Nucleospin Gel and PCR Cleanup | Machery-Nagel | 740609 | |
| P200 pipet | Rainin | L-200XLS+ | |
| p24 Lenti-X rapid titer kit | Clontech | 632200 | |
| PCR film seal | Fisher | AB0558 | |
| Penicillin/streptomycin | Life Technologies | 15140-122 | |
| Protease inhibitor cocktail | Sigma | P8340 | |
| ReFresh Charcoal Filter canister | E-Z Anesthesia | EZ-258 | |
| Scalpel blades, #10 | Fine Science tools Inc | 10010-00 | |
| SD rats 150-200 g | Charles River | Rats | rats ordered at 150-200 g. Surgery 5 days after arrival |
| Small animal ear tags | National Band and Tag co | 1005-1 | |
| Sterile surgical drapes | Braintree Scientific | SP-MPS | |
| Synergy 2 plate reader | BioTek | n/a | |
| TaqMan Universal PCR Master Mix | Applied Biosystems | 4304437 | |
| Thapsigargin | Sigma | T9033 | harmful to human health |
| Virapower lentiviral packaging mix | Life Technologies | K4975-00 | |
| Xfect Transfection reagent | Clontech | 631318 | |
| Xylazine | Valley Vet | 468RX |
Referências
- Sitia, R., Braakman, I. Quality control in the endoplasmic reticulum protein factory. Nature. 426 (6968), 891-894 (2003).
- Burdakov, D., Petersen, O. H., Verkhratsky, A. Intraluminal calcium as a primary regulator of endoplasmic reticulum function. Cell Calcium. 38 (3-4), 303-310 (2005).
- Fu, S., et al. Aberrant lipid metabolism disrupts calcium homeostasis causing liver endoplasmic reticulum stress in obesity. Nature. 473 (7348), 528-531 (2011).
- Micaroni, M. The role of calcium in intracellular trafficking. Curr Mol Med. 10 (8), 763-773 (2010).
- Mekahli, D., Bultynck, G., Parys, J. B., De Smedt, H., Missiaen, L. Endoplasmic-reticulum calcium depletion and disease. Cold Spring Harb Perspect Biol. 3 (6), (2011).
- Paredes, R. M., Etzler, J. C., Watts, L. T., Zheng, W., Lechleiter, J. D. Chemical calcium indicators. Methods. 46 (3), 143-151 (2008).
- Whitaker, M. Genetically encoded probes for measurement of intracellular calcium. Methods Cell Biol. 99, 153-182 (2010).
- Tang, S., et al. Design and application of a class of sensors to monitor Ca2+ dynamics in high Ca2+ concentration cellular compartments. Proc Natl Acad Sci U S A. 108 (39), 16265-16270 (2011).
- Palmer, A. E., Jin, C., Reed, J. C., Tsien, R. Y. Bcl-2-mediated alterations in endoplasmic reticulum Ca2+ analyzed with an improved genetically encoded fluorescent sensor. Proc Natl Acad Sci U S A. 101 (50), 17404-17409 (2004).
- Suzuki, J., et al. Imaging intraorganellar Ca2+ at subcellular resolution using CEPIA. Nat Commun. 5, 4153(2014).
- Rehberg, M., Lepier, A., Solchenberger, B., Osten, P., Blum, R. A new non-disruptive strategy to target calcium indicator dyes to the endoplasmic reticulum. Cell Calcium. 44 (4), 386-399 (2008).
- Henderson, M. J., Wires, E. S., Trychta, K. A., Richie, C. T., Harvey, B. K. SERCaMP: a carboxy-terminal protein modification that enables monitoring of ER calcium homeostasis. Mol Biol Cell. 25 (18), 2828-2839 (2014).
- Henderson, M. J., Richie, C. T., Airavaara, M., Wang, Y., Harvey, B. K. Mesencephalic astrocyte-derived neurotrophic factor (MANF) secretion and cell surface binding are modulated by KDEL receptors. J Biol Chem. 288 (6), 4209-4225 (2013).
- Shipman, C. Evaluation of 4-(2-hydroxyethyl)-1-piperazineëthanesulfonic acid (HEPES) as a tissue culture buffer. Proc Soc Exp Biol Med. 130 (1), 305-310 (1969).
- Zigler, J. S., Lepe-Zuniga, J. L., Vistica, B., Gery, I. Analysis of the cytotoxic effects of light-exposed HEPES-containing culture medium. In Vitro Cell Dev Biol. 21 (5), 282-287 (1985).
- Howard, D. B., Powers, K., Wang, Y., Harvey, B. K. Tropism and toxicity of adeno-associated viral vector serotypes 1, 2, 5, 6, 7, 8, and 9 in rat neurons and glia in vitro. Virology. 372 (1), 24-34 (2008).
- Smeets, E. F., Heemskerk, J. W., Comfurius, P., Bevers, E. M., Zwaal, R. F. Thapsigargin amplifies the platelet procoagulant response caused by thrombin. Thromb Haemost. 70 (6), 1024-1029 (1993).
- Tannous, B. A. Gaussia luciferase reporter assay for monitoring biological processes in culture and in vivo. Nat Protoc. 4 (4), 582-591 (2009).
- Sobrevals, L., et al. AAV vectors transduce hepatocytes in vivo as efficiently in cirrhotic as in healthy rat livers. Gene Ther. 19 (4), 411-417 (2012).
- Wang, Z., et al. Rapid and highly efficient transduction by double-stranded adeno-associated virus vectors in vitro and in vivo. Gene Ther. 10 (26), 2105-2111 (2003).
- Seppen, J., et al. Adeno-associated virus vector serotypes mediate sustained correction of bilirubin UDP glucuronosyltransferase deficiency in rats. Mol Ther. 13 (6), 1085-1092 (2006).
- Hareendran, S., et al. Adeno-associated virus (AAV) vectors in gene therapy: immune challenges and strategies to circumvent them. Rev Med Virol. 23 (6), 399-413 (2013).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados