Method Article
Suivi réticulum endoplasmique homéostasie calcique l'aide d'un
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Endoplasmic reticulum calcium homeostasis is disrupted in diverse pathologies. A secreted ER calcium monitoring protein (SERCaMP) reporter can be used to detect disruptions in the ER calcium store. This protocol describes the use of a Gaussia luciferase SERCaMP to examine ER calcium homeostasis in vitro and in vivo.
Résumé
Le réticulum endoplasmique (RE) contient le plus haut niveau de calcium intracellulaire, avec des concentrations d'environ 5000 fois plus élevée que les niveaux cytoplasmiques. Un contrôle serré sur ER calcium est impératif pour le repliement des protéines, la modification et la traite. Les perturbations à ER calcium peuvent conduire à l'activation de la réponse de la protéine dépliée, un mécanisme de réponse au stress du RE à trois broches, et contribuer à la pathogenèse d'une variété de maladies. La capacité de surveiller les modifications de calcium ER apparition et la progression au cours de la maladie est important en principe, mais difficile en pratique. Méthodes actuellement disponibles pour ER de surveillance de calcium, tels que les colorants et les protéines fluorescentes calcium-dépendante, ont permis de mieux comprendre la dynamique ER de calcium dans les cellules, mais ces outils ne sont pas bien adaptés pour des études in vivo. Notre laboratoire a démontré qu'une modification de l'extrémité carboxy-terminale de la luciférase de Gaussia confère sécrétion du rapporteur en réponse àER appauvrissement de calcium. Les procédés d'utilisation d'une luciférase en fonction, la protéine de surveillance de calcium du RE sécrétée (SERCaMP) pour in vitro et in vivo dans des applications sont décrits ici. Cette vidéo met injections hépatiques, la manipulation pharmacologique de GLUC-SERCaMP, la collecte et le traitement du sang, et les paramètres de dosage pour le suivi longitudinal de ER calcium.
Introduction
Le réticulum endoplasmique (RE) des fonctions dans de nombreuses capacités cellulaires, y compris le repliement des protéines, la sécrétion de protéines, l'homéostasie lipidique et de signalisation intracellulaire 1. Central à la fonction ER normale est de maintenir les concentrations de calcium luminal à ~ 5000 fois ceux trouvés dans le cytoplasme 2-4. Ce processus intensif d'énergie est réglementée par la ATPase Sarco / réticulum endoplasmique de calcium (SERCA), une pompe qui déplace des ions calcium dans le RE. Efflux de calcium du RE est principalement médiée par la ryanodine (RyR) et l'inositol triphosphate (IP3R) récepteurs. Parce que de nombreux processus de ER sont dépendantes du calcium, perturbant le magasin peut conduire à des stress du RE et la mort cellulaire éventuelle.
ER dysrégulation de calcium a été observée dans les maladies y compris la cardiomyopathie, le diabète, la maladie d'Alzheimer, la maladie de Parkinson et 5. En raison de la nature progressive de ces maladies, il a été difficile de délimiter la nouvelle cause à effetlation entre la pathogenèse et les modifications dans le magasin ER de calcium. Un certain nombre de technologies ont permis des avancées significatives dans notre compréhension de la dynamique ER de calcium, y compris les colorants et les indicateurs de calcium génétiquement codés (GeCIS). Des colorants à faible affinité de calcium, ce qui augmente la fluorescence lorsqu'il est lié à Ca2 +, peuvent être chargées dans les cellules à examiner compartiments subcellulaires avec des concentrations élevées de calcium 6. GeCIS, comme D1ER et le receveur permettre un suivi des fluctuations de calcium avec un contrôle plus précis de la localisation subcellulaire 7-9. Récemment, une autre classe de GECIS appelés indicateurs de protéines organelles piégée calcium de mesure (CEPIA) ont été décrits 10. Une troisième approche combinant la génétique et la chimie des petites molécules ciblé est-estérase charge de colorant (TED), qui utilise une carboxylestérase codé génétiquement (ciblé pour l'ER) avec un colorant à base d'ester de calcium-11.
Bien que la aforementioned approches ont des forces et des faiblesses inhérentes, ils peuvent fournir des informations précieuses sur la dynamique de calcium ER par des mesures aigus de fluorescence. Ils sont, cependant, pas optimal pour les études longitudinales souvent nécessaires pour enquêter sur la progression de la maladie. Dans le but de mettre au point une méthode pour surveiller la dynamique de calcium sur des périodes de temps prolongées, nous avons identifié et développé une modification des protéines pour créer les protéines sécrétées de calcium ER surveillance (SERCaMPs) 12.
SERCaMP contourne plusieurs limitations associées avec d'autres méthodes, en fournissant une approche minimalement invasive pour interroger plusieurs reprises la boutique ER de calcium. Nous avons précédemment démontré que le peptide ASARTDL carboxy-terminale (alanine-sérine-arginine-alanine-thréonine-leucine-acide aspartique) est suffisante pour favoriser la rétention au ER; cependant, dans des conditions qui causent des diminutions de calcium ER, la séquence peptidique est plus en mesure de maintenir ER localization et la protéine est sécrétée 13. La base de la technologie de SERCaMP est l'appendice de ASARTDL à l'extrémité carboxy-terminale d'une protéine sécrétée (par exemple, la luciférase de Gaussia, ou Gluc) de telle sorte que la sécrétion est déclenchée par épuisement ER de calcium, créant ainsi un journaliste robuste de ER dysrégulation de calcium 12. L'expression de Gluc-SERCaMP par des méthodes transgéniques permet fluides biologiques, notamment milieu de culture de cellules et le plasma à analyser les changements dans l'activité Gluc comme indicateur de l'homéostasie de calcium ER. La méthode a des applications pour l'étude longitudinale des modifications progressives dans le magasin de calcium ER la fois in vitro et in vivo. Le protocole suivant est écrit comme un cadre général pour l'aide basée SERCaMP-GLUC pour étudier ER homéostasie du calcium, mais le protocole peut servir de guide pour SERCaMPs rapporteurs alternatives.
Protocole
1. Essai in vitro: Détection SERCaMP sortie d'une écurie SH-SY5Y Cell Line
- Plate-SH-SY5Y Gluc-ASARTDL (SERCaMP) dans une culture tissulaire traitée plaques à 150.000 cellules par cm 2 de surface. Pour plaques à 96 puits, par exemple, les graines de 50.000 cellules par puits (figure 1A). Cultiver les cellules SH-SY5Y dans DMEM (glucose élevé, GlutaMAX, pyruvate) + 10% de croissance de sérum bovin + 1x pénicilline / streptomycine.
- Cellules jusqu'à 15 fois (figure 1B) de Passage. Numéro de passage supérieur n'a pas été testé.
- Retour à cellules incubateur humidifié à 37 ° C avec 5,5% de CO 2 et incuber pendant une nuit.
- Avant le traitement (s) expérimentale, prélever un échantillon de référence pour chaque puits en transférant 5 pi de surnageant de culture à une opaque muré plaque de 96 puits. Avant de recueillir, tapotez doucement la plaque sur tous les côtés et agiter pour éviter les effets de dégradé. Sceller la plaque opaque avec un adhésif sfeuille Ealing et conserver à 4 ° C jusqu'au moment de l'essai enzymatique.
Remarque: sécrétée Gluc-SERCaMP est très stable dans un milieu de culture cellulaire. Nous avons précédemment rapporté environ 5-10% de l'activité a été perdue Gluc après une incubation de 72 h à 37 ° C (incubé sur SH-SY5Y) 12. - Traiter les cellules comme souhaité pour examiner ER appauvrissement de calcium (par exemple l'environnement, pharmacologique, manipulations génétiques). Evitez une longue exposition à l'environnement ambiant (en dehors de l'incubateur contrôlée) que les changements de pH va se produire rapidement au CO 2 atmosphérique. Ajouter HEPES au milieu de culture à 20 mM, pH 14 pour stabiliser, si manipulations longues sont nécessaires. Éviter l'exposition à la lumière lors de l'utilisation HEPES dans le milieu de culture 15.
- Contrôle positif: traiter les cellules avec 100 nM thapsigargine (Tg) ou de l'acide cyclopiazonique 50 pm (CPA) pour 4-6 heures pour des expériences dans SH-SY5Y. Réponse maximale dans d'autres lignées cellulaires peut exiger incubations plus longues ou différentes concentrations de composés.
- Contrôle négatif: milieu de culture recueillons auprès de SH-SY5Y parentales. Dans notre expérience, la luminescence de fond pour cet essai est inférieure à 0,05% de la sécrétion basale de cellules SH-SY5Y-Gluc-SERCaMP stables.
- Recueillir et échantillons magasin 5 pi de milieu conditionné au timepoints souhaitées, comme indiqué dans l'étape 1.2.
- Évaluer l'activité enzymatique dans le milieu, comme indiqué à la section 5.
- Examinez GLUC intracellulaire par immunotransfert ou un essai de luminescence.
- Pour immunoblot: lyser des cellules dans un tampon RIPA modifié contenant 50 mM de Tris (pH 7,4), NaCl 150 mM, désoxycholate de sodium à 0,25%, EDTA 1 mM, 1% de NP40 et des inhibiteurs de protéase. Séparé sur gel de polyacrylamide-SDS et transfert sur une membrane de 0,20 um en PVDF. Incuber la membrane avec l'anticorps GLUC (1: 2000 de dilution) nuit à 4 ° C. Effectuer incubation d'anticorps et membranaires lavages secondaires selon le protocole défini par l'utilisateur pour le réactif de détection de choix.
- Pourtest de luminescence (Figure 2): effectuez les étapes suivantes sur la glace:
- Retirez tout moyen de puits de la plaque de culture de tissus et rincer avec 200 pi de PBS froid.
- Ajouter 75 ul de tampon de lyse contenant 50 mM de Tris (pH 7,5), NaCl 150 mM, 1% de NP40 et des inhibiteurs de protease à chaque puits.
- Faire tourner la plaque sur un agitateur orbital (120 rpm) à 4 ° C pendant 20 min.
- Pipette doucement le lysat de haut en bas à l'aide d'une pipette multicanaux, en évitant les bulles d'air. Transfert 5 pi de lysat à une plaque opaque et évaluer la luminescence comme indiqué à la section 5.
2. Essai in vitro: transfection transitoire de cellules immortalisées avec SERCaMP
Note: Nous avons observé que les procédures de transfection transitoire peuvent induire un stress cellulaire et émousser la réponse GLUC-SERCaMP ultérieure. L'approche suivante a été développé pour minimiser transfection eff ECTS à SH-SY5Y. L'optimisation de ce procédé (y compris le choix du réactif de transfection) pour les lignées cellulaires de remplacement peut être nécessaire. Lorsque cela est possible, il est recommandé d'utiliser des lignées cellulaires stables ou méthodes de transduction virales décrites dans les sections 1 et 3 respectivement.
- Plate SH-SY5Y dans un plat de 100 mm à 4 x 10 6 cellules. Ce plat sera suffisante pour réensemencer environ 300 puits (format de plaque à 96 puits) en suivant la procédure de transfection.
- Transfecter des cellules avec un réactif xfect en utilisant 20 ug d'ADN plasmidique (codant Gluc-SERCaMP) et 6 ul de réactif xfect. ADN à grande échelle et de réactif xfect conséquence pour grands ou plus petits récipients de culture.
- Retour cellules dans l'incubateur pendant 48 heures.
- Trypsiniser cellules et réensemencer des plaques à 96 puits à 60.000 cellules par puits. Suivez les étapes suivantes décrites dans la Section 1.
3. Test in vitro: Viral Expression Vector médiation GLUC-SERCaMP
tente "> Remarque: viral adéno-associé (AAV) emballage 16 et la purification 12 et 13 lentivirus production ont déjà été signalé.- Titre Gluc-SERCaMP AAV en utilisant les amorces et les sondes suivantes: amorce avant, 5'-CACGCCCAAGATGAAGAAGT-3 '; amorce inverse, 5'-GAACCCAGGAATCTCAGGAATG-3 '; sonde (5'-6-FAM / 3'-BHQ-1 marqué), 5'-TACGAAGGCGACAAAGAGTCCGC-3 'pour la PCR quantitative.
- Préparer la courbe standard par linéarisation un plasmide contenant GLUC et la purification de l'ADN en utilisant un spin-colonne (par exemple Machery-Nagel NucleoSpin Gel et PCR nettoyage). Quantifier l'ADN par séparation sur un gel d'agarose à côté d'une échelle de masse. Préparer des dilutions 1:10 de l'ADN de 100 pg / ml à 10 fg / ml dans PBS. Calculer les copies / ml d'ADN plasmidique Gluc à chacune des concentrations en fonction du poids moléculaire du plasmide.
- Diluer les stocks de AAV dans du PBS (dilution appropriée sera fonctionparamètres de préparation virale et déterminée empiriquement).
- Exécuter la réaction de PCR dans un système PCR en temps réel en utilisant les conditions suivantes: 95 ° C x 5 min, 94 ° C x 20 sec, et 60 ° C x 1 min pendant 41 cycles. Calculer copies / mL en utilisant la courbe standard.
- Titre avec un lentivirus Lenti-X kit de titration rapide de p24. Décongeler aliquotes lentiviraux sur la glace et diluer la protéine de contrôle de p24 dans un milieu SH-SY5Y.
- Diluer le lentivirus tels qu'il va tomber sur la courbe standard (par exemple, 1: 20.000 ou 1: 100 000). Le facteur de dilution requis variera en fonction des paramètres de préparation lentiviraux et doit être déterminée de manière empirique. Suivez les instructions du fabricant pour toutes les étapes subséquentes.
- Cellules de la plaque plaques à 96 puits. Pour SH-SY5Y, procédures de placage décrits dans la section 1 peuvent être suivies. Pour les neurones corticaux primaires de rat, les cellules doivent être isolés et ensemencées sur des plaques revêtues de manière appropriée uns 16 décrit précédemment. Maintenir les neurones corticaux primaires de rat dans du milieu Neurobasal additionné de B27 1x et 500 uM de L-glutamine. Effectuer des échanges demi de taille tous les autres jours.
- Transduire les cellules avec le virus. Le but de transduction virale est de parvenir à une expression faible niveau, comme Gaussia luciférase fournit le signal robuste.
- Cellules SH-SY5Y AAV transduction: transduisent le lendemain placage. Diluer AAV à 6,0 x 10 7 vg / ul dans AAV tampon de dilution (PBS + 0,5 mM MgCl2). Ajouter 5 ul de AAV dilué (3.0 x 10 8 vg; MOI d'environ 6.000) par puits de plaque de 96 puits (figure 3A). Utilisez l'eau de Javel à 10% pour inactiver les déchets de vecteur viral.
- AAV transduction de neurones corticaux primaires de rat: transduire 6-8 jours après placage. Diluer AAV à 4,0 x 10 6 vg / ul dans du tampon de dilution AAV. Ajouter 5 ul de l'AAV diluée (2,0 x 10 7 vg; MOI d'environ 350) par puits dePlaque de 96 puits (figure 3B). La MOI optimale doit être déterminée empiriquement pour d'autres types de cellules. Utilisez l'eau de Javel à 10% pour inactiver les déchets de vecteur viral.
- De transduction lentivirale SH-SY5Y: transduire le jour suivant placage. Diluer à 20 lentivirus pg / pl p24 (concentration déterminée en utilisant le kit de titrage) dans une solution saline équilibrée de Hank. Ajouter 5 ul du virus dilué par puits (100 pg de p24, équivalent à 1.250.000 particules lentiviraux, ou ~ 1250 IFU) d'une plaque de 96 puits contenant un volume de 100 pi. Échelle conséquence pour les grands formats. Utilisez l'eau de Javel à 10% pour inactiver les déchets virale.
- Prélever un échantillon du milieu de pré-traitement et de commencer des traitements expérimentaux 48 h (SH-SY5Y) ou 5-7 jours (rat neurones corticaux primaires) après transduction.
4. Dosage in vivo SERCaMP
Remarque: Avant de procéder à toutes les procédures animales être sûr d'obtenir l'approbation appropriée auprès de votre institution. Touschirurgies survie sont à faire dans des conditions stériles avec une anesthésie adéquate. Toutes les procédures décrites ci-dessous ont été approuvés et sont en conformité avec les directives du NIH ACUC.
- Instruments chirurgicaux autoclave avant le début de la chirurgie (121 ° C, 30 min stérilisation, 20 min le temps de séchage). Nettoyez tous les instruments d'un appareil à ultrasons immédiatement après toutes les procédures et avant autoclavage. Maintenir des conditions stériles pendant la chirurgie de survie. Pour les chirurgies nécessitant plusieurs animaux, essuyez instruments chirurgicaux avec 70% d'alcool, de perles et de stériliser ultrasonicate entre les rats. Reportez-vous à la liste de matériaux pour les instruments nécessaires.
- Préparer rat pour la chirurgie. Ici, nous utilisons Sprague-Dawley mâle (180-200 g).
- Anesthésier les rats à l'aide de gaz isoflurane pendant 3 min (4-5% d'isoflurane présentées à 1000 cc / min), suivi par des injections intraperitoneales de xylazine (8 mg / kg) et de la kétamine (80 mg / kg). Appliquer une pommade ophtalmique pour protéger les cornées de se dessécher. Bla chirurgie egin une fois que le rat est profondément anesthésié comme l'a démontré par le manque de réflexe de retrait suivant la queue ou le pied presseur.
- Rasez la région de l'abdomen légèrement en dessous des côtes (faible) région thoracique à la région abdominale mi. Frotter la zone chirurgicale trois fois, en alternant 70% d'alcool et Betadine scrub. Placez rat en position couchée sur la zone chirurgicale stérile avec draps chirurgicaux stériles.
- Diluer AAV-Gluc-SERCaMP à 7,6 x 10 9 vg / ml (concentration finale). Bien mélanger en inversant le tube.
Remarque: La portée de la concentration virale peut varier (Figure 4).- Pipet 105 pi de AAV diluée dans un plat stérile. Utiliser une aiguille de calibre 30 pour recueillir le virus dans une seringue.
- Effectuer une chirurgie pour exposer le foie et injecter AAV-Gluc-SERCaMP.
- Avant de faire une incision dans l'abdomen, appliquer bupivacaïne à 0,25% pour la zone d'incision. Avec un scalpel, faire une incision horizontale en dessous de la cage thoracique (apron 2-3 cm). Blunt disséquer pour séparer le tissu conjonctif de l'hypoderme.
- Couper muscle abdominal, exposant le lobe médial droit de foie.
Nota: Les lobes supplémentaires peuvent être injectées en fonction de l'application finale. - Placez l'animal sous microscope chirurgical et ajuster pour obtenir lobe médial droit de foie dans le champ de vision. Injecter virus dans le parenchyme du lobe médial; 3 sites distincts, environ 33 pi par site.
Remarque: Laissez l'aiguille dans le tissu pour les 5-10 secondes après l'injection pour assurer la livraison de l'ensemble du volume d'injection. - Suturer le muscle abdominal et la peau séparément et ajouter Néosporine utilisant du coton applicateur à bout. Placez rat dans une chambre de récupération jusqu'à ce que la conscience est repris et le rat est capable de maintenir en position verticale. Ne pas laisser le rat (s) sans surveillance tant qu'il a repris conscience suffisante pour maintenir décubitus sternal. Maison seuls jusqu'à l'incision est guérie et les sutures ont été retirées (7-14 jours).
Remarque: Conformément aux directives post-chirurgicales NIH, tenir un registre chirurgical. Annoter la carte de la cage à la procédure, la date, l'identificateur de l'expérience, le poids corporel, et le jour de la chirurgie. Douleur / détresse, la production de matières fécales, l'activité, l'alimentation et la consommation d'eau doivent être surveillés et enregistrés la chirurgie de 3 jours. Analgésie post-opératoire est fournie par l'ajout de l'acétaminophène pour l'eau potable (450 mg / 100 cc), même si nous ne constatons généralement des signes de douleur ou de détresse après la chirurgie.
- Commencer la collecte de sang de la queue 4-7 jours après l'injection. Préparer des tubes de collecte de sang par voie d'étiquetage et de pré-pesée. Ajouter 50 ul d'héparine (1000 U / ml) à chaque tube.
- Lieu rat dans la chambre de l'isoflurane pendant 3 min (4-5% d'isoflurane livré à 1000 cc / min). Retirer rat de la chambre et le placer dans le nez cône (2-3% d'isoflurane livré à 500 cc / min). La collecte de sang peut commencer une fois que le rat est profondément anesthésié comme l'a démontré par le manque de réflexe de retrait suivante queue piNCH.
- Avec des ciseaux stériles pointe couper la queue (1-2 mm) et recueillir le sang goutte à goutte dans le tube pré-remplie héparine. Prélever le sang jusqu'à ce volume atteint supérieur à 2: 1 rapport sang héparine (> 100 pi de sang / 50 ul d'héparine). Volumes de collecte de sang peuvent être ajustées en fonction de la conception expérimentale. Utilisez un applicateur de coton humide pour appliquer la poudre hémostatique à la queue pour arrêter le saignement.
- Tubes de sang de magasin à 4 ° C si la collecte d'échantillons ultérieurs. Essuyez ciseaux avec tampon de l'éthanol et le talon stériliser entre les collections.
- Peser les tubes de prélèvement et d'ajuster avec de l'héparine pour obtenir ratio 2: 1 (sang: héparine). Cette étape normaliser la quantité d'héparine dans chaque échantillon (tableau 1).
- Tubes à centrifuger à 2000 g pendant 5 min à 4 ° C. Transférer le surnageant (plasma) dans un nouveau tube et conserver à -80 ° C jusqu'au dosage de la luciférase (section 5).
Remarque: Le stockage des échantillons à 4 ° C jusqu'à 72 heures avant le dosage enzymatique a minimal effet sur la luminescence (figure 5A). Jusqu'à 3 cycles de gel-dégel des échantillons de plasma ont aucun effet sur la luminescence (figure 5B).
- Administration thapsigargine (contrôle positif):
- Préparer thapsigargine en diluant dans de l'éthanol à une concentration finale de 2,5 mg / ml. Injecter thapsigargine à 1 mg / kg ip dans le bas-ventre.
Remarque: thapsigargine augmente plaquettaire induite par la thrombine coagulation 17 et peut faire la collecte de sang de la queue plus difficile.
- Préparer thapsigargine en diluant dans de l'éthanol à une concentration finale de 2,5 mg / ml. Injecter thapsigargine à 1 mg / kg ip dans le bas-ventre.
- Gaussia dosage de la luciférase:
- Décongeler les échantillons de plasma sur la glace.
Remarque: Pour les études longitudinales, dégel et effectuer test de luminescence pour tous les échantillons de TIMEPOINT le même jour (en utilisant la préparation unique de substrat). - Transfert 10 pi de plasma à une plaque paroi opaque et mesurer l'activité enzymatique comme décrit dans la section 5. Run 3-4 répétitions techniques de chaque échantillon de plasma.
- Décongeler les échantillons de plasma sur la glace.
- Euthanasiun
Remarque: L'avantage de la technologie SERCaMP est la capacité de moniteur longitudinalement ER calcium. En fonction des paramètres expérimentaux et point final des analyses, les animaux doivent être euthanasiés par des mesures appropriées pour critère analyses et conformément aux lignes directrices de l'ACUC institutionnels.
5. Luminescence Assay
- Préparer des solutions coelentérazine (CTZ) sous licence par dilution du composé dans du methanol acidifié (30 ul de HCl à 10 3 ml de methanol) à 20 mM. Préparer des aliquotes à usage unique et conserver à -80 ° C.
- Préparer le substrat de travail sur le jour de dosage.
- Pour les essais in vitro, diluer coelentérazine à 8 uM dans du PBS, par exemple, ajouter 10 ul de 20 mM CTZ de stock à 25 ml de PBS (Figure 6a, b).
- Pour les essais in vivo, diluer à 100 uM cœlentérazine dans du PBS mM, acide ascorbique 500, 5 mM de NaCl.
- Incuber préparé CTZ pendant au moins 30 minà température ambiante avant de commencer le test.
Remarque: Cette étape est souvent inclus dans Gaussia dosages de luciférase comme il ya des rapports de décomposition du substrat rapide au cours de 30 premières minutes après la préparation. Nous avons pas observé cet effet dans notre système (Figure 6C); cependant, nous incluons souvent l'étape d'incubation comme nous l'avons constaté aucun impact négatif sur le dosage. - Utiliser un lecteur de plaque qui est capable de bioluminescence et de surveillance équipé d'un injecteur de substrat. Prime les lignes avec substrat.
Remarque: Le support initial à travers les lignes peuvent être sujettes à la dégradation. Pour éviter des lectures artificiellement bas pour les premiers échantillons, injecter 20-30 puits vides (chargement une assiette vide sur le lecteur) avant de mesurer les échantillons expérimentaux. - Injecter 100 ul de substrat dans le puits, secouez vitesse moyenne pendant 5 sec, et de mesurer l'émission de lumière. Pour le lecteur de plaque Biotek Synergy II, intégrer l'émission de lumière plus de 0,5 sec (échantillons in vitro) et 5 secondes (enin vivo des échantillons) pour l'étape de lecture. Optimiser les paramètres du lecteur de plaque pour la performance du test idéal.
Remarque: expositions Gaussia luciférase Flash cinétique avec décroissance rapide du signal (par rapport à briller cinétiques observées avec d'autres luciférases). La cinétique flash de GLUC est influencée par le sérum dans un milieu de culture cellulaire (figure 7A), soulignant l'importance de contrôler la composition du milieu entre les échantillons. En raison de la dégradation rapide de la luminescence après l'ajout de substrat (cinétique flash), le temps entre injection et lire étapes doit être uniforme pour tous les échantillons. Le lecteur de plaque doit être réglé pour injecter substrat à un bien, attendez un temps fixe (par exemple, nous utilisons une étape de bougé de 5 sec), et lisons que bien. Ajout de substrat pour une plaque entière avant la lecture pose un défi de taille à moins substrat peut être ajouté à tous les puits simultanément. Si un injecteur ne sont pas disponibles, la question peut être partiellement contourné par incubation de la plaque pendant 10 min entre le substrat Addition et de mesure (évitant ainsi la partie raide de la courbe de décroissance) (figure 7B). - Répéter l'injection, le temps d'attente, et de lire étapes pour chaque puits sur la plaque.
Résultats
La méthode GLUC-SERCaMP permet pour l'évaluation des ER homéostasie calcique en échantillonnant les liquides extracellulaires. Plusieurs contrôles peuvent être inclus dans la conception expérimentale pour améliorer l'interprétation des résultats. Tout d'abord, l'utilisation d'un journaliste constitutivement sécrétée (par exemple GLUC sans ASARTDL C-terminale ou "GLUC-Pas Tag") peut être utilisé pour évaluer les effets des traitements expérimentaux sur la voie de sécrétion (de sécrétion cellulaire mondial) et l'expression du transgène. Par exemple, une augmentation dans les niveaux extracellulaires de deux GLUC-SERCaMP et GLUC-Pas Tag serait considéré comme un résultat ambigu. En variante, une augmentation de la sécrétion Gluc-SERCaMP correspondant à une absence de réponse Gluc-No Tag supporte un événement dépendant ER de calcium (Figure 8). La sécrétion de Gluc-SERCaMP en réponse à l'épuisement de calcium ER peut être en outre évaluée en mesurant intracellulaire Gluc, bien que cela soit limité à un seul point de temps que la lyse est nécessaire. Int racellular Gluc-SERCaMP diminue en réponse à l'épuisement de calcium ER, comme il est progressivement sécrétée, et la extracellulaire: intracellulaire rapport (calculé pour chaque puits individuel) augmente (figure 2B). Le extracellulaire: intracellulaire rapport est utile pour contrôler les changements dans l'expression du transgène.
Modulateurs pharmacologiques de la boutique de calcium ER peuvent être utilisés pour confirmer la contribution des ER calcium pour SERCaMP libération dans de nouveaux paradigmes. Dantrolène, un antagoniste RyR, est connu pour stabiliser ER calcium, ce qui devrait réduire ou inhiber la libération de SERCaMP en réponse à Tg (figure 8B). Il est recommandé, si possible, pour tester d'autres composés qui affectent ER flux de calcium (par exemple Xestospongin C, 4-chloro-m-crésol) en employant de nouveaux paradigmes expérimentaux SERCaMP. Ces études sont souvent difficiles in vivo, mais il peut être possible dans des modèles de culture de tissu correspondant.
"> Pour les études in vitro utilisant SERCaMP base-Gluc, il est recommandé de calculer les réponses sur des assiettes individuelles relatives au contrôle (s). La réponse« traitement-induite »peut être évaluée sur la timecourse par le suivi des changements en réponse par rapport par rapport au contrôle ( pour entre-plaque comparaisons). Il est déconseillé de comparer des chiffres bruts sur plusieurs plaques, en raison de la désintégration du substrat, ce qui peut conduire à des changements dans les valeurs premières entre timepoints (Figure 6C). Faire des comparaisons relatives au sein d'une plaque minimise cet effet (Figure 6D). Un exemple d'analyse de données pour une expérience in vitro dans SERCaMP libération induite Tg est présentée en figure 9.Pour les études in vivo en utilisant GLUC-SERCaMP, les données doivent être évalués indépendamment pour chaque animal, chaque animal étant son propre contrôle 'pré-traitement ». Cela est nécessaire pour tenir compte de la variabilité de transgène delIvery et d'expression entre les animaux (figure 4A).
L'ampleur des réponses SERCaMP sera affectée par une variété de facteurs, dont beaucoup sont liés à la santé de base et des cellules peuvent être directement commandées par l'investigateur. Pour maximale SERCaMP réactivité, il est impératif d'optimiser les conditions qui favorisent l'homéostasie basale ER de calcium. Cela inclut les cellules d'ensemencement à une densité optimale et en utilisant de faibles titres viraux. Types de cellules et de tissus différents peuvent avoir des exigences supplémentaires, qui devraient être déterminées empiriquement.
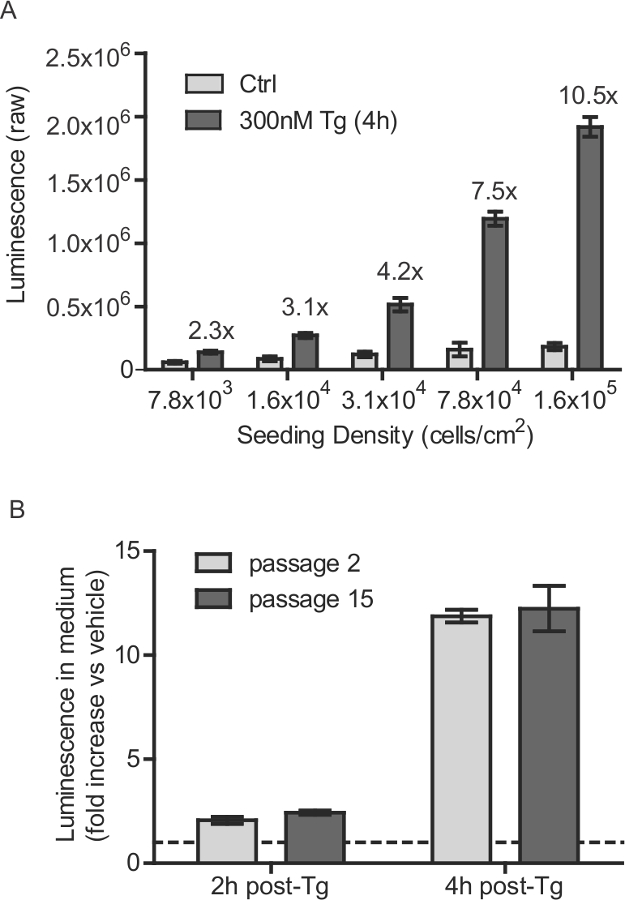
Figure 1:. Densité de semis Stable SH-SY5Y lignée cellulaire et de passage des considérations de nombre (A) SH-SY5Y-Gluc-SERCaMP ont été ensemencées à différentes densités et incubées pendant 40 heures. Sécrétée GLUC-SERCaMP a été mesurée 4 heures après le traitement avec 300 nM Tg ocontrôle du véhicule r (moyenne ± SD, n = 6). Augmentation induite par la thapsigargine dans Gluc-SERCaMP sécrétion est indiqué pour chaque densité de cellules. Cellules (B) SH-SY5Y-Gluc-SERCaMP au passage numéro 2 et 15 ont été examinés pour la sécrétion induite thapsigargine. Les cellules ont été traitées avec 100 nM Tg pendant 2 heures ou 4 heures, et l'activité de Gluc sécrétée a été normalisé aux témoins traités par le véhicule (moyenne ± SD, n = 4, aucun effet significatif de passage du facteur, 2-way ANOVA). La ligne pointillée indique y = 1. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
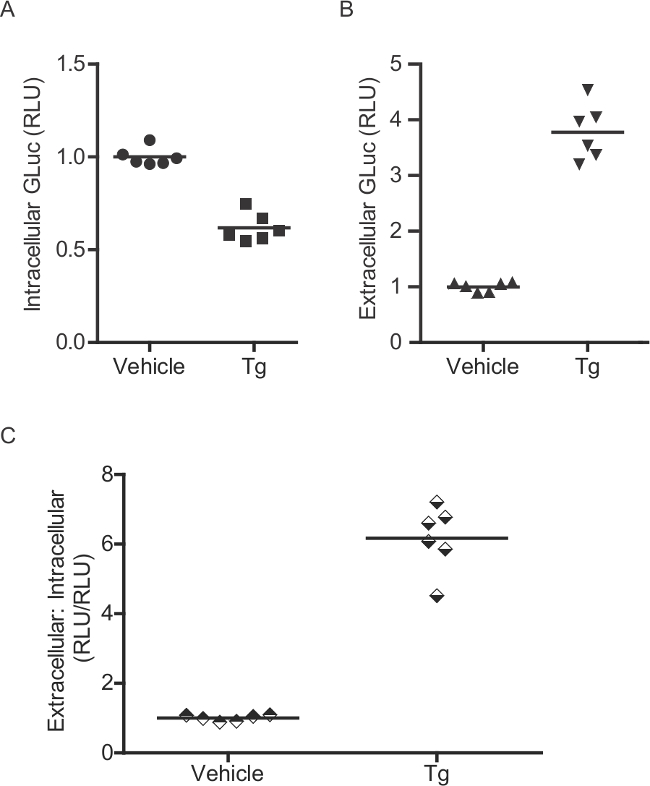
Figure 2:. Dosage enzymatique pour la mesure de Gluc-SERCaMP intracellulaire (A) intracellulaire et (B) une activité enzymatique extracellulaire Gluc a été évaluée chez le rat primaire corneurones tiques (transduites avec l'AAV-Gluc-SERCaMP). Six jours après la transduction, les cellules ont été traitées avec 60 nM de thapsigargine pendant 4 heures. Comme GLUC-ASARTDL accumule dans le milieu, baisses correspondantes des niveaux intracellulaires sont observées. (C) Un ratio de extracellulaire: activité GLUC intracellulaire peut être calculé pour chaque puits.

Figure 3:. AAV-Gluc-ASARTDL titre par rapport à la réponse induite par la thapsigargine pour les cellules SH-SY5Y et le rat neurones corticaux primaires (A) SH-SY5Y ont été ensemencées dans des plaques à 96 puits à 5 x 10 4 cellules par puits et a permis d'adhérer pendant une nuit. Les cellules ont été transduites à la multiplicité indiquée d'infection (MOI), incubé pendant 48 heures, puis traité avec 300 nM Tg ou un véhicule. La luminescence a été mesurée dans le milieu après 8 heures (moyenne ± SEM, n = 3). * P <0,05, multests t tiple (correction Holm-Sidak). (B) Rat neurones corticaux primaires ont été transduites sur DIV8 avec AAV-Gluc-ASARTDL à la MOI indiqué (calculée à partir de 60.000 cellules par approximation bien au moment de la transduction). Cinq jours après la transduction, les cellules ont été traitées avec 100 nM Tg ou le contrôle du véhicule et la luminescence dans le milieu a été mesurée après 8 heures (moyenne ± SEM, n = 6). * P <0,05, plusieurs tests t (correction Holm-Sidak).
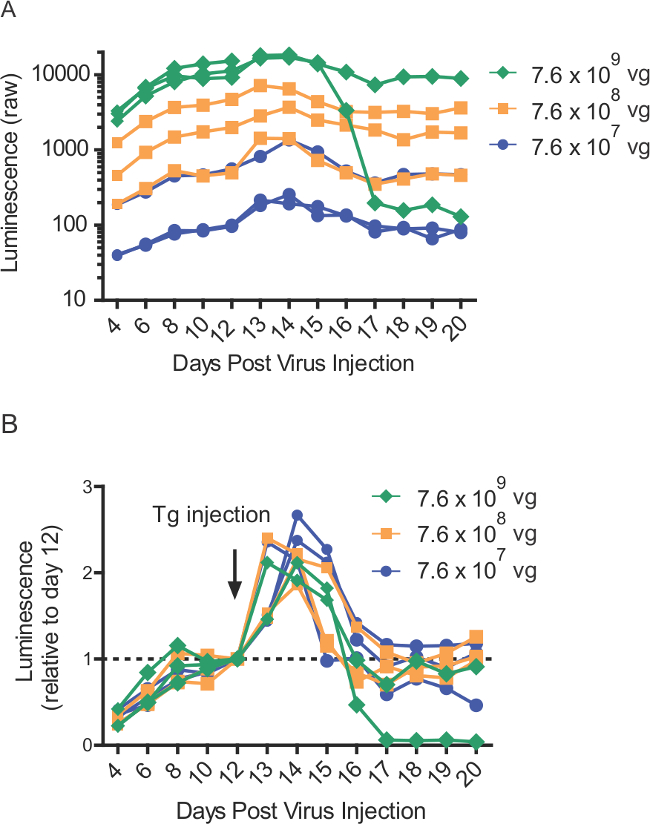
Figure 4:. Thapsigargine induite GLUC-SERCaMP libération dans le sang la suite d'injections intra-hépatiques plus de gamme de titres viraux (A) les valeurs de luminescence premières de rats (n = 8) intrahepatically injecté avec différents titres AAV-Gluc-ASARTDL. Thapsigargine (1 mg / kg) par injection (ip) a été administré au jour 12. Le sang a été recueilli à des points de temps indiqués et stocké à -80 & #176; C jusqu'au dosage. (B) valeurs de luminescence normalisée à partir panneau A, démontrant réponse SERCaMP induite thapsigargine chez les rats (n = 8) exprimant diverses quantités de l'AAV-Gluc-ASARTDL.

Figure 5:. Manipulation et stockage d'échantillons de plasma GLUC-SERCaMP (in vivo) (A) plasma ont été recueillies à partir de rats exprimant intrahepatically GLUC-SERCaMP (n = 10), aliquotés et conservés à -80 ° C jusqu'au moment des tests. Les tubes ont été retirés de -80 ° C et stockés à 4 ° C pendant des temps indiqués avant la mesure de luminescence (moyenne ± SD). (B) Effet de gel / dégel multiples d'échantillons de plasma sur GLUC activité enzymatique. Les échantillons de plasma recueillis chez des rats exprimant intrahepatically AAV-Gluc-SERCaMP (n = 10) ont été soumis au numéro indiquédes cycles de gel-dégel et dosés pour la luminescence (moyenne ± écart type).

Figure 6:. Préparation substrat coelentérazine pour les dosages GLUC-de SERCaMP moyen (A) de la culture ont été recueillies auprès SH-SY5Y-Gluc-SERCaMP lignées de cellules traitées avec 300 nM Tg (ou le contrôle du véhicule) pendant 5 heures. Gluc activité dans le milieu a été déterminée par injection de PBS + diverses concentrations de coelentérazine (moyenne ± SD, n = 6). (B) les valeurs de luminescence du panneau A ont été normalisées à véhicule traitée contrôle à chaque concentration de substrat pour évaluer l'effet induit thapsigargine. (C) décroissance Substrat pendant plusieurs heures. La luminescence à partir d'une quantité connue d'recombinant Gluc (0,1 ng 0,02 ng ou) a été mesurée sur plusieurs heures après la préparation de substrat (moyenne ± SD, n = 4). (D) Alors que la luminescence première pour le recombinantGLUC a diminué au fil du temps en raison de la décomposition du substrat, la différence fois dans les échantillons (tel que déterminé par luminescence) a été maintenue.
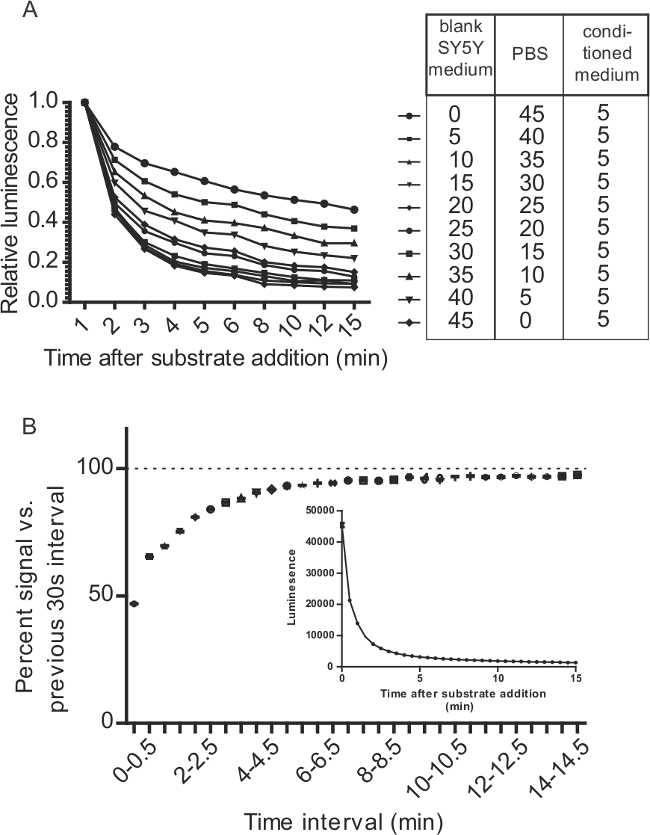
Figure 7:. Considérations pour les dosages GLUC-de SERCaMP liés à la cinétique de réaction GLUC / CTZ (A) Le milieu de culture modifie la désintégration d'un signal GLUC / CTZ. 5 ul de surnageant contenant Gluc-SERCaMP ont été mélangés avec des rapports variables de PBS et le milieu de culture. 100 pi de substrat (15 uM dans du PBS + CTZ 500 acide ascorbique mM) a été ajouté à 50 ul d'échantillon qui a été diluée comme indiqué dans le tableau. L'émission de lumière a été surveillée pendant 15 min. (B) 5 ul de milieu ont été recueillies à partir de SH-SY5Y-Gluc-ASARTDL et 100 ul de substrat (8 uM dans du PBS + CTZ NaCl 5 mM) a été ajouté. La luminescence a été mesurée immédiatement après l'ajout de substrat (T = 0) et toutes les 30 secondes sur Au cours de 15 min (± écart-type, n = 12). Les résultats sont portés que le signal de pour cent par rapport à l'intervalle de 30 secondes précédente pour évaluer le taux de décroissance. L'encart montre les données de luminescence premières.

Figure 8:. Corroboration pharmacologique de l'épuisement ER de calcium (A) Effet de 100 nM thapsigargine sur GLUC sécrétion a été examiné pour GLUC-ASARTDL et GLUC-Pas de contrôle de Tag (moyenne ± SD, n = 6). (B) La stabilisation ER calcium avec le dantrolène (RyR antagoniste) inhibe Tg induit la libération SERCaMP. Les cellules ont été prétraitées avec les concentrations indiquées de dantrolène pendant 30 min ou 16 h avant l'addition de 100 nM de thapsigargine. Gluc activité dans le milieu a été mesurée après 4 h (moyenne ± SD, n = 6).
99fig9.jpg "/>
Figure 9:. Mock résultats représentatifs pour le dosage Gluc-SERCaMP véhicule Remarque valeurs traitées peuvent diminuer entre les plaques, en raison de rupture du substrat (en fonction de l'intervalle de temps entre la lecture des plaques individuelles). Pour tenir compte de cet effet, l'effet du traitement spécifique est calculé indépendamment pour chaque plaque et ce rapport est comparé à travers des plaques.
| Date | Rat | Masse Tube (mg) | Le volume de l'héparine (ml) | Densité de l'héparine (g / ml) | masse de l'héparine (mg) | Masse de la tarière + héparine (mg) | La masse totale après la collecte de sang (mg) | Messe de sang prélevé (mg) | De sang Densité (g / ml) | Le sang de volume calculé (ul) | Volume d'héparine nécessaire pour rapport 2: 1 | ml d'héparine supplémentaire à ajouter avant de spin |
| 01/01/15 | SD Homme | 1135,9 | 50 | 1.117 | 55.83 | 1191,73 | 1317,70 | 125.97 | 1,05 | 119,97 | 59.98 | 9,98 |
Tableau 1:. Sang collection tableau Exemple de journal de collecte de sang pour les études SERCaMP.
Discussion
Ce protocole met en évidence in vitro et in vivo de l'utilité de Gluc-SERCaMP pour contrôler l'épuisement de calcium ER. Bien que la modification de la protéine pour générer SERCaMP semble généraliser à d'autres 12 protéines rapporteurs, nous avons choisi pour la luciférase de Gaussia son robuste (200-1,000 fois supérieure) bioluminescence par rapport aux autres luciférases 18. Nous démontrons détectable induite thapsigargine GLUC-SERCaMP libération à travers une gamme de dose de 100 fois de virus GLUC-SERCaMP livré à rat primaires neurones corticaux, SH-SY5Y, et le foie de rat (figures 3 et 4). Nous avons décrit précédemment la génération d'une lignée de cellules transfectées de façon stable exprimant GLUC-ASARTDL et démontré que aussi peu que 20 cellules dans une population de 5 x 10 4 cellules non marquées peuvent signaler une thapsigargine induit une réponse 12. Ici, nous montrons que la lignée cellulaire stable peut toujours signaler réponse Tg-induite à 15 passages, le plus Analyzed, indiquant que l'expression continue de la journaliste le temps n'a pas d'impact de sa capacité à être libéré en réponse à l'épuisement ER de calcium (Figure 1). Nos données indiquent que GLUC-SERCaMP est principalement lieu dans la salle d'urgence d'une cellule jusqu'à ce qu'un moment de ER appauvrissement de calcium quand il est sécrétée. Dans des conditions "normales", il ya une faible sécrétion basale qui permet à l'établissement de référence ER homéostasie calcique 12. À la suite de l'épuisement de calcium ER par la thapsigargine, les niveaux de variation de luminescence extracellulaire et intracellulaire dans des directions opposées. Ceci peut être exprimé sous forme de rapport pour indiquer un changement dans la distribution à l'état stable du capteur (figure 2). Surtout, comme SERCaMP libération est modulée par KDEL expression du récepteur 12, l'ampleur de la libération peut varier selon le type de cellule. Nous envisageons que la substitution 'ASARTDL' avec des séquences carboxy-terminal KDEL comme suppléant peut être nécessaire pour atteindre maxiSERCaMP réponse mal dans une cellule ou un tissu type spécifique.
Pour les essais in vitro, les niveaux de extracellulaire GLUC-SERCaMP vont s'accumuler au fil du temps en raison de la stabilité de la journaliste sécrétée; nous avons rapporté une diminution d'environ 5-10% de l'activité après 72 h 12. En tant que tel, agent d'échange avant d'initier un effet pharmacologique ou un défi génétique à ER homéostasie du calcium peut être nécessaire de réduire le signal de fond due à l'accumulation de capteur. En revanche, la demi-vie de GLUC-SERCAMP in vivo est 03.05 à 04.07 min 12 signal d'indication dans le plasma représente une récente libération de la journaliste dans le sang circulant. Une fois que le sang est traité ex vivo et à plasma, cependant, Gluc-SERCaMP est très stable (figure 5).
Pour les méthodes décrites, moyen ou le plasma est transféré dans des plaques 96 puits opaques avant dosages enzymatiques. Deux facteurs importants à considérer lors de l'utilisation journaliste basé à GLUCs sont la cinétique et la répartition du substrat coelentérazine flash de cet enzyme. Lecteurs de plaques équipé d'injecteurs sont les mieux adaptés pour la course GLUC dosages enzymatiques à normaliser le temps entre l'addition de substrat et mesures de luminescence. Les propriétés chimiques de la coelentérazine rendent sujettes à la décomposition, ce qui exclut l'on compare les valeurs de luminescence mesurées brutes à différents moments après la préparation du substrat. Pliez les différences entre les échantillons, toutefois, sont maintenus (Figure 6), permettant à la différence relative entre le contrôle et les échantillons expérimentaux pour être suivis sur la durée d'expériences (Figure 9).
La capacité de surveiller les fluctuations ER de calcium in vivo est avantageux lors d'enquêtes sur des maladies évolutives. Alors que d'autres méthodes, comme des colorants fluorescents cytoplasmiques, sont appropriés pour aiguë des études in vitro, un journaliste SERCaMP est le premier à permettre la surveillance de calcium ER longitudinale. Our protocole décrit hépatiques injections directes de l'AAV-Gluc-SERCaMP. Nous avons détecté des niveaux stables de GLUC-SERCaMP en circulation des animaux incontestés pendant 56 jours post-injection (dernière timepoint testé jusqu'à présent) et de prévoir des expériences plus longues sont possibles 12. Vecteurs AAV sont de petite taille, mesurant environ 20 nm de diamètre, et posent des exigences minimales en matière de biosécurité 19. Pour contourner la conversion de l'AAV génome simple brin à l'ADN double brin, l'AAV-SERCaMP a été emballé comme un sérotype AAV-1 double brin vecteur 20. Sérotype AAV-1 a été montré pour transduire efficacement des foies de rats 19,21; Toutefois, la mise en garde de notre technique d'injection est le risque de virus de se déplacer vers d'autres tissus dans le corps. Bien que le vecteur a été injecté directement dans le foie, la méthodologie telle que présentée ne peut pas discerner la source de SERCaMP libération, et par conséquent il est possible que les tissus autres que le foie peuvent contribuer à la Gluc-SERCle signal ampli. Manipulations génétiques futures restreindre l'expression pour cibler des types de tissus. Par exemple, les lignes d'excitateurs Cre spécifiques d'un tissu croisé avec une Cre-Gluc-dépendant SERCaMP permettra une surveillance spécifique d'un tissu de calcium par l'intermédiaire d'ER échantillonnage de plasma.
La technique décrite dans vivo utilise de faibles titres viraux en raison de la nature robuste de la journaliste. GLUC-SERCaMP libération peut être détectée à partir d'une gamme virale de 7,6 x 10 7 vg à 7,6 x 10 9 vg (Figure 4). Cette gamme est 4-400 fois inférieur à celui rapporté dans des travaux antérieurs utilisant luciole injections virales du foie 19 basée luciférase. À des concentrations plus élevées, on observe une perte de l'expression détectable au fil du temps, ce qui est peut-être due à une réponse immunitaire de l'animal pour le transgène 22. Des titres plus élevés de virus devraient être évités si possible en raison de la probabilité accrue de perte de signal. Les titres plus faibles que celles présentées ont pasfr testé. Ce protocole définit les injections de l'AAV-Gluc-SERCaMP dans le foie; des approches similaires sont théoriquement réalisable pour d'autres types de tissus. Des paramètres tels que la concentration et le sérotype viral doivent être optimisés pour l'expression dans d'autres tissus suffisant.
En raison de la nature robuste de la journaliste, de petits volumes de sang (100-150 pi) peuvent être collectées à partir de la queue coupée, ce qui permet pour les collections à travers des expériences répétées. Ce fut utile pour la caractérisation longitudinale de GLUC-SERCaMP de presse en réponse à la thapsigargine, où nous avons observé des niveaux élevés après l'administration de la thapsigargine suivie d'un retour à des niveaux de référence (figure 4). La manipulation appropriée des échantillons de plasma suivants collecte de sang est également important. A ce titre, nous avons démontré que SERCaMP est stable dans le plasma conservé à 4 ° C jusqu'à 72 heures avant le dosage enzymatique (Figure 5). En outre, des échantillons de plasma peuvent subir au moins trois congélation / thaw cycles avec un effet minimal sur la luminescence (figure 5). Dans la pratique, nous stockons tous les échantillons à -80 ° C, éviter inutiles cycles gel-dégel avant d'évaluer le dosage enzymatique, et d'analyser tous les échantillons pour une expérience dans le même temps.
ER épuisement de calcium est impliqué dans la pathogenèse de diverses maladies. Il est souvent considéré comme un événement en amont qui entrave les fonctions cellulaires et conduit à l'activation de la réponse de la protéine dépliée (UPR). L'EPU est une réponse adaptative employé par l'ER pour rétablir des conditions homéostatiques 5. États de stress chronique ER dépassent la capacité de l'EPU pour restaurer l'homéostasie, conduisant finalement à la mort cellulaire. Stress du RE et ER dysrégulation de calcium sont observées dans des maladies telles que le diabète de type 1, la néphropathie diabétique, les maladies neurodégénératives et cardiovasculaires dieases 5. La relation entre la dysrégulation de calcium et de pathogenèse de la maladie, cependant, est difficULT à délimiter. La technologie de SERCaMP a le potentiel pour suivre ce processus au cours de la durée de vie d'un animal, fournissant ainsi un aperçu de développement de la maladie et la progression. En outre, l'évaluation des agents thérapeutiques potentiels visant à prévenir ou corriger une dysrégulation de calcium ER peut être évaluée grâce à l'utilisation de SERCaMP. Enfin, l'identification des maladies où GLUC-SERCaMP libération se produit offre la possibilité de concevoir et d'utiliser des protéines ou peptides thérapeutiques sécrétées que SERCaMPs comme un moyen de la thérapie génique des maladies réglementées.
Déclarations de divulgation
The authors have nothing to disclose.
Remerciements
This work was supported by the Intramural Research Program at the National Institute on Drug Abuse. We thank Doug Howard, Chris Richie, Lowella Fortuno, and Josh Hinkle for their contributions to developing this method.
matériels
| Name | Company | Catalog Number | Comments |
| 1.5 ml tubes | Fisher | 02-682-550 | |
| 10% NP-40 solution | Pierce | 28324 | for intracellular GLuc assays |
| 1 ml luer-lok syringes | Fisher | 14-823-30 | |
| 200 microliter filter tips | Rainin | RT-L200F | |
| 3-0 surgical sutures | Fisher | NC9598192 | |
| 30 G needles | Fisher Scientific | 14-821-13A | |
| Adhesive microplate sealing sheets | Thermo | AB-0558 | |
| Alcohol prep pads | Fisher | 22-246-073 | |
| Anesthesia Auto Flow System | E-Z Anesthesia | EZ-AF9000 | |
| Animal recovery chamber | Lyon Vet | ICU-912-004 | |
| B27 supplement | Life Technologies | 17504-044 | |
| Betadine solution | Fisher | NC9386574 | |
| Bleach | Clorox | n/a | |
| Bovine growth serum | Thermo | SH30541.03 | |
| Coelenterazine, Native | Regis Technologies | 1-361204-200 | |
| Cotton tipped applicators | Puritan | 806-WC | |
| Cutting needles 3/8 circle sutures | WPI | 501803 | |
| Digital ultrasconic cleaner | Fisher Scientific | FS60D | |
| DMEM high glucose, GlutaMAX, pyruvate | Life Technologies | 10569-010 | |
| DNA mass ladder | Life Technologies | 10496-016 | |
| Gaussia luciferase (recombinant protein) | Nanolight | 321-100 | |
| Gaussia luciferase antibody (for WB, ICC, or IHC) | New England Biolabs | E8023S | 1:2,000 (WB) |
| Germinator 500 | CellPoint Scientific | DS-401 | |
| Gluc assay plates (96 well, opaque) | Fisher | 07-200-589 | |
| Hank's balanced salt solution | Life Technologies | 14175-095 | |
| Heparin | Allmedtech | 63323-276-02 | |
| Isoflurane | Butler Schein | 29404 | |
| Ketamine | Henry Schein | 995-2949 | |
| Kwik Stop Styptic powder | Butler Schein | 5867 | |
| L-glutamine | Sigma | G8540 | |
| Methanol | Fisher | a452-4 | |
| Microfuge 22R Centrifuge | Bekman Colter | 368831 | |
| Neosporin | Fisher | 19-898-143 | |
| Neurobasal medium | Life Technologies | 21103049 | |
| Nikon Stereoscope | Nikon | SMZ745T | |
| Nucleospin Gel and PCR Cleanup | Machery-Nagel | 740609 | |
| P200 pipet | Rainin | L-200XLS+ | |
| p24 Lenti-X rapid titer kit | Clontech | 632200 | |
| PCR film seal | Fisher | AB0558 | |
| Penicillin/streptomycin | Life Technologies | 15140-122 | |
| Protease inhibitor cocktail | Sigma | P8340 | |
| ReFresh Charcoal Filter canister | E-Z Anesthesia | EZ-258 | |
| Scalpel blades, #10 | Fine Science tools Inc | 10010-00 | |
| SD rats 150-200 g | Charles River | Rats | rats ordered at 150-200 g. Surgery 5 days after arrival |
| Small animal ear tags | National Band and Tag co | 1005-1 | |
| Sterile surgical drapes | Braintree Scientific | SP-MPS | |
| Synergy 2 plate reader | BioTek | n/a | |
| TaqMan Universal PCR Master Mix | Applied Biosystems | 4304437 | |
| Thapsigargin | Sigma | T9033 | harmful to human health |
| Virapower lentiviral packaging mix | Life Technologies | K4975-00 | |
| Xfect Transfection reagent | Clontech | 631318 | |
| Xylazine | Valley Vet | 468RX |
Références
- Sitia, R., Braakman, I. Quality control in the endoplasmic reticulum protein factory. Nature. 426 (6968), 891-894 (2003).
- Burdakov, D., Petersen, O. H., Verkhratsky, A. Intraluminal calcium as a primary regulator of endoplasmic reticulum function. Cell Calcium. 38 (3-4), 303-310 (2005).
- Fu, S., et al. Aberrant lipid metabolism disrupts calcium homeostasis causing liver endoplasmic reticulum stress in obesity. Nature. 473 (7348), 528-531 (2011).
- Micaroni, M. The role of calcium in intracellular trafficking. Curr Mol Med. 10 (8), 763-773 (2010).
- Mekahli, D., Bultynck, G., Parys, J. B., De Smedt, H., Missiaen, L. Endoplasmic-reticulum calcium depletion and disease. Cold Spring Harb Perspect Biol. 3 (6), (2011).
- Paredes, R. M., Etzler, J. C., Watts, L. T., Zheng, W., Lechleiter, J. D. Chemical calcium indicators. Methods. 46 (3), 143-151 (2008).
- Whitaker, M. Genetically encoded probes for measurement of intracellular calcium. Methods Cell Biol. 99, 153-182 (2010).
- Tang, S., et al. Design and application of a class of sensors to monitor Ca2+ dynamics in high Ca2+ concentration cellular compartments. Proc Natl Acad Sci U S A. 108 (39), 16265-16270 (2011).
- Palmer, A. E., Jin, C., Reed, J. C., Tsien, R. Y. Bcl-2-mediated alterations in endoplasmic reticulum Ca2+ analyzed with an improved genetically encoded fluorescent sensor. Proc Natl Acad Sci U S A. 101 (50), 17404-17409 (2004).
- Suzuki, J., et al. Imaging intraorganellar Ca2+ at subcellular resolution using CEPIA. Nat Commun. 5, 4153(2014).
- Rehberg, M., Lepier, A., Solchenberger, B., Osten, P., Blum, R. A new non-disruptive strategy to target calcium indicator dyes to the endoplasmic reticulum. Cell Calcium. 44 (4), 386-399 (2008).
- Henderson, M. J., Wires, E. S., Trychta, K. A., Richie, C. T., Harvey, B. K. SERCaMP: a carboxy-terminal protein modification that enables monitoring of ER calcium homeostasis. Mol Biol Cell. 25 (18), 2828-2839 (2014).
- Henderson, M. J., Richie, C. T., Airavaara, M., Wang, Y., Harvey, B. K. Mesencephalic astrocyte-derived neurotrophic factor (MANF) secretion and cell surface binding are modulated by KDEL receptors. J Biol Chem. 288 (6), 4209-4225 (2013).
- Shipman, C. Evaluation of 4-(2-hydroxyethyl)-1-piperazineëthanesulfonic acid (HEPES) as a tissue culture buffer. Proc Soc Exp Biol Med. 130 (1), 305-310 (1969).
- Zigler, J. S., Lepe-Zuniga, J. L., Vistica, B., Gery, I. Analysis of the cytotoxic effects of light-exposed HEPES-containing culture medium. In Vitro Cell Dev Biol. 21 (5), 282-287 (1985).
- Howard, D. B., Powers, K., Wang, Y., Harvey, B. K. Tropism and toxicity of adeno-associated viral vector serotypes 1, 2, 5, 6, 7, 8, and 9 in rat neurons and glia in vitro. Virology. 372 (1), 24-34 (2008).
- Smeets, E. F., Heemskerk, J. W., Comfurius, P., Bevers, E. M., Zwaal, R. F. Thapsigargin amplifies the platelet procoagulant response caused by thrombin. Thromb Haemost. 70 (6), 1024-1029 (1993).
- Tannous, B. A. Gaussia luciferase reporter assay for monitoring biological processes in culture and in vivo. Nat Protoc. 4 (4), 582-591 (2009).
- Sobrevals, L., et al. AAV vectors transduce hepatocytes in vivo as efficiently in cirrhotic as in healthy rat livers. Gene Ther. 19 (4), 411-417 (2012).
- Wang, Z., et al. Rapid and highly efficient transduction by double-stranded adeno-associated virus vectors in vitro and in vivo. Gene Ther. 10 (26), 2105-2111 (2003).
- Seppen, J., et al. Adeno-associated virus vector serotypes mediate sustained correction of bilirubin UDP glucuronosyltransferase deficiency in rats. Mol Ther. 13 (6), 1085-1092 (2006).
- Hareendran, S., et al. Adeno-associated virus (AAV) vectors in gene therapy: immune challenges and strategies to circumvent them. Rev Med Virol. 23 (6), 399-413 (2013).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon