Method Article
使用して小胞体カルシウムの恒常性の監視
要約
Endoplasmic reticulum calcium homeostasis is disrupted in diverse pathologies. A secreted ER calcium monitoring protein (SERCaMP) reporter can be used to detect disruptions in the ER calcium store. This protocol describes the use of a Gaussia luciferase SERCaMP to examine ER calcium homeostasis in vitro and in vivo.
要約
小胞体(ER)は、細胞質のレベルよりも約5,000倍高い濃度で細胞内カルシウムの最高レベルを、含まれています。 ERカルシウムを厳格にコントロールは、タンパク質の折り畳み、修正や人身売買のために不可欠です。 ERカルシウムの摂動は、小胞体ストレス応答、三つ又のERストレス応答機構の活性化をもたらす、および種々の疾患で病因に寄与することができます。疾患の発症と進行の間に、ERカルシウムの変化を監視する能力は、実際にはまだ挑戦的、原理的には重要です。現在、このようなカルシウム依存性蛍光色素やタンパク質などERカルシウムを監視するための利用可能な方法は、細胞内の小胞体のカルシウム動態への洞察を提供してきたが、これらのツールは、in vivoでの研究のためにはあまり適していません。私たちの研究室では、 ガウシアルシフェラーゼのカルボキシ末端への変更は、に応じて、レポーターの分泌を与えることを実証しました小胞体カルシウム枯渇。 インビトロ及びインビボ用途においてルシフェラーゼベースの分泌ERカルシウム監視タンパク質(SERCaMP)を使用するための方法は、本明細書中に記載されています。このビデオでは、ERカルシウムの長手方向の監視のために肝臓の注射、GLUC-SERCaMP、血液収集および処理の薬理学的操作、およびアッセイパラメータを強調しています。
概要
タンパク質の折り畳み、タンパク質分泌、脂質ホメオスタシス、および1の細胞内シグナル伝達を含む多くの細胞容量の小胞体(ER)機能。通常のER機能の中心は〜5000倍細胞質2-4に見られるもので、管腔のカルシウム濃度を維持しています。このエネルギー集約的なプロセスはsarco /小胞体カルシウムATPアーゼ(SERCA)、ERへのカルシウムイオンを移動させるポンプによって調整されます。 ERからのカルシウムの流出は、主としてリアノジン(のRyR)およびイノシトール三リン酸(IP3R)受容体によって媒介されます。多くのERプロセスは、カルシウムに依存しているので、店を中断すると、小胞体ストレスと最終的に細胞死につながることができます。
ERのカルシウム調節不全は、心筋症、糖尿病、アルツハイマー病、およびパーキンソン病を含む5において観察されています。これらの疾患の進行性の性質のために、それは因果再描写するために挑戦されています小胞体カルシウムストアの病因および変更の間lationship。多くの技術は、染料および遺伝的にコードされたカルシウム指標(GECIs)を含む、ERカルシウム動態の理解における大きな進歩のために許可されています。 Ca 2+と結合すると蛍光の増加低親和性のカルシウム色素は、カルシウム6の高濃度の細胞内コンパートメントを調べるために、細胞内にロードすることができます。このようD1ERと捕手としてGECIs、細胞内局在7-9のより正確な制御とカルシウムの変動の監視を可能にします。最近、GECIsの別のクラスは、カルシウム測定オルガネラ封入タンパク質指標(CEPIA)は10に記載されていると呼ばれます。遺伝学とエステル系カルシウム色素11(ERに標的化)遺伝的にコードされたカルボキシルエステラーゼを利用する小分子の化学的性質を標的エステラーゼされる色素充填(TED)を組み合わせた第三のアプローチ。
aforながらementionedアプローチは彼らが蛍光の急性測定によって、ERカルシウム動態に貴重な洞察を提供することができ、固有の長所と短所を持っています。これらは、しかしながら、多くの場合、疾患の進行を調査するために必要な縦断的研究のために最適ではありません。長時間にわたりカルシウム動態を監視するための方法を考案することを目的として、我々は、タンパク質(SERCaMPs)12を監視し 、分泌小胞体カルシウムを作成するために、タンパク質修飾を特定し、開発しました。
SERCaMPを繰り返し、ERカルシウムストアを調べるために低侵襲的アプローチを提供することによって、他の方法に関連したいくつかの制限を回避します。我々は以前に、カルボキシ末端ペプチドASARTDL(アラニン、セリン、アラニン、アルギニン、トレオニン - アスパラギン酸 - ロイシン)がER保持を促進するのに十分であることを実証しました。しかしながら、ERカルシウムの減少を引き起こす条件下で、ペプチド配列は、もはやER localizatioを保持することができませんnと、タンパク質が13分泌されます。 SERCaMP技術の基礎は、分泌タンパク質のカルボキシ末端の分泌は、このように、ERのカルシウム調節不全12の強固なレポーターを作成し、小胞体カルシウム枯渇によってトリガーされるように(例えば、 ガウシアルシフェラーゼ 、またはGLUC)にASARTDLの付属物です。トランスジェニック方法によるGLUC-SERCaMPの発現は、ERカルシウム恒常性の指標としてGLUC活性の変化について分析される細胞培養培地および血漿などの生体液を可能にします。この方法は 、インビトロおよびインビボの両方のERカルシウムストアの進行変化の縦断的研究のための用途を有します。以下のプロトコルは、ERカルシウム恒常性を研究するためにGLUCベースSERCaMPを使用するための一般的なアウトラインとして書かれているが、このプロトコルは、代替レポーターSERCaMPsためのガイドとして機能することができます。
プロトコル
インビトロアッセイ 1:安定SH-SY5Y細胞株から検出SERCaMPリリース
- 組織培養におけるプレートSH-SY5Y-Glucを-ASARTDL(SERCaMP)は、表面面積1cm 2 150,000個の細胞でプレートを処理しました。 96ウェルプレートについては、例えば、ウェルあたり50,000細胞( 図1A)を播種。 DMEM(高グルコース、グルタ、ピルビン酸)+ 10%ウシ成長血清+ 1×ペニシリン/ストレプトマイシンで、SH-SY5Y細胞を成長させます。
- 15回( 図1B)まで継代細胞。より高い継代数は、テストされていません。
- 5.5%CO 2で37℃の加湿インキュベーターに細胞を戻し、一晩インキュベートします。
- 実験的治療(複数可)の前に、不透明に培養上清の5μLを転送することによって、各ウェルのベースラインサンプルを収集し、96ウェルプレートを壁。収集する前に、静かにすべての側面にプレートをタップして、グラデーション効果を回避するために、渦。接着剤Sとの不透明なプレートをシール酵素アッセイの時まで4℃でシートや店舗をイーリング。
注:分泌GLUC-SERCaMPは、細胞培養培地中で非常に安定です。我々は以前GLUCの活性の約5〜10%が37°C(SH-SY5Y細胞上でインキュベート)12で72時間のインキュベーション後に失われたと報告しました。 - 小胞体カルシウム枯渇を調べるために、必要に応じて(例えば、環境、薬理学的、遺伝子操作)細胞を処理します。 pHの変化が急速に大気中のCO 2で発生するように、周囲の環境(制御インキュベーターの外)への長い露出を避けてください。長期の操作が必要な場合、pHが14を安定させるために 、20 mmに培地にHEPESを加えます。培地15に HEPESを使用した場合、光への露出を避けてください。
- 陽性対照:SH-SY5Y細胞での実験のために4-6時間、100 nmのタプシガルジン(Tg)がまたは50μMのシクロピアゾン酸(CPA)で細胞を処理します。他の細胞株での最大応答は、長いインキュベーションまたは異なるconcenを必要とするかもしれません化合物のtrations。
- ネガティブコントロール:親のSH-SY5Y細胞から培地を収集します。我々の経験では、このアッセイのバックグラウンド発光は、安定したSH-SY5Y-Glucを-SERCaMP細胞からの基礎分泌の0.05%未満です。
- ステップ1.2で説明したように、希望する時点で馴化培地の5μlのサンプルを収集し、保存します。
- 第5章で説明したように培地中に酵素活性を評価します。
- イムノブロットまたは発光アッセイによる細胞内GLUCを調べます。
- 50mMトリス(pH7.4)中、150mMのNaCl、0.25%デオキシコール酸ナトリウム、1mMのEDTA、1%NP40を含む改変RIPA緩衝液中の溶解細胞、およびプロテアーゼ阻害剤:イムノブロットしました。 SDSポリアクリルアミドゲルおよび0.20μmのPVDF膜への転写に分離します。 4℃で一晩:(2000希釈1)GLUC抗体で膜をインキュベートします。選択した検出試薬のためのユーザー定義のプロトコルに従って二次抗体インキュベーションおよび膜の洗浄を行います。
- ための発光アッセイ( 図2):氷の上で次の手順を実行します。
- 組織培養プレートのウェルからすべての培地を除去し、冷PBS200μlですすいでください。
- 各ウェルに、50mMのトリス(pH7.5)を、150mMのNaCl、1%NP40を含有する溶解緩衝液およびプロテアーゼ阻害剤の75μLを加えます。
- 4℃で20分間オービタルシェーカー(120 rpm)でのプレートを回転させます。
- 静かにまで及び、マルチチャンネルピペッターを用いて空気の泡を避けダウン溶解液をピペット。不透明なプレートに溶解物の5μLを移し、第5章で説明したように発光を評価します。
インビトロアッセイ 2:SERCaMPと不死化細胞の一過性トランスフェクション
注:私たちは、一過性トランスフェクション手順は、細胞ストレスを誘導し、その後のGLUC-SERCaMP応答を鈍らできることを観察しました。次の方法は、トランスフェクションのEFFを最小化するために開発されました SH-SY5Y細胞におけるクト。別の細胞株について(トランスフェクション試薬の選択を含む)は、この手順の最適化が必要とされ得ます。可能な場合には、それぞれセクション1と3で概説した安定な細胞株またはウイルス形質導入法を使用することをお勧めします。
- 4×10 6細胞で100 mmディッシュでプレートSH-SY5Y細胞。この料理は、トランスフェクションの手順に従って再シード約300ウェル(96ウェルプレートフォーマット)するのに十分であろう。
- (GLUC-SERCaMPをコードする)プラスミドDNAの20μgのを使用してXfect試薬で細胞をトランスフェクトし、Xfect試薬6μlの。大きいか小さい培養容器のためのそれに応じてスケールのDNAとXfect試薬。
- 48時間インキュベーターにセルを返します。
- 細胞をトリプシン処理し、ウェル当たり60,000個の細胞で96ウェルプレートに再シード。第1節で概説し、その後の手順に従ってください。
インビトロアッセイ 3:GLUC-SERCaMPのウイルスベクター媒介発現
10トン">注:アデノ随伴ウイルス(AAV)ベクターパッケージング16と精製12とレンチウイルス生産13は、以前に報告されています。- 以下のプライマーおよびプローブを使用して、力価GLUC-SERCaMP AAV:フォワードプライマー、5'-CACGCCCAAGATGAAGAAGT-3 ';リバースプライマー、5'-GAACCCAGGAATCTCAGGAATG-3 '。プローブ(5'-6-FAM / 3'-BHQ-1ラベル)定量的PCRのため、5'-TACGAAGGCGACAAAGAGTCCGC-3 '。
- GLUCを含むプラスミドを線形化し、スピンカラム( 例えば Machery-ナーゲルNUCLEOSPINゲルおよびPCRクリーンアップ)を用いてDNAを精製することにより、標準曲線を準備します。質量ラダーと一緒にアガロースゲル上で分離してDNAを定量。 PBS中10 FG / mlのミリリットル100 PG /からのDNA 1:10希釈液を調製します。プラスミドの分子量に基づいて、濃度のそれぞれでGLUCプラスミドDNAのコピー/ mlを計算します。
- PBS中でのAAVストックを希釈する(適切な希釈は、に依存することになりますウイルス調製物と経験的に決定される)のパラメータを設定します。
- 以下の条件を用いてリアルタイムPCRシステムでPCR反応を実行する:95℃×5分間、94°Cで41サイクルの間、1分20秒×、および60℃×。標準曲線を用いてコピー/ mlを計算します。
- P24レンチ-X急速力価キットでタイターレンチウイルス。氷の上にレンチウイルスのアリコートを解凍し、SH-SY5Y培地中のp24制御タンパク質を希釈します。
- それは標準曲線(20,000または1 10万例 1)に落ちるようにレンチウイルスを希釈します。必要な希釈率は、レンチウイルスの調製パラメータに基づいて変動するため、経験的に決定されなければなりません。後続のすべての手順については、製造元の指示に従ってください。
- 96ウェルプレートにプレート細胞。 SH-SY5Y細胞は、第1節で概説メッキ手順に従うことができます。ラット一次皮質ニューロンのために、細胞を単離し、適切にコーティングされたプレート上に播種されるべきですSは、以前に16を説明しました。 1X B27および500μMのL-グルタミンを補充したNeurobasal培地中でラット初代皮質ニューロンを維持します。一日おきに培地の半分交換を行います。
- ウイルスを細胞に形質導入します。 ガウシアルシフェラーゼは、強いシグナルを提供するように、ウイルス形質導入の目的は、低レベルの発現を達成することです。
- AAV導入SH-SY5Y細胞:メッキ翌日伝達します。 AAV希釈バッファー(PBS + 0.5mMのMgCl 2を)に6.0×10 7 VG /μlにAAVを希釈します。 (;約6000のMOI 3.0×10 8 VG)を96ウェルプレート( 図3A)のウェルあたり希釈AAVの5μLを加えます。ウイルスベクターの廃棄物を不活性化するために、10%の漂白剤を使用してください。
- ラット一次皮質ニューロンのAAV導入:6-8日、めっき後に伝達します。 AAVの希釈緩衝液中4.0×10 6 VG /μlにAAVを希釈します。ウェルあたり、希釈されたAAVの5μL(約350のMOI 2.0×10 7 VG)を追加します96ウェルプレート(図3B)。最適なMOIは、他の細胞型のために経験的に決定されるべきです。ウイルスベクターの廃棄物を不活性化するために、10%の漂白剤を使用してください。
- SH-SY5Y細胞のレンチウイルス形質導入:メッキ翌日を伝達します。ハンクス平衡塩溶液(濃度は滴定キットを用いて測定)は20pg /μlのP24にレンチウイルスを希釈します。 100μlのボリュームを含む96ウェルプレートの希釈ウェルあたりウイルス(1,250,000レンチウイルス粒子に相当のp24の100頁、または〜1,250 IFUs)の5μLを追加します。大きなフォーマットのそれに応じてスケール。ウイルスの廃棄物を不活性化するために、10%の漂白剤を使用してください。
- メディアの前処理サンプルを収集し、実験的治療を48時間(SH-SY5Y)または形質導入後5-7日(ラット一次皮質ニューロン)を開始します。
インビボアッセイSERCaMP 4.
注意:任意の動物手順は、あなたの機関を通じて、適切な承認を得るようにしてください実施する前に。オール生存手術は、十分な麻酔を用いて無菌条件下で行われるべきです。以下で説明するすべての手順は、承認され、NIH ACUCガイドラインに準拠しているされています。
- オートクレーブ外科手術器具(121℃、30分間殺菌、20分の乾燥時間)の開始前。すぐにすべての手続きとオートクレーブの前に、次の超音波装置内のすべての機器を清掃してください。生存手術中に無菌状態を維持します。複数の動物を必要とする手術の場合、70%のアルコール、ultrasonicateとビードラットの間で殺菌と手術器具を拭きます。必要な機器のための材料リストを参照してください。
- 手術のためにラットを準備します。ここでは、オスのスプラーグ - ドーリー(180〜200グラム)を使用します。
- キシラジン(8mg / kg)およびケタミン(/ kgを80 mg)を腹腔内注射に続いて3分(4〜5%がイソフルラン千CC /分で供給)するためのガスイソフルランを使用して、ラットを麻酔。乾燥から角膜を保護するための眼軟膏を適用します。 B尾や足のピンチ次引っ込め反射の欠如によって示されるように、ラット一度egin手術を深く麻酔しています。
- 少し半ば腹部にリブ(低胸部)の下に腹部領域を剃ります。 70%アルコールおよびベタジンスクラブを交互に、手術領域を3回スクラブ。滅菌外科用ドレープと滅菌手術領域に仰臥位にラットを置きます。
- 9 VG / ml(最終濃度)7.6×10にAAV-Glucを-SERCaMPを希釈します。チューブを反転させてよく混ぜます。
注意:ウイルス濃度の範囲は( 図4)を変化させることができます。- ピペット滅菌皿に希釈されたAAVの105μlの。シリンジにウイルスを収集するために30ゲージの針を使用してください。
- 肝臓を露出させ、AAV-Glucを-SERCaMPを注入する手術を行います。
- 腹部切開を行う前に、切開領域に0.25%ブピバカインを適用します。メスを用いて、胸郭の下に水平切開(APを作ります近接2-3センチ)。ブラントは、皮下組織からの結合組織を分離するために解剖します。
- 肝臓の右中葉を露出させ、腹筋をカット。
注意:追加のローブは、最終用途に基づいて注入することができます。 - 手術用顕微鏡下で動物を置き、視野内の肝臓の右中葉を取得するために調整します。内側ローブの実質にウイルスを注入。 3つの別々のサイト、サイトあたり約33μlの。
注意:全体の注入量の配信を保証するために、注入後5〜10秒間、組織に針を残します。 - 別々に腹筋と皮膚を縫合糸と綿チップソーアプリケーターを用いてネオスポリンを追加します。意識を取り戻し、ラットが直立位置を維持することができるされるまで、回復室にラットを置きます。それは胸骨横臥位を維持するのに十分な意識を取り戻したまでラット(複数可)、無人のままにしないでください。ハウスは単独まで切開が治癒したと縫合糸は、(7-14日)削除されました。
注:NIH手術後のガイドラインに従って、外科的な記録を維持します。手順、日付、実験識別子、体重、および手術の日にケージカードに注釈を付けます。痛み/苦痛、糞の生産、活動、食品や水の消費量を監視し、3日後に手術を記録します。術後鎮痛は、我々は通常、手術後の痛みや苦痛の徴候を観察していないが、飲料水(450ミリグラム/ 100 CC)にアセトアミノフェンを添加することにより提供されます。
- 4-7日注射後の尾採血を開始します。標識し、事前に計量することによって採血管を準備します。各チューブに50μlのヘパリン(千U / ml)を追加します。
- 3分間イソフルラン麻酔室に入れラット(4〜5%イソフルラン1,000 CC /分で供給)。 (500のcc /分で供給2〜3%イソフルラン)ノーズコーン内チャンバーと場所からラットを削除します。テールパイを次の引っ込め反射の欠如によって示されるように、採血はラットを深く麻酔されると開始することができますNCH。
- 滅菌はさみを使用すると、(1-2 mm)の尾の先端をカットし、予め充填されたヘパリンチューブに血液滴下を収集します。ヘパリン比(> 100μlの血液/ 50μlのヘパリン)に1血液:ボリュームが2より大きいに達するまで血液を採取します。採血ボリュームが実験計画に基づいて調整することができます。出血を止めるために末尾に止血粉を適用するために湿った綿棒を使用してください。
- 4℃で保存血管以降のサンプルを収集する場合。コレクション間で滅菌エタノールパッドとビーズとハサミを拭いてください。
- コレクションチューブを秤量し、2得るためにヘパリンを調整する:1の比率(血液:ヘパリン)。このステップは、各サンプル( 表1)でのヘパリンの量を正規化します。
- 4℃で5分間、2,000×gで遠心分離管。ルシフェラーゼアッセイ(第5節)の時まで-80℃で新鮮なチューブやストアに上清(血漿)を転送します。
注:前に酵素アッセイに72時間まで4℃でサンプルの保存はメートルを持っています発光( 図5A)にinimal効果。血漿試料の3回の凍結融解サイクルまでの発光( 図5B)に影響を及ぼさありません。
- タプシガルジン管理(陽性コントロール):
- 2.5 mg / mlの最終濃度までエタノール中に希釈することにより調製タプシガルギン。下腹部には1mg / kg、腹腔内でタプシガルギン注入します。
注意:タプシガルギンは、トロンビン誘導血小板凝集17が増加し、尾からの採血をより困難にすることができます。
- 2.5 mg / mlの最終濃度までエタノール中に希釈することにより調製タプシガルギン。下腹部には1mg / kg、腹腔内でタプシガルギン注入します。
- ガウシアルシフェラーゼアッセイ:
- 氷上で血漿サンプルを解凍します。
縦の研究のため、解凍し、同じ日にすべての時点のサンプルに対して発光アッセイを行う(基板の単一の製剤を使用して):注意してください。 - 不透明な壁のプレートに移し、血漿を10μlと部5を実行し、各血漿サンプルの3-4技術的反復で説明したように、酵素活性を測定します。
- 氷上で血漿サンプルを解凍します。
- EuthanasiA
注意:SERCaMP技術の利点は、モニタ、ERカルシウムを縦にする機能です。実験パラメータおよびエンドポイント分析に応じて、動物は、エンドポイント分析のための適切かつ制度的ACUCのガイドラインに従った措置により安楽死させなければなりません。
5.発光アッセイ
- 20 mMの(メタノール3mlに10 N HClを30μl)を酸性化メタノールに化合物を希釈することによりセレンテラジン(CTZ)のストック溶液を準備します。単回使用のアリコートを調製し、-80℃で保存します。
- アッセイの日に作業基板を準備します。
- in vitroアッセイは、 例えば 、PBS中の8μmのセレンテラジンを希釈し、PBS 25 mlに20 mMのCTZの株式の10μlを添加する( 図6A、B)。
- インビボのアッセイのために、PBS中の100μM、500 mMのアスコルビン酸、5 mMの塩化ナトリウムにセレンテラジンを希釈します。
- 少なくとも30分間準備CTZをインキュベートアッセイを開始する前に、室温で。
注:準備の後の最初の30分間の急速な基板崩壊の報告があるので、このステップは、多くの場合、ガウシアルシフェラーゼアッセイに含まれています。当社は、当社のシステム( 図6C)で、この効果を確認されていません。私たちは、アッセイに負の影響を発見したとしてしかし、私たちはしばしば、インキュベーション工程が含まれます。 - 生物発光を監視し、基板インジェクターを装備することが可能なプレートリーダーを使用してください。プライム基板とのライン。
注:ラインを介して初期基板が劣化しやすくなります。初期のサンプルのための人為的な低読みを避けるために、実験試料を測定する前に20〜30空のウェル(リーダーで空のプレートをロードする)を注入します。 - ウェルに100μlの基質を注入し、5秒間中速を振るし、発光を測定します。バイオテックシナジーIIプレートリーダーのために (0.5秒かけて(in vitroでのサンプル)と5秒の発光を統合読み取りステップのための生体サンプル)。理想的なアッセイ性能のためのプレートリーダーのパラメータを最適化します。
注:(他のルシフェラーゼで観察動態をグローと比較して)急速な信号減衰とガウシアルシフェラーゼの展示フラッシュ動態。 GLUCのフラッシュ速度は、サンプルの両端の培地組成をコントロールすることの重要性を強調し、細胞培養培地( 図7A)の血清によって影響されます。これにより、基板(フラッシュ動態)を追加した後の発光の急速な崩壊、注入およびすべてのサンプルについて均一でなければならない手順をお読みの間の時間に。プレートリーダーは、(我々は5秒シェイクステップを使用など )、およびそのほかの読み取り一定時間を待って、ウェルに基質を注入するように設定する必要があります。基板は、同時に全てのウェルに添加することができない限り、読み取り前に、プレート全体に基板を追加すると、重要な課題を提起します。インジェクタが利用できない場合、問題は、部分的に基板のaddiの間で10分間、プレートをインキュベートすることによって回避することができますると測定(したがって、減衰曲線の急峻な部分を回避する)( 図7B)。 - 注射を繰り返し、時間を待って、プレート上の各ウェルのための手順をお読みください。
結果
GLUC-SERCaMP方法は、細胞外液をサンプリングすることにより、ERカルシウム恒常性の評価が可能になります。いくつかのコントロールは、結果の解釈を強化するために実験計画に含めることができます。まず、(C末端ASARTDLまたは「GLUC-タグはありません」なし例えば GLUC)構成的に分泌されたレポーターの使用は分泌経路(グローバル細胞分泌)および導入遺伝子発現に関する実験治療の効果を評価するために使用することができます。例えば、GLUC-SERCaMPとGLUC-NOタグの両方の細胞外レベルの増大はあいまい結果と考えられます。また、GLUC-、タグの応答の対応欠如とGLUC-SERCaMP分泌の増加は、ERのカルシウム依存性イベント( 図8)をサポートしています。溶解が必要とされるように、これは、単一の時点に制限されているが、ERカルシウムの枯渇に応答しGLUC-SERCaMPの分泌はさらに、細胞内GLUCを測定することによって評価することができます。 int型 racellular GLUC-SERCaMPは、それが徐々に分泌されるように、小胞体カルシウム枯渇に応じて減少し、細胞外になります。(各個々のウェルについて計算)の細胞内比率が( 図2B)増加します。外:細胞内の比率は、導入遺伝子発現の変化を制御するのに有用です。
小胞体カルシウムストアの薬理学的調節物質は、新規なパラダイムでSERCaMPリリースにERカルシウムの寄与を確認するために利用することができます。ダントロレン、のRyRアンタゴニストは、Tgは( 図8B)に応答してSERCaMPの放出を減少させるまたは阻害する必要のある、ERカルシウムを安定化することが知られています。これは、小胞体カルシウムフラックス(例えばXestospongin C、4-クロロ-m-クレゾール)SERCaMPを採用した新たな実験パラダイムでに影響を与える追加の化合物を試験するために、可能な場合は、推奨されます。これらの研究は、多くの場合、 生体内で挑戦されているが、対応する組織培養モデルにおいて実現可能です。
"> GLUCベースSERCaMPを用いたin vitro試験のために、制御(複数可)を基準に個々のプレート上の応答を計算することをお勧めします。「治療誘発性の応答は、(コントロールに対する相対応答の変化を追跡することによって、時間経過にわたって評価することができます間板の比較)。これは。の時点( 図6C)との間に生の値に変化をもたらすことができ、基板の崩壊に起因するプレート内での相対的な比較を行う、複数のプレート全体に生の数値を比較することはお勧めできませんのためにこの効果を最小限に抑えます( 図6D)。 インビトロのTg誘発性SERCaMP放出実験のためのデータ分析の例を図9に示されています。GLUC-SERCaMPを用いたin vivo試験のために、データは、独自の「前処理」対照として、すべての動物を、各動物について独立して評価されるべきです。これは、導入遺伝子デルの変動を考慮することが必要です動物間iveryと式( 図4A)。
SERCaMP応答の大きさは、細胞の健康のベースラインに関連しており、直接研究者によって制御することができる多くは、様々な要因によって影響されます。最大SERCaMP応答のためには、基礎ERカルシウム恒常性に有利な条件を最適化することが不可欠です。これは、最適な密度で細胞を播種し、低ウイルス力価を使用することを含みます。種々の細胞および組織型は、経験的に決定されるべきである追加の要件を有してもよいです。
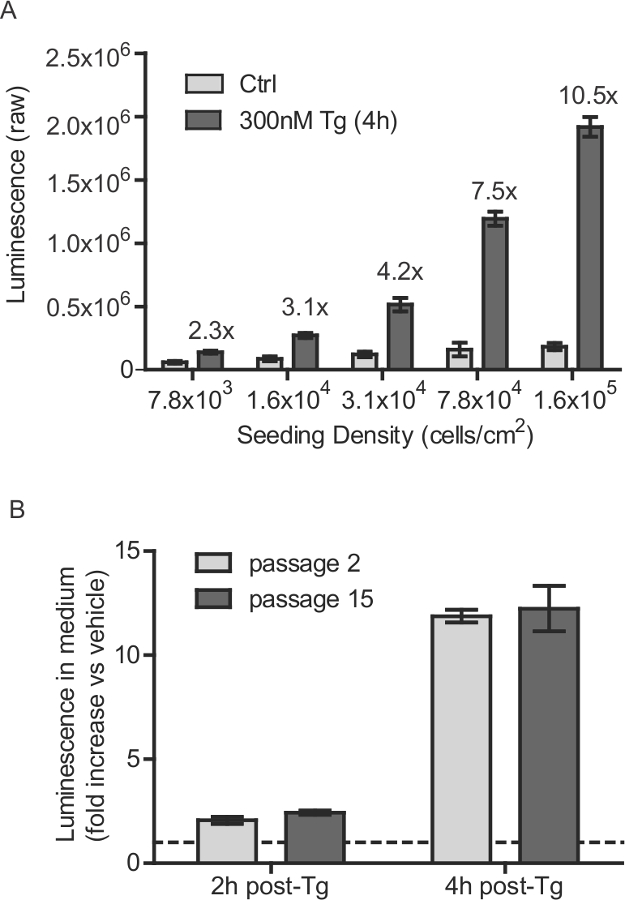
図1:安定したSH-SY5Y細胞株の播種密度および継代数の考慮事項(A)SH-SY5Y-Glucを-SERCaMP細胞は、種々の密度で播種し、40時間インキュベートしました。分泌GLUC-SERCaMPは300 nMのTgがOで処理した後の4時間を測定しました。Rの車両制御(平均±SD、N = 6)。 GLUC-SERCaMP分泌のタプシガルギン誘発性の増加は、それぞれの細胞密度のために示されています。 (B)継代数2と15でSH-SY5Y-Glucを-SERCaMP細胞はタプシガルギン誘発性分泌について検討しました。細胞を、2時間または4時間100 nMのTgを有する処理し、ビヒクル処理のコントロールがに分泌GLUC活性が標準化した(平均±SD、n = 4の、通路率の有意な効果、2ウェイANOVA)。破線は、yが1を=示し、この図の拡大版をご覧になるにはこちらをクリックしてください。
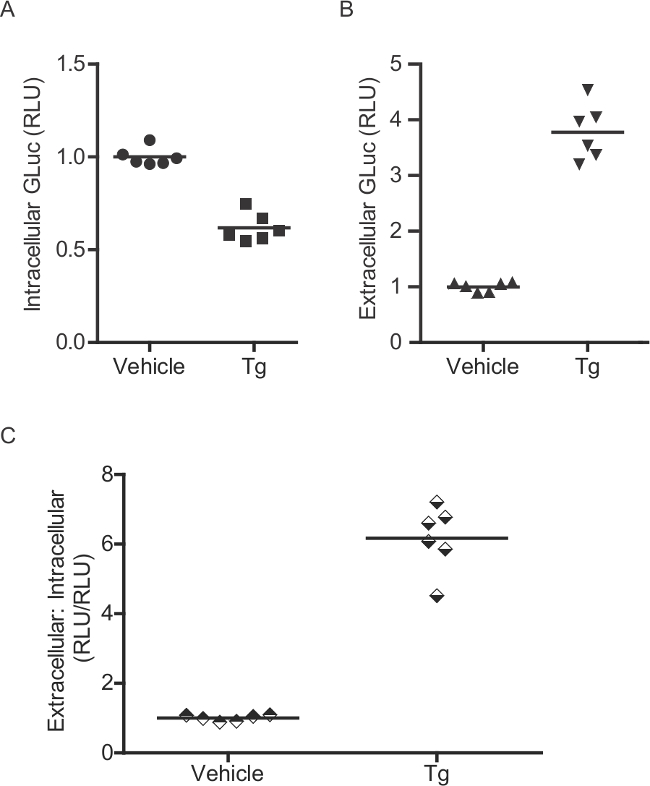
図2:細胞内GLUC-SERCaMPを測定するための酵素アッセイは、(A)は、細胞内及び(B)は、細胞外GLUC酵素活性は、ラット初代CORで評価しました(AAV-Glucを-SERCaMPで形質導入)ticalニューロン。六日間形質導入後、細胞を、4時間、60 nmのタプシガルジンで処理しました。 GLUC-ASARTDLが培地中に蓄積するように、細胞内レベルでの対応する減少が観察されます。 (C)外の比:細胞内GLUC活性は、個々のウェルについて算出することができます。

図3:SH-SY5Y細胞と一次皮質ニューロンをラットについてタプシガルジンにより誘導される応答に対して、AAV-Glucを-ASARTDL力価は、(A)、SH-SY5Y細胞は、ウェルあたり5×10 4個の細胞で96ウェルプレートに播種し、付着させました一晩。細胞を48時間インキュベートし、次いで300nMのTgをまたはビヒクルで処置し、感染の指示された多重度(MOI)で形質導入しました。発光は(平均±SEM、n = 3)を8時間後に培地中で測定しました。 * P <0.05、MUL複数指t検定(ホルム - シダック補正)。 (B)ラット初代皮質ニューロンを、(形質導入時によく近似当たり60,000細胞を使用して計算された)が示さMOIでAAV-Glucを-ASARTDLでDIV8で形質導入しました。五日目の形質導入後、細胞を培地中で100nMのTgがまたはビヒクル対照と発光で処理した8時間後に測定した(平均±SEM、N = 6)。 * P <0.05、複数のt検定(ホルム - シダック補正)。
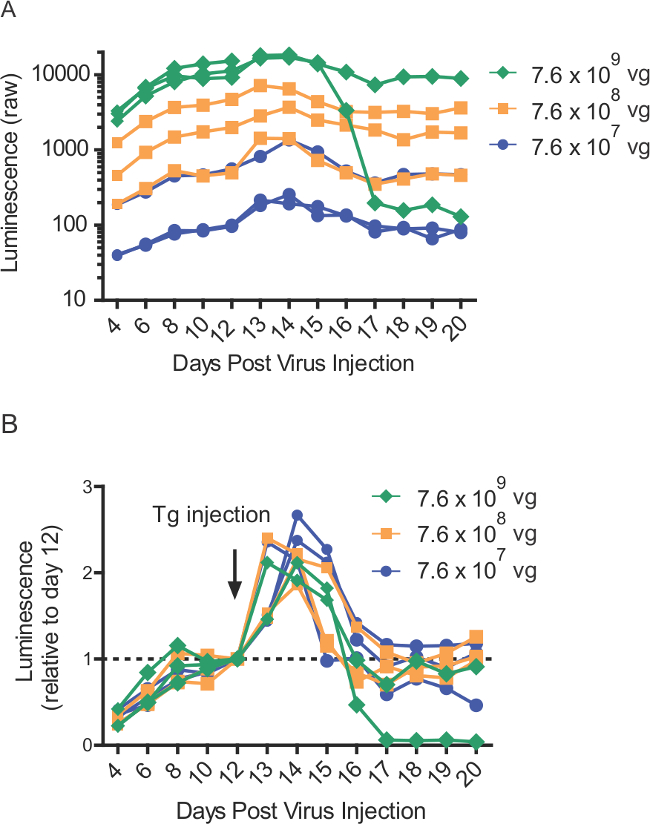
ラットからのウイルス力価の範囲にわたって肝臓内注射後の血液中にタプシガルギン誘発性GLUC-SERCaMPリリース(A)生の発光値(N = 8)肝内の異なるAAV-Glucを-ASARTDL力価を注入します。図4。タプシガルギン(1ミリグラム/ kg)の注射(IP)は、12の血液は、示された時点で収集し、-80&#で保存した日に投与しました。176; Cアッセイの時まで。 (B)パネルAからの正規化された発光値、ラットにおけるタプシガルギン誘発性SERCaMP応答を実証した(n = 8)、AAV-Glucを-ASARTDLの様々な量を表します。

図5:取扱い及び( インビボ)GLUC-SERCaMP血漿サンプルのストレージは(A)血漿を、肝内(N = 10)GLUC-SERCaMPを発現するラットから採取し、等分し、アッセイするまで-80℃で保存しました。チューブは(平均±SD)発光測定の前に-80℃から取り出し、示された時間、4℃で保存しました。 (B)GLUC酵素活性の血漿サンプルの複数の凍結/解凍の影響。血漿サンプルは、示された数に供した(N = 10)肝内AAV-Glucを-SERCaMPを発現するラットから採取し凍結融解サイクルのと(平均±SD)の発光を測定しました。

図6:GLUC-SERCaMPアッセイにセレンテラジン基質を準備する(A)培養培地を5時間、300 nMでのTg(又はビヒクルコントロール)で処理したSH-SY5Y-Glucを-SERCaMP細胞株から採取しました。培地中のGlucを活性は(平均±SD、N = 6)セレンテラジンのPBS +様々な濃度を注入することにより評価しました。パネルAから(B)発光値は、タプシガルギン誘発性の効果を評価するために、各基質濃度の制御をあしらった車両に標準化しました。 (C)数時間にわたって基板崩壊。組換えGLUC(0.1 ngの0.02 NG)の既知量からの発光は、(平均±SD、n = 4)は基板を作製した後、数時間にわたって測定しました。 (D)は、組換えのための生の発光ながらGLUCの減衰を基板に起因する経時的に減少し、試料中の倍の差は、(発光によって決定される)に維持しました。
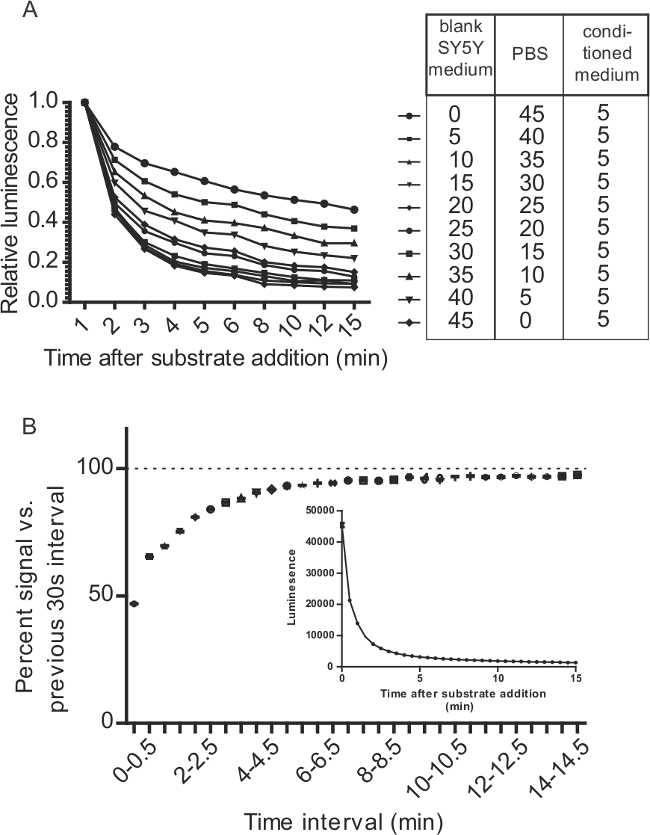
図7:GLUC / CTZ反応の速度に関連GLUC-SERCaMPアッセイのための考慮事項は、(A)培地をGLUC / CTZ信号の減衰を変化させます。 GLUC-SERCaMPを含む上清5μlをPBS、培地、種々の比で混合しました。 100μlの基質(PBS中15μMのCTZ + 500mMのアスコルビン酸)は、表に示すように希釈したサンプルの50μlに添加しました。発光を15分間かけてモニターしました。 (B)中の5μlのはSH-SY5Y-Glucを-ASARTDL細胞と100μlの基質(PBS + 5 mMのNaCl中8μMCTZ)から採取した追加されました。発光は、上基板(T = 0)、30秒ごとに追加した直後に測定しました。 15分(±SD、N = 12)のコースです。データは、減衰率を評価するために、前の30秒間隔%の信号の相対としてプロットされています。挿入図は、生の発光データを示します。

図8:小胞体カルシウム枯渇の薬理学的裏付け(A)GLUC分泌に100 nmのタプシガルジンの効果(平均±SD、N = 6)GLUC-ASARTDLとGLUC-、タグのコントロールのために調べました。 (B)ダントロレンとERカルシウムの安定化(のRyRアンタゴニスト)のTg誘発性SERCaMPの放出を阻害します。細胞を、100nMのタプシガルジンの添加前に30分以上16時間ダントロレンの示された濃度で予備処理しました。培地中のGLUC活動は、(平均±SD、N = 6)4時間後に測定しました。
99fig9.jpg "/>
図9:GLUC-SERCaMPアッセイのためのモック代表的な結果ビヒクル処理値は(個々のプレートを読み取る間の時間間隔に依存して)基板破壊による板の間に低下することがあります。この効果を説明するために、具体的な治療効果が、各プレートのために独立して計算され、この比率は、プレート間で比較されます。
| 期日 | ラット | チューブ質量(mg)で | ヘパリン容量(ml) | ヘパリン密度(グラム/ ml)を | ヘパリンの質量(mg)で | チューブ+ヘパリン(MG)の質量 | 採血後の総質量(mg)を | 採取した血液の質量(mg)を | 密度の血液(グラム/ ml)を | 計算された体積の血液(UL) | 2ために必要なヘパリンの量:1の比 | スピンの前に追加するmlの追加のヘパリン |
| 01.01.15 | SD男性 | 1135.9 | 50 | 1.117 | 55.83 | 1191.73 | 1317.70 | 125.97 | 1.05 | 119.97 | 59.98 | 9.98 |
表1:採血テーブル SERCaMP研究のための採血ログの例。
ディスカッション
このプロトコルは 、インビトロを強調し、GLUC-SERCaMPの生体ユーティリティで、ERカルシウムの枯渇をモニターします。 SERCaMPを生成するタンパク質修飾は、他のレポータータンパク質12に一般に見えますが、我々は他のルシフェラーゼ18と比較して(200〜1,000倍以上)の強固な生物発光のためのガウシアルシフェラーゼを選択しました。私たちは、初代ラット皮質ニューロン、SH-SY5Y細胞、およびラットの肝臓( 図3、図4)に配信GLUC-SERCaMPウイルスの100倍の用量範囲にわたって検出可能タプシガルギン誘発性GLUC-SERCaMPリリースを示しています。我々は以前GLUC-ASARTDLを発現する安定にトランスフェクト細胞株の生成を記載し、5×10 4の非標識細胞の集団のようにいくつかの20個の細胞が応答12を誘発しタプシガルギンを報告できることを実証しました。ここでは、安定な細胞株は、一貫して15継代、最もアナライザーに出Tgが誘発性応答を報告できることを示しています経時レポーターの連続的発現は、ERカルシウム枯渇( 図1)に応答して放出する能力に影響を与えないことを示し編、。我々のデータは、GLUC-SERCaMPは、主としてそれが分泌される小胞体カルシウム枯渇の時間まで、細胞のER内に保持されることを示します。 「正常な」条件下では、ベースラインERカルシウムホメオスタシス12の確立を可能にする低い基礎分泌があります。タプシガルギンによって小胞体カルシウム枯渇に続いて、反対方向に細胞内および細胞外の発光変化のレベル。これは、センサ( 図2)の定常状態の分布の変化を示す比として表すことができます。 SERCaMP放出がKDEL受容体の発現12によって変調されるように重要なのは、放出の大きさは、細胞型に依存して変化し得ます。別のKDELのようなカルボキシ末端配列を有する「ASARTDL 'を代入すると、マキシを達成するために必要とされ得ることを我々は想定特定の細胞または組織型におけるMAL SERCaMP応答。
in vitroアッセイでは、細胞外GLUC-SERCaMPのレベルが原因で、分泌レポーターの安定に時間をかけて蓄積されます。私たちは72時間12後の活動でおおよそ5〜10%の減少を報告しました。このように、ERカルシウムホメオスタシスに薬理学的または遺伝的チャレンジを開始する前に培地を交換することは、センサの蓄積に起因するバックグラウンドシグナルを低減する必要があるかもしれません。これとは対照的に、in vivoでの GLUC-SERCAMPの半減期は、血漿中の信号を示す3.5から4.7分で12ある循環血液中へのレポーターの最新リリースを表します。血液がエキソビボおよび血漿に加工すると、しかしながら、GLUC-SERCaMP(図5)は非常に安定です。
説明される方法のために、培地または血漿は、酵素アッセイの前に、不透明な96ウェルプレートに移されます。 GLUCベースのレポーターを使用する際に考慮すべき二つの重要な要因Sは、酵素のフラッシュ動態およびセレンテラジン基板の内訳です。インジェクターを装備したプレートリーダーは、基質添加し、発光測定の間の時間を正規化するためにGLUC酵素アッセイを実行するのに最適です。セレンテラジンの化学的性質は、基板の製造後の異なる時点で測定された未加工の蛍光値を比較排除れ、減衰することを作る傾向があります。実験の期間( 図9)を介して追跡される制御と実験サンプルとの間の相対的な差を可能にすること、しかし、維持されている( 図6)のサンプル間の差異を折ります。
プログレッシブ疾患を調査する際に、インビボで ERカルシウムの変動を監視する能力は、有利で す。例えば蛍光細胞質染料などの他の方法は、in vitro試験で急性に適しているが、SERCaMPレポーターは、縦、ERカルシウムのモニタリングを可能にする最初のものです。王Rプロトコルは、AAV-Glucを-SERCaMPの直接肝注射の概要を説明します。私たちは12可能です(最新の時点では、これまでテストした)56日後に、注射のために比類のない動物の循環でGLUC-SERCaMPの安定レベルを検出し、長い実験を予測しています。 AAVベクターは、直径約20nmの測定、サイズが小さく、最低限の生物学的安全性の要件19をもたらします 。二本鎖DNAを一本鎖AAVゲノムの変換を回避するために、AAV-SERCaMPは、AAV血清型1の二本鎖ベクター20としてパッケージ化されました。 AAV血清型1を効果的にラットの肝臓19,21を伝達することが示されています。しかし、私たちの注入法の注意点は、身体全体の他の組織に移動するウイルスの可能性です。ベクターは、直接肝臓に注入したが、提示される我々の方法はSERCaMP放出源を識別することができないので、それは、肝臓以外の組織がGLUC、SERCに寄与し得ることが可能ですアンプ信号。今後の遺伝子操作は、組織タイプを標的とするために式を制限します。例えば、組織特異的Creをドライバラインは、プラズマサンプリングを介した小胞体カルシウムの組織特異的なモニタリングを可能にするCre依存GLUC-SERCaMPと交配。
記載のインビボ技術は、レポーターの堅牢な性質のため、低ウイルス力価を使用しています。 GLUC-SERCaMP放出は7.6×10 9 VG( 図4)に7.6×10 7のウイルスVG範囲を検出することができます。この範囲は、肝臓19のホタルルシフェラーゼベースのウイルス注射を利用前作で報告されたものより4-400倍低いです。より高い濃度で、我々は、おそらく導入遺伝子22に対する動物の免疫応答に起因している、時間をかけて検出可能な発現の損失を観察しました。ウイルスの高い力価は、可能な場合に起因する信号損失の可能性の増大に避けるべきです。提示されたものよりも低い力価はならないしていますアンは、試験しました。このプロトコルは、肝臓へのAAV-Glucを-SERCaMPの注射を概説。同様のアプローチは、理論的には、他の組織タイプのために可能です。そのようなウイルス濃度および血清型などのパラメータは、他の組織において十分な発現のために最適化されなければなりません。
レポーターの堅牢な性質のために、血液(100〜150μl)を少量の実験を通して、繰り返しコレクションを可能にする、尾の切り抜きから採取することができます。これはベースラインレベルへの復帰が続くタプシガルギン管理( 図4)の後に上昇したレベルを観察タプシガルギンに応答してGLUC-SERCaMPリリースの長手方向の特徴付けのために有用でした。採血後の血漿サンプルを適切に処理することも重要です。このように、我々はSERCaMP前酵素アッセイ( 図5)に72時間まで4℃で保存された血漿中で安定であることを実証しました。また、血漿試料を、少なくとも3回の凍結/ Tを受けることができます発光に対する影響を最小限に抑えます (図5)とサンザシのサイクル。実際には、我々は前に酵素アッセイを評価するには不必要な凍結融解サイクルを避けるため、-80℃で、すべてのサンプルを格納すると同時に、実験のすべてのサンプルを分析します。
ERカルシウムの枯渇は、様々な疾患の病因に関与しています。それは、多くの場合、細胞の機能を妨害し、小胞体ストレス応答(UPR)の活性化を導く上流のイベントであると考えられています。 UPRは恒常的条件5を再確立するために、ERで採用適応反応です。小胞体ストレスの慢性状態は、最終的に細胞死に至る、恒常性を回復するUPRの容量を超えています。 ERストレスとERカルシウム調節不全は、1型糖尿病、糖尿病性腎症、神経変性疾患および心臓血管dieases 5のような疾患において観察されます。カルシウム調節不全と疾病の病因との関係は、しかしながら、difficあります線引きするULT。 SERCaMP技術は、このように、疾患の発症と進行への洞察を提供し、動物の寿命にわたって、このプロセスを追跡する可能性を秘めています。また、ERのカルシウム調節不全を防止または補正するように設計された潜在的な治療薬の評価はSERCaMPの使用により評価することができます。最後に、GLUC-SERCaMPリリースが発生する疾患を同定することは疾患調節遺伝子治療の手段としてSERCaMPsとして分泌の治療用タンパク質またはペプチドを設計し、採用する機会を提供しています。
開示事項
The authors have nothing to disclose.
謝辞
This work was supported by the Intramural Research Program at the National Institute on Drug Abuse. We thank Doug Howard, Chris Richie, Lowella Fortuno, and Josh Hinkle for their contributions to developing this method.
資料
| Name | Company | Catalog Number | Comments |
| 1.5 ml tubes | Fisher | 02-682-550 | |
| 10% NP-40 solution | Pierce | 28324 | for intracellular GLuc assays |
| 1 ml luer-lok syringes | Fisher | 14-823-30 | |
| 200 microliter filter tips | Rainin | RT-L200F | |
| 3-0 surgical sutures | Fisher | NC9598192 | |
| 30 G needles | Fisher Scientific | 14-821-13A | |
| Adhesive microplate sealing sheets | Thermo | AB-0558 | |
| Alcohol prep pads | Fisher | 22-246-073 | |
| Anesthesia Auto Flow System | E-Z Anesthesia | EZ-AF9000 | |
| Animal recovery chamber | Lyon Vet | ICU-912-004 | |
| B27 supplement | Life Technologies | 17504-044 | |
| Betadine solution | Fisher | NC9386574 | |
| Bleach | Clorox | n/a | |
| Bovine growth serum | Thermo | SH30541.03 | |
| Coelenterazine, Native | Regis Technologies | 1-361204-200 | |
| Cotton tipped applicators | Puritan | 806-WC | |
| Cutting needles 3/8 circle sutures | WPI | 501803 | |
| Digital ultrasconic cleaner | Fisher Scientific | FS60D | |
| DMEM high glucose, GlutaMAX, pyruvate | Life Technologies | 10569-010 | |
| DNA mass ladder | Life Technologies | 10496-016 | |
| Gaussia luciferase (recombinant protein) | Nanolight | 321-100 | |
| Gaussia luciferase antibody (for WB, ICC, or IHC) | New England Biolabs | E8023S | 1:2,000 (WB) |
| Germinator 500 | CellPoint Scientific | DS-401 | |
| Gluc assay plates (96 well, opaque) | Fisher | 07-200-589 | |
| Hank's balanced salt solution | Life Technologies | 14175-095 | |
| Heparin | Allmedtech | 63323-276-02 | |
| Isoflurane | Butler Schein | 29404 | |
| Ketamine | Henry Schein | 995-2949 | |
| Kwik Stop Styptic powder | Butler Schein | 5867 | |
| L-glutamine | Sigma | G8540 | |
| Methanol | Fisher | a452-4 | |
| Microfuge 22R Centrifuge | Bekman Colter | 368831 | |
| Neosporin | Fisher | 19-898-143 | |
| Neurobasal medium | Life Technologies | 21103049 | |
| Nikon Stereoscope | Nikon | SMZ745T | |
| Nucleospin Gel and PCR Cleanup | Machery-Nagel | 740609 | |
| P200 pipet | Rainin | L-200XLS+ | |
| p24 Lenti-X rapid titer kit | Clontech | 632200 | |
| PCR film seal | Fisher | AB0558 | |
| Penicillin/streptomycin | Life Technologies | 15140-122 | |
| Protease inhibitor cocktail | Sigma | P8340 | |
| ReFresh Charcoal Filter canister | E-Z Anesthesia | EZ-258 | |
| Scalpel blades, #10 | Fine Science tools Inc | 10010-00 | |
| SD rats 150-200 g | Charles River | Rats | rats ordered at 150-200 g. Surgery 5 days after arrival |
| Small animal ear tags | National Band and Tag co | 1005-1 | |
| Sterile surgical drapes | Braintree Scientific | SP-MPS | |
| Synergy 2 plate reader | BioTek | n/a | |
| TaqMan Universal PCR Master Mix | Applied Biosystems | 4304437 | |
| Thapsigargin | Sigma | T9033 | harmful to human health |
| Virapower lentiviral packaging mix | Life Technologies | K4975-00 | |
| Xfect Transfection reagent | Clontech | 631318 | |
| Xylazine | Valley Vet | 468RX |
参考文献
- Sitia, R., Braakman, I. Quality control in the endoplasmic reticulum protein factory. Nature. 426 (6968), 891-894 (2003).
- Burdakov, D., Petersen, O. H., Verkhratsky, A. Intraluminal calcium as a primary regulator of endoplasmic reticulum function. Cell Calcium. 38 (3-4), 303-310 (2005).
- Fu, S., et al. Aberrant lipid metabolism disrupts calcium homeostasis causing liver endoplasmic reticulum stress in obesity. Nature. 473 (7348), 528-531 (2011).
- Micaroni, M. The role of calcium in intracellular trafficking. Curr Mol Med. 10 (8), 763-773 (2010).
- Mekahli, D., Bultynck, G., Parys, J. B., De Smedt, H., Missiaen, L. Endoplasmic-reticulum calcium depletion and disease. Cold Spring Harb Perspect Biol. 3 (6), (2011).
- Paredes, R. M., Etzler, J. C., Watts, L. T., Zheng, W., Lechleiter, J. D. Chemical calcium indicators. Methods. 46 (3), 143-151 (2008).
- Whitaker, M. Genetically encoded probes for measurement of intracellular calcium. Methods Cell Biol. 99, 153-182 (2010).
- Tang, S., et al. Design and application of a class of sensors to monitor Ca2+ dynamics in high Ca2+ concentration cellular compartments. Proc Natl Acad Sci U S A. 108 (39), 16265-16270 (2011).
- Palmer, A. E., Jin, C., Reed, J. C., Tsien, R. Y. Bcl-2-mediated alterations in endoplasmic reticulum Ca2+ analyzed with an improved genetically encoded fluorescent sensor. Proc Natl Acad Sci U S A. 101 (50), 17404-17409 (2004).
- Suzuki, J., et al. Imaging intraorganellar Ca2+ at subcellular resolution using CEPIA. Nat Commun. 5, 4153(2014).
- Rehberg, M., Lepier, A., Solchenberger, B., Osten, P., Blum, R. A new non-disruptive strategy to target calcium indicator dyes to the endoplasmic reticulum. Cell Calcium. 44 (4), 386-399 (2008).
- Henderson, M. J., Wires, E. S., Trychta, K. A., Richie, C. T., Harvey, B. K. SERCaMP: a carboxy-terminal protein modification that enables monitoring of ER calcium homeostasis. Mol Biol Cell. 25 (18), 2828-2839 (2014).
- Henderson, M. J., Richie, C. T., Airavaara, M., Wang, Y., Harvey, B. K. Mesencephalic astrocyte-derived neurotrophic factor (MANF) secretion and cell surface binding are modulated by KDEL receptors. J Biol Chem. 288 (6), 4209-4225 (2013).
- Shipman, C. Evaluation of 4-(2-hydroxyethyl)-1-piperazineëthanesulfonic acid (HEPES) as a tissue culture buffer. Proc Soc Exp Biol Med. 130 (1), 305-310 (1969).
- Zigler, J. S., Lepe-Zuniga, J. L., Vistica, B., Gery, I. Analysis of the cytotoxic effects of light-exposed HEPES-containing culture medium. In Vitro Cell Dev Biol. 21 (5), 282-287 (1985).
- Howard, D. B., Powers, K., Wang, Y., Harvey, B. K. Tropism and toxicity of adeno-associated viral vector serotypes 1, 2, 5, 6, 7, 8, and 9 in rat neurons and glia in vitro. Virology. 372 (1), 24-34 (2008).
- Smeets, E. F., Heemskerk, J. W., Comfurius, P., Bevers, E. M., Zwaal, R. F. Thapsigargin amplifies the platelet procoagulant response caused by thrombin. Thromb Haemost. 70 (6), 1024-1029 (1993).
- Tannous, B. A. Gaussia luciferase reporter assay for monitoring biological processes in culture and in vivo. Nat Protoc. 4 (4), 582-591 (2009).
- Sobrevals, L., et al. AAV vectors transduce hepatocytes in vivo as efficiently in cirrhotic as in healthy rat livers. Gene Ther. 19 (4), 411-417 (2012).
- Wang, Z., et al. Rapid and highly efficient transduction by double-stranded adeno-associated virus vectors in vitro and in vivo. Gene Ther. 10 (26), 2105-2111 (2003).
- Seppen, J., et al. Adeno-associated virus vector serotypes mediate sustained correction of bilirubin UDP glucuronosyltransferase deficiency in rats. Mol Ther. 13 (6), 1085-1092 (2006).
- Hareendran, S., et al. Adeno-associated virus (AAV) vectors in gene therapy: immune challenges and strategies to circumvent them. Rev Med Virol. 23 (6), 399-413 (2013).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved