Method Article
Monitoreo de la homeostasis del calcio del retículo endoplasmático Usando una
* Estos autores han contribuido por igual
En este artículo
Resumen
Endoplasmic reticulum calcium homeostasis is disrupted in diverse pathologies. A secreted ER calcium monitoring protein (SERCaMP) reporter can be used to detect disruptions in the ER calcium store. This protocol describes the use of a Gaussia luciferase SERCaMP to examine ER calcium homeostasis in vitro and in vivo.
Resumen
El retículo endoplasmático (ER) contiene el mayor nivel de calcio intracelular, con concentraciones aproximadamente 5000 veces mayor que los niveles citoplasmáticos. El control estricto sobre el calcio ER es imprescindible para el plegamiento de proteínas, la modificación y la trata. Las perturbaciones a ER de calcio pueden dar lugar a la activación de la respuesta de la proteína desplegada, un mecanismo de respuesta de estrés ER de tres patas, y contribuir a la patogénesis de una variedad de enfermedades. La capacidad de monitorear alteraciones de calcio ER durante el inicio de la enfermedad y la progresión es importante en principio, pero difícil en la práctica. Los métodos actualmente disponibles para el monitoreo de calcio ER, tales como tintes y proteínas fluorescentes dependientes de calcio, han proporcionado información sobre la dinámica del calcio ER en las células, sin embargo estas herramientas no son muy adecuados para estudios in vivo. Nuestro laboratorio ha demostrado que una modificación en el carboxi-terminal de la luciferasa Gaussia confiere la secreción del reportero en respuesta aEl agotamiento de calcio ER. Los métodos para utilizar una luciferasa basado, proteína de monitoreo de calcio ER secretada (SERCaMP) para in vitro e in aplicaciones in vivo se describen en el presente documento. Este vídeo destaca inyecciones hepáticas, la manipulación farmacológica de Gluc-SERCaMP, extracción de sangre y el procesamiento y los parámetros de ensayo para el control longitudinal de calcio ER.
Introducción
Las funciones en muchas capacidades celulares incluyendo plegamiento de proteínas, la secreción de proteínas, homeostasis de los lípidos, y de señalización intracelular 1 retículo endoplasmático (ER). Central a la función normal ER es mantener las concentraciones de calcio luminal a ~ 5.000 veces mayores que se encuentran en el citoplasma 2-4. Este proceso intensivo de energía está regulado por la ATPasa de calcio Sarco / retículo endoplásmico (SERCA), una bomba que mueve iones de calcio en la sala de emergencias. Flujo de calcio desde el ER está mediada principalmente por la rianodina (RyR) e inositol trifosfato (IP3R) receptores. Debido a que muchos procesos ER son dependientes de calcio, lo que altera la tienda puede conducir a estrés ER y la muerte celular eventual.
ER desregulación de calcio se ha observado en enfermedades como la cardiopatía, la diabetes, el Alzheimer y el Parkinson 5. Debido a la naturaleza progresiva de estas enfermedades, ha sido un reto para delinear la causa-efecto relación entre patogénesis y alteraciones en la tienda de calcio ER. Varias tecnologías han permitido importantes avances en nuestra comprensión de la dinámica del calcio ER, incluyendo colorantes e indicadores de calcio codificados genéticamente (Gecis). Baja afinidad colorantes de calcio, que aumentan en la fluorescencia cuando se une a Ca 2+, se pueden cargar en las células para examinar compartimentos subcelulares con altas concentraciones de calcio 6. Gecis, tales como D1ER y el receptor permite la monitorización de las fluctuaciones de calcio con un control más preciso de la localización subcelular 7-9. Recientemente, otra clase de Gecis llama indicadores de proteínas de orgánulos atrapado en calcio de medición (CEPIA) se han descrito 10. Un tercer enfoque que combina la genética y la química pequeña molécula es-esterasa específica colorante de carga (TED), que utiliza una carboxilesterasa codificado genéticamente (dirigido a la ER) con un colorante de calcio a base de éster 11.
Mientras que el AFORenfoques ementioned tienen fortalezas y debilidades inherentes, pueden proporcionar información valiosa sobre la dinámica del calcio ER a través de mediciones agudos de fluorescencia. Ellos son, sin embargo, no es óptimo para los estudios longitudinales a menudo necesarias para investigar la progresión de la enfermedad. Con el objetivo de diseñar un método para controlar la dinámica del calcio durante períodos prolongados de tiempo, hemos identificado y desarrollado una modificación de proteínas para crear las proteínas secretadas calcio ER monitoreo (SERCaMPs) 12.
SERCaMP sortea varias limitaciones asociadas con otras metodologías, proporcionando un método mínimamente invasivo para interrogar en varias ocasiones el almacén de calcio ER. Hemos demostrado anteriormente que la ASARTDL péptido carboxi-terminal (alanina-serina-alanina-arginina-treonina-ácido aspártico-leucina) es suficiente para promover la retención de ER; Sin embargo, bajo condiciones que causan disminuciones en calcio ER, la secuencia del péptido ya no es capaz de retener localizatio ERn y la proteína es secretada 13. La base de la tecnología SERCaMP es el apéndice de ASARTDL a la carboxi-terminal de una proteína secretada (por ejemplo, luciferasa Gaussia, o gluc) de modo que la secreción es provocada por el agotamiento de calcio ER, creando así un reportero robusta de ER disregulación de calcio 12. La expresión de Gluc-SERCaMP a través de métodos transgénicos permite fluidos biológicos incluyendo medio de cultivo celular y plasma a analizar los cambios en la actividad gluc como un indicador de la homeostasis del calcio ER. El método tiene aplicaciones para el estudio longitudinal de alteraciones progresivas en la tienda de calcio ER tanto in vitro como in vivo. El siguiente protocolo se escribe como un esquema general para el uso de SERCaMP basado en gluc para estudiar la homeostasis del calcio ER, pero el protocolo puede servir como una guía para SERCaMPs informadores alternativos.
Protocolo
1. Ensayo in vitro: Detectando SERCaMP de lanzamiento de una línea celular estable SH-SY5Y
- Placa SH-SY5Y-Gluc-ASARTDL (SERCaMP) en placas de cultivo de tejidos tratados en 150.000 células por cm 2 de superficie. Para placas de 96 pocillos, por ejemplo, semilla de 50.000 células por pocillo (Figura 1a). Crecer células SH-SY5Y en DMEM (glucosa alta, GlutaMAX, piruvato) + crecimiento bovino 10% de suero + 1x penicilina / estreptomicina.
- Células Passage hasta 15 veces (Figura 1B). Número de pases Superior no ha sido probado.
- Células Regreso al incubador humidificado a 37 ° C con 5,5% de CO 2 y se incuba durante la noche.
- Antes del tratamiento experimental (s), recoger una muestra de línea de base para cada pocillo mediante la transferencia de 5 l de sobrenadante de cultivo a una opaca amurallado placa de 96 pocillos. Antes de recoger, golpear suavemente la placa en todos los lados y agitar para evitar efectos de degradado. Sellar la placa opaca con un adhesivo shoja de Ealing y almacenar a 4 ° C hasta el momento del ensayo enzimático.
Nota: Secretada Gluc-SERCaMP es muy estable en medio de cultivo celular. Hemos informado anteriormente de aproximadamente el 10.5% de la actividad Gluc se perdió después de una incubación de 72 horas a 37 ° C (se incubaron en SH-SY5Y células) 12. - Tratar a las células como se desee para examinar el agotamiento de calcio ER (por ejemplo, medio ambiente, farmacológico, las manipulaciones genéticas). Evite la exposición prolongada al entorno ambiental (fuera de la incubadora controlada) como los cambios de pH se producirá rápidamente a CO 2 atmosférico. Añadir HEPES al medio de cultivo a 20 mM, pH 14 para estabilizar, si se requieren manipulaciones prolongados. Evite la exposición a la luz cuando se utiliza HEPES en medio de cultivo 15.
- Control positivo: tratar las células con 100 nM thapsigargin (Tg) o ácido ciclopiazónico 50 mM (CPA) durante 4-6 hr para los experimentos en células SH-SY5Y. Respuesta máxima en otras líneas celulares puede requerir incubaciones más largas o diferentes concentraciones de compuestos.
- Control negativo: medio de cultivo Colecta de las células SH-SY5Y parentales. En nuestra experiencia, la luminiscencia de fondo para este ensayo es inferior al 0,05% de la secreción basal de las células SH-SY5Y-Gluc-SERCaMP estables.
- Recoger y almacenar muestras de 5 l de medio condicionado en los puntos de tiempo deseados, como se indica en el paso 1.2.
- Evaluar la actividad enzimática en el medio como se indica en la Sección 5.
- Examinar gluc intracelular mediante inmunotransferencia o ensayo de luminiscencia.
- Para inmunoblot: lisan las células en tampón RIPA modificado que contiene 50 mM Tris (pH 7,4), NaCl 150 mM, 0,25% de desoxicolato de sodio, EDTA 1 mM, 1% de NP40, y los inhibidores de la proteasa. Separar en gel de poliacrilamida-SDS y transferencia a una membrana de 0,20 micras PVDF. Incubar la membrana con anticuerpo Gluc (1: 2000 dilución) durante la noche a 4 ° C. Realizar incubación del anticuerpo y de membrana lavados secundarias según el protocolo definido por el usuario para el reactivo de detección de elección.
- Porensayo de luminiscencia (Figura 2): realice los pasos siguientes en el hielo:
- Retire todo el medio de los pozos de la placa de cultivo de tejidos y enjuague con 200 l de PBS frío.
- Añadir 75 l de tampón de lisis que contiene 50 mM Tris (pH 7,5), NaCl 150 mM, 1% de NP40 y los inhibidores de proteasa a cada pocillo.
- Girar la placa en un agitador orbital (120 rpm) a 4 ° C durante 20 min.
- Pipeta suavemente el lisado arriba y abajo utilizando una pipeta multicanal, evitando las burbujas de aire. Transfiera 5 l de lisado a una placa opaca y evaluar luminiscencia como se indica en la Sección 5.
2. Ensayo in vitro: transfección transitoria de células inmortalizadas con SERCaMP
Nota: Hemos observado que los procedimientos de transfección transitoria pueden inducir estrés celular y mitigar la posterior respuesta Gluc-SERCaMP. El siguiente enfoque fue desarrollado para minimizar eff transfección eja en SH-SY5Y células. Puede ser necesario Optimización de este procedimiento (incluyendo la elección de reactivo de transfección) para líneas celulares alternativos. Cuando sea posible, se recomienda el uso de líneas celulares estables o métodos de transducción virales descritos en las secciones 1 y 3, respectivamente.
- Placa SH-SY5Y células en un plato de 100 mm a 4 x 10 6 células. Este plato será suficiente para volver a la semilla aproximadamente 300 pozos (96 formato de placa de) Siguiendo el procedimiento de transfección.
- Transfectar células con Xfect reactivo usando 20 g de ADN plásmido (que codifica Gluc-SERCaMP) y 6 l de reactivo Xfect. ADN Escala y reactivo Xfect consecuencia para recipientes de cultivo más grandes o más pequeñas.
- Células Volver a la incubadora durante 48 horas.
- Tripsinizar las células y sembrar de nuevo a placas de 96 pocillos a 60.000 células por pocillo. Siga los pasos siguientes se describen en la Sección 1.
3. Ensayo in vitro: viral mediada por vector de expresión de Gluc-SERCaMP
tienda "> Nota: viral adeno-asociado (AAV) envases de vectores 16 y purificación 12 y lentivirus producción 13 han sido reportados previamente.- Titer Gluc-SERCaMP AAV usando los siguientes cebadores y sondas: cebador directo, 5'-CACGCCCAAGATGAAGAAGT-3 '; cebador inverso, 5'-GAACCCAGGAATCTCAGGAATG-3 '; sonda (5'-6-FAM / 3'-BHQ-1 marcado), 5'-TACGAAGGCGACAAAGAGTCCGC-3 'para la PCR cuantitativa.
- Preparar la curva estándar linealizando un plásmido que contiene gluc y purificar el ADN utilizando un spin-columna (por ejemplo Machery-Nagel NucleoSpin Gel y PCR de limpieza). Cuantificar el ADN mediante la separación en un gel de agarosa al lado de una escalera de masas. Preparar diluciones 1:10 de ADN a partir de 100 pg / ml a 10 fg / ml en PBS. Calcular las copias / ml de ADN de plásmido gluc en cada una de las concentraciones con base en el peso molecular del plásmido.
- Diluir las poblaciones de AAV en PBS (dilución apropiada dependerá deparámetros de la preparación viral y determinado empíricamente).
- Ejecutar la reacción de PCR en un sistema de PCR en tiempo real usando las siguientes condiciones: 95 ° C × 5 min, 94 ° C x 20 seg, y 60 ° C × 1 min durante 41 ciclos. Calcular copias / ml usando la curva estándar.
- Lentivirus título con un Lenti-X kit de titulación rápida p24. Descongele alícuotas lentiviral en hielo y se diluye la proteína p24 en el control medio SH-SY5Y.
- Diluir la lentivirus tal que caerá en la curva estándar (por ejemplo, 1: 20.000 ó 1: 100.000). El factor de dilución requerida variará en función de los parámetros de preparación de lentivirus y debe ser determinado empíricamente. Siga las instrucciones del fabricante para todos los pasos posteriores.
- Células de la placa a placas de 96 pocillos. Para las células SH-SY5Y, procedimientos de chapado señalados en la Sección 1 se pueden seguir. Para neuronas corticales primarias de rata, las células deben ser aislados y se sembraron en placas recubiertas adecuadamente as descrito previamente 16. Mantener las neuronas corticales primarias de rata en medio Neurobasal complementado con 1x B27 y 500 mM de L-glutamina. Realizar intercambios medianas y medio cada dos días.
- Transducir las células con virus. El objetivo de la transducción viral es lograr bajo nivel de expresión, como Gaussia luciferasa proporciona señal robusta.
- De transducción de AAV SH-SY5Y células: transducir el día siguiente de chapado. Diluir AAV a 6,0 x 10 7 vg / l en tampón de dilución de AAV (PBS + 0,5 mM MgCl2). Añadir 5 l de AAV diluido (3,0 x 10 8 vg; MOI de aproximadamente 6000) por pocillo de placa de 96 pocillos (Figura 3A). Utilice lejía al 10% para inactivar los residuos vector viral.
- AAV transducción de rata neuronas corticales primarias: transducir 6-8 días después de la siembra. Diluir AAV a 4,0 x 10 6 vg / l en tampón de dilución de AAV. Añadir 5 l de AAV diluido (2,0 x 10 7 vg; MOI de aproximadamente 350) por pocillo dePlaca de 96 pocillos (Figura 3B). El MOI óptima debe determinarse empíricamente para otros tipos de células. Utilice lejía al 10% para inactivar los residuos vector viral.
- Lentiviral transducción de las células SH-SY5Y: transducir el día siguiente de chapado. Diluir lentivirus a 20 pg / l p24 (concentración determinada usando el kit de titulación) en solución salina equilibrada de Hank. Añadir 5μl de virus diluido por pocillo (100 pg de p24, equivalente a 1.250.000 partículas lentivirales, o ~ 1250 IDU) de una placa de 96 pocillos que contiene 100 l de volumen. Escala en consecuencia para los formatos más grandes. Utilice lejía al 10% para inactivar los residuos viral.
- Se recoge una muestra de pre-tratamiento de mediano y comenzar tratamientos experimentales 48 h (SH-SY5Y) o 5-7 días (rata neuronas corticales primarias) después de la transducción.
4. Ensayo In Vivo SERCaMP
Nota: Antes de realizar cualquier procedimiento de animales que asegúrese de obtener la aprobación adecuada a través de su institución. Todocirugías de supervivencia son que hacerse bajo condiciones estériles con anestesia adecuada. Todos los procedimientos descritos a continuación han sido aprobados y están en conformidad con las directrices del NIH ACUC.
- Instrumentos quirúrgicos autoclave antes del inicio de la cirugía (121 ° C, 30 min esterilización, 20 min de tiempo de secado). Limpie todos los instrumentos en una ultrasonicador inmediatamente después de todos los procedimientos y antes de la esterilización en autoclave. Mantener condiciones estériles durante la cirugía de supervivencia. Para las cirugías que requieren múltiples animales, limpie instrumentos quirúrgicos con 70% de alcohol, ultrasonicate y grano esterilizar entre las ratas. Consulte la Lista de materiales para los instrumentos necesarios.
- Preparar la rata para la cirugía. Aquí se utiliza macho Sprague-Dawley (de 180-200 g).
- Anestesiar ratas utilizando isoflurano gas durante 3 min (4-5% de isoflurano, presentadas en 1000 cc / min) seguido por inyecciones intraperitoneales de xilazina (8 mg / kg) y ketamina (80 mg / kg). Aplicar pomada oftálmica para proteger las córneas se sequen. Bcirugía egin una vez que la rata está profundamente anestesiado, como lo demuestra la falta de reflejo de retirada tras la cola o pellizco pie.
- Shave la región de abdomen ligeramente por debajo de las costillas (baja región torácica) a la región abdominal media. Frote el área quirúrgica tres veces, alternando 70% de alcohol y Betadine matorrales. Coloque rata en posición supina en el área quirúrgica estéril con paños quirúrgicos estériles.
- Diluir AAV-Gluc-SERCaMP a 7,6 x 10 9 VG / ml (concentración final). Mezclar bien invirtiendo el tubo.
Nota: El rango de concentración viral puede variar (Figura 4).- Pipetear 105 l de AAV diluida en un plato estéril. Utilice una aguja de calibre 30 para recoger el virus en una jeringa.
- Realizar la cirugía para exponer el hígado e inyectar AAV-Gluc-SERCaMP.
- Antes de hacer una incisión en el abdomen, se aplican 0,25% de bupivacaína al área de la incisión. Usando un bisturí, hacer una incisión horizontal debajo de la caja torácica (apmadamente 2-3 cm). Blunt disección para separar el tejido conectivo de la hipodermis.
- Cortar el músculo abdominal, exponiendo el lóbulo medial derecho del hígado.
Nota: lóbulos adicionales se pueden inyectar basado en la aplicación final. - Coloque animal bajo microscopio quirúrgico y ajuste para obtener el lóbulo medial derecho del hígado en el campo de visión. Inyectar virus en el parénquima del lóbulo medial; 3 sitios separados, aproximadamente 33 l por sitio.
Nota: Deje la aguja en el tejido durante 5-10 segundos después de la inyección para asegurar la entrega de todo el volumen de inyección. - Suturar el músculo abdominal y la piel por separado y añadir Neosporin utilizando algodón aplicador con punta. Coloque rata en una cámara de recuperación hasta que la conciencia se recuperó y la rata es capaz de mantener la posición vertical. No deje de rata (s) sin vigilancia hasta que se haya recuperado el conocimiento suficiente para mantener decúbito esternal. Casa por separado hasta que la incisión haya cicatrizado y las suturas se han eliminado (7-14 días).
Nota: Según el NIH directrices post-quirúrgicas, mantener un registro quirúrgico. Anotar tarjeta de jaula con el procedimiento, la fecha, el identificador de experimento, el peso corporal, y el día de la cirugía. El dolor la angustia, la producción de heces, la actividad, y los alimentos y el consumo de agua / deben ser monitoreado y grabado 3 días posteriores a la cirugía. La analgesia postoperatoria se proporciona mediante la adición de acetaminofeno al agua potable (450 mg / 100 cc) a pesar de que no suelen observar signos de dolor o malestar después de la cirugía.
- Comienza la recogida de sangre de la cola de 4-7 días después de la inyección. Preparar los tubos de extracción de sangre por medio del etiquetado y pre-pesaje. Añadir 50 l de heparina (1.000 U / ml) a cada tubo.
- Lugar de rata en la cámara de anestesia con isoflurano durante 3 min (4-5% de isoflurano pronunciado en 1000 cc / min). Retire la rata desde la cámara y el lugar en el cono de la nariz (2-3% de isoflurano pronunciado en 500 cc / min). La recogida de sangre puede comenzar una vez que la rata está profundamente anestesiado, como lo demuestra la falta de reflejo de retirada tras pi colanch.
- Con unas tijeras estériles punta cortada de la cola (1-2 mm) y recoger la sangre gota a gota en el tubo de heparina precargada. Recoger la sangre hasta que el volumen alcanza mayor que 2: 1 de sangre a la proporción de heparina (> 100 l de sangre / 50 l de heparina). Los volúmenes de extracción de sangre se pueden ajustar según el diseño experimental. Use un aplicador de algodón húmedo para aplicar polvo astringente a la cola para detener el sangrado.
- Tubos de sangre se almacena a 4 ° C si la recogida de muestras posteriores. Limpie las tijeras con la pista de etanol y grano esterilizar entre colecciones.
- Pesar los tubos de recogida y ajustar con heparina para obtener 2: 1 ratio (sangre: heparina). Este paso normalizar la cantidad de heparina en cada muestra (Tabla 1).
- Tubos centrífuga a 2000 xg durante 5 min a 4 ° C. Transferir el sobrenadante (plasma) a un tubo nuevo y almacenar a -80 ° C hasta el momento de ensayo de luciferasa (artículo 5).
Nota: El almacenamiento de muestras a 4 ° C hasta 72 hr antes del ensayo enzimático tiene minimal efecto en la luminiscencia (Figura 5A). Hasta 3 ciclos de congelación y descongelación de las muestras de plasma no tienen efecto sobre la luminiscencia (Figura 5B).
- Administración tapsigargina (control positivo):
- Preparar thapsigargin diluyendo en etanol a una concentración final de 2,5 mg / ml. Inyectar thapsigargin a 1 mg / kg ip en el abdomen inferior.
Nota: tapsigargina aumenta inducida por trombina de las plaquetas de la coagulación 17 y puede hacer que la recogida de sangre de la cola más difícil.
- Preparar thapsigargin diluyendo en etanol a una concentración final de 2,5 mg / ml. Inyectar thapsigargin a 1 mg / kg ip en el abdomen inferior.
- Gaussia ensayo de luciferasa:
- Descongele las muestras de plasma en el hielo.
Nota: Para los estudios longitudinales, deshielo y realizar ensayo de luminiscencia para todas las muestras punto de tiempo en el mismo día (usando la preparación individual de sustrato). - Transferencia de 10 l de plasma a una placa de pared opaca y medir la actividad enzimática como se describe en la sección 5. Run 3/4 técnicos repeticiones de cada muestra de plasma.
- Descongele las muestras de plasma en el hielo.
- Euthanasila
Nota: La ventaja de la tecnología SERCaMP es la capacidad de calcio longitudinalmente monitor de ER. En función de los parámetros experimentales y análisis de punto final, los animales son que ser sacrificados por las medidas apropiadas para punto final de análisis y de conformidad con las directrices institucionales ACUC.
5. La luminiscencia Ensayo
- Preparar soluciones de coelenterazina (CTZ) de valores mediante la dilución del compuesto en metanol acidificado (30 l de HCl 10 N a 3 ml de metanol) a 20 mM. Preparar alícuotas de un solo uso y se almacena a -80 ° C.
- Preparar el sustrato a trabajar en el día de ensayo.
- Para los ensayos in vitro, diluir coelenterazina a 8 mM en PBS, por ejemplo, añadir 10 l de 20 mM CTZ acciones a 25 ml de PBS (Figura 6A, B).
- Para los ensayos in vivo, diluir coelenterazina a 100 mM en PBS, ácido ascórbico 500 mM, NaCl 5 mM.
- Incubar preparado CTZ durante al menos 30 mina temperatura ambiente antes de comenzar el ensayo.
Nota: Este paso se incluye a menudo en los ensayos de luciferasa Gaussia ya que hay informes de la decadencia sustrato rápida durante primeros 30 minutos después de preparar. No hemos observado este efecto en nuestro sistema (Figura 6C); Sin embargo, a menudo incluyen la etapa de incubación como hemos encontrado ningún impacto negativo en el ensayo. - Utilice un lector de placas que es capaz de monitorizar la bioluminiscencia y equipado con un inyector de sustrato. Prime las líneas con sustrato.
Nota: El soporte inicial a través de las líneas puede ser propenso a la degradación. Para evitar lecturas artificialmente bajos para los primeros muestras, inyectar 20-30 pozos vacíos (que cargan un plato vacío en el lector) antes de medir las muestras experimentales. - Inyectar 100 l de sustrato en el pozo, agitar velocidad media durante 5 segundos, y medir la emisión de luz. Para el lector de placas Biotek Sinergia II, integrar la emisión de luz durante 0,5 seg (muestras in vitro) y 5 segundos (envivo muestras) para el paso de lectura. Optimizar parámetros lector de placas para el rendimiento del ensayo ideal.
Nota: exposiciones Gaussia luciferasa cinética de flash con la decadencia de la señal rápida (en comparación a brillar cinéticas observadas con otras luciferasas). La cinética de flash de gluc está influenciada por el suero en medio de cultivo celular (Figura 7A), destacando la importancia de controlar para la composición del medio a través de muestras. Debido al rápido decaimiento de la luminiscencia después de añadir sustrato (cinética de flash), el tiempo entre la inyección y leer los pasos deben ser uniformes para todas las muestras. El lector de placas se debe establecer para inyectar sustrato a un pozo, esperar un tiempo fijo (por ejemplo, usamos un paso batido de 5 seg), y leer bien. La adición de sustrato a una placa entera antes de la lectura plantea un reto significativo a menos sustrato puede ser añadido a todos los pocillos al mismo tiempo. Si un inyector no está disponible, el problema puede ser parcialmente eludirse mediante la incubación de la placa durante 10 min entre ADDI sustratoción y medición (evitando así la parte empinada de la curva de caída) (Figura 7B). - Repetir la inyección, tiempo de espera, y leer los pasos para cada pozo de la placa.
Resultados
El método Gluc-SERCaMP permite la evaluación de la homeostasis del calcio ER mediante el muestreo de fluidos extracelulares. Varios controles pueden ser incluidas en el diseño experimental para mejorar la interpretación de los resultados. En primer lugar, el uso de un reportero constitutivamente secretada (por ejemplo, gluc sin la ASARTDL C-terminal o "Gluc-No Tag") se puede emplear para evaluar los efectos de los tratamientos experimentales en la vía secretora (secreción celular global) y la expresión del transgen. Por ejemplo, un aumento en los niveles extracelulares de ambos Gluc-SERCaMP y Gluc-Tag No se consideraría un resultado ambiguo. Alternativamente, un aumento en la secreción de Gluc-SERCaMP con una correspondiente falta de Gluc-No respuesta de la etiqueta soporta un evento dependiente de calcio ER (Figura 8). La secreción de Gluc-SERCaMP en respuesta al agotamiento de calcio ER puede evaluarse aún más mediante la medición intracelular Gluc, aunque esto está limitado a un solo punto de tiempo ya que se requiere la lisis. Int racellular Gluc-SERCaMP disminuirá en respuesta al agotamiento de calcio ER, ya que es secretada progresivamente, y el extracelular: intracelular ratio (calculado para cada pocillo individual) aumentará (Figura 2B). El extracelular: relación intracelular es útil para controlar los cambios en la expresión del transgen.
Moduladores farmacológicos de la tienda de calcio ER pueden ser utilizados para confirmar la contribución de calcio ER a la liberación SERCaMP en nuevos paradigmas. El dantroleno, un antagonista RyR, es conocido para estabilizar ER de calcio, lo que debería reducir o inhibir la liberación de SERCaMP en respuesta a Tg (Figura 8B). Se recomienda, siempre que sea posible, para probar compuestos adicionales que afectan el flujo de calcio ER (por ejemplo xestospongin C, 4-cloro-m-cresol) en nuevos paradigmas experimentales que emplean SERCaMP. Estos estudios son a menudo difíciles en vivo, pero puede ser factible en modelos de cultivo de tejidos correspondientes.
"> Para los estudios in vitro utilizando SERCaMP basada en Gluc, se recomienda calcular respuestas en platos individuales en relación con el control (s). La respuesta de tratamiento inducida 'se puede evaluar el timecourse mediante el seguimiento de los cambios en la respuesta relativa versus control ( para entre-placa comparaciones). No es recomendable comparar números en bruto a través de múltiples placas, debido a la descomposición del sustrato, lo que puede conducir a cambios en los valores de primas entre los puntos de tiempo (Figura 6C). Hacer comparaciones relativas dentro de una placa minimiza este efecto (Figura 6D). Un ejemplo de análisis de datos para un in vitro inducida por Tg experimento de liberación en SERCaMP se presenta en la Figura 9.Para los estudios in vivo utilizando Gluc-SERCaMP, los datos deben ser evaluados de forma independiente para cada animal, con cada animal que actúa como su propio control "pre-tratamiento". Esto es necesario para tener en cuenta la variabilidad en la transgén delivery y la expresión entre los animales (Figura 4A).
La magnitud de las respuestas SERCaMP se verá afectada por una variedad de factores, muchos de los cuales están relacionados con la salud de referencia de las células y pueden ser controlados directamente por el investigador. Por la capacidad de respuesta SERCaMP máxima, es imprescindible para optimizar las condiciones que favorecen la homeostasis del calcio basal ER. Esto incluye las células de siembra a una densidad óptima y utilizando los títulos virales bajos. Los diferentes tipos de células y tejidos pueden tener requisitos adicionales, que deberían determinarse empíricamente.
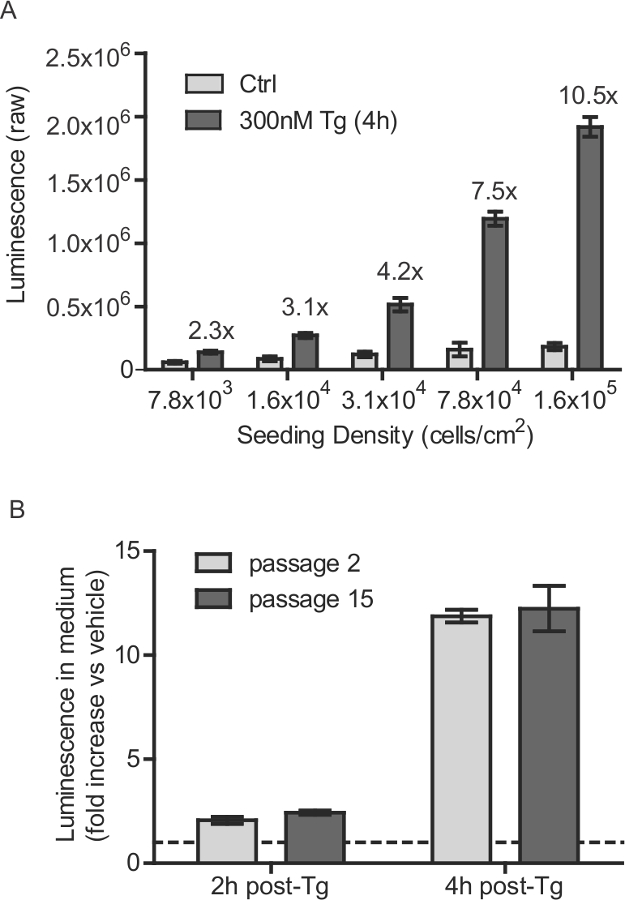
Figura 1:. Estable SH-SY5Y línea celular densidad de siembra y las consideraciones número de pases células SH-SY5Y-Gluc-SERCaMP (A) se sembraron en varias densidades y se incubaron durante 40 h. Secretada Gluc-SERCaMP se midió 4 horas después del tratamiento con 300 nM Tg ocontrol del vehículo r (media ± DE, n = 6). Inducida por aumento en la secreción de tapsigargina Gluc-SERCaMP está indicado para cada densidad celular. Células (B) SH-SY5Y-Gluc-SERCaMP en el paso número 2 y 15 fueron examinados para la secreción inducida thapsigargin. Las células fueron tratadas con 100 nM Tg durante 2 horas o 4 horas, y la actividad gluc secretada se normalizó a los controles tratados con vehículo (media ± SD, n = 4, no tiene efecto significativo de paso factor, 2-way ANOVA). La línea indica y = 1. Haga clic aquí para ver una versión más grande de esta figura.
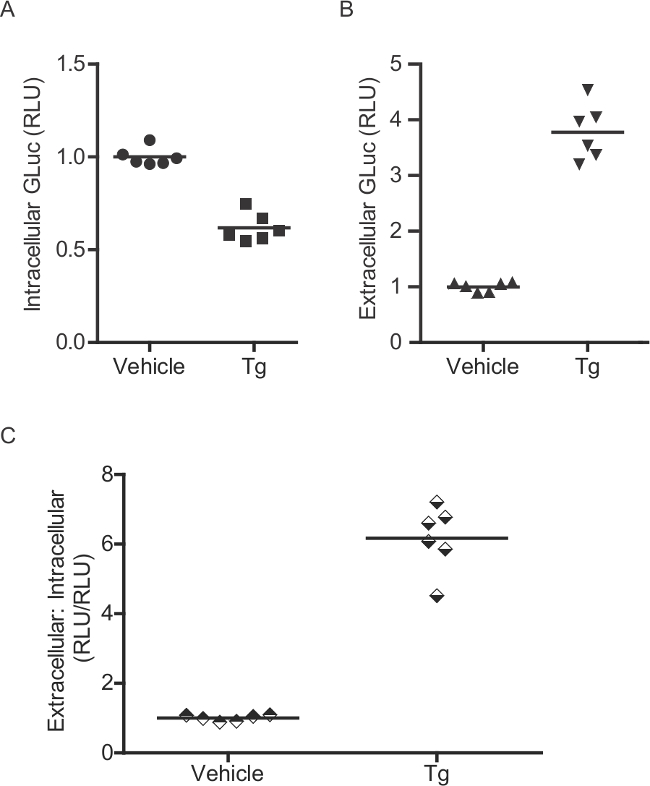
Figura 2:. Ensayo enzimático para la medición de intracelular Gluc-SERCaMP (A) intracelular y (B) la actividad enzimática extracelular Gluc se evaluó en la rata primaria corneuronas ticos (transducidas con AAV-Gluc-SERCaMP). Seis días después de la transducción, las células fueron tratadas con 60 nM thapsigargin durante 4 h. Como Gluc-ASARTDL acumula en el medio, se observan disminuciones correspondientes en los niveles intracelulares. (C) Una relación de extracelular: gluc actividad intracelular se puede calcular para cada pocillo individual.

Figura 3:. AAV-Gluc-ASARTDL título frente a la respuesta inducida thapsigargin-para las células SH-SY5Y y de rata neuronas corticales primarias células SH-SY5Y (A) se sembraron en placas de 96 pocillos a 5 x 10 4 células por pocillo y se dejaron adherir durante la noche. Las células fueron transducidas en la multiplicidad indicada de infección (MOI), se incubaron durante 48 hr y después se trató con 300 nM Tg o vehículo. La luminiscencia se midió en el medio después de 8 horas (media ± SEM, n = 3). * P <0,05, mulpruebas t tiple (corrección Holm-Sidak). (B) de la rata neuronas corticales primarias fueron transducidas en DIV8 con AAV-Gluc-ASARTDL en el MOI indicada (calculado utilizando 60.000 células por aproximación bien en el momento de la transducción). Cinco días después de la transducción, las células fueron tratadas con 100 nM Tg o control del vehículo y luminiscencia en el medio se midió después de 8 horas (media ± SEM, n = 6). * P <0,05, múltiples pruebas t (corrección Holm-Sidak).
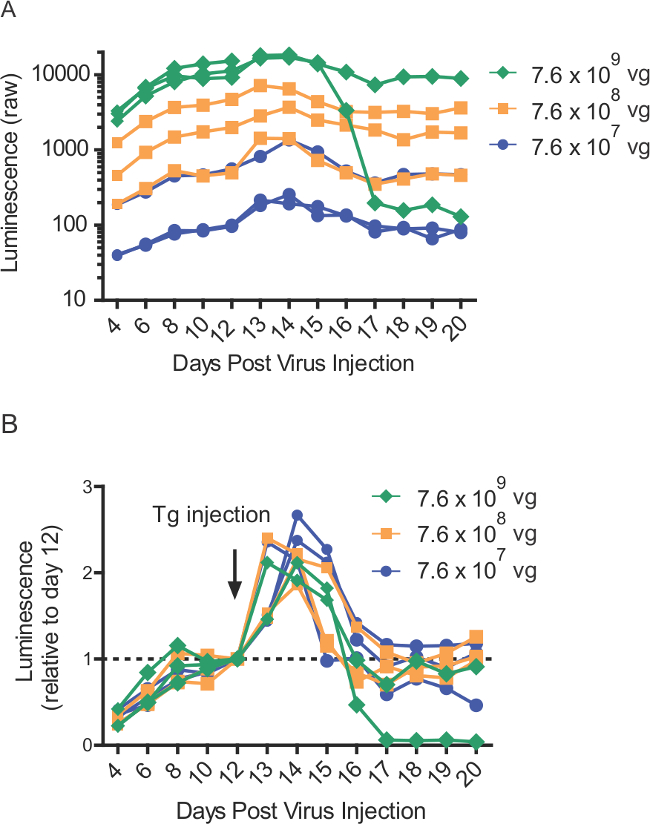
Figura 4:.-La liberación inducida por tapsigargina Gluc-SERCaMP en sangre después de las inyecciones intrahepáticas más de gama de títulos virales valores de luminiscencia sin procesar (a) de ratas (n = 8) intrahepatically inyectado con diferentes títulos de AAV-Gluc-ASARTDL. Tapsigargina (1 mg / kg) por inyección (ip) se administró en el día 12. Se recogió la sangre en los puntos de tiempo indicados y se almacenó a -80 & #176; C hasta el momento de ensayo. (B) los valores de luminiscencia normalizados desde el panel A, lo que demuestra la respuesta inducida SERCaMP thapsigargin en ratas (n = 8) que expresan diversas cantidades de AAV-Gluc-ASARTDL.

Figura 5:. Manipulación y almacenamiento de muestras de plasma Gluc-SERCaMP (in vivo) (A) Se recogió plasma de ratas intrahepatically expresar Gluc-SERCaMP (n = 10), alícuotas y se almacenaron a -80 ° C hasta el momento de los ensayos. Los tubos se retiran de -80 ° C y se almacenaron a 4 ° C durante los tiempos indicados antes de la medición de luminiscencia (media ± SD). (B) Efecto de múltiples congelación / deshielo de las muestras de plasma sobre la actividad enzimática Gluc. Muestras de plasma recogidas de ratas intrahepatically expresar AAV-Gluc-SERCaMP (n = 10) se sometieron a el número indicadode los ciclos de congelación-descongelación y se ensayó la luminiscencia (media ± DE).

Figura 6:. Preparar sustrato coelenterazina para ensayos Gluc-SERCaMP medio (A) La cultura se recogió de SH-SY5Y-Gluc-SERCaMP líneas de células tratadas con 300 nM Tg (o el control del vehículo) durante 5 horas. Gluc actividad en el medio se evaluó mediante la inyección de PBS + diversas concentraciones de coelenterazina (media ± SD, n = 6). (B) los valores de luminiscencia desde el panel A se normalizaron a vehículo tratado de control en cada concentración de sustrato para evaluar el efecto inducido thapsigargin. (C) Substrato decaimiento durante varias horas. La luminiscencia a partir de una cantidad conocida de gluc recombinante (0,1 ng o 0,02 ng) se midió durante varias horas después de la preparación de sustrato (media ± SD, n = 4). (D) Mientras que la luminiscencia prima para la recombinanteGluc disminuyó con el tiempo debido al sustrato decaimiento, se mantuvo la diferencia veces en las muestras (como se determina por luminiscencia).
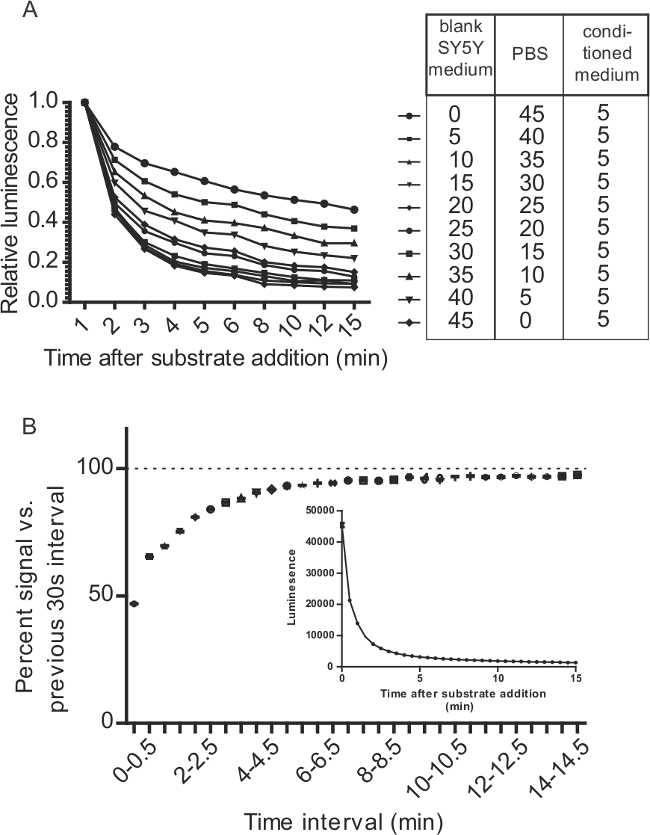
Figura 7:. Consideraciones para ensayos Gluc-SERCaMP relacionados con la cinética de la reacción Gluc / CTZ (A) El medio de cultivo altera el decaimiento de la señal Gluc / CTZ. 5 l de sobrenadante que contiene Gluc-SERCaMP se mezclaron con relaciones variables de PBS y medio de cultivo. 100 l de sustrato (15 mM en PBS + CTZ 500 mM ácido ascórbico) se añadió a 50 l de muestra que se diluyó como se indica en la tabla. La emisión de luz se monitorizó durante 15 min. Se añadió (B) 5 l de medio se recogieron a partir de células SH-SY5Y-Gluc-ASARTDL y 100 l de sustrato (8 M CTZ en PBS + NaCl 5 mM). La luminiscencia se midió inmediatamente después de la adición de sustrato (T = 0) y cada 30 seg durante el transcurso de 15 min (± SD, n = 12). Los datos se representan como la señal por ciento en relación con el intervalo de 30 seg anterior para evaluar la tasa de descomposición. El recuadro muestra los datos de luminiscencia primas.

Figura 8:. Corroboración farmacológico de agotamiento de calcio ER (A) Efecto de 100 nM thapsigargin sobre la secreción Gluc se examinó para Gluc-ASARTDL y No Gluc de control Tag (media ± DE, n = 6). (B) La estabilización de calcio ER con dantroleno (RyR antagonista) inhibe la liberación SERCaMP inducida por Tg. Las células se pre-trataron con las concentraciones indicadas de dantroleno para 30 min o 16 h antes de la adición de 100 nM thapsigargin. Actividad Gluc en el medio se midió después de 4 horas (media ± DE, n = 6).
99fig9.jpg "/>
Figura 9:. Mock resultados representativos para el gluc-SERCaMP Nota del vehículo valores tratados pueden disminuir entre las placas, debido al sustrato desglose (depende de intervalo de tiempo entre la lectura de las placas individuales). Para tener en cuenta este efecto, el efecto del tratamiento específico se calcula independientemente para cada placa y esta relación se compara través de las placas.
| Fecha | Rata | Masa del tubo (mg) | Volumen de heparina (ml) | La heparina densidad (g / ml) | masa heparina (mg) | Misa del tubo + heparina (mg) | Masa total después de la extracción de sangre (mg) | Masa de sangre recogida (mg) | Sangre Densidad (g / ml) | Sangre volumen calculado (ul) | Volumen de heparina necesaria para el 2: 1 relación de | ml de heparina adicional para agregar antes de giro |
| 1.1.15 | SD Male | 1135.9 | 50 | 1,117 | 55.83 | 1191.73 | 1317.70 | 125.97 | 1.05 | 119.97 | 59.98 | 9.98 |
Tabla 1:. La recogida de sangre tabla Ejemplo de registro de la extracción de sangre para estudios SERCaMP.
Discusión
Este protocolo pone de relieve la in vitro e in vivo de utilidad Gluc-SERCaMP para supervisar el agotamiento de calcio ER. Aunque la modificación de proteínas para generar SERCaMP parece generalizarse a otras proteínas reportero 12, elegimos Gaussia luciferasa por su robusta (200-1.000 mayor veces) bioluminiscencia en comparación con otras luciferasas 18. Demostramos detectable inducida thapsigargin de liberación Gluc-SERCaMP a través de un rango de dosis de 100 veces de virus Gluc-SERCaMP entregado a neuronas de rata primaria corticales, SH-SY5Y células, y el hígado de rata (Figuras 3 y 4). Hemos descrito previamente la generación de una línea de células transfectadas establemente expresando Gluc-ASARTDL y demostramos que tan sólo 20 células en una población de 5 x 10 4 células no marcadas pueden reportar un thapsigargin respuesta 12 inducida. Aquí nos muestran que la línea celular estable puede reportar constantemente la respuesta inducida por Tg a 15 pasajes, el más Analyzed, lo que indica que la expresión continua de la periodista con el tiempo no afecta a su capacidad para ser liberado en respuesta al agotamiento de calcio ER (Figura 1). Nuestros datos indican que Gluc-SERCaMP se lleva a cabo principalmente en el ER de una célula hasta el tiempo de agotamiento de calcio ER cuando se secreta. En condiciones "normales", hay una secreción basal baja que permite el establecimiento de la línea base ER homeostasis del calcio 12. Después de ER agotamiento de calcio por thapsigargin, los niveles de cambio de luminiscencia intracelular y extracelular en direcciones opuestas. Esto se puede expresar como una relación para indicar un cambio en la distribución en estado estacionario del sensor (Figura 2). Es importante destacar que, como la liberación SERCaMP es modulada por la expresión del receptor KDEL 12, la magnitud de la liberación puede variar dependiendo del tipo de célula. Nuestra idea es que puede ser necesaria la sustitución de 'ASARTDL' con secuencias carboxi-terminal-KDEL como alternativas para lograr maxirespuesta mal SERCaMP en un tipo de célula o tejido específico.
Para los ensayos in vitro, los niveles de extracelular Gluc-SERCaMP se acumulan con el tiempo debido a la estabilidad del reportero secretada; se informó una disminución 10.5% aproximado en actividad después de 72 h 12. Como tal, el intercambio de medio antes de iniciar un efecto farmacológico o un desafío genética a la homeostasis del calcio ER puede ser necesario reducir la señal de fondo debido a la acumulación sensor. En contraste, la vida media de Gluc-SERCAMP in vivo es 3/5 a 4/7 min 12 que indica la señal en el plasma representa una versión reciente del reportero en la sangre circulante. Una vez que la sangre es ex vivo y procesada para plasma, sin embargo, Gluc-SERCaMP es muy estable (Figura 5).
Para las metodologías descritas, medio o plasma se transfiere a placas de 96 pocillos opacos antes de ensayos enzimáticos. Dos factores importantes a considerar cuando se utiliza el reportero con sede en glucs son la cinética de flash de la enzima y el desglose del sustrato coelenterazina. Lectores de placas equipados con inyectores son los más adecuados para el funcionamiento de gluc ensayos enzimáticos para normalizar el tiempo entre la adición del sustrato y las mediciones de luminiscencia. Las propiedades químicas de coelenterazina hacen propensos a la caries, lo que impide la comparación de los valores de luminiscencia medida en bruto en diferentes momentos después de la preparación del sustrato. Doblar diferencias entre las muestras, sin embargo, se mantienen (Figura 6), permitiendo que la diferencia relativa entre el control y las muestras experimentales para realizar un seguimiento durante la duración de los experimentos (Figura 9).
La capacidad de controlar las fluctuaciones de calcio ER in vivo es ventajoso cuando la investigación de enfermedades progresivas. Mientras que otros métodos, tales como colorantes fluorescentes citoplasmáticas, son apropiados para aguda en estudios in vitro, un reportero SERCaMP es la primera para permitir la monitorización de calcio ER longitudinal. Our protocolo describe inyecciones hepáticas directos de AAV-Gluc-SERCaMP. Hemos detectado niveles estables de Gluc-SERCaMP en circulación de los animales no impugnadas durante 56 días después de la inyección (último punto de tiempo probado hasta ahora) y predecir los experimentos más largos son posibles 12. Los vectores AAV son de tamaño pequeño, que mide aproximadamente 20 nm de diámetro, y plantean requisitos mínimos de bioseguridad 19. Para evitar la conversión de AAV genoma monocatenario a ADN de doble hebra, AAV-SERCaMP fue empaquetado como un serotipo-1 vector de doble hebra de AAV 20. AAV serotipo-1 se ha demostrado para transducir eficazmente hígados de rata 19,21; sin embargo, la salvedad de nuestra técnica de inyección es el potencial de virus a viajar a otros tejidos en todo el cuerpo. Aunque el vector se inyecta directamente en el hígado, tal como se presenta nuestra metodología no puede discernir la fuente de liberación SERCaMP, y por lo tanto es posible que los tejidos que no sean el hígado pueden contribuir a la Gluc-SERCseñal de AMP. Manipulaciones genéticas futuras restringir la expresión para atacar tipos de tejidos. Por ejemplo, Cre líneas de controladores específicos de tejidos cruzados con una Cre-dependiente Gluc-SERCaMP permitirá para la supervisión específica de tejido de calcio a través de ER de muestreo plasma.
La técnica descrita en vivo utiliza los títulos virales bajos debido a la naturaleza robusta del reportero. Liberación Gluc-SERCaMP se puede detectar a partir de una gama viral de 7,6 x 10 7 vg de 7,6 x 10 9 vg (Figura 4). Esta gama es 4-400 veces menor que lo reportado en trabajos previos utilizando inyecciones virales basados en luciferasa de luciérnaga del hígado 19. En concentraciones más altas, se observó una pérdida de la expresión detectable en el tiempo, que es posiblemente debido a una respuesta inmune del animal para el transgén 22. Los títulos más altos de virus deben ser evitados cuando sea posible debido a la mayor probabilidad de pérdida de señal. Los títulos bajos que los que se presentan no han seren la prueba. Este protocolo esboza inyecciones de AAV-Gluc-SERCaMP en el hígado; enfoques similares son en teoría factible para otros tipos de tejidos. Parámetros tales como la concentración y el serotipo viral debe ser optimizado para una expresión suficiente en otros tejidos.
Debido a la naturaleza robusta de la reportera, pequeños volúmenes de sangre (100-150 l) se pueden recoger de recortes de la cola, lo que permite colecciones repetidas a lo largo de los experimentos. Esto era útil para la caracterización longitudinal de liberación Gluc-SERCaMP en respuesta a thapsigargin, donde observamos niveles elevados después de la administración thapsigargin seguido de un retorno a los niveles basales (Figura 4). El manejo adecuado de las muestras de plasma siguientes recogida de sangre también es importante. Como tal, hemos demostrado que SERCaMP es estable en el plasma se almacenó a 4 ° C hasta 72 horas antes de ensayo enzimático (Figura 5). Además, las muestras de plasma pueden someterse a por lo menos tres ciclos de congelación / tciclos haw con un efecto mínimo en la luminiscencia (Figura 5). En la práctica, almacenamos todas las muestras a -80 ° C, evitar los ciclos de congelación-descongelación innecesarias previas a la evaluación de ensayo enzimático, y analizar todas las muestras para un experimento al mismo tiempo.
ER agotamiento de calcio está implicada en la patogénesis de una variedad de enfermedades. A menudo se piensa que es un evento aguas arriba que dificulta las funciones celulares y conduce a la activación de la respuesta de proteína no plegada (UPR). El EPU es una respuesta adaptativa empleada por la sala de emergencia para restablecer condiciones homeostáticos 5. Estados crónicos de estrés ER exceden la capacidad de la UPR para restaurar la homeostasis, en última instancia conduce a la muerte celular. Estrés ER y la desregulación del calcio ER se observan en enfermedades como la diabetes tipo 1, la nefropatía diabética, enfermedades neurodegenerativas y cardiovasculares dieases 5. La relación entre la desregulación del calcio y patogénesis de la enfermedad, sin embargo, es difficULT para delinear. La tecnología SERCaMP tiene el potencial para realizar un seguimiento de este proceso largo de la vida de un animal, proporcionando así información sobre el desarrollo y la progresión de la enfermedad. Por otra parte, la evaluación de los potenciales agentes terapéuticos diseñados para prevenir o desregulación correcta de calcio ER puede ser evaluado a través de la utilización de SERCaMP. Por último, la identificación de enfermedades en las que se produce la liberación Gluc-SERCaMP ofrece la oportunidad de diseñar y emplear proteínas o péptidos terapéuticos secretadas como SERCaMPs como un medio de la enfermedad regulada terapia génica.
Divulgaciones
The authors have nothing to disclose.
Agradecimientos
This work was supported by the Intramural Research Program at the National Institute on Drug Abuse. We thank Doug Howard, Chris Richie, Lowella Fortuno, and Josh Hinkle for their contributions to developing this method.
Materiales
| Name | Company | Catalog Number | Comments |
| 1.5 ml tubes | Fisher | 02-682-550 | |
| 10% NP-40 solution | Pierce | 28324 | for intracellular GLuc assays |
| 1 ml luer-lok syringes | Fisher | 14-823-30 | |
| 200 microliter filter tips | Rainin | RT-L200F | |
| 3-0 surgical sutures | Fisher | NC9598192 | |
| 30 G needles | Fisher Scientific | 14-821-13A | |
| Adhesive microplate sealing sheets | Thermo | AB-0558 | |
| Alcohol prep pads | Fisher | 22-246-073 | |
| Anesthesia Auto Flow System | E-Z Anesthesia | EZ-AF9000 | |
| Animal recovery chamber | Lyon Vet | ICU-912-004 | |
| B27 supplement | Life Technologies | 17504-044 | |
| Betadine solution | Fisher | NC9386574 | |
| Bleach | Clorox | n/a | |
| Bovine growth serum | Thermo | SH30541.03 | |
| Coelenterazine, Native | Regis Technologies | 1-361204-200 | |
| Cotton tipped applicators | Puritan | 806-WC | |
| Cutting needles 3/8 circle sutures | WPI | 501803 | |
| Digital ultrasconic cleaner | Fisher Scientific | FS60D | |
| DMEM high glucose, GlutaMAX, pyruvate | Life Technologies | 10569-010 | |
| DNA mass ladder | Life Technologies | 10496-016 | |
| Gaussia luciferase (recombinant protein) | Nanolight | 321-100 | |
| Gaussia luciferase antibody (for WB, ICC, or IHC) | New England Biolabs | E8023S | 1:2,000 (WB) |
| Germinator 500 | CellPoint Scientific | DS-401 | |
| Gluc assay plates (96 well, opaque) | Fisher | 07-200-589 | |
| Hank's balanced salt solution | Life Technologies | 14175-095 | |
| Heparin | Allmedtech | 63323-276-02 | |
| Isoflurane | Butler Schein | 29404 | |
| Ketamine | Henry Schein | 995-2949 | |
| Kwik Stop Styptic powder | Butler Schein | 5867 | |
| L-glutamine | Sigma | G8540 | |
| Methanol | Fisher | a452-4 | |
| Microfuge 22R Centrifuge | Bekman Colter | 368831 | |
| Neosporin | Fisher | 19-898-143 | |
| Neurobasal medium | Life Technologies | 21103049 | |
| Nikon Stereoscope | Nikon | SMZ745T | |
| Nucleospin Gel and PCR Cleanup | Machery-Nagel | 740609 | |
| P200 pipet | Rainin | L-200XLS+ | |
| p24 Lenti-X rapid titer kit | Clontech | 632200 | |
| PCR film seal | Fisher | AB0558 | |
| Penicillin/streptomycin | Life Technologies | 15140-122 | |
| Protease inhibitor cocktail | Sigma | P8340 | |
| ReFresh Charcoal Filter canister | E-Z Anesthesia | EZ-258 | |
| Scalpel blades, #10 | Fine Science tools Inc | 10010-00 | |
| SD rats 150-200 g | Charles River | Rats | rats ordered at 150-200 g. Surgery 5 days after arrival |
| Small animal ear tags | National Band and Tag co | 1005-1 | |
| Sterile surgical drapes | Braintree Scientific | SP-MPS | |
| Synergy 2 plate reader | BioTek | n/a | |
| TaqMan Universal PCR Master Mix | Applied Biosystems | 4304437 | |
| Thapsigargin | Sigma | T9033 | harmful to human health |
| Virapower lentiviral packaging mix | Life Technologies | K4975-00 | |
| Xfect Transfection reagent | Clontech | 631318 | |
| Xylazine | Valley Vet | 468RX |
Referencias
- Sitia, R., Braakman, I. Quality control in the endoplasmic reticulum protein factory. Nature. 426 (6968), 891-894 (2003).
- Burdakov, D., Petersen, O. H., Verkhratsky, A. Intraluminal calcium as a primary regulator of endoplasmic reticulum function. Cell Calcium. 38 (3-4), 303-310 (2005).
- Fu, S., et al. Aberrant lipid metabolism disrupts calcium homeostasis causing liver endoplasmic reticulum stress in obesity. Nature. 473 (7348), 528-531 (2011).
- Micaroni, M. The role of calcium in intracellular trafficking. Curr Mol Med. 10 (8), 763-773 (2010).
- Mekahli, D., Bultynck, G., Parys, J. B., De Smedt, H., Missiaen, L. Endoplasmic-reticulum calcium depletion and disease. Cold Spring Harb Perspect Biol. 3 (6), (2011).
- Paredes, R. M., Etzler, J. C., Watts, L. T., Zheng, W., Lechleiter, J. D. Chemical calcium indicators. Methods. 46 (3), 143-151 (2008).
- Whitaker, M. Genetically encoded probes for measurement of intracellular calcium. Methods Cell Biol. 99, 153-182 (2010).
- Tang, S., et al. Design and application of a class of sensors to monitor Ca2+ dynamics in high Ca2+ concentration cellular compartments. Proc Natl Acad Sci U S A. 108 (39), 16265-16270 (2011).
- Palmer, A. E., Jin, C., Reed, J. C., Tsien, R. Y. Bcl-2-mediated alterations in endoplasmic reticulum Ca2+ analyzed with an improved genetically encoded fluorescent sensor. Proc Natl Acad Sci U S A. 101 (50), 17404-17409 (2004).
- Suzuki, J., et al. Imaging intraorganellar Ca2+ at subcellular resolution using CEPIA. Nat Commun. 5, 4153(2014).
- Rehberg, M., Lepier, A., Solchenberger, B., Osten, P., Blum, R. A new non-disruptive strategy to target calcium indicator dyes to the endoplasmic reticulum. Cell Calcium. 44 (4), 386-399 (2008).
- Henderson, M. J., Wires, E. S., Trychta, K. A., Richie, C. T., Harvey, B. K. SERCaMP: a carboxy-terminal protein modification that enables monitoring of ER calcium homeostasis. Mol Biol Cell. 25 (18), 2828-2839 (2014).
- Henderson, M. J., Richie, C. T., Airavaara, M., Wang, Y., Harvey, B. K. Mesencephalic astrocyte-derived neurotrophic factor (MANF) secretion and cell surface binding are modulated by KDEL receptors. J Biol Chem. 288 (6), 4209-4225 (2013).
- Shipman, C. Evaluation of 4-(2-hydroxyethyl)-1-piperazineëthanesulfonic acid (HEPES) as a tissue culture buffer. Proc Soc Exp Biol Med. 130 (1), 305-310 (1969).
- Zigler, J. S., Lepe-Zuniga, J. L., Vistica, B., Gery, I. Analysis of the cytotoxic effects of light-exposed HEPES-containing culture medium. In Vitro Cell Dev Biol. 21 (5), 282-287 (1985).
- Howard, D. B., Powers, K., Wang, Y., Harvey, B. K. Tropism and toxicity of adeno-associated viral vector serotypes 1, 2, 5, 6, 7, 8, and 9 in rat neurons and glia in vitro. Virology. 372 (1), 24-34 (2008).
- Smeets, E. F., Heemskerk, J. W., Comfurius, P., Bevers, E. M., Zwaal, R. F. Thapsigargin amplifies the platelet procoagulant response caused by thrombin. Thromb Haemost. 70 (6), 1024-1029 (1993).
- Tannous, B. A. Gaussia luciferase reporter assay for monitoring biological processes in culture and in vivo. Nat Protoc. 4 (4), 582-591 (2009).
- Sobrevals, L., et al. AAV vectors transduce hepatocytes in vivo as efficiently in cirrhotic as in healthy rat livers. Gene Ther. 19 (4), 411-417 (2012).
- Wang, Z., et al. Rapid and highly efficient transduction by double-stranded adeno-associated virus vectors in vitro and in vivo. Gene Ther. 10 (26), 2105-2111 (2003).
- Seppen, J., et al. Adeno-associated virus vector serotypes mediate sustained correction of bilirubin UDP glucuronosyltransferase deficiency in rats. Mol Ther. 13 (6), 1085-1092 (2006).
- Hareendran, S., et al. Adeno-associated virus (AAV) vectors in gene therapy: immune challenges and strategies to circumvent them. Rev Med Virol. 23 (6), 399-413 (2013).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados