Method Article
Avaliação da viabilidade de gordura humana injecção em ratinhos nu com Micro-Tomografia Computadorizada
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Fat grafting is an essential technique for reconstructing soft tissue deficits. However, it remains an unpredictable procedure characterized by variable graft survival. Our goal was to devise a mouse model that utilizes a novel imaging method to compare volume retention between differing techniques of fat graft preparation and delivery.
Resumo
Lipotransfer é uma ferramenta essencial em arsenal do cirurgião para o tratamento de défices de tecidos moles de todo o corpo. A gordura é o ideal de enchimento de tecido mole, uma vez que é prontamente disponível, facilmente obtido, de baixo custo, e inerentemente biocompatível. 1 No entanto, apesar da sua popularidade crescente, enxerto de gordura é dificultada pelos resultados imprevisíveis e sobrevivência do enxerto variável, com as taxas de retenção publicados que variam de 10 -80%. 1-3
Para facilitar a investigação sobre o enxerto de gordura, que, por conseguinte, ter desenvolvido um modelo animal que permite a análise em tempo real de retenção do volume injectado gordura. Em resumo, um pequeno corte é feito no couro cabeludo de um ratinho nu CD-1 e 200-400 ul de lipoaspirado processado é colocado sobre o crânio. O couro cabeludo é escolhido como o local receptor por causa da sua ausência de gordura subcutânea nativa, e por causa da excelente contraste de base fornecida pela calote craniana, o que ajuda nao processo de análise. Tomografia Micro-computadorizada (micro-CT) é usado para digitalizar o enxerto na linha de base e cada duas semanas. As imagens de TC são reconstruídos, e um software de imagem é usado para quantificar os volumes de garfo.
Tradicionalmente, as técnicas para avaliar o volume de enxerto de gordura exigiram a eutanásia do animal estudo para fornecer apenas uma única avaliação de peso e volume do enxerto por medição física ex vivo. Comparações bioquímicos e histológicos têm igualmente necessária o animal estudo a ser sacrificados. Esta técnica de imagem descrita oferece a vantagem de visualizar e quantificar objetivamente o volume em diferentes períodos após a enxertia inicial sem ter que sacrificar o animal estudo. A técnica é limitada pelo tamanho da prótese capaz de ser injectado como enxertos de pele de riscos maiores e necrose gordura. Este método tem utilidade para todos os estudos que avaliam a viabilidade do enxerto de gordura e retenção de volume. Ele é particularmente bem adaptado para Providing uma representação visual do enxerto de gordura e seguindo as variações de volume ao longo do tempo.
Introdução
Soft tissue defects arise from a variety of causes including trauma, tumor resection, aging, and congenital anomaly. They can be debilitating for patients, and represent one of the most common, yet challenging problems for reconstructive surgeons. Many methods exist for addressing soft tissue deficiencies, such as local and free flaps, collagen injections, and synthetic fillers.4-8 However, since its first documented use by Neuber in 18931, autologous fat transfer remains the gold standard for the repair of soft tissue deficits, as it is ready available, easy and safe to harvest, and naturally compatible.1,2
Despite these advantages, autologous fat grafts suffer from unpredictable and variable survival, with retention rates ranging anywhere from 10-80% over time.1-3,9 In order to account for this expected loss of volume and symmetry, surgeons must often overcorrect when filling soft tissue defects, or perform multiple follow-up procedures.
Poorly vascularized graft beds are partly to blame for this tissue resorption. Additionally, the lack of a benchmark analysis method to compare graft survival may also contribute to the inconsistency in reported results. A precise method for measuring graft volume would reduce measurement error when evaluating retention rates. This in turn would help researchers more accurately identify the causative factors that affect graft survival. Although many laboratory animal models have facilitated both quantitative and qualitative assessment of human fat graft survival, most are based on histological and biochemical means and require sacrificing the study animal to yield a single measurement.3,10-12 Little has been reported on the use of imaging techniques to enumerate fat graft volume retention in vivo.
A handful of clinical studies have shown more effective measurement techniques using imaging. Magnetic Resonance Imaging (MRI) was employed by Hörl et al. to measure fat graft survival13, and CT was utilized by Har-Shai et al. and Fontdevila et al. in their analyses of volume retention after grafting in patients who suffered from HIV.14,15 Employing three-dimensional (3D) imaging software, Meier et al. measured volume retention in humans after autologous fat grafting by comparing images from the preoperative and postoperative period.16
Yet, a standardized method employing imaging to measure fat graft survival is lacking in basic science research. A high resolution imaging approach for assessing the volumes of fat grafts would allow not only for accurate and reproducible volume measurements, but also for repeated measurements allowing visualization of the evolution of fat graft survival in a real time fashion.
Protocolo
NOTA: Os protocolos experimentais e formulários de consentimento dos pacientes para a obtenção de gordura foram revisadas e aprovadas pela Universidade Institutional Review Board Stanford (Protocolo nº 2188). Todos os procedimentos com animais foram aprovados pelo Painel Administrativo Stanford em Laboratory Animal Care (APLAC) sob o protocolo nº 9999. Todos os experimentos foram realizados com a estrita observância a segurança do animal e orientações de cuidados humanos.
1. Fat colheita
- Utilizando o procedimento Coleman 17-19, obter o tecido adiposo humano do abdômen, flanco, e / ou regiões da coxa de pacientes saudáveis do sexo feminino submetidos a lipoaspiração eletivo.
- Para processar o lipoaspirado para enxertia, começar permitindo a gordura que se contentar com 30 min.
- Lipoaspirado normalmente se instala em três camadas, com óleo, na parte superior, a gordura no meio, e sangue na parte inferior. Aspirar e descartar a camada de óleo superior e a camada de sangue inferior.
- Para remover ainda mais qualquer tumesc restanteent fluido ou detritos celulares, centrifugar a gordura durante 5 min a 350 xg e 4 ° C, e aspirar a camada aquosa inferior.
- Calcula-se a quantidade de gordura necessária para a enxertia, permitindo a entrega de 20% de erro, e transferir o volume desejado de gordura para 50 ml cónica (s). 400 multiplicar pelo número de ratinhos no estudo, para obter microlitros de gordura necessária para a enxertia.
- Neste ponto, se realizando celular Assistida Lipotransfer 20,21, o volume lugar de gordura para enxerto no gelo. Então colheita de células derivadas de tecido adiposo do estroma (ASC) da gordura remanescente usando a técnica padrão descrito por Zuk et al 22.
2. lipoenxertia
- Obter fêmea, ratinhos CD-1 nu homozigóticos para o estudo experimental. Escolha ratinhos entre 8-12 semanas de idade.
- Para induzir a anestesia, o local do mouse em uma caixa de knockdown com 2,5% de mistura de isoflurano / oxigênio a 2 L / min por aproximadamente 10 min. Por favor, note que ISOF recomendadodose de lurane varia com o mouse tensão.
- Quando a taxa de respiração do mouse abrandou, confirme sedação adequada com uma pitada dedo do pé. Aplicar veterinária lubrificante pomada oftálmica a ambos os olhos do mouse.
- Se o mouse não se mexe em resposta aos pés pitada, isso confirma um avião suficiente de anestesia. Coloque o nariz do mouse em uma nosecone entregando 2,5% de mistura de isoflurano / oxigênio em 1-2 L / min. Se o mouse retrai de toe pitada, voltar para a caixa knockdown e reteste após 5 min.
- Configure campo estéril sob mouse e, em seguida, esterilizar couro cabeludo com 2,5% iodopovidona seguido de solução de etanol a 70%. Repita mais duas vezes.
- Coloque campos cirúrgicos sobre o mouse e ter o cuidado de manter o campo estéril. Instrumentos esterilizados, luvas e PPE deve ser usado em todos os momentos.
- Se o volume de gordura a ser enxertado foi previamente colocado no gelo, permitir que a gordura se primeiro de ajustar a RT antes do parto.
- Protelar a 1 ml seringa luer-lock com 1 mlde gordura.
- Conectar um L 14, 8 cm, gordura cânula enxerto, para a extremidade da seringa.
- Primeiro sistema pressionando o êmbolo da seringa até entre 200 e 400 ul de gordura permanece na seringa. Ao pressionar o êmbolo da seringa confirmar que a cânula se totalmente preenchido com gordura através da observação de gordura que sai do orifício de cânula distai.
- Usando fórceps finos, levantar a pele dorsal na linha média que se sobrepõe ao caudal mais aspecto do crânio. Faça um 1,5 milímetros corte na pele usando uma tesoura fina.
- Coloque um único fio de sutura 6-0 nylon através meio do corte que será posteriormente utilizado para trazer a ferida bordas juntos após a enxertia é realizada. Não amarre o fio de sutura.
- Criar uma bolsa subcutânea sobre o crânio, inserindo a cânula através da incisão na pele e passando a cânula e para trás em um padrão em forma de leque sobre o crânio para libertar todos os anexos do tecido conjuntivo da pele sobrejacente.
- Uma vez que a bolsa foi criada, posicione o cAnnula na linha média do rato directamente sobre o crânio até que a ponta se encontra no rostral mais aspecto do bolso, que deve ser apenas por trás de uma linha traçada entre os olhos. (Figura 1A)
- Lentamente injetar a gordura em uma forma retrógrada, avançando o êmbolo enquanto puxa a cânula de volta. Utilizando uma pinça, trazer as bordas da ferida juntos e levantá-los para manter qualquer gordura de vazar para fora do bolso.
- Amarre a sutura que foi previamente colocado, certificando-se que o primeiro nó situa-se levemente contra a pele. Amarre mais três nós quadrados e cortar o fio de sutura com uma cauda de 3 mm. (Figura 1B)
- Confirme com a visualização e palpação manual que o bolso não está sobrecarregada e pele que recobre o bolso não é tensa. Se o bolso estiver muito cheio, corte o fio de sutura e retire toda a gordura de dentro do bolso. Lava-se a bolsa para fora com salina tamponada com fosfato (PBS) pH 7,4 e re-injectar um volume menor de gordura.
- Retire do rato a partir de umanesthesia e lugar em sua parte traseira ou lateral em uma gaiola limpa por si só. Monitorar o animal para a respiração regular, os movimentos normais, ausência de sangramento, e sinais de dor ou angústia. Administrar buprenorfina 0,1 mg / kg por via subcutânea a cada 6 horas até 48 horas, se o animal está com dor.
- Certifique-se de que o animal tem de acordar o suficiente para manter decúbito esternal antes o abandona. Não coloque animais em uma gaiola com outros animais, até que se recuperou totalmente.
- Após 4 horas, garantir que o animal é capaz de comer e beber, mover e respirar normalmente e que não há sangramento do local da cirurgia. Devolvê-lo para a instalação de cuidados com os animais.
3. Micro-CT
- Camundongos Scan for o volume da linha de base por dia de pós-operatório 3, e em seguida, repita varreduras nas semanas de pós-operatório 2, 4, 6 e 8.
- Quando imaginando os ratos em cada ponto do tempo, siga as orientações de sedação e de cuidados de animais pré e pós-processuais, conforme descrito anteriormente em SPTE 2,2-2,4 e 2,17-2,19.
- Realizar varreduras em um scanner de micro-CT com um tamanho reconstrução voxel de 100 m ou melhor.
- Com um pico de raios-X quilovoltagem de 80 kVp e uma corrente de ânodo de 450 mA, administrar uma dose de ração de aproximadamente 5 centiGy durante uma 9 min de digitalização para cada rato. Por favor note que estes valores variam dependendo do protocolo de verificação.
- Antes de realizar a primeira varredura, calibre micro-CT com um fantasma de imagem que distingue entre o ar, a água ea intensidade óssea.
- Coloque quatro ratos em scanner para a posição ventral com dois ratos no topo e dois na parte inferior. A mesa de digitalização pode ser facilmente construído utilizando 60 ml seringas para segurar o corpo do mouse e 10 ml seringas como cones de nariz 23.
- Manter os ratos sob anestesia com uma mistura de isoflurano / oxigénio 2,5% em 1-2 L por min.
- Confirme imagem Escuteiro com que todo o crânio do rato, do nariz à primeira vértebra cervical, e da parte superior do crânio para a base de skull, vai ser trabalhada.
Análise 4. Micro-CT
- Abra as imagens reconstruídas com um micro-CT imaging software de análise que permite a criação de regiões de interesse (ROI de) selecionando voxels usando limiares de intensidade de pixel. Software também permite a criação de superfícies 3D através da interpolação dos voxels selecionadas, e para a análise de volume.
- Comece por carregar as imagens reconstruídas CT em bidimensional (2D) coronal, axial e sagital. (Figura 2A)
- Usando o corte axial, como um guia, para navegar a fatia sagital que corresponde à face mais à esquerda do enxerto de gordura. Escolher um limite superior e inferior para a intensidade de pixel que capta todos os voxels correspondentes para o enxerto de gordura, mas que exclui o tecido circundante e osso. (Figura 2B)
- Definir um ROI na visão sagital que corresponde ao enxerto de gordura usando limiares de intensidade de pixel previamente definidos. REPEAT esse procedimento a cada quinta corte sagital, navegando até a direita aspecto do enxerto é atingido. (Figura 2C)
- Interpolar voxels selecionados de todas as ROI 2D de em um único, combinado ROI 3D. (Figura 2D)
- Volume de ROI registro calculado pelo software.
- Tornar o isosurface 3D para visualizar o volume final do enxerto de gordura. (Figura 2E)
- Em análises posteriores, não se esqueça de manter os valores mínimos de limite máximo de intensidade de pixel e os mesmos que os utilizados para a análise de base.
5. Fat Colheita
- Depois de camundongos foram digitalizadas para a semana 8 24,25 ponto de tempo, anestesiar os ratos como anteriormente descritos acima nos Passos 2,2-2,4 e 2,17-2,19.
- Seguindo orientações Aplac, eutanásia os ratos, separando as suas colunas vertebrais.
- Coloque o mouse no campo operatório. Com uma tesoura tenotomia, abra cuidadosamente o bolso e dissecar tele recobre anexos do tecido conjuntivo da pele e do enxerto de gordura.
- Neste ponto, ele pode ajudar a extirpar um remendo da pele sobrejacente dorsal para ajudar na extração do enxerto. (Figura 3A)
- Levemente manter a tração sobre o enxerto com uma pinça e transformá-enxerto de lado a lado para visualizar pontos sucessivos de tensão que precisam ser lançado com uma tesoura.
- Ficar o mais próximo ao enxerto possível quando excisão para minimizar o tecido conjuntivo tomadas com o enxerto. (Figura 3B)
- Após excisão do enxerto, medir a massa em uma escala tarado que é preciso, pelo menos, 0,01 gramas.
- Calcular o volume do enxerto de gordura utilizando o valor de massa medida e a densidade média de gordura humana (0,9 g / ml) como uma taxa de conversão.
- Compare volume calculado de enxerto de gordura à obtida com micro-CT.
- Enxerto de gordura pode ser processado para histologia ou análise posterior se necessário.
Resultados
Enxertos de gordura diminuiu progressivamente em volume durante o curso do estudo, resultando em 62,2% de sobrevivência médio por Semana 8. (Figura 4A) 24 Após a conclusão da verificação Semana 8, cada enxerto de gordura foi extraída em uma única peça. Utilizou-se um teste da soma de Wilcoxan para comparar a diferença entre as medições de volume de enxerto de gordura obtidos por ambos os micro-CT ou calculados a partir de massa física. Não foi encontrada diferença significativa entre os dois métodos (frente e verso valor p = 0,9362). (Figura 4B)
Com 5 centiGy por varredura e cinco pontos de tempo de digitalização, cada rato recebeu não mais do que um total de 25 centiGy ao longo do estudo. Coerente com isso, nenhum dos ratinhos apresentado qualquer prova bruta de queimaduras de radiação cutâneas.

Figura 1. (A) L 14 Uma cânula numa seringa de 1 ml, posicionado na linha média e a mais rostral-aspecto da bolsa antes de iniciar a injecção de gordura. (B) ratinho nu após enxerto de gordura completada, com uma sutura simples de nylon utilizados para trazer ferida bordos em conjunto. O bolso tem sido preenchido mas não é tenso.

Figura 2. (A) As imagens reconstruídas inicialmente exibido em axial, coronal e sagital. (B) Usando a visão axial como um guia para navegar para o aspecto mais à esquerda do enxerto em vista sagital. A definição de um limiar de intensidade de pixel para que todos os voxels selecionado dentro da faixa de limiar irá representar o tecido adiposo, assim, permitir a demarcação do volume de enxerto de gordura. (C) do ROI definido em sagital vista começando no aspecto mais à esquerda do enxerto e continuou semprequinta fatia y movendo-se para a outra extremidade do enxerto. (D) Todos os voxels selecionados a partir de 2D ROI de interpolados em um único ROI 3D. (E) A superfície tridimensional foi criado utilizando uma interpolação cúbica-spline para visualizar os volumes totais de enxerto de gordura .
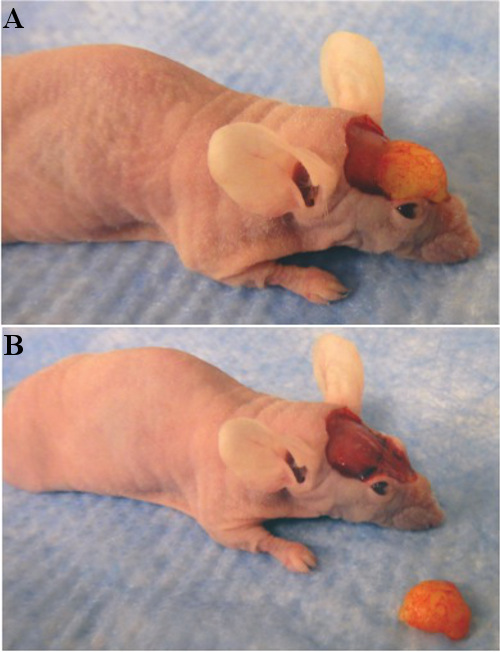
Figura 3. (A) Fat enxerto antes de explante, com remendo dorsal da pele removida. (B) Fat enxerto após a sua extração.

Figura 4. Análise (A) Micro-CT volumétrica demonstrou perda gradual do volume de enxerto de gordura ao longo de oito semanas. (B) volumes de enxerto de gordura finais, medida pelo micro-CT, correspondeu de perto para volumes calculados a partir das massas de enxerto de gordura explantadas. A densidade média de gordura humana (0,9 g / ml) foi usado como uma taxa de conversão.

Tabela 1. Calculado Micro-CT Volume vs. real medido Fat Volume 24
Discussão
Até este ponto, a maioria dos pesquisadores basearam-se em modalidades não geradores de imagem para quantificar a sobrevivência a longo prazo de enxertos de gordura, mas estes métodos requerem o sacrifício do animal estudo e produzirá apenas uma única medição. 3,10-12 Nosso estudo representa um método de análise melhorada que permite objectivo, a quantificação em tempo real de sobrevivência do enxerto de gordura num modelo de ratinho.
Crítica neste processo é assegurar que os ratos imunocomprometidos são suficientemente utilizados para o estudo, como este evita a rejeição do enxerto que poderia ocorrer se os ratos com sistemas imunitários são utilizados intactos. Preservar a integridade de gordura é fundamental durante a colheita, processamento e fases de colocação de enxerto. Em conformidade com as normas tradicionalmente aceitos, para enxerto de gordura deve ser obtida por meio de sucção assistida lipoaspiração (SAL). Durante a colocação, a gordura deve ser injectado a uma taxa de fluxo constante não mais rápido do que 0,5 ml / seg. A cânula de calibre 14, é o preferido para enxertia ina mouse, mas cânulas de maior diâmetro podem ser utilizados sem qualquer prejuízo para a gordura. Cânulas e agulhas menores, especialmente aqueles mais estreita do que 16 gauge-são desencorajados durante a colocação, pois podem causar a gordura ao colapso devido ao aumento da tensão de cisalhamento. Embora nós descrevemos a técnica preferida para o processamento acima, qualquer combinação de sedimentação, centrifugação e / ou filtração pode ser utilizado, desde que as camadas de petróleo e de sangue são adequadamente separados a partir da gordura antes do enxerto.
Enxertos de gordura deve ser de pelo menos 200 mL de tamanho para minimizar variação nos resultados, devido à natureza inconsistente de enxerto de gordura. Enxertos maiores, até 400 ul de tamanho podem ser utilizadas, mas acima deste volume, suprimento vascular diminuída e tensão excessiva da pele pode resultar em necrose e gordura da pele. Em última análise, o tamanho máximo de enxerto de gordura será determinada pela área de superfície e volume da bolsa. Para aumentar o volume de um enxerto que pode ser emitido com segurança, o pocket pode ser expandido por mais extensa dissecção. No entanto, esta pode colocar gordura para além dos limites do topo do crânio, o que fará com que o contraste entre o enxerto e o tecido circundante menos claro. Por isso, após a seleção voxel se tornará mais difícil.
Se a incisão inicial pele é suficientemente pequeno, uma sutura pode não ser necessário, desde que a gordura permanece confinada e não é visto fugas para fora da bolsa. Se uma sutura é colocado, é preciso ter cuidado para não amarrar o primeiro nó com muita força, caso contrário, lesões na pele podem ocorrer. Uma sutura de monofilamento não absorvível, tal como o nylon é preferido, uma vez que limita a reacção inflamatória e é menos provável que abrigam infecção. A re-epitelização da incisão vai ocorrer dentro de 24 a 48 horas pós-operatório, e o fio de sutura pode ser removido neste momento. Suturas absorvíveis entrançadas e não devem ser usados. A pele deve sempre ser tratado com o mínimo de força necessária, e o cirurgião deve tomar cuidado para não esmagar a pelemantendo-se bordas da ferida.
Dependendo do software de imagem análise dos investigadores, a relação exata entre a intensidade de pixel e da densidade do tecido pode variar. Os investigadores devem escolher limiares de intensidade de pixel para se obter uma gama máxima e mínima que distingue com mais precisão o enxerto de gordura a partir do tecido circundante. Os mesmos valores limites máximo e mínimo deve ser usado durante todo o volume de análises para manter a consistência.
Existem vários métodos para selecionar o volume de enxerto uma vez os limiares de intensidade de pixel foram definidas. Apesar de encontrar a pintura com uma ferramenta pincel na visão sagital melhor em nossas mãos, outros métodos de seleção de voxel para criar um ROI pode ser usado como desenhar com a ferramenta de spline ou pintura na vista axial. É preferível que uma única pessoa executa todo o volume de análises de forma tão consistente quanto possível, a fim de reduzir erros de medição.
O não-natureza invasiva deste método e a visualização em tempo real de evolução enxerto oferecer vantagens significativas em relação às técnicas tradicionais. No entanto, esta técnica é limitada na sua capacidade para identificar a viabilidade e da saúde dos enxertos remanescentes. Além disso, não se pode demonstrar revascularização relativa de enxertos. Embora as mudanças na aparência e densidade enxerto pode sugerir necrose gordurosa, infecção, formação de cistos, ou liquefação, é difícil tirar conclusões exatas de micro-CT sozinho.
Esperamos que esta técnica vai servir como uma base sobre a qual estudos futuros podem ser conduzidos para compreender melhor os fatores causadores de sobrevida do enxerto de gordura e perda. Variações sobre este tema pode elucidar o papel que as células-tronco, fatores de crescimento, citocinas, genes e marcadores da superfície celular desempenham na preservação final do volume de enxerto de gordura. Com esse melhor ferramenta para testar hipóteses contrastantes, estamos ansiosos para uma melhor compreensão da transferência de gordura que transforms uma técnica caprichosa para o tratamento de déficits de tecidos moles em um mais previsível.
Divulgações
None of the authors have any competing financial interest to report.
Agradecimentos
Este estudo foi financiado pela Fundação Oak, o Laboratório Hagey for Pediatric Regenerative Medicine, e do Instituto Nacional de Saúde, concessões NIHR21DE019274, NIHR01DE019434, NIHR01DE021683 e NIHU01HL099776 para MTLDCW foi apoiado pela Research Fellowship ACS Franklin H. Martin Faculdade, o Hagey Laboratory for Pediatric Regenerative Medicine, e do Instituto de Pesquisa de Saúde Infantil da Universidade de Stanford Faculdade Scholar Award. Micro-CT foi realizado no Centro de Stanford para a Inovação na In Vivo Imaging.
Materiais
| Name | Company | Catalog Number | Comments |
| SAL lipoaspirate | |||
| Centrifuge | Beckman Coulter, Inc., Pasadena, CA | ||
| 50 ml conical tubes | BD Biosciences, San Jose, CA | ||
| CD-1 nude mice (Crl:CD1-Foxn1nu) | Charles River Laboratories, Inc., Wilmington, MA | ||
| Isoflurane | Henry Schein, Dublin, OH | ||
| 2.5% Betadine | Purdue Pharma, L.P., Stamford, CT | ||
| 70% Ethanol solution | Gold Shield, Hayward, CA | ||
| 1cc luer-lock syringe | BD Biosciences, San Jose, CA | ||
| 14 gauge cannula | Shippert Medical, Centennial, CO | ||
| Forceps | Fine Science Tools, Heidelberg, Germany | ||
| Tenotomy scissors | Fine Science Tools, Heidelberg, Germany | ||
| 6-0 nylon suture | Ethicon, Blue Ash, OH | ||
| Phosphate buffered saline | Gibco, Carlsbad, CA | ||
| micro-CT scanner | Siemens Healthcare, Pleasanton, CA | ||
| Phantom | TriFoil Imaging, Northridge, CA | ||
| Imaging analysis software | IRW, Siemens Healthcare, Pleasanton, CA | ||
| Scale | Mettler-Toledo International, Inc., Columbus, OH |
Referências
- Gir, P., et al. Fat grafting: evidence-based review on autologous fat harvesting, processing, reinjection, and storage. Plast Reconstr Surg. 130 (1), 249-258 (2012).
- Kaufman, M. R., et al. Autologous fat transfer national consensus survey: trends in techniques for harvest, preparation, and application, and perception of short- and long-term results. Plast Reconstr Surg. 119 (1), 323-331 (2007).
- Smith, P., et al. Autologous human fat grafting: effect of harvesting and preparation techniques on adipocyte graft survival. Plast Reconstr Surg. 117 (6), 1836-1844 (2006).
- Eppley, B. L., Dadvand, B. Injectable soft-tissue fillers: clinical overview. Plast Reconstr Surg. 118 (4), 98e-106e (2006).
- Yarborough, J. M. The treatment of soft tissue defects with injectable collagen. Am J Med Sci. 290 (1), 28-31 (1985).
- Baumann, D. P., Butler, C. E. Soft tissue coverage in abdominal wall reconstruction. Surg Clin North Am. 93 (5), 1199-1209 (2013).
- Tukiainen, E. Chest wall reconstruction after oncological resections. Scand J Surg. 102 (1), 9-13 (2013).
- Zan, T., et al. Surgical treatment of facial soft-tissue deformities in postburn patients: a proposed classification based on a retrospective study. Plast Reconstr Surg. 132 (6), 1001e-1014e (2013).
- Bucky, L. P., Percec, I. The science of autologous fat grafting: views on current and future approaches to neoadipogenesis. Aesthet Surg J. 28 (3), 313-321 (2008).
- Lee, J. H., et al. The effect of pressure and shear on autologous fat grafting. Plast Reconstr Surg. 131 (5), 1125-1136 (2013).
- Kirkham, J. C., et al. The impact of liposuction cannula size on adipocyte viability. Ann Plast Surg. 69 (4), 479-481 (2012).
- Medina, M. A., et al. 3rd et al. Polymer therapy: a novel treatment to improve fat graft viability. Plast Reconstr Surg. 127 (6), 2270-2282 (2011).
- Horl, H. W., Feller, A. M., Biemer, E. Technique for liposuction fat reimplantation and long-term volume evaluation by magnetic resonance imaging. Ann Plast Surg. 26 (3), 248-258 (1991).
- Har-Shai, Y., Lindenbaum, E. S., Gamliel-Lazarovich, A., Beach, D., Hirshowitz, B. An integrated approach for increasing the survival of autologous fat grafts in the treatment of contour defects. Plast Reconstr Surg. 104 (4), 945-954 (1999).
- Fontdevila, J., et al. Assessing the long-term viability of facial fat grafts: an objective measure using computed tomography. Aesthet Surg J. 28 (4), 380-386 (2008).
- Meier, J. D., Glasgold, R. A., Glasgold, M. J. Autologous fat grafting: long-term evidence of its efficacy in midfacial rejuvenation. Arch Facial Plast Surg. 11 (1), 24-28 (2009).
- Coleman, S. R. Structural fat grafts: the ideal filler. Clin Plast Surg. 28 (1), 111-119 (2001).
- Coleman, S. R. Structural fat grafting: more than a permanent filler. Plast Reconstr Surg. 118 (3 Suppl), 108S-120S (2006).
- Pu, L. L., Coleman, S. R., Cui, X., Ferguson, R. E., Vasconez, H. C. Autologous fat grafts harvested and refined by the Coleman technique: a comparative study. Plast Reconstr Surg. 122 (3), 932-937 (2008).
- Matsumoto, D., et al. Cell-assisted lipotransfer: supportive use of human adipose-derived cells for soft tissue augmentation with lipoinjection. Tissue Eng. 12 (12), 3375-3382 (2006).
- Yoshimura, K., Suga, H., Eto, H. Adipose-derived stem/progenitor cells: roles in adipose tissue remodeling and potential use for soft tissue augmentation. Regen Med. 4 (2), 265-273 (2009).
- Zuk, P. A., et al. Multilineage cells from human adipose tissue: implications for cell-based therapies. Tissue Eng. 7 (2), 211-228 (2001).
- Habte, F., et al. Impact of a multiple mice holder on quantitation of high-throughput MicroPET imaging with and without Ct attenuation correction. Mol Imaging Biol. 15 (5), 569-575 (2013).
- Chung, M. T., et al. Micro-computed tomography evaluation of human fat grafts in nude mice. Tissue Eng Part C Methods. 19 (3), 227-232 (2013).
- Thanik, V. D., et al. A murine model for studying diffusely injected human fat. Plast Reconstr Surg. 124 (1), 74-81 (2009).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados