Method Article
הערכה של יכולת הקיום של הזרקת שומן האנושי בעכברי עירום עם מיקרו-טומוגרפיה ממוחשבת
* These authors contributed equally
In This Article
Summary
Fat grafting is an essential technique for reconstructing soft tissue deficits. However, it remains an unpredictable procedure characterized by variable graft survival. Our goal was to devise a mouse model that utilizes a novel imaging method to compare volume retention between differing techniques of fat graft preparation and delivery.
Abstract
Lipotransfer הוא כלי חיוני בארסנל של המנתח לטיפול בגירעונות ברקמות רכים של כל הגוף. השומן הוא מילוי רקמות הרך האידיאלי כפי שהוא זמין, להשיג בקלות, זול, ומטבעו ביולוגית. 1 עם זאת, למרות הפופולריות הגואה שלו, השתלת שומן הקשתה על ידי תוצאות בלתי צפויות והישרדות שתל משתנה, עם שיעורי ההחזקה פורסמו נעים בכל מקום בין 10 -80%. 1-3
כדי להקל על חקירות בהשתלת שומן, יש לנו ולכן פיתחתי מודל חיה המאפשר ניתוח של שימור נפח שומן מוזרק בזמן אמת. בקצרה, חתך קטן נעשה בקרקפת של עכבר בעירום CD-1 ו200-400 μl של lipoaspirate מעובד ממוקם מעל הגולגולת. הקרקפת נבחרה כאתר נמען בגלל העדרו של שומן תת עורי המקומי, ובגלל הניגוד המצוין רקע הניתן על ידי calvarium, אשר מסייע בתהליך הניתוח. טומוגרפיה ממוחשבת-מיקרו (מיקרו-CT) משמשת כדי לסרוק את השתל בתחילת מחקר ובכל שבועיים לאחר מכן. תמונות CT משוחזרות, ותוכנת הדמיה משמשת לכמת כרכי שתל.
באופן מסורתי, טכניקות להערכת שומן שתל נפח חייבו הרדמת חסד בבעלי החיים המחקר לספק רק הערכה אחת של משקל ונפח שתל על ידי מדידה פיזית vivo לשעבר. השוואות ביוכימיים והיסטולוגית שכמו כן נדרשו בעלי החיים המחקר להיות מורדמים. טכניקת הדמיה שתוארה זה מציעה את היתרון של הדמיה ואובייקטיבית כימות היקף בנקודות זמן מרובות לאחר השתלה ראשונית מבלי להקריב בעלי החיים המחקר. הטכניקה מוגבלת על ידי הגודל של השתל יכול להיות מוזרקים כמו עור סיכון שתלים גדולים יותר ונימק שומן. לשיטה זו כלי לכל מחקרי הערכת כדאיות שתל שומן ושימור נפח. הוא טוב במיוחד מתאים לproviding ייצוג חזותי של שתלי שומן ובעקבות שינויים בנפח לאורך זמן.
Introduction
Soft tissue defects arise from a variety of causes including trauma, tumor resection, aging, and congenital anomaly. They can be debilitating for patients, and represent one of the most common, yet challenging problems for reconstructive surgeons. Many methods exist for addressing soft tissue deficiencies, such as local and free flaps, collagen injections, and synthetic fillers.4-8 However, since its first documented use by Neuber in 18931, autologous fat transfer remains the gold standard for the repair of soft tissue deficits, as it is ready available, easy and safe to harvest, and naturally compatible.1,2
Despite these advantages, autologous fat grafts suffer from unpredictable and variable survival, with retention rates ranging anywhere from 10-80% over time.1-3,9 In order to account for this expected loss of volume and symmetry, surgeons must often overcorrect when filling soft tissue defects, or perform multiple follow-up procedures.
Poorly vascularized graft beds are partly to blame for this tissue resorption. Additionally, the lack of a benchmark analysis method to compare graft survival may also contribute to the inconsistency in reported results. A precise method for measuring graft volume would reduce measurement error when evaluating retention rates. This in turn would help researchers more accurately identify the causative factors that affect graft survival. Although many laboratory animal models have facilitated both quantitative and qualitative assessment of human fat graft survival, most are based on histological and biochemical means and require sacrificing the study animal to yield a single measurement.3,10-12 Little has been reported on the use of imaging techniques to enumerate fat graft volume retention in vivo.
A handful of clinical studies have shown more effective measurement techniques using imaging. Magnetic Resonance Imaging (MRI) was employed by Hörl et al. to measure fat graft survival13, and CT was utilized by Har-Shai et al. and Fontdevila et al. in their analyses of volume retention after grafting in patients who suffered from HIV.14,15 Employing three-dimensional (3D) imaging software, Meier et al. measured volume retention in humans after autologous fat grafting by comparing images from the preoperative and postoperative period.16
Yet, a standardized method employing imaging to measure fat graft survival is lacking in basic science research. A high resolution imaging approach for assessing the volumes of fat grafts would allow not only for accurate and reproducible volume measurements, but also for repeated measurements allowing visualization of the evolution of fat graft survival in a real time fashion.
Protocol
הערה: פרוטוקולי ניסוי וטפסי הסכמת מטופל לקבלת שומן היו נבדקו ואושרו על ידי אוניברסיטת סטנפורד Institutional Review Board (פרוטוקול # 2,188). נהלי כל החיה אושרו על ידי הפנל המנהלי סטנפורד במעבדת טיפול בבעלי חיים (APLAC) לפי הפרוטוקול # 9999. כל הניסויים שנערכו עם הקפדה על בטיחות בבעלי חיים והנחיות טיפול הומניות.
1. שומן קציר
- באמצעות ההליך קולמן 17-19, להשיג רקמת שומן אנושית מהבטן, האגף, ו / או אזורי ירך של מטופלות בריאים עוברות שאיבת שומן אלקטיבי.
- כדי לעבד את lipoaspirate להשתלה, כך שהוא מאפשר להתחיל השומן להתיישב למשך 30 דקות.
- Lipoaspirate מתיישב בדרך כלל לשלוש שכבות, עם שמן בראש, שומן באמצע, ודם בתחתית. לשאוב ולזרוק את שכבת שמן העליונה ושכבה התחתונה דם.
- כדי להסיר כל שנותר tumesc נוסףנוזל ent או פסולת תא, צנטריפוגות השומן במשך 5 דקות ב 350 XG ו4 ° C, ולשאוב את השכבה המימית התחתונה.
- לחשב את כמות השומן הדרוש לשתל, המאפשר 20% שגיאת משלוח, ולהעביר את הנפח הרצוי של שומן לחרוטי 50 מיליליטר (ים). להכפיל 400 במספר העכברים במחקר כדי להשיג מיקרוליטר של השומן הדרוש לשתל.
- בשלב זה, אם Cell ביצוע Assisted Lipotransfer 20,21, מקום נפח של שומן להשתלה על קרח. לאחר מכן לקצור תאי שמקורם שומן סטרומה (ASCs) מהשומן שנותר בטכניקה סטנדרטית שתוארה על ידי צוק et al 22.
2. שומן הארכת
- להשיג נקבה, עכברים בעירום CD-1 הומוזיגוטים למחקר הניסיוני. בחר עכברים בין 8 - 12 שבועות של גיל.
- כדי לגרום להרדמה, עכבר מקום לתיבת מציאה עם 2.5% תערובת isoflurane / חמצן ב2 L / min למשך כ -10 דקות. שים לב שisof המומלץמינון lurane משתנה עם זן עכבר.
- כאשר קצב הנשימה של עכבר הואט, לאשר הרגעה נאותה עם קמצוץ הבוהן. החל משחת עיני סיכה וטרינרים לשני העיניים של העכבר.
- אם העכבר אינו נרתע בתגובה לקמצוץ הבוהן, זה מאשר את מטוס מספק של הרדמה. מניחים את אפו של העכבר לnosecone אספקת 2.5% תערובת isoflurane / חמצן ב1-2 L / min. אם עכבר חוזר מקמצוץ הבוהן, לחזור לקופסה ובדוק שוב מציאה לאחר 5 דקות.
- הגדר את שדה סטרילי תחת עכבר ולאחר מכן לחטא את הקרקפת עם 2.5% povidone- יוד ואחריו 70% אתנול פתרון. חזור על עוד פעמיים.
- הנח וילונות כירורגית על העכבר ולהיות זהיר כדי לשמור על שדה סטרילי. מכשירים סטריליים, כפפות, וPPE יש להשתמש בכל העת.
- אם נפח שומן להיות מורכב הונח בעבר על קרח, לאפשר לשומן ראשון להסתגל לRT לפני הלידה.
- Backload מזרק luer נעילת מיליליטר 1 עם 1 מיליליטרשל שומן.
- חבר 14 G, צינורית שומן ארוך 8 סנטימטר השתלה לסוף המזרק.
- מערכת ראש-ידי לחיצה על בוכנת המזרק עד בין 200 ל -400 μl של שומן נשארה במזרק. בעוד מדכא על בוכנת המזרק לאשר שהצינורית מילאה באופן מלא עם שומן על ידי התבוננות שומן יציאת חור הצינורית הדיסטלית.
- באמצעות מלקחיים עדינים, להרים את עור הגב בקו האמצע מעל הזנב ביותר ההיבט של הגולגולת. הפוך 1.5 מ"מ לחתוך בעור באמצעות מספריים עדינים.
- מניחים תפר 6-0 ניילון אחת דרך אמצע החתך שמאוחר יותר ישמש כדי להביא את פצע קצוות יחד לאחר ההשתלה מתבצעת. אין לקשור את התפר.
- צור כיס תת-עורי מעל הגולגולת על ידי החדרת הצינורית דרך החתך בעור ועובר את הצינורית קדימה ואחורה בצורה מניפה מעל הגולגולת לשחרר קבצים מצורפים רקמת חיבור לעור שמעליה.
- ברגע שהכיס נוצר, מקם את גannula בקו האמצע של העכבר ישירות על הגולגולת עד הקצה טמון במקורי ביותר ההיבט של הכיס שאמורה להיות ממש מאחורי קו בין העיניים. (איור 1 א)
- לאט לאט להזריק השומן באופן מדרדר, קידום הבוכנה תוך משיכת הצינורית בחזרה. בעזרת מלקחיים, להביא את קצות הפצע יחד ולהרים אותם כדי לשמור על כל שומן מדולף החוצה מהכיס.
- לקשור את התפר שהונח בעבר, ולוודא כי הקשר הראשון טמון בקלילות על העור. לקשור עוד שלושה קשרים מרובעים ולחתוך את התפר עם זנב 3 מ"מ. (איור 1)
- ודא עם הדמיה ומישוש ידני שהכיס לא מלא יתר על מידה ועור שמעל הכיס הוא לא מתוח. אם הכיס כבר מלא יתר על מידה, לחתוך את התפר ולהסיר את כל השומן בכיס. לשטוף את הכיס עם נאגר מלוח פוספט pH (PBS) 7.4 מחדש להזריק נפח קטן יותר של שומן.
- הסר עכבר מnesthesia ומניחים על הגב שלה או בצד בכלוב נקי על ידי עצמו. לפקח על בעלי החיים לנשימה רגילה, תנועות רגילות, היעדר הדימום, וסימנים של כאב או מצוקה. לנהל 0.1 מ"ג / קילוגרם תת עורי כל שעה 6 עצירות עד 48 שעות אם בעל החיים הוא בכאב.
- לוודא כי בעלי החיים התעוררו במידה מספקת כדי לשמור על כיבה sternal לפני שעזב אותו ללא השגחה. אל תניחו לבעלי חיים לכלוב עם בעלי חיים אחרים, עד שהתאושש באופן מלא.
- לאחר 4 שעות, להבטיח כי בעל החיים הוא מסוגל לאכול ולשתות, מהלך, ולנשום באופן רגיל ושאין דימום ממקום הניתוח. להחזיר אותו למתקן הטיפול בבעלי החיים.
3. מיקרו-CT
- עכברי סריקה לנקודת התחלה ב היום שלאחר ניתוח 3 נפח, ולאחר מכן לחזור על סריקות בשבועות שלאחר ניתוח 2, 4, 6 ו -8.
- כאשר ההדמיה העכברים בכל נקודת זמן, פעל לפי הנחיות הרגעה וטיפול בבעלי החיים לפני ואחרי-פרוצדוראלי כפי שתואר בעבר בSteps 2.2-2.4 ו2.17-2.19.
- לבצע סריקות בסורק CT מיקרו עם גודל voxel שחזור של 100 מיקרומטר או טוב יותר.
- עם kilovoltage שיא X-ray של 80 KVP ונוכחי האנודה של 450 מייקרו-אמפר, לנהל מנת מנה של כ 5 centiGy במהלך סריקת 9 דקות לכל עכבר. שים לב ערכים אלה משתנים בהתאם לפרוטוקול הסריקה.
- קודם לביצוע הסריקה הראשונה, לכייל מיקרו-CT עם פנטום הדמיה שמבדיל בין האוויר, מים, ועוצמת עצם.
- הנח ארבעה עכברים לסורק במצב הגחון עם שני עכברים על גבי ושתי בתחתית. מיטת סריקה בקלות ניתן לבנות באמצעות 60 מיליליטר מזרקים להחזיק את גוף העכבר ומזרקי 10 מיליליטר כקונוסים האף. 23
- לשמור על עכברים תחת הרדמה עם 2.5% תערובת isoflurane / חמצן ב 1-2 ליטר לדקה.
- ודא עם תמונת צופים שכל הגולגולת של העכבר, מהאף לחוליית צוואר הראשון, ומחלק העליון של גולגולת לבסיס של SKUll, יהיה צילם.
ניתוח 4. מיקרו-CT
- פתח את התמונות משוחזרות עם תוכנת מיקרו-CT הדמיה ניתוח שמאפשרת יצירת אזורים של העניין (ROI של) על ידי בחירת voxels באמצעות ספים לעוצמת פיקסל. תוכנה גם מאפשרת יצירת משטחי 3D באמצעות אינטרפולציה של voxels שנבחר, ולניתוח נפח.
- התחל על ידי טעינת תמונות CT המשוחזרת בשני ממדים (2D) העטרה, צירי, ונוף sagittal. (איור 2 א)
- שימוש בפרוסה הצירית כמדריך, לנווט לפרוסת sagittal שמתאימה להיבט השמאלי ביותר של שתל השומן. בחר סף עליון ותחתון לעוצמת פיקסל הלוכד את כל voxels המתאים להשתלת השומן, אבל זה אינו כולל את הרקמות ועצמות הסמוכות. (איור 2)
- הגדר את ההחזר על ההשקעה בתצוגת sagittal שמתאימה לשתל השומן באמצעות ספי עוצמת פיקסל שהוגדרו בעבר. REPEAT הליך זה כל פרוסה sagittal החמישית, ניווט עד שיגיע לימני ביותר ההיבט של השתל. (איור 2 ג)
- לשרבב voxels שנבחרו מכל ROI 2D של ל, ROI 3D בשילוב יחיד. (איור 2 ד)
- ROI שיא מחושב על ידי תוכנת נפח.
- לדקלם isosurface 3D לדמיין סופי שתל שומן הנפח. (איור 2E)
- בניתוחים שלאחר מכן, הקפד לשמור את מקסימום עצמת פיקסל וערכי סף מינימליים זהים לאלה המשמשים לניתוח הבסיסי.
5. שומן קציר
- לאחר העכברים נסרקו ל8 24,25 נקודת הזמן בשבוע, להרדים את העכברים כפי שתואר לעיל לעיל בשלבי 2.2-2.4 ו2.17-2.19.
- בעקבות הנחיות APLAC, להרדים את העכברים על ידי הפרדת העמודות בעמוד השדרה שלהם.
- מניחים את העכבר בשדה אופרטיבי. בעזרת המספריים tenotomy, לפתוח בזהירות את הכיס ולנתח tהוא מעל עור ורקמות חיבור קבצים מצורפים משתל השומן.
- בשלב זה, זה עשוי לעזור לבלו תיקון של עור הגב שמעליה כדי לסייע בחילוץ של השתל. (איור 3 א)
- קל לשמור על מתיחה על השתל עם מלקחיים ולהפוך את שתל מצד לצד כדי להמחיש נקודות רצופות של מתח שצריך להשתחרר במספריים.
- הישאר קרוב לשתל ככל האפשר כאשר מוציאים כדי למזער את רקמת החיבור שצולמה עם השתל. (איור 3)
- לאחר כריתת שתל, למדוד מסה בקנה מידת tared כי הוא מדויק ללפחות 0.01 גרם.
- חשב את הנפח של שתל השומן באמצעות הערך שנמדד המסה והצפיפות הממוצעת של שומן אנושי (0.9 גר '/ מיליליטר) כיחס המרה.
- שקלו את הנפח מחושב של שתל שומן לזו המתקבלת באמצעות מיקרו-CT.
- שתלי שומן יכולים להיות מעובד להיסטולוגיה או ניתוח נוסף במידת צורך.
תוצאות
שתלי שומן ירדו בהדרגה בנפח במהלך המחקר, וכתוצאה מכך 62.2% הישרדות ממוצעת על ידי 8. (איור 4 א) בשבוע 24 בסיום סריקת השבוע 8, כל שתל שומן הופק בחתיכה אחת. בדיקת סכום דרגת Wilcoxan שימשה להשוות את ההבדל בין מדידות נפח של שתלי שומן מתקבלים על ידי שני מיקרו-CT או מחושבים ממסה פיזית. לא נמצא הבדל משמעותי בין שתי שיטות אלה (עמ '-value דו-צדדי = .9362). (איור 4)
עם 5 centiGy לסריקה וחמש נקודות זמן סריקה, כל עכבר קיבל לא יותר מסך של 25 centiGy במהלך המחקר. עולה בקנה אחד עם זה, אף אחד מהעכברים מוצג כל ראיות גולמית של כוויות קרינת עורית.

איור 1. (א) צינורית 14 G במזרק 1 מיליליטר, ממוקמת בקו האמצע ובמקורי ביותר ההיבט של הכיס לפני תחילת הזרקת שומן. (ב) עכבר עירום על השתלת שומן הושלמה, עם תפר ניילון אחת נהגה להביא פצע קצוות יחד. הכיס כבר מלא, אבל הוא לא מתוח.

איור 2. (א) תמונות משוחזרות בתחילה מוצג בצירי, העטרה, ונוף sagittal. (ב) באמצעות התצוגה הצירית כמדריך כדי לנווט לביותר ההיבט השמאלי של השתל על השקפת sagittal. קביעת סף לעוצמת פיקסל, כך שכל voxels שנבחר בטווח הסף ייצג רקמת שומן, ובכך לאפשר לתיחום של שתל שומן הנפח. (C) מוגדר במבט sagittal מתחיל ברוב ההיבט השמאלי של השתל ושל ROI המשיך אי פעםפרוסת y החמישית שעברה לקצה השני של השתל. (ד) כל voxels שנבחר מ2D ROI של אינטרפולציה ל3D ROI אחת. (E) משטח תלת-ממדי נוצרה באמצעות אינטרפולציה מעוקב-שגם לדמיין את כרכי שתל השומן כללי .
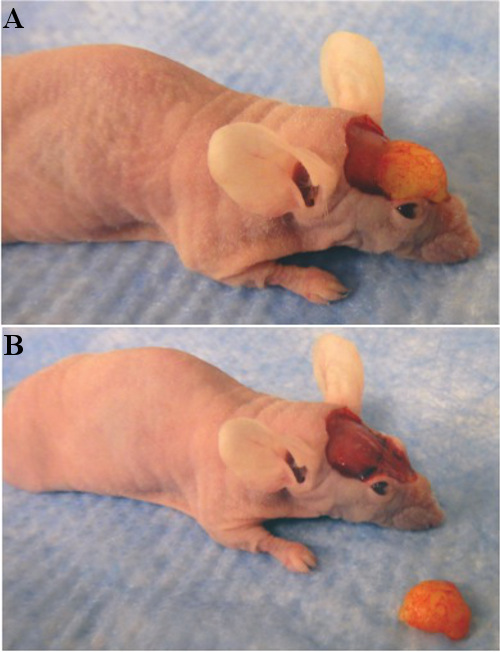
איור 3. שתל () שומן לפני explantation, עם תיקון גב של עור הוסר. (B) שתל שומן לאחר explantation.

ניתוח 4. (א) נפח מיקרו-CT איור הפגין אובדן הדרגתי של שומן שתל נפח במשך שמונה שבועות. (ב) כרכי שתל שומן הסופיים, כפי שהיא נמדדת על ידי מיקרו-CT, תואם באופן הדוק לכרכים מחושבים מהמוני שתל שומן explanteds. הצפיפות הממוצעת של שומן אנושי (מיליליטר / 0.9 g) שימשה כיחס המרה.

טבלת 1. מחושב נפח מיקרו-CT לעומת נפח שומן מדודים בפועל 24
Discussion
עד לנקודה זו, רוב החוקרים הסתמכו על שיטות הלא הדמיה לכמת את ההישרדות לטווח הארוך של שתלי שומן, אך שיטות אלה דורשים הקרבת בעלי החיים המחקר ולהניב רק מדידה אחת. 3,10-12 המחקר שלנו מייצג שיטת ניתוח השתפרה המאפשרת אובייקטיבי, כימות של הישרדות שתל שומן בזמן אמת במודל של עכברים.
קריטי בתהליך זה הוא להבטיח כי עכברים מספיק חיסון המשמשים למחקר, כמו זה מונע את דחיית השתל שיתרחש אם עכברים בעלי מערכת חיסונית שלמה משמשים. שמירה על שלמות שומן היא קריטית במהלך המסיק, העיבוד, ושלבי מיקום של השתלה. בהתאם לאמות מידה מקובלות באופן מסורתי, יש לקבל שומן להשתלה על ידי שאיבת שומן שאיבה סייעה (SAL). במהלך ההשמה, שומן צריך להיות מוזרק בקצב זרימה יציב לא מהר יותר מאשר 0.5 מיליליטר / sec. צינורית 14 מד עדיפה להשתלת ina עכבר, אבל קנולות קוטר גדולות יותר ניתן להשתמש ללא כל פגיעה בשומן. קנולות וקטנות יותר מחטים-במיוחד אלה צרים יותר 16 מד-מיואשות במהלך ההשמה כפי שהם עלולים לגרום להתמוטטות השומן בשל לחץ גזירה מוגברת. למרות שאנו מתארים הטכניקה המועדפת עלינו לעיבוד לעיל, כל שילוב של שקיעה, צנטריפוגה, ו / או סינון ניתן להשתמש כל עוד שכבות הנפט ודם מופרדות במידה מספקת מהשומן לפני ההשתלה.
שתלי שומן צריכים להיות לפחות 200 μl בגודל למזער שונות בתוצאות בשל האופי הלא העקבי של השתלת שומן. שתלים גדולים יותר עד 400 μl בגודל ניתן להשתמש, אבל מעל לכרך זה, אספקת דם לקויה ומתח עור מוגזם עלולות לגרום לשומן ונימק עור. סופו של דבר, גודל שתל שומן מרבי שייקבע על ידי שטח פנים ונפח של הכיס. כדי להגביר את עוצמת הקול של שתל שיכול להיות מועבר בצורה בטוחה, ת.ד.cket ניתן להרחיב על ידי נתיחה נרחבת יותר. עם זאת, זה עשוי להציב שומן מעבר לגבולות העליונים של הגולגולת, אשר יהפוך את הניגוד בין השתל והרקמה סובב פחות ברורה. לפיכך, בחירת voxel שלאחר מכן תהיה קשה יותר.
אם חתך בעור ראשוני הוא קטן מספיק, תפר לא יהיה צורך עוד שומן נשאר הכיל ולא ראה דולף החוצה מהכיס. אם תפר ממוקם, יש להקפיד שלא לקשור את הקשר הראשון חזק מדי, אחרת התמוטטות עור עלולה להתרחש. תפר monofilament שאינו נספג כמו ניילון הוא מועדף, כפי שהוא מגביל את התגובה הדלקתית ופחות סביר נמל זיהום. -Epithelialization מחדש של החתך יתרחש בתוך 24 עד 48 שעות לאחר ניתוח, והתפר ניתן להסיר בשלב זה. אין להשתמש בתפרים נספגים וקלועים. עור צריך תמיד להיות מטופלים עם הכוח לפחות הכרחי, והמנתח צריך לדאוג שלא למחוץ את העורכשהוא אוחז את קצות פצע.
בהתאם לתוכנת ניתוח ההדמיה של החוקרים, הקשר המדויק בין עוצמת פיקסל והצפיפות של רקמה עשוי להשתנות. חוקרים צריכים לבחור סף עוצמת פיקסל להשיג טווח מרבי ומזערי בצורה מדויקת ביותר שמייחד את שתל השומן מהרקמה הסובבת. יש להשתמש בערכי סף מרבי ומזערי אותה במהלך כל נפח הניתוחים כדי לשמור על עקביות.
ישנן שיטות רבות לבחירת שתל נפח פעם נקבעו ערכי סף עוצמת פיקסל. למרות שאנו מוצאים בציור עם כלי מברשת בתצוגה הטובה ביותר sagittal בידיים שלנו, שיטות בחירת voxel אחרות כדי ליצור את ההחזר על ההשקעה יכולה לשמש כמו ציור עם הכלי שגם ציור או בתצוגה הצירית. עדיף אם אדם אחד מבצע את כל נפח מנתח באופן עקבי ככל האפשר על מנת להקטין את טעות מדידה.
איהטבע פולשנית של שיטה זו ויזואליזציה של אבולוציה שתל בזמן אמת מציע יתרונות משמעותיים על פני טכניקות מסורתיות. עם זאת, טכניקה זו היא מוגבלת ביכולתה לזהות את הכדאיות ובריאותם של שתלי שריד. יתר על כן, זה לא יכול להוכיח revascularization היחסית של שתלים. למרות שינויים במראה ובצפיפות שתל עשויים לרמוז על נמק שומן, זיהום, היווצרות ציסטה, או עיבוי, קשה להסיק מסקנות מדויקות ממייקרו-CT לבד.
אנו מקווים טכניקה זו תשמש כבסיס שעליו ניתן לבצע מחקרים עתידיים כדי להבין טוב יותר את הגורמים סיבתי בהישרדות שתל שומן והפסד. וריאציות על הנושא הזה עשויים להבהיר את התפקיד שתאי גזע, גורמי גדילה, ציטוקינים, גנים, וסמנים פני התא לשחק בשימור האולטימטיבי של שומן שתל נפח. עם כלי משופר זו כדי לבדוק מנוגד השערות, אנו מצפים להבנה טובה יותר של העברת שומן שtransfoRMS טכניקה גחמנית לטיפול בגירעונות רקמות רכים לאחד יותר לחיזוי.
Disclosures
None of the authors have any competing financial interest to report.
Acknowledgements
מחקר זה נתמך על ידי קרן Oak, המעבדה Hagey לילדי רפואת רגנרטיבית, והמכון הלאומי לבריאות, מענקי NIHR21DE019274, NIHR01DE019434, NIHR01DE021683, וNIHU01HL099776 לMTLDCW נתמכה על ידי ACS פרנקלין H. מרטין הפקולטה למחקר המלגה, Hagey מעבדה לילדי רפואת רגנרטיבית, והפקולטה Scholar פרס אוניברסיטת סטנפורד מכון מחקר לבריאות הילד. מיקרו-CT נערך במרכז סטנפורד לחדשנות בin vivo הדמיה.
Materials
| Name | Company | Catalog Number | Comments |
| SAL lipoaspirate | |||
| Centrifuge | Beckman Coulter, Inc., Pasadena, CA | ||
| 50 ml conical tubes | BD Biosciences, San Jose, CA | ||
| CD-1 nude mice (Crl:CD1-Foxn1nu) | Charles River Laboratories, Inc., Wilmington, MA | ||
| Isoflurane | Henry Schein, Dublin, OH | ||
| 2.5% Betadine | Purdue Pharma, L.P., Stamford, CT | ||
| 70% Ethanol solution | Gold Shield, Hayward, CA | ||
| 1cc luer-lock syringe | BD Biosciences, San Jose, CA | ||
| 14 gauge cannula | Shippert Medical, Centennial, CO | ||
| Forceps | Fine Science Tools, Heidelberg, Germany | ||
| Tenotomy scissors | Fine Science Tools, Heidelberg, Germany | ||
| 6-0 nylon suture | Ethicon, Blue Ash, OH | ||
| Phosphate buffered saline | Gibco, Carlsbad, CA | ||
| micro-CT scanner | Siemens Healthcare, Pleasanton, CA | ||
| Phantom | TriFoil Imaging, Northridge, CA | ||
| Imaging analysis software | IRW, Siemens Healthcare, Pleasanton, CA | ||
| Scale | Mettler-Toledo International, Inc., Columbus, OH |
References
- Gir, P., et al. Fat grafting: evidence-based review on autologous fat harvesting, processing, reinjection, and storage. Plast Reconstr Surg. 130 (1), 249-258 (2012).
- Kaufman, M. R., et al. Autologous fat transfer national consensus survey: trends in techniques for harvest, preparation, and application, and perception of short- and long-term results. Plast Reconstr Surg. 119 (1), 323-331 (2007).
- Smith, P., et al. Autologous human fat grafting: effect of harvesting and preparation techniques on adipocyte graft survival. Plast Reconstr Surg. 117 (6), 1836-1844 (2006).
- Eppley, B. L., Dadvand, B. Injectable soft-tissue fillers: clinical overview. Plast Reconstr Surg. 118 (4), 98e-106e (2006).
- Yarborough, J. M. The treatment of soft tissue defects with injectable collagen. Am J Med Sci. 290 (1), 28-31 (1985).
- Baumann, D. P., Butler, C. E. Soft tissue coverage in abdominal wall reconstruction. Surg Clin North Am. 93 (5), 1199-1209 (2013).
- Tukiainen, E. Chest wall reconstruction after oncological resections. Scand J Surg. 102 (1), 9-13 (2013).
- Zan, T., et al. Surgical treatment of facial soft-tissue deformities in postburn patients: a proposed classification based on a retrospective study. Plast Reconstr Surg. 132 (6), 1001e-1014e (2013).
- Bucky, L. P., Percec, I. The science of autologous fat grafting: views on current and future approaches to neoadipogenesis. Aesthet Surg J. 28 (3), 313-321 (2008).
- Lee, J. H., et al. The effect of pressure and shear on autologous fat grafting. Plast Reconstr Surg. 131 (5), 1125-1136 (2013).
- Kirkham, J. C., et al. The impact of liposuction cannula size on adipocyte viability. Ann Plast Surg. 69 (4), 479-481 (2012).
- Medina, M. A., et al. 3rd et al. Polymer therapy: a novel treatment to improve fat graft viability. Plast Reconstr Surg. 127 (6), 2270-2282 (2011).
- Horl, H. W., Feller, A. M., Biemer, E. Technique for liposuction fat reimplantation and long-term volume evaluation by magnetic resonance imaging. Ann Plast Surg. 26 (3), 248-258 (1991).
- Har-Shai, Y., Lindenbaum, E. S., Gamliel-Lazarovich, A., Beach, D., Hirshowitz, B. An integrated approach for increasing the survival of autologous fat grafts in the treatment of contour defects. Plast Reconstr Surg. 104 (4), 945-954 (1999).
- Fontdevila, J., et al. Assessing the long-term viability of facial fat grafts: an objective measure using computed tomography. Aesthet Surg J. 28 (4), 380-386 (2008).
- Meier, J. D., Glasgold, R. A., Glasgold, M. J. Autologous fat grafting: long-term evidence of its efficacy in midfacial rejuvenation. Arch Facial Plast Surg. 11 (1), 24-28 (2009).
- Coleman, S. R. Structural fat grafts: the ideal filler. Clin Plast Surg. 28 (1), 111-119 (2001).
- Coleman, S. R. Structural fat grafting: more than a permanent filler. Plast Reconstr Surg. 118 (3 Suppl), 108S-120S (2006).
- Pu, L. L., Coleman, S. R., Cui, X., Ferguson, R. E., Vasconez, H. C. Autologous fat grafts harvested and refined by the Coleman technique: a comparative study. Plast Reconstr Surg. 122 (3), 932-937 (2008).
- Matsumoto, D., et al. Cell-assisted lipotransfer: supportive use of human adipose-derived cells for soft tissue augmentation with lipoinjection. Tissue Eng. 12 (12), 3375-3382 (2006).
- Yoshimura, K., Suga, H., Eto, H. Adipose-derived stem/progenitor cells: roles in adipose tissue remodeling and potential use for soft tissue augmentation. Regen Med. 4 (2), 265-273 (2009).
- Zuk, P. A., et al. Multilineage cells from human adipose tissue: implications for cell-based therapies. Tissue Eng. 7 (2), 211-228 (2001).
- Habte, F., et al. Impact of a multiple mice holder on quantitation of high-throughput MicroPET imaging with and without Ct attenuation correction. Mol Imaging Biol. 15 (5), 569-575 (2013).
- Chung, M. T., et al. Micro-computed tomography evaluation of human fat grafts in nude mice. Tissue Eng Part C Methods. 19 (3), 227-232 (2013).
- Thanik, V. D., et al. A murine model for studying diffusely injected human fat. Plast Reconstr Surg. 124 (1), 74-81 (2009).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved