Method Article
Évaluation de la viabilité de la graisse humaine injection dans des souris nude avec Micro-tomodensitométrie
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Fat grafting is an essential technique for reconstructing soft tissue deficits. However, it remains an unpredictable procedure characterized by variable graft survival. Our goal was to devise a mouse model that utilizes a novel imaging method to compare volume retention between differing techniques of fat graft preparation and delivery.
Résumé
Lipotransfer est un outil essentiel dans l'arsenal du chirurgien pour le traitement des déficits de tissu mou dans le corps. La graisse est la charge idéale des tissus mous car il est facilement disponible, facile à obtenir, peu coûteux, et intrinsèquement biocompatible. 1 Toutefois, malgré sa popularité en plein essor, la greffe de graisse est entravée par des résultats imprévisibles et la survie du greffon variable, taux de rétention publiés variant entre 10 -80%. 3/1
Pour faciliter les enquêtes sur la greffe de graisse, nous avons donc mis au point un modèle animal qui permet une analyse en temps réel de la rétention de volume graisse injectée. En bref, une petite incision est faite dans le cuir chevelu d'une souris CD-1 nu et 200 à 400 ul de lipoaspirat traité est placé sur le crâne. Le cuir chevelu est choisi comme site receveur en raison de son absence de graisse sous-cutanée d'origine, et en raison de l'excellent contraste de fond fourni par le calvarium, qui aide àle processus d'analyse. Tomographie micro-ordinateur (micro-CT) est utilisé pour balayer la greffe au départ et toutes les deux semaines par la suite. Les images TDM sont reconstruits, et un logiciel d'imagerie est utilisé pour quantifier les volumes greffés.
Traditionnellement, les techniques pour évaluer le volume de greffe de graisse ont nécessité euthanasier l'animal d'étude pour fournir simplement une évaluation unique de poids de greffe et le volume par mesure physique ex vivo. Comparaisons biochimiques et histologiques ont également requis l'animal d'étude pour être euthanasié. Cette technique d'imagerie décrit offre l'avantage de visualiser et de quantifier objectivement volume à de multiples points de temps après la greffe initiale sans avoir à sacrifier l'animal de l'étude. Cette technique est limitée par la taille de la greffe pouvant être injecté comme les greffes de peau plus grands risques et nécrose de graisse. Cette méthode a une utilité pour toutes les études évaluant la viabilité de la greffe de graisse et la rétention de volume. Il est particulièrement bien adapté à providing une représentation visuelle de greffe de graisse et à la suite des changements de volume au fil du temps.
Introduction
Soft tissue defects arise from a variety of causes including trauma, tumor resection, aging, and congenital anomaly. They can be debilitating for patients, and represent one of the most common, yet challenging problems for reconstructive surgeons. Many methods exist for addressing soft tissue deficiencies, such as local and free flaps, collagen injections, and synthetic fillers.4-8 However, since its first documented use by Neuber in 18931, autologous fat transfer remains the gold standard for the repair of soft tissue deficits, as it is ready available, easy and safe to harvest, and naturally compatible.1,2
Despite these advantages, autologous fat grafts suffer from unpredictable and variable survival, with retention rates ranging anywhere from 10-80% over time.1-3,9 In order to account for this expected loss of volume and symmetry, surgeons must often overcorrect when filling soft tissue defects, or perform multiple follow-up procedures.
Poorly vascularized graft beds are partly to blame for this tissue resorption. Additionally, the lack of a benchmark analysis method to compare graft survival may also contribute to the inconsistency in reported results. A precise method for measuring graft volume would reduce measurement error when evaluating retention rates. This in turn would help researchers more accurately identify the causative factors that affect graft survival. Although many laboratory animal models have facilitated both quantitative and qualitative assessment of human fat graft survival, most are based on histological and biochemical means and require sacrificing the study animal to yield a single measurement.3,10-12 Little has been reported on the use of imaging techniques to enumerate fat graft volume retention in vivo.
A handful of clinical studies have shown more effective measurement techniques using imaging. Magnetic Resonance Imaging (MRI) was employed by Hörl et al. to measure fat graft survival13, and CT was utilized by Har-Shai et al. and Fontdevila et al. in their analyses of volume retention after grafting in patients who suffered from HIV.14,15 Employing three-dimensional (3D) imaging software, Meier et al. measured volume retention in humans after autologous fat grafting by comparing images from the preoperative and postoperative period.16
Yet, a standardized method employing imaging to measure fat graft survival is lacking in basic science research. A high resolution imaging approach for assessing the volumes of fat grafts would allow not only for accurate and reproducible volume measurements, but also for repeated measurements allowing visualization of the evolution of fat graft survival in a real time fashion.
Protocole
REMARQUE: Les protocoles expérimentaux et les formulaires de consentement des patients pour obtenir la graisse ont été examinés et approuvés par le Conseil de l'Université Stanford examen institutionnel (Protocole N ° 2188). Toutes les procédures d'animaux ont été approuvés par la commission administrative sur Stanford Laboratoire de protection des animaux (APLAC) en vertu du protocole # 9999. Toutes les expériences ont été menées dans le strict respect de la sécurité des animaux et des lignes directrices de soins humanitaires.
1. Fat récolte
- En utilisant la procédure Coleman 17-19, obtenir des tissus adipeux humain de l'abdomen, le flanc, et / ou les régions de la cuisse de patients sains de sexe féminin subissant la liposuccion élective.
- Pour traiter le lipoaspirat pour le greffage, commencer par permettre à la graisse de se contenter de 30 min.
- Lipoaspirat installe généralement en trois couches, avec de l'huile au sommet, en gras dans le milieu, et le sang au fond. Aspirer et jeter la couche d'huile supérieure et la couche de sang bas.
- Pour retirer davantage tout en restant tumescfluide ent ou des débris de cellules, Centrifugeuse la graisse pendant 5 min à 350 xg et 4 ° C, et aspirer la couche aqueuse inférieure.
- Calculer la quantité de graisse nécessaire pour le greffage, permettant 20% d'erreur de livraison, et de transférer le volume souhaité de la graisse à 50 ml conique (s). Multiplier par 400 le nombre de souris dans l'étude pour obtenir microlitres de graisse nécessaire pour le greffage.
- À ce stade, si la cellule effectuer assistée Lipotransfer 20,21, lieu volume de graisse pour le greffage sur la glace. Puis récolter les cellules stromales dérivées du tissu adipeux (CSA) de la graisse restante en utilisant la technique standard décrite par Zuk et al 22.
2. Fat greffage
- Obtenir femelle, homozygote souris CD-1 nue pour l'étude expérimentale. Choisissez souris entre 8-12 semaines d'âge.
- Pour induire une anesthésie, le lieu souris dans une boîte de knockdown avec le mélange isoflurane / oxygène de 2,5% à 2 L / min pendant environ 10 min. Se il vous plaît noter que ISOF recommandéelurane dose varie avec la souche de souris.
- Lorsque le taux de la souris de la respiration a ralenti, confirmer sédation adéquate avec une pincée d'orteil. Appliquer vétérinaire pommade ophtalmique lubrifiante pour les deux yeux de souris.
- Si la souris ne bronche pas en réponse à pincement de l'orteil, ce qui confirme un plan suffisante de l'anesthésie. Placez le nez de la souris dans une ogive prestation mélange isoflurane / oxygène de 2,5% à 1-2 L / min. Si la souris se rétracte de pincement de l'orteil, retourner à la boîte démontable et retest après 5 min.
- Mettre en place la souris sous champ stérile, puis stériliser cuir chevelu avec 2,5% de povidone-iode, suivie par une solution d'éthanol à 70%. Répéter deux autres fois.
- Placez draps chirurgicaux sur la souris et veiller à maintenir champ stérile. Instruments stériles, des gants et PPE devraient être utilisés à tout moment.
- Si le volume de graisse pour être greffé a été précédemment mis sur la glace, permettra la graisse d'abord se adapter à la température ambiante avant la livraison.
- Un backloading 1 ml seringue Luer-Lok avec 1 mlde matières grasses.
- Raccorder une 14 G, 8 cm de long canule graisse greffage à l'extrémité de la seringue.
- Premier système en appuyant sur le piston de la seringue jusqu'à ce que entre 200 et 400 ul de graisse reste dans la seringue. Tout en appuyant sur le piston de la seringue confirmer que la canule est entièrement rempli avec de la graisse par l'observation de la graisse sortant du trou de la canule distale.
- En utilisant des pinces fines, soulever la peau du dos sur la ligne médiane recouvrant la caudale aspect le plus du crâne. Faire un 1,5 mm, découpées dans la peau à l'aide de ciseaux fins.
- Placez une seule suture 6-0 de nylon dans milieu de la coupe qui sera ensuite utilisé pour amener bords de la plaie ensemble après greffage est effectué. Ne pas attacher la suture.
- Créer une poche sous-cutanée sur le crâne en insérant la canule à travers l'incision de la peau et passer la canule avant en arrière dans un motif en forme d'éventail sur le crâne pour libérer les pièces jointes du tissu conjonctif de la peau sus-jacente.
- Une fois que la poche a été créée, placez le cAnnula sur la ligne médiane de la souris directement sur le crâne jusqu'à ce que la pointe se trouve au-rostrale aspect le plus de la poche qui devrait être juste derrière une ligne tracée entre les yeux. (Figure 1A)
- Injecter lentement la graisse de façon rétrograde, avancer le plongeur tout en tirant la canule arrière. En utilisant des pinces, amener les bords de la plaie ensemble et les soulever pour garder toute la graisse de se échapper de la poche.
- Attachez le fil de suture qui a été précédemment placé, se assurer que le premier nœud se trouve légèrement contre la peau. Attachez trois autres noeuds carrés et couper le fil de suture avec une queue de 3 mm. (Figure 1B)
- Confirmez avec la visualisation et la palpation manuelle que la poche ne est pas surchargé et la peau recouvrant la poche ne est pas tendue. Si la poche a été trop rempli, couper la suture et enlever tout le gras de l'intérieur de la poche. Laver la poche avec tampon phosphate salin (PBS) pH 7,4 et réinjecter un plus petit volume de graisse.
- Retirer la souris à partir d'unenesthesia et lieu sur le dos ou sur le côté dans une cage propre par lui-même. Surveiller l'animal pour la respiration régulière, les mouvements normaux, absence de saignements, et des signes de douleur ou de détresse. Administrer la buprénorphine à 0,1 mg / kg par voie sous cutanée toutes les 6 h jusqu'à 48 h si l'animal est dans la douleur.
- Assurez-vous que l'animal est réveillé suffisamment pour maintenir décubitus sternal avant de le laisser sans surveillance. Ne pas placer l'animal dans une cage avec les autres animaux jusqu'à ce qu'il ait totalement récupéré.
- Après 4 heures, se assurer que l'animal est capable de manger et de boire, de déplacer et de respirer normalement et qu'il n'y a pas de saignement du site opératoire. Retournez à l'établissement de soins des animaux.
3. Micro-CT
- Souris Scan for volume de base par jour post-opératoire 3, puis répéter les analyses aux semaines post-opératoires 2, 4, 6 et 8.
- Lorsque l'imagerie de la souris à chaque point de temps, suivre les directives de sédation et de soins des animaux avant et après la procédure comme indiqué précédemment dans S02.02 à 02.04 et de 02.17 à 02.19 Teps.
- Effectuer des analyses sur un scanner micro-CT avec une taille de voxel la reconstruction de 100 um ou mieux.
- Avec un pic kilovoltage rayons X de 80 kVp et un courant anodique de 450 uA, administrer une dose d'environ 5 ration centiGy pendant un balayage de 9 min à chaque souris. Se il vous plaît noter que ces valeurs varient en fonction du protocole de balayage.
- Avant de procéder à la première analyse, calibrer micro-CT avec un fantôme d'imagerie qui distingue entre l'air, l'eau, et l'intensité de l'os.
- Placez quatre souris dans scanner dans la position ventrale avec deux souris sur le dessus et deux sur le fond. Un lit de balayage peut facilement être construit en utilisant 60 ml seringues pour maintenir le corps de la souris et de 10 ml seringues que des cônes de nez 23.
- Maintenir souris sous anesthésie avec un mélange isoflurane / oxygène de 2,5% à 1-2 L par minute.
- Confirmez image dépisteur que l'ensemble du crâne de la souris, du nez à la première vertèbre cervicale, et du haut du crâne à la base du skull, sera imagé.
4. Analyse Micro-CT
- Ouvrez les images reconstruites avec un logiciel de micro-imagerie CT analyse qui permet la création de régions d'intérêt (ROI) en sélectionnant voxels en utilisant des seuils pour l'intensité de pixel. Le logiciel permet également la création de surfaces 3D par l'interpolation des voxels sélectionnés, et pour l'analyse du volume.
- Commencez par charger les images tomodensitométriques reconstruites en deux dimensions (2D) coronale, axiale, et une vue sagittale. (Figure 2A)
- Utilisation de la coupe axiale comme un guide, accédez à la coupe sagittale qui correspond à l'aspect le plus à gauche de la greffe de graisse. Sélectionner un seuil supérieur et inférieur pour l'intensité du pixel qui saisit tous les voxels correspondant à la greffe de graisse, mais qui exclut le tissu et l'os environnant. (Figure 2B)
- Définir un retour sur investissement dans la vue sagittale qui correspond à la greffe de graisse à l'aide de seuils d'intensité de pixel précédemment définies. REPEAT cette procédure chaque cinquième coupe sagittale, la navigation jusqu'à la plus à droite aspect du greffon est atteint. (Figure 2C)
- Interpole voxels sélectionnés de tous 2D ROI en une seule, combinée ROI 3D. (Figure 2D)
- Volume de ROI enregistrement calculée par le logiciel.
- Rendre l'isosurface 3D pour visualiser le volume final de greffe de graisse. (Figure 2E)
- Dans les analyses ultérieures, être sûr de garder le maximum d'intensité de pixel et les valeurs de seuil minimum les mêmes que ceux utilisés pour l'analyse de base.
5. Fat récolte
- Après les souris ont été numérisés pour la semaine 8 24,25 point de temps, anesthésier les souris comme décrit précédemment ci-dessus dans les étapes 2.2 à 2.4 et 2.17 à 2.19.
- Conformément aux lignes directrices de l'APLAC, euthanasier les souris en séparant leurs colonnes vertébrales.
- Placez la souris dans le champ opératoire. Avec des ciseaux de ténotomie, ouvrir soigneusement la poche et disséquer til recouvrant la peau et les pièces jointes du tissu conjonctif de la greffe de graisse.
- À ce stade, il peut aider à exciser un patch de la peau recouvrant dorsale pour faciliter l'extraction de la greffe. (Figure 3A)
- Maintenir légèrement traction sur la greffe avec une pince et tournez la greffe d'un côté à l'autre pour visualiser les points successifs de tension qui doivent être libérés avec des ciseaux.
- Rester aussi près que possible du greffon lors de l'excision de minimiser le tissu conjonctif prise avec le greffon. (Figure 3B)
- Après excision greffe, mesurer la masse sur une échelle taré qui est une précision d'au moins 0,01 grammes.
- Calculer le volume de la greffe de graisse en utilisant la valeur mesurée de masse et la densité moyenne de la graisse humaine (0,9 g / ml) en tant que taux de conversion.
- Comparer volume calculé de greffe de graisse à celle obtenue à l'aide de micro-CT.
- Greffe de graisse peuvent être traitées pour l'histologie ou une analyse plus approfondie si nécessaire.
Résultats
Greffe de graisse progressivement diminué en volume sur le cours de l'étude, résultant de la survie moyenne de 62,2% par semaine 8. (figure 4A) 24 À la fin de l'analyse Semaine 8, chaque greffe de graisse a été extrait en une seule pièce. Un test rang Wilcoxan somme a été utilisée pour comparer la différence entre les mesures de volume de greffe de graisse obtenus soit par micro-CT ou calculées de la masse physique. Aucune différence significative n'a été observée entre ces deux méthodes (p recto verso -VALEUR = 0,9362). (Figure 4B)
Avec 5 centiGy par balayage et cinq points de temps de balayage, chaque souris a reçu pas plus d'un total de 25 centiGy au cours de l'étude. Conformément à cela, aucune des souris affiche aucune preuve brut de brûlures par irradiation cutanées.

Figure 1. (A) A 14 G canule sur une seringue de 1 ml, positionné sur la ligne médiane et à la rostral-plus aspect de la poche avant le début de l'injection de graisse. (B) de la souris Nude sur la greffe de graisse terminé, avec une seule suture de nylon utilisé pour amener plaie bords ensemble. La poche a été remplie mais ne est pas tendue.

Figure 2. (A) Les images reconstruites initialement affichées dans axial, coronal et sagittal vues. (B) Utilisation de la vue axiale comme un guide pour naviguer à l'aspect le plus à gauche de la greffe sur la vue sagittale. Fixer un seuil pour l'intensité de pixel de sorte que tous les voxels sélectionnés dans la plage de seuil représentera le tissu adipeux, donc permettre la délimitation du volume de greffe de graisse. (C) de ROI définie sur vue sagittale à partir de l'aspect le plus à gauche de la greffe et continue jamaiscinquième tranche y déplacer à l'autre extrémité de la greffe. (D) Tous les voxels sélectionnés de la 2D ROI interpolée en un seul ROI 3D. (E) Une surface en trois dimensions a été créée en utilisant cubique interpolation spline de visualiser les volumes totaux de greffe de graisse .
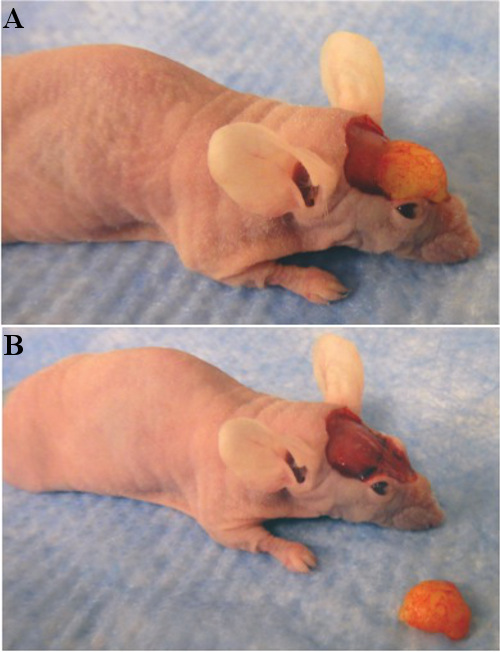
Figure 3. (A) Fat greffe avant explantation, avec le patch dorsale de peau enlevée. (B) Fat greffe après explantation.

Figure 4. Analyse (A) Micro-CT volumétrique démontré perte progressive du volume de greffe de graisse plus de huit semaines. (B) volumes de greffe de graisse finales, tel que mesuré par micro-CT, correspond étroitement aux volumes calculés à partir des masses de greffe de graisse explantées. La densité moyenne de la graisse humaine (0,9 g / ml) a été utilisé en tant que taux de conversion.

Tableau 1. Calculé Micro-CT Volume vs réelle mesurée Fat Volume 24
Discussion
Jusqu'à ce point, la plupart des chercheurs se sont appuyés sur les modalités non-imagerie pour quantifier la survie à long terme de la greffe de graisse, mais ces méthodes nécessitent le sacrifice de l'animal de l'étude et produire une seule mesure. 3,10-12 Notre étude représente une méthode d'analyse qui permet une meilleure objectif, la quantification en temps réel de la survie du greffon de graisse dans un modèle de souris.
Critique dans ce processus est de se assurer que les souris suffisamment immunodéprimés sont utilisés pour l'étude, car cela empêche le rejet de greffe qui se produirait si les souris dont le système immunitaire est intact sont utilisés. Préserver l'intégrité de graisse est essentiel lors de la récolte, la transformation, et les phases de placement de greffage. En conformité avec les normes traditionnellement acceptées, la graisse pour le greffage doit être obtenu par aspiration liposuccion assistée (SAL). Lors du placement, la graisse doit être injecté à un débit constant pas plus vite que 0,5 ml / sec. Une canule de calibre 14 est préférable pour le greffage ina souris, mais canules de plus grand diamètre peuvent être utilisés sans aucun préjudice à la graisse. Les petites canules et aiguilles, surtout ceux inférieures à 16 jauge sont découragés pendant le placement car ils peuvent provoquer la graisse à la dégradation due à l'augmentation du stress de cisaillement. Bien que nous décrivons notre technique préférée pour le traitement ci-dessus, ne importe quelle combinaison de sédimentation, centrifugation et / ou filtration peut être utilisé aussi longtemps que les couches d'huile et de sang sont suffisamment séparés à partir de la graisse avant le greffage.
Greffe de graisse doivent être d'au moins 200 pi de taille pour minimiser la variance dans les résultats en raison de la nature inégale de la greffe de graisse. Grandes greffes jusqu'à 400 pi de taille peuvent être utilisés, mais supérieur à ce volume, alimentation vasculaire rénale et une tension excessive de la peau peut entraîner dans la graisse et de la nécrose de la peau. En fin de compte, la taille maximale de greffe de graisse sera déterminé par la surface et le volume de la poche. Pour augmenter le volume d'une greffe qui peut être livré en toute sécurité, le poprise située peut être étendu par plus vaste dissection. Toutefois, cela peut placer la graisse au-delà des frontières de la partie supérieure du crâne, ce qui rendra le contraste entre le greffon et le tissu moins claire environnante. Ainsi, le choix de voxel ultérieure deviendra plus difficile.
Si incision initiale de la peau est suffisamment petit, un fil de suture ne soit pas nécessaire tant que la graisse reste contenue et ne est pas considérée se échapper de la poche. Si un fil de suture est placé, il faut prendre soin de ne pas lier le premier nœud trop serré, sinon dégradation de la peau peut se produire. Monofilament suture non absorbable tel que le nylon est préféré, car il limite la réaction inflammatoire et est moins susceptible d'abriter une infection. Ré-épithélialisation de l'incision aura lieu dans les 24 à 48 heures après l'opération, et la suture peut être supprimé à ce moment. Sutures absorbables tressés et ne doivent pas être utilisés. La peau doit toujours être manipulé avec le moins de force nécessaire, et le chirurgien devrait prendre soin de ne pas écraser la peautout en maintenant en place bords de la plaie.
Selon imagerie du logiciel d'analyse des enquêteurs, la relation exacte entre l'intensité de pixel et la densité du tissu peut varier. Les enquêteurs devraient choisir les seuils d'intensité de pixel pour obtenir une portée maximale et minimale qui distingue le plus fidèlement la greffe de graisse du tissu environnant. Les mêmes valeurs de seuil maximum et minimum doivent être utilisés pendant tout le volume des analyses afin de maintenir la cohérence.
Il existe plusieurs méthodes pour sélectionner le volume de greffe, une fois les valeurs de seuil d'intensité de pixel ont été fixés. Bien que nous trouvons la peinture avec un outil pinceau dans la vue sagittale mieux dans nos mains, d'autres méthodes de sélection de voxel de créer un retour sur investissement peut être utilisé comme dessin avec l'outil de spline ou la peinture dans la vue axiale. Il est préférable si une seule personne effectue toutes volume analyse aussi cohérente que possible afin de réduire l'erreur de mesure.
Le non-caractère invasif de la méthode et la visualisation en temps réel de l'évolution de greffage offrent des avantages significatifs par rapport aux techniques traditionnelles. Cependant, cette technique est limitée dans sa capacité à identifier la viabilité et la santé des greffes restantes. En outre, il ne peut pas démontrer revascularisation relative des greffes. Bien que des changements dans l'apparence et la densité de greffe peuvent allusion à la nécrose adipeuse, l'infection, la formation de kystes, ou de la liquéfaction, il est difficile de tirer des conclusions exactes à partir de micro-CT seul.
Nous espérons que cette technique servira de base sur laquelle de futures études peuvent être menées pour mieux comprendre les facteurs étiologiques de la survie du greffon et la perte de graisse. Des variations sur ce thème peuvent élucider le rôle que les cellules souches, les facteurs de croissance, des cytokines, des gènes et des marqueurs de surface cellulaire jouer dans la conservation du volume final de la greffe de graisse. Avec cet outil amélioré pour tester des hypothèses contrastées, nous nous réjouissons à une meilleure compréhension du transfert de graisse qui transforms une technique capricieuse pour le traitement des déficits des tissus mous en un système plus prévisible.
Déclarations de divulgation
None of the authors have any competing financial interest to report.
Remerciements
Cette étude a été soutenue par la Fondation Oak, le Laboratoire Hagey for Pediatric médecine régénérative, et l'Institut national de la santé, subventions NIHR21DE019274, NIHR01DE019434, NIHR01DE021683 et NIHU01HL099776 à MTLDCW a été soutenu par la bourse de recherche ACS Franklin H. Martin Faculté, le Hagey Laboratoire de médecine régénérative pédiatrique, et la Faculté Scholar Award Child Health Research Institute de l'Université de Stanford. Micro-CT a été menée au Centre de Stanford pour l'innovation en imagerie in vivo.
matériels
| Name | Company | Catalog Number | Comments |
| SAL lipoaspirate | |||
| Centrifuge | Beckman Coulter, Inc., Pasadena, CA | ||
| 50 ml conical tubes | BD Biosciences, San Jose, CA | ||
| CD-1 nude mice (Crl:CD1-Foxn1nu) | Charles River Laboratories, Inc., Wilmington, MA | ||
| Isoflurane | Henry Schein, Dublin, OH | ||
| 2.5% Betadine | Purdue Pharma, L.P., Stamford, CT | ||
| 70% Ethanol solution | Gold Shield, Hayward, CA | ||
| 1cc luer-lock syringe | BD Biosciences, San Jose, CA | ||
| 14 gauge cannula | Shippert Medical, Centennial, CO | ||
| Forceps | Fine Science Tools, Heidelberg, Germany | ||
| Tenotomy scissors | Fine Science Tools, Heidelberg, Germany | ||
| 6-0 nylon suture | Ethicon, Blue Ash, OH | ||
| Phosphate buffered saline | Gibco, Carlsbad, CA | ||
| micro-CT scanner | Siemens Healthcare, Pleasanton, CA | ||
| Phantom | TriFoil Imaging, Northridge, CA | ||
| Imaging analysis software | IRW, Siemens Healthcare, Pleasanton, CA | ||
| Scale | Mettler-Toledo International, Inc., Columbus, OH |
Références
- Gir, P., et al. Fat grafting: evidence-based review on autologous fat harvesting, processing, reinjection, and storage. Plast Reconstr Surg. 130 (1), 249-258 (2012).
- Kaufman, M. R., et al. Autologous fat transfer national consensus survey: trends in techniques for harvest, preparation, and application, and perception of short- and long-term results. Plast Reconstr Surg. 119 (1), 323-331 (2007).
- Smith, P., et al. Autologous human fat grafting: effect of harvesting and preparation techniques on adipocyte graft survival. Plast Reconstr Surg. 117 (6), 1836-1844 (2006).
- Eppley, B. L., Dadvand, B. Injectable soft-tissue fillers: clinical overview. Plast Reconstr Surg. 118 (4), 98e-106e (2006).
- Yarborough, J. M. The treatment of soft tissue defects with injectable collagen. Am J Med Sci. 290 (1), 28-31 (1985).
- Baumann, D. P., Butler, C. E. Soft tissue coverage in abdominal wall reconstruction. Surg Clin North Am. 93 (5), 1199-1209 (2013).
- Tukiainen, E. Chest wall reconstruction after oncological resections. Scand J Surg. 102 (1), 9-13 (2013).
- Zan, T., et al. Surgical treatment of facial soft-tissue deformities in postburn patients: a proposed classification based on a retrospective study. Plast Reconstr Surg. 132 (6), 1001e-1014e (2013).
- Bucky, L. P., Percec, I. The science of autologous fat grafting: views on current and future approaches to neoadipogenesis. Aesthet Surg J. 28 (3), 313-321 (2008).
- Lee, J. H., et al. The effect of pressure and shear on autologous fat grafting. Plast Reconstr Surg. 131 (5), 1125-1136 (2013).
- Kirkham, J. C., et al. The impact of liposuction cannula size on adipocyte viability. Ann Plast Surg. 69 (4), 479-481 (2012).
- Medina, M. A., et al. 3rd et al. Polymer therapy: a novel treatment to improve fat graft viability. Plast Reconstr Surg. 127 (6), 2270-2282 (2011).
- Horl, H. W., Feller, A. M., Biemer, E. Technique for liposuction fat reimplantation and long-term volume evaluation by magnetic resonance imaging. Ann Plast Surg. 26 (3), 248-258 (1991).
- Har-Shai, Y., Lindenbaum, E. S., Gamliel-Lazarovich, A., Beach, D., Hirshowitz, B. An integrated approach for increasing the survival of autologous fat grafts in the treatment of contour defects. Plast Reconstr Surg. 104 (4), 945-954 (1999).
- Fontdevila, J., et al. Assessing the long-term viability of facial fat grafts: an objective measure using computed tomography. Aesthet Surg J. 28 (4), 380-386 (2008).
- Meier, J. D., Glasgold, R. A., Glasgold, M. J. Autologous fat grafting: long-term evidence of its efficacy in midfacial rejuvenation. Arch Facial Plast Surg. 11 (1), 24-28 (2009).
- Coleman, S. R. Structural fat grafts: the ideal filler. Clin Plast Surg. 28 (1), 111-119 (2001).
- Coleman, S. R. Structural fat grafting: more than a permanent filler. Plast Reconstr Surg. 118 (3 Suppl), 108S-120S (2006).
- Pu, L. L., Coleman, S. R., Cui, X., Ferguson, R. E., Vasconez, H. C. Autologous fat grafts harvested and refined by the Coleman technique: a comparative study. Plast Reconstr Surg. 122 (3), 932-937 (2008).
- Matsumoto, D., et al. Cell-assisted lipotransfer: supportive use of human adipose-derived cells for soft tissue augmentation with lipoinjection. Tissue Eng. 12 (12), 3375-3382 (2006).
- Yoshimura, K., Suga, H., Eto, H. Adipose-derived stem/progenitor cells: roles in adipose tissue remodeling and potential use for soft tissue augmentation. Regen Med. 4 (2), 265-273 (2009).
- Zuk, P. A., et al. Multilineage cells from human adipose tissue: implications for cell-based therapies. Tissue Eng. 7 (2), 211-228 (2001).
- Habte, F., et al. Impact of a multiple mice holder on quantitation of high-throughput MicroPET imaging with and without Ct attenuation correction. Mol Imaging Biol. 15 (5), 569-575 (2013).
- Chung, M. T., et al. Micro-computed tomography evaluation of human fat grafts in nude mice. Tissue Eng Part C Methods. 19 (3), 227-232 (2013).
- Thanik, V. D., et al. A murine model for studying diffusely injected human fat. Plast Reconstr Surg. 124 (1), 74-81 (2009).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon