Method Article
Detecção de
Neste Artigo
Resumo
Este protocolo demonstra como Ensaio de Proximidade A ligadura pode ser utilizada para detectar em interacções proteína-proteína in situ na junção neuromuscular, de larvas de Drosophila. Com esta técnica, os discos grande e Hu-li Shao tai são apresentados para formar um complexo na região pós-sináptica, uma associação previamente identificado por meio de co-imunoprecipitação.
Resumo
Discs large (Dlg) is a conserved member of the membrane-associated guanylate kinase family, and serves as a major scaffolding protein at the larval neuromuscular junction (NMJ) in Drosophila. Previous studies have shown that the postsynaptic distribution of Dlg at the larval NMJ overlaps with that of Hu-li tai shao (Hts), a homologue to the mammalian adducins. In addition, Dlg and Hts are observed to form a complex with each other based on co-immunoprecipitation experiments involving whole adult fly lysates. Due to the nature of these experiments, however, it was unknown whether this complex exists specifically at the NMJ during larval development.
Proximity Ligation Assay (PLA) is a recently developed technique used mostly in cell and tissue culture that can detect protein-protein interactions in situ. In this assay, samples are incubated with primary antibodies against the two proteins of interest using standard immunohistochemical procedures. The primary antibodies are then detected with a specially designed pair of oligonucleotide-conjugated secondary antibodies, termed PLA probes, which can be used to generate a signal only when the two probes have bound in close proximity to each other. Thus, proteins that are in a complex can be visualized. Here, it is demonstrated how PLA can be used to detect in situ protein-protein interactions at the Drosophila larval NMJ. The technique is performed on larval body wall muscle preparations to show that a complex between Dlg and Hts does indeed exist at the postsynaptic region of NMJs.
Introdução
Discos de Drosophila grande (Dlg) é um membro conservada da guanilato-quinase associada à membrana da família de proteínas de andaimes que ajudam a orquestrar a montagem de grandes complexos de proteínas em sítios específicos da membrana plasmática. Originalmente identificado como uma proteína supressora de tumor, Dlg serve como um importante determinante da epitelial 1,2,3 apicobasal polaridade. Dlg também serve como um importante módulo de andaime na junção neuromuscular (JNM) dos neurônios motores glutamatérgicos durante o desenvolvimento larval 4. Dlg desempenha diversos papéis na JNM larval, e a sua pleiotropismo depende da sua capacidade de se associar com várias proteínas de 5,6. Uma dessas proteínas é Hu-li tai Shao (HTS), um homólogo às adducins mamíferos que foram descritos principalmente no que diz respeito às suas funções na regulação da actina-spectrin citoesqueleto 7. Foi previamente mostrado que Dlg e Hts pode formar um complexo com os outros com base em testes in vitro experimentos co-imunoprecipitação envolvendo toda mosca adulta lisados 8. Uma desvantagem destes resultados, no entanto, é que elas não indicam onde este formas complexas. Com a utilização de imuno-histoquímica, as distribuições de Dlg e Hts são observados a sobrepor-se na membrana pós-sináptica da NMJs larvas, mas são eles em um complexo na região 8? Como mostrado recentemente e detalhado mais aqui, Proximity Ligation Assay (PLA) é usado para procurar um em associação situ entre Dlg e Hts especificamente no larval NMJ 27.
PLA é uma técnica relativamente nova usado principalmente em cultura de células e de tecidos que podem detectar interacções proteína-proteína in situ 9. Neste ensaio, os anticorpos primários contra as duas proteínas de interesse são detectados com um par de anticorpos secundários específicos da espécie, denominados sondas de PLA, que são conjugados com oligonucleótidos (Figura 1A, B). Se as duas proteínass estão em estreita proximidade uns dos outros (isto é, dentro de poucas dezenas de nanómetros), a distância entre as sondas de PLA podem ser ligados em ponte através de hibridação de dois oligonucleótidos de conectores adicionais (Figura 1C). Neste conformação, as extremidades livres dos oligonucleótidos do conector está perto o suficiente para entrar em contacto uns com os outros, e uma molécula de ADN circular, fechada pode ser formada a partir de ligadura situ (Figura 1D). A molécula de ADN circular, serve como molde para a amplificação in situ círculo rolante, o qual é preparado por um dos oligonucleótidos conjugados com as sondas de PLA (Figura 1E). Sequências dentro do amplificado, produto de ADN concatemeric resultante pode então ser visualizado com marcada com fluorescência, as sondas de oligonucleótidos complementares (Figura 1F). Uma vez que o ADN amplificado permanece ligado a uma das sondas de PLA, a localização subcelular da interacção proteína-proteína withind tecido pode ser facilmente determinada.
Vários métodos são comumente usados para detectar interacções proteína-proteína, incluindo técnicas in vitro tais como a co-imunoprecipitação, ensaios de pull-down e levedura de rastreio de dois híbridos, e em técnicas in vivo, tais como transferência de energia de ressonância de Förster (FRET) e Bimolecular Complementação de fluorescência ( BiFC). Um problema das técnicas in vitro é que eles não identificam onde a interacção ocorre endogenamente, enquanto o acima mencionados nas técnicas in vivo envolvem a expressão artificial de proteínas de fusão que pode não reflectir o comportamento nativo dos seus homólogos endógenos. Uma grande vantagem de PLA é que ele é capaz de determinar dentro de um tecido a localização subcelular de proteínas de interactores endógenos que estão em estreita proximidade uns dos outros e provável que formam um complexo, com o grau de proximidade necessária para gerar um sinal a ser comparáveis aos FRET e BiFC. PLA podem detectar interacções com elevada especificidade e sensibilidade devido ao acoplamento de reconhecimento do anticorpo e a amplificação de ADN. Assim, o ensaio pode gerar sinais luminosos discretas, em forma de pontos lacrimais que indicam a posição exacta da interacção. Além disso, os antigénios dificilmente visíveis pode ser detectada. Finalmente, PLA é uma técnica relativamente simples de executar, e já não tem do que um procedimento padrão imuno-histoquímico para ser concluído. Portanto, PLA fornece uma vantagem técnica sobre outros ensaios de interação proteína-proteína que muitas vezes são atormentados com tempos de preparação longa e extensa solução de problemas.
Este protocolo demonstra como PLA pode ser aplicado para a Drosophila larval JNM para a finalidade de detecção de interacções proteína-proteína endógenos, in situ. Aqui, PLA é realizada em preparações de músculos da parede do corpo larval onde Dlg e Hts são mostrados para realmente existem em um complexo na região pós-sináptica da NMJs. PLA não tenha sido previamente utilizado para estudar a NMJ larval, e existem, actualmente, apenas um punhado de artigos publicados que utilizaram este ensaio no tecido Drosophila. Espera-se que uma maior exposição do PLA para a comunidade Drosophila resultará em aumento da sua utilização como uma ferramenta adicional para complementar outras, mais comumente utilizados ensaios de interação proteína-proteína.
Protocolo
1. Corpo de parede Preparação
NOTA: Preparação do terceiro estádio larvar paredes do corpo (para estudo de NMJs que enervam os músculos da parede corporal) foi realizada como previamente descrito em Brent et al 10, ou Ramachandran e Budnik 11,12, mas com algumas modificações..
- Dissecação
- Elevar existências mosca e cruzes, a 25 ° C durante cinco a seis dias, utilizando 13 procedimentos standard.
- Escolha rastejando larvas de terceiro instar de frascos ou garrafas usando uma pinça fina.
- Lavar as larvas numa pequena placa de Petri contendo tampão de fosfato salino (PBS) para remover quaisquer partículas de alimento.
- Coloque uma única larva em um disco Sylgard e mergulhá-lo em algumas gotas de PBS gelado. Usando PBS gelado vai ajudar atordoar o larva tornando mais fácil de manipular. Ao longo do esvaziamento, assegurar que a preparação está sempre submersa em PBS para evitar que sequem.
- Posicione a larva com o seu lado dorsal voltada para cima, de modo que as duas vias de traqueais são visíveis sob um microscópio de dissecção (Figura 2A). Usando a pinça para agarrar um pino minutien, fixar a larva para baixo na extremidade posterior, perto das spiracles (Figura 2B). Com um outro pino, furar através da cutícula na extremidade anterior perto dos ganchos na boca. Delicadamente, esticar a larva no sentido longitudinal, em seguida, fixá-lo para baixo (Figura 2B).
- Com uma tesoura microdissecção, aperte a extremidade posterior perto do pino para criar uma pequena abertura. A incisão deve ser superficial apenas o suficiente para passar através da cutícula.
- Colocar a ponta da lâmina inferior das tesouras na incisão, cortado ao longo de todo o comprimento da linha média dorsal entre as duas vias de traqueal (Figura 2C). Aponte as lâminas da tesoura ligeiramente para cima quando o corte para evitar danificar os músculos da parede ventral do corpo.
- Faça uma pequena incisão horizontal ligeiramente anterior para o cargoeriorly pino colocado (Figura 2C). Fazer uma outra incisão semelhante ligeiramente posterior ao pino colocado anteriormente (Figura 2C). As incisões deve apenas passar através da cutícula.
NOTA: As três incisões de passos 1.1.7 e 1.1.8 combinados deve assemelhar-se um " "Quando concluído, ou seja, uma aba esquerda e da direita à mão no lado dorsal do corpo larval deve ser produzido.
"Quando concluído, ou seja, uma aba esquerda e da direita à mão no lado dorsal do corpo larval deve ser produzido. - Limpe cuidadosamente os órgãos internos com a pinça. Adicionando algumas gotas contundentes de PBS vai ajudar a substituir os órgãos fora do corpo larval, tornando assim mais fácil para removê-los. Evite cutucando o corpo larval como ele irá causar danos aos músculos da parede do corpo.
- Desfraldar o corpo larval aberto e fixam os cantos para baixo (Figura 2D). Quando fixando, esticar a parede do corpo, tanto horizontal como verticalmente para formar um rectângulo uniformemente-tensionada (SEe Figura 2G para a forma), tomando cuidado para não rasgar os músculos da parede do corpo no processo.
- Terminar de remover qualquer restantes órgãos internos (Figura 2E).
- Fixação e permeabilização
- Mergulhe as paredes do corpo preso em várias gotas de solução de Bouin. Incubar por 15 min no gelo. Alternativamente, usar 4% de paraformaldeído (PFA) como um fixador alternativo; incube durante 30 min.
- Lavar três vezes com tampão fosfato salina com Triton (PBT).
- Usando uma pinça fina, retire cuidadosamente os pinos e transferir as paredes do corpo por seus cantos em um siliconized 0,65 ml tubo de microcentrífuga.
- Armazenar as paredes do corpo em PBT a 4 ° C até estar pronto para o PLA. Para melhores resultados, comece imunocolora�o as paredes do corpo dentro de um ou dois dias de dissecção.
NOTA: Para economizar nos reagentes e para assegurar que todas as paredes do corpo são tratados da mesma forma durante o ensaio, diferentes genótipos podem ser colocados em uma únicatubo. Os genótipos podem ser distinguidos através do corte dos cantos das paredes do corpo de forma diferente (ver Figura 2F para exemplos).
2. A imuno-histoquímica
NOTA: A imunocoloração de terceiro estádio larvar paredes do corpo foi realizada como previamente descrito em Brent et al 14 e Ramachandran e Budnik 11, mas com algumas modificações 11,14..
NOTA: Execute todas as etapas à temperatura ambiente e com agitação suave, salvo indicação contrária.
- Bloqueio
- Lavam-se as paredes do corpo com PBT três vezes durante 10 minutos cada.
- Bloquear com 1% de Albumina de Soro Bovino (BSA) durante 1 h.
- Immunostaining
- Incubar as paredes do corpo com anticorpos de ratinho e de coelho primárias contra as duas proteínas de interesse (diluídos em 1% de BSA) durante 2 horas à temperatura ambiente, ou durante a noite a 4 ° C. Neste caso, usar 1:10 rato anti-Dlg e 1: 250 de um coelhonti-HtsM 15,16. Os anticorpos contra os marcadores que não são feitos em rato ou coelho também podem ser incluídos - por exemplo, usar 1: 200 de cabra anti-HRP para delinear as membranas neuronais.
- Lavar três vezes com PBT durante 10 min cada.
- Incubar com anticorpos secundários conjugados com um fluoróforo para detectar os marcadores (diluídos em 1% de BSA) durante 2 horas à temperatura ambiente, ou durante a noite a 4 ° C. Como o sinal de PLA é depois visualizada com um fluoróforo vermelho, outro fluoróforo deve ser usada para detectar o marcador - por exemplo, usar 1: 200 conjugado com FITC anti-cabra para detectar o anticorpo de cabra anti-HRP. Devido ao uso de reagentes sensíveis à luz, manter os tubos no escuro a partir deste ponto.
NOTA: O kit que é usado para PLA permite a ser realizada entre os anticorpos primários desenvolvidos no rato e coelho, com o sinal visualizado no canal vermelho sob microscopia confocal. Se desejado, outros kits disponíveis que permitem o ensaio deve ser feito com primary anticorpos desenvolvidos em outras espécies, e o sinal visualizado em outros canais.
3. Proximidade Ligation Assay
NOTA: Execute todas as etapas à temperatura ambiente e com agitação suave, salvo indicação contrária.
- PLA Sondas
- Lavam-se as paredes do corpo com PBT três vezes durante 10 minutos cada.
- Incubar com sondas PLA (1: 5 de cada diluição em 1% de BSA) durante 2 horas a 37 ° C. Neste caso, usar 40 ul de sonda de PLA anti-ratinho MENOS, 40 ul de sonda de PLA anti-coelho PLUS e 120 ul de BSA a 1% para assegurar a imersão adequada e mistura de 5-10 paredes do corpo. Até uma diluição das sondas PLA 01:25 ainda pode resultar em uma proporção adequada de sinal-para-ruído (isto é, para esta experiência).
- Ligadura
- Lave as paredes do corpo com Wash Buffer A duas vezes por 5 min cada.
- Incubar com solução Ligadura (diluição 1:40 de ligase em tampão de ligação) durante 1 hora umat 37 ° C. Neste caso, utilizar 5 ul de ligase, 40 ul de tampão de 5 ligadura e 155 ul de água de pureza elevada para assegurar a imersão adequada e mistura de 5-10 paredes do corpo.
- Amplificação
- Lave as paredes do corpo com Wash Buffer A duas vezes para 2 min cada.
- Incubar com solução Amplificação (diluição 1:80 em tampão de polimerase da amplificação) durante 2 horas a 37 ° C. Neste caso, usar 2,5 ul de polimerase, 40 ul de tampão de 5 Amplificação e 157,5 uL de água de pureza elevada para assegurar a imersão adequada e mistura de 5-10 paredes do corpo.
- Preparação para criação de imagens
- Lave as paredes do corpo com tampão de lavagem B duas vezes por 10 min cada.
- Lavar com 0.01x Wash Buffer B uma vez para 1 min.
- Equilibrar com algumas gotas de solução de montagem para, pelo menos, 30 min antes da montagem, ou armazenar durante a noite a 4 ° C.
- Usando uma pinça fina, transferir cuidadosamente as paredes do corpo sobre uma lâmina de plataforma wom suas cutículas voltado para baixo. Posicione as paredes do corpo em fileiras e com a mesma orientação dentro de uma gota ou duas de montagem. Coloque uma 22 mm x 40 milímetros lamela sobre a preparação tomando cuidado para não gerar bolhas de ar, em seguida, selar o slide com unhas polonês claro.
- Guarde os slides no escuro a -20 ° C até que esteja pronto para a imagem latente confocal.
Resultados
Em selvagens terceiro estádio NMJs larvais, Dlg é predominantemente encontrado na membrana pós-sináptica de tipo I boutons glutamatérgicos, com níveis de imunorreatividade Dlg sendo mais pronunciada na boutons tipo Ib que o tipo é boutons (Figura 3A) 4. Hts está presente em todo o músculo, mas concentra-se na região pós-sináptica com Hts níveis imunorreatividade aparecendo igual em ambos os tipos I boutons, e também é encontrada pré-sináptico (Figura 3A ') 8,17. Note-se que as distribuições de Dlg e Hts se sobrepõem em grande parte na região pós-sináptica (Figura 3A '') 8.
Para determinar se Dlg e Hts existem num complexo com o JNM, PLA entre as duas proteínas foi realizada no corpo de larvas de preparações de músculo da parede. Para este ensaio, um anticorpo de ratinho anti-Dlg que detecta o segundo domínio PDZ no N-terminal e um anticorpo de coelho anti-HtsMque detecta o domínio da MARCKS-homologia ao terminal C foram usadas 15,16. No tipo selvagem, sinal PLA entre Dlg e Hts foi observada especificamente no JNM (Figura 3C-C ''). O sinal principalmente localizadas circunferencialmente à membrana pré-sináptica de boutons de tipo I, que foi demarcadas por Hrp, indicando assim que Dlg e Hts estão em estreita proximidade uns dos outros e, provavelmente formar um complexo na região pós-sináptica. O resultado foi determinado como sendo específico como o nosso controlo negativo, envolvendo HTS 01.103 NMJs mutantes que carecem de Hts imunorreactividade (Figura 3B-B ''), não apresentaram sinais de PLA observável (Figura 3D) 8,17,18. Além disso, o PLA realizada sem a adição do anticorpo de coelho anti-HtsM produzido nenhum sinal (dados não mostrados). Visualizações alta ampliação dos boutons revelou que Dlg e Hts immunoreactivity grosseiramente sobrepostas na região do pós-sináptica (Figura 3E), Ao passo que o PLA entre as duas proteínas resultou em pontos lacrimais discreto indicando que apenas um subconjunto das proteínas totais Dlg e Hts estão em complexo (Figura 3F).
Para testar a fiabilidade de PLA como uma ferramenta para estudar o JNM larval, nós também avaliadas as interacções entre a serina / treonina-quinase activada por p21, Pak, e outras proteínas sinápticas 19. Anteriores experiências de co-imunoprecipitação mostraram que Pak é um membro do complexo Rabisco, dos quais Dlg é também um membro 20. No tipo selvagem NMJs, Pak se localiza a densidade pós-sináptica (Figura 4A, C), onde ele é necessário para a localização de Dlg 15,21. As distribuições de imunorreactivas Pak e Dlg sobrepõem na região pós-sináptica (Figura 4A ''), e PLA entre as duas proteínas resultaram num sinal positivo especificamente no JNM (Figura 4B). Estes resultados indicam que as duas proteínas estão em c perde proximidade uns dos outros e são provavelmente formar um complexo nesta região. Outra proteína sináptica testado por nós complexo Pak ligação foi Wingless (GP), o ligando Drosophila Wnt, que desempenha várias funções no NMJ 22. No tipo selvagem, Wg é enriquecido nos lados pré-sinápticos e pós-sinápticos do tipo I BOUTONS, mas também está presente como pontos lacrimais por todo o citoplasma muscular (Figura 4C ') 23. Curiosamente, apesar de as distribuições de imunorreactivas Pak e Wg parcialmente sobreposta na região pós-sináptica (Figura 4C ''), PLA entre as duas proteínas não produziu qualquer sinal observável (Figura 4D). Portanto, Pak e Wg não estão em estreita proximidade uns dos outros na NMJ. Este resultado demonstra que nem todas as proteínas que mostram as imunorreactividades de sobreposição através de experiências de co-localização tradicionais irá gerar um sinal de PLA, e serve como um controlo negativo adicional.
ent "fo: manter-together.within-page =" always ">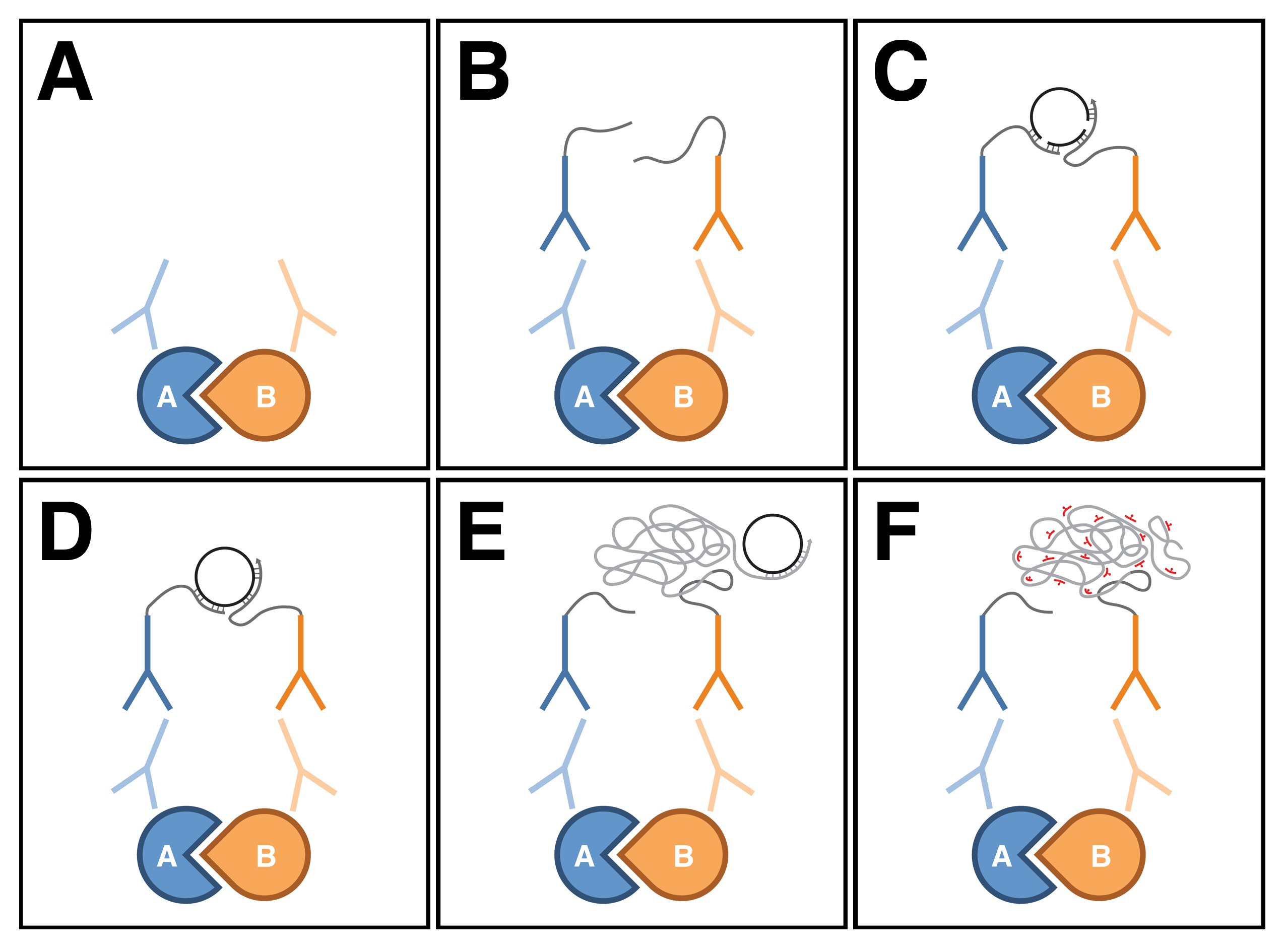
Figura 1: Diagrama esquemático da Proximity Ligation Assay. (A) Os anticorpos primários para ligar as duas proteínas de interesse, usando procedimentos de imuno-histoquímica padrão. (B) Os anticorpos primários são então detectados com um par de anticorpos secundários específicos da espécie, denominados sondas de PLA, que são conjugados com oligonucleótidos. (C) Se as duas proteínas estão em estreita proximidade uns dos outros, a distância entre as sondas de PLA podem ser ligados em ponte através de hibridação de dois oligonucleótidos de conectores adicionais. (D) Neste conformação, os oligonucleótidos do conector pode formar uma molécula de ADN circular, fechada em cima, em ligação situ (E). A molécula de ADN circular, serve como molde para amplificação em círculo rolante in situ, que é preparado por um dos oligonucleotides conjugados com as sondas de PLA. Sequências (F) no interior do produto de ADN amplificado são então detectados com fluorescentemente marcado, sondas de oligonucleótidos complementares. Note-se que a figura foi baseada em Weibrecht et al. 24. Por favor, clique aqui para ver uma versão maior da figura.

Figura 2: Preparação do terceiro estádio larvar paredes do corpo. (AF) desenhos esquemáticos que representam uma dissecção da parede do corpo. (A) Colocar uma única larva num disco Sylgard com o seu lado dorsal voltada para cima, de modo que as duas vias de traqueais são visíveis. (B) Pino da larva para baixo nas extremidades anterior e posterior com pinos minutien, esticando a larva no sentido longitudinal no processo. (C) Faça três incisões no lado dorsal do corpo larval com tesoura microdissection. As incisões deve se parecer com um '' eu '' quando concluído. (D) Desfralda o corpo larval aberto e fixam os cantos para baixo, que se estende da parede do corpo horizontalmente e verticalmente no processo para formar um retângulo uniformemente-tensionadas. (E) Limpo fora todos os restantes órgãos internos. (F) apresentadas são exemplos das diferentes maneiras de cortar o canto das paredes do corpo, a fim de distinguir os diferentes genótipos. (G) Vista de uma preparação da parede do corpo esticado quando concluído. A foto foi tirada com uma câmera digital montado em um microscópio de dissecação. Barra de escala no painel de F representa um milímetro. Note-se que a figura foi baseada em Ramachandran e Budnik, 2010 12. Por favor, clique aqui para ver uma versão maior da figura.
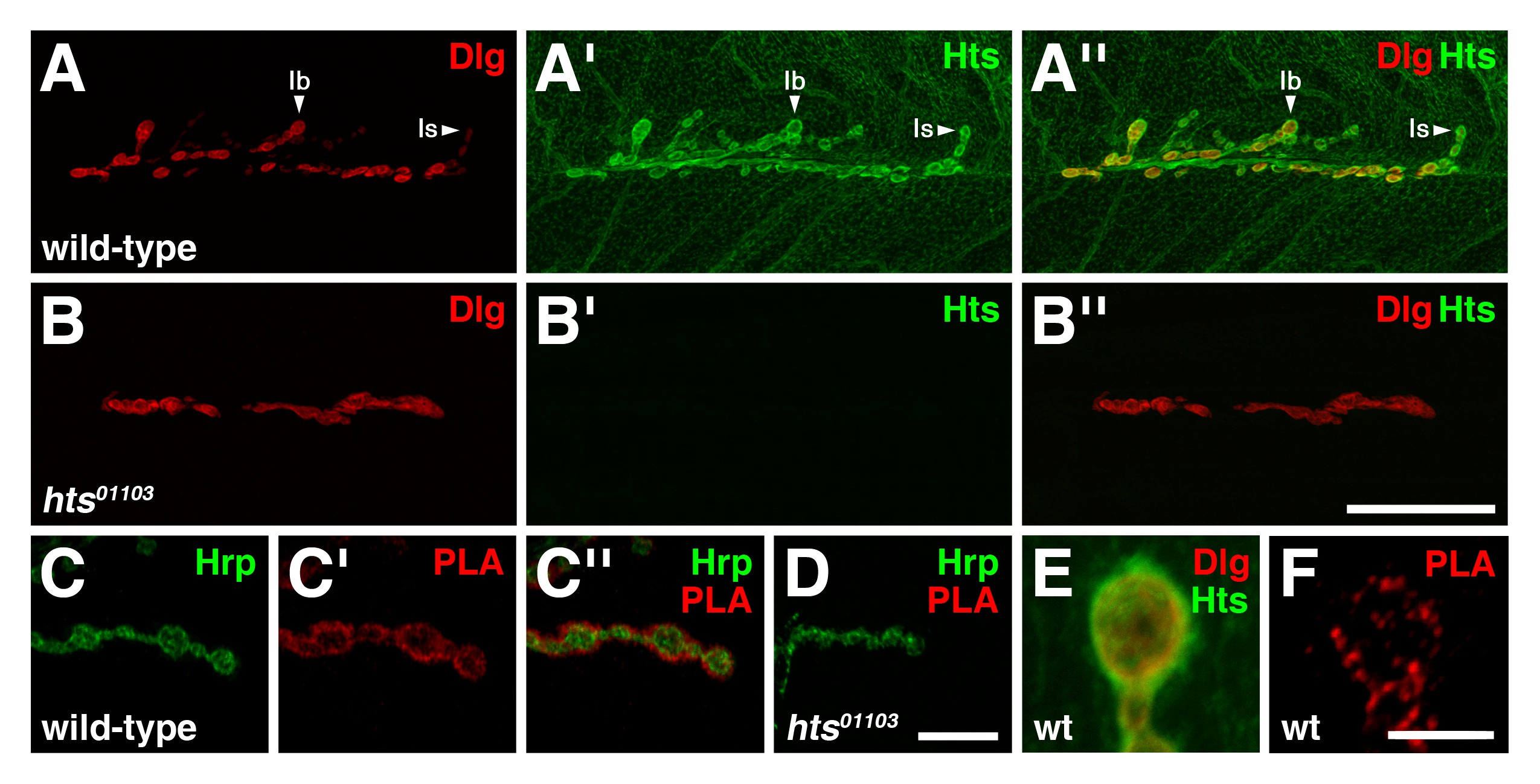
Figura 3: Dlg e Hts existir em um complexo na região pós-sináptica da NMJs larvais (AB '') Distribuições de Dlg (vermelho) e Hts (verde) no tipo selvagem e hts NMJs mutantes (AA. '') Em selvagem. -tipo NMJs, Dlg encontra-se predominantemente na membrana pós-sináptica da I boutons tipo, com níveis Dlg sendo mais acentuado no tipo Ib que é boutons. Hts está presente em todo o músculo, mas também se concentra em torno da região pós-sináptica, com níveis Hts sendo semelhante em ambos os tipos I boutons. As distribuições de Dlg e Hts sobrepõem na região pós-sináptica. (BB '') mutante NMJs para hts falta Hts immunoreactivity. Note-se que o hts 01103 efeitos de mutação NMJ ramificação 8. (CD '') PLA entre Dlg e Hts (vermelho) Realizada na de tipo selvagem e mutantes hts NMJs. Hrp é utilizado para marcar a membrana neuronal (verde). São mostrados os pontos de vista de alta ampliação de alguns boutons. (CC '') no tipo selvagem, sinal PLA é observada especificamente no NMJ. O sinal é principalmente localizadas circunferencialmente à membrana pré-sináptica de boutons tipo I, indicando que Dlg e Hts estão em estreita proximidade uns dos outros e existir num complexo na região pós-sináptica. (D) para o HTS NMJs mutante não apresentaram sinais de PLA observável. (EF) Mostram-se vistas de alta ampliação de boutons individuais. (E) e Hts Dlg imunorreactividade sobreposição grosseiramente na região pós-sináptica. (F) PLA entre Dlg e Hts resulta em pontos lacrimais distinta, indicando que apenas um subconjunto das proteínas estão em um complexo . Barra de escala no Painel B '' representa 40 pm (AB ''); barra de escala no Painel D '' representa 10 um (CD ''); scale bar no Painel F representa 5 m (EF). Todos os NMJs mostrados são de músculos 6/7 do segmento abdominal 4. As imagens foram tomadas como pilhas mescladas usando uma Nikon A1R varredura a laser confocal microscópio com software NIS-Elements, e processadas com o Adobe Photoshop. Por favor, clique aqui para ver uma versão maior do figura.
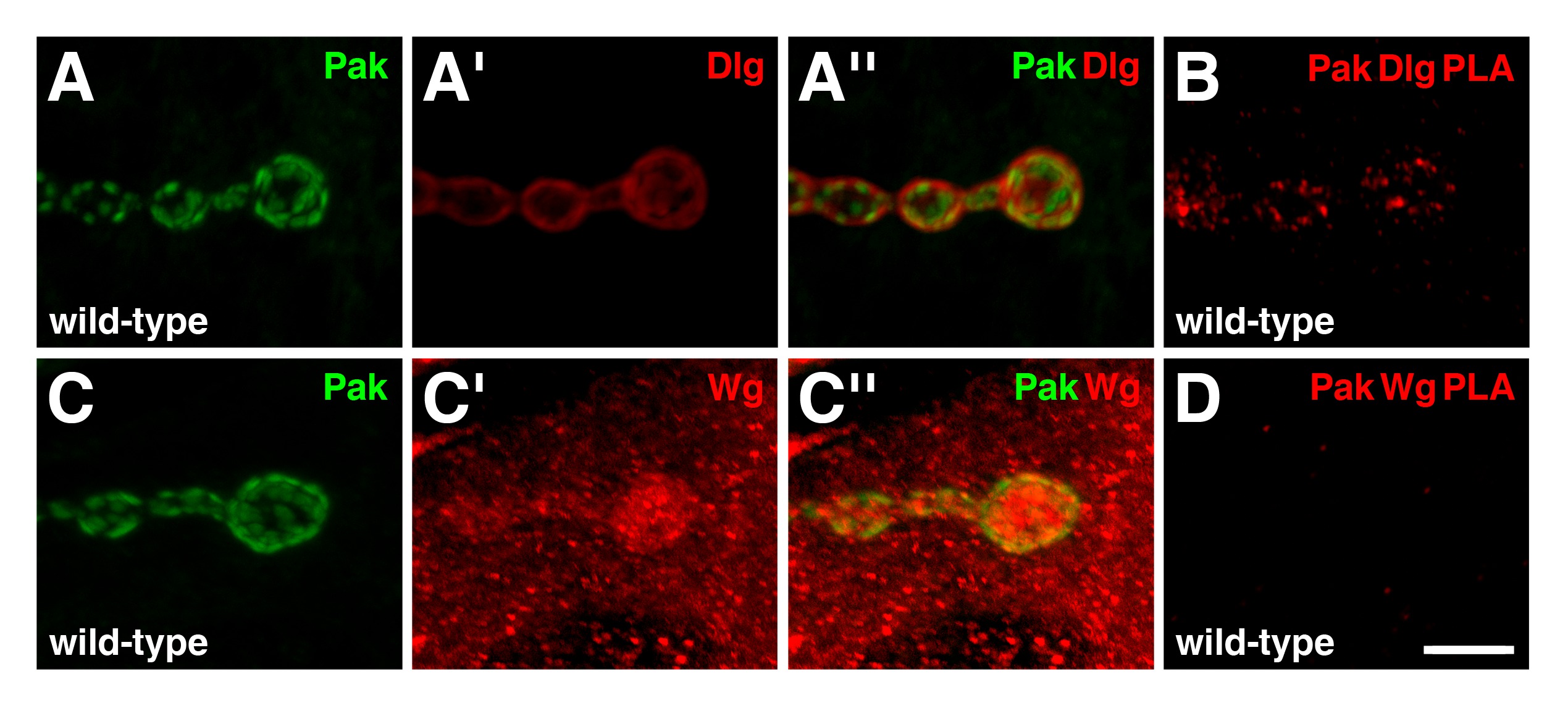
Figura 4: Pak existir num complexo com Dlg, mas não Wg, na região pós-sináptica do NMJs larvares (AD) Mostram-se vistas de alta ampliação de algumas boutons (AA '') Distribuições de Pak (verde) e Dlg (.. vermelho) do tipo selvagem em NMJs. Pak se localiza a densidade pós-sináptica. Note-se que as distribuições imunoreactivos de Pak e Dlg sobrepõem na região pós-sináptica. (B) PLA bntre Pak e Dlg (vermelho) realizada on-tipo selvagem NMJs. Sinal de PLA é especificamente observado no JNM, indicando que as duas proteínas estão em estreita proximidade uns dos outros nesta região. As distribuições de Pak (verde) e Wg (vermelho) do tipo selvagem em NMJs (CC ''). Wg é enriquecida em ambos os lados pré-sinápticos e pós-sinápticos do JNM, mas também está presente como pontos lacrimais ao longo do músculo. Note-se que a distribuição de imunorreactivo Pak é também observada a sobrepor-se parcialmente com Wg na região pós-sináptica. (D) entre o PLA e Wg Pak (vermelho) realizado no tipo selvagem NMJs. Não há sinal de PLA específica é observado, indicando que as duas proteínas não estão em estreita proximidade uns dos outros no JNM apesar das suas distribuições sobrepostas. Barra de escala no Painel D representa 5 m (AD). Todos os NMJs inervam músculos 6/7 do segmento abdominal 4. As imagens foram tomadas como pilhas mescladas usando uma Nikon A1R varredura a laser confocal microscópio com software NIS-Elements, e processed com Adobe Photoshop. Por favor, clique aqui para ver uma versão maior da figura.
Discussão
Este relatório demonstra como PLA pode ser aplicado para a Drosophila larval JNM. O ensaio é realizado em preparações de músculo da parede do corpo de larvas para a finalidade de detecção de interacções proteína-proteína endógenos presentes na NMJ. Com esta técnica, Dlg e Hts mostram-se em estreita proximidade uns dos outros, e assim existir em um complexo, especialmente na região pós-sináptica 27. Em apoio a esse resultado, um estudo anterior tenha apresentado provas de sua associação com os seguintes dados: 1) as distribuições imunoreactivos de Dlg e Hts sobrepõem na região pós-sináptica da NMJs larvais, 2) Dlg e Hts formar um complexo com base em co- experimentos de imunoprecipitação envolvendo toda mosca adulta lisados, e 3) Dlg e Hts interagir tanto epitelial e junções sinápticas 8. Sinal de PLA na região pós-sináptica também foi observada entre Dlg e Pak, uma interacção anteriormente identificadas em outros estudos, proporcionando assim a continuação credence de usar este ensaio, na JNM 15,20,21. Curiosamente, PLA entre Pak e WG resultou em nenhum sinal observável, mesmo que suas distribuições imunoreactivos sobreposto no NMJ. Este resultado demonstra que nem todas as proteínas que mostram as distribuições sobrepostas imunorreactivas irá gerar um sinal de PLA, por conseguinte, indicando que o PLA oferece uma resolução mais elevada na detecção de interacções proteína-proteína de estudos de co-localização tradicionais.
Várias alterações foram feitas com o protocolo PLA origem para optimizar o ensaio para o JNM larval (dados não mostrados) 9,25. Em primeiro lugar, determinou-se que 1% de BSA é um melhor agente de bloqueio para as paredes do corpo, em vez da Solução de Bloqueio fornecida. Em segundo lugar, para produzir uma forte relação sinal-ruído, imersão apropriado e mistura das paredes do corpo nas soluções de reacção é crítica. Um mínimo de 200 ul durante cinco a dez paredes do corpo, num tubo de microcentrífuga de 0,65 ml foi considerado suitable quando incubação com o PLA sondas, ligase ou polimerase, embora os volumes podem ser aumentados em consonância ao processar mais paredes do corpo. A intensidade do sinal foi também melhorada através do aumento dos tempos de reacção de 30 minutos durante os tempos recomendados. Em terceiro lugar, foi realizado um teste de diluição em série de sondas de PLA para optimizar o equilíbrio entre a conservação de reagentes e a intensidade do sinal. Para as experiências realizadas neste relatório, até uma diluição de 1:25 - do recomendado diluição 1: 5 - ainda pode produzir uma razão razoável de sinal-para-ruído. Observe que a optimização das reacções de ligação e amplificação não foram realizadas. Finalmente, como PLA pode ser sensível a alterações minutos, é altamente recomendável que os diferentes genótipos de uma única experiência são colocados num único tubo, de modo que os controlos e as experiências são tratados da mesma forma durante o ensaio. Os genótipos podem ser distinguidos através do corte dos cantos das paredes do corpo de maneira diferente.
Several métodos são usados para detectar Drosophila interacções proteína-proteína de levedura, incluindo o rastreio de dois híbridos, co-imunoprecipitação e de FRET. Mas como é que esses métodos comparar com PLA e sua capacidade de visualizar interações proteína-proteína in situ? A levedura de dois híbridos pode detectar a ligação directa entre as proteínas de Drosophila expressas em levedura, e que tem sido utilizado em telas de todo o genoma de alto rendimento. Embora muitas das interações identificadas são biologicamente relevante, o ensaio, muitas vezes produz falsos positivos. Além disso, os falsos negativos podem ocorrer por várias razões: as proteínas são fundidas a domínios de factor de transcrição que possam interferir com a ligação, muitas interacções requerem modificações pós-tradução que não ocorrem na levedura, e o núcleo (onde tem lugar o ensaio) pode não ser um ambiente adequado para algumas interações para formar corretamente. Tais questões não são encontrados com PLA como ele lida com as proteínas endógenas na sua ambi nativaente. Um método que pode ser utilizado para detectar interacções entre proteínas endógenas co-imunoprecipitação. As experiências que envolvem lisados de Drosophila podem revelar o tecido e fase no ciclo de vida em que ocorre uma interacção. No entanto, como a formação de lisado envolve rompimento das células para extrair as proteínas, as células dentro do tecido em que a interacção ocorre no, bem como sua localização subcelular, não pode ser avaliado - ao contrário do PLA. Além disso, a co-imunoprecipitação detecta complexo proteína de ligação e não pode distinguir quais as proteínas do complexo são em estreita proximidade uns dos outros. Existem métodos tais como FRET disponíveis para Drosophilists que permitem a visualização de interacções proteína-proteína dentro da célula. No entanto, FRET envolve a sobre-expressão de proteínas transgênicas fundidos com marcadores fluorescentes e podem não refletir o comportamento proteína endógena como no PLA.
Apesar de suas vantagens, há alguns limitatíons quando usando PLA. Uma tal limitação é a disponibilidade de anticorpos primários contra as proteínas de interesse que são feitas em diferentes espécies. Este problema pode ser facilmente contornada com a utilização de proteínas transgénicas marcados, embora eles não podem ser verdadeiramente representativos da interacção endógeno. Outra questão é que o PLA pode produzir falsos negativos, por exemplo, quando os dois anticorpos primários estericamente dificultar o outro ou quando o epitopo de um dos anticorpos primários envolve o sítio de interacção proteína-proteína. Além disso, embora o PLA detecta proteínas que estão em estreita proximidade uns dos outros, mas não distingue entre as interacções proteína-proteína, directos e indirectos, ensaios em contrário suspensos levedura e rastreio de dois híbridos. Além disso, o PLA entre proteínas endógenas não irá identificar domínios que são responsáveis pela interacção. Assim, outros ensaios de interacção proteína-proteína ainda que serão necessários para caracterizar completamente a interacção molecularly.
Os investigadores começaram a usar microscopia super-resolução para mapear a arquitetura espacial da Drosophila larval JNM, com resoluções de dezenas de nanômetros sendo alcançado 26. PLA, com a sua resolução molecular comparável, deve proporcionar um baixo custo, tecnicamente simples complemento a esses estudos que ajudarão na construção de uma visão detalhada da organização das inúmeras proteínas no NMJ.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Agradecemos ao Bloomington Drosophila da Center for fornecendo stocks de voar. Agradecemos também a estudos de desenvolvimento Hybridoma Banco e Dr. Lynn Cooley (Yale University) para a prestação de anticorpos. Um agradecimento especial vai para AhHyun Yoo por sua ajuda no manuscrito. Este trabalho foi financiado por doações de Ciências Naturais e Engenharia Research Council of Canada (Krieger), o William e Ada Fundo Aço Isabelle (Krieger), e os Institutos Canadenses de Pesquisa em Saúde (Harden).
Materiais
| Name | Company | Catalog Number | Comments |
| Forceps (fine #5) | Almedic | A10-704 | |
| Sylgard Disc | World Precision Instruments | SYLG184 | Mix elastomer base and curing agent in a 10:1 ratio. Set for 30 min. Pour into a mold (e.g. use a 12-well cell culture plate). Let cure for at least 24 hr. Adhere to the lid of a 60 x 15 mm Petri dish lid when dissecting. |
| Minutien Pins (0.0125 mm tip diameter) | Fine Science Tools | 26002-10 | |
| Microdissection Scissors (ultra fine) | Fine Science Tools | 15200-00 | |
| Platform Slides | Glue two 22 x 22 mm2 coverslips onto a microscope slide with clear nail polish, leaving a <20 mm gap in between for sample mounting. | ||
| w1118 | Bloomington Drosophila Stock Center | 3605 | |
| hts01103 | Bloomington Drosophila Stock Center | 10989 | Stock was re-balanced over a GFP balancer so that homozygous mutants can be selected based on the absence of GFP signal. |
| 1x PBS (Phosphate Buffered Saline): 3 mM NaH2PO4, 7 mM Na2HPO4, 130 mM NaCl, pH 7.0 | NaH2PO4 (Caledon Laboratories - 8180-1), Na2HPO4 (Caledon - 8120-1), NaCl (Caledon - 7560-1) | ||
| Bouin's Solution | Sigma-Aldrich | HT10132 | |
| 4% PFA (Paraformaldehyde): 4% PFA in 1x PBS | PFA (Anachemia Science - 66194-300). See doi:10.1101/pdb.rec9959 Cold Spring Harb Protoc 2006 for instructions on how to make the solution. | ||
| [header] | |||
| 1x PBT (Phosphate Buffered Saline with Triton): 1x PBS with 0.01% Triton | Triton X-100 (Sigma-Aldrich - T8787) | ||
| 1% BSA (Bovine Serum Albumin): 1% BSA in 1x PBT | BSA (Bioshop Canada - ALB001). Store at 4 °C. | ||
| mouse anti-Dlg (Discs large) | Developmental Studies Hybridoma Bank | 4F3 | Use at a 1:10 dilution in 1% BSA. |
| rabbit anti-HtsM (Hu-li tai shao) | Provided by Dr. Lynn Cooley (Yale University). Use at a 1:250 dilution in 1% BSA. | ||
| rabbit anti-Pak (p21-activated kinase) | Provided by Dr. Nicholas Harden (Simon Fraser University). Use at a 1:500 dilution in 1% BSA. | ||
| mouse anti-Wg (Wingless) | Developmental Studies Hybridoma Bank | 4D4 | Use at a 1:5 dilution in 1% BSA. |
| goat anti-Hrp (Horseradish peroxidase) | Jackson ImmunoResearch | 123-065-021 | Use at a 1:200 dilution in 1% BSA. |
| FITC-conjugated donkey anti-goat | Jackson ImmunoResearch | 705-095-003 | Use at a 1:200 dilution in 1% BSA. |
| Duolink In Situ PLA Probe anti-mouse MINUS | Sigma-Aldrich | DUO92004 | |
| Duolink In Situ PLA Probe anti-rabbit PLUS | Sigma-Aldrich | DUO92002 | |
| Duolink In Situ Detection Reagents Red | Sigma-Aldrich | DUO92008 | |
| 1x Wash Buffer A: 0.01 M Tris, 0.15 M NaCl, 0.05% Tween 20, pH 7.4 | Sigma-Aldrich | DUO82049 | Tris (Caledon Laboratories - 8980-1), NaCl (Caledon - 7560-1), Tween 20 (Fisher Scientific - BP337) |
| 1x Wash Buffer B: 0.2 M Tris, 0.1 M NaCl, pH 7.5 | Sigma-Aldrich | DUO82049 | Tris (Caledon Laboratories - 8980-1), NaCl (Caledon - 7560-1) |
| 0.01x Wash Buffer B: 2 mM Tris, 1 mM NaCl, pH 7.5 | Sigma-Aldrich | DUO82049 | Tris (Caledon Laboratories - 8980-1), NaCl (Caledon - 7560-1) |
| Duolink In Situ Mounting Medium with DAPI | Sigma-Aldrich | DUO82040 | |
Referências
- Woods, D. F., Bryant, P. J. The discs-large tumor suppressor gene of Drosophila encodes a guanylate kinase homolog localized at septate junctions. Cell. 66, 451-464 (1991).
- Yamanaka, T., Ohno, S. Role of Lgl/Dlg/Scribble in the regulation of epithelial junction, polarity and growth. Front Biosci. 13, 6693-6707 (2008).
- Humbert, P. O., et al. Control of tumourigenesis by the Scribble/Dlg/Lgl polarity module. Oncogene. 27, 6888-6907 (2008).
- Lahey, T., Gorczyca, M., Jia, X. X., Budnik, V. The Drosophila tumor suppressor gene dlg is required for normal synaptic bouton structure. Neuron. 13, 823-835 (1994).
- Ataman, B., Budnik, V., Thomas, U. Scaffolding proteins at the Drosophila neuromuscular junction. Int Rev Neurobiol. 75, 181-216 (2006).
- Thomas, U., Kobler, O., Gundelfinger, E. D. The Drosophila larval neuromuscular junction as a model for scaffold complexes at glutamatergic synapses: benefits and limitations. J Neurogenet. 24, 109-119 (2010).
- Matsuoka, Y., Li, X., Bennett, V. Adducin: structure, function and regulation. Cell Mol Life Sci. 57, 884-895 (2000).
- Wang, S., et al. Drosophila adducin regulates Dlg phosphorylation and targeting of Dlg to the synapse and epithelial membrane. Dev Biol. 357, 392-403 (2011).
- Soderberg, O., et al. Characterizing proteins and their interactions in cells and tissues using the in situ proximity ligation assay. Methods. 45, 227-232 (2008).
- Brent, J. R., Werner, K. M., McCabe, B. D. Drosophila larval NMJ dissection. J Vis Exp. (24), (2009).
- Ramachandran, P., Budnik, V. Immunocytochemical staining of Drosophila larval body-wall muscles. Cold Spring Harb Protoc. 2010, (2010).
- Ramachandran, P., Budnik, V. Dissection of Drosophila larval body-wall muscles. Cold Spring Harb Protoc. , (2010).
- Ashburner, M. . Drosophila: A Laboratory Manual. , (1989).
- Brent, J., Werner, K., McCabe, B. D. Drosophila larval NMJ immunohistochemistry. J Vis Exp. (25), (2009).
- Parnas, D., Haghighi, A. P., Fetter, R. D., Kim, S. W., Goodman, C. S. Regulation of postsynaptic structure and protein localization by the Rho-type guanine nucleotide exchange factor dPix. Neuron. 32, 415-424 (2001).
- Petrella, L. N., Smith-Leiker, T., Cooley, L. The Ovhts polyprotein is cleaved to produce fusome and ring canal proteins required for Drosophila oogenesis. Development. 134, 703-712 (2007).
- Pielage, J., Bulat, V., Zuchero, J. B., Fetter, R. D., Davis, G. W. Hts/Adducin controls synaptic elaboration and elimination. Neuron. 69, 1114-1131 (2011).
- Spradling, A. C., et al. The Berkeley Drosophila Genome Project gene disruption project: Single P-element insertions mutating 25% of vital Drosophila genes. Genetics. 153, 135-177 (1999).
- Bokoch, G. M. Biology of the p21-Activated Kinases. Annu Rev Biochem. 72, 743-781 (2003).
- Bahri, S., et al. The leading edge during dorsal closure as a model for epithelial plasticity: Pak is required for recruitment of the Scribble complex and septate junction formation. Development. 137, 2023-2032 (2010).
- Albin, S. D., Davis, G. W. Coordinating structural and functional synapse development: postsynaptic p21-activated kinase independently specifies glutamate receptor abundance and postsynaptic morphology. J Neurosci. 24, 6871-6879 (2004).
- Koles, K., Budnik, V. Wnt signaling in neuromuscular junction development. Cold Spring Harb Perspect Biol. 4, (2012).
- Packard, M., et al. The Drosophila Wnt, wingless, provides an essential signal for pre- and postsynaptic differentiation. Cell. 111, 319-330 (2002).
- Weibrecht, I., et al. Proximity ligation assays: a recent addition to the proteomics toolbox. Expert Rev Proteomics. 7, 401-409 (2010).
- Thymiakou, E., Episkopou, V. Detection of signaling effector-complexes downstream of bmp4 using PLA, a proximity ligation assay. J Vis Exp. (49), (2011).
- Maglione, M., Sigrist, S. J. Seeing the forest tree by tree: super-resolution light microscopy meets the neurosciences. Nat Neurosci. 16, 790-797 (2013).
- Wang, S., et al. . Biol. Open. 3 (12), 1196-1206 (2014).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados