Method Article
Détection de
Dans cet article
Résumé
Ce protocole montre comment Proximité Ligation Assay peut être utilisé pour détecter des interactions protéine-protéine in situ à la jonction des larves de Drosophila neuromusculaire. Avec cette technique, disques grande et Hu-li shao de tai sont présentés pour former un complexe dans la région post-synaptique, une association préalablement identifiés par co-immunoprécipitation.
Résumé
Discs large (Dlg) is a conserved member of the membrane-associated guanylate kinase family, and serves as a major scaffolding protein at the larval neuromuscular junction (NMJ) in Drosophila. Previous studies have shown that the postsynaptic distribution of Dlg at the larval NMJ overlaps with that of Hu-li tai shao (Hts), a homologue to the mammalian adducins. In addition, Dlg and Hts are observed to form a complex with each other based on co-immunoprecipitation experiments involving whole adult fly lysates. Due to the nature of these experiments, however, it was unknown whether this complex exists specifically at the NMJ during larval development.
Proximity Ligation Assay (PLA) is a recently developed technique used mostly in cell and tissue culture that can detect protein-protein interactions in situ. In this assay, samples are incubated with primary antibodies against the two proteins of interest using standard immunohistochemical procedures. The primary antibodies are then detected with a specially designed pair of oligonucleotide-conjugated secondary antibodies, termed PLA probes, which can be used to generate a signal only when the two probes have bound in close proximity to each other. Thus, proteins that are in a complex can be visualized. Here, it is demonstrated how PLA can be used to detect in situ protein-protein interactions at the Drosophila larval NMJ. The technique is performed on larval body wall muscle preparations to show that a complex between Dlg and Hts does indeed exist at the postsynaptic region of NMJs.
Introduction
Drosophila disques large (DLG) est un élément conservé de la famille guanylate kinase associée à la membrane d'un échafaudage de protéines qui aident à orchestrer l'ensemble de grands complexes de protéines à des sites spécifiques de la membrane plasmique. Initialement identifié comme une protéine suppresseur de tumeur, Dlg sert un déterminant important de l'épithélium 1,2,3 apicobasal de polarité. Dlg sert également un module d'échafaudage majeur à la jonction neuromusculaire (JNM) des neurones moteurs glutamatergiques cours du développement larvaire 4. Dlg joue divers rôles à la JNM des larves, et son pléiotropisme repose sur sa capacité à associer à de multiples protéines 5,6. Une telle protéine est Hu-li tai shao (Hts), un homologue aux adducins mammifères qui ont été décrites principalement en ce qui concerne leurs rôles dans la régulation du cytosquelette d'actine-spectrine 7. Il a été montré précédemment que la DLG et Hts peuvent former un complexe avec l'autre sur la base in vitro expériences de co-immunoprécipitation impliquant toute mouche adulte lysats 8. Un inconvénient de ces résultats, cependant, ce est qu'ils ne indiquent pas où cela formes complexes. Avec l'utilisation de l'immunohistochimie, les distributions de la DLG et sont observés Hts à se chevaucher sur la membrane post-synaptique de la JNM des larves, mais elles sont dans un complexe dans cette région 8? Comme l'a récemment illustré et détaillé plus loin ici, Proximité ligature Assay (PLA) est utilisé pour rechercher une association entre Dlg situ et Hts en particulier au stade larvaire NMJ 27.
PLA est une technique relativement nouvelle utilisée principalement dans la culture de cellules et de tissus qui permet de détecter les interactions protéine-protéine in situ neuf. Dans ce dosage, les anticorps primaires contre les deux protéines d'intérêt sont détectés avec une paire d'anticorps secondaire spécifique à l'espèce, appelées sondes PLA, qui sont conjugués à des oligonucleotides (Figure 1A, B). Si les deux protéiness sont à proximité étroite les uns des autres (ce est à dire au bout de quelques dizaines de nanomètres), la distance entre les sondes attachées PLA peut être comblé par l'hybridation de deux oligonucléotides connecteurs complémentaires (figure 1C). Dans cette conformation, les extrémités libres des oligonucléotides connecteurs sont suffisamment proches pour entrer en contact avec l'autre, et une molécule d'ADN circulaire fermé peuvent être formées sur la ligature en situ (Figure 1D). La molécule d'ADN circulaire sert de matrice in situ pour l'amplification par cercle roulant, qui est amorcée par l'un des oligonucléotides conjugués à des sondes de l'APL (Figure 1E). Les séquences au sein de la amplifiée, un produit d'ADN concatémère résultant peuvent ensuite être visualisées, avec des sondes oligonucléotidiques complémentaires marquées par fluorescence (Figure 1F). Étant donné que l'ADN amplifié reste attaché à l'une des sondes de l'APL, la localisation subcellulaire de la protéine-protéine interaction withitissus na peut être facilement établi.
Plusieurs méthodes sont couramment utilisées pour détecter les interactions protéine-protéine, y compris des techniques in vitro telles que la co-immunoprécipitation, pull-down des essais et de la levure Double hybride, et dans les techniques in vivo telles que le transfert Förster Resonance Energy (FRET) et bimoléculaire complémentation de fluorescence ( BiFC). Un écueil des techniques in vitro, ce est qu'ils ne identifient pas où l'interaction est endogène produit, tandis que les techniques in vivo l'susmentionnés impliquent dans l'expression artificielle de protéines de fusion qui peuvent ne pas refléter le comportement natif de leurs homologues endogènes. Un avantage majeur de PLA est qu'il est capable de déterminer au sein d'un tissu de la localisation subcellulaire des interacteurs protéiques endogènes qui sont à proximité étroite les uns aux autres et susceptibles formant un complexe, avec le degré de proximité nécessaire pour produire un signal comparable à FRET et BiFC. PLA peut détecter des interactions avec une spécificité élevée et une sensibilité due au couplage de la reconnaissance d'anticorps et l'amplification d'ADN. Ainsi, le dosage peut générer des signaux lumineux discrets, sous la forme de points lacrymaux qui révèlent la position exacte de l'interaction. En outre, les antigènes à peine visibles peuvent être détectés. Enfin, le PLA est une technique relativement simple à réaliser, et il ne prend pas plus d'une procédure standard pour compléter immunohistochimique. Par conséquent, PLA offre un avantage technique sur d'autres tests d'interaction protéine-protéine qui sont souvent en proie à des temps de préparation long et vaste dépannage.
Ce protocole montre comment PLA peut être appliquée à la Drosophile larvaire JNM dans le but de détecter les interactions protéine-protéine endogènes in situ. Ici, le PLA est effectuée sur des larves préparations de muscle de la paroi du corps où Dlg et Hts sont présentées d'exister en effet dans un complexe dans la région post-synaptique du NMJs. PLA n'a pas déjà été utilisé pour étudier la JNM des larves, et il ya à l'heure actuelle seule une poignée d'articles publiés qui ont utilisé cette technique dans le tissu drosophile. Il est à espérer que la poursuite de l'exposition de PLA à la communauté Drosophila entraînera dans son utilisation accrue comme un outil supplémentaire pour compléter d'autres, les plus couramment utilisés essais d'interaction protéine-protéine.
Protocole
1. Préparation du corps mur
REMARQUE: Préparation du troisième stade larvaire parois du corps (par étude des NMJs qui innervent les muscles de la paroi du corps) a été réalisée comme décrit précédemment dans Brent et al dix, ou Ramachandran et Budnik 11,12, mais avec quelques modifications..
- Dissection
- Augmenter les stocks et les croix mouche à 25 ° C pendant cinq à six jours en utilisant des procédures standard 13.
- Choisissez ramper troisième stade larvaire de flacons ou bouteilles en utilisant une pince fine.
- Laver les larves dans une petite boîte de Pétri contenant un tampon phosphate salin (PBS) pour éliminer les particules alimentaires.
- Placez une seule larve sur un disque de Sylgard et la plonger dans quelques gouttes de PBS glacé. Utilisation de PBS glacé aidera étourdir la larve qui rend plus facile à manipuler. Tout au long de la dissection, veiller à ce que la préparation est toujours immergé dans du PBS pour l'empêcher de sécher.
- Placez le larva avec sa face dorsale orientée vers le haut de sorte que les deux secteurs de la trachée sont visibles sous un microscope à dissection (figure 2A). En utilisant les forceps pour saisir une broche de minuties, épingler la larve vers le bas à l'extrémité postérieure près des stigmates (figure 2B). Avec une autre épingle, percer à travers la cuticule à l'extrémité antérieure près de l'embouchure crochets. Étirer doucement la larve sur la longueur, puis épingler le bas (figure 2B).
- Avec des ciseaux de microdissection, pincez l'extrémité postérieure près de la broche pour créer une petite ouverture. L'incision doit être assez superficielle juste passer à travers la cuticule.
- Mise en place de la pointe de la lame inférieure des ciseaux dans l'incision, coupé le long de toute la longueur de la ligne médiane dorsale entre les deux voies trachéaux (figure 2C). Dirigez les lames de ciseaux légèrement vers le haut lors de la coupe pour éviter d'endommager les muscles de la paroi ventrale du corps.
- Faire une petite incision horizontale légèrement antérieur au posteeriorly broche placée (figure 2C). Faire une autre incision similaire légèrement postérieure à la broche antérieurement placé (figure 2C). Les incisions doivent simplement passer à travers la cuticule.
NOTE: Les trois incisions des étapes 1.1.7 et 1.1.8 combinés devrait ressembler à un " "Une fois terminé, ce est à dire, un volet de gauche et de droite sur la face dorsale du corps de la larve devrait être produite.
"Une fois terminé, ce est à dire, un volet de gauche et de droite sur la face dorsale du corps de la larve devrait être produite. - Nettoyer soigneusement les organes internes avec la pince. Ajout de quelques gouttes de PBS énergiques aidera déplacer les organes du corps larvaire, rendant ainsi plus facile de les enlever. Évitez piquer le corps des larves car il risque d'endommager les muscles de la paroi du corps.
- Déroulez le corps des larves ouverte et épinglez les coins vers le bas (Figure 2D). Lorsque l'épinglage, étirer la paroi du corps à la fois horizontalement et verticalement pour former un rectangle uniformément tendu (soie Figure 2G pour la forme), en prenant soin de ne pas déchirer les muscles de la paroi du corps dans le processus.
- Terminer la suppression de tous les organes internes restants (figure 2E).
- Fixation et perméabilisation
- Plonger les parois du corps épinglés dans plusieurs gouttes de solution de Bouin. Incuber pendant 15 min sur la glace. Vous pouvez également utiliser paraformaldéhyde 4% (PFA) comme un autre fixateur; incuber pendant 30 min.
- Rincer trois fois avec du tampon phosphate salin avec du Triton (PBT).
- En utilisant des pinces fines, retirez soigneusement les broches et transférer les parois du corps par leurs coins en 0,65 ml microtube siliconé.
- Conserver les parois du corps dans PBT à 4 ° C jusqu'au moment de PLA. Pour des résultats optimaux, commencer immunocoloration les parois de la caisse dans un jour ou deux de dissection.
REMARQUE: Pour enregistrer sur les réactifs et d'assurer que tous les murs du corps sont traités de manière égale pendant l'essai, différents génotypes peuvent être placés dans un seultube. Les génotypes peuvent être distingués en coupant les coins des parois de la caisse différemment (voir la figure 2F pour des exemples).
2. immunohistochimie
REMARQUE: Immunomarquage de troisième stade larvaire parois du corps a été effectuée comme décrit précédemment dans Brent et al 14 et Ramachandran et Budnik 11, mais avec quelques modifications 11,14..
REMARQUE: Effectuez toutes les étapes à la température ambiante et sous agitation douce, sauf indication contraire.
- Blocage
- Laver les parois du corps avec PBT trois fois pendant 10 minutes chacun.
- Bloquer avec 1% de sérum-albumine bovine (BSA) pendant 1 heure.
- Immunocoloration
- Incuber les parois de la caisse avec la souris et le lapin primaires d'anticorps contre les deux protéines d'intérêt (dilué dans 1% de BSA) pendant 2 h à température ambiante, ou pendant une nuit à 4 ° C. Dans ce cas, utilisez 01:10 souris anti-Dlg et 1: 250 de lapin d'unenti-HtsM 15,16. Les anticorps dirigés contre des marqueurs qui ne sont pas faites chez la souris ou le lapin peuvent également être inclus - par exemple, utiliser 1: 200 de chèvre anti-HRP pour délimiter les membranes neuronales.
- Laver avec PBT trois fois pendant 10 minutes chacun.
- Incuber avec des anticorps secondaires conjugués à un fluorophore à détecter les marqueurs (dilué dans 1% de BSA) pendant 2 h à température ambiante, ou pendant une nuit à 4 ° C. Comme le signal PLA est ensuite visualisée avec un fluorochrome rouge, un autre fluorophore doit être utilisé pour détecter le marqueur - par exemple, en utilisant 1: 200 anti-chèvre conjugué à FITC pour détecter l'anticorps anti-HRP de chèvre. En raison de l'utilisation de réactifs sensibles à la lumière, garder les tubes dans l'obscurité partir de ce point.
REMARQUE: Le kit qui est utilisée permet de PLA à effectuer entre anticorps primaires soulevées dans la souris et le lapin, avec le signal visualisé sur le canal rouge sous microscopie confocale. Si on le souhaite, d'autres kits sont disponibles qui permettent à l'essai à effectuer avec primaanticorps ry soulevées dans d'autres espèces, et le signal visualisées sur d'autres canaux.
3. Proximité ligature Assay
REMARQUE: Effectuez toutes les étapes à la température ambiante et sous agitation douce, sauf indication contraire.
- PLA Sondes
- Laver les parois du corps avec PBT trois fois pendant 10 minutes chacun.
- Incuber avec des sondes PLA (1: 5 de chaque dilution dans 1% de BSA) pendant 2 h à 37 ° C. Dans ce cas, utiliser 40 pi de sonde PLA MOINS anti-souris, 40 pl de sonde PLA anti-lapin PLUS et 120 pi de 1% de BSA pour assurer l'immersion correcte et le mélange de 5-10 parois du corps. Jusqu'à une dilution 1:25 des sondes PLA peut encore se traduire par un rapport adéquat signal-sur-bruit (par exemple, pour cette expérience).
- Ligature
- Laver les parois du corps avec le tampon de lavage A deux fois pendant 5 min chacune.
- Incuber avec une solution de ligature (1h40 de dilution de ligase dans un tampon de ligature) pendant 1 heure unt 37 ° C. Dans ce cas, utiliser 5 ul de ligase, 40 pi de tampon de ligature et 5 155 pi d'eau de haute pureté pour assurer l'immersion approprié et le mélange de 5 à 10 parois de la caisse.
- Amplification
- Laver les parois du corps avec le tampon de lavage A deux fois pour 2 minutes chacun.
- Incuber avec une solution d'amplification (1:80 de dilution dans du tampon de polymerase amplification) pendant 2 heures à 37 ° C. Dans ce cas, utiliser 2,5 pi de la polymérase, 40 pi de tampon 5 Amplification et 157,5 pi d'eau de haute pureté pour assurer l'immersion correcte et le mélange de 5-10 parois du corps.
- Préparation for Imaging
- Laver les parois du corps avec le tampon de lavage B deux fois pour 10 minutes chacun.
- Laver avec 0,01x tampon de lavage B une fois pour 1 min.
- Équilibrer dans quelques gouttes de solution de montage pour au moins 30 min avant le montage ou la conserver pendant une nuit à 4 ° C.
- En utilisant des pinces fines, transférer soigneusement les parois du corps sur une lame de la plateforme wvec leurs cuticules vers le bas. Positionner les parois de la caisse dans des rangées et dans la même orientation à l'intérieur d'une ou deux gouttes de milieu de montage. Placez un 22 mm x 40 mm lamelle sur la préparation en prenant soin de ne pas générer des bulles d'air, puis sceller la lame avec vernis à ongles transparent.
- Conserver les diapositives dans l'obscurité à -20 ° C jusqu'au moment de l'imagerie confocale.
Résultats
Dans de type sauvage troisième stade larvaire NMJs, Dlg est principalement trouvé à la membrane postsynaptique de type I boutons glutamatergiques, avec des niveaux d'immunoréactivité Dlg étant plus marquée dans le type Ib boutons que le type est boutons (figure 3A) 4. Hts est présent tout au long du muscle, mais se concentre dans la région post-synaptique avec Hts niveaux d'immunoréactivité apparaissant égale dans les deux boutons de type I, et se retrouve également présynaptique (figure 3A ') 8,17. Notez que les distributions de Dlg et Hts recoupent largement dans la région post-synaptique (figure 3A '') 8.
Pour déterminer si Dlg et Hts existent dans un complexe à la NMJ, PLA entre les deux protéines a été réalisée sur les préparatifs mur musculaires du corps larvaire. Pour ce dosage, un anticorps anti-souris qui détecte Dlg le deuxième domaine PDZ à l'extrémité N-terminale et un anticorps anti-lapin HtsMqui détecte la MARCKS-domaine d'homologie à l'extrémité C-terminale ont été utilisés 15,16. Dans de type sauvage, le signal PLA entre Dlg et Hts a été observée spécifiquement au NMJ (figure 3C-C ''). Le signal principalement localisé sur la circonférence de la membrane présynaptique de boutons de type I, qui a été démarquée par Hrp, indiquant ainsi que la DLG et Hts sont à proximité les uns aux autres et susceptibles de former un complexe dans la région post-synaptique. Le résultat a été jugée spécifique de notre contrôle négatif, impliquant 01103 hts NMJs mutantes qui ne ont pas Hts immunoréactivité (figure 3B-B ''), n'a montré aucun signal observable PLA (Figure 3D) 8,17,18. En outre, PLA effectuée sans ajouter l'anticorps de lapin anti-HtsM produit pas de signal (données non présentées). Vues à fort grossissement des boutons ont révélé que la DLG et Hts immunoréactivité grossièrement recouverte à la région post-synaptique (Figure 3E), Alors que PLA entre les deux protéines a entraîné puncta discrète indiquant que seul un sous-ensemble des protéines totales et Dlg Hts sont dans un complexe (figure 3F).
Pour tester la fiabilité de PLA comme un outil pour étudier la JNM des larves, nous avons également évalué les interactions entre p21-activated kinase de sérine / thréonine, Pak, et d'autres 19 protéines synaptiques. Précédentes expériences de co-immunoprécipitation ont montré que Pak est un membre du complexe dessin à main levée, de Dlg qui est également un membre 20. Dans NMJs de type sauvage, Pak se localise dans la densité post-synaptique (figure 4A, C), où il est nécessaire pour la localisation Dlg 15,21. Les distributions immunoréactives de Pak et Dlg se chevauchent dans la région post-synaptique (figure 4A ''), et le PLA entre les deux protéines abouti à un signal positif spécifiquement au NMJ (figure 4B). Ces résultats indiquent que les deux protéines sont en c perdre proximité les uns des autres et sont susceptibles de former un complexe dans cette région. Une autre protéine synaptique nous avons testé pour la liaison complexe Pak était sans ailes (GT), le ligand Drosophila Wnt, qui joue de nombreux rôles à la NMJ 22. Dans de type sauvage, Wg est enrichi sur les côtés pré- et post-synaptiques de type I boutons, mais est également présent comme puncta tout le cytoplasme musculaire (figure 4C) 23. Fait intéressant, bien que les distributions immunoréactives de Pak et Wg chevauchent partiellement dans la région post-synaptique (figure 4C ''), le PLA entre les deux protéines ne produisit aucun signal observable (figure 4D). Par conséquent, Pak et Wg ne sont pas à proximité immédiate de l'autre à la jonction neuromusculaire. Ce résultat démontre que tous les protéines qui montrent immunoréactivités chevauchent à travers des expériences traditionnelles co-localisation vont générer un signal PLA, et sert de contrôle négatif supplémentaire.
ent "fo: keep-together.within-page =" always ">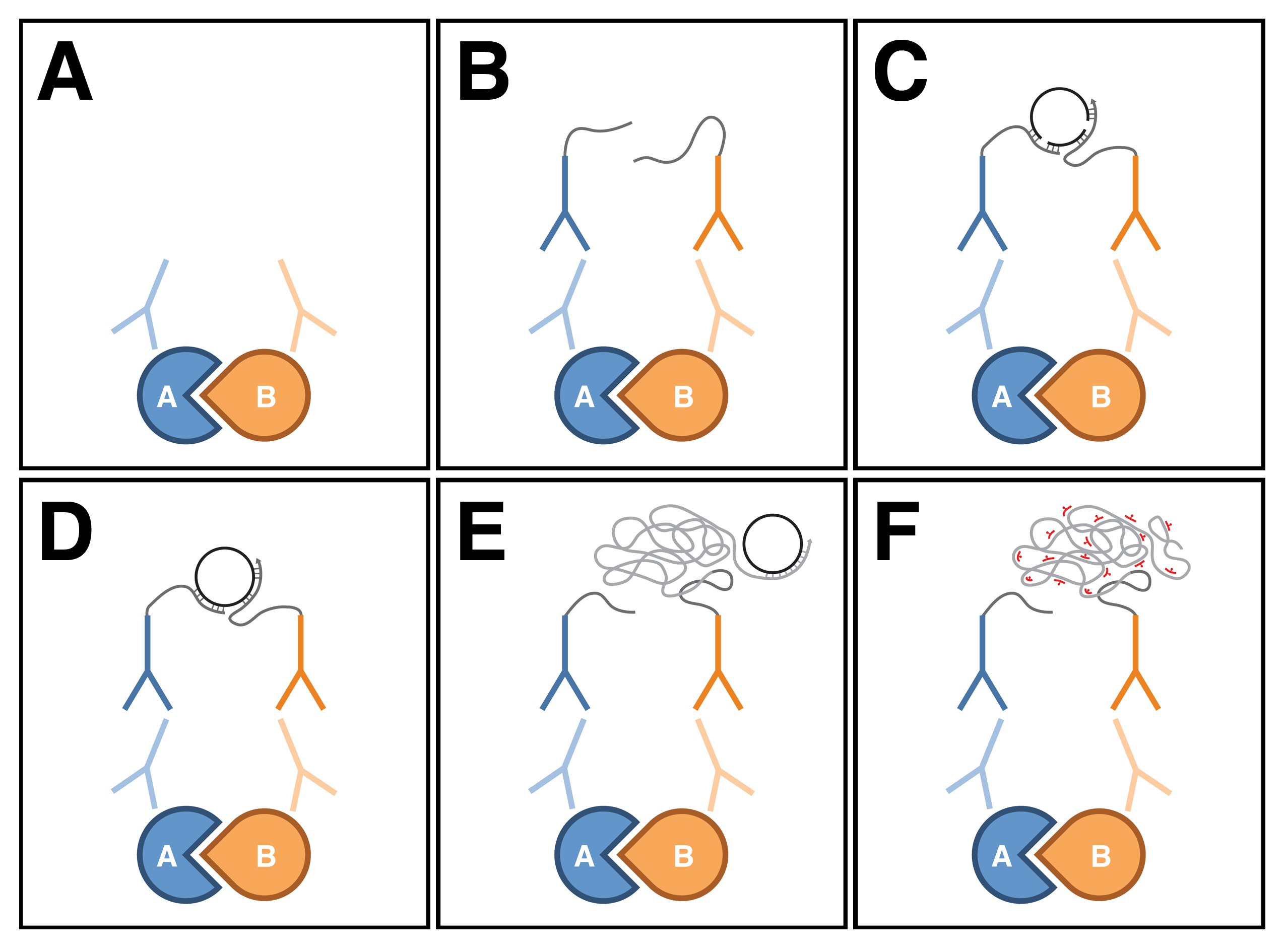
Figure 1: Schéma de Proximité ligature Assay. (A) Les anticorps primaires se lient aux deux protéines d'intérêt en utilisant des procédures immunohistochimiques standard. (B) Les anticorps primaires sont ensuite détectés avec une paire d'anticorps secondaire spécifique à l'espèce, appelées sondes PLA, qui sont conjugués à des oligonucleotides. (C) Si les deux protéines sont très proches les uns des autres, la distance entre les sondes PLA attachés peut être comblé par l'hybridation de deux oligonucléotides connecteurs complémentaires. (D) Dans cette conformation, les oligonucléotides connecteurs peuvent former une molécule d'ADN circulaire fermé lors de la ligature in situ . (E) La molécule d'ADN circulaire sert de matrice in situ pour amplification par cercle roulant, qui est amorcée par l'un des oligonucleotides conjugués aux sondes PLA. (F) des séquences dans le produit d'ADN amplifié sont ensuite détectés avec des sondes oligonucléotidiques complémentaires marquées par fluorescence. Notez que le chiffre était basé sur Weibrecht et al. 24. Se il vous plaît cliquer ici pour voir une version plus grande de la figure.

Figure 2: Préparation du troisième stade larvaire parois de la caisse. (AF) Les dessins schématiques représentant une dissection de la paroi du corps. (A) Placez une seule larve sur un disque de Sylgard avec sa face dorsale vers le haut de sorte que les deux secteurs de la trachée sont visibles. (B) Pin la larve bas aux extrémités antérieures et postérieures avec des épingles minuties, qui se étend sur la longueur de la larve dans le processus. (C) Faire trois incisions dans la face dorsale du corps des larves avec des ciseaux de microdissection. Les incisions doivent ressembler à un '' je '' une fois rempli. (D) Déroulez le corps des larves ouverte et épinglez les coins vers le bas, l'étirement de la paroi du corps à la fois horizontalement et verticalement dans le processus pour former un rectangle uniformément tendu. (E) Nettoyer sur tous les organes internes restants. (F) indiqués sont des exemples des différents moyens de réduire l'angle des parois de la caisse afin de distinguer différents génotypes. (G) Voir d'une préparation de la paroi du corps étiré une fois rempli. La photo a été prise avec un appareil photo numérique monté sur un microscope à dissection. La barre d'échelle dans le Panneau de F représente 1 mm. Notez que le chiffre était basé sur Ramachandran et Budnik, 2010 12. Se il vous plaît cliquer ici pour voir une version plus grande de la figure.
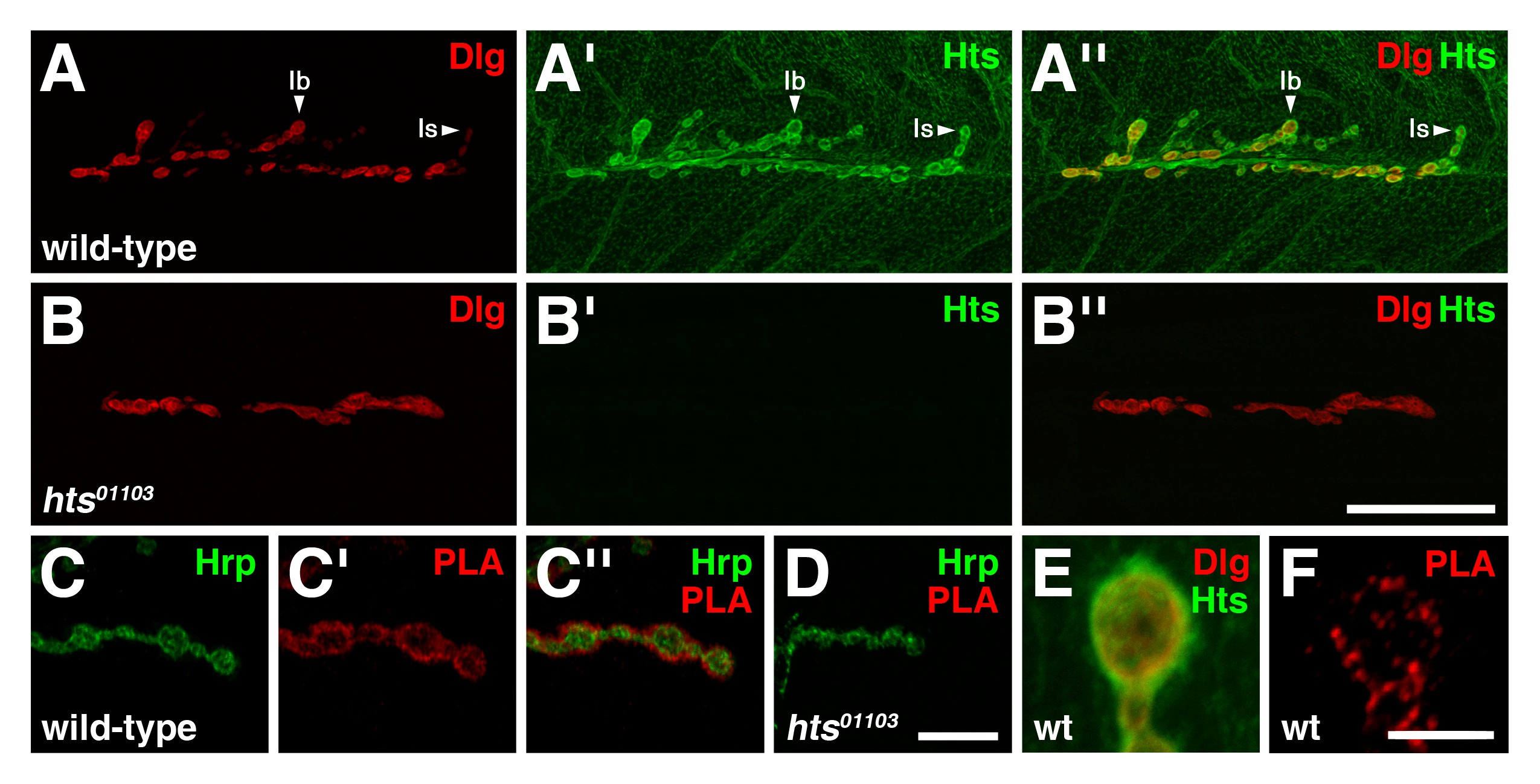
Figure 3: Dlg et Hts existent dans un complexe dans la région post-synaptique du NMJs larvaires (AB '') Distributions de Dlg (rouge) et Hts (vert) dans de type sauvage et hts NMJs mutantes (AA. '') Dans sauvage. -type NMJs, Dlg se retrouve principalement à la membrane post-synaptique des boutons de type I, avec des niveaux Dlg étant plus marquée dans le type Ib à Est boutons. Hts est présent tout au long du muscle, mais se concentre également autour de la région post-synaptique, avec des niveaux Hts être similaire dans les deux boutons de type I. Les distributions de Dlg et Hts se chevauchent dans la région post-synaptique. (BB '') mutant NMJs pour hts manque Hts immunoréactivité. Notez que le hts 01 103 effets de mutation NMJ ramification 8. (CD '') PLA entre Dlg et Hts (rouge) Réalisées sur de type sauvage et HTS NMJs mutantes. Hrp est utilisé pour marquer la membrane neuronale (vert). Présentés sont vues à fort grossissement de quelques boutons. (CC '') dans de type sauvage, le signal PLA est observée spécifiquement au NMJ. Le signal est principalement localisé sur la circonférence de la membrane présynaptique de boutons de type I, ce qui indique que la DLG et Hts sont à proximité les uns des autres et se trouvent dans un complexe à la région post-synaptique. (D) mutant NMJs pour hts a montré qu'aucun signal PLA observable. (EF) Montré sont vues à fort grossissement de boutons simples. (E) Hts et Dlg immunoréactivité chevauchement grossièrement à la région post-synaptique. (F) PLA entre Dlg et Hts résultats dans puncta distincte indiquant que seul un sous-ensemble des protéines sont dans un complexe . La barre d'échelle dans le Panneau de B '' représente 40 um (AB ''); barre d'échelle dans le Panneau de D '' représente 10 um (CD ''); scale bar dans le Panneau de F représente 5 um (EF). Tous NMJs indiqués sont des muscles 6/7 dans segment abdominal 4. Les images ont été prises comme piles fusionnés à l'aide d'un Nikon A1R balayage laser microscope confocal avec le logiciel NIS-Elements, et traitées avec Adobe Photoshop. Se il vous plaît cliquer ici pour voir une version plus grande de la figure.
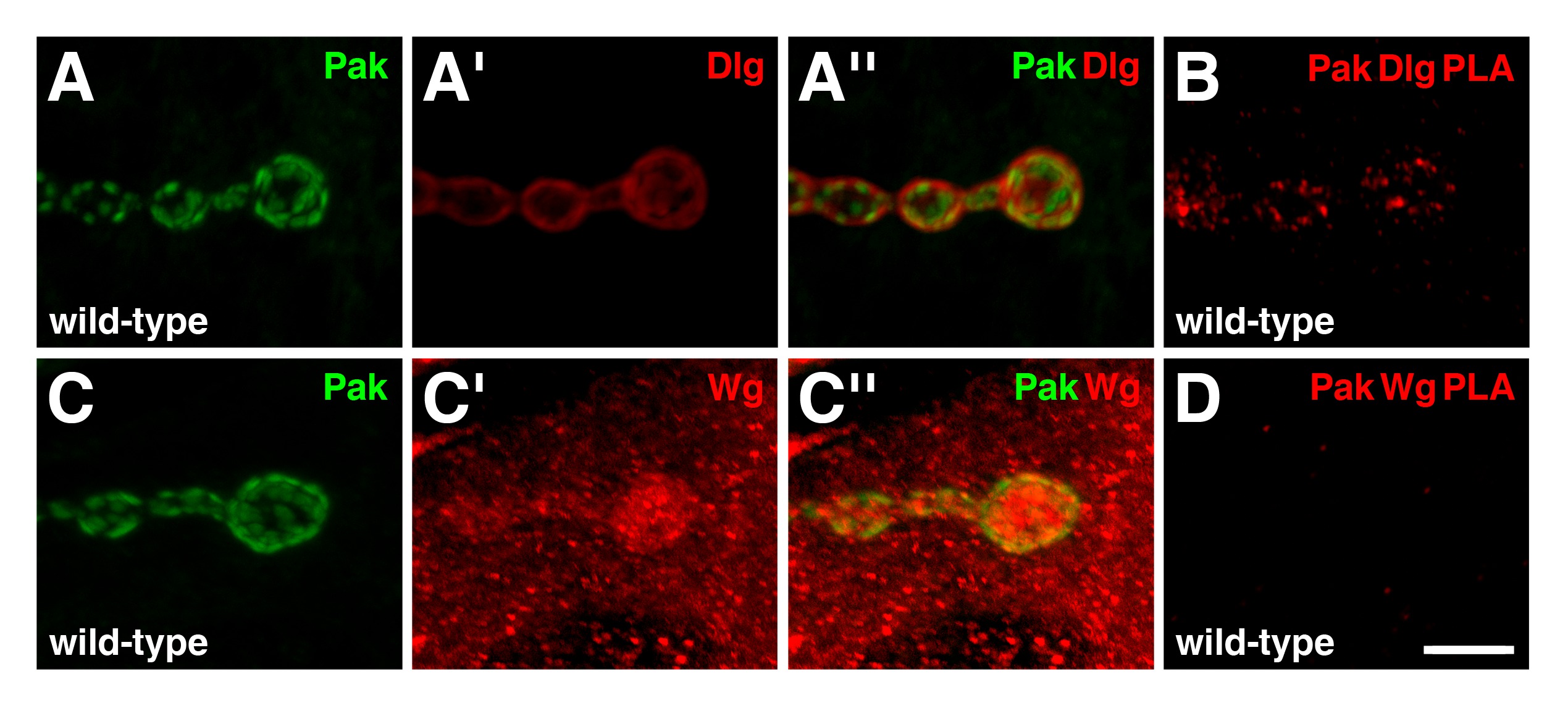
Figure 4: Pak existe dans un complexe avec Dlg, mais pas Wg, dans la région post-synaptique du NMJs larvaires (AD) indiqués sont vues à fort grossissement de quelques boutons (AA '') Distributions de Pak (vert) et Dlg (.. rouge) dans NMJs de type sauvage. Pak se localise dans la densité post-synaptique. Notez que les distributions immunoréactives de Pak et Dlg se chevauchent dans la région post-synaptique. (B) b PLAntre Pak et Dlg (rouge) effectuées sur NMJs de type sauvage. Signal de PLA est observée spécifiquement au NMJ, indiquant que les deux protéines sont à proximité les uns des autres dans cette région. Les distributions de Pak (vert) et Wg (rouge) dans NMJs de type sauvage (CC ''). Wg est enrichi à la fois les côtés pré- et post-synaptiques de la NMJ, mais est également présent comme puncta à travers le muscle. Notez que la distribution immunoréactive de Pak est également observée à se chevaucher partiellement avec le GT dans la région post-synaptique. (D) PLA entre Pak et Wg (rouge) effectuée sur NMJs de type sauvage. Aucun signal spécifique PLA est observée, indiquant que les deux protéines ne sont pas à proximité immédiate de l'autre à la jonction neuromusculaire, malgré leurs distributions se chevauchent. La barre d'échelle dans le Panneau de D représente 5 um (AD). Tous NMJs innervent les muscles en 6/7 segment abdominal 4. Les images ont été prises comme piles fusionnés à l'aide d'un Nikon A1R balayage laser microscope confocal avec le logiciel NIS-Elements et protransformés avec Adobe Photoshop. Se il vous plaît cliquer ici pour voir une version plus grande de la figure.
Discussion
Ce rapport montre comment PLA peut être appliqué à la drosophile larves NMJ. Le dosage est réalisé sur des larves préparations de muscle de la paroi du corps dans le but de détecter les interactions protéine-protéine endogènes présentes à la jonction neuromusculaire. Avec cette technique, Dlg Hts et sont indiqués pour être à proximité immédiate de l'autre, et ainsi exister dans un complexe, en particulier dans la région post-synaptique 27. À l'appui de ce résultat, une étude précédente a fourni la preuve de leur association avec les données suivantes: 1) les distributions immunoréactives de Dlg et Hts se chevauchent dans la région post-synaptique du NMJs larvaires, 2) Dlg et Hts forment un complexe à base de co- des expériences d'immunoprécipitation impliquant toute mouche adulte lysats, et 3) Dlg et interagissent dans les deux Hts épithéliale et jonctions synaptiques 8. Signal de PLA dans la région post-synaptique a également été observée entre Dlg et Pak, une interaction précédemment identifié dans d'autres études, accordant ainsi une plus credence de l'utilisation de ce test à la NMJ 15,20,21. Fait intéressant, PLA entre Pak et Wg n'a pas entraîné de signal observable, même si leurs distributions immunoréactives chevauchent au NMJ. Ce résultat démontre que toutes les protéines qui montrent les distributions immunoréactives se chevauchent générer un signal APL, par conséquent, ce qui indique que le PLA possède une résolution plus élevée dans la détection des interactions protéine-protéine que les études traditionnelles de co-localisation.
Plusieurs modifications ont été apportées au protocole PLA originale afin d'optimiser le dosage pour le NMJ larvaire (données non présentées) 9,25. Tout d'abord, on a déterminé que 1% de BSA est un meilleur agent de blocage pour les parois de la caisse au lieu de la solution de blocage prévue. Deuxièmement, pour produire un rapport fort rapport signal-bruit, l'immersion approprié et le mélange des parois de la caisse dans les solutions de réaction est critique. Un minimum de 200 ul pendant cinq à dix parois du corps dans un tube de microcentrifugation de 0,65 ml a été jugé suitabquand le incubation avec l'APL sondes, ou ligase polymérase, si les volumes peuvent être augmentés en conséquence lors du traitement de plus de parois du corps. La puissance du signal est également renforcée en augmentant les temps de réaction de 30 minutes au cours des périodes recommandées. Troisièmement, un test de dilution en série des sondes PLA a été réalisée afin d'optimiser l'équilibre entre la conservation du réactif et de la force du signal. Pour les expériences réalisées dans ce rapport, jusqu'à une dilution 1:25 - du recommandé dilution 1: 5 - peut encore produire un ratio raisonnable signal-bruit. Notez que l'optimisation des réactions de ligature et d'amplification n'a été effectuée. Enfin, comme PLA peut être sensible aux changements de dernière minute, il est fortement recommandé que les différents génotypes d'une expérience unique sont placés dans un seul tube de sorte que les contrôles et les expériences sont traités de manière égale pendant l'essai. Les génotypes peuvent être distingués en coupant les coins des parois de la caisse différemment.
Several méthodes sont utilisées pour détecter Drosophila interactions protéine-protéine, y compris la levure criblage à deux hybrides, la co-immunoprécipitation et le FRET. Mais comment ces méthodes comparent contre PLA et sa capacité à visualiser les interactions protéine-protéine in situ? Deux hybrides de levure peut détecter la liaison directe entre les protéines de drosophile exprimées dans la levure, et il a été utilisé dans les écrans de l'ensemble du génome à haut débit. Bien que beaucoup des interactions identifiées sont biologiquement pertinente, l'analyse produit souvent faux positifs. En outre, les faux négatifs peuvent se produire pour de nombreuses raisons: les protéines sont fusionnées à des domaines de facteurs de transcription qui peuvent interférer avec la liaison, de nombreuses interactions nécessitent des modifications post-traductionnelles qui ne existent pas dans la levure, et le noyau (où le dosage a lieu) peut pas un environnement approprié pour certaines interactions pour former correctement. Ces questions ne sont pas rencontrés avec PLA car il traite avec des protéines endogènes dans leur envir natifonnement. Un procédé qui peut être utilisé pour détecter des interactions entre des protéines endogènes est co-immunoprécipitation. Les expériences impliquant des lysats Drosophila peuvent révéler le tissu et le stade dans le cycle de vie dans laquelle se produit une interaction. Cependant, comme la formation de lysat implique la rupture des cellules pour extraire les protéines, les cellules dans le tissu dans lequel l'interaction se produit dans, ainsi que sa localisation subcellulaire, ne peuvent pas être évalués - à la différence de PLA. En outre, la co-immunoprécipitation détecte complexe de protéine de liaison et qui ne peut pas distinguer les protéines dans le complexe sont à proximité les uns des autres. Il existe des méthodes telles que la disposition de FRET Drosophilists qui permettent la visualisation des interactions protéine-protéine dans la cellule. Cependant, FRET implique la surexpression de protéines transgéniques fusionnés à des marqueurs fluorescents et peut ne pas refléter le comportement de protéine endogène comme dans PLA.
Malgré ses avantages, il ya quelques limitations lors de l'utilisation PLA. Une telle limitation est la disponibilité d'anticorps primaires dirigés contre les protéines d'intérêt qui sont faites dans différentes espèces. Ce problème peut être facilement contournée par l'utilisation de protéines transgéniques étiquetés, se ils ne peuvent pas être vraiment représentatif de l'interaction endogène. Un autre problème est que l'APL peut produire des résultats faussement négatifs, par exemple lorsque les deux anticorps primaires empêchent stériquement l'autre ou lorsque l'épitope de l'un des anticorps primaires comprend le site d'interaction protéine-protéine. En outre, bien PLA détecte des protéines qui sont à proximité étroite les uns aux autres, il ne distingue pas les interactions protéine-protéine directe et indirecte, à la différence dans des dosages pull-down et de la levure criblage à deux hybrides. En outre, PLA entre les protéines endogènes ne sera pas identifier les domaines sont responsables de l'interaction. Ainsi, d'autres dosages d'interaction protéine-protéine seront encore nécessaires pour caractériser complètement l'interaction molecularly.
Les chercheurs ont commencé à utiliser la microscopie de super-résolution pour cartographier l'architecture spatiale de la drosophile larves NMJ, avec des résolutions de dizaines de nanomètres atteints 26. PLA, avec sa résolution moléculaire comparable, devrait fournir un faible coût, techniquement simple complément à ces études qui aideront à construire une vue détaillée de l'organisation des nombreuses protéines à la jonction neuromusculaire.
Déclarations de divulgation
Les auteurs ne ont rien à divulguer.
Remerciements
Nous remercions le Bloomington Drosophila Stock Center pour fournir des stocks de mouches. Nous remercions également le Hybridoma Banque études développementales et le Dr Lynn Cooley (Université de Yale) pour fournir des anticorps. Un merci spécial à AhHyun Yoo pour son aide sur le manuscrit. Ce travail a été soutenu par des subventions du Fonds acier Isabelle Ada (Krieger) Conseil de recherches en génie du Canada (Krieger) les sciences naturelles et le William et et les Instituts canadiens de recherche en santé (Harden).
matériels
| Name | Company | Catalog Number | Comments |
| Forceps (fine #5) | Almedic | A10-704 | |
| Sylgard Disc | World Precision Instruments | SYLG184 | Mix elastomer base and curing agent in a 10:1 ratio. Set for 30 min. Pour into a mold (e.g. use a 12-well cell culture plate). Let cure for at least 24 hr. Adhere to the lid of a 60 x 15 mm Petri dish lid when dissecting. |
| Minutien Pins (0.0125 mm tip diameter) | Fine Science Tools | 26002-10 | |
| Microdissection Scissors (ultra fine) | Fine Science Tools | 15200-00 | |
| Platform Slides | Glue two 22 x 22 mm2 coverslips onto a microscope slide with clear nail polish, leaving a <20 mm gap in between for sample mounting. | ||
| w1118 | Bloomington Drosophila Stock Center | 3605 | |
| hts01103 | Bloomington Drosophila Stock Center | 10989 | Stock was re-balanced over a GFP balancer so that homozygous mutants can be selected based on the absence of GFP signal. |
| 1x PBS (Phosphate Buffered Saline): 3 mM NaH2PO4, 7 mM Na2HPO4, 130 mM NaCl, pH 7.0 | NaH2PO4 (Caledon Laboratories - 8180-1), Na2HPO4 (Caledon - 8120-1), NaCl (Caledon - 7560-1) | ||
| Bouin's Solution | Sigma-Aldrich | HT10132 | |
| 4% PFA (Paraformaldehyde): 4% PFA in 1x PBS | PFA (Anachemia Science - 66194-300). See doi:10.1101/pdb.rec9959 Cold Spring Harb Protoc 2006 for instructions on how to make the solution. | ||
| [header] | |||
| 1x PBT (Phosphate Buffered Saline with Triton): 1x PBS with 0.01% Triton | Triton X-100 (Sigma-Aldrich - T8787) | ||
| 1% BSA (Bovine Serum Albumin): 1% BSA in 1x PBT | BSA (Bioshop Canada - ALB001). Store at 4 °C. | ||
| mouse anti-Dlg (Discs large) | Developmental Studies Hybridoma Bank | 4F3 | Use at a 1:10 dilution in 1% BSA. |
| rabbit anti-HtsM (Hu-li tai shao) | Provided by Dr. Lynn Cooley (Yale University). Use at a 1:250 dilution in 1% BSA. | ||
| rabbit anti-Pak (p21-activated kinase) | Provided by Dr. Nicholas Harden (Simon Fraser University). Use at a 1:500 dilution in 1% BSA. | ||
| mouse anti-Wg (Wingless) | Developmental Studies Hybridoma Bank | 4D4 | Use at a 1:5 dilution in 1% BSA. |
| goat anti-Hrp (Horseradish peroxidase) | Jackson ImmunoResearch | 123-065-021 | Use at a 1:200 dilution in 1% BSA. |
| FITC-conjugated donkey anti-goat | Jackson ImmunoResearch | 705-095-003 | Use at a 1:200 dilution in 1% BSA. |
| Duolink In Situ PLA Probe anti-mouse MINUS | Sigma-Aldrich | DUO92004 | |
| Duolink In Situ PLA Probe anti-rabbit PLUS | Sigma-Aldrich | DUO92002 | |
| Duolink In Situ Detection Reagents Red | Sigma-Aldrich | DUO92008 | |
| 1x Wash Buffer A: 0.01 M Tris, 0.15 M NaCl, 0.05% Tween 20, pH 7.4 | Sigma-Aldrich | DUO82049 | Tris (Caledon Laboratories - 8980-1), NaCl (Caledon - 7560-1), Tween 20 (Fisher Scientific - BP337) |
| 1x Wash Buffer B: 0.2 M Tris, 0.1 M NaCl, pH 7.5 | Sigma-Aldrich | DUO82049 | Tris (Caledon Laboratories - 8980-1), NaCl (Caledon - 7560-1) |
| 0.01x Wash Buffer B: 2 mM Tris, 1 mM NaCl, pH 7.5 | Sigma-Aldrich | DUO82049 | Tris (Caledon Laboratories - 8980-1), NaCl (Caledon - 7560-1) |
| Duolink In Situ Mounting Medium with DAPI | Sigma-Aldrich | DUO82040 | |
Références
- Woods, D. F., Bryant, P. J. The discs-large tumor suppressor gene of Drosophila encodes a guanylate kinase homolog localized at septate junctions. Cell. 66, 451-464 (1991).
- Yamanaka, T., Ohno, S. Role of Lgl/Dlg/Scribble in the regulation of epithelial junction, polarity and growth. Front Biosci. 13, 6693-6707 (2008).
- Humbert, P. O., et al. Control of tumourigenesis by the Scribble/Dlg/Lgl polarity module. Oncogene. 27, 6888-6907 (2008).
- Lahey, T., Gorczyca, M., Jia, X. X., Budnik, V. The Drosophila tumor suppressor gene dlg is required for normal synaptic bouton structure. Neuron. 13, 823-835 (1994).
- Ataman, B., Budnik, V., Thomas, U. Scaffolding proteins at the Drosophila neuromuscular junction. Int Rev Neurobiol. 75, 181-216 (2006).
- Thomas, U., Kobler, O., Gundelfinger, E. D. The Drosophila larval neuromuscular junction as a model for scaffold complexes at glutamatergic synapses: benefits and limitations. J Neurogenet. 24, 109-119 (2010).
- Matsuoka, Y., Li, X., Bennett, V. Adducin: structure, function and regulation. Cell Mol Life Sci. 57, 884-895 (2000).
- Wang, S., et al. Drosophila adducin regulates Dlg phosphorylation and targeting of Dlg to the synapse and epithelial membrane. Dev Biol. 357, 392-403 (2011).
- Soderberg, O., et al. Characterizing proteins and their interactions in cells and tissues using the in situ proximity ligation assay. Methods. 45, 227-232 (2008).
- Brent, J. R., Werner, K. M., McCabe, B. D. Drosophila larval NMJ dissection. J Vis Exp. (24), (2009).
- Ramachandran, P., Budnik, V. Immunocytochemical staining of Drosophila larval body-wall muscles. Cold Spring Harb Protoc. 2010, (2010).
- Ramachandran, P., Budnik, V. Dissection of Drosophila larval body-wall muscles. Cold Spring Harb Protoc. , (2010).
- Ashburner, M. . Drosophila: A Laboratory Manual. , (1989).
- Brent, J., Werner, K., McCabe, B. D. Drosophila larval NMJ immunohistochemistry. J Vis Exp. (25), (2009).
- Parnas, D., Haghighi, A. P., Fetter, R. D., Kim, S. W., Goodman, C. S. Regulation of postsynaptic structure and protein localization by the Rho-type guanine nucleotide exchange factor dPix. Neuron. 32, 415-424 (2001).
- Petrella, L. N., Smith-Leiker, T., Cooley, L. The Ovhts polyprotein is cleaved to produce fusome and ring canal proteins required for Drosophila oogenesis. Development. 134, 703-712 (2007).
- Pielage, J., Bulat, V., Zuchero, J. B., Fetter, R. D., Davis, G. W. Hts/Adducin controls synaptic elaboration and elimination. Neuron. 69, 1114-1131 (2011).
- Spradling, A. C., et al. The Berkeley Drosophila Genome Project gene disruption project: Single P-element insertions mutating 25% of vital Drosophila genes. Genetics. 153, 135-177 (1999).
- Bokoch, G. M. Biology of the p21-Activated Kinases. Annu Rev Biochem. 72, 743-781 (2003).
- Bahri, S., et al. The leading edge during dorsal closure as a model for epithelial plasticity: Pak is required for recruitment of the Scribble complex and septate junction formation. Development. 137, 2023-2032 (2010).
- Albin, S. D., Davis, G. W. Coordinating structural and functional synapse development: postsynaptic p21-activated kinase independently specifies glutamate receptor abundance and postsynaptic morphology. J Neurosci. 24, 6871-6879 (2004).
- Koles, K., Budnik, V. Wnt signaling in neuromuscular junction development. Cold Spring Harb Perspect Biol. 4, (2012).
- Packard, M., et al. The Drosophila Wnt, wingless, provides an essential signal for pre- and postsynaptic differentiation. Cell. 111, 319-330 (2002).
- Weibrecht, I., et al. Proximity ligation assays: a recent addition to the proteomics toolbox. Expert Rev Proteomics. 7, 401-409 (2010).
- Thymiakou, E., Episkopou, V. Detection of signaling effector-complexes downstream of bmp4 using PLA, a proximity ligation assay. J Vis Exp. (49), (2011).
- Maglione, M., Sigrist, S. J. Seeing the forest tree by tree: super-resolution light microscopy meets the neurosciences. Nat Neurosci. 16, 790-797 (2013).
- Wang, S., et al. . Biol. Open. 3 (12), 1196-1206 (2014).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon