Method Article
Detección de
En este artículo
Resumen
Este protocolo demuestra cómo la proximidad Ligadura ensayo se puede usar para detectar in situ en las interacciones proteína-proteína en la unión neuromuscular Drosophila larval. Con esta técnica, los discos grandes y Hu-li shao tai se muestra para formar un complejo en la región postsináptica, una asociación identificado previamente a través de co-inmunoprecipitación.
Resumen
Discs large (Dlg) is a conserved member of the membrane-associated guanylate kinase family, and serves as a major scaffolding protein at the larval neuromuscular junction (NMJ) in Drosophila. Previous studies have shown that the postsynaptic distribution of Dlg at the larval NMJ overlaps with that of Hu-li tai shao (Hts), a homologue to the mammalian adducins. In addition, Dlg and Hts are observed to form a complex with each other based on co-immunoprecipitation experiments involving whole adult fly lysates. Due to the nature of these experiments, however, it was unknown whether this complex exists specifically at the NMJ during larval development.
Proximity Ligation Assay (PLA) is a recently developed technique used mostly in cell and tissue culture that can detect protein-protein interactions in situ. In this assay, samples are incubated with primary antibodies against the two proteins of interest using standard immunohistochemical procedures. The primary antibodies are then detected with a specially designed pair of oligonucleotide-conjugated secondary antibodies, termed PLA probes, which can be used to generate a signal only when the two probes have bound in close proximity to each other. Thus, proteins that are in a complex can be visualized. Here, it is demonstrated how PLA can be used to detect in situ protein-protein interactions at the Drosophila larval NMJ. The technique is performed on larval body wall muscle preparations to show that a complex between Dlg and Hts does indeed exist at the postsynaptic region of NMJs.
Introducción
Drosophila discos grandes (DLG) es un miembro conservada de la guanilato quinasa de la familia asociada a la membrana de andamios proteínas que ayudan a orquestar el ensamblaje de complejos de proteínas grandes en sitios específicos de la membrana plasmática. Originalmente identificado como una proteína supresora de tumores, Dlg sirve como un determinante importante de la polaridad epitelial 1,2,3 apicobasal. Dlg también sirve como un módulo de andamio importante en la unión neuromuscular (NMJ) de las neuronas motoras glutamatérgicas durante el desarrollo larvario 4. Dlg juega diversos papeles en la larval NMJ, y su pleiotropism se basa en su capacidad para asociarse con múltiples proteínas de 5,6. Una de estas proteínas es shao Hu-li tai (HTS), un homólogo de los mamíferos adducins que principalmente se han descrito en lo que respecta a sus funciones en la regulación de la actina-espectrina citoesqueleto 7. Previamente se ha demostrado que Dlg y Hts pueden formar un complejo con el uno al otro sobre la base de in vitro experimentos de co-inmunoprecipitación que participe toda adultos lisados mosca 8. Una deficiencia de estos resultados, sin embargo, es que no indican donde este complejo formas. Con el uso de inmunohistoquímica, se observan las distribuciones de Dlg y Hts a superponerse en la membrana postsináptica de NMJs larvas, pero son en un complejo en esta región 8? Como se muestra recientemente y se detalla más adelante aquí, ligadura de ensayo de proximidad (PLA) se utiliza para buscar una en asociación situ entre Dlg y Hts específicamente en el larval NMJ 27.
PLA es una técnica relativamente nueva se utiliza principalmente en las células y el tejido cultural que puede detectar interacciones proteína-proteína in situ 9. En este ensayo, los anticuerpos primarios contra las dos proteínas de interés se detectan con un par de anticuerpos secundarios específicos de especie, denominados sondas de PLA, que están conjugados a oligonucleótidos (Figura 1A, B). Si la proteína de doss están muy cerca entre sí (es decir, dentro de unas pocas decenas de nanómetros), la distancia entre las sondas PLA adjuntos puede salvarse a través de la hibridación de dos oligonucleótidos de conectores adicionales (Figura 1C). En esta conformación, los extremos libres de los oligonucleótidos de conector son lo suficientemente cerca para hacer contacto uno con otro, y una molécula de ADN circular cerrado se pueden formar sobre la ligadura en situ (Figura 1D). La molécula de ADN circular sirve como una plantilla para in situ amplificación por círculo rodante, que se prepara por uno de los oligonucleótidos conjugados con las sondas PLA (Figura 1E). Las secuencias dentro de la amplificado, producto de ADN resultante concatemeric entonces se pueden visualizar con, sondas de oligonucleótido complementario marcado con fluorescencia (Figura 1f). Dado que el ADN amplificado permanece unida a una de las sondas de PLA, la localización subcelular de la interacción proteína-proteína withitejido na puede determinarse fácilmente.
Varios métodos se usan comúnmente para detectar interacciones proteína-proteína incluyendo técnicas in vitro tales como co-inmunoprecipitación, ensayos de pull-down y la levadura de dos híbridos, y en técnicas in vivo tales como Förster de transferencia de energía de resonancia (FRET) y bimolecular de fluorescencia de Complementación ( BiFC). Un error de las técnicas in vitro es que no se identifican donde la interacción se produce de manera endógena, mientras que la mencionada en técnicas in vivo implican la expresión de proteínas de fusión artificial que puede no reflejar el comportamiento natural de sus homólogos endógenos. Una ventaja importante de PLA es que es capaz de determinar dentro de un tejido la localización subcelular de interactores de proteínas endógenas que se encuentran en estrecha proximidad entre sí y probablemente formando un complejo, con el grado de cercanía requerido para generar una señal comparable a FRET y BiFC. PLA puede detectar interacciones con alta especificidad y sensibilidad debido al acoplamiento de reconocimiento de anticuerpos y la amplificación de ADN. Por lo tanto, el ensayo puede generar, señales luminosas discretas en forma de puntos lagrimales que revelan la posición exacta de la interacción. Además, los antígenos apenas visibles pueden ser detectados. Finalmente, PLA es una técnica relativamente sencilla de realizar, y ya no tiene que un procedimiento inmunohistoquímico estándar para completar. Por lo tanto, PLA ofrece una ventaja técnica sobre otros ensayos de interacción proteína-proteína que a menudo se ven afectadas con largos tiempos de preparación y amplia solución de problemas.
Este protocolo se muestra cómo PLA se puede aplicar a la Drosophila larval NMJ para el propósito de la detección de interacciones proteína-proteína endógenos in situ. Aquí, el PLA se realiza en preparaciones de músculo de la pared corporal larvarios donde se muestran Dlg y Hts de existir de hecho en un complejo en la región postsináptica de NMJs. PLA no se ha utilizado previamente para estudiar la larval NMJ, y existen en la actualidad sólo un puñado de trabajos publicados que han utilizado este ensayo en el tejido Drosophila. Se espera que una mayor exposición de PLA a la comunidad de Drosophila se traducirá en el aumento de su uso como una herramienta adicional para complementar otros ensayos de interacción proteína-proteína más comúnmente utilizados,.
Protocolo
1. Cuerpo Preparación de la pared
NOTA: Preparación de tercer estadio larval paredes del cuerpo (para el estudio de los NMJs que inervan los músculos de la pared corporal) se realizó como se ha descrito previamente en Brent et al 10, o Ramachandran y Budnik 11,12, pero con algunas modificaciones..
- Disección
- Elevar las existencias de moscas y cruces a 25 ° C durante cinco o seis días, utilizando procedimientos estándar 13.
- Escoja arrastrándose larvas de tercer estadio de frascos o botellas utilizando unas pinzas finas.
- Lavar las larvas en una pequeña placa Petri que contenía tampón fosfato salino (PBS) para eliminar las partículas de comida.
- Coloque una sola larva en un disco Sylgard y sumergirlo en unas gotas de helado de PBS. El uso de helado de PBS ayudará aturdir la larva por lo que es más fácil de manipular. A lo largo de la disección, asegúrese de que la preparación siempre se sumerge en PBS para evitar que se seque.
- Coloque la larva con el lado dorsal de modo que las dos secciones traqueales son visibles bajo un microscopio de disección (Figura 2A). Usando las pinzas para agarrar un alfiler minutien, Pin de la larva hacia abajo en el extremo posterior cerca de los espiráculos (Figura 2B). Con otro pin, perforar a través de la cutícula en el extremo anterior cerca de los ganchos de la boca. Estire suavemente la larva a cabo a lo largo, entonces pin abajo (Figura 2B).
- Con unas tijeras de microdisección, pellizcar el extremo posterior cerca del pasador para crear una pequeña abertura. La incisión debe ser lo suficientemente superficial sólo tiene que pasar a través de la cutícula.
- La colocación de la punta de la cuchilla inferior de las tijeras en la incisión, corte a lo largo de toda la longitud de la línea media dorsal entre las dos secciones traqueales (Figura 2C). Señalar las cuchillas de la tijera ligeramente hacia arriba cuando se corta para evitar dañar los músculos de la pared ventral del cuerpo.
- Hacer una pequeña incisión horizontal ligeramente anterior al puestopin colocado eriorly (Figura 2C). Haz otra incisión similares posterior ligeramente a la aguja colocada anteriormente (Figura 2C). Las incisiones deben sólo tiene que pasar a través de la cutícula.
NOTA: Los tres incisiones de los pasos 1.1.7 y 1.1.8 combinados debe ser similar a un " "Una vez terminado, es decir, una aleta izquierda y derecha en la parte dorsal del cuerpo de la larva debe ser producido.
"Una vez terminado, es decir, una aleta izquierda y derecha en la parte dorsal del cuerpo de la larva debe ser producido. - Limpiar cuidadosamente los órganos internos con los fórceps. Añadir unas gotas contundentes de PBS ayudará a desplazar a los órganos fuera del cuerpo de la larva, por lo que es más fácil para eliminarlos. Evite meter el cuerpo de las larvas, ya que puede causar daños en los músculos de la pared corporal.
- Desplegar el cuerpo larval abierta y fijar las esquinas hacia abajo (Figura 2D). Cuando fijación, estirar la pared del cuerpo, tanto horizontal como verticalmente para formar un rectángulo uniformemente tensado (see Figura 2G para la forma), teniendo cuidado de no romper los músculos de la pared del cuerpo en el proceso.
- Termine de retirar cualquiera de los órganos internos restantes (Figura 2E).
- La fijación y permeabilización
- Sumerja las paredes del cuerpo clavado en varias gotas de solución de Bouin. Incubar durante 15 min en hielo. Como alternativa, utilice el 4% de paraformaldehído (PFA) como una solución fijadora alternativa; incubar durante 30 min.
- Enjuague tres veces con tampón fosfato salino con Triton (PBT).
- Con unas pinzas finas, retire con cuidado los pasadores y transferir las paredes del cuerpo por sus esquinas en un tubo de microcentrífuga de 0,65 ml siliconado.
- Guarde las paredes del cuerpo de PBT a 4 ° C hasta el momento de PLA. Para obtener resultados óptimos, comience inmunotinción las paredes del cuerpo dentro de un día o dos de disección.
NOTA: Para ahorrar en reactivos y para asegurar que todas las paredes del cuerpo son tratados por igual durante el ensayo, diferentes genotipos se pueden colocar en una solatubo. Los genotipos se pueden distinguir por el corte de las esquinas de las paredes del cuerpo de forma diferente (véase la Figura 2F para los ejemplos).
2. La inmunohistoquímica
NOTA: La inmunotinción de tercer instar paredes del cuerpo de las larvas se realizó como se ha descrito previamente en Brent et al 14 y Ramachandran y Budnik 11, pero con algunas modificaciones 11,14..
NOTA: Realice todos los pasos a temperatura ambiente y con agitación suave a menos que se indique lo contrario.
- Bloqueo
- Lavar las paredes del cuerpo con PBT tres veces durante 10 minutos cada uno.
- Bloque con 1% albúmina de suero bovino (BSA) durante 1 hr.
- Inmunoticción
- Incubar las paredes del cuerpo con anticuerpos de ratón y primarios de conejo contra las dos proteínas de interés (diluido en 1% de BSA) durante 2 horas a temperatura ambiente, o durante la noche a 4 ° C. En este caso, utilice 1:10 de ratón anti-Dlg y 1: 250 de conejo unnti-HtsM 15,16. Los anticuerpos contra los marcadores que no se hacen en el ratón o conejo también se pueden incluir - por ejemplo, utilizar 1: 200 cabra anti-HRP para delinear las membranas neuronales.
- Lavar con PBT tres veces durante 10 minutos cada uno.
- Incubar con anticuerpos secundarios conjugado con fluoróforo para detectar los marcadores (diluido en 1% de BSA) durante 2 horas a temperatura ambiente, o durante la noche a 4 ° C. Como la señal de PLA se visualizó más tarde con un fluoróforo rojo, otro fluoróforo debe ser utilizado para detectar el marcador - por ejemplo, usar 1: 200 anti-cabra conjugado con FITC para detectar el anticuerpo de cabra anti-Hrp. Debido a la utilización de los reactivos sensibles a la luz, mantener los tubos en la oscuridad desde este punto en adelante.
NOTA: El kit que se utiliza para PLA permite que se realice entre los anticuerpos primarios planteadas en ratón y conejo, con la señal visualizado en el canal rojo bajo microscopía confocal. Si se desea, otros kits están disponibles que permiten que el ensayo se realiza con primaanticuerpos ry criados en otras especies, y la señal visualizaron en otros canales.
3. Proximidad Ligadura Ensayo
NOTA: Realice todos los pasos a temperatura ambiente y con agitación suave a menos que se indique lo contrario.
- PLA Sondas
- Lavar las paredes del cuerpo con PBT tres veces durante 10 minutos cada uno.
- Incubar con sondas de PLA (dilución 1: 5 cada uno en 1% BSA) durante 2 horas a 37 ° C. En este caso, utilizar 40 l de sonda de PLA MENOS anti-ratón, 40 l de sonda de PLA anti-conejo PLUS y 120 l de BSA al 1% para asegurar la inmersión adecuado y mezcla de 5-10 paredes del cuerpo. Hasta una dilución 01:25 de las sondas de PLA todavía puede resultar en una adecuada relación señal a ruido (es decir, para este experimento).
- Ligadura
- Lavar las paredes del cuerpo con el tampón de lavado A dos veces durante 5 minutos cada uno.
- Incubar con solución de ligación (dilución 1:40 de ligasa en tampón de ligación) durante 1 hr unat 37 ° C. En este caso, utilizar 5 l de ligasa, 40 l de tampón de ligación y 5 155 l de agua de alta pureza para garantizar la inmersión adecuado y mezcla de 5-10 paredes del cuerpo.
- Amplificación
- Lavar las paredes del cuerpo con el tampón de lavado A dos veces durante 2 minutos cada uno.
- Incubar con solución de amplificación (1:80 dilución de la polimerasa en tampón de amplificación) durante 2 horas a 37 ° C. En este caso, utilizar 2,5 l de polimerasa, 40 l de tampón de amplificación 5 y 157,5 l de agua de alta pureza para garantizar la inmersión adecuado y mezcla de 5-10 paredes del cuerpo.
- Preparación de la Imagen
- Lavar las paredes del cuerpo con el tampón de lavado B dos veces durante 10 minutos cada uno.
- Lavar con 0,01x Wash Buffer B una vez durante 1 min.
- Equilibrar en unas pocas gotas de solución de montaje por lo menos 30 min antes del montaje, o almacenar durante la noche a 4 ° C.
- Con unas pinzas finas, transferir cuidadosamente las paredes del cuerpo en un portaobjetos plataforma wITH sus cutículas hacia abajo. Coloque las paredes del cuerpo en filas y en la misma orientación dentro de una o dos gotas de medio de montaje. Coloque un 22 mm x 40 mm cubreobjetos sobre la preparación con cuidado de no generar burbujas de aire, y luego sellar la diapositiva con esmalte de uñas transparente.
- Guarde las diapositivas de la oscuridad a -20 ° C hasta el momento de la imagen confocal.
Resultados
En los de tipo salvaje tercer instar NMJs larvales, Dlg es predominantemente encontrar en la membrana postsináptica de boutons glutamatérgicos tipo I, con niveles de inmunorreactividad Dlg siendo más pronunciada en boutons tipo Ib que el tipo es boutons (Figura 3) 4. Hts está presente en todo el músculo sino que se concentra en la región postsináptica con Hts niveles de inmunorreactividad aparece igual en ambos tipo I boutons, y también se encuentra presinápticamente (Figura 3A ') 8,17. Tenga en cuenta que las distribuciones de Dlg y Hts se solapan en gran medida en la región postsináptica (Figura 3A '') 8.
Para determinar si existen Dlg y Hts en un complejo en la NMJ, PLA entre las dos proteínas se realizó en preparaciones de músculo de la pared del cuerpo de las larvas. Para este ensayo, un anticuerpo anti-ratón Dlg que detecta el segundo dominio PDZ en el extremo N-terminal y un anticuerpo de conejo anti-HtsMque detecta el dominio MARCKS-homología en el extremo C-terminal se utilizaron 15,16. En silvestres de tipo, señal PLA entre Dlg y Hts se observó específicamente en la UNM (Figura 3 C-C ''). La señal mayormente localizada circunferencialmente a la membrana presináptica de tipo I boutons, que fue demarcada por Hrp, lo que indica que Dlg y Hts están en estrecha proximidad entre sí y probablemente forman un complejo en la región postsináptica. El resultado se determinó que era específica como nuestro control negativo, que implica HTS 01103 NMJs mutantes que carecen de Hts inmunoreactividad (Figura 3B-B ''), no mostró ninguna señal de PLA observable (Figura 3D) 8,17,18. Además, PLA realiza sin añadir el anticuerpo de conejo anti-HtsM producido ninguna señal (datos no mostrados). Vistas de gran aumento de los boutons revelaron que Dlg y Hts inmunorreactividad groseramente superpuso en la región postsináptica (Figura 3E), Mientras que PLA entre las dos proteínas resultó en puntos lagrimales discreta que indica que sólo un subconjunto del total de proteínas Dlg y Hts están en complejo (Figura 3F).
A fin de probar la fiabilidad de PLA como una herramienta para estudiar la larval NMJ, también se evaluó la interacción entre la serina / treonina quinasa activada por p21, Pak, y otras proteínas sinápticas 19. Anteriores experimentos de co-inmunoprecipitación han demostrado que Pak es un miembro del complejo Scribble, de los cuales Dlg es también un miembro 20. En NMJs de tipo salvaje, Pak se localiza en la densidad postsináptica (Figura 4 A, C), en la que se requiere para Dlg localización 15,21. Las distribuciones de inmunorreactivas Pak y Dlg se superponen en la región postsináptica (Figura 4a ''), y PLA entre las dos proteínas dado lugar a una señal positiva específicamente a la NMJ (Figura 4B). Estos resultados indican que las dos proteínas están en c perder proximidad entre sí y es probable la formación de un complejo en esta región. Otra proteína sináptica probamos para complejo Pak unión era sin alas (WG), el ligando Drosophila Wnt, que desempeña numerosos papeles en la UNM 22. En de tipo salvaje, Wg se enriquece en los lados presinápticos y postsinápticos de tipo I BOUTONS, pero también está presente como puntos lagrimales por todo el citoplasma muscular (Figura 4C ') 23. Curiosamente, a pesar de las distribuciones de inmunorreactivas Pak y Wg superponen parcialmente en la región postsináptica (Figura 4C ''), PLA entre las dos proteínas produce ninguna señal observable (Figura 4D). Por lo tanto, Pak y Wg no están en estrecha proximidad entre sí en la NMJ. Este resultado demuestra que no todas las proteínas que muestran inmunorreactividades superpuestas a través de experimentos de co-localización tradicionales generará una señal de PLA, y sirve como un control negativo adicional.
ent "fo: keep-together.within-page =" always ">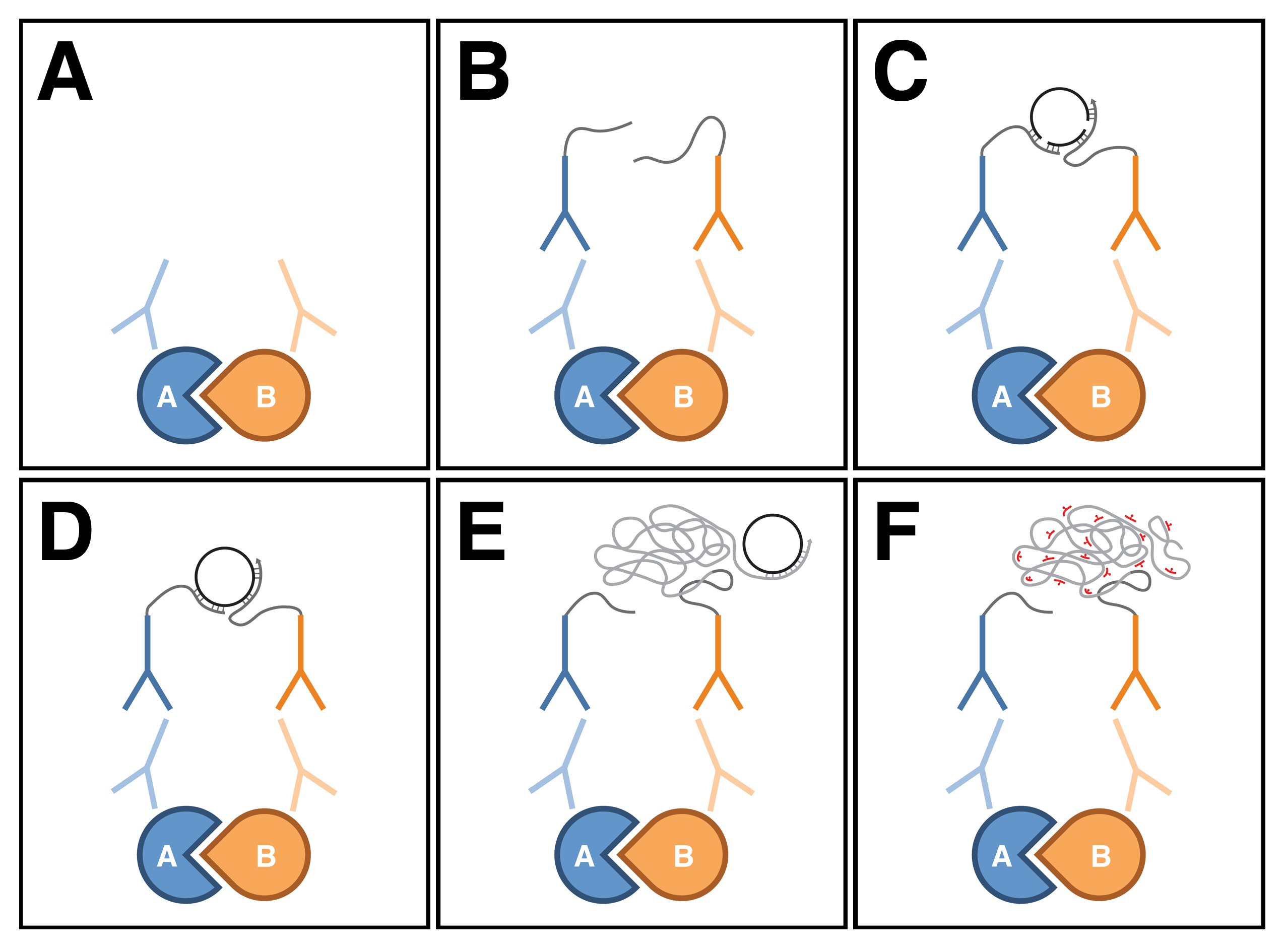
Figura 1: Esquema de proximidad ligadura de ensayo. (A) Los anticuerpos primarios se unen a las dos proteínas de interés usando procedimientos inmunohistoquímicos estándar. (B) Los anticuerpos primarios son detectados con un par de anticuerpos secundarios específicos de especie, denominados sondas de PLA, que están conjugados a oligonucleótidos. (C) Si las dos proteínas están en estrecha proximidad entre sí, la distancia entre las sondas de PLA adjuntos puede ser puenteada a través de la hibridación de dos oligonucleótidos conector adicional. (D) En esta conformación, los oligonucleótidos conector puede formar una molécula de ADN circular cerrado sobre ligadura en situ . (E) La molécula de ADN circular sirve como una plantilla para in situ amplificación por círculo rodante, que se prepara por uno de los oligonucleotides conjugados con las sondas Pla. (F) secuencias dentro del producto de ADN amplificado se detectaron entonces con, sondas de oligonucleótidos complementarios marcados con fluorescencia. Tenga en cuenta que la cifra se basaba en Weibrecht et al. 24. Haga clic aquí para ver una versión más grande de la figura.

Figura 2: Preparación de tercer instar paredes del cuerpo de las larvas. (AF) dibujos esquemáticos que representan una disección de la pared del cuerpo. (A) Colocar una sola larva en un disco Sylgard con el lado dorsal de modo que las dos secciones traqueales son visibles. (B) Pin la larva hacia abajo en los extremos anterior y posterior con alfileres minutien, que se extiende a la larva a cabo a lo largo del proceso. (C) Haga tres incisiones en la parte dorsal del cuerpo de la larva con tijeras de microdisección. Las incisiones deben asemejarse a un '' I '' cuando esté terminado. (D) Desenrollar el cuerpo larval abierta y fijar las esquinas hacia abajo, estirando la pared del cuerpo, tanto horizontal como verticalmente en el proceso para formar un rectángulo uniformemente tensado. (E) Limpiar cabo cualquier restantes órganos internos. (F) Se muestran ejemplos de las diferentes formas de reducir la esquina de las paredes del cuerpo con el fin de distinguir los diferentes genotipos. (G) Vista de una preparación de la pared corporal estirada cuando esté terminado. La foto fue tomada con una cámara digital montada sobre un microscopio de disección. La barra de escala en el Panel F representa 1 mm. Tenga en cuenta que la cifra se basaba en Ramachandran y Budnik, 2010 12. Haga clic aquí para ver una versión más grande de la figura.
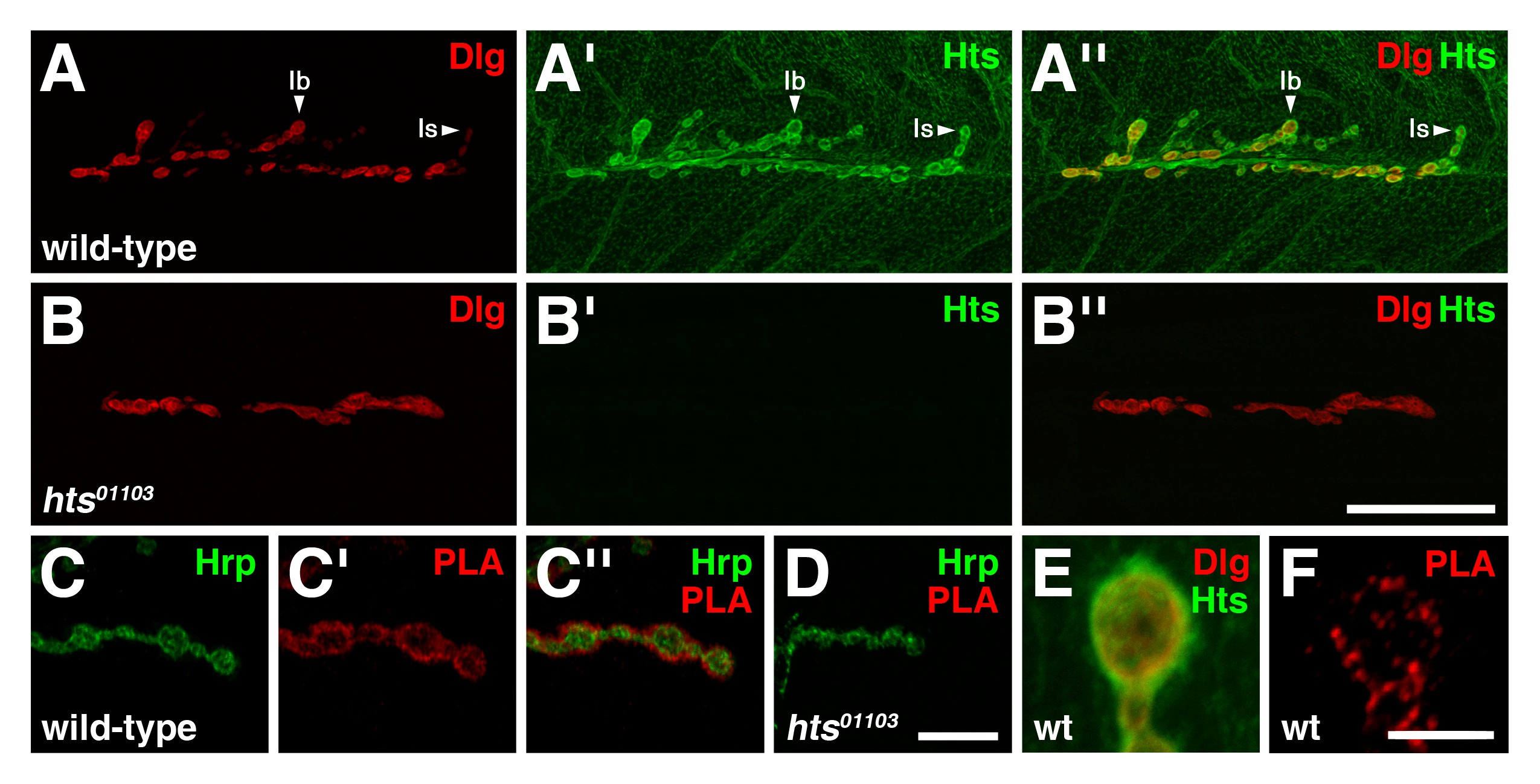
Figura 3: Dlg y Hts existen en un complejo en la región postsináptica de NMJs larvales (AB '') Distribución de Dlg (rojo) y Hts (verde) en la naturaleza y tipo HTS NMJs mutantes (AA ''.) En silvestre. mecanografíe NMJs, Dlg se encuentra predominantemente en la membrana postsináptica de tipo I boutons, con niveles Dlg ser más pronunciada en el tipo Ib que es boutons. Hts está presente en todo el músculo, sino también concentrados alrededor de la región postsináptica, con niveles Hts ser similar en ambos tipos boutons I. Las distribuciones de Dlg y Hts superponen en la región postsináptica. (BB '') mutante NMJs para hts carecen Hts inmunorreactividad. Tenga en cuenta que el hts 01.103 efectos de mutación NMJ ramificación 8. (CD '') PLA entre Dlg y Hts (rojo) Realizaron en la naturaleza y tipo HTS NMJs mutantes. Hrp se utiliza para marcar la membrana neuronal (verde). Se muestran altas vistas de ampliación de unos boutons. (CC '') de tipo salvaje, se observa señal PLA específicamente en la UNM. La señal se localiza principalmente circunferencialmente a la membrana presináptica de tipo I boutons, lo que indica que Dlg y Hts están en estrecha proximidad entre sí y existen en un complejo en la región postsináptica. (D) mutante NMJs para HTS no mostró ninguna señal de PLA observable. (EF) que se muestran son altos puntos de vista de magnificación de boutons individuales. (E) HTS y Dlg inmunorreactividad solapamiento groseramente en la región postsináptica. (F) PLA entre Dlg y Hts resultados en distintos puntos lagrimales que indica que sólo un subconjunto de las proteínas están en un complejo . La barra de escala en el Panel B '' representa 40 micras (AB ''); barra de escala en el Panel D '' representa 10 micras (CD ''); scale bar en el Panel F representa 5 micras (EF). Todos NMJs mostrados son de músculos 6/7 en el segmento abdominal 4. Las imágenes fueron tomadas como pilas fusionadas utilizando un escaneo láser confocal microscopio Nikon A1R con software NIS-Elements, y procesan con Adobe Photoshop. Haga clic aquí para ver una versión más grande de la figura.
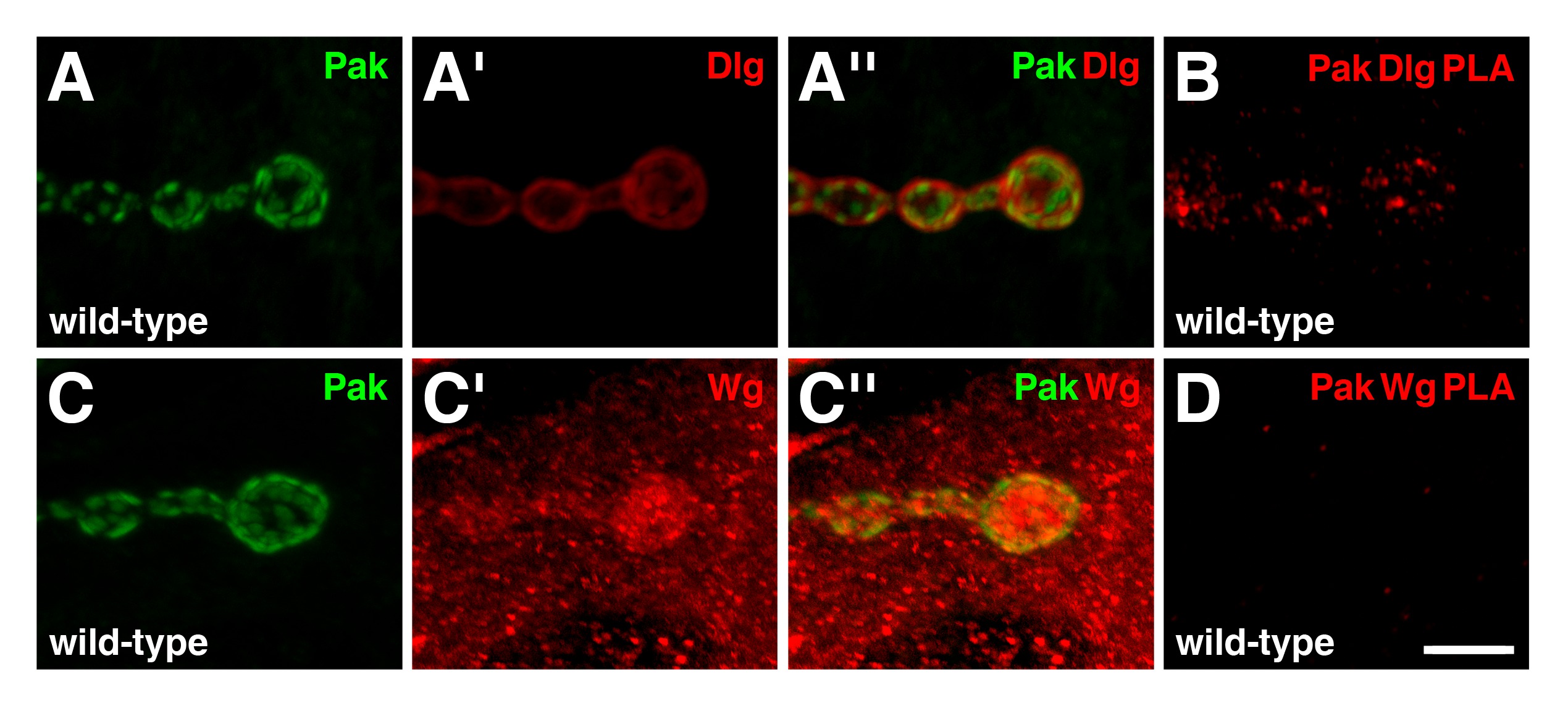
Figura 4: Pak existe en un complejo con Dlg, pero no el GT, en la región postsináptica de NMJs larvales (AD) Se muestran altas vistas de ampliación de unos boutons Las distribuciones de Pak (verde) y Dlg (AA '') (.. rojo) en NMJs de tipo salvaje. Pak localiza a la densidad postsináptica. Tenga en cuenta que las distribuciones inmunorreactivas de Pak y Dlg superponen en la región postsináptica. (B) b PLAntre Pak y Dlg (rojo) realizaron en NMJs de tipo salvaje. Se observa señal de PLA específicamente a la NMJ, indicando que las dos proteínas están en estrecha proximidad entre sí en esta región. Distribuciones de Pak (verde) y Wg (rojo) en NMJs de tipo salvaje (CC ''). Wg se enriquece en ambos lados presinápticos y postsinápticos de la NMJ, pero también está presente como puntos lagrimales en todo el músculo. Tenga en cuenta que también se observa la distribución de inmunorreactiva Pak para solaparse parcialmente con Wg en la región postsináptica. (D) PLA entre Pak y Wg (rojo) realiza en NMJs de tipo salvaje. No se observa ninguna señal específica PLA, lo que indica que las dos proteínas no son en estrecha proximidad entre sí en la NMJ a pesar de sus distribuciones se solapan. La barra de escala en el Panel D representa el 5 micras (AD). Todos NMJs inervan los músculos 6/7 en el segmento abdominal 4. Las imágenes fueron tomadas como pilas fusionadas utilizando un escaneo láser confocal microscopio Nikon A1R con software NIS-Elements, y prosar Adobe Photoshop. Haga clic aquí para ver una versión más grande de la figura.
Discusión
Este informe demuestra cómo PLA se puede aplicar a la Drosophila larval NMJ. El ensayo se realizó en preparaciones de músculo de la pared corporal de larvas para el propósito de la detección de interacciones proteína-proteína endógenos presentes en la NMJ. Con esta técnica, Dlg y Hts se muestran a estar en estrecha proximidad entre sí, y por lo tanto existir en un complejo, específicamente en la región postsináptica 27. En apoyo de este resultado, un estudio previo ha proporcionado pruebas de su asociación con los siguientes datos: 1) las distribuciones inmunorreactivas de Dlg y Hts superponen en la región postsináptica de NMJs larvales, 2) Dlg y Hts forman un complejo basado en co- experimentos de inmunoprecipitación que participe toda adulto vuela lisados, y 3) Dlg y Hts interactúan en tanto epiteliales y uniones sinápticas 8. Señal de PLA en la región postsináptica también se observó entre Dlg y Pak, una interacción identificado previamente en otros estudios, proporcionando de ese modo más credena vez de utilizar este ensayo en la UNM 15,20,21. Curiosamente, PLA entre Pak y el GT dio lugar a ninguna señal observable, a pesar de que sus distribuciones inmunorreactivas se superponen en la UNM. Este resultado demuestra que no todas las proteínas que muestran la superposición de las distribuciones inmunorreactivas generará una señal de PLA, por lo tanto, lo que indica que PLA proporciona una resolución más alta en la detección de interacciones proteína-proteína que los estudios de co-localización tradicionales.
Se hicieron varios cambios en el protocolo original PLA con el fin de optimizar el ensayo para la NMJ larval (datos no mostrados) 9,25. En primer lugar, se determinó que 1% de BSA es un mejor agente de bloqueo para las paredes del cuerpo en lugar de la solución de bloqueo proporcionado. En segundo lugar, para producir una fuerte relación señal-ruido, inmersión adecuado y mezcla de las paredes del cuerpo en las soluciones de reacción es crítico. Un mínimo de 200 l durante cinco a diez paredes del cuerpo en un tubo de 0,65 ml de microcentrífuga se consideró él apropiadole al incubar con el EPL sondas, ligasa o polimerasa, aunque los volúmenes se pueden aumentar en consecuencia al procesar más paredes del cuerpo. Intensidad de la señal también se ha mejorado mediante el aumento de los tiempos de reacción por 30 minutos más de los tiempos recomendados. En tercer lugar, se realizó una prueba de dilución en serie de las sondas de PLA para optimizar el equilibrio entre la conservación de reactivos y fuerza de la señal. Para los experimentos realizados en este informe, hasta una dilución uno y veinticinco - desde el recomendado dilución 1: 5 - todavía se puede producir una relación razonable de señal a ruido. Tenga en cuenta que la optimización de las reacciones de ligación y amplificación no se realizaron. Por último, como PLA puede ser sensible a los cambios de minutos, se recomienda encarecidamente que los diferentes genotipos de un solo experimento se colocan en un solo tubo de manera que los controles y los experimentos son tratados por igual durante el ensayo. Los genotipos se pueden distinguir por el corte de las esquinas de las paredes del cuerpo de manera diferente.
Several métodos se utilizan para detectar Drosophila interacciones proteína-proteína incluyendo la levadura de dos híbridos, co-inmunoprecipitación y FRET. Pero ¿cómo se comparan estos métodos contra PLA y su capacidad de visualizar las interacciones proteína-proteína in situ? Levadura de dos híbridos puede detectar directa de unión entre las proteínas de Drosophila expresadas en la levadura, y se ha utilizado en pantallas de todo el genoma de alto rendimiento. Aunque muchas de las interacciones identificadas son biológicamente relevantes, el ensayo suele producir falsos positivos. Además, los falsos negativos pueden producirse por varias razones: las proteínas se fusionan a los dominios del factor de transcripción que pueden interferir con la unión, muchas interacciones requieren modificaciones post-traduccionales que no se producen en la levadura, y el núcleo (donde el ensayo se lleva a cabo) puede no puede ser un medio ambiente adecuado para algunas interacciones para formar correctamente. Estas cuestiones no se encuentran con PLA, ya que se ocupa de las proteínas endógenas en su envir nativaAMBIENTE. Un método que se puede utilizar para detectar interacciones entre proteínas endógenas es co-inmunoprecipitación. Experimentos con lisados Drosophila pueden revelar el tejido y la etapa del ciclo vital en el que se produce una interacción. Sin embargo, como la formación de lisado implica romper las células para extraer las proteínas, las células dentro del tejido en el que la interacción se produce en, así como su localización subcelular, no se pueden evaluar - a diferencia de PLA. Además, co-inmunoprecipitación detecta complejo proteína de unión y no puede distinguir que las proteínas dentro del complejo están en estrecha proximidad entre sí. Hay métodos tales como FRET disponibles a Drosophilists que permiten la visualización de las interacciones proteína-proteína dentro de la célula. Sin embargo, FRET implica la sobreexpresión de las proteínas transgénicas fusionados con etiquetas fluorescentes y puede no reflejar el comportamiento de la proteína endógena como en PLA.
A pesar de sus ventajas, hay algunos limitationes cuando se utiliza PLA. Una de estas limitaciones es la disponibilidad de anticuerpos primarios contra las proteínas de interés que se hacen en diferentes especies. Este problema puede evitarse fácilmente con el uso de proteínas transgénicas etiquetados, aunque pueden no ser verdaderamente representativa de la interacción endógena. Otra cuestión es que PLA puede producir falsos negativos, por ejemplo, cuando los dos anticuerpos primarios impiden estéricamente entre sí o cuando el epítopo de uno de los anticuerpos primarios implica el sitio de interacción proteína-proteína. Además, aunque PLA detecta las proteínas que se encuentran en estrecha proximidad entre sí, que no distingue entre interacciones directas e indirectas proteína-proteína, a diferencia de en los ensayos de pull-down y el cribado de dos híbridos de levadura. Además, PLA entre proteínas endógenas no identificará los que los dominios son responsables de la interacción. Por lo tanto, todavía serán necesarios otros ensayos de interacción proteína-proteína para caracterizar completamente la interacción molecularly.
Los investigadores han comenzado a usar super-resolución microscopía para mapear la arquitectura espacial de la Drosophila larval NMJ, con resoluciones de decenas de nanómetros están logrando 26. PLA, con su resolución molecular comparable, debe proporcionar un bajo costo, técnicamente simple complemento de estos estudios que ayudarán en la creación de una vista detallada de la organización de las numerosas proteínas en la UNM.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Agradecemos a la Bloomington Drosophila Stock Center para proporcionar reservas de la mosca. También agradecemos al hibridoma Estudios del Desarrollo del Banco y el Dr. Lynn Cooley (Universidad de Yale) para proporcionar anticuerpos. Un agradecimiento especial a AhHyun Yoo por su ayuda en el manuscrito. Este trabajo fue apoyado por becas de Ciencias Naturales e Ingeniería de Investigación de Canadá (Krieger), el William y Fondo de acero Isabelle Ada (Krieger), y los Institutos Canadienses de Investigación en Salud (Harden).
Materiales
| Name | Company | Catalog Number | Comments |
| Forceps (fine #5) | Almedic | A10-704 | |
| Sylgard Disc | World Precision Instruments | SYLG184 | Mix elastomer base and curing agent in a 10:1 ratio. Set for 30 min. Pour into a mold (e.g. use a 12-well cell culture plate). Let cure for at least 24 hr. Adhere to the lid of a 60 x 15 mm Petri dish lid when dissecting. |
| Minutien Pins (0.0125 mm tip diameter) | Fine Science Tools | 26002-10 | |
| Microdissection Scissors (ultra fine) | Fine Science Tools | 15200-00 | |
| Platform Slides | Glue two 22 x 22 mm2 coverslips onto a microscope slide with clear nail polish, leaving a <20 mm gap in between for sample mounting. | ||
| w1118 | Bloomington Drosophila Stock Center | 3605 | |
| hts01103 | Bloomington Drosophila Stock Center | 10989 | Stock was re-balanced over a GFP balancer so that homozygous mutants can be selected based on the absence of GFP signal. |
| 1x PBS (Phosphate Buffered Saline): 3 mM NaH2PO4, 7 mM Na2HPO4, 130 mM NaCl, pH 7.0 | NaH2PO4 (Caledon Laboratories - 8180-1), Na2HPO4 (Caledon - 8120-1), NaCl (Caledon - 7560-1) | ||
| Bouin's Solution | Sigma-Aldrich | HT10132 | |
| 4% PFA (Paraformaldehyde): 4% PFA in 1x PBS | PFA (Anachemia Science - 66194-300). See doi:10.1101/pdb.rec9959 Cold Spring Harb Protoc 2006 for instructions on how to make the solution. | ||
| [header] | |||
| 1x PBT (Phosphate Buffered Saline with Triton): 1x PBS with 0.01% Triton | Triton X-100 (Sigma-Aldrich - T8787) | ||
| 1% BSA (Bovine Serum Albumin): 1% BSA in 1x PBT | BSA (Bioshop Canada - ALB001). Store at 4 °C. | ||
| mouse anti-Dlg (Discs large) | Developmental Studies Hybridoma Bank | 4F3 | Use at a 1:10 dilution in 1% BSA. |
| rabbit anti-HtsM (Hu-li tai shao) | Provided by Dr. Lynn Cooley (Yale University). Use at a 1:250 dilution in 1% BSA. | ||
| rabbit anti-Pak (p21-activated kinase) | Provided by Dr. Nicholas Harden (Simon Fraser University). Use at a 1:500 dilution in 1% BSA. | ||
| mouse anti-Wg (Wingless) | Developmental Studies Hybridoma Bank | 4D4 | Use at a 1:5 dilution in 1% BSA. |
| goat anti-Hrp (Horseradish peroxidase) | Jackson ImmunoResearch | 123-065-021 | Use at a 1:200 dilution in 1% BSA. |
| FITC-conjugated donkey anti-goat | Jackson ImmunoResearch | 705-095-003 | Use at a 1:200 dilution in 1% BSA. |
| Duolink In Situ PLA Probe anti-mouse MINUS | Sigma-Aldrich | DUO92004 | |
| Duolink In Situ PLA Probe anti-rabbit PLUS | Sigma-Aldrich | DUO92002 | |
| Duolink In Situ Detection Reagents Red | Sigma-Aldrich | DUO92008 | |
| 1x Wash Buffer A: 0.01 M Tris, 0.15 M NaCl, 0.05% Tween 20, pH 7.4 | Sigma-Aldrich | DUO82049 | Tris (Caledon Laboratories - 8980-1), NaCl (Caledon - 7560-1), Tween 20 (Fisher Scientific - BP337) |
| 1x Wash Buffer B: 0.2 M Tris, 0.1 M NaCl, pH 7.5 | Sigma-Aldrich | DUO82049 | Tris (Caledon Laboratories - 8980-1), NaCl (Caledon - 7560-1) |
| 0.01x Wash Buffer B: 2 mM Tris, 1 mM NaCl, pH 7.5 | Sigma-Aldrich | DUO82049 | Tris (Caledon Laboratories - 8980-1), NaCl (Caledon - 7560-1) |
| Duolink In Situ Mounting Medium with DAPI | Sigma-Aldrich | DUO82040 | |
Referencias
- Woods, D. F., Bryant, P. J. The discs-large tumor suppressor gene of Drosophila encodes a guanylate kinase homolog localized at septate junctions. Cell. 66, 451-464 (1991).
- Yamanaka, T., Ohno, S. Role of Lgl/Dlg/Scribble in the regulation of epithelial junction, polarity and growth. Front Biosci. 13, 6693-6707 (2008).
- Humbert, P. O., et al. Control of tumourigenesis by the Scribble/Dlg/Lgl polarity module. Oncogene. 27, 6888-6907 (2008).
- Lahey, T., Gorczyca, M., Jia, X. X., Budnik, V. The Drosophila tumor suppressor gene dlg is required for normal synaptic bouton structure. Neuron. 13, 823-835 (1994).
- Ataman, B., Budnik, V., Thomas, U. Scaffolding proteins at the Drosophila neuromuscular junction. Int Rev Neurobiol. 75, 181-216 (2006).
- Thomas, U., Kobler, O., Gundelfinger, E. D. The Drosophila larval neuromuscular junction as a model for scaffold complexes at glutamatergic synapses: benefits and limitations. J Neurogenet. 24, 109-119 (2010).
- Matsuoka, Y., Li, X., Bennett, V. Adducin: structure, function and regulation. Cell Mol Life Sci. 57, 884-895 (2000).
- Wang, S., et al. Drosophila adducin regulates Dlg phosphorylation and targeting of Dlg to the synapse and epithelial membrane. Dev Biol. 357, 392-403 (2011).
- Soderberg, O., et al. Characterizing proteins and their interactions in cells and tissues using the in situ proximity ligation assay. Methods. 45, 227-232 (2008).
- Brent, J. R., Werner, K. M., McCabe, B. D. Drosophila larval NMJ dissection. J Vis Exp. (24), (2009).
- Ramachandran, P., Budnik, V. Immunocytochemical staining of Drosophila larval body-wall muscles. Cold Spring Harb Protoc. 2010, (2010).
- Ramachandran, P., Budnik, V. Dissection of Drosophila larval body-wall muscles. Cold Spring Harb Protoc. , (2010).
- Ashburner, M. . Drosophila: A Laboratory Manual. , (1989).
- Brent, J., Werner, K., McCabe, B. D. Drosophila larval NMJ immunohistochemistry. J Vis Exp. (25), (2009).
- Parnas, D., Haghighi, A. P., Fetter, R. D., Kim, S. W., Goodman, C. S. Regulation of postsynaptic structure and protein localization by the Rho-type guanine nucleotide exchange factor dPix. Neuron. 32, 415-424 (2001).
- Petrella, L. N., Smith-Leiker, T., Cooley, L. The Ovhts polyprotein is cleaved to produce fusome and ring canal proteins required for Drosophila oogenesis. Development. 134, 703-712 (2007).
- Pielage, J., Bulat, V., Zuchero, J. B., Fetter, R. D., Davis, G. W. Hts/Adducin controls synaptic elaboration and elimination. Neuron. 69, 1114-1131 (2011).
- Spradling, A. C., et al. The Berkeley Drosophila Genome Project gene disruption project: Single P-element insertions mutating 25% of vital Drosophila genes. Genetics. 153, 135-177 (1999).
- Bokoch, G. M. Biology of the p21-Activated Kinases. Annu Rev Biochem. 72, 743-781 (2003).
- Bahri, S., et al. The leading edge during dorsal closure as a model for epithelial plasticity: Pak is required for recruitment of the Scribble complex and septate junction formation. Development. 137, 2023-2032 (2010).
- Albin, S. D., Davis, G. W. Coordinating structural and functional synapse development: postsynaptic p21-activated kinase independently specifies glutamate receptor abundance and postsynaptic morphology. J Neurosci. 24, 6871-6879 (2004).
- Koles, K., Budnik, V. Wnt signaling in neuromuscular junction development. Cold Spring Harb Perspect Biol. 4, (2012).
- Packard, M., et al. The Drosophila Wnt, wingless, provides an essential signal for pre- and postsynaptic differentiation. Cell. 111, 319-330 (2002).
- Weibrecht, I., et al. Proximity ligation assays: a recent addition to the proteomics toolbox. Expert Rev Proteomics. 7, 401-409 (2010).
- Thymiakou, E., Episkopou, V. Detection of signaling effector-complexes downstream of bmp4 using PLA, a proximity ligation assay. J Vis Exp. (49), (2011).
- Maglione, M., Sigrist, S. J. Seeing the forest tree by tree: super-resolution light microscopy meets the neurosciences. Nat Neurosci. 16, 790-797 (2013).
- Wang, S., et al. . Biol. Open. 3 (12), 1196-1206 (2014).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados