Method Article
검출
요약
이 프로토콜은 근접 내고 분석은 초파리 애벌레 신경 근육 접합부에서 현장 단백질 - 단백질 상호 작용을 검출 할 수있는 방법을 보여줍니다. 이 기술, 디스크 크고 후진타오 - 리 타이 샤오는 시냅스 지역에서 복잡한, 이전에 공동 면역 통해 식별 관계를 형성하기 위해 표시됩니다.
초록
Discs large (Dlg) is a conserved member of the membrane-associated guanylate kinase family, and serves as a major scaffolding protein at the larval neuromuscular junction (NMJ) in Drosophila. Previous studies have shown that the postsynaptic distribution of Dlg at the larval NMJ overlaps with that of Hu-li tai shao (Hts), a homologue to the mammalian adducins. In addition, Dlg and Hts are observed to form a complex with each other based on co-immunoprecipitation experiments involving whole adult fly lysates. Due to the nature of these experiments, however, it was unknown whether this complex exists specifically at the NMJ during larval development.
Proximity Ligation Assay (PLA) is a recently developed technique used mostly in cell and tissue culture that can detect protein-protein interactions in situ. In this assay, samples are incubated with primary antibodies against the two proteins of interest using standard immunohistochemical procedures. The primary antibodies are then detected with a specially designed pair of oligonucleotide-conjugated secondary antibodies, termed PLA probes, which can be used to generate a signal only when the two probes have bound in close proximity to each other. Thus, proteins that are in a complex can be visualized. Here, it is demonstrated how PLA can be used to detect in situ protein-protein interactions at the Drosophila larval NMJ. The technique is performed on larval body wall muscle preparations to show that a complex between Dlg and Hts does indeed exist at the postsynaptic region of NMJs.
서문
큰 초파리 디스크 (굴림)은 세포막의 특정 사이트에서 큰 단백질 복합체의 조립을 조율 도움이 단백질 비계의 막 관련 구 아닐 키나제 가족의 보존 회원입니다. 종양 억제 단백질, 굴림은 상피 apicobasal 극성 1,2,3를 결정하는 중요한 역할로 원래 확인했다. 굴림 또한 유생 4시 글루타메이트 운동 신경의 신경 근육 접합 (NMJ)에서 중요한 발판 모듈 역할을한다. DLG는 애벌레 NMJ에서 다양한 역할을 수행하고, 그 pleiotropism 여러 단백질 5,6와 연결하는 능력에 의존한다. 하나는 이러한 단백질은 후진타오 - 리 타이 샤오 (HTS), 주로 7 골격 액틴 스펙 트린을 조절하는 역할에 관해서 설명 된 포유류 adducins에 상동입니다. 이것은 이전과 굴림 HTS 시험관에 기초하여 서로 착체를 형성 할 수 있음을 보여왔다 전체 성인 플라이 해물 (8)을 포함하는 공동 면역 침전 실험. 이러한 결과의 단점 중 하나는, 그러나, 그들이 어디에이 복잡한 형태를 나타내지 않는다는 것이다. 면역 조직 화학 염색의 사용으로, 굴림과 HTS의 분포는 애벌레 NMJs의 시냅스 막에 겹쳐 관찰되지만,이 지역 8 복잡한에? 최근에 보여 여기에서 더 자세히 설명, 근접 내고 분석 (PLA)는 애벌레 NMJ 27 구체적으로 굴림과 HTS 사이의 현장 연관을 찾기 위해 사용됩니다.
PLA는 주로 9 동일계 단백질 - 단백질 상호 작용을 검출 할 수있는 세포 및 조직 배양에 사용되는 비교적 새로운 기술이다. 이 분석에서, 관심의 단백질에 대해 두 일차 항체 종 특이 이차 항체의 쌍의 검출 올리고 뉴클레오타이드에 접합되는 프로브를 PLA, 명명 (도 1A, B). 두 단백질의 경우S는 첨부 PLA 프로브 사이의 거리가 두 개의 추가 커넥터 올리고 뉴클레오티드 (도 1C)의 하이브리드 화를 통해 가교 될 수있다 (수십 나노 미터 내의 IE) 서로 근접하게된다. 이 형태에서, 올리고 뉴클레오티드 커넥터의 자유 단부가 서로 접촉 할 정도로 가까운 및 닫힌 원형 DNA 분자가 라이 게이션 동일계에서 (도 1D)에 형성 될 수있다. 원형 DNA 분자는 PLA 프로브 (그림 1E)에 결합 올리고 뉴클레오티드 중 하나에 의해 준비가 끝났다 현장에서 롤링 원 증폭을위한 템플릿 역할을합니다. 그 결과 증폭, concatemeric DNA 제품 내에서 시퀀스는 다음 형광 표지, 보완 올리고 뉴클레오티드 프로브 (그림 1 층)로 시각화 할 수 있습니다. 증폭 된 DNA는 PLA 프로브 중 하나, 단백질 - 단백질 상호 작용 withi의 세포 내 위치 파악에 부착되는 방식 때문에NA 조직을 용이하게 확인 될 수있다.
여러 가지 방법이 일반적으로, 이러한 공동 면역 침전 등의 체외 기술을 포함하여 단백질 - 단백질 상호 작용을 검출 (-풀다운 분석 및 효모 두 하이브리드 심사, 및 포스터 공명 에너지 전달 (FRET) 및 생체 분자 형광 보완 등의 생체 기술에 사용됩니다 BiFC). 시험 관내 기법 함정 상호 내생 발생되는 경우에, 상기 생체 기술 내인성 대응의 기본 동작을 반영하지 않을 융합 단백질의 인공 표현을 수반하면서 이들이 식별하지 않는다는 것이다. PLA의 하나의 주요 장점은 FR에 비교되는 신호를 생성하는 데 필요한의 근사 정도, 조직 내에서 서로 가까운 위치에 있고 가능성 착체를 형성 내인성 단백질 인터랙의 세포 내 위치 파악을 결정하는 능력이ET와 BiFC. PLA 인해 항체 인식 및 DNA 증폭의 결합에 높은 특이성과 민감도와의 상호 작용을 검출 할 수있다. 따라서, 분석은 상호 작용의 정확한 위치를 드러내 puncta의 형태의 이산, 밝은 신호를 생성 할 수있다. 또한, 부족하게 보이는 항원을 검출 할 수있다. 마지막으로, PLA는 수행 할 수있는 비교적 간단한 기술 없으며,이를 완료하는 데 표준 면역 절차보다 더 오래 걸립니다. 따라서, PLA는 종종 긴 준비 시간과 광범위한 문제 해결 퍼진 다른 단백질 - 단백질 상호 작용 분석을 통해 기술적 이점을 제공한다.
이 프로토콜은 PLA가 반응계 내에서 내인성 단백질 - 단백질 상호 작용을 검출하기위한 목적 초파리 애벌레 NMJ 어떻게 적용될 수 있는지를 보여준다. 여기에, PLA는 굴림과 HTS가 실제로 NMJs의 시냅스 부위에 복잡한에 존재하는 것으로 표시됩니다 애벌레 몸 벽 근육 준비에 수행. PLA는 이전에 애벌레 NMJ을 연구하는 데 사용되지 않은, 초파리의 조직이 분석을 사용한 출판 논문의 단지 소수는 현재이 있습니다. 그것은 초파리 사회에 PLA의 추가 노출이 다른, 더 일반적으로 사용되는 단백질 - 단백질 상호 작용 분석을 보완하기 위해 추가 도구로 그 사용이 증가 될 것으로 기대된다.
프로토콜
1. 몸 벽 준비
. 참고 : 이전에 브렌트 등 10 또는 라마 찬드 및 Budnik (11, 12)에 설명 된대로 (몸 벽 근육에 분포 NMJs의 연구를위한) 셋째 령 애벌레 몸 벽의 준비하지만 일부 수정을 수행했다.
- 해부
- 표준 절차 (13)를 사용하여 5~6일 25 ° C에서 플라이 주식과 십자가를 올립니다.
- 미세 집게를 사용하여 유리 병 또는 병에서 세번째 령 유충 크롤링을 선택합니다.
- 음식 입자를 제거하기 위해 인산 버퍼 식염수 (PBS)를 포함하는 작은 페트리 접시에 유충을 씻으십시오.
- 실 가드 디스크에 하나의 애벌레를 놓고 얼음처럼 차가운 PBS 몇 방울에 몰입. 얼음처럼 차가운 PBS는 조작하기 쉽게 만드는 유충 기절 도움이됩니다 사용. 해부 전반에 걸쳐 준비가 항상 건조되는 것을 방지하기 위해 PBS에 빠져들되어 있는지 확인합니다.
- 라의 위치를그 등쪽 두 기관 책자는 해부 현미경 (그림 2A)에서 볼 수 있습니다 너무 위로 향하게 RVA. 집게를 사용하면, minutien 핀을 파악 spiracles (그림 2B) 근처의 후방 끝 부분에 유충을 고정합니다. 다른 핀으로, 입 후크 근처 앞쪽 끝 부분에있는 표피 관통. 부드럽게 한 다음, 길이 유충을 스트레칭 (그림 2B)를 아래로 핀.
- 미세 절제 가위를 사용하여 작은 구멍을 만드 핀 근처 후단을 꼬집어. 절개는 표피를 통과 할만큼 피상적해야한다.
- 두 기관 책자 (그림 2C) 사이의 등쪽 정중선의 전체 길이를 따라 절단, 절개로 가위의 아래쪽 블레이드의 팁을 배치. 복부 몸 벽 근육 손상을 방지하기 위해 절단시 약간 위쪽으로 가위 블레이드를 가리 킵니다.
- 약간 포스트 앞쪽에 작은 수평 절개를합니다eriorly - 위치 핀 (그림 2C). 다른 유사한 절개 약간 전방-배치 핀 (그림 2C) 후부합니다. 절개는 표피를 통과해야한다.
참고 : 유사합니다 결합 단계 1.1.7과 1.1.8에서 세 절개 "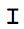 완료 할 때 ", 즉, 애벌레 몸의 등 쪽의 왼손 및 오른손 플랩이 생성되어야한다.
완료 할 때 ", 즉, 애벌레 몸의 등 쪽의 왼손 및 오른손 플랩이 생성되어야한다. - 조심스럽게 집게와 내부 장기를 청소. PBS의 몇 가지 강력한 방울을 추가하면, 애벌레 몸에서 장기를 대체하여 쉽게 제거 할 수있게 도와 줄 것입니다. 그것은 몸 벽 근육에 손상을 원인이됩니다 애벌레 몸을 파고하지 마십시오.
- 열린 애벌레 몸을 펼쳐라 아래 모서리 (그림 2D)를 핀. 피닝시 균일 텐션 사각형을 형성하도록 수평 및 수직 체벽 스트레칭 (SE전자 그림 모양에 대한 2G), 돌보는이 과정에서 몸 벽 근육이 찢어지지.
- 남아있는 내부 장기 (그림 2E)를 제거 완료.
- 고정 및 투과성으로
- 보우 인의 솔루션의 몇 방울에 고정 된 본체 벽을 담근다. 얼음에 15 분 동안 품어. 대안으로, 대안 고착성 등 4 % 파라 포름 알데히드 (PFA)를 사용한다; 30 분 동안 품어.
- 트리톤과 인산 버퍼 식염수 (PBT)로 3 회 씻어.
- 미세 핀셋으로 조심스럽게 핀을 제거하고 실리콘 화 0.65 ml의 마이크로 원심 분리 튜브에 그 모서리를 본체의 벽을 전송.
- PLA를 위해 준비 될 때까지 4 ° C에서 PBT의 몸 벽을 저장합니다. 최적의 결과를 얻으려면 하루 해부의 두 내 몸 벽을 면역 염색 시작합니다.
참고 : 시약에 저장하고 신체의 모든 벽은 분석 기간 동안 동등하게 취급되도록, 다른 유전자형은 하나에 배치 할 수 있습니다튜브. 유전형 (예는도 2F 참조) 다르게 몸체 벽의 모서리를 절단함으로써 구별 될 수있다.
2. 면역 조직 화학
참고 :. 셋째 령 애벌레 몸 벽의 면역 염색은 이전 브렌트 등 14 라마 찬드 및 Budnik (11)에 설명 된대로 수행하지만, 일부 수정 11,14와했다.
참고 : 달리 명시되지 않는 실내 온도에서 교반과 함께 모든 단계를 수행합니다.
- 블로킹
- 10 분마다 PBT로 3 회 보디 벽을 씻는다.
- 1 시간 동안 1 % 소 혈청 알부민 (BSA)로 차단합니다.
- 면역 염색
- 관심 두 단백질에 대해 마우스 및 토끼 일차 항체와 본체의 벽을 인큐베이션을 실온에서 2 시간 또는 밤새 39 ° C (1 %의 BSA에 희석). 250 토끼이 경우 1:10 마우스 항 굴림 및 1을 사용NTI-HTSM (15, 16). 하지 마우스 나 토끼에서 만들어진 마커에 대한 항체도 포함 할 수있다 - 예를 들어, 1을 사용 : 200 염소 항 - HRP는 신경 세포막을 윤곽을 그리다.
- 10 분마다 PBT로 3 회 세척 할 것.
- 실온에서 2 시간 또는 밤새 39 ° C (1 %의 BSA에 희석) 마커를 검출하기 위해 형광 접합 된 이차 항체와 함께 배양한다. HRP 염소 항 - 항체를 검출하기 위해 200-FITC 접합 항 - 염소 : 예 1을 사용 - PLA 신호 이후 적색 형광 가시화 된 바와 같이, 형광 물질은 다른 마커를 검출하기 위해 사용되어야한다. 때문에 빛에 민감한 시약의 사용, 이후이 시점에서 어둠 속에서 튜브를 유지.
참고 : PLA는 공 초점 현미경 아래에서 빨강 채널에서 시각 신호와, 마우스 및 토끼에서 제기 된 주요 항체 사이에 수행 할 수에 사용되는 키트는 할 수 있습니다. 원하는 경우, 다른 키트는 분석이 주역으로 수행 할 수 있도록 그 사용할 수 있습니다RY 항체는 다른 종에서 발생하고, 신호는 다른 채널에 가시화.
3. 근접 내고 분석
참고 : 달리 명시되지 않는 실내 온도에서 교반과 함께 모든 단계를 수행합니다.
- PLA 프로브
- 10 분마다 PBT로 3 회 보디 벽을 씻는다.
- 37 ° C에서 2 시간 동안 (5 희석 1 % BSA 각 1) PLA의 프로브를 품어. 이 경우, 5-10 몸체 벽의 적당한 침지 및 혼합을 보장하기 PLA 프로브 항 - 마우스 마이너스 40 μL, PLA 프로브 항 - 토끼 PLUS 40 μL와 1 % BSA 120 μl를 사용한다. PLA 프로브 1시 25분 희석율 여전히 (이 실험 예) 적절한 신호 대 잡음 비율을 초래할 수있다.
- 결찰
- 5 분 각각에 대해 두 번 세척 버퍼와 신체 벽을 씻으십시오.
- 1 시간에 대한 연결 용액 (결찰 완충액 리가 아제 1시 40분 희석)과 인큐베이션t 37 ° C의. 이 경우, 본체 5-10 벽의 적절한 혼합 및 침지를 위해 리가 아제 5 μL, 5 결찰 완충액 40 μL 및 고순도의 물 155 μl를 사용한다.
- 확대
- 2 분 각각에 대해 두 번 세척 버퍼와 신체 벽을 씻으십시오.
- 37 ° C에서 2 시간 동안 증폭 용액 (증폭 완충액 폴리머 라제 1:80 희석)으로 배양한다. 이 경우, 본체 5-10 벽의 적절한 혼합 및 침지를 위해 폴리머 라제 2.5 μL, 5 증폭 완충액 40 μL 및 고순도 157.5 μL의 물을 사용한다.
- 이미징을위한 준비
- 10 분 각각에 대해 두 번 세척 버퍼 B와 몸 벽을 씻으십시오.
- 1 분에 대해 한 번 0.01x 워시 버퍼 B 씻으시오.
- 장착하기 전에 적어도 30 분 동안 장착 솔루션의 몇 방울의 평형, 또는 4 ℃에서 하룻밤 저장합니다.
- 미세 집게를 사용하여 조심스럽게 플랫폼 슬라이드 w에 몸 벽을 전송i 번째 자신의 손톱이 아래를 향. 행과 mountant의 하락 또는 두 내에서 같은 방향으로 몸 벽을 배치합니다. 다음 투명 매니큐어와 슬라이드를 밀봉, 공기 방울을 발생하지 않도록 준비를 돌보는 동안 22mm X 40mm coverslip에 배치합니다.
- 공 초점 이미징을위한 준비가 될 때까지 -20 ° C에서 어둠 속에서 슬라이드를 저장합니다.
결과
야생 형의 제 3 령 애벌레 NMJs에서 굴림은 주로 유형의 종말보다 굴림 면역 수준이 형 IB의 종말에서 더 두드러 인 상태, I 형 글루타메이트 종말의 시냅스 막에서 발견된다 (그림 3A) 4. HTS는 근육에 걸쳐 존재하지만 HTS 면역 수준이 두 유형 I 종말 동일 표시와 시냅스 부위에 집중하고, 또한 (그림 3A ') 8,17 시냅스 발견된다. 굴림과 HTS의 분포가 크게 시냅스 영역 (그림 3A '') 8시에 중복 있습니다.
굴림과 HTS는 NMJ에서 복잡한에 존재하는지 확인하려면, PLA는 두 단백질 사이에 애벌레 몸 벽 근육 준비에 실시 하였다. 이 분석, N 말단 및 토끼 항 HTSM 항체에서 제 PDZ 도메인을 검출하는 마우스 항 통해 Dlg 항체즉, C 말단 MARCKS 상동 도메인 (15, 16)를 검출 하였다. 야생형, 굴림 HTS와 PLA 사이의 신호는 구체적 NMJ (도 3C-C '')에 존재 하였다. 따라서, 신호는 거의 굴림 및 HTS이 서로 가까운 위치에 있고 가능성 시냅스 영역에서 복합체를 형성하는 것을 나타내는, HRP에 의해 I 형 demarked 하였다 종말의 시냅스 전 막에 원주 지역화. 결과는 HTS에게 면역 결여 HTS 01103 돌연변이 NMJs 관련된 우리의 음성 대조군 구체적으로 측정되었다 (도 3B-B ''는) 관측되지 PLA 신호 (도 3d) 8,17,18 없었다. 또한, PLA (데이타 미기재) 신호를 생성하지 토끼 항 HTSM 항체를 첨가하지 않고 수행. 종말의 높은 배율의 뷰는 굴림과 HTS 면역이 크게 시냅스 부위에 중첩 것으로 나타났다 (그림 3E)두 단백질 사이의 PLA 반면 총 굴림 HTS 및 단백질의 일부만 착체 (도 3f)에 나타내는 신중한 puncta의 결과.
더 애벌레 NMJ을 연구하는 도구로 PLA의 안정성을 테스트하기 위해, 우리는 또한 세린 / 트레오닌 p21의 활성화 키나아제, 박세리, 그리고 다른 시냅스 단백질 (19) 사이의 상호 작용을 평가 하였다. 이전 공동 면역 침전 실험은 박세리가 굴림도 부재 (20)가되는 낙서 복합체의 구성원 인 것으로 나타났습니다. 야생형 NMJs에서 박 그것이 굴림 지역화 15,21 필요 시냅스 밀도 (도 4a, C)에 편재. 박세리와 굴림의 면역 분포는 특히 NMJ (그림 4B)에서 긍정적 인 신호 결과 두 단백질 사이의 시냅스 영역 (그림 4A '')에서 중복 및 PLA. 이러한 결과는 두 단백질 C에 있다는 것을 나타낼 서로 근접을 잃고 가능성이 지역의 복합체를 형성한다. 우리가 결합 박의 복잡한 검사를 또 다른 시냅스 단백질은 날개없는 WG (), NMJ (22)에 많은 역할을한다 초파리의 Wnt 리간드했다. 야생형, 워킹 그룹은 I 형의 종말 및 시냅스 전 시냅스 농후 측에, 또한 근육 세포질 (도 4C ') 23 puncta에 걸쳐로서 존재한다. 박 및 WG의 활동 면역 분포가 부분적으로 시냅스 영역 (그림 4C '')에서 중복하지만 흥미롭게도, PLA는 두 단백질 사이에 더 관찰 신호 (그림 4D)을 생산하지 않습니다. 따라서, 박 및 워킹 그룹 NMJ에서 서로 가까이에 있지 않습니다. 이 결과는 기존의 공동 현지화 실험을 통해 중복 면역 반응을 보여 모든 단백질은 PLA 신호를 생성 할 것을 증명하고, 추가 음성 대조군 역할을합니다.
항상 "> :"유지 - together.within 페이지를 = FO "천만에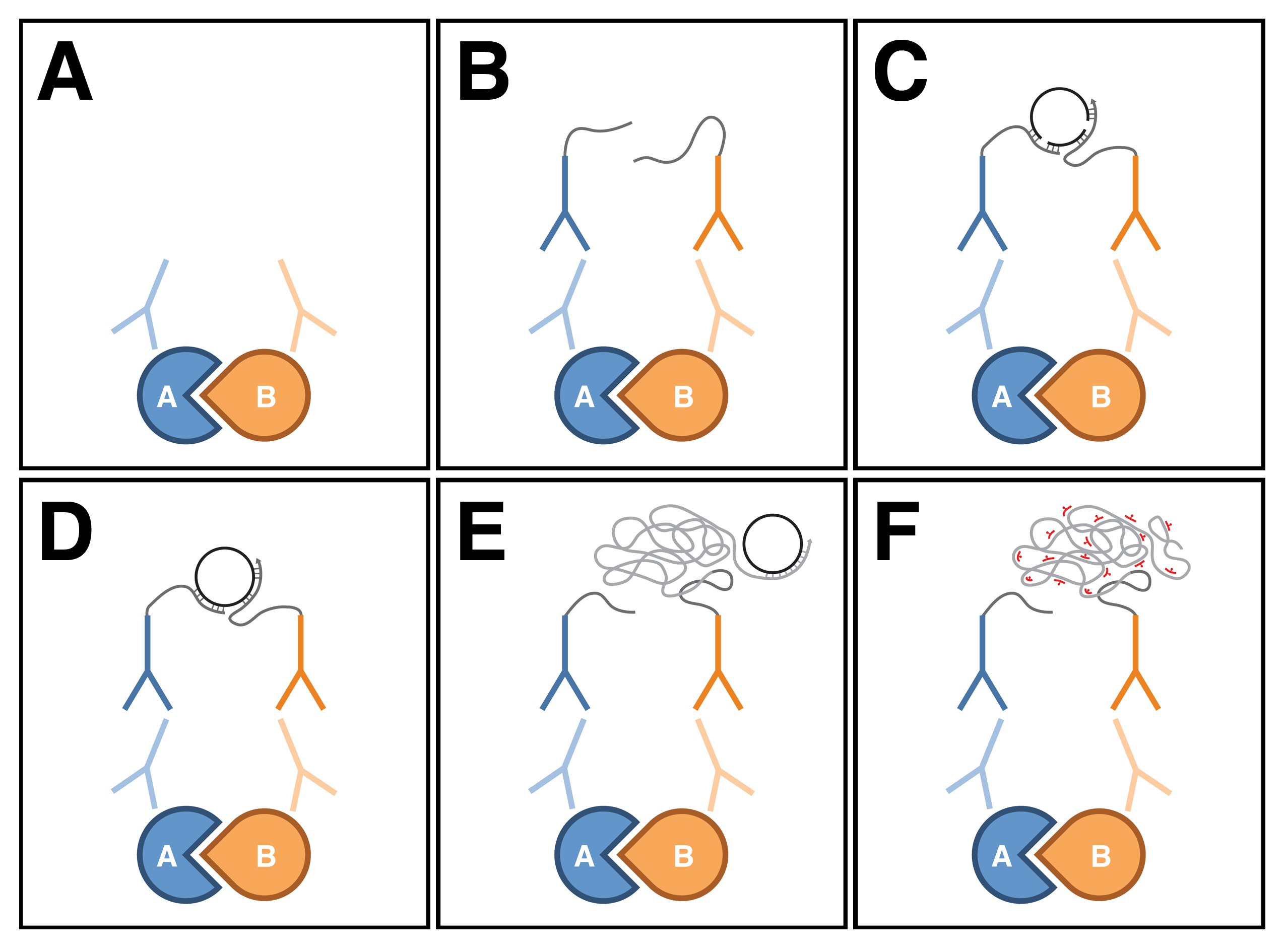
그림 1 : 근접 내고 분석의 개략도. (A) 1 차 항체가 표준 면역 조직 화학적 방법을 사용하여 관심있는 두 단백질에 결합한다. (B)를 일차 항체이어서 종 특이 이차 항체의 쌍의 검출 올리고 뉴클레오타이드에 접합되는 PLA 프로브를 불린다. (C)하면 두 단백질이 서로 가까운 위치에, 부착 PLA 프로브 사이의 거리가 두 개의 추가 커넥터 올리고 뉴클레오타이드 혼성화를 통해 가교 될 수있다. (D) 본 형태에서는, 커넥터 올리고 뉴클레오티드 시츄 결찰에 따라 닫힌 원형 DNA 분자를 형성 할 수있다 . (E)은 원형 DNA 분자는 OLI 프라이머 중 하나에 의해 증폭되는 원을 압연 시츄위한 템플릿 역할증폭 된 DNA 제품 내에서 PLA 프로브에 결합 gonucleotides. (F) 시퀀스는 다음 형광 표지, 보완 올리고 뉴클레오티드 프로브로 검출된다. 그림이 Weibrecht 등. (24)에 기반합니다. 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2 : 세 번째 령 애벌레 몸 벽의 준비. 전방 및 후방 끝 (AF) 몸 벽 해부를 나타내는 개략도. (A)의 등쪽 두 기관 책자 볼 수 있도록 위로 향하게 실 가드 디스크에 하나의 애벌레를 놓습니다. (B) 핀은 유충 아래로 그 과정에서 길이 유충을 스트레칭 minutien 핀,와. (C) 미세 절제 가위와 애벌레 몸의 등쪽에 세 개의 절개를합니다. 절개 청소 '완료 할 때'내가 ''. (D) 균등 텐션 사각형을 형성하는 과정에서 수평 및 수직으로 몸 벽 스트레칭, 열린 애벌레 몸을 펼쳐라 아래 모서리를 고정. (E)를 유사합니다 밖으로 나머지 내장. (F) 표시됨 다른 유전자형을 구별하기 위해 몸체 벽의 모서리를 절단하는 여러 방법의 예이다. 연신 체벽의 제조 (G)보기 완료. 사진은 해부 현미경 상에 장착, 디지털 카메라로 촬영했다. 패널 F의 스케일 바는 1mm를 나타냅니다. 그림이 라마 찬드 및 Budnik 2010 년 (12)에 기반합니다. 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
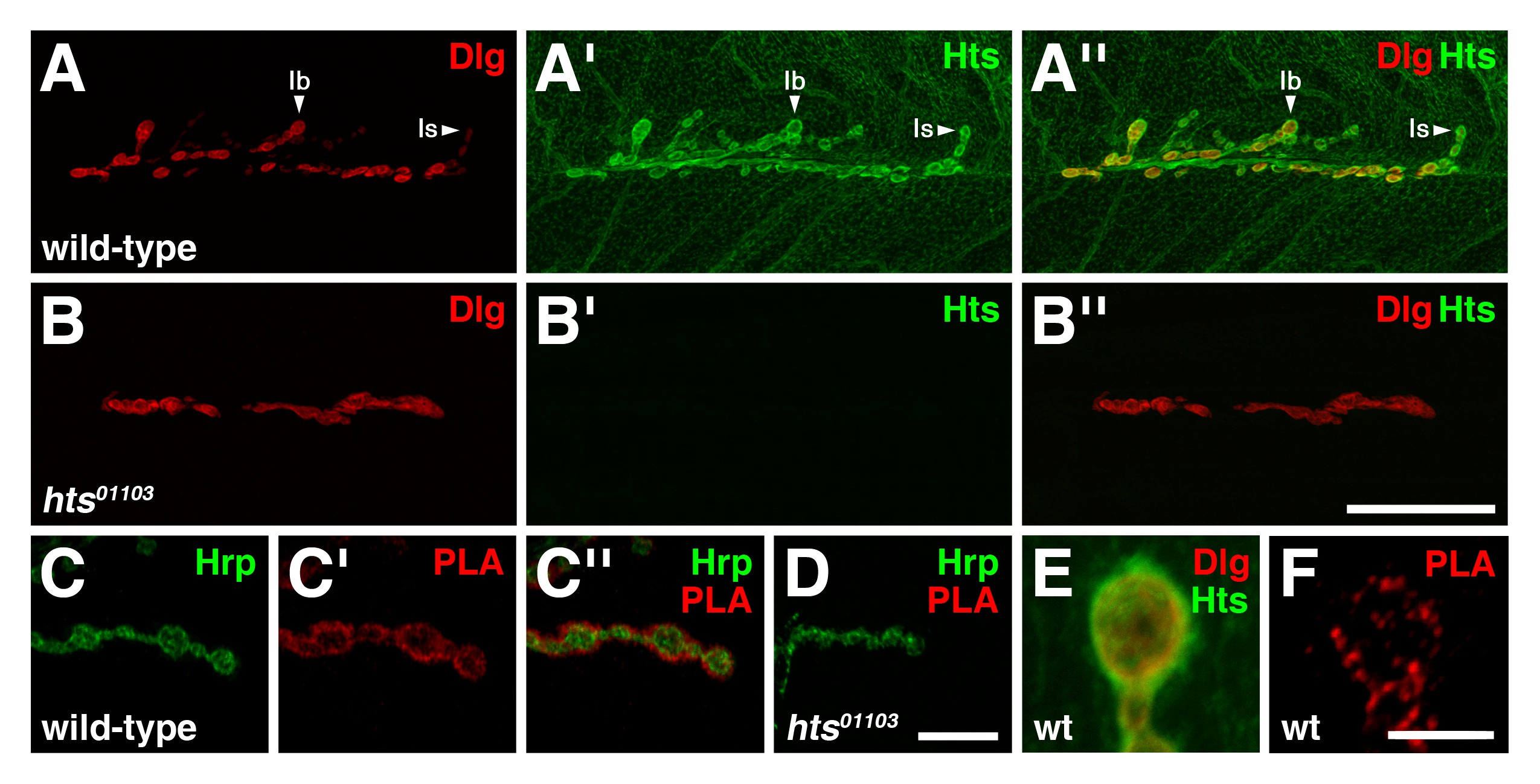
그림 3 :. 굴림과 HTS는 '돌연변이 NMJs을 야생형에서 굴림 (빨간색)와 HTS (녹색)의 분포와 HTS (AA를. 애벌레 NMJs의 시냅스 지역에서 단지에 (AB')를 '존재') 야생에서 NMJs π 형, 굴림은 주로 굴림 수준이 종말보다 Ib 형에서 더 두드러 인 상태, 유형 I 종말의 시냅스 막에서 발견된다. HTS는 근육에 걸쳐 존재하지만 또한 HTS 수준이 두 유형 I 종말에서와 동일하게, 시냅스 지역 주위에 집중하고 있습니다. 굴림과 HTS의 분포는 시냅스 지역. (BB '') HTS에 대한 NMJs 돌연변이가 HTS 면역 부족에서 중첩된다. HTS 01103 돌연변이 효과 NMJ 8 분기 있습니다. (CD '') 굴림과 HTS 사이의 PLA을 (빨간색)는 야생형에 수행 돌연변이 NMJs을 HTS. HRP는 신경 막 (녹색)를 표시하는 데 사용됩니다. 몇 종말. (CC ') 야생형의 고배율 뷰 제시된, PLA 신호 NMJ 구체적으로 관찰된다. 신호는 주로 굴림 및 HTS이 서로 가까운 위치에 있고 시냅스 영역 At 복합체에 존재하는지 나타내는 유형 I 종말의 시냅스 전 막에 원주 지역화. HTS 대 (D) NMJs 변이체는 관측되지 PLA 신호를 나타내지 않았다. 단백질의 부분 집합 만이 복잡한에있는 것을 나타내는 (EF) 단일 종말의 높은 배율의 뷰가있는 바와 같다. (E) 시냅스 지역에서 HTS와 굴림 면역 심하게 중복. 별개의 puncta의에서 굴림과 HTS 결과 사이의 (F) PLA . '패널 B의 스케일 바'( '40 μm의 AB)를 나타내는'; '패널 D 규모 바'( '10 μm의 CD)를 나타내는'; SCAL패널 F에서 전자 줄에 5 μm의 (EF)를 나타냅니다. 표시된 모든 NMJs 4. 이미지가 NIS-요소 소프트웨어 니콘 A1R 레이저 스캐닝 공 초점 현미경을 사용하여 통합 스택으로 간주하고, 어도비 포토샵으로 처리 된 복부 세그먼트의 근육 6/7에서 있습니다. 더 큰 버전을 보려면 여기를 클릭하십시오 그림.
그림 4 : 박세리는 애벌레 NMJs의 시냅스 부위에 작업반 (WG)을 굴림과 복합체에 존재하지만 도시하지 않음 (AD)는 몇 종말의 고배율도이다 (AA '') 박세리 (녹색)과 굴림의 분포를 (.. 야생형 NMJs 빨간색). 박세리는 시냅스 밀도 지역화. 박세리와 굴림의 면역 분포가 시냅스 부위에 중첩합니다. (B) PLA의 Between 박과 굴림 (적색) 야생형 NMJs에서 수행. PLA 신호는 두 단백질이이 영역에서 서로 가까이에있는 것을 나타낸다 NMJ에서 구체적으로 관찰된다. (CC ') 야생형 NMJs에서 박 (녹색)를 Wg (적색)의 배포판. WG는 NMJ의 시냅스 및 시냅스 후 양측에서 농축뿐만 아니라 근육 puncta에 걸쳐로서 존재한다. 박의 면역 반응성 분포는 일부 영역에서 시냅스를 Wg 겹치지 관찰 유의. 박과를 Wg (적색) 사이 (D) PLA 야생형 NMJs 수행. 특별한 PLA 신호는 두 단백질이 중복하는 분포에도 불구 NMJ에서 서로 근접하지 않은 것을 나타내는, 관찰되지 않는다. 패널 D의 스케일 바는 5 μm의 (AD)를 나타냅니다. 복부 세그먼트의 정신 자극 모든 NMJs 근육 6/7 4. 이미지는 NIS-요소 소프트웨어 니콘 A1R 레이저 스캐닝 공 초점 현미경을 사용하여 통합 스택으로 간주하고, 프로되었다어도비 포토샵과 cessed. 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
이 보고서는 PLA가 초파리 애벌레 NMJ에 적용 할 수있는 방법을 보여줍니다. 분석은 본 NMJ에서 내인성 단백질 - 단백질 상호 작용을 검출하기위한 목적 유생 체벽 근육 제제에 대해 수행된다. 이 기술로, 굴림 및 HTS 서로 매우 밀접, 따라서 구체적으로 시냅스 영역 (27)에서, 복합체에 존재하는 것으로 도시된다. 이 결과의 지원으로, 이전의 연구는 다음과 같은 데이터와의 연관성의 증거 제공하고있다 : 굴림과 HTS의 면역 분포 애벌레 NMJs의 시냅스 부위에 겹쳐 1), 2) 굴림과 HTS는 공동 기반으로하는 복합체를 형성 면역 전체 성인 해물 비행과 관련된 실험, 3) 굴림과 HTS는 상피와 시냅스 접합 8 모두에서 상호 작용한다. 시냅스 지역에서 PLA 신호도 굴림와 박세리, 이전에 다른 연구에서 확인 된 상호 작용 사이에 관찰하여 더 크리 디를 제공NMJ 15,20,21에서이 분석을 사용 NCE. 흥미롭게도, 박과를 Wg 사이의 PLA는 면역 분포는 NMJ에서 중복에도 불구하고, 아니 관찰 신호 발생했습니다. 이 결과는 면역 분포를 겹쳐 보여 모든 단백질 따라서 PLA는 기존의 공동 현지화 연구보다 단백질 - 단백질 상호 작용을 검출에서 더 높은 해상도를 제공하는 것을 나타내는, PLA 신호를 생성하는 것을 보여줍니다.
여러 변경 유생 NMJ 대한 분석을 최적화하기 위해 원래 PLA 프로토콜을 만들었다 9,25 (데이타 미기재). 첫째, 1 % BSA가 본체 벽 대신에 제공된 차단 솔루션 나은 차단제 인 것으로 판정되었다. 둘째로, 반응 액에 상기 본체의 벽 강한 신호 대 잡음비, 및 침지 적절한 혼합을 생성하는 것은 매우 중요하다. 0.65 ㎖의 microcentrifuge 관에서 5-10 몸 벽 200 μL의 최소 suitab 간주되었다더 바디 벽을 처리 할 때 볼륨 따라 증가 될 수 있지만 르는 PLA 프로브, 또는 중합 효소 리가 인큐베이션 때. 신호 강도는 또한 추천 배 이상 30 분 반응 시간의 증가에 의해 강화되었다. 셋째, PLA 프로브의 일련의 희석 실험 시약 보존 및 신호 강도의 밸런스를 최적화하기 위해 수행 하였다. 권장 1 - 업 1시 25분 희석이 보고서에서 수행 실험의 경우 : 5 희석 - 아직도 합리적인 신호 - 대 - 잡음비를 생산할 수있다. 결찰 및 증폭 반응의 최적화 기능이 수행되지 않았다. PLA는 순간 변화에 민감 할 수 마지막으로, 그것은 강하게 컨트롤 실험과 분석 중에 동등하게 취급 될 수 있도록 하나의 실험의 다른 유전자형이 단일 관에 위치하는 것이 권장된다. 유전자형 다르게 몸체 벽의 모서리를 절단함으로써 구별 될 수있다.
SeveraL 효모 방법은 두 하이브리드 스크리닝, 공동 면역 침전 법 및 FRET 포함 초파리 단백질 - 단백질 상호 작용을 검출하기 위해 사용된다. 그러나 이러한 방법은 PLA와 현장에서 단백질 - 단백질 상호 작용을 시각화 할 수있는 능력에 대해 어떻게 비교합니까? 효모 두 하이브리드 효모에서 발현 된 단백질의 초파리 간의 바인딩을 직접 검출 할 수 있으며, 높은 처리량 게놈 전체 화면에 사용되어왔다. 확인 된 상호 작용의 대부분이 생물학적으로 관련이 있지만, 분석은 종종 가양를 생성합니다. 또한, 음성 (false negative)은 여러 이유로 발생할 수 있습니다 단백질 결합을 방해 할 수있는 전사 인자 도메인에 융합되어, 많은 상호 작용이 번역 후 효모 발생하지 않는 수정 및 (분석이 발생하는) 핵을 필요로 할 수있다 어떤 상호 작용이 제대로 형성하기에 적합한 환경을지지 않습니다. 그것은 그들의 고유 envir에 내인성 단백질을 다루는 그러한 문제는 PLA와 발생되지 않습니다onment. 내인성 단백질 간의 상호 작용을 검출하는데 사용될 수있는 하나의 방법은 공동 - 면역 침전 법이다. 초파리 해물 관련된 실험은 상호 작용이 발생하는 라이프 사이클 단계 및 조직을 밝힐 수있다. 용해질 형성이 단백질을 추출하는 세포를 방해 포함하지만, 상호 작용이 발생하는 조직 내의 세포,뿐만 아니라 세포 내 로컬라이제이션 평가 될 수 없다 - PLA 달리. 또한, 공동 - 면역 침전은 결합 단백질 복합체를 검출하고, 단백질 복합체 내에서 서로 가까이에있는 구별 할 수있다. 세포 내에서 단백질 - 단백질 상호 작용의 시각화를 허용 Drosophilists 사용할 예컨대 FRET 등의 방법이있다. 그러나, FRET은 형광 태그에 융합 유전자 변형 단백질의 과발현을 포함하고 PLA와 같이 내인성 단백질의 행동을 반영하지 않을 수 있습니다.
그 장점에도 불구하고, 일부 limitat있다이온은 PLA를 사용하는 경우. 그러한 하나의 한계는 다른 종에서 만들어진 관심 단백질에 대한 일차 항체의 가용성이다. 그들이 상호 작용의 내인성 진정한 대표하지 않을 수 있지만이 문제는 쉽게 태그 단백질 유전자를 이용하여 회피 될 수있다. 또 다른 문제는 두 개의 주요 항체가 서로 입체적으로 또는 일차 항체의 하나의 항원 단백질 - 단백질 상호 작용 부위를 포함 할 경우에 방해가 PLA 때, 예를 위음성을 생산할 수 있다는 것이다. PLA는 서로 근접해 단백질을 검출되지만 또한 그것은 풀다운 분석 효모 두 하이브리드 스크리닝 달리, 직접 및 간접 단백질 - 단백질 상호 작용을 구별하지 않는다. 또한, 내인성 단백질 사이의 PLA는 상호 작용을 담당하는 도메인을 식별하지 않습니다. 따라서, 다른 단백질 - 단백질 상호 작용 분석은 아직 완전히 상호 작용을 특성화하기 위해 필요할 것이다 molecularlY.
연구원은 수십 나노 미터 (26)를 달성되는 해상도가 초파리 애벌레 NMJ의 공간 구조를 매핑 초해 현미경을 사용하기 시작했다. PLA는, 그것의 비교 분자 해상도, 저렴한 비용, NMJ에서 수많은 단백질의 조직에 대한 상세보기를 구축에 도움이됩니다 이러한 연구에 기술적으로 간단한 보완을 제공해야한다.
공개
저자가 공개하는 게 없다.
감사의 말
우리는 플라이 주식을 제공하기위한 블루밍턴 초파리 증권 센터 감사합니다. 우리는 또한 항체를 제공하기 위해 발달 연구 하이 브리 도마 은행과 박사 린 쿨리 (예일 대학) 감사합니다. 특별한 감사는 원고에 그녀의 도움을 AhHyun 유 간다. 이 작품은 자연 과학 및 캐나다의 공학 연구 협의회 (크리거), 윌리엄과 에이다 이사벨 스틸 기금 (크리거) 및 건강 연구의 캐나다 연구소 (강화)에서 보조금에 의해 지원되었다.
자료
| Name | Company | Catalog Number | Comments |
| Forceps (fine #5) | Almedic | A10-704 | |
| Sylgard Disc | World Precision Instruments | SYLG184 | Mix elastomer base and curing agent in a 10:1 ratio. Set for 30 min. Pour into a mold (e.g. use a 12-well cell culture plate). Let cure for at least 24 hr. Adhere to the lid of a 60 x 15 mm Petri dish lid when dissecting. |
| Minutien Pins (0.0125 mm tip diameter) | Fine Science Tools | 26002-10 | |
| Microdissection Scissors (ultra fine) | Fine Science Tools | 15200-00 | |
| Platform Slides | Glue two 22 x 22 mm2 coverslips onto a microscope slide with clear nail polish, leaving a <20 mm gap in between for sample mounting. | ||
| w1118 | Bloomington Drosophila Stock Center | 3605 | |
| hts01103 | Bloomington Drosophila Stock Center | 10989 | Stock was re-balanced over a GFP balancer so that homozygous mutants can be selected based on the absence of GFP signal. |
| 1x PBS (Phosphate Buffered Saline): 3 mM NaH2PO4, 7 mM Na2HPO4, 130 mM NaCl, pH 7.0 | NaH2PO4 (Caledon Laboratories - 8180-1), Na2HPO4 (Caledon - 8120-1), NaCl (Caledon - 7560-1) | ||
| Bouin's Solution | Sigma-Aldrich | HT10132 | |
| 4% PFA (Paraformaldehyde): 4% PFA in 1x PBS | PFA (Anachemia Science - 66194-300). See doi:10.1101/pdb.rec9959 Cold Spring Harb Protoc 2006 for instructions on how to make the solution. | ||
| [header] | |||
| 1x PBT (Phosphate Buffered Saline with Triton): 1x PBS with 0.01% Triton | Triton X-100 (Sigma-Aldrich - T8787) | ||
| 1% BSA (Bovine Serum Albumin): 1% BSA in 1x PBT | BSA (Bioshop Canada - ALB001). Store at 4 °C. | ||
| mouse anti-Dlg (Discs large) | Developmental Studies Hybridoma Bank | 4F3 | Use at a 1:10 dilution in 1% BSA. |
| rabbit anti-HtsM (Hu-li tai shao) | Provided by Dr. Lynn Cooley (Yale University). Use at a 1:250 dilution in 1% BSA. | ||
| rabbit anti-Pak (p21-activated kinase) | Provided by Dr. Nicholas Harden (Simon Fraser University). Use at a 1:500 dilution in 1% BSA. | ||
| mouse anti-Wg (Wingless) | Developmental Studies Hybridoma Bank | 4D4 | Use at a 1:5 dilution in 1% BSA. |
| goat anti-Hrp (Horseradish peroxidase) | Jackson ImmunoResearch | 123-065-021 | Use at a 1:200 dilution in 1% BSA. |
| FITC-conjugated donkey anti-goat | Jackson ImmunoResearch | 705-095-003 | Use at a 1:200 dilution in 1% BSA. |
| Duolink In Situ PLA Probe anti-mouse MINUS | Sigma-Aldrich | DUO92004 | |
| Duolink In Situ PLA Probe anti-rabbit PLUS | Sigma-Aldrich | DUO92002 | |
| Duolink In Situ Detection Reagents Red | Sigma-Aldrich | DUO92008 | |
| 1x Wash Buffer A: 0.01 M Tris, 0.15 M NaCl, 0.05% Tween 20, pH 7.4 | Sigma-Aldrich | DUO82049 | Tris (Caledon Laboratories - 8980-1), NaCl (Caledon - 7560-1), Tween 20 (Fisher Scientific - BP337) |
| 1x Wash Buffer B: 0.2 M Tris, 0.1 M NaCl, pH 7.5 | Sigma-Aldrich | DUO82049 | Tris (Caledon Laboratories - 8980-1), NaCl (Caledon - 7560-1) |
| 0.01x Wash Buffer B: 2 mM Tris, 1 mM NaCl, pH 7.5 | Sigma-Aldrich | DUO82049 | Tris (Caledon Laboratories - 8980-1), NaCl (Caledon - 7560-1) |
| Duolink In Situ Mounting Medium with DAPI | Sigma-Aldrich | DUO82040 | |
참고문헌
- Woods, D. F., Bryant, P. J. The discs-large tumor suppressor gene of Drosophila encodes a guanylate kinase homolog localized at septate junctions. Cell. 66, 451-464 (1991).
- Yamanaka, T., Ohno, S. Role of Lgl/Dlg/Scribble in the regulation of epithelial junction, polarity and growth. Front Biosci. 13, 6693-6707 (2008).
- Humbert, P. O., et al. Control of tumourigenesis by the Scribble/Dlg/Lgl polarity module. Oncogene. 27, 6888-6907 (2008).
- Lahey, T., Gorczyca, M., Jia, X. X., Budnik, V. The Drosophila tumor suppressor gene dlg is required for normal synaptic bouton structure. Neuron. 13, 823-835 (1994).
- Ataman, B., Budnik, V., Thomas, U. Scaffolding proteins at the Drosophila neuromuscular junction. Int Rev Neurobiol. 75, 181-216 (2006).
- Thomas, U., Kobler, O., Gundelfinger, E. D. The Drosophila larval neuromuscular junction as a model for scaffold complexes at glutamatergic synapses: benefits and limitations. J Neurogenet. 24, 109-119 (2010).
- Matsuoka, Y., Li, X., Bennett, V. Adducin: structure, function and regulation. Cell Mol Life Sci. 57, 884-895 (2000).
- Wang, S., et al. Drosophila adducin regulates Dlg phosphorylation and targeting of Dlg to the synapse and epithelial membrane. Dev Biol. 357, 392-403 (2011).
- Soderberg, O., et al. Characterizing proteins and their interactions in cells and tissues using the in situ proximity ligation assay. Methods. 45, 227-232 (2008).
- Brent, J. R., Werner, K. M., McCabe, B. D. Drosophila larval NMJ dissection. J Vis Exp. (24), (2009).
- Ramachandran, P., Budnik, V. Immunocytochemical staining of Drosophila larval body-wall muscles. Cold Spring Harb Protoc. 2010, (2010).
- Ramachandran, P., Budnik, V. Dissection of Drosophila larval body-wall muscles. Cold Spring Harb Protoc. , (2010).
- Ashburner, M. . Drosophila: A Laboratory Manual. , (1989).
- Brent, J., Werner, K., McCabe, B. D. Drosophila larval NMJ immunohistochemistry. J Vis Exp. (25), (2009).
- Parnas, D., Haghighi, A. P., Fetter, R. D., Kim, S. W., Goodman, C. S. Regulation of postsynaptic structure and protein localization by the Rho-type guanine nucleotide exchange factor dPix. Neuron. 32, 415-424 (2001).
- Petrella, L. N., Smith-Leiker, T., Cooley, L. The Ovhts polyprotein is cleaved to produce fusome and ring canal proteins required for Drosophila oogenesis. Development. 134, 703-712 (2007).
- Pielage, J., Bulat, V., Zuchero, J. B., Fetter, R. D., Davis, G. W. Hts/Adducin controls synaptic elaboration and elimination. Neuron. 69, 1114-1131 (2011).
- Spradling, A. C., et al. The Berkeley Drosophila Genome Project gene disruption project: Single P-element insertions mutating 25% of vital Drosophila genes. Genetics. 153, 135-177 (1999).
- Bokoch, G. M. Biology of the p21-Activated Kinases. Annu Rev Biochem. 72, 743-781 (2003).
- Bahri, S., et al. The leading edge during dorsal closure as a model for epithelial plasticity: Pak is required for recruitment of the Scribble complex and septate junction formation. Development. 137, 2023-2032 (2010).
- Albin, S. D., Davis, G. W. Coordinating structural and functional synapse development: postsynaptic p21-activated kinase independently specifies glutamate receptor abundance and postsynaptic morphology. J Neurosci. 24, 6871-6879 (2004).
- Koles, K., Budnik, V. Wnt signaling in neuromuscular junction development. Cold Spring Harb Perspect Biol. 4, (2012).
- Packard, M., et al. The Drosophila Wnt, wingless, provides an essential signal for pre- and postsynaptic differentiation. Cell. 111, 319-330 (2002).
- Weibrecht, I., et al. Proximity ligation assays: a recent addition to the proteomics toolbox. Expert Rev Proteomics. 7, 401-409 (2010).
- Thymiakou, E., Episkopou, V. Detection of signaling effector-complexes downstream of bmp4 using PLA, a proximity ligation assay. J Vis Exp. (49), (2011).
- Maglione, M., Sigrist, S. J. Seeing the forest tree by tree: super-resolution light microscopy meets the neurosciences. Nat Neurosci. 16, 790-797 (2013).
- Wang, S., et al. . Biol. Open. 3 (12), 1196-1206 (2014).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유