Method Article
זיהוי של
In This Article
Summary
פרוטוקול זה מדגים כיצד סמיכות קשירת Assay יכול לשמש כדי לזהות באינטראקציות חלבון-חלבון אתרו בצומת העצבית-שרירית זחל תסיסנית. בעזרת טכניקה זו, שאו טאי גדול והו-לי דיסקים מוצגים בצורה מורכבת באזור postsynaptic, עמותה זוהתה בעבר באמצעות שיתוף immunoprecipitation.
Abstract
Discs large (Dlg) is a conserved member of the membrane-associated guanylate kinase family, and serves as a major scaffolding protein at the larval neuromuscular junction (NMJ) in Drosophila. Previous studies have shown that the postsynaptic distribution of Dlg at the larval NMJ overlaps with that of Hu-li tai shao (Hts), a homologue to the mammalian adducins. In addition, Dlg and Hts are observed to form a complex with each other based on co-immunoprecipitation experiments involving whole adult fly lysates. Due to the nature of these experiments, however, it was unknown whether this complex exists specifically at the NMJ during larval development.
Proximity Ligation Assay (PLA) is a recently developed technique used mostly in cell and tissue culture that can detect protein-protein interactions in situ. In this assay, samples are incubated with primary antibodies against the two proteins of interest using standard immunohistochemical procedures. The primary antibodies are then detected with a specially designed pair of oligonucleotide-conjugated secondary antibodies, termed PLA probes, which can be used to generate a signal only when the two probes have bound in close proximity to each other. Thus, proteins that are in a complex can be visualized. Here, it is demonstrated how PLA can be used to detect in situ protein-protein interactions at the Drosophila larval NMJ. The technique is performed on larval body wall muscle preparations to show that a complex between Dlg and Hts does indeed exist at the postsynaptic region of NMJs.
Introduction
תסיסנית דיסקים גדולים (DLG) הוא חבר של המשפחה שמורה kinase guanylate קרום הקשורים פיגומי חלבונים המסייעים לתזמר את ההרכבה של קומפלקסי חלבונים גדולים באתרים ספציפיים של קרום הפלזמה. זוהה במקור כחלבון מדכא סרטן, DLG משמש כגורם חשוב 1,2,3 קוטביות apicobasal אפיתל. DLG משמש גם כמודול פיגומים גדול בצומת העצבית-שהרירית (NMJ) של הנוירונים מוטוריים glutamatergic במהלך התפתחות זחל 4. DLG משחק תפקידים מגוונים בNMJ הזחל, וpleiotropism מסתמך על יכולתו לקשר עם חלבונים מרובים 5,6. חלבון אחד כזה הוא שאו הו-לי טאי (HTS), homologue לadducins היונקים שתוארו בעיקר בכל הקשור לתפקידם בויסות תקטין spectrin שלד תא 7. זה בעבר הוכח כי DLG וHTS יכולים ליצור קומפלקס אחד עם השני על בסיס במבחנה שיתוף immunoprecipitation ניסויים מעורבים lysates לטוס כל המבוגר 8. חסרון אחד של תוצאות אלה, עם זאת, הוא שהם לא מציינים היכן צורות מורכבות זו. עם השימוש באימונוהיסטוכימיה, ההפצות של DLG וHTS הם נצפו לחפיפה בקרום postsynaptic של NMJs זחל, אבל הם במתחם באזור זה 8? כפי שניתן לראות לאחרונה ומפורט יותר כאן, הקירבה קשירת Assay (PLA) משמש כדי לחפש בשיתוף אתרו בין DLG וHTS במיוחד בNMJ זחל 27.
PLA הוא טכניקה חדשה יחסית המשמשת בעיקר בתרבית תאים ורקמות שיכולות לזהות אינטראקציות חלבון-חלבון באתר 9. ב assay זה, נוגדנים עיקריים נגד שני החלבונים של עניין מזוהים עם זוג של נוגדנים משני מינים ספציפיים, המכונה בדיקות PLA, אשר מצומדת לoligonucleotides (איור 1 א ', ב'). אם שני החלבוניםים נמצא בסמיכות זה לזה (כלומר בתוך כמה עשרות ננומטרים), ניתן לגשר על המרחק בין בדיקות PLA המצורפות באמצעות הכלאה של שני oligonucleotides נוסף מחבר (איור 1 ג). בקונפורמציה זו, מסתיימת ללא oligonucleotides המחבר קרוב מספיק כדי ליצור קשר אחד עם השני, ומולקולת DNA מעגלית סגורה יכולה להיווצר עליו בקשירה באתרו (1D איור). מולקולת ה- DNA המעגלית משמשת כתבנית באתר הגברה המעגל מתגלגל, אשר ערוכה על ידי אחד מoligonucleotides המוצמד לבדיקות PLA (איור 1E). רצפים בתוך מוגבר מוצר ה- DNA וכתוצאה מכך, concatemeric אז יכולים להיות דמיינו עם, בדיקות שכותרתו fluorescently משלימות oligonucleotide (איור 1F). מאז DNA המוגבר נשאר מחובר לאחד מבדיקות PLA, לוקליזציה subcellular של withi האינטראקציה בין חלבוניםרקמת na אפשר ללמוד בקלות.
כמה שיטות משמשות בדרך כלל כדי לזהות אינטראקציות חלבון-חלבון כוללים בטכניקות חוץ גופית כגון שיתוף immunoprecipitation, הנפתח מבחני והקרנת שתי היברידית שמרים, ובטכניקות vivo כגון העברת פורסטר תהודה אנרגיה (סריג) וbimolecular פלואורסצנטי שלמה ( BiFC). מלכודת של הטכניקות במבחנה היא שהם אינם מזדהים בו האינטראקציה מתרחשת באופן אנדוגני, בעוד vivo טכניקות האמורות בלערב את הביטוי המלאכותי של חלבוני היתוך שעלול שלא לשקף התנהגות יליד עמיתי אנדוגני. אחד יתרונות עיקריים של PLA הוא שהוא מסוגל לקבוע בתוך רקמת לוקליזציה subcellular של interactors חלבון אנדוגני שנמצאים בסמיכות זה לזה, וסביר להניח להרכיב מורכב, עם מידת הקרבה הדרושה כדי ליצור אות להיות דומה לFRET וBiFC. PLA יכול לזהות אינטראקציות עם סגוליות גבוהות ורגישות בשל הצימוד של הכרת נוגדן והגברת DNA. לפיכך, assay יכול ליצור אותות בדידים, בהירים בצורה של puncta החושפות את עמדתה של האינטראקציה המדויקת. בנוסף, ניתן לאתר אנטיגנים בקושי נראים לעין. לבסוף, PLA הוא טכניקה פשוטה יחסית לביצוע, וזה לוקח לא יותר מהליך immunohistochemical סטנדרטי כדי להשלים. לכן, PLA מספק יתרון טכני על מבחני אינטראקציה אחרים חלבון-חלבון שלעתים קרובות נגועים בזמני הכנה ארוכים ופתרון בעיות נרחבות.
פרוטוקול זה מדגים כיצד ניתן ליישם PLA לתסיסנית הזחל NMJ לצורך איתור אינטראקציות חלבון-חלבון אנדוגני באתר. כאן, PLA מבוצע על הכנות שריר זחל קיר גוף שבו DLG וHTS מוצגים לאכן מתקיימים במתחם באזור postsynaptic של NMJs. PLA לא היה בשימוש בעבר כדי ללמוד את NMJ הזחל, ויש כיום רק קומץ של מאמרים שפורסמו שהשתמשו assay זה ברקמת דרוזופילה. יש לקוות כי חשיפה נוספת של PLA לקהילת תסיסנית תגרום שימוש ככלי נוסף הגדיל אותו כדי להשלים את מבחני אחרים, נפוצים יותר חלבונים אינטראקציה.
Protocol
1. גוף וול הכנה
הערה: הכנת גוף זחל קירות instar השלישי (למחקר של NMJs שמעצבב את קיר שרירי גוף) בוצעה כפי שתואר בעבר ברנט ואח '10, או Ramachandran וBudnik 11,12, אבל עם כמה שינויים..
- Dissection
- להעלות מניות לטוס וצלבים על 25 מעלות צלזיוס במשך 5-6 ימים באמצעות נהלים סטנדרטיים 13.
- בחר זוחל זחלי instar שלישיים מבקבוקונים או בקבוקים באמצעות מלקחיים בסדר.
- שטוף את הזחלים בצלחת פטרי קטנה המכילה פוספט הצפת מלוח (PBS) כדי להסיר כל חלקיקי מזון.
- הנח זחל יחיד על גבי דיסק sylgard ולטבול אותו בכמה טיפות של PBS קר כקרח. באמצעות PBS קר כקרח יעזור לי המם את הזחל שהופך אותו קל יותר לתמרן. לאורך לנתיחה, להבטיח כי ההכנה היא תמיד שקועה בPBS כדי למנוע את זה מהתייבשות.
- מקם את laRvA עם צד הגב שלה פונה כלפי מעלה, כך ששני קטעים לקנה הנשימה נראים תחת מיקרוסקופ לנתח (איור 2 א). שימוש במלקחיים כדי לתפוס סיכת minutien, להצמיד את הזחל בקצה האחורי ליד spiracles (איור 2). עם סיכה אחרת, לחדור מבעד לציפורן בקצה הקדמי ליד הפה הווים. בעדינות למתוח את הזחל מתוך אורך, אז להצמיד אותו (איור 2).
- בעזרת המספריים microdissection, לצבוט את הקצה האחורי ליד הסיכה כדי ליצור פתח קטן. החתך צריך להיות שטחי מספיק רק לעבור לציפורן.
- הצבת קצה הלהב התחתון של המספריים לתוך החתך, לחתוך לאורך כל אורכו של קו האמצע הגב בין שני קטעים לקנה הנשימה (איור 2 ג). כוון את להבי מספריים מעט כלפי מעלה בעת החיתוך כדי למנוע נזק לשרירי קיר גוף הגחון.
- לעשות חתך אופקי קטן מעט קדמי לתפקידסיכת eriorly-הציבה (איור 2 ג). לעשות עוד חתך דומה מעט אחורי לפין anteriorly-הציב (איור 2 ג). החתכים צריכים רק לעבור לציפורן.
הערה: שלושה חתכים מצעדים 1.1.7 ו1.1.8 בשילוב צריך להיות דומה " "כשסיים, כלומר, שמאל ויד ימין דש בצד הגב של גוף הזחל צריך להיות מיוצר.
"כשסיים, כלומר, שמאל ויד ימין דש בצד הגב של גוף הזחל צריך להיות מיוצר. - לנקות את זהירות את האיברים הפנימיים עם המלקחיים. הוספה כמה טיפות בכוח של PBS תעזור לתפוס את האיברים מחוץ לגוף הזחל, וכך קל יותר כדי להסיר אותם. הימנע תוקע גוף הזחל כפי שיגרום נזק לקיר שרירי גוף.
- לפרוש גוף הזחל פתוח ולהצמיד את הפינות כלפי מטה (איור 2 ד). כאשר מצמיד, למתוח את קיר הגוף אופקי ואנכי כדי ליצור מלבן באופן שווה-מתוח (seדואר איור 2G לצורה), מטפל שלא לקרוע את קיר שרירי גוף בתהליך.
- לסיים הסרת כל איברים שנותרו פנימיים (איור 2E).
- קיבעון וpermeabilization
- לטבול את גוף הקירות תלו בכמה טיפות של התמיסה של Bouin. דגירה במשך 15 דקות על קרח. לחלופין, להשתמש paraformaldehyde 4% (PFA) כמקבע חלופי; דגירה למשך 30 דקות.
- לשטוף שלוש פעמים עם פוספט הצפת מלוח עם טריטון (PBT).
- בעזרת מלקחיים בסדר, להסיר בזהירות את הסיכות ולהעביר את גוף הקירות בפינות שלהם לתוך צינור microcentrifuge siliconized 0.65 מיליליטר.
- אחסן את גוף הקירות בPBT ב 4 ° C עד מוכן לPLA. לקבלת תוצאות אופטימליות, להתחיל immunostaining גוף הקירות בתוך יום או ימים של נתיחה.
הערה: כדי לחסוך בחומרים כימיים ועל מנת להבטיח כי הם התייחסו לכל הגוף באופן שווה במהלך קירות assay, ניתן להציב גנוטיפים שונים ליחידצינור. ניתן להבחין גנוטיפים על ידי חיתוך הפינות של קירות הגוף שונה (ראה תרשים 2F לדוגמאות).
2. אימונוהיסטוכימיה
הערה: Immunostaining של גוף זחל קירות instar השלישי בוצע כפי שתואר בעבר ברנט ואח '14 וRamachandran ו -11 Budnik, אבל עם כמה שינויים 11,14..
הערה: בצע את כל השלבים בטמפרטורת חדר ועם תסיסה עדינה, אלא אם כן צוין אחרת.
- חסימה
- שטוף את גוף קירות עם PBT שלוש פעמים במשך 10 דקות כל אחד.
- לחסום עם 1% אלבומין סרום שור (BSA) במשך שעה 1.
- Immunostaining
- דגירה גוף הקירות עם נוגדני עכבר ועיקריים ארנב נגד שני החלבונים של עניין (בדילול מלא 1% BSA) לשעה 2 בטמפרטורת חדר, או הלילה ב 4 ° C. במקרה זה, להשתמש בעכבר 01:10 אנטי-DLG ו -1: 250 ארנבNTI-HtsM 15,16. נוגדנים כנגד סמנים שאינם נעשו בעכבר או ארנבת יכולים להיכלל גם - למשל, להשתמש 1: 200 עיזים אנטי-Hrp להתוות ממברנות עצביות.
- לשטוף עם PBT שלוש פעמים במשך 10 דקות כל אחד.
- דגירה עם נוגדנים משני fluorophore מצומדות כדי לזהות הסמנים (בדילול מלא BSA 1%) לשעה 2 בטמפרטורת חדר, או הלילה ב 4 ° C. כאות PLA מאוחר יותר דמיין עם fluorophore אדום, fluorophore אחר יש להשתמש כדי לזהות את הסמן - למשל, להשתמש 1: 200 אנטי-עז FITC- מצומדות כדי לזהות את הנוגדן אנטי Hrp העז. בשל השימוש בחומרים כימיים רגיש לאור, לשמור על הצינורות בחושך מנקודה זו ואילך.
הערה: הערכה המשמשת מאפשרת לPLA להתבצע בין נוגדנים העיקריים שהועלו בעכבר וארנב, עם האות דמיין בערוץ האדום תחת מיקרוסקופ confocal. אם תרצה, ערכות אחרות זמינות המאפשרות assay להיעשות עם פרימהנוגדני ר"י גדלו במינים אחרים, ואת האות דמיין בערוצים אחרים.
3. סמיכות קשירת Assay
הערה: בצע את כל השלבים בטמפרטורת חדר ועם תסיסה עדינה, אלא אם כן צוין אחרת.
- בדיקות PLA
- שטוף את גוף קירות עם PBT שלוש פעמים במשך 10 דקות כל אחד.
- דגירה עם בדיקות PLA (1: 5 דילול כל אחד בBSA 1%) לשעה 2 ב 37 ° C. במקרה זה, להשתמש 40 μl של מינוס אנטי עכבר הבדיקה PLA, 40 μl של PLUS נגד ארנב הבדיקה PLA ו -120 μl של BSA 1% על מנת להבטיח את הטבילה וערבוב הנכונים של 5-10 גוף קירות. עד דילול 01:25 של בדיקות PLA עדיין יכול לגרום ליחס הולם אות לרעש (כלומר, עבור ניסוי זה).
- קשירה
- שטוף את גוף קירות עם הצפת לשטוף פעמיים במשך 5 דקות כל אחד.
- דגירה עם פתרון קשירת (01:40 דילול של אנזים במאגר קשירת) לשעה 1C ° 37 t. במקרה זה, להשתמש 5 μl של אנזים, 40 μl של חיץ 5 קשירת וμl 155 של מים טוהר גבוהים כדי להבטיח טבילה וערבוב הנכונים של 5-10 גוף קירות.
- הגברה
- שטוף את גוף קירות עם הצפת לשטוף פעמיים עבור 2 דקות כל אחד.
- דגירה עם פתרון ההגברה (1:80 דילול של פולימראז במאגר הגברה) לשעה 2 ב 37 ° C. במקרה זה, להשתמש 2.5 μl של פולימראז, 40 μl של 5 חיץ הגברה ו157.5 μl מים טוהר גבוהים על מנת להבטיח את הטבילה וערבוב הנכונים של 5-10 גוף קירות.
- הכנה להדמיה
- שטוף את גוף קירות עם הצפת לשטוף B פעמיים במשך 10 דקות כל אחד.
- לשטוף עם 0.01x הצפת לשטוף B פעם 1 דקות.
- לאזן בכמה טיפות של תמיסת הרכבה לפחות 30 דקות לפני ההרכבה, או לאחסן לילה ב 4 מעלות צלזיוס.
- באמצעות מלקחיים עדינים, להעביר בזהירות את קירות גוף לשקופית פלטפורמת wה- i הציפורניים שלהם פונות כלפי מטה. מקם את גוף הקירות בשורות ובאותו הכיוון בתוך טיפה או שתיים של mountant. מניחים coverslip x 40 מ"מ 22 מ"מ מעל מטפל הכנה לא ליצור בועות אוויר, ואז לאטום את השקופית עם לק ברור.
- אחסן את השקופיות בחושך ב -20 ° C עד מוכן להדמית confocal.
תוצאות
בNMJs זחל instar השלישי wild-type, DLG נמצא ברובה בקרום postsynaptic של boutons glutamatergic אני סוג, עם רמות immunoreactivity DLG להיות בולטות יותר בboutons Ib סוג מהסוג האם boutons (איור 3 א) 4. HTS נוכח לאורך כל השרירים, אבל מתרכז באזור postsynaptic עם רמות immunoreactivity HTS מופיעות זהות בשני סוגים אני boutons, והוא נמצא גם Presynaptically (איור 3 א ') 8,17. שים לב שההפצות של DLG וHTS החופפים במידה רבה באזור postsynaptic (איור 3 א '') 8.
כדי לקבוע אם DLG וHTS קיימים במתחם בNMJ, PLA בין שני החלבונים בוצע על הכנות קיר שרירים גוף זחל. עבור assay זה, נוגדן אנטי DLG עכבר שמזהה את תחום PDZ השני בN-הסופי ונוגדן אנטי HtsM ארנבהמאתר את תחום MARCKS-ההומולוגיה בC-הסופי שימש 15,16. בwild-type, אות PLA בין DLG וHTS נצפתה במיוחד בNMJ (איור 3 ג-ג ''). האות בעיקר מקומי circumferentially קרום presynaptic שלי boutons הסוג, שdemarked ידי Hrp, ובכך מצביע על כך שDLG וHTS נמצא בסמיכות זה לזה, וסביר להניח בצורה מורכבת באזור postsynaptic. התוצאה הייתה נחוש להיות ספציפי כמו השליטה השלילית שלנו, הכולל 01,103 HTS NMJs מוטציה שאין HTS immunoreactivity (איור 3-B ''), לא הראו שום אות PLA לצפייה (איור 3D) 8,17,18. בנוסף, PLA בוצע מבלי להוסיף נוגדן הארנב נגד HtsM לא הניב שום אות (מידע לא מוצג). צפיות בהגדלה גבוהה של boutons גילו כי immunoreactivity DLG וHTS חפף באופן בוטה באזור postsynaptic (איור 3E), ואילו PLA בין שני החלבונים הביאו puncta דיסקרטי מצביע על כך שרק קבוצת משנה של כולל חלבוני DLG וHTS נמצא במתחם (איור 3F).
כדי להוסיף ולבדוק את האמינות של PLA ככלי ללמוד NMJ הזחל, אנחנו גם הערכנו אינטראקציות בין קינאז סרין / תראונין מופעל p21, פאק, והחלבונים סינפטיים אחרים 19. שיתוף immunoprecipitation ניסויים קודמים הראו כי פאק הוא חבר של מתחם שרבוט, שDLG הוא גם חבר 20. בNMJs wild-type, פאק localizes לצפיפות postsynaptic (איור 4 א, ג), שבו הוא נדרש ללוקליזציה DLG 15,21. הפצות immunoreactive של פאק וDLG חפיפה באזור postsynaptic (איור 4 א ''), וPLA בין שני החלבונים הביאו לאיתות חיובית במיוחד בNMJ (איור 4). תוצאות אלו מצביעות על כך ששני החלבונים נמצאים בג לאבד קרוב זה לזה והם צפויים להרכיב מורכבים באזור זה. עוד חלבון הסינפטי בדקנו עבור מורכב Pak מחייב היה חסר-כנפיים (WG), ליגנד תסיסנית Wnt, אשר משחק תפקידים רבים ב-22 NMJ. בwild-type, WG מועשר בצדדים presynaptic וpostsynaptic מהסוג אני boutons, אבל הוא גם הווה כpuncta ברחבי הציטופלסמה השריר (איור 4C ') 23. מעניין, אם כי הפצות immunoreactive של פאק וWG חפפו באופן חלקי באזור postsynaptic (איור 4C ''), PLA בין שני החלבונים המופק אין אות לצפייה (איור 4D). לכן, פאק וWG אינם בסמיכות זה לזה בNMJ. תוצאה זו מוכיחה כי לא כל החלבונים שמראים immunoreactivities החופף באמצעות ניסויי שיתוף לוקליזציה מסורתיים יפיקו אות PLA, ומשמשת כביקורת שלילית נוספת.
אף אוזן גרון "fo: לשמור-together.within-page =" תמיד ">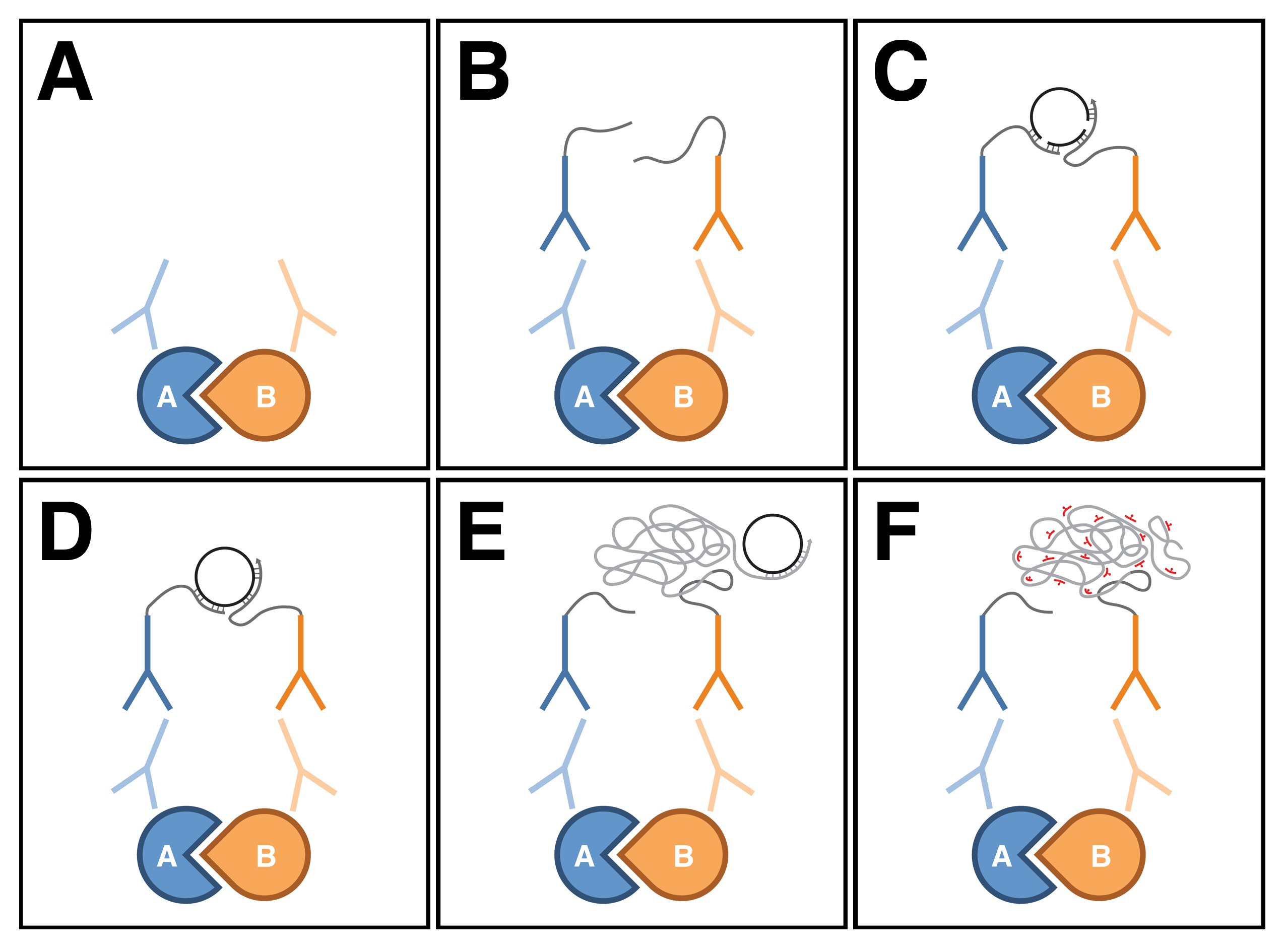
איור 1: תרשים סכמטי של Proximity קשירת Assay. (א) נוגדנים ראשיים להיקשר לשני חלבונים של עניין באמצעות נהלי immunohistochemical סטנדרטיים. (ב) לאחר מכן הנוגדנים העיקריים מזוהים עם זוג של נוגדנים משני מינים ספציפיים, המכונה בדיקות PLA, אשר מצומדת לoligonucleotides. (ג) אם שני החלבונים נמצאים בסמיכות זה לזה, ניתן לגשר על המרחק בין בדיקות PLA המצורפות באמצעות הכלאה של שני oligonucleotides מחבר נוסף. (ד) בקונפורמציה זו, oligonucleotides המחבר יכול ליצור מולקולת DNA מעגלית סגורה עליו בקשירה באתר . (E) מולקולת DNA המעגלית משמשת כתבנית באתר מתגלגלת הגברה המעגל, אשר ערוכה על ידי אחד מoligonucleotides המוצמד לבדיקות PLA. רצפים (F) בתוך מוצר DNA המוגבר לאחר מכן זוהו עם בדיקות oligonucleotide שכותרתו fluorescently, משלימים. שים לב שהדמות הייתה מבוססת על Weibrecht et al. 24. לחץ כאן כדי לצפות בגרסה גדולה יותר של הדמות.

איור 2: הכנת גוף זחל קירות instar השלישי. (AF) ציורי סכמטי המייצגים קיר גוף לנתיחה. () מניחים זחל יחיד על גבי דיסק sylgard עם צד הגב שלה פונה כלפי מעלה, כך ששני קטעים לקנה הנשימה גלויים. (B) פין הזחל במורד בקצוות הקדמי והאחוריים עם סיכות minutien, מתיחת הזחל החוצה לאורך בתהליך. (C) g> הפוך שלושה חתכים בצד הגב של גוף הזחל עם מספריים microdissection. החתכים צריכים להיות דומים '' '' אני כשסיימתי. (ד) לפרוש גוף הזחל פתוח ולהצמיד את הפינות כלפי מטה, מותח את קיר הגוף אופקי ואנכי בתהליך ליצירת מלבן באופן שווה-מתוח. (E) נקיים את כל איברים פנימיים שנותרו. (F) מוצגים הם דוגמאות של הדרכים השונות כדי לחתוך את הפינה של גוף הקירות כדי להבדיל גנוטיפים שונים. צפה (G) של קיר גוף הכנה מתוחה כאשר הושלמו. התמונה צולמה במצלמה דיגיטלית רכובה על גבי מיקרוסקופ לנתח. בר סולם בלוח F מייצג 1 מ"מ. שים לב שהדמות הייתה מבוססת על Ramachandran וBudnik, 2010 12. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של הדמות.
p-together.within-page = "תמיד"> 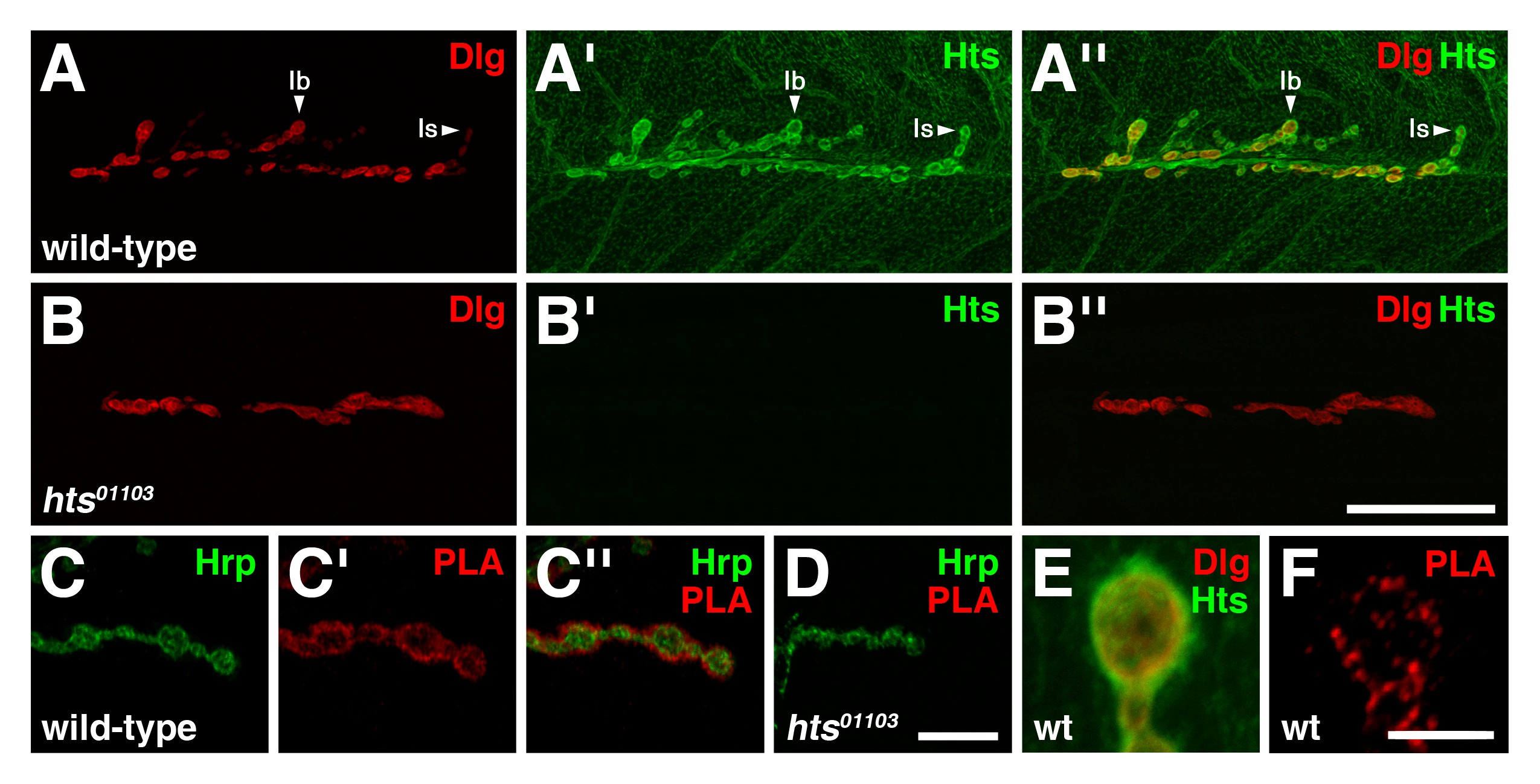
איור 3: DLG וHTS קיימים במתחם באזור postsynaptic של NMJs זחל (AB '') הפצות של DLG (אדום) וHTS (ירוק) בwild-type וHTS NMJs מוטציה (AA. '') בפרא. רווחים מהסוג NMJs, DLG נמצא בעיקר בקרום postsynaptic שלי boutons הסוג, עם רמות DLG להיות בולטות יותר בסוג Ib מ האם boutons. HTS נוכח לאורך כל השרירים, אלא גם מתרכז סביב אזור postsynaptic, עם רמות HTS להיות דומות בשני סוגים אני boutons. ההפצות של DLG וHTS חפיפה באזור postsynaptic. (BB '') המוטציה NMJs לHTS חסרה immunoreactivity HTS. שים לב שNMJ HTS 01,103 השפעות מוטציה הסתעפות 8. (CD '') PLA בין DLG וHTS (אדום) שבוצע על wild-type וHTS NMJs מוטציה. Hrp משמש לסימון הקרום העצבי (ירוקה). מוצגות דעות הגדלה גבוהות של כמה boutons. (CC '') בwild-type, אות PLA הוא ציין במיוחד בNMJ. האות היא בעיקר מקומית circumferentially קרום presynaptic שלי boutons הסוג, מצביעה על כך שDLG וHTS נמצא בסמיכות זה לזה וקיים במתחם באזור postsynaptic. (ד) המוטציה NMJs לHTS לא הראתה אות PLA נצפית. (EF) מוצגות דעות הגדלה גבוהות של boutons אחת. (E) חפיפה גסה immunoreactivity HTS וDLG באזור postsynaptic. (F) PLA בין תוצאות DLG וHTS בpuncta השונה מצביע על כך שרק קבוצת משנה של החלבונים הם במתחם . בר סולם בלוח ב '' 'מייצג 40 מיקרומטר (AB' '); סרגל קנה מידה בלוח ד '' מייצג 10 מיקרומטר (CD ''); SCALבר דואר בלוח F מייצג 5 מיקרומטר (EF). כל NMJs המוצג הם משרירים 6/7 בקטע בטן 4. תמונות צולמו כערימות התמזגו באמצעות מיקרוסקופ confocal סריקת לייזר Nikon A1R עם תוכנת ש"ח-אלמנטים, ומעובד עם Adobe Photoshop. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות.
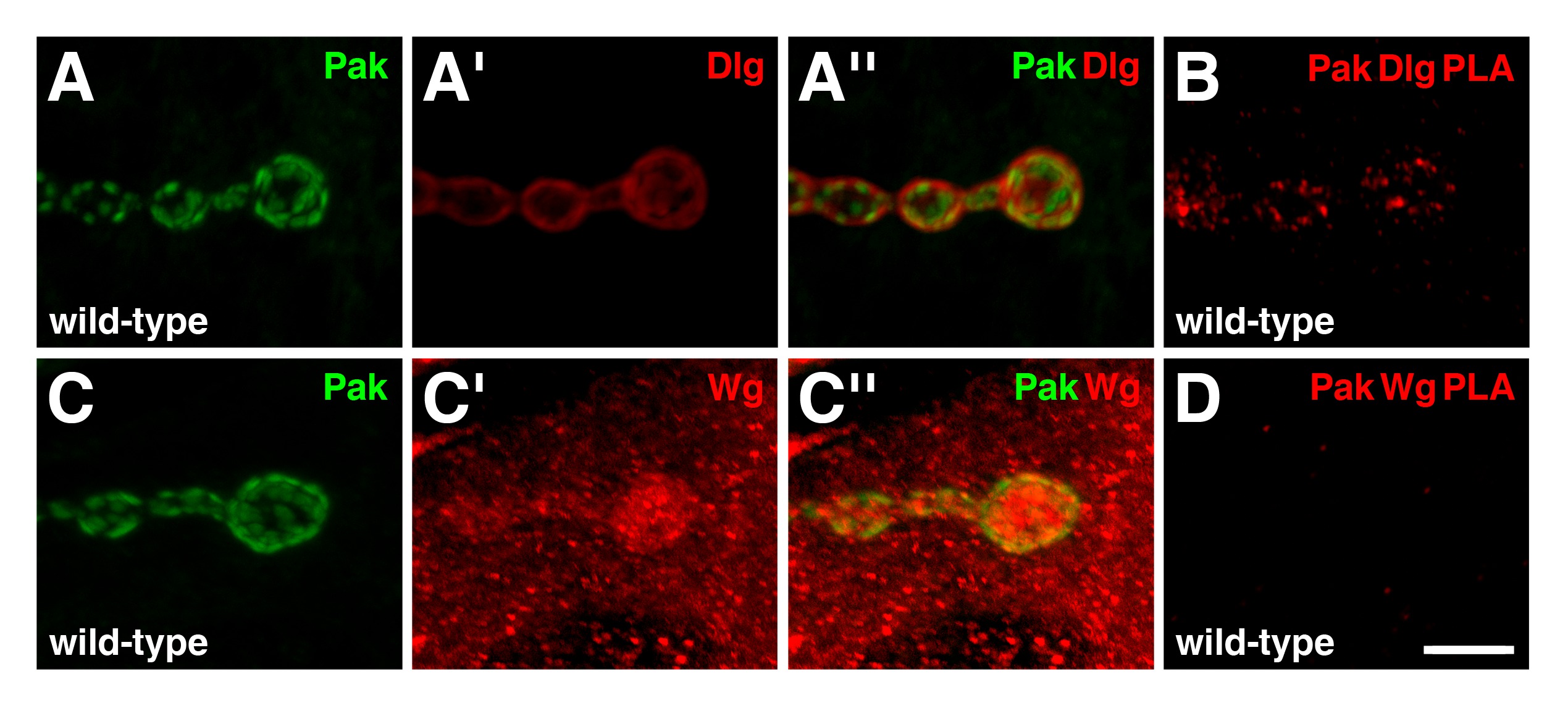
איור 4: פאק קיים במתחם עם DLG, אבל לא WG, באזור postsynaptic של NMJs זחל (AD) מוצג דעות הגדלה גבוהות של כמה boutons (AA '') הפצות של פאק (ירוק) וDLG (.. אדום) בNMJs wild-type. Pak localizes לצפיפות postsynaptic. שים לב שהפצות immunoreactive של פאק וDLG חפיפה באזור postsynaptic. (B) PLA בetween Pak וDLG (אדום) שבוצעו על NMJs wild-type. אות PLA הוא ציין במיוחד בNMJ, מצביעה על כך ששני החלבונים נמצאים בסמיכות זה לזה באזור זה. (CC '') הפצות של פאק (ירוק) וWG (אדום) בNMJs wild-type. WG מועשר בשני הצדדים presynaptic וpostsynaptic של NMJ, אבל הוא גם הווה כpuncta בכל השריר. שימו לב כי חלוקת immunoreactive של פאק הוא ציין גם חפיפה חלקית עם WG באזור postsynaptic. (ד) PLA בין Pak וWG (אדום) שבוצע על NMJs wild-type. אין אות PLA הספציפית הוא ציין, מצביע על כך ששני החלבונים הם לא בסמיכות זה לזה בNMJ למרות החלוקה החופף שלהם. בר סולם בלוח D מייצג 5 מיקרומטר (AD). כל NMJs innervate שרירי 6/7 בקטע בטן 4. תמונות צולמו כערימות התמזגו באמצעות מיקרוסקופ confocal סריקת לייזר Nikon A1R עם תוכנת ש"ח-אלמנטים, ופרוcessed עם Adobe Photoshop. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של הדמות.
Discussion
דו"ח זה מדגים כיצד ניתן ליישם PLA לתסיסנית הזחל NMJ. Assay מבוצע על הכנות שריר קיר גוף זחל לצורך איתור אינטראקציות חלבון-חלבון אנדוגני נוכחים בNMJ. בעזרת טכניקה זו, DLG וHTS מוצגים להיות בסמיכות זה לזה, ובכך קיימים במתחם, במיוחד באזור postsynaptic 27. בתמיכה של תוצאה זו, מחקר קודם סיפק עדות לקשר שלהם עם הנתונים הבאים: 1) הפצות immunoreactive של DLG וHTS חפיפה באזור postsynaptic של NMJs זחל, 2) DLG וHTS צורה מורכבת המבוססים על שיתוף ניסויי immunoprecipitation מעורבים כל המבוגר לטוס lysates, ו -3) DLG וHTS האינטראקציה בשני אפיתל וצמתים הסינפטי 8. אות PLA באזור postsynaptic נצפתה גם בין DLG ופאק, אינטראקציה זוהתה בעבר במחקרים אחרים, ובכך לספק Crede נוסףפליטות של שימוש assay זה ב15,20,21 NMJ. מעניין, PLA בין Pak וWG לא גרם לאות נצפית, למרות שהפצות immunoreactive חפפו בNMJ. תוצאה זו מוכיחה כי לא כל החלבונים שמראים חופף הפצות immunoreactive יפיקו אות PLA, לכן מצביע על כך שPLA מספק רזולוציה גבוהה יותר באיתור אינטראקציות חלבון-חלבון מאשר מחקרי שיתוף לוקליזציה מסורתיים.
שינויים מרובים שנעשו לפרוטוקול PLA המקורי על מנת לייעל את assay לNMJ הזחל (מידע לא מוצג) 9,25. ראשית, נקבע כי BSA 1% הוא סוכן חסימה טוב יותר לגוף הקירות במקום פתרון חסימה סיפק. שנית, כדי לייצר יחס חזק אות לרעש, טבילה ראויה וערבוב של גוף הקירות בפתרונות התגובה הוא קריטי. מינימום של 200 μl ל09:55 גוף קירות בצינור 0.65 מיליליטר microcentrifuge נחשב suitable כאשר דוגרים עם בדיקות, האנזים או פולימראז PLA, אם כי ניתן להגדיל הכמויות בהתאם עת עיבוד יותר גוף קירות. עוצמת אות הייתה גם משופרת על ידי הגדלת זמני תגובה על ידי 30 דקות על פי המליץ. שלישית, מבחן דילול סדרתי של בדיקות PLA בוצע כדי לייעל את האיזון בין שימור מגיב ועוצמת אות. לניסויים שבוצעו בדוח זה, עד דילול 01:25 - מ1 המומלץ: הדילול 5 - עדיין יכול לייצר יחס אות לרעש סביר. שים לב שאופטימיזציה של תגובות קשירה והגברה לא בוצע. לבסוף, כPLA יכול להיות רגיש לשינויים של הרגע, מומלץ מאוד שגנוטיפים השונים של ניסוי יחיד ממוקמים בצינור אחד, כך שמטופלי הבקרות וניסויים במידה שווה במהלך assay. ניתן להבחין גנוטיפים על ידי חיתוך הפינות של קירות הגוף באופן שונה.
Severaשיטות l המשמשות לאיתור אינטראקציות חלבון-חלבון תסיסנית כולל הקרנת שמרים שני-היברידית, שיתוף immunoprecipitation וסריג. אבל איך שיטות אלה להשוות נגד PLA ויכולתה לחזות אינטראקציות חלבון-חלבון באתר? שמרי שני היברידיים יכול לזהות ישיר מחייב בין חלבוני תסיסנית באו לידי ביטוי בשמרים, וזה כבר נעשה שימוש במסכי הגנום תפוקה גבוהה. למרות שרבים מהאינטראקציות המזוהות רלוונטיים מבחינה ביולוגית, assay לעתים קרובות מייצר שווא-תוצאות חיוביות. בנוסף, שליליים שגוי יכול להתרחש מסיבות רבות: החלבונים הם התמזגו לתחומים גורם שעתוק שעלול להפריע למחייבים, אינטראקציות רבות דורשות שלאחר translational שינויים שאינם מתרחשים בשמרים, וגרעין (שבו מתרחש assay) רשאי לא להיות סביבה שמתאימה לכמה אינטראקציות כדי ליצור כראוי. בעיות מסוג זה לא נתקלו עם PLA שהיא מתמודדת עם חלבונים אנדוגניים בenvir האם שלהםonment. שיטה אחת שיכול לשמש כדי לזהות אינטראקציות בין חלבונים אנדוגניים היא שיתוף immunoprecipitation. ניסויים הכוללים lysates תסיסנית יכולים לחשוף את הרקמה ושלב במחזור החיים בי אינטראקציה מתרחשת. עם זאת, כפי שהיווצרות lysate כרוכה לשבש את התאים כדי לחלץ את החלבונים, התאים בתוך הרקמה שבה האינטראקציה מתרחשת ב, כמו גם לוקליזציה subcellular שלה, לא ניתן להעריך - שלא כמו בPLA. יתר על כן, שיתוף immunoprecipitation מזהה מורכב חלבון מחייב ולא ניתן להבחין בו חלבונים בתוך המתחם נמצאים בסמיכות זה לזה. ישנן שיטות כגון סריג זמינות לDrosophilists המאפשרות ההדמיה של אינטראקציות בין חלבונים בתוך התא. עם זאת, סריג כרוך ביטוי היתר של חלבונים מהונדסים התמזגו תגי ניאון ולא עשוי לשקף אנדוגני התנהגות חלבון כמו בPLA.
למרות יתרונותיה, יש כמה limitatיונים בעת שימוש PLA. מגבלה אחת כזו היא הזמינות של נוגדנים עיקריים נגד החלבונים של עניין העשויה במינים שונים. בעיה זו בקלות ניתן לעקוף עם השימוש בחלבונים מהונדסים מתויגים, למרות שהם לא יכולים להיות באמת נציג של האינטראקציה אנדוגני. בעיה נוספת היא שPLA עשוי לייצר שלילית שווא, למשל, כאשר שני נוגדנים ראשוניים sterically לעכב אחד את השני או כאשר epitope של אחד מהנוגדנים העיקריים כרוך באתר האינטראקציה בין חלבונים. בנוסף, למרות שPLA מזהה חלבונים הנמצאים בסמיכות זה לזה, הוא אינו מבחין בין אינטראקציות חלבון-חלבון ישירות ועקיפות, שלא כמו במבחנים נפתחים והקרנת שתי היברידי שמרים. יתר על כן, PLA בין חלבונים אנדוגניים לא יזהה שתחומים אחראים לאינטראקציה. לפיכך, עדיין יהיו צורך מבחני אינטראקציה בין חלבונים אחרים לאפיין את האינטראקציה מלאה molecularly.
חוקרים החלו באמצעות מיקרוסקופ ברזולוציה הסופר למפות את הארכיטקטורה המרחבי של תסיסנית הזחל NMJ, עם החלטות של עשרות ננומטרים שהשיגו 26. PLA, עם הרזולוציה המולקולרית הדומה שלה, אמור לספק עלות נמוכה, מבחינה טכנית משלימים פשוטות למחקרים אלה שיסייעו בבניית תצוגה מפורטת של הארגון של מספר רב של חלבונים בNMJ.
Disclosures
יש לי המחברים אין לחשוף.
Acknowledgements
אנו מודים לתסיסנית מרכז Stock Bloomington למתן מניות זבוב. אנו מודים גם לבנק התפתחותית המחקרים Hybridoma וד"ר לין קולי (אוניברסיטת ייל) למתן נוגדנים. תודה מיוחדת לAhHyun Yoo על עזרתה בכתב היד. עבודה זו נתמכה על ידי מענקים ממדעי הטבע והנדסת מועצת מחקר של קנדה (קריגר), ויליאם ועדה איזבל פלדת הקרן (קריגר), והמכון הקנדי לחקר בריאות (הרדן).
Materials
| Name | Company | Catalog Number | Comments |
| Forceps (fine #5) | Almedic | A10-704 | |
| Sylgard Disc | World Precision Instruments | SYLG184 | Mix elastomer base and curing agent in a 10:1 ratio. Set for 30 min. Pour into a mold (e.g. use a 12-well cell culture plate). Let cure for at least 24 hr. Adhere to the lid of a 60 x 15 mm Petri dish lid when dissecting. |
| Minutien Pins (0.0125 mm tip diameter) | Fine Science Tools | 26002-10 | |
| Microdissection Scissors (ultra fine) | Fine Science Tools | 15200-00 | |
| Platform Slides | Glue two 22 x 22 mm2 coverslips onto a microscope slide with clear nail polish, leaving a <20 mm gap in between for sample mounting. | ||
| w1118 | Bloomington Drosophila Stock Center | 3605 | |
| hts01103 | Bloomington Drosophila Stock Center | 10989 | Stock was re-balanced over a GFP balancer so that homozygous mutants can be selected based on the absence of GFP signal. |
| 1x PBS (Phosphate Buffered Saline): 3 mM NaH2PO4, 7 mM Na2HPO4, 130 mM NaCl, pH 7.0 | NaH2PO4 (Caledon Laboratories - 8180-1), Na2HPO4 (Caledon - 8120-1), NaCl (Caledon - 7560-1) | ||
| Bouin's Solution | Sigma-Aldrich | HT10132 | |
| 4% PFA (Paraformaldehyde): 4% PFA in 1x PBS | PFA (Anachemia Science - 66194-300). See doi:10.1101/pdb.rec9959 Cold Spring Harb Protoc 2006 for instructions on how to make the solution. | ||
| [header] | |||
| 1x PBT (Phosphate Buffered Saline with Triton): 1x PBS with 0.01% Triton | Triton X-100 (Sigma-Aldrich - T8787) | ||
| 1% BSA (Bovine Serum Albumin): 1% BSA in 1x PBT | BSA (Bioshop Canada - ALB001). Store at 4 °C. | ||
| mouse anti-Dlg (Discs large) | Developmental Studies Hybridoma Bank | 4F3 | Use at a 1:10 dilution in 1% BSA. |
| rabbit anti-HtsM (Hu-li tai shao) | Provided by Dr. Lynn Cooley (Yale University). Use at a 1:250 dilution in 1% BSA. | ||
| rabbit anti-Pak (p21-activated kinase) | Provided by Dr. Nicholas Harden (Simon Fraser University). Use at a 1:500 dilution in 1% BSA. | ||
| mouse anti-Wg (Wingless) | Developmental Studies Hybridoma Bank | 4D4 | Use at a 1:5 dilution in 1% BSA. |
| goat anti-Hrp (Horseradish peroxidase) | Jackson ImmunoResearch | 123-065-021 | Use at a 1:200 dilution in 1% BSA. |
| FITC-conjugated donkey anti-goat | Jackson ImmunoResearch | 705-095-003 | Use at a 1:200 dilution in 1% BSA. |
| Duolink In Situ PLA Probe anti-mouse MINUS | Sigma-Aldrich | DUO92004 | |
| Duolink In Situ PLA Probe anti-rabbit PLUS | Sigma-Aldrich | DUO92002 | |
| Duolink In Situ Detection Reagents Red | Sigma-Aldrich | DUO92008 | |
| 1x Wash Buffer A: 0.01 M Tris, 0.15 M NaCl, 0.05% Tween 20, pH 7.4 | Sigma-Aldrich | DUO82049 | Tris (Caledon Laboratories - 8980-1), NaCl (Caledon - 7560-1), Tween 20 (Fisher Scientific - BP337) |
| 1x Wash Buffer B: 0.2 M Tris, 0.1 M NaCl, pH 7.5 | Sigma-Aldrich | DUO82049 | Tris (Caledon Laboratories - 8980-1), NaCl (Caledon - 7560-1) |
| 0.01x Wash Buffer B: 2 mM Tris, 1 mM NaCl, pH 7.5 | Sigma-Aldrich | DUO82049 | Tris (Caledon Laboratories - 8980-1), NaCl (Caledon - 7560-1) |
| Duolink In Situ Mounting Medium with DAPI | Sigma-Aldrich | DUO82040 | |
References
- Woods, D. F., Bryant, P. J. The discs-large tumor suppressor gene of Drosophila encodes a guanylate kinase homolog localized at septate junctions. Cell. 66, 451-464 (1991).
- Yamanaka, T., Ohno, S. Role of Lgl/Dlg/Scribble in the regulation of epithelial junction, polarity and growth. Front Biosci. 13, 6693-6707 (2008).
- Humbert, P. O., et al. Control of tumourigenesis by the Scribble/Dlg/Lgl polarity module. Oncogene. 27, 6888-6907 (2008).
- Lahey, T., Gorczyca, M., Jia, X. X., Budnik, V. The Drosophila tumor suppressor gene dlg is required for normal synaptic bouton structure. Neuron. 13, 823-835 (1994).
- Ataman, B., Budnik, V., Thomas, U. Scaffolding proteins at the Drosophila neuromuscular junction. Int Rev Neurobiol. 75, 181-216 (2006).
- Thomas, U., Kobler, O., Gundelfinger, E. D. The Drosophila larval neuromuscular junction as a model for scaffold complexes at glutamatergic synapses: benefits and limitations. J Neurogenet. 24, 109-119 (2010).
- Matsuoka, Y., Li, X., Bennett, V. Adducin: structure, function and regulation. Cell Mol Life Sci. 57, 884-895 (2000).
- Wang, S., et al. Drosophila adducin regulates Dlg phosphorylation and targeting of Dlg to the synapse and epithelial membrane. Dev Biol. 357, 392-403 (2011).
- Soderberg, O., et al. Characterizing proteins and their interactions in cells and tissues using the in situ proximity ligation assay. Methods. 45, 227-232 (2008).
- Brent, J. R., Werner, K. M., McCabe, B. D. Drosophila larval NMJ dissection. J Vis Exp. (24), (2009).
- Ramachandran, P., Budnik, V. Immunocytochemical staining of Drosophila larval body-wall muscles. Cold Spring Harb Protoc. 2010, (2010).
- Ramachandran, P., Budnik, V. Dissection of Drosophila larval body-wall muscles. Cold Spring Harb Protoc. , (2010).
- Ashburner, M. . Drosophila: A Laboratory Manual. , (1989).
- Brent, J., Werner, K., McCabe, B. D. Drosophila larval NMJ immunohistochemistry. J Vis Exp. (25), (2009).
- Parnas, D., Haghighi, A. P., Fetter, R. D., Kim, S. W., Goodman, C. S. Regulation of postsynaptic structure and protein localization by the Rho-type guanine nucleotide exchange factor dPix. Neuron. 32, 415-424 (2001).
- Petrella, L. N., Smith-Leiker, T., Cooley, L. The Ovhts polyprotein is cleaved to produce fusome and ring canal proteins required for Drosophila oogenesis. Development. 134, 703-712 (2007).
- Pielage, J., Bulat, V., Zuchero, J. B., Fetter, R. D., Davis, G. W. Hts/Adducin controls synaptic elaboration and elimination. Neuron. 69, 1114-1131 (2011).
- Spradling, A. C., et al. The Berkeley Drosophila Genome Project gene disruption project: Single P-element insertions mutating 25% of vital Drosophila genes. Genetics. 153, 135-177 (1999).
- Bokoch, G. M. Biology of the p21-Activated Kinases. Annu Rev Biochem. 72, 743-781 (2003).
- Bahri, S., et al. The leading edge during dorsal closure as a model for epithelial plasticity: Pak is required for recruitment of the Scribble complex and septate junction formation. Development. 137, 2023-2032 (2010).
- Albin, S. D., Davis, G. W. Coordinating structural and functional synapse development: postsynaptic p21-activated kinase independently specifies glutamate receptor abundance and postsynaptic morphology. J Neurosci. 24, 6871-6879 (2004).
- Koles, K., Budnik, V. Wnt signaling in neuromuscular junction development. Cold Spring Harb Perspect Biol. 4, (2012).
- Packard, M., et al. The Drosophila Wnt, wingless, provides an essential signal for pre- and postsynaptic differentiation. Cell. 111, 319-330 (2002).
- Weibrecht, I., et al. Proximity ligation assays: a recent addition to the proteomics toolbox. Expert Rev Proteomics. 7, 401-409 (2010).
- Thymiakou, E., Episkopou, V. Detection of signaling effector-complexes downstream of bmp4 using PLA, a proximity ligation assay. J Vis Exp. (49), (2011).
- Maglione, M., Sigrist, S. J. Seeing the forest tree by tree: super-resolution light microscopy meets the neurosciences. Nat Neurosci. 16, 790-797 (2013).
- Wang, S., et al. . Biol. Open. 3 (12), 1196-1206 (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved