Method Article
Heterotópico Rat auxiliar Liver Transplantation com fluxo regulado Portal Vein Arterialização na Insuficiência Hepática Aguda
Neste Artigo
Resumo
O transplante de fígado auxiliar proporciona um suporte temporário em insuficiência hepática aguda, até que a regeneração do fígado, não. O transplante heterotópico auxiliar fígado (HALT) com Arterialização veia porta (PVA) torna a função hepática está suficientemente bem. Desenvolvemos uma técnica análoga, no rato, para examinar a influência da arterialização veia portal na morfologia e função do enxerto.
Resumo
Na insuficiência hepática de transplante de fígado auxiliar aguda é uma abordagem alternativa interessante. O objetivo é fornecer um apoio temporário até que o fígado nativo não regenerou. 1-3 O APOLT-método, a implantação ortotópico de segments- auxiliar evita a maioria dos problemas técnicos. No entanto, este método necessita de grandes ressecções de ambos o fígado nativo e o enxerto. 4 Em 1998, Erhard desenvolvido o transplante heterotópico auxiliar fígado (PARADA), utilizando a arterialização da veia porta (PVA) (Figura 1). Esta técnica se mostrou promissora resultados clínicos iniciais. 5-6 Desenvolvemos uma parada-técnica com fluxo regulado PVA no rato para examinar a influência do PVA-fluxo regulado na morfologia e função (Figura 2) enxerto.
Um enxerto de fígado reduzida para 30% do seu tamanho original, foi heterotopicamente implantado na região renal direita do receptor após o explante do rim direito.60; A veia cava de infra-hepática do enxerto anastomose com a veia cava infrahepatic do destinatário. O Arterialização da veia porta do doador foi realizado via artéria renal direita do destinatário com a técnica de stent. A regulação do fluxo de sangue da veia porta arterializado foi conseguido com a utilização de uma prótese com um diâmetro interno de 0,3 mm. O tronco celíaco do enxerto foi de ponta a lado com anastomose aorta do destinatário e do ducto biliar foi implantado no duodeno. A ressecção do fígado nativo foi realizada para induzir falha hepática aguda 7.
Deste modo foram realizados 112 transplantes. A taxa de sobrevivência perioperatória foi de 90% e a taxa de sobrevivência de 6 semanas foi de 80%. Seis semanas após a operação, o fígado nativo regenerada, que apresenta um aumento de peso de 2,3 ± 0,8 g para 9,8 ± 1 g. Nesta altura, o peso do enxerto diminuiu de 3,3 ± 0,8 g para 2,3 ± 0,8 g. Nós fomos capazes de obter promissores resultados a longo prazo em termos de morfologia e função do enxerto. HALT com fluxo regulado PVA preenche de forma confiável insuficiência hepática aguda até o fígado nativo regenera.
Introdução
Insuficiência hepática aguda representa um problema grave em medicina clínica que leva a uma taxa de mortalidade de 60-80%. 8 Na insuficiência hepática aguda, transplante hepático auxiliar é uma terapia alternativa promissora para superar a fase aguda. O fígado nativo é deixado para regenerar e segue para a regeneração dos medicamentos de imunossupressão pode ser interrompido. Como consequência, o enxerto se torne atrófica. No entanto, a técnica operatória para transplante de fígado auxiliar ainda é discutido. 1-3 Neste contexto, Terpstra relatou a falta de espaço para o enxerto, o sangue portal roubar fenômeno e que o problema de congestão venosa e drenagem 9-10 veia porta do doador. anastomose fim-a-lado a veia porta do destinatário. Isto resultou em competição de fluxo portal entre o enxerto eo fígado nativo e em trombose da veia porta. A maioria destes problemas técnicos podem ser evitadas com a utilização do método APOLT-(orthotopic implantação de segmentos auxiliares). 4 No entanto, este método requer extensas ressecção de ambos o fígado nativo e o enxerto. 4, em 1998, e a sua equipa Erhard desenvolvido o transplante heterotópico auxiliar fígado (PARADA), utilizando a arterialização da veia porta (PVA) (Figura 1 ). O hilo e a veia portal do fígado nativa sejam respeitados com a utilização do presente método. Isso poupa o destinatário de efeitos colaterais indesejáveis, tais como trombose da veia porta e sangue portal roubar fenômeno, que poderia perturbar a recuperação do fígado nativo. Além disso, há grandes ressecções hepáticas do fígado nativo e enxerto são necessários para este método, com conseqüente menor sangramento e mais massa total do parênquima hepático restante para colmatar (enxerto) e regeneração (fígado nativo). Esta técnica se mostrou promissora resultados clínicos iniciais. 5-6 O objetivo deste trabalho experimental foi o desenvolvimento de uma técnica de parar com Arterialização veia porta emo rato para fins de pesquisa (figura 2). Nos experimentos preliminares, não levamos em consideração a regulação do fluxo sangüíneo da veia portal arterializado, o que resultou em congestionamento do enxerto transplantado após a reperfusão e sangramento maciço da cápsula do fígado. 11 Desde então, o fluxo de sangue na veia portal arterializado foi regulada por um stent com um diâmetro interno de 0,3 mm e um comprimento de 8 mm. Experiências piloto tinham mostrado que um diâmetro de 0,3 milímetros de stent produz um fluxo de sangue média na veia porta arterializado que está dentro da gama fisiológica superior (1,7 +/- 0,4 ml / min / g de peso de fígado). Nossos 12 resultados sem regulação do fluxo sanguíneo correlacionar com os resultados de Hong, que realizou parada com PVA através da artéria ilíaca do destinatário. 13 Em seus experimentos, sem regulação do fluxo sangüíneo portal enorme e congestionamentos sinusoidais ocorreu.
O objetivo do nosso vídeo é demonstrate passo a passo desta técnica cirúrgica experimental ne.w no rato. No longo prazo, a técnica proposta pode ser utilizado em estudos sobre a regeneração do fígado e da concorrência inter-fígado e Arterialização veia porta, hiperperfus� veia porta e regulação do fluxo sangüíneo portal.
Protocolo
1. Animais Experimentais
- Obter uma aprovação do Comitê de Ética local para todos os experimentos que serão realizados, de acordo com as diretrizes de proteção animal FELASA (K 40, 17/99).
- Use ratos Lewis machos disponíveis para compra a partir de qualquer criador comercial (por exemplo, Charles River Wiga GmbH, Sulzfeld, Alemanha). Aqui, 224 animais (112 doadores, 112 destinatários) foram utilizados para realizar 112 transplantes. Os receptores foram sacrificados seis semanas de pós-operatório. No momento da operação, os animais devem pesar 250-350 g.
- Manter os animais em quartos climatizados com acesso gratuito à comida e água.
2 Anestesia e preparação operativo
- Colocar o rato dentro de uma caixa de plexiglas ligado à máquina de anestesia com uma taxa de fluxo de oxigénio de 1 L / min, e um vaporizador de isofluorano com 5% de gás anestésico para induzir a anestesia. Manter a anestesia em 1,5% isofluorano.
- Colocar os ratos emdecúbito dorsal sobre uma placa de aquecimento.
- Retire a pele do abdômen com um creme de depilação.
- Prepare um campo cirúrgico estéril da seguinte forma: Use um desinfetante para limpar a bancada. Para a desinfecção de clorexidina a utilização local de incisão primeira, segunda e álcool, finalmente, uma solução de esfrega (por exemplo, cloro-hexidina e 70% de álcool isopropílico). Usar um vestido cirúrgico descartável e luvas cirúrgicas.
- Use instrumentos de microcirurgia estéreis.
- Use um microscópio de operação em ampliação de 12-20 vezes.
3 Procedimento Cirúrgico
- Operação do Doador
Preparação- Realize uma laparotomia mediana e ressecção do lobo lateral esquerdo eo lobo médio do enxerto, como descrito por Higgins. 14
- Em seguida, preparar o ligamento hepatoduodenal. Primeiro ligadura do ducto biliar, a fim de induzir a congestão e dilatação do ducto biliar. Em seguida, ligar e transecto a gastroduodenal veia e artéria. Em seguida, isolar o tronco celíaco e da artéria hepática comum e transecto da artéria gástrica esquerda e artéria esplênica. Inciso do ducto biliar congestionado, e introduzir um stent 20-G para ele. O posicionamento do stent tem de assegurar a drenagem de todo o sistema de ductos biliares hilares. Transecto do ducto biliar distal ao stent.
- Isolar o segmento infrahepatic da veia cava logo acima da veia renal direita.
Perfusão - Após ligadura da aorta acima do tronco celíaco, fixar a veia porta e inciso lo. Introduzir o cateter de perfusão (14 L) para dentro da veia portal, e efectuar a perfusão com 30 ml de triptofano--cetoglutarato de histidina (HTK) -solution (12 cm de H2O, 4 ° C).
- Cortar o diafragma e a veia cava supra-hepática para permitir que o perfusato para fluir para fora.
- Extirpar o tronco celíaco, juntamente com um remendo da aorta e lave-o com uma solução de histidina-triptofano-cetoglutarato.
Explantação - Transecto a veia cava infrahepatic logo acima da veia renal direita.
- Em seguida, coloque um stent com um diâmetro de 0,3 milímetros na veia porta e corrigi-lo com uma ligadura. Durante a operação seguinte, na veia porta é arterializada através da artéria renal direita. Transecto a veia portal distal ao stent.
- Após ligadura da veia cava supra-hepática, transecto-lo juntamente com um manguito de diafragma.
- Explante enxerto e armazená-lo em histidina-triptofano-cetoglutarato (HTK) -solution a 4 ° Celsius em um saco plástico com gelo. Suturas lugar de canto (8-0 Ethilon) na veia cava infrahepatic.
- Operação Destinatário
- Realize uma laparotomia mediana e preparar a veia cava infrahepatic. Em seguida, isolar a artéria renal direita e do ureter, ligar o ureter e transecção ele. Fixar a artéria renal direita em sua origem, em seguida, ligar a veia renal direita. Em seguida, após a transecção da re tantovasos Nal, realizar a nefrectomia. Posteriormente, encurtar a artéria renal direita, lave-o com solução de heparina salina (soro fisiológico 40 UI de heparina / ml).
- Transecto a veia renal direita proximal à ligadura após o pinçamento proximal e distal da veia cava infrahepatic para criar um lúmen ovais na veia cava infrahepatic. Lavar a veia cava com uma solução salina com heparina. Implantar o enxerto na região renal direita do abdômen do destinatário.
- Anastomosar infrahepatic fim-lateral da veia cava do doador para a veia cava recipient`s com sutura contínua 8-0 Ethilon.
- Após lavagem com solução de heparina / solução salina, introdução do stent na veia portal para a artéria renal direita (Figura 3). Ligue a veia porta ea artéria renal com dois pontos (8-0 Ethilon). Fixe o stent ligando na artéria renal com uma ligadura (trançado de seda preta 7-0).
- Para permitir a reperfusão, primeiro retire a braçadeira arterial, em seguida, ambosbraçadeiras venoso (Figura 4).
- Prepare a aorta infra-renal, em seguida, coloque uma proximal e distal e inciso microclampe a aorta direita entre os dois grampos. Anastomose término-lateral entre a aorta e tronco celíaco do doador, usando um tapa-aórtica, com sutura contínua 10-0 Ethilon.
- Inserir o canal biliar para o duodeno: Aplicar uma sutura em bolsa na parede do duodeno, fazer uma pequena incisão na parede do duodeno à direita no meio do em bolsa. Introduzir o ducto biliar stent para o duodeno, e aperte o sutura em bolsa. Finalmente, segurar o duodeno e do ducto biliar firmemente junto com dois pontos (8-0 Ethilon) (Figura 5).
- Em seguida, realizar uma ressecção do fígado nativo, primeiro descrito por Emond et al. para imitar insuficiência hepática aguda. sete
- Fixar a veia cava supra-hepática do enxerto, em conjunto com um rotador de diafragma, a parede abdominal lateral do recipient com Vicryl 4-0 sutura. Lavar o abdômen com solução salina (Figura 6).
- Para a camada muscular utilizar um fio de sutura 4-0 Vicryl execução e para a sutura contínua cutânea 3-0 Vicryl.
4 Recuperação e manejo pós-operatório
- Deixe os animais recuperar da anestesia sob uma lâmpada de aquecimento infravermelho.
- Injectar buprenorfina a uma dose de 0,03-0,05 mg / kg de peso corporal todas as 8-12 horas sc durante 2 dias.
- Examine os animais relativas ao estado geral e sinais de doença ou infecções.
5 Cálculo do fígado inicial Peso Native
Calcula-se o peso inicial de fígado nativo da seguinte maneira: subtrair o peso dos lóbulos do fígado ressecados a partir do peso do fígado completo (2,66% do peso corporal (este valor, com um desvio padrão de 0,49% +/- foi determinada em experiências anteriores com n = 80 animais da mesma estirpe e umage)) 15.
Resultados
A duração média do transplante foi de cerca de 150 min. O tempo de isquemia fria foi de 64 +/- 7 min, o tempo de isquemia quente foi inferior a 25 min.
A taxa de sobrevivência perioperatória foi de 90% e a taxa de sobrevivência de 6 semanas foi de 80%. A perda de 20% foi devido a peritonite por causa do deslocamento do stent e extravasamento biliar (quatro animais) durante a primeira semana de pós-operatório e, devido à pneumonia, abcesso intra-abdominal e íleo (sete animais) durante os seguintes cinco semanas. Os animais vivos estavam em excelente estado geral.
Os parâmetros do fígado-síntese (valor da rápida: 110 +/- 7,8%, AT III: 104 +/- 6%) estavam dentro da faixa normal, seis semanas após a operação.
Neste ponto de tempo, o fígado nativo tinha regenerado, mostrando um aumento de peso de 2,3 ± 0,8 g para 9,8 ± 1 g (P: 0,0065). O peso do enxerto diminuiu de 3,3 ± 0,8 g para 2,3 ± 0,8 g (P: 0,06). The o peso total de ambos os fígados estava dentro da proporção de peso do fígado fisiológico / peso corporal (Figura 7).
Na coloração histológica dos enxertos com Hematoxilina-Eosina às 6 semanas após HALT, hepatócitos normais foram observadas com nenhum edema nem degeneração gordurosa (Figura 8). Todos os enxertos mostraram ligeira proliferação de ductuli biliar e colangite, devido à formação de lodo (Figura 8). Baixo grau intra-parenquimatoso necroses hepatocelular pode ser observada em apenas dois enxertos. Depois de seis semanas a histologia do fígado nativo não revelou alterações.

Figura 1 Representação esquemática do transplante heterotópico auxiliar fígado (HALT) com Arterialização veia porta (PVA) em humanos. O PORveia tal (3) é arterializada através de uma artéria ilíaca bifurcação interposição de enxerto (5), que também é o alimentador de navio da artéria hepática (6).
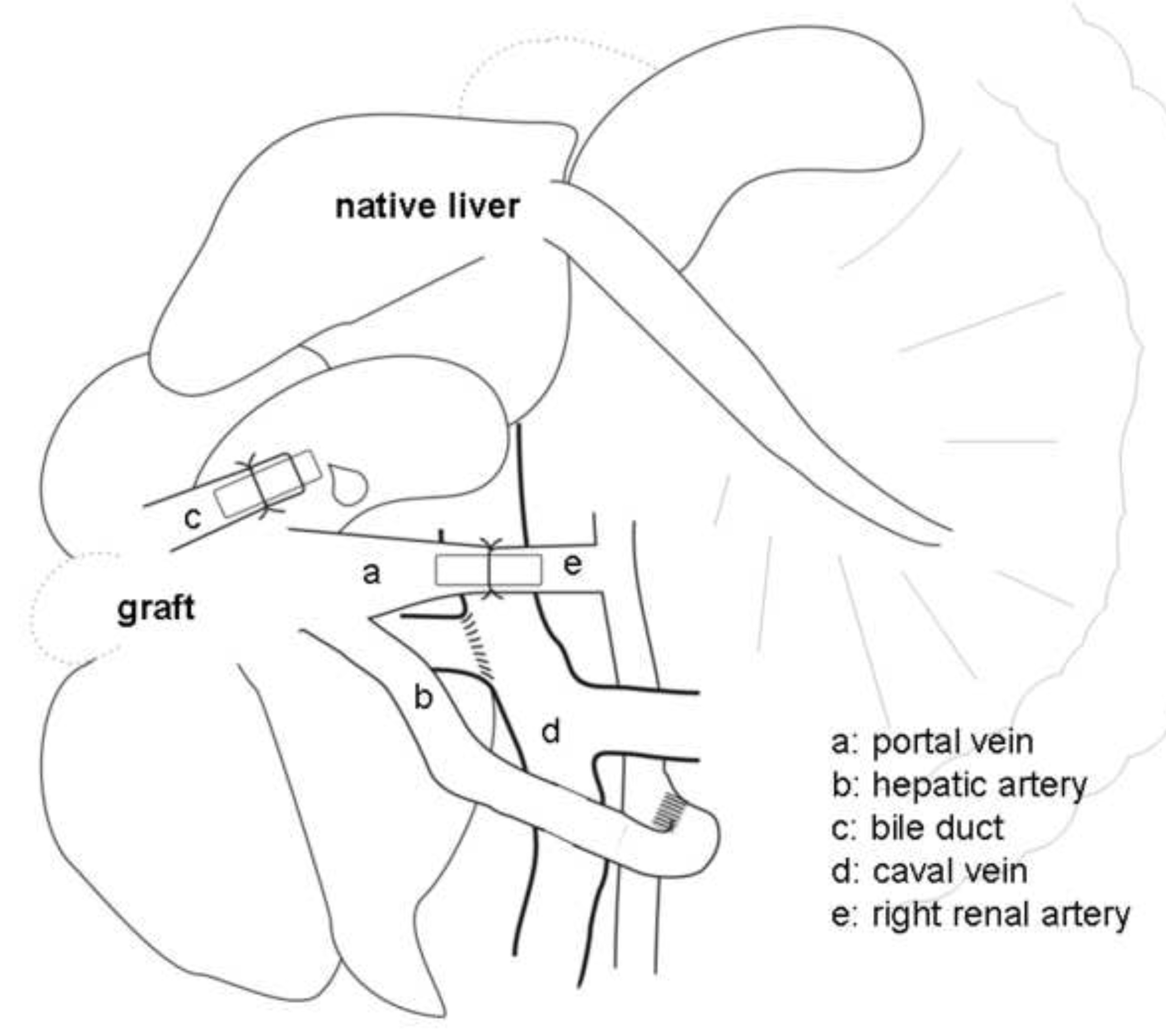
Figura 2 Representação esquemática do transplante heterotópico auxiliar fígado (PARADA) com a arterialização da veia porta (PVA) no rato. A veia portal (a) é arterializada através da artéria renal direita (e) por um stent.

Figura 3. Portal arterialização veia durante HALT com PVA no rato. (A) O stent na veia porta é introduzido na artéria renal direita. (B) o POR veia tal e da artéria renal direita estão conectados com duas suturas. Clique aqui para ver uma versão maior desta figura.

Figura 4 Situs da reperfusão através da veia portal arterializado no rato. Clique aqui para ver uma versão maior desta figura. Clique aqui para ver uma versão maior desta figura.
"width =" pg 500 "/>
Figura 5 Choledocho-duodenotomia durante HALT no rato. Clique aqui para ver uma versão maior desta figura.
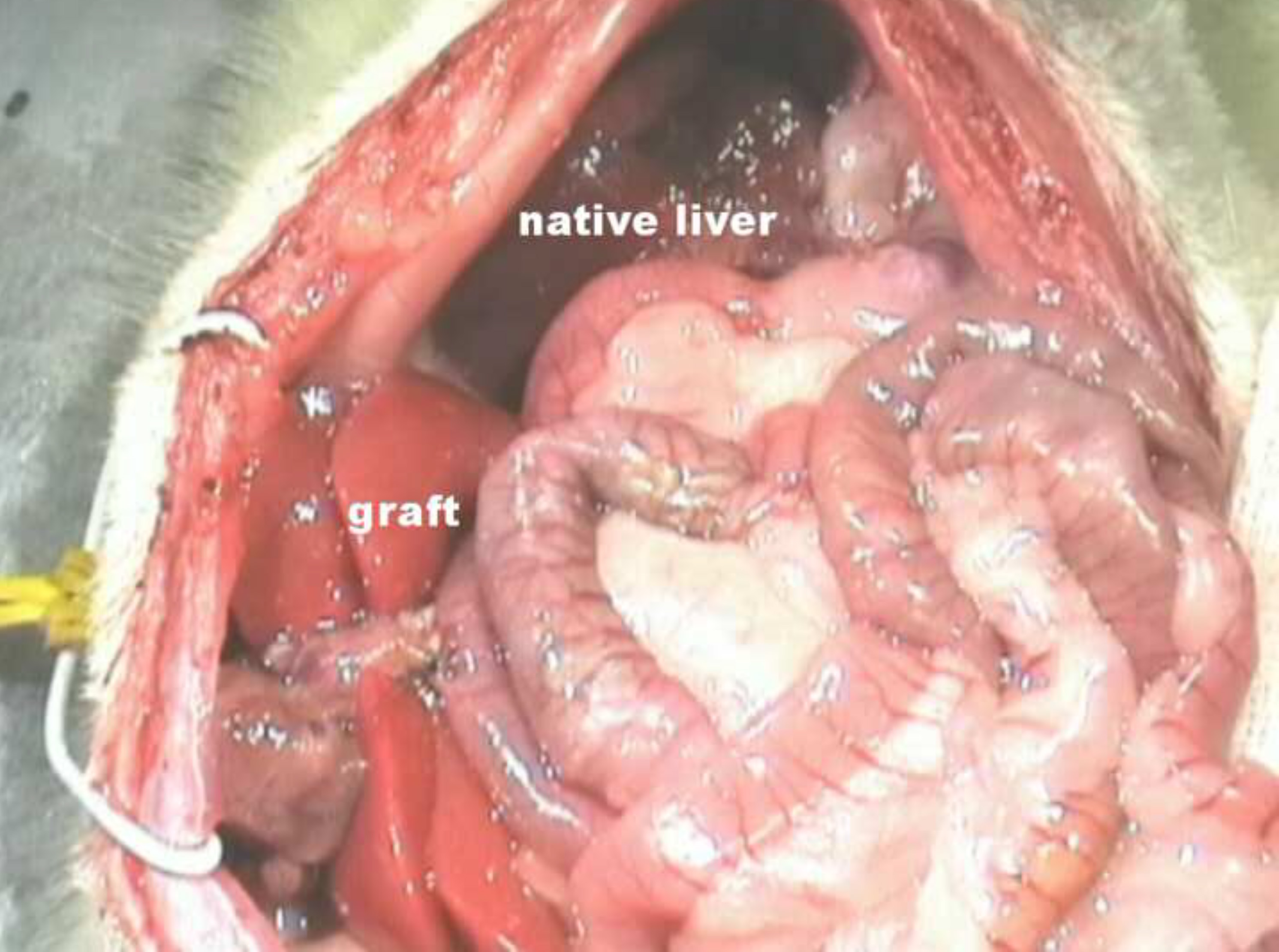
Figura 6 Situs após parar com PVA no rato. Clique aqui para ver uma versão maior desta figura.

Figura 7 Apresentação gráfica do peso do fígado (gr) de nativo fígado, enxerto efígado total no ponto de tempo de funcionamento e após seis semanas.

Figura 8 Corte histológico do enxerto depois de seis semanas, corados com Hematoxilina-Eosina (HE) (x100 ampliação (A) e x400 (B)). Clique aqui para ver uma versão maior desta figura.
Discussão
O primeiro transplante de fígado de rato heterotópico auxiliar foi descrito por Lee et al. 16, em 1966, seguido por Hess. 17 A veia portal do enxerto anastomose com a veia portal do destinatário. Durante este processo, o fornecimento de sangue da veia porta para o fígado nativo é comprometida.
Em 1991, Hong realizada parada com PVA através da artéria ilíaca do destinatário. 13 Sem regulação do fluxo sangüíneo portal enorme e congestionamentos sinusoidais ocorreu.
Além disso Aguirrezabalaga et al., PARADA realizada com PVA, no entanto sem prestar a atenção necessária para a regulação do fluxo sanguíneo na veia porta arterializado 18.
A utilização de uma prótese endovascular possuindo um diâmetro interno de 0,3 mm e um comprimento de 8 milímetros produz um fluxo de sangue portal média após reperfusão da veia portal arterializado que está dentro do tocou fisiológica superior12-E.
A drenagem biliar é o calcanhar de Aquiles do transplante de fígado. Os animais receptores estão em perigo de morrer devido ao extravasamento biliar e peritonite. Para esta finalidade utilizou-se um stent para executar o choledocho-duodenotomia. Além disso, aplicamos uma sutura em bolsa com um par de pontos adicionais para evitar fugas e desconexão. Por conseguinte, as complicações biliares foram reduzidos a 4%.
No presente estudo, uma ressecção do fígado nativo foi realizada para induzir a insuficiência hepática aguda. Esta técnica foi descrita pela primeira vez por Emond, é padronizado e não mostra efeitos colaterais em outros órgãos ou no enxerto. 7
Em 2002, a técnica publicada Palmes APOLT no rato, com uma taxa de sobrevivência de 70-80%, os animais foram sacrificados após duas semanas. 19 Neste modelo, o lobo esquerdo do enxerto transplantado foi depois retirada do lobo esquerdo do natfígado ive. Veia portal do enxerto anastomose de ponta a ponta para a esquerda da veia porta segmentar do receptor, resultando em dificuldade cirúrgica para executar a operação, uma vez que o lúmen dos vasos torna-se muito pequeno.
Ao contrário do transplante de fígado, durante o transplante hepático heterotópico não há nenhuma fase anepática. Os anastomose pode ser realizada sem qualquer tempo de-pressão. Além disso, na posição heterotópica, não há interferência através da membrana em movimento. Além disso, a veia porta do receptor não é apertado, evitando assim a congestão venosa do intestino delgado, baço, pâncreas e estômago.
Obtivemos bons resultados a longo prazo no que respeita a microcirculação do enxerto, morfologia e 20 de parar com o fluxo regulado PVA pode preencher de forma confiável uma fase aguda insuficiência hepática enquanto o fígado nativo regenera função. 15.
HALT com fluxo regulado é um PVAn técnica inovadora, relativamente fácil de estabelecer. Este modelo permite que os futuros estudos sobre a regeneração do fígado e da concorrência inter-fígado e Arterialização veia porta, hiperperfus� veia porta e regulação do fluxo sangüíneo portal. 20, 21
Divulgações
Todos os autores declararam interesses conflitantes.
Agradecimentos
Este estudo foi financiado pela "Deutsche Forschungsgemeinschaft" (DFG). K. Schleimer foi apoiado pelo Lise Meitner Sociedade do Ministério da Ciência e Pesquisa da NRW. Gostaríamos de agradecer a senhora Mary-Joan Blümich pelo seu excelente assistência edição. Dr. Maria Kokozidou foi financiada a Fresenius 2011_A61.
Materiais
| Name | Company | Catalog Number | Comments |
| Braided Silk black 7-0 | Ethicon Products | 892100 | |
| Vicryl 3-0 | Ethicon Products | J285G | |
| Vicryl 4-0 | Ethicon Products | J284G | |
| Ethilon 8-0 | Ethicon Products | 1714G | |
| Ethilon 10-0 | Ethicon Products | 7770G | |
| Vasofix safety 14G | B Braun | 2758853 | |
| Vasofix safety 20G | B Braun | 2758818 | |
| 2 French (.012”/0.3mm ID x .025”/0.6mm OD) x 24”/60cm polyurethane catheter | Access technologies a division of Norfolk Medical, Inc., Illinois, USA | CNC-2P | |
| HTK solution, | Dr. Franz Köhler Chemie GmbH, Alsbach-Hähnlein, Germany | ||
| Custodiol | |||
| Isofluorane 5 % | Any genericon | ||
| Heparin | Any genericon | ||
| 0.9% saline | Any genericon | ||
| Buprenorphine | Any genericon |
Referências
- Boudjema, K., et al. Auxiliary liver transplantation for fulminant and subfulminant hepatic failure. Transplantation. 59, 218-223 (1995).
- Boudjema, K., Jaeck, D., Siméoni, U., Bientz, J., Chenard, M. P., Brunot, P. Temporary auxiliary liver transplantation for subacute liver failure in a child. The Lancet. 342, 778-779 (1993).
- Chenard-Neu, M. P., et al. Auxiliary liver transplantation: Regeneration of the native liver and outcome in 30 patients with fulminant hepatic failure - a multicenter European study. Hepatology. 23, 1119-1127 (1996).
- Gubernatis, G., Pichlmayr, R., Kemnitz, J., Gratz, K. Auxiliary partial orthotopic liver–transplantation (APOLT) for fulminant hepatic failure: first successful case report. World J Surg. 15, 660-666 (1991).
- Erhard, J., Lange, R., Giebler, R., Rauen, U., de Groot, H., Eigler, F. W. Arterialization of the portal vein in orthotopic and auxiliary liver transplantation. Transplantation. 60, 877-879 (1995).
- Erhard, J., et al. Auxiliary liver transplantation with arterialization of the portal vein for acute hepatic failure. Transpl Int. 11, 266-271 (1998).
- Emond, J., Capron-Laudereau, M., Meriggi, F., Bernuau, J., Reynes, M., Houssin, D. Extent of Hepatectomy in the rat. Eur Surg Res. 21, 251-259 (1989).
- Mas, A., Rode`s, J. Fulminant hepatic failure. Lancet. 349, 1081-1085 (1997).
- Terpstra, O. T. Auxiliary liver grafting: a new concept in liver transplantation. The Lancet. 342, 758 (1993).
- Terpstra, O. T., Reuvers, C. B., Schalm, S. W. Auxiliary heterotopic liver transplantation. Transplantation. 45, 1003-1007 (1988).
- Schleimer, K., Lange, R., Rauen, U., Erhard, J. Auxiliary liver transplantation in acute liver failure in the rat - an illustrated description of a new surgical approach. Langenbecks Arch Surg. 384 (2), 204-208 (1999).
- Schleimer, K., et al. Physiologic microcirculation of the heterotopically transplanted rat liver with portal vein arterialization depending on optimal stent diameter. Med Sci Monit. 28 (BR140-145), (2006).
- Hong, H. Q., et al. Study of portal arterialization with auxiliary liver in rats. Hiroshima J. Med. Sci. 40, 29-33 (1991).
- Higgins, G. M., Anderson, R. M. Experimental pathology of the liver. I--Restoration of the liver of the white rat following partial surgical removal. Arch. Path. 12, 186-202 (1931).
- Schleimer, K., et al. Auxiliary liver transplantation with flow-regulated portal vein arterialization offers a successful therapeutic option in acute hepatic failure--investigations in heterotopic auxiliary rat liver transplantation. Transpl Int. 19 (7), 581-588 (2006).
- Lee, S., Edgington, T. S. Liver transplantation in the rat. Surg. Forum. 17, 220-222 (1966).
- Hess, F., Willemen, A., Jerusalem, C. Auxiliary liver transplantation in the rat, influence of the condition of the recipient's liver on the fate of the graft. Eur. Surg. Res. 9, 270-279 (1977).
- Aguirrezabalaga, J., Arnal, F., Marini, M., Centeno, A., Fernandez-Selles, C., Rey, I., Gomez, M. Auxiliary liver transplantation with portal arterialization in the rat: description of a new model. Microsurgery. 22, 21-26 (2002).
- Palmes, D., Dietl, K. H., Drews, G., Holzen, J. P., Spiegel, H. U. Auxiliary partial orthotopic liver transplantation: treatment of acute liver failure in a new rat model. Langenbecks Arch Surg. (386), 534-541 (2002).
- Schleimer, K., et al. Improved microcirculation of a liver graft by controlled portal vein arterialization. J Surg Res. 116 (2), 202-210 (2004).
- Schleimer, K., et al. Portal hyperperfusion causes disturbance of microcirculation and increased rate of hepatocellular apoptosis: investigations in heterotopic rat liver transplantation with portal vein arterialization. Transplant Proc. 38 (3), 725-729 (2006).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados