Method Article
Heterotope Hilfs Ratte Leber-Transplantation mit strömungs geregelt Pfortader Arterialisation in akutes Leberversagen
In diesem Artikel
Zusammenfassung
Hilfslebertransplantation bietet eine temporäre Unterstützung in akuten Leberversagen, bis die Regeneration der Leberversagen. Die heterotope Hilfslebertransplantation (HALT) mit Pfortader Arterialisation (PVA) macht ausreichende Leberfunktion. Wir entwickelten eine analoge Technik in der Ratte, um den Einfluss der Pfortader Arterialisation auf die Morphologie und Funktion des Transplantats zu untersuchen.
Zusammenfassung
In akuten Leberversagen Hilfslebertransplantation ist eine interessante Alternative Ansatz. Ziel ist es, eine vorübergehende Unterstützung bieten, bis die ausgefallene nativen Leber regeneriert hat. 1-3 Die APOLT-Methode, die orthotope Implantation von Hilfs segments- wendet die meisten technischen Probleme. Allerdings erfordert diese Methode umfangreichen Resektionen sowohl der nativen Leber und des Transplantats. 4 Im Jahr 1998 entwickelte Erhard heterotopen Hilfslebertransplantation (HALT) unter Verwendung Pfortader Arterialisation (PVA) (Abbildung 1). Diese Technik zeigte vielversprechende erste klinische Ergebnisse. 5-6 Wir entwickelten eine HALT-Technik mit stromgeregelten PVA bei der Ratte um den Einfluss der Strömungs geregelt PVA auf die Transplantat Morphologie und Funktion (Abbildung 2) zu untersuchen.
Eine Lebertransplantat auf 30% seiner ursprünglichen Größe verringert wurde heterotop in der rechten Nierengegend des Empfängers nach der Explantation der rechten Niere implantiert.60; Die Infrarot-Leber Hohlvene des Transplantats wurde mit dem infrahepatische Hohlvene des Empfängers anastomosiert. Die Arterialisierung Pfortader des Spenders wurde über rechte Nierenarterie des Empfängers mit dem Stent-Technik durchgeführt. Der Blutdurchflussregulierung des arterialisierten Pfortader wurde mit der Verwendung eines Stents mit einem Innendurchmesser von 0,3 mm erreicht. Die Zöliakie-Stamm des Transplantats war Ende-zu-Seite mit der Aorta des Empfängers und des Gallengangs anastomosiert wurde in den Zwölffingerdarm implantiert. Eine Zwischensumme Resektion des nativen Leber wurde durchgeführt, um akutes Leberversagen auslösen. 7
Auf diese Weise wurden 112 Transplantationen durchgeführt. Die perioperative Überlebensrate betrug 90% und der 6-Wochen-Überlebensrate betrug 80%. Sechs Wochen nach der Operation, die native Leber regeneriert, zeigt eine Gewichtszunahme von 2,3 ± 0,8 g auf 9,8 ± 1 g. Zu dieser Zeit, Gewichtsabnahme des Transplantats von 3,3 ± 0,8 g auf 2,3 ± 0,8 g. Wir waren in der Lage, vielversprechende langfristige Ergebnisse in Bezug auf die Transplantat-Morphologie und Funktion zu erhalten. HALT mit stromgeregelten PVA zuverlässig überbrückt akutes Leberversagen, bis die einheimischen Leber regeneriert.
Einleitung
Akute Leberversagen stellt ein schwerwiegendes Problem in der klinischen Medizin, die zu einer Mortalitätsrate von 60-80%. 8 In akuten Leberversagen ist die Hilfslebertransplantation eine vielversprechende alternative Therapie, um die akute Phase überbrücken. Die native Leber ist links zu regenerieren und nach dem Regenerations die Immunsuppression Medikamente können abgesetzt werden. Als Folge das Transplantat werden atrophisch. Allerdings ist die Operationstechnik für Hilfslebertransplantation ist immer noch diskutiert. 1-3 In diesem Zusammenhang berichtet Terpstra den Mangel an Platz für das Transplantat, das Portal Blut stehlen Phänomen und das Problem der venösen Stauung und Entwässerung. 9-10 Pfortader des Spenders wurde Pfortader des Empfängers anastomosiert Ende-zu-Seite. Dies führte zu Portal-Flow Wettbewerb zwischen dem Transplantat und der nativen Leber und in Portalvenenthrombose. Die meisten dieser technischen Probleme können bei der Verwendung des APOLT-Methode (orthotop vermiedenic Implantation von Hilfssegmente). 4 Allerdings erfordert diese Methode umfangreichen Resektionen sowohl der nativen Leber und des Transplantats. 4 1998 Erhard und sein Team entwickelten die heterotope Hilfslebertransplantation (HALT) unter Verwendung Pfortader Arterialisation (PVA) (Abbildung 1 ). Hilus und die Pfortader der nativen Leber mit der Verwendung dieses Verfahrens eingehalten. Das schont die Empfänger von unerwünschten Nebenwirkungen wie Thrombose der Pfortader und Portalblut stehlen Phänomen, das Mutter Leber Erholung stören könnten. Darüber hinaus werden keine umfangreichen Leber Resektionen der nativen Leber und Transplantat für diese Methode zur Überbrückung (Graft) und Regeneration (native Leber) erforderlich, damit mit weniger Blutungen und verbleibende Gesamt Leberparenchymzellen Masse. Diese Technik zeigte vielversprechende erste klinische Ergebnisse. 5-6 Das Ziel dieser experimentellen Arbeit war die Entwicklung eines HALT-Technik mit Pfortader in Arterialisationdie Ratte für Forschungszwecke (Abbildung 2). In den Vorversuchen haben wir nicht berücksichtigen, das den Blutfluss Regulierung der arterialisierte Pfortader 11 Seitdem der Blutfluss in der Pfortader arterialisierte nehmen, die in Staus des transplantierten Transplantat nach Reperfusion und massive Blutungen aus der Leberkapsel geführt. wurde mit einem Stent, der mit einem Innendurchmesser von 0,3 mm und einer Länge von 8 mm geregelt. Modellversuche habe gezeigt, dass ein Stent Durchmesser von 0,3 mm ergibt sich eine mittlere Durchblutung im arterialisierten Pfortader, die innerhalb des oberen physiologischen Bereich liegt (1,7 +/- 0,4 ml / min / g Lebergewicht). 12 Unsere Ergebnisse ohne Blutflussregel korrelieren mit den Ergebnissen der Hong, der HALT mit PVA über die Beckenarterie des Empfängers 13 In seinen Experimenten. ohne Blutfluss Regulierung massiven Portal durchgeführt und Sinus Staus aufgetreten.
Das Ziel unserer Video ist auf demonstrate schrittweise dies ne.w Versuchsoperationstechnik bei der Ratte. Auf lange Sicht kann die vorgeschlagene Technik in Studien zur Leberregeneration und inter Leber Wettbewerb und Pfortader Arterialisation, Pfortader Hyperperfusion und Portalblutflussregelung verwendet werden.
Protokoll
1. Versuchstiere
- Besorgen Sie sich eine Ethikkommission die Genehmigung für alle Experimente, die durchgeführt werden, in Übereinstimmung mit den Tierschutz FELASA Richtlinien (K 40, 17/99).
- Verwenden männlichen Lewis-Ratten zur Verfügung, um von jeder kommerziellen Züchter (zB Charles River Wiga GmbH, Sulzfeld, Deutschland) erwerben. Hier, 224 Tiere (112 Spendern, 112 Empfänger) wurden verwendet, um 112 Transplantationen durchzuführen. Die Empfänger wurden bei 6 Wochen nach der Operation getötet. Zum Zeitpunkt der Operation sollten die Tiere 250-350 g wiegen.
- Halten Sie die Tiere in klimatisierten Räumen mit freiem Zugang zu Nahrung und Wasser.
2. Anästhesie und Operative Vorbereitung
- Platzieren Sie die Ratte in einem Plexiglaskasten zu der Anästhesiemaschine mit einer Sauerstoffdurchflussrate von 1 l / min und einer Isofluran Verdampfer mit 5% Narkosegas Anästhesie herbei verbunden. Aufrechterhaltung einer Narkose bei 1,5% Isofluran.
- Legen Sie die Ratten inRückenlage auf einer Warmhalteplatte.
- Entfernen Sie das Fell des Bauches mit einer Enthaarungscreme.
- Bereiten Sie einen sterilen OP-Bereich wie folgt: Verwenden Sie ein Desinfektionsmittel, um den Tisch reinigen. Zur Desinfektion von der Inzisionsstelle Verwendung Chlorhexidin ersten, zweiten Alkohol und schließlich einer Waschlösung (zB Chlorhexidin und 70% Isopropylalkohol). Tragen Sie einen Einweg-OP-Kittel und OP-Handschuhen.
- Sterile Mikroinstrumenten.
- Verwenden Sie ein Operationsmikroskop in 12-20-fache Vergrößerung.
3. Chirurgische Verfahren
- Spender Betrieb
Vorbereitung- Führen Sie eine mediane Laparotomie und Resektion der linken Seitenlappen und der Mittellappen des Transplantats durch Higgins beschrieben. 14
- Dann bereiten die Ligamentum hepatoduodenale. Ersten ligieren den Gallengang, um Staus und Dilatation der kleinen Gallengang zu induzieren. Dann ligieren und durchtrennen die gastroduodenal Vene und Arterie. Anschließend isolieren Zöliakie Stamm und die gemeinsame Leberarterie und durchschneiden die linke Magenarterie und die Milzarterie. Inzision der Gallengang verstopft, und die Einführung einer 20-G-Stent hinein. Die Positionierung des Stents muss die Entwässerung der gesamten hilar Gallengangsystems zu gewährleisten. Schneiden den Gallengang distal des Stents.
- Isolieren Sie die infrahepatische Segment der Hohlvene rechts über der rechten Nierenvene.
Perfusion - Nach der Ligation der Aorta oberhalb des Truncus, klemmen die Pfortader und einzuschneiden es. Einführung der Perfusion Katheter (14 G) in die Pfortader, und führen Sie die Perfusion mit 30 ml Histidin-Tryptophan-Ketoglutarat (HTK) -Lösung (12 cm H2O, 4 ° C).
- Schneiden Sie die Membran und das suprahepatischen Hohlvene, damit das Perfusat zu fließen.
- Verbrauchsteuern Das Zöliakie-Stamm zusammen mit einem Aorten-Patch und spülen Sie es mit Histidin-Tryptophan-Ketoglutarat-Lösung.
Explantation - Durchschneiden die infrahepatische Hohlvene rechts über der rechten Nierenvene.
- Legen Sie dann einen Stent mit einem Durchmesser von 0,3 mm in der Pfortader und fixieren Sie es mit einer Ligatur. Beim folgenden Vorgang wird die Pfortader über die rechte Nierenarterie arterialisiert. Durchschneiden die Pfortader distal des Stents.
- Nach der Ligation der suprahepatischen Hohlvene, Transekt es zusammen mit einer Manschette des Zwerchfells.
- Explantation der Prothese und speichern sie in Histidin-Tryptophan-Ketoglutarat (HTK) -Lösung bei 4 ° Celsius in einer Plastiktüte auf Eis. Platz Ecke Nähte (8-0 Ethilon) in der infrahepatische Hohlvene.
- Empfänger Betrieb
- Führen Sie eine mediane Laparotomie und bereiten die infrahepatische Hohlvene. Dann isolieren die rechte Nierenarterie und der Harnleiter, ligieren den Harnleiter und durchschneiden sie. Klemmen Sie die rechte Nierenarterie an seinem Ursprung, dann ligieren das Recht Nierenvenen. Dann, nach Durchtrennung der beiden neunal Gefäße, führen Sie die Nephrektomie. Anschließend verkürzen die rechte Nierenarterie, spülen Sie es mit Heparin Kochsalzlösung (40 UI Heparin / ml Kochsalzlösung).
- Durchschneiden das Recht Nierenvenen proximal der Ligatur nach proximal und distal Klemmung des infrahepatische Hohlvene zu einer ovalen Lumen im infrahepatische Hohlvene erstellen. Spülen Sie die Hohlvene mit Heparin Kochsalzlösung. Implantieren das Transplantat in der rechten Nierengegend des Bauches des Empfängers.
- Anastomosieren infrahepatische Hohlvene Ende-zu-Seite des Spenders auf die recipient`s Hohlvene mit einem 8-0 Ethilon laufende Naht.
- Nach dem Spülen mit Heparin / Kochsalzlösung einzuführen, den Stent in der Pfortader in der rechten Nierenarterie (3). Schließen Sie die Pfortader und Nierenarterie mit 2 Maschen (8-0 Ethilon). Befestigen Sie die Verknüpfung Stent in der Nierenarterie mit einer Ligatur (geflochtene Seide schwarz 7-0).
- Der Reperfusion zu ermöglichen, zunächst die Arterienklemme zu entfernen, dann beidevenösen Klemmen (4).
- Bereiten Sie die infrarenalen Aorta, dann einen proximalen und distalen microCLAMP und einschneiden die Aorta rechts zwischen den beiden Klemmen. Führen Sie eine Ende-zu-Seit-Anastomose zwischen der Aorta und Truncus des Spenders, mit einem Aorten-Patch, mit einem 10-0 Ethilon laufende Naht.
- Legen Sie die Gallengang in den Zwölffingerdarm: Tragen Sie eine Tabaksbeutelnaht im Zwölffingerdarmwand, machen Sie einen kleinen Schnitt in der Zwölffingerdarmwand in der Mitte der Tabaksbeutel. Einführung der Stent Gallengang in den Zwölffingerdarm, und ziehen Sie die Tabaksbeutelnaht. Schließlich halten den Zwölffingerdarm und der Gallengang fest zusammen mit zwei Maschen (Ethilon 8-0) (Abbildung 5).
- Führen Sie dann eine Zwischensumme Resektion des nativen Leber, zuerst von Emond et al. um akute Leberversagen zu imitieren. 7
- Fixieren die suprahepatischen Hohlvene des Transplantats mit einer Manschette Membran, an der seitlichen Bauchwand von der Wiederfänger mit 4-0 Vicryl Naht. Spülung der Bauch mit Kochsalzlösung (Abbildung 6).
- Für die Muskelschicht mit einem 4-0 Vicryl genäht und die für die Haut ein 3-0 Vicryl fortlaufende Naht.
4. Wiederherstellung und Postoperative Behandlung
- Lassen Sie die Tiere aus der Narkose zu erholen unter einer Infrarotwärmelampe.
- Injizieren Buprenorphin in einer Dosierung von 0,03-0,05 mg / kg KG sc alle 8-12 Stunden für 2 Tage.
- Untersucht die Tiere über den Allgemeinzustand und Anzeichen von Krankheit oder Infektionen.
5. Berechnung des Anfangsmutterlebergewicht
Berechnen Sie die ersten nativen Lebergewicht in der folgenden Weise: subtrahieren das Gewicht der resezierten Leberlappen aus der vollständigen Lebergewicht (2,66% des Körpergewichts (dieser Wert mit einer Standardabweichung von 0,49% +/- wurde in früheren Experimenten mit n bestimmt = 80 Tiere des gleichen Stamms undge)). 15
Ergebnisse
Die mittlere Dauer der Transplantation war etwa 150 min. Die kalte Ischämie Zeit betrug 64 min +/- 7, die warme Ischämie Zeit weniger als 25 min.
Die perioperative Überlebensrate betrug 90% und der 6-Wochen-Überlebensrate betrug 80%. Der Verlust von 20% ist auf Peritonitis, da der Stent-Dislokation und Gallen Leckage (vier Tiere) während der ersten postoperativen Woche und wegen Lungenentzündung, intra-abdominalen Abszess und Ileus (sieben Tiere) in den folgenden fünf Wochen. Die überlebenden Tiere waren in sehr gutem Allgemeinzustand.
Die Parameter der Leber-Synthese (Quickwert: 110 +/- 7,8%, AT III: 104 +/- 6%) waren im Normbereich 6 Wochen nach der Operation.
Zu diesem Zeitpunkt, die native Leber regeneriert hatte, zeigt eine Gewichtszunahme von 2,3 ± 0,8 g auf 9,8 ± 1 g (P: 0,0065). Gewicht des Transplantats sank von 3,3 ± 0,8 g auf 2,3 ± 0,8 g (P: 0,06). The Gesamtgewicht beider Lebern war im physiologischen Verhältnis von Lebergewicht / Körpergewicht (Abbildung 7).
In der histologischen Färbung der Transplantate mit Hämatoxylin-Eosin bei 6 Wochen nach HALT wurden regelmäßige Hepatozyten weder Ödeme noch Verfettung (Abbildung 8) beobachtet. Alle Transplantate leichte Proliferation von Gallen ductuli und Cholangitis zeigte durch Schlammbildung (Abbildung 8). Low-grade-intra-parenchymatösen Leberzell Nekrosen konnte in nur zwei Transplantate beobachtet werden. Nach sechs Wochen ist die Histologie der nativen Leber zeigten keine Veränderungen.

Abbildung 1. Schematische Darstellung der heterotopen Hilfslebertransplantation (HALT) mit Pfortader Arterialisation (PVA) in der menschlichen. PORtal Ader (3) über eine Abzweigung A. iliaca Zwischen Transplantat arterialisiert (5), die auch die Behälter-Zufuhrvorrichtung der Leberarterie (6).
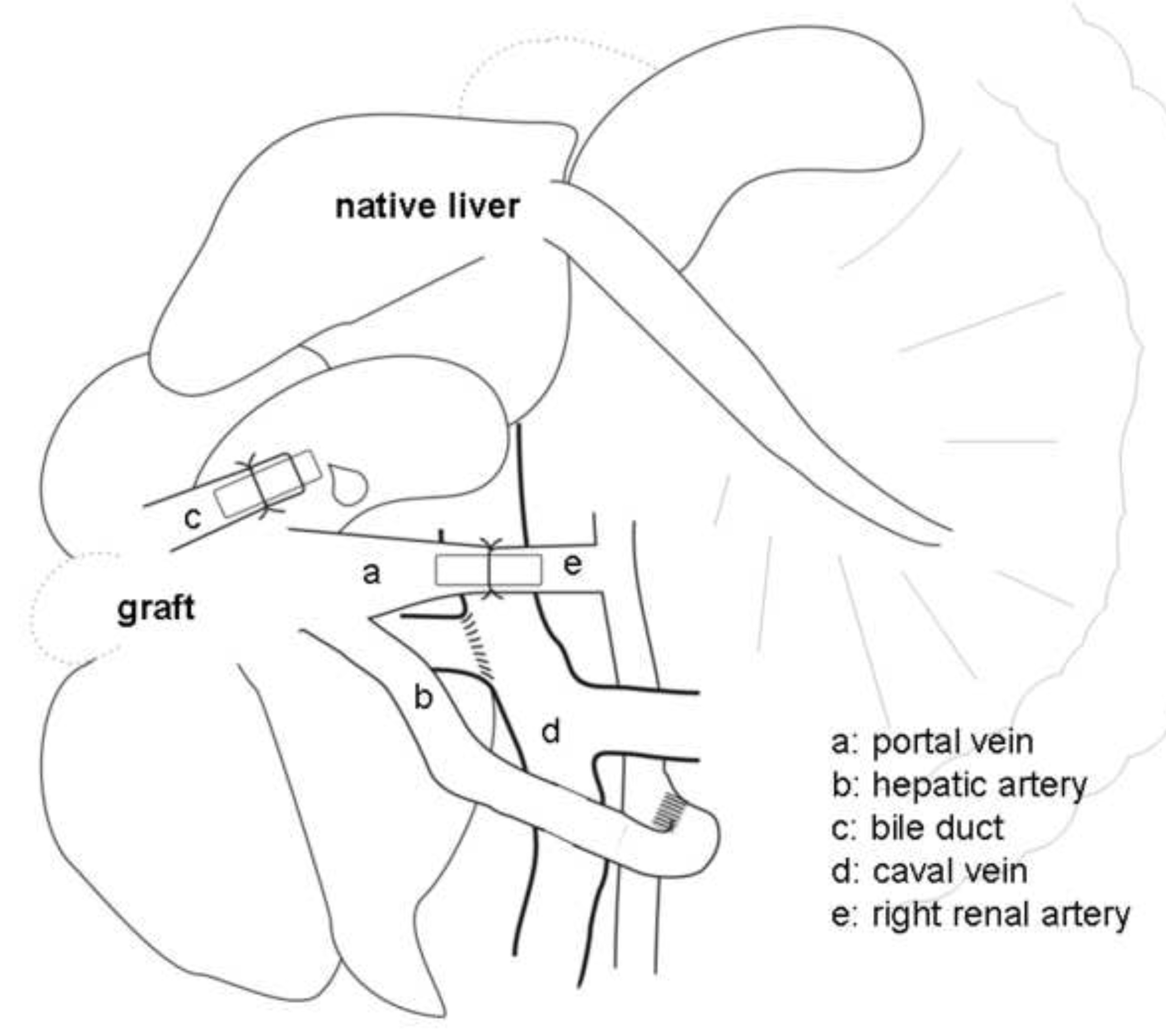
Abbildung 2. Schematische Darstellung der heterotopen Hilfslebertransplantation (HALT) mit Pfortader Arterialisation (PVA) bei der Ratte. Die Pfortader (a) über die rechte Nierenarterie (e) durch einen Stent arterialisierten.

Abbildung 3. Pfortader Arterialisation während HALT mit PVA bei der Ratte. (A) Stent in der Pfortader ist in der rechten Nierenarterie eingeführt. (B) die por tal Vene und die rechte Nierenarterie sind mit zwei Fäden verbunden. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.

Abbildung 4. Situs nach Transplantat Reperfusion über die arterialisierte Pfortader bei der Ratte. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
pg "width =" 500 "/>
Abbildung 5. Choledocho-Duodenostomie während HALT bei der Ratte. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
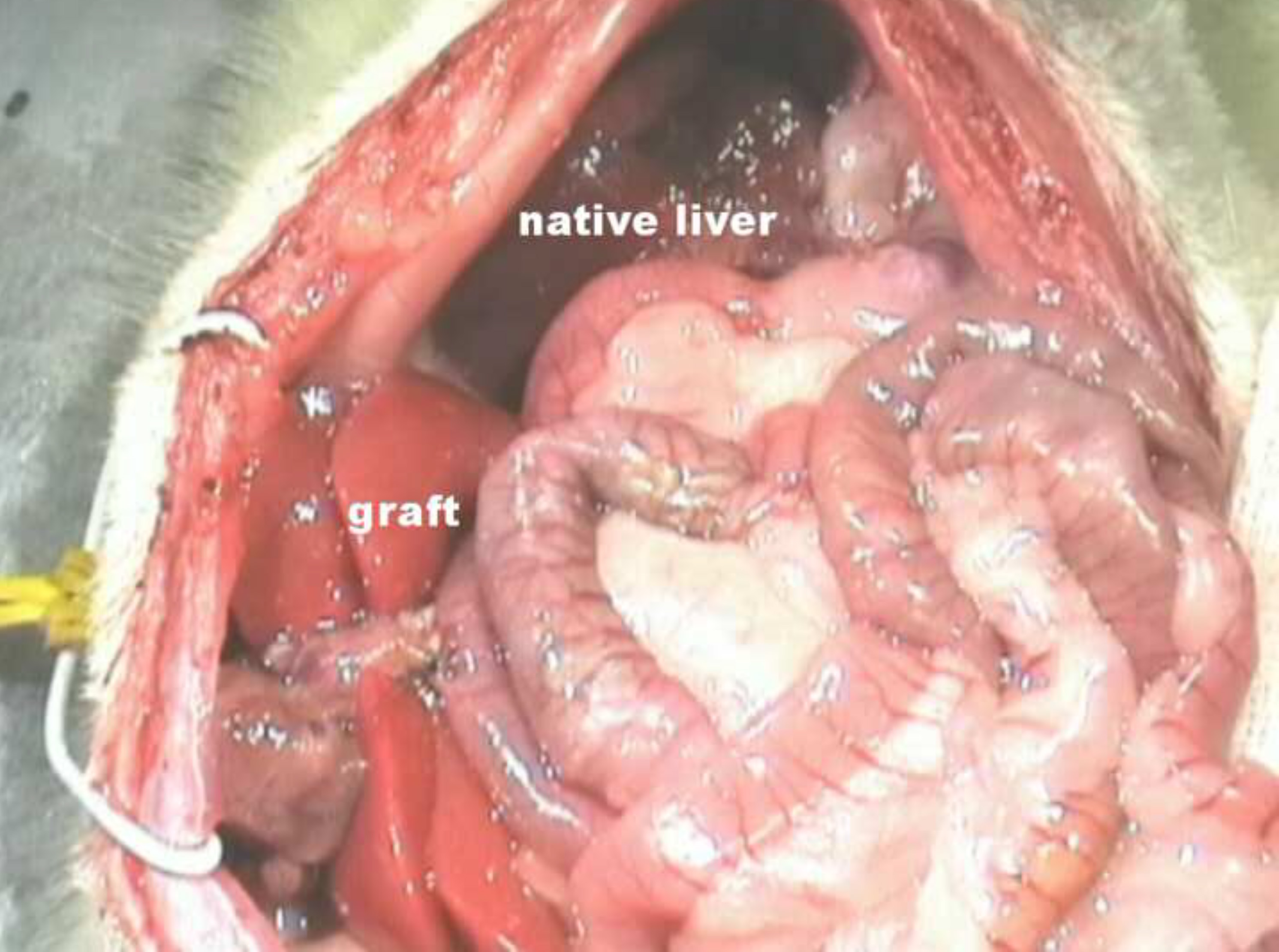
Abbildung 6. Situs nach HALT mit PVA bei der Ratte. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.

Abbildung 7. Graphische Darstellung der Lebergewicht (gr) der nativen Leber, Transplantat undGesamtleber, zum Zeitpunkt der Operation und nach sechs Wochen.

Abbildung 8. Histologischer Schnitt des Transplantats nach sechs Wochen, mit Hämatoxylin-Eosin (HE) (Vergrößerung x100 (A) und X400 (B)) gefärbt. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
Diskussion
Der erste Hilfs heterotopen Rattenlebertransplantation wurde von Lee et al., 16 1966, gefolgt von Hess. 17 Pfortader des Transplantats wurde mit der Pfortader des Empfängers anastomosiert. Während dieser Prozedur wird die Pfortader Blutversorgung des nativen Leber beeinträchtigt.
Im Jahr 1991 durchgeführt Hong HALT mit PVA über die Beckenarterie des Empfängers. Ohne 13 Blutfluss Regulierung massiven Portal und Sinus Staus aufgetreten.
18 Außerdem Aguirrezabalaga et al., Durchgeführt HALT mit PVA, doch ohne die Zahlung der notwendigen Aufmerksamkeit auf die Blutflussregulierung in der arterialisierte Pfortader.
Die Verwendung eines Stents mit einem Innendurchmesser von 0,3 mm und einer Länge von 8 mm ergibt eine durchschnittliche portale Durchblutung nach der Reperfusion des arterialisierten Pfortader, die innerhalb des oberen physiologischen Rang iste. 12
Der biliäre Drainage ist die Achillesferse der Lebertransplantation. Die Empfängertiere sind in Gefahr, wegen Gallen Leckage und Peritonitis sterben. Zu diesem Zweck verwendet man einen Stent, um die choledocho-Duodenostomie zuführen. Zusätzlich haben wir mit einer Tabaksbeutelnaht mit einem Paar von zusätzlichen Nähte, um eine Leckage und Abschalten zu vermeiden. Folglich wurden die Gallen Komplikationen auf 4% reduziert.
In dieser aktuellen Studie wurde eine Zwischensumme Resektion der Leber durchgeführt nativen zu akutem Leberversagen auslösen. Diese Technik wurde zuerst von Emond beschrieben, ist es standardisierte und zeigt keine Nebenwirkungen auf andere Organsysteme oder auf dem Transplantat. 7
2002 veröffentlichte die Palmes APOLT Technik bei der Ratte mit einer Überlebensrate von 70-80% wurden die Tiere nach zwei Wochen getötet. 19 In diesem Modell wird der linke Lappen der Transplantat wurde nach Resektion des linken Lappens des NAT transplantiertive Leber. Pfortader des Transplantats wurde Anastomose Ende-zu-Ende auf der linken Seite segmentale Pfortader des Empfängers, wodurch chirurgische Schwierigkeit, den Vorgang durchzuführen, da das Lumen der Gefäße sehr klein wird.
Im Gegensatz zu Lebertransplantation, während heterotope Lebertransplantation gibt es keine anhepatischen Phase. Die Anastomosen können ohne Zeitdruck durchgeführt werden. Außerdem im heterotopen Position gibt es keine Störung durch die Membran bewegen. Ferner ist Pfortader des Empfängers nicht geklemmt, wodurch venöse Stauung des Dünndarms, Milz, Bauchspeicheldrüse und Magen vermieden wird.
Wir erhalten gute Langzeitergebnisse zur Transplantatmikrozirkulation, Morphologie und 20 HALT mit Durchfluss geregelt PVA zuverlässig eine akute Leberversagen Phase zu überbrücken, während die native Leber regeneriert Funktion. 15.
HALT mit Durchfluss geregelt PVA ist einen innovative Technik, relativ leicht zu etablieren. Dieses Modell ermöglicht es zukünftigen Studien auf die Leberregeneration und inter-Leber Wettbewerb und Pfortader Arterialisation, Pfortader Hyperperfusion und Portal Blutfluss Regulierung. 20, 21
Offenlegungen
Alle Autoren erklärten keine Interessenkonflikte.
Danksagungen
Diese Studie wurde von der "Deutschen Forschungsgemeinschaft" (DFG) gefördert. K. Schleimer wurde von der Lise-Meitner-Stipendium des Ministeriums für Wissenschaft und Forschung des Landes NRW unterstützt. Wir möchten Frau Mary-Joan Blümich für ihre ausgezeichnete Bearbeitung Unterstützung danken. Dr. Maria Kokozidou wurde von der Fresenius 2011_A61 finanziert.
Materialien
| Name | Company | Catalog Number | Comments |
| Braided Silk black 7-0 | Ethicon Products | 892100 | |
| Vicryl 3-0 | Ethicon Products | J285G | |
| Vicryl 4-0 | Ethicon Products | J284G | |
| Ethilon 8-0 | Ethicon Products | 1714G | |
| Ethilon 10-0 | Ethicon Products | 7770G | |
| Vasofix safety 14G | B Braun | 2758853 | |
| Vasofix safety 20G | B Braun | 2758818 | |
| 2 French (.012”/0.3mm ID x .025”/0.6mm OD) x 24”/60cm polyurethane catheter | Access technologies a division of Norfolk Medical, Inc., Illinois, USA | CNC-2P | |
| HTK solution, | Dr. Franz Köhler Chemie GmbH, Alsbach-Hähnlein, Germany | ||
| Custodiol | |||
| Isofluorane 5 % | Any genericon | ||
| Heparin | Any genericon | ||
| 0.9% saline | Any genericon | ||
| Buprenorphine | Any genericon |
Referenzen
- Boudjema, K., et al. Auxiliary liver transplantation for fulminant and subfulminant hepatic failure. Transplantation. 59, 218-223 (1995).
- Boudjema, K., Jaeck, D., Siméoni, U., Bientz, J., Chenard, M. P., Brunot, P. Temporary auxiliary liver transplantation for subacute liver failure in a child. The Lancet. 342, 778-779 (1993).
- Chenard-Neu, M. P., et al. Auxiliary liver transplantation: Regeneration of the native liver and outcome in 30 patients with fulminant hepatic failure - a multicenter European study. Hepatology. 23, 1119-1127 (1996).
- Gubernatis, G., Pichlmayr, R., Kemnitz, J., Gratz, K. Auxiliary partial orthotopic liver–transplantation (APOLT) for fulminant hepatic failure: first successful case report. World J Surg. 15, 660-666 (1991).
- Erhard, J., Lange, R., Giebler, R., Rauen, U., de Groot, H., Eigler, F. W. Arterialization of the portal vein in orthotopic and auxiliary liver transplantation. Transplantation. 60, 877-879 (1995).
- Erhard, J., et al. Auxiliary liver transplantation with arterialization of the portal vein for acute hepatic failure. Transpl Int. 11, 266-271 (1998).
- Emond, J., Capron-Laudereau, M., Meriggi, F., Bernuau, J., Reynes, M., Houssin, D. Extent of Hepatectomy in the rat. Eur Surg Res. 21, 251-259 (1989).
- Mas, A., Rode`s, J. Fulminant hepatic failure. Lancet. 349, 1081-1085 (1997).
- Terpstra, O. T. Auxiliary liver grafting: a new concept in liver transplantation. The Lancet. 342, 758 (1993).
- Terpstra, O. T., Reuvers, C. B., Schalm, S. W. Auxiliary heterotopic liver transplantation. Transplantation. 45, 1003-1007 (1988).
- Schleimer, K., Lange, R., Rauen, U., Erhard, J. Auxiliary liver transplantation in acute liver failure in the rat - an illustrated description of a new surgical approach. Langenbecks Arch Surg. 384 (2), 204-208 (1999).
- Schleimer, K., et al. Physiologic microcirculation of the heterotopically transplanted rat liver with portal vein arterialization depending on optimal stent diameter. Med Sci Monit. 28 (BR140-145), (2006).
- Hong, H. Q., et al. Study of portal arterialization with auxiliary liver in rats. Hiroshima J. Med. Sci. 40, 29-33 (1991).
- Higgins, G. M., Anderson, R. M. Experimental pathology of the liver. I--Restoration of the liver of the white rat following partial surgical removal. Arch. Path. 12, 186-202 (1931).
- Schleimer, K., et al. Auxiliary liver transplantation with flow-regulated portal vein arterialization offers a successful therapeutic option in acute hepatic failure--investigations in heterotopic auxiliary rat liver transplantation. Transpl Int. 19 (7), 581-588 (2006).
- Lee, S., Edgington, T. S. Liver transplantation in the rat. Surg. Forum. 17, 220-222 (1966).
- Hess, F., Willemen, A., Jerusalem, C. Auxiliary liver transplantation in the rat, influence of the condition of the recipient's liver on the fate of the graft. Eur. Surg. Res. 9, 270-279 (1977).
- Aguirrezabalaga, J., Arnal, F., Marini, M., Centeno, A., Fernandez-Selles, C., Rey, I., Gomez, M. Auxiliary liver transplantation with portal arterialization in the rat: description of a new model. Microsurgery. 22, 21-26 (2002).
- Palmes, D., Dietl, K. H., Drews, G., Holzen, J. P., Spiegel, H. U. Auxiliary partial orthotopic liver transplantation: treatment of acute liver failure in a new rat model. Langenbecks Arch Surg. (386), 534-541 (2002).
- Schleimer, K., et al. Improved microcirculation of a liver graft by controlled portal vein arterialization. J Surg Res. 116 (2), 202-210 (2004).
- Schleimer, K., et al. Portal hyperperfusion causes disturbance of microcirculation and increased rate of hepatocellular apoptosis: investigations in heterotopic rat liver transplantation with portal vein arterialization. Transplant Proc. 38 (3), 725-729 (2006).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten