Method Article
Anticâncer metal Complexos: Síntese e Avaliação de citotoxicidade pelo ensaio MTT
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Um método para a síntese de titânio e vanádio anticancerígenos agentes sensíveis ao ar é descrito, juntamente com a avaliação da sua actividade citotóxica no sentido de linha de células de cancro humano por o Ensaio MTT.
Resumo
De titânio (IV) e vanádio (V) são complexos de agentes anticancerígenos altamente potentes. Um desafio na sua síntese refere-se à sua instabilidade hidrolítica, pelo que a sua preparação deve ser conduzida sob uma atmosfera inerte. Avaliação da actividade anti-cancerígena destes complexos pode ser alcançado através do ensaio MTT.
O ensaio com MTT é um ensaio colorimétrico baseado na viabilidade de redução enzimática da molécula de MTT para formazan, quando ele é exposto a células viáveis. O resultado da redução é uma mudança de cor da molécula de MTT. As medições de absorvância em relação a um controlo de determinar a percentagem de células cancerosas remanescentes viáveis após o seu tratamento com diversas concentrações de um composto de ensaio, que é traduzido para a actividade anti-cancerígena composto e os seus valores de IC 50. O MTT é amplamente comum em estudos de citotoxicidade devido à sua precisão, rapidez e simplicidade relativa.
Aqui nós preenviado um protocolo detalhado para a síntese de medicamentos à base de ar de metal sensível e de medições de viabilidade de células, incluindo a preparação de placas celulares, a incubação dos compostos com as células, medições de viabilidade usando o ensaio de MTT, e determinação dos valores de IC 50.
Introdução
A quimioterapia ainda é um dos principais cursos de tratamentos utilizados na clínica para várias doenças cancerosas, e, assim, grande quantidade de pesquisa é conduzida em todo o mundo com o objetivo de desenvolver novas e melhores drogas anticâncer. Tais estudos principalmente começar no nível químico, com a concepção e preparação de compostos, seguido de avaliação biológica das propriedades citotóxicas in vitro. A viabilidade celular pode ser avaliada por vários ensaios que fornecem informações sobre a actividade celular 1-2.
A cisplatina é um exemplo de um complexo de platina que é largamente utilizado como um fármaco quimioterapêutico, que é considerado um tratamento eficaz principalmente para testiculares e ovarianos cancros 3-4. No entanto, a sua gama de atividade estreito e efeitos colaterais graves desencadear estudos de outros complexos de metais de transição potente 5-8. Entre outros, de titânio (IV) e vanádio (V) os complexos apresentaram resultados promissores de actividade elevada e reduzidatoxicidade 9-16. Ti (IV) foram os primeiros a entrar em ensaios clínicos após a cisplatina, devido a essas propriedades, no entanto, eles não conseguiram os ensaios devido a dificuldades de formulação e instabilidade hidrolítica. Há, portanto, uma necessidade atual para desenvolver melhores derivados destes complexos metálicos que podem combinar alta atividade anticâncer com resistência à água 15,17-21.
Um desafio para a preparação de Ti (IV) e V (V) refere-se a complexos de a instabilidade hidrolítica dos reagentes precursores e, portanto, a atmosfera inerte deve ser mantida. A preparação de Ti (IV) e V (V) os compostos é realizado sob N 2 ou Ar condições em uma caixa de luvas ou usando técnicas de linha Schlenk.
Um método comum para a avaliação da actividade anti-cancro baseia-se em MTT (3 - (4,5-dimetiltiazolil) -2,5-) ensaio. Este ensaio é um ensaio colorimétrico de viabilidade que foi apresentada, em 1983, por Mosmann22. É extremamente bem estudada e caracterizada, e considera-se altamente eficiente quando se avalia a eficácia de novos compostos citotóxicos devido à sua precisão, rapidez, e sua capacidade de ser aplicada em diversas linhas celulares. Este ensaio de viabilidade é baseado na mudança de cor da molécula MTT quando ele é exposto a células viáveis. A medição da absorbância, a qual é proporcional ao número de células viáveis e, em comparação com controlos não tratados, permite a avaliação da capacidade de inibição do crescimento celular do composto testado.
O teste colorimétrico de MTT é conduzido num formato de placa de 96 poços 23. As células podem exigir pré-incubação dos poços antes da adição da droga testada. Os tempos de pré-incubação pode variar de 0-24 horas de acordo com as propriedades da linha celular. As células são normalmente expostas ao fármaco durante 24-96 horas, dependendo da actividade do fármaco. Solução de MTT é então adicionado às células tratadas, em que o gritoow MTT é reduzido a formazano púrpura por uma variedade de enzimas mitocondriais e citosólicas que são operacionais em células viáveis (Figura 1) 24. A molécula de MTT não é reduzido por células mortas e células vermelhas do sangue (células metabolicamente inactivas), as células de baço (células em repouso) e linfócitos estimulados com concanavalina A (células activadas) 22. Depois de 3-4 horas de incubação com MTT os precipitados formazana. A formação do formazano começa após 0,5 horas de incubação, mas para melhores resultados, é melhor para expor as células à MTT durante pelo menos 3 h 22. Consequentemente, o meio de cultura é removido e o formazano é dissolvido num solvente orgânico, de preferência isopropanol, 25, apesar de DMSO também pode ser usado 26. A eliminação do meio é crucial para a obtenção de resultados precisos desde vermelho de fenol, que é amplamente comum em meio de crescimento, e precipitando proteínas pode interferir com a medição de absorção 25. Quando a formasolução zan atinge homogénea, a absorvância da solução é medida utilizando um espectrofotómetro leitor de microplacas. A absorvância a 550 nm é directamente proporcional ao número de células na gama de 200-50,000 células por cavidade, e, assim, quantidades muito pequenas de células pode ser detectado 22. A absorvância indica a quantidade de células viáveis que permaneceram após o tratamento com a droga, e é comparada com a absorvância de células de controle que não foram expostas ao fármaco. Análise dos resultados por software apropriado proporciona a IC50 (concentração de inibição, 50%) e os seus valores com base em erros estatísticos de várias repetições da medição.
O MTT é amplamente comum em estudos de citotoxicidade para a triagem de novos compostos anti-cancerígenos, devido a sua precisão e simplicidade relativa. No entanto, quando se utiliza o ensaio de MTT, que é dependia da reacção enzimática, deve-se considerar que os vários inibidores de enzimas pode afectar a redução de MTT umd levar a resultados falsos 27. Além disso, o ensaio de MTT não fornece qualquer informação sobre o mecanismo molecular da actividade citotóxica do fármaco 2.
Protocolo
- Preparação do V (V) complexo (Figura 2); 18 conduta passos 1,1-1,4 em um porta-luvas, se um porta-luvas não está disponível, pule para a alternativa passos 2 (2,1-2,6).
- Dissolve-se 0,42 mmol de os ligandos H 2 L de THF seco e adiciona a uma solução em agitação de quantidades equivalentes de VO (OiPr) 3 em THF.
- Agita-se a mistura de reacção à temperatura ambiente durante 15 min e remover os voláteis sob vácuo.
- Adicionar hexano frio e removê-lo sob vácuo. Um pó de cor púrpura escura deve ser obtido com um rendimento quantitativo.
- Pesar 8 mg do composto obtido em um frasco de Eppendorf. Ir para o passo 3.
- Prepare o complexo V (V) utilizando uma linha Schlenk.
- Dissolve-se 0,42 mmol do ligando com H 2 L de THF seco, num balão de Schlenk seco com uma tampa de septo, se ligar a uma linha de Schlenk e aplicar ambientes de vácuo / gás inerte (N2 ou Ar) alternadas, recomenda-se a aplicação de três such rodadas e esperar 2-5 minutos sobre os estágios de vácuo.
- Adicionar THF seco através de uma seringa através da tampa de septo.
- Adicionar quantidades equivalentes de VO (OiPr) 3 em uma solução de THF, o qual tinha sido preparado de modo semelhante ligando um balão de Schlenk seco adequado para a linha, a aplicação de um ambiente inerte e adicionando os reagentes através de uma seringa a partir da solução de vanádio ao do o ligando.
- Agita-se a mistura de reacção à temperatura ambiente durante 15 min e remover os voláteis sob vácuo e, se houver um problema de produtos instáveis, executar tipo Schlenk de destilação dos produtos voláteis sob uma atmosfera inerte; utilizar o fluxo de gás inerte, para fixar o material de vidro necessário que tinha sido pré-seca .
- Adicionar hexano frio e removê-lo sob vácuo. Um pó de cor púrpura escura deve ser obtido com um rendimento quantitativo.
- Pesar 8 mg do composto obtido em um frasco de Eppendorf.
- Preparação do Ti (IV) (Figura 2), sendo que 28 conduta passos 3,1-3,3 em um porta-luvas, se um porta-luvas não está disponível, ajuste as etapas alternativas discutidas para o análogo de vanádio (passo 2) que empregam uma linha Schlenk vez.
- Dissolve-se 0,35 mmol do ligando com H 2 L de THF seco e adiciona a uma solução em agitação de quantidades equivalentes de Ti (O i Pr) 4 em THF.
- Agita-se a mistura de reacção à temperatura ambiente durante 2 horas. Remover os voláteis sob vácuo para se obter um produto amarelo com um rendimento quantitativo.
- Pesar 8 mg do composto obtido em Eppendorf frasco.
- Preparação de células HT-29 placa de 96 poços
- Cultura células HT-29 em de 75 cm 2 balão com meio RPMI-1640 que contém 1% de penicilina / estreptomicina antibióticos, 1% de L-glutamina, e 10% de soro fetal bovino (FBS), a 37 ° C com 5% de CO 2 .
- Remova o meio quando as células HT-29 a confluência máxima (90-100%, a cada 3-4 dias sem subcultura). Lava-se com 1 mlsolução de tripsina (0,25%) / EDTA (0,05%) e removê-lo.
- Adicionar 1 ml de tripsina (0,25%) de solução / EDTA (0,05%) e incubar durante 5 min.
- Retire as células HT-29 do frasco e adicionar 10 ml do meio de desativar a atividade de tripsina. Transferir 5 ml da mistura de células para um tubo.
- Usar uma pipeta para transferir algumas gotas da mistura de células em câmara de contador. A câmara de contador inclui 5 x 5 quadrados.
- Contar as células em 5 quadrados representativos utilizando um microscópio: as quatro quadrados nos cantos e aquele que está no meio.
- Calcule a quantidade estimada de células presentes. Soma as células nos 5 quadrados representativos e dividir por 20.
- Divida 0,6 pelo resultado do passo 4.7. O número recebido é a quantidade de mistura de células é necessária por placa. Este cálculo refere-se a uma placa que contém 0,6 x 10 6 células (9000 células por poço).
- Use pipeta para transferir a quantidade de mistura de células necessária por pfinal (como calculado na secção 4.8) e adicionar 13,2 mL de meio (200 ul por poço × 66 poços).
- Adicionar a mistura a placa de 96 poços com uma pipeta de 11 canais (200 ul por poço, 6 linhas, 66 cavidades no total). Um bem de cada linha deve permanecer vazio para o controle em branco.
- Incubar a placa a 37 ° C com 5% de CO 2 durante 24 horas para permitir que as células se fixem à placa.
- A inserção dos compostos
- Adicionar 200 mL (ou quantidade diferente de acordo com o intervalo de concentração desejada) de THF seco, a 8 mg de cada composto pesados, como descrito no passo 1.4 (ou 2,6) ou 3,3. Pesar 8 mg do ligando H 2 L, também.
- Diluir cada solução composto ainda pela adição de 60 mL de THF em 9 tubos Eppendorf diferentes.
- Com uma pipeta de 60 uL da mistura na secção 5.1 para o primeiro frasco de Eppendorf, e ressuspender a transferência de 60 uL para a próxima frasco, e assim por diante até 10 concentrações diferentes são obtained (incluindo a mistura de pai na seção 5.1).
- Dilui-se 20 ul de cada concentração em THF com 180 ul de meio.
- Prepara-se uma solução de controlo com apenas THF, 20 mL de THF, com 180 mL de meio em cada medição.
- Adicionar 10 ml da solução resultante (incluindo o controlo de THF), a cada poço, que já contém 200 ul da solução de células no meio acima referido para dar as concentrações finais do composto de até 200 mg / L (a gama de concentração pode ser alterado de acordo com a atividade composto).
- Pode observar alguma precipitação na maior concentração aplicada, dependendo da solubilidade do composto.
- Repetir a cada medição das 3x compostos (3 linhas na placa do mesmo composto); cada linha contém: células tratadas com o composto em 10 concentrações diferentes, uma bem contendo células tratadas apenas com dissolvente para o controlo e um poço sem células para branco controle.
- Incubar a placa carregada durante 3 dias a 37 ° C em 5% de CO2.
- Medição da citotoxicidade utilizando o teste de MTT
- Preparar a solução de MTT através da adição de 1 g de MTT em pó a uma solução de meio RPMI-1640 de 200 ml, sem vermelho de fenol. A solução-mãe pode ser dividido para tubos de 15 mL e armazenado em -20 ° C.
- Adicionar 20 ul de solução de MTT a cada poço utilizando uma pipeta de 11 canais (excepto aos poços de controlo em branco, sem as células do passo 4.10), e incuba-se a placa durante 3 horas adicionais.
- Remover a solução de meio de cada poço.
- Adicionar 200 mL de isopropanol a cada cavidade para dissolver o formazano. Agita-se a placa, durante 0,5 horas até que a homogeneidade é alcançada.
- Medir a absorvância a 550 nm para 200 ul da solução acima referida por um espectrofotómetro leitor de microplacas.
- Repita cada medida (que inclui 3 repetições, veja o passo 5.8) em 3 dias diferentes.
- Calcule tele percentagem de viabilidade celular, deduzindo o valor de absorvência de controlo em branco a partir do valor medido, dividindo o resultado pela absorvância do valor de controlo de solvente THF e multiplicando por 100%.
- Calcular os valores de IC50 utilizando o software GraphPad Prism (ou equivalente).
- O IC 50 é reportado a média de todos os valores de IC 50 recolhidos em, pelo menos, três dias diferentes, e o valor de erro é o desvio padrão.
Resultados
Os complexos foram elaboradas com base em procedimentos estabelecidos 18,28 e sua pureza pode ser avaliada por análise de RMN e elementar.
Os dados recebidos a partir do ensaio de MTT é analisada para avaliar a citotoxicidade do composto 18,21. Em primeiro lugar, a subtracção do valor de absorvência de controlo em branco a partir de todos os outros valores é realizada. Em segundo lugar, o valor de controlo de solvente THF é definida como 100% de viabilidade, como não foi adicionado o composto inibidor do crescimento. Todos os outros valores são transformados em percentagem de viabilidade de acordo com o controlo. As concentrações aplicadas e a percentagem de viabilidade calculada relativa são então inseridos no software GraphPad Prism (ou equivalente) para determinar os valores de IC 50 com base na regressão não linear de inclinação variável (quatro parâmetros) modelo (Figura 4, Tabela 1) 29.
As medições devem ser realizadas em um intervalo dede concentração que irão produzir um gráfico que mostra uma distribuição uniforme ponto: pelo menos três pontos de cada planalto e três pontos para definir a inclinação (Figura 3, o gráfico A). Medições insuficientes em concentrações elevadas ou baixas concentrações (Figura 3, gráfico B) vai prejudicar o ajuste de regressão não linear da curva é necessária para a determinação dos valores de IC 50, e como resultado, a diminuir a sua precisão.
Os valores de IC50 relativos, tal como determinado pelo ajuste de regressão não linear 29, correspondem às concentrações que conduzem a 50% de inibição do crescimento de células possível pelo composto testado, que é calculado como o ponto médio entre o valor máximo e mínimo de viabilidade celular medida (não necessariamente de 100% e 0%, respectivamente, ver Figura 3, gráfico C, um). Por exemplo, se um composto inibe apenas 60% do crescimento celular em relação ao controlo (0% e em baixa concentraçãos), a sua relação de IC50 representa a concentração que conduz a 30% de inibição em relação ao controlo. Os valores de erro deve refletir o desvio dos resultados obtidos para as diferentes repetições do valor médio IC50 informou, tomadas como as doenças sexualmente transmissíveis. Além disso, os valores de máxima inibição de crescimento celular (%) deve ser indicado, conforme calculado subtraindo de 100% a viabilidade mínimo medido.
Uma análise alternativa pode incluir a determinação dos absolutos IC 50 valores. Estas correspondem às concentrações que conduzem a 50% de inibição do crescimento celular em relação ao controlo de 100%, independentemente da viabilidade celular máxima e mínima medidos. Estes valores também podem ser obtidos por um modelo de regressão não-linear. Como estes valores são absolutos, relatando os valores de inibição do crescimento de células máximas é opcional. Como representado na Figura 3, gráfico C, um composto pode ter uma actividade relativamente baixa em termos de máximo de células gpropriedades de inibição de rescimento (curva A), e ainda apresentam um valor de IC 50 relativa que é inferior não só à sua uma absoluta, mas também do que o de um composto que atinge perto de 100% de inibição de crescimento (curva b). É, portanto, extremamente importante para apresentar a curva de, juntamente com os relatados valores de IC 50 de qualquer tipo.
Quando inspeccionar os resultados das experiências descritas no protocolo (Figura 4, Tabela 1), fica claro que a cisplatina e complexos LTi (O i Pr) 2 e VO (O i Pr) são altamente activos. Também é notável que o mais perto o valor máximo de inibição de um determinado composto é de 100%, o mais perto do valor relativo IC 50 é um absoluto. Quando se comparam os valores de IC 50 entre os diferentes compostos, a (IV) complexo Ti tem o maior citotoxicidade e os seus valores de IC50 são inferiores às da cisplatina e o V (V) complexo. No entanto, a free exposições ligante atividade reduzida significativamente, uma vez que após a adição do ligante em diferentes concentrações, a viabilidade celular não cair de forma tão significativa como faz para os seus complexos. Isto assegura que a elevada actividade anti-cancro dos complexos depende dos centros metálicos. Uma vez que o ligando livre apenas atinge 50% de inibição do crescimento celular, um valor absoluto de IC50 não pode ser derivada com precisão. Na verdade, um valor relativo, também não poderia ter sido adequadamente calculados pelo software devido à atividade menor e correspondentes valores elevados de erro. No entanto, é evidente que, mesmo se um valor relativo IC 50 pode ter sido derivado de H 2 L, não teria uma actividade apreciável reflectida, tornando assim o relatório do valor da inibição máxima, juntamente com os valores de IC50 relativos (e a representação da curva) essencial.
| IC Relativa 50 (iM) | Absoluto de IC 50 (uM) | A inibição máxima (%) | |
| LVO (O i Pr) | 13 ± 3 | 19 ± 8 | 81% |
| LTi (O i Pr) 2 | 3 ± 1 | 5 ± 3 | 87% |
| H 2 L | - | - | 47% |
| Cisplatina | 14 ± 5 | 13 ± 6 | 91% |
Tabela 1. Resultados de citotoxicidade para os compostos testados: relativa e absoluta de IC 50 (M) e os valores de inibição do crescimento celular para lograr células HT-29, após o período de incubação de três dias com o V (V) LVO complexa (O i Pr), Ti (IV ) complexo LTi (O i Pr) 2, o ligando livre H 2 L e cisplatina; 18,21 valores de IC50 são apresentados como a média de pelo l a leste, três vezes três repetições com valores de erro como as doenças sexualmente transmissíveis.

Figura 1. A redução do MTT por enzimas mitocondriais e citosólicas de formazan. Clique aqui para ver maior figura .
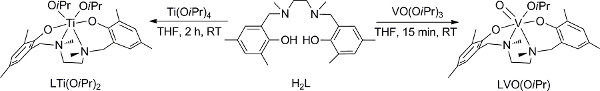
Figura 2. Preparação de V (V) e Ti (IV) 18,28. Clique aqui para ver maior figura .
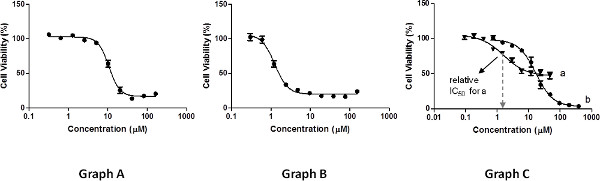
Figura 3. Exemplos de resultados de medições de viabilidade celular. Clique aqui para ver maior figura .

Figura 4. Dose curvas de citotoxicidade dependente para os compostos testados: Dependência de HT-29, a viabilidade das células na concentração administrada de V (V) LVO complexa (O i Pr) (azul), o Ti (IV) LTi (OiPr) 2 ( vermelho), o ligando livre H 2 L (preto) e cisplatina (verde), após um período de incubação de três dias, como obtained de pelo menos três vezes três repetições como refletido pelo erro valoriza 18,21.
Discussão
O método descrito neste manuscrito combina a síntese química, com ensaio de viabilidade de células biológicas. Tal como acontece com todos os métodos biológicos em matéria de células viáveis, é fundamental para o trabalho em uma capa laminar, e manter condições estéreis, incluindo o uso de solventes orgânicos estéreis. Além disso, a preparação e armazenamento de medicamentos à base de metal hidroliticamente instável deve ser realizado sob condições inertes, para o qual devem ser utilizadas técnicas de caixa de luvas ou de linha de Schlenk.
A escolha da técnica para funcionar em ambiente inerte é principalmente dependente da disponibilidade de uma caixa de luvas. Se estiver disponível, todas as sínteses que requerem condições de temperatura ambiente são extremamente conveniente para realizar nele. As sínteses que necessitam de aquecimento são normalmente retirado da caixa num balão de Schlenk e está ligado à linha de Schlenk. Quando uma caixa de luvas não está disponível, todas as manipulações podem ser efectuadas com material de vidro cuidadosamente seleccionados com um Schlenk linha, durante a utilização do vácuo / gás inerte (N2 ou Ar) manipulações para manter a atmosfera seca.
No processo de avaliação da citotoxicidade, é necessário analisar a aparência das células ao longo da experiência. Antes do início da experiência, o meio de crescimento de células aderentes saudáveis deve ser claro. A cultura contaminado aparecerá turva. Além disso, depois da incubação das células com tripsina-EDTA, as células devem separar o balão e mergulhar no meio. Se a maioria das células permanecem aderentes ao frasco, o frasco deve ser ainda incubadas durante vários minutos.
O comprimento de uma tal medida é de cinco dias. Nós permitir um dia para as células aderentes para prender e para aclimatar a placa de células, e três dias para a incubação das células com as drogas testadas, a fim de permitir que as células se proceder à apoptose. Um dia adicional é necessário para a incubação com MTT. Todo esse MeasureMent deve ser repetido pelo menos mais duas vezes em dias diferentes a partir de diferentes culturas de células, a fim de que as medições para ser independente.
A técnica, tal como aqui descrito é aplicado sobre os tipos de células aderentes. Para aplicar este método em tipos de células não aderentes devem ser feitos vários ajustes. Já não é necessário a dedicar um dia para as células se fixem e se aclimatarem à placa de células, e, por conseguinte, a preparação da chapa e o suplemento das drogas testadas pode ser realizada no mesmo dia. Além disso, na etapa final da medição, imediatamente após a incubação das células com MTT, a solução deve ser centrifugado antes da remoção do meio e adição de isopropanol.
Também é possível substituir a utilização de MTT como o marcador de células vitais com um ensaio alternativo para a inibição do crescimento celular, em que o tempo de incubação das células com o marcador é mais curto do que o tchapéu com MTT 30. Outro fator a considerar ao escolher o marcador é o possível mecanismo de ação do medicamento testado 27. O ensaio de MTT fornece informação sobre a actividade metabólica mitocôndrias, e uma vez que está dependente de reacções enzimáticas, que pode ser influenciado por inibidores da enzima.
A combinação da preparação de medicamentos com a avaliação da sua citotoxicidade por meio de um ensaio MTT representa um método eficaz para o desenvolvimento de novos fármacos citotóxicos à base de metal. No entanto, este método não fornece qualquer informação sobre o mecanismo de morte celular, a fase do ciclo celular que é afectado pela droga e as suas possíveis alvos biológicos. Para estes fins, os métodos adicionais, tais como o iodeto de propídio (PI) e Ensaio de Captação de análise do ciclo celular deve ser realizada 31.
Divulgações
Os autores declaram que não têm interesses financeiros concorrentes.
Agradecimentos
O financiamento foi recebido do Conselho Europeu de Investigação no âmbito do Sétimo Programa-Quadro da Comunidade Europeia (FP7/2007-2013) / ERC acordo Grant não [239603]
Materiais
| Name | Company | Catalog Number | Comments |
| Reagent/Material | |||
| Fetal bovine serum (FBS) | Biological Industries | 04-007-1A | |
| Hexane AR | Gadot | 830122313 | Dried using a solvent drying system |
| HT-29 cell line | ATCC | HTB-38 | |
| Isopropanol AR | Gadot | 830111370 | |
| L-glutamine | Biological Industries | 03-020-1B | |
| MTT | Sigma-Aldrich | M5655-1G | |
| Penicillin/streptomycin antibiotics | Biological Industries | 03-031-1B | |
| RPMI-1640 with phenol red with L-glutamine | Sigma-Aldrich | R8758 | |
| RPMI without phenol red | Biological Industries | 01-103-1A | |
| Tetrahydrofuran (THF) AR | Gadot | 830156391 | dried using a solvent drying system |
| Ti(OiPr)4 | Sigma-Aldrich | 205273-500ML | moisture sensitive |
| Trypsin/EDTA | Biological Industries | 03-052-1B | |
| VO(OiPr)3 | Sigma-Aldrich | 404926-10G | moisture sensitive |
| Equipment | |||
| 12-channel pipette 30-300 μl | Thermo Scientific | ||
| 12-channel pipette 5-50 μl | Finnpipette | ||
| 75 cm2 flask | NUNC | 156472 | |
| 96-well plate with lid (flat bottom) | NUNC | 167008 | |
| CO2 Incubator | Binder | APT.line C150 | |
| Counter chamber | Marienfeld-Superior | 650030 | |
| Eppendorf vial | KARTELL | ||
| Glove box | M. Braun | ||
| Laminar flow hood | ADS LAMINAIRE | OPTIMALE 12 | |
| Microplate reader spectrophotometer | Bio-Tek | El-800 | |
| Microscope | Nikon | Eclipse TS100 | |
| Pipette 20-200 μl | Finnpipette | ||
| Pipette 5-50 μl | Finnpipette | ||
Referências
- Niles, A. L., Moravec, R. A., Riss, T. L. Update on in vitro cytotoxicity assays for drug development. Expert Opinion on Drug Discovery. 3, 655-669 (2008).
- Hatok, J., et al. In vitro assays for the evaluation of drug resistance in tumor cells. Clinical and Experimental Medicine. 9, 1-7 (2009).
- Wang, D., Lippard, S. J. Cellular processing of platinum anticancer drugs. Nature Reviews Drug Discovery. 4, 307-320 (2005).
- Muggia, F. Platinum compounds 30 years after the introduction of cisplatin: Implications for the treatment of ovarian cancer. Gynecologic Oncology. 112, 275-281 (2009).
- Bruijnincx, P. C., Sadler, P. J. New trends for metal complexes with anticancer activity. Current Opinion in Chemical Biology. 12, 197-206 (2008).
- Ott, I., Gust, R. Non platinum metal complexes as anti-cancer drugs. Archiv der Pharmazie (Weinheim. 340, 117-126 (2007).
- Desoize, B. Metals and metal compounds in cancer treatment. Anticancer Research. 24, 1529-1544 (2004).
- Jakupec, M. A., Galanski, M., Arion, V. B., Hartinger, C. G., Keppler, B. K. Antitumour metal compounds: more than theme and variations. Dalton Transactions. , 183-194 (2008).
- Meléndez, E. Titanium complexes in cancer treatment. Critical Reviews in Oncology/Hematology. 42, 309-315 (2002).
- Evangelou, A. M. Vanadium in cancer treatment. Critical Reviews in Oncology/Hematology. 42, 249-265 (2002).
- Djordjevic, C. Antitumor activity of vanadium compounds. Metal ions in biological systems. 31, 595-616 (1995).
- Caruso, F., Rossi, M., Pettinari, C. Anticancer titanium agents. Expert Opinion on Therapeutic Patents. 11, 969-979 (2001).
- Caruso, F., Rossi, M. Antitumor titanium compounds. Mini-Review in Medicinal Chemistry. 4, 49-60 (2004).
- Kostova, I. Titanium and vanadium complexes as anticancer agents. Anti-Cancer Agents in Medicinal Chemistry. 9, 827-842 (2009).
- Tshuva, E. Y., Ashenhurst, J. A. Cytotoxic Titanium(IV) Complexes: Renaissance. European Journal of Inorganic Chemistry. , 2203-2218 (2009).
- Buettner, K. M., Valentine, A. M. Bioinorganic Chemistry of Titanium. Chemical Reviews. 112, 1863-1881 (2012).
- Meker, S., Margulis-Goshen, K., Weiss, E., Magdassi, S., Tshuva, E. Y. High antitumor activity of highly resistant salan-titanium(IV) complexes in nanoparticles: an identified active species. Angewandte Chemie International Edition in English. 51, 10515-10517 (2012).
- Reytman, L., Braitbard, O., Tshuva, E. Y. Highly cytotoxic vanadium(V) complexes of salan ligands; insights on the role of hydrolysis. Dalton Transactions. 41, 5241-5247 (2012).
- Tzubery, A., Tshuva, E. Y. Cytotoxicity and Hydrolysis of trans-Ti(IV) Complexes of Salen Ligands: Structure-Activity Relationship Studies. Inorganic Chemistry. 51, 1796-1804 (2012).
- Tshuva, E. Y., Peri, D. Modern cytotoxic titanium(IV) complexes; Insights on the enigmatic involvement of hydrolysis. Coordination Chemistry Reviews. 253, 2098-2115 (2009).
- Shavit, M., Peri, D., Manna, C. M., Alexander, J. S., Tshuva, E. Y. Active cytotoxic reagents based on non-metallocene non-diketonato well-defined C-2-symmetrical titanium complexes of tetradentate bis(phenolato) ligands. Journal of the American Chemical Society. 129, 12098-12099 (2007).
- Mosmann, T. Rapid Colorimetric Assay for Cellular Growth and Survival - Application to Proliferation and Cyto-Toxicity Assays. Journal of Immunological Methods. 65 (83), 55-63 (1983).
- Ahmadian, S., Barar, J., Saei, A. A., Fakhree, M. A. A., Omidi, Y. Cellular Toxicity of Nanogenomedicine in MCF-7 Cell Line: MTT assay. Journal of Visualized Experiments. (26), e1191(2009).
- Gonzalez, R. J., Tarloff, J. B. Evaluation of hepatic subcellular fractions for Alamar blue and MTT reductase activity. Toxicology in Vitro. 15, 257-259 (2001).
- Denizot, F., Lang, R. Rapid Colorimetric Assay for Cell-Growth and Survival - Modifications to the Tetrazolium Dye Procedure Giving Improved Sensitivity and Reliability. Journal of Immunological Methods. 89, 271-277 (1986).
- Alley, M. C., et al. Feasibility of drug screening with panels of human tumor cell lines using a microculture tetrazolium assay. Cancer Research. 48, 589-601 (1988).
- Weyermann, J., Lochmann, D., Zimmer, A. A practical note on the use of cytotoxicity assays. International Journal of Pharmaceutics. 288, 369-376 (2005).
- Chmura, A. J., et al. Group 4 complexes with aminebisphenolate ligands and their application for the ring opening polymerization of cyclic esters. Macromolecules. 39, 7250-7257 (2006).
- Sebaugh, J. L. Guidelines for accurate EC50/IC50 estimation. Pharmaceutical Statistics. 10, 128-134 (2011).
- Yung, W. K. A. In vitro Chemosensitivity Testing and its Clinical-Application in Human Gliomas. Neurosurgical Review. 12, 197-203 (1989).
- McCarthy, N. J., Evan, G. I. Current Topics in Developmental Biology. 36, 259-278 (1997).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados