Method Article
MTT의 분석에 의해 합성 및 세포 독성 평가 : 항암 금속 합성물
요약
공기에 민감한 티탄 및 바나듐 항암제의 합성 방법은 MTT 분석에 의해 인간의 암 세포주를 향해 자신의 세포 상해 활성의 평가와 함께 설명한다.
초록
티타늄 (IV) 및 바나듐 (V) 착물은 매우 강력한 항암제이다. 자신의 합성 문제는 자신의 가수 분해 불안정을 의미하므로 자신의 준비는 불활성 분위기 하에서 수행되어야한다. 이러한 복합체의 항암 활성의 평가는 MTT 분석에 의해 달성 될 수있다.
MTT 분석은 그것이 가능한 세포에 노출되었을 때 MTT 포마 잔하는 분자의 환원 효소에 기반 비색 생존력 분석법이다. 환원의 결과는 MTT 분자의 색 변화이다. 컨트롤을 기준으로 흡광도 측정은 복합 항암 활성 및 IC 50 값으로 변환하는 테스트 화합물의 농도 변화와의 다음과 같은 치료 가능한 암 세포를 나머지의 비율을 결정합니다. MTT 분석은 정확성, 신속성, 그리고 상대적으로 단순에 의한 세포 독성 연구에서 널리 일반적입니다.
여기에서 우리는 사전셀 플레이트의 제조, 세포와 화합물의 배양 등 공기에 민감한 금속 기반 약물 및 세포 생존 능력 측정의 합성에 대한 상세한 프로토콜을 전송, MTT 분석하고 IC 50 값의 판정을 사용하여 생존력을 측정.
서문
화학 요법은 여전히 다양한 암 질환의 임상 치료에 사용의 주된 과정 중 하나이며, 따라서 연구의 방대한 양의 새롭고 개선 된 항암제를 개발하는 것을 목표로 세계적으로 수행된다. 이러한 연구는 주로 시험 관내 세포 독성 특성의 생물학적 평가에이어서 화합물의 설계 및 제조와, 화학적 레벨에서 시작한다. 세포 생존 능력은 세포 활동 1-2에 대한 정보를 제공하는 다양한 분석에 의해 평가 될 수있다.
시스플라틴은 광범위 정소 및 난소 암 3-4 주로 효율적인 치료 간주 화학 치료 약물로 사용되는 백금 착물의 예이다. 그러나, 좁은 활성 범위 및 심각한 부작용은 다른 유력한 전이 금속 착체 5-8의 연구 결과를 발생시킨다. 다른 사람의 사이에서, 티타늄 (IV) 및 바나듐 (V) 단지는 높은 활동의 유망한 결과를 보여 주었다 감소독성 9-16. 티타늄 (IV) 컴플렉스 때문에 이러한 속성에 시스플라틴 후 임상 시험을 입력하는 첫번째이었다, 그러나, 그들은 인해 배합 어려움과 가수 불안정 시험을 실패했습니다. 내수성 15,17-21 높은 항암 활성을 결합 할 수있는 금속 착체의 개선 된 유도체를 개발하기 위해 현재 필요하므로있다.
티타늄 (IV) 및 V의 제조에 도전 (V) 착물 전구체 시약의 가수 불안정성을 의미하므로, 불활성 분위기가 유지되어야한다. 티타늄 (IV) 및 V (V) 화합물의 제조는 글로브 박스 또는 쉬 렝크 라인 기술을 사용하여 N 2 또는 아르곤 조건 하에서 수행된다.
분석 - 항암 활성의 평가를위한 하나의 일반적인 방법은 MTT ((4,5 - dimethylthiazolyl) -2,5 - 디 페닐 테트라 졸륨 브로마이드 3)에 기초한다. 이 분석은 Mosmann에 의해 1983 년에 발표 된 비색 생존 분석입니다22. 그것은 매우 잘 연구되고 특징으로 인해 정밀도, 신속성 및 세포주의 다양한 적용되는 그 기능에 새로운 세포 독성 화합물의 효과를 평가할 때, 그것은 매우 효율적으로 간주된다. 이 생존력 분석은 그것이 가능한 세포에 노출 MTT 분자의 색상 변화에 근거한다. 생존 세포의 수에 비례하여 흡광도, 및 미처리 컨트롤과 비교하여 측정은, 시험 된 화합물의 세포 성장 억제 능력의 평가를 가능하게한다.
MTT 비색 분석은 96 - 웰 플레이트 포맷 (23)에서 수행된다. 세포는 시험 약물을 추가하기 전에 우물에서 예비 배양을 필요로 할 수있다. 예비 배양 시간은 세포주의 특성에 따라 0-24 시간과 다를 수 있습니다. 셀은 일반적으로 약물 활동에 따라 24-96 시간 동안 약물에 노출된다. MTT 용액을 엘 처리 된 세포에 첨가된다오우 MTT (그림 1) (24) 실행 가능한 세포에서 운영되어 미토콘드리아와 세포질 다양한 효소에 의해 보라색 포르 마잔로 감소된다. MTT 분자는 죽은 세포 또는 적혈구 (대사 비활성 셀), 비장 세포 (휴식 세포)와 콘 카나 발린 A를 자극 림프구 (활성화 된 세포) (22)에 의해 감소되지 않습니다. MTT 포마 침전물과 배양 3 ~ 4 시간 후. 포르 마잔의 형성은 배양 0.5 시간 후 시작하지만, 최적의 결과를 위해 적어도 3 시간 (22) MTT에 세포를 노출하는 것이 가장 좋습니다. 따라서, 성장 배지를 제거하고 DMSO도 26을 사용할 수 있지만 포르 마잔은, 유기 용매, 바람직하게는 이소프로판올 (25)에 용해된다. 매체의 제거는 성장 배지에서 널리 일반적인 페놀 레드, 이후 정확한 결과를 달성하고, 단백질은 흡광도 측정 (25)을 방해 할 수 석출 위해 결정적이다. 때 견적잔 용액 용액의 흡광도를 마이크로 플레이트 리더 분광 광도계를 사용하여 측정되고, 균질 도달한다. 550 nm에서의 흡광도는 웰 당 200-50,000 셀 범위의 셀의 개수에 비례하고, 따라서 셀의 매우 작은 양 (22)을 검출 할 수있다. 흡광도는 약물 치료 후에 남아 생존 세포의 양을 나타내며, 약물에 노출되지 않은 대조군 세포의 흡광도와 비교된다. 적절한 소프트웨어에 의해 결과의 분석은 IC 50 (억제 농도, 50 %) 제공 값과 통계적 오차 측정의 몇몇 반복에 따라.
MTT 분석은 정확성과 단순함으로 인해 새로운 항암 화합물을 스크리닝 세포 독성 연구에서 널리 일반적입니다. 효소 반응에 의존 MTT 분석법을 사용한 경우에는, 하나는 각종 효소 저해제는 MTT의 감소에 영향을 미칠 수 있다는 것을 참고해야false 결과 27로 이어질 거라고. 또, MTT 분석법은 약물 2의 세포 상해 활성의 기전에 대한 어떠한 정보도 제공하지 않는다.
프로토콜
- V의 제조 (V) 복잡한 (그림 2), 18 행위는 글로브 박스에 1.1 ~ 1.4 단계, 글로브 박스를 사용할 수없는 경우, 대체로 이동 2 (2.1-2.6)를 반복합니다.
- 리간드의 0.42 밀리몰 건조 THF에있는 H 2 L 녹여 THF에서 VO의 동등한 양의 교반 용액 (O 나는 잠) 3에 추가합니다.
- 실온에서 15 분간 반응 혼합물을 교반하고, 진공하에 휘발성 물질을 제거한다.
- 차가운 헥산을 추가하고 진공 상태에서 제거합니다. 어두운 자주색 분말을 정량적 수율로 얻을 수 있어야합니다.
- 에펜 도르프 유리 병에서 얻어진 화합물의 8 mg의 무게. 3 단계로 건너 뜁니다.
- 쉬 렌크 줄을 사용하여 V (V) 복합체를 준비합니다.
- 격막 모자와 건조 쉬 렝크 플라스크에 건조 THF의 리간드 H 2 L의 0.42 밀리몰을 녹이고, 쉬 렌크 라인에 부착 진공 / 불활성 가스 (N 2 또는 AR) 환경을 교대로 적용, 그것은 세 가지의를 적용하는 것이 좋습니다라운드를 UCH 진공 단계에 2-5 분을 기다립니다.
- 격막 캡을 주사기를 통해 건조 THF를 추가합니다.
- VO (O 나는 잠)의 상당 금액을 추가 라인에 적절한 건조 쉬 렝크 플라스크를 후킹 불활성 환경을 적용하고의에 바나듐 솔루션에서 주사기를 통해 시약을 추가하여 유사하게 제조 한 THF 용액, 3 리간드.
- 실온에서 15 분간 반응 혼합물을 교반하고, 진공하에 휘발성 물질을 제거; 불안정한 제품의 우려가있는 경우, 불활성 분위기 하에서 휘발 쉴 렌크 분류 증류를 수행; 예비 건조했다 필요한 유리를 부착하기 위하여 불활성 가스의 흐름을 사용 .
- 차가운 헥산을 추가하고 진공 상태에서 제거합니다. 어두운 자주색 분말을 정량적 수율로 얻을 수 있어야합니다.
- 에펜 도르프 유리 병에서 얻어진 화합물의 8 mg의 무게.
- 티타늄의 제조 (IV) 복잡한 (그림 2), 28 행위는 글러브 박스에 3.1-3.3 단계를, 글러브 박스를 사용할 수없는 경우, 대신 쉬 렌크 라인을 사용 바나듐 아날로그 (2 단계)에 대한 논의 대체 단계를 조정합니다.
- 건조 THF의 리간드 H 2 L의 0.35 밀리몰을 녹여 용액에 티 (O 나 홍보) 4의 동등한 양의 교반 솔루션에 추가합니다.
- 실온에서 2 시간 동안 반응 혼합물을 교반 하였다. 정량적 인 수율에 노란색 제품을 제공하기 위해 진공 상태에서 휘발성 물질을 제거합니다.
- 에펜 도르프 유리 병에서 얻어진 화합물의 8 mg의 무게.
- HT-29 세포를 96 - 웰 플레이트의 제조
- 1 % 페니실린 / 스트렙토 마이신 항생제, 1 % L-글루타민, 37 ° C에서 10 % 소 태아 혈청 (FBS), 5 % CO 2를 포함 RPMI-1640 배지와 75cm 2 플라스크에 문화 HT-29 세포 .
- HT-29 세포 (배양하지 않고 모든 3~4일 90~100%) 최대 포화 상태에 도달했을 때 매체를 제거합니다. 1 ㎖로 세척의 트립신 (0.25 %) / EDTA (0.05 %) 용액을 제거합니다.
- 트립신 1 ㎖ (0.25 %) / EDTA (0.05 %) 솔루션을 추가하고 5 분 동안 품어.
- 플라스크에서 HT-29 세포를 분리하고 트립신의 활동을 해제하는 매체의 10 ML을 추가합니다. 튜브에 세포 혼합물의 5 ML을 전송합니다.
- 카운터 챔버 내로 세포 혼합물을 몇 방울을 전송 피펫을 사용한다. 카운터 챔버는 5 × 5 정사각형을 포함한다.
- 모서리에 4 개의 사각형과 중간에 하나를 현미경을 사용하여 5 대표 사각형의 세포를 계산합니다.
- 현재 셀의 예상 금액을 계산합니다. 5 대표 사각형의 셀 합계를 20로 나눕니다.
- 단계 4.7의 결과로 0.6을 나눈다. 수신 번호는 접시 당 필요한 세포 혼합물의 금액입니다. 이 계산은 0.6 × 10 6 세포 (물론 당 9,000 세포)를 포함하는 판을 말한다.
- P 당 필요한 세포 혼합액의 양을 전송 피펫을 사용후반 (4.8 절에서 계산 된) 및 매체의 13.2 mL를 넣고 (물론 × 66 웰 당 200 μL).
- 11 채널 피펫 (물론 당 200 μL, 6 라인, 총 66 웰)로 96 - 웰 플레이트에 혼합물을 추가합니다. 각 라인의 한 잘 빈 제어 비어있게해야합니다.
- 세포가 플레이트에 부착 할 수 있도록 24 시간 동안 5 % CO 2와 37 ° C에서 접시를 품어.
- 화합물의 삽입
- 단계 1.4 (또는 2.6) 또는 3.3에 설명 된대로 각 화합물의 8 밀리그램 건조 THF의 (원하는 농도 범위에 따라 또는 다른 금액) 200 μl를 추가 무게. 도 리간드 H 2 L의 8 밀리그램 무게.
- 9 다른 에펜 도르프 튜브에 THF 60 μl를 추가하여 더욱 각 화합물 용액을 희석.
- 10 개의 서로 다른 농도가 O 때까지에 대한 최초의 에펜 도르프 유리 병,에 resuspend하고 다음 유리 병에 전송 60 μl를, 그리고에 5.1 절에있는 혼합물의 피펫 60 μL로 이동(5.1 절에서 부모의 혼합물을 포함한다) btained.
- 매체의 180 μL와 THF의 각 농도의 20 μl를 희석.
- 만 THF와 제어 솔루션을 준비, 각 측정 매체의 180 μL와 THF 20 ㎕.
- 이미 농도 범위는 수 (최대 200 ㎎ / L의 화합물의 최종 농도를 제공하기 위해 중간에있는 세포의 상기 용액 200 μl를 포함 각 웰에, (THF 제어 포함), 생성 된 용액을 10 μl를 추가합니다 )의 화합물의 활성에 따라 변화 될 수있다.
- 당신은 화합물의 용해도에 따라 적용되는 높은 농도에 약간의 침전을 관찰 할 수 있습니다.
- 화합물의 3 배 (같은 화합물의 접시에 3 선)의 각 측정을 반복, 각 라인은 포함 10 가지의 농도, 잘 빈에 대한 세포없이 만 제어 및 1 용매로 처리 한 잘 포함하는 셀의 화합물로 처리 된 세포를 제어 할 수 있습니다.
- CO 2 분위기 5 %에서 37 ° C에서 3 일간로드 플레이트를 품어.
- MTT 분석을 이용하여 세포 독성을 측정
- 페놀 레드없는 RPMI-1640 배지 200 ㎖ 용액에 MTT 분말 1g을 첨가하여 MTT 용액을 준비한다. 원액은 15 ML 튜브로 나누어 -20 ° C.에 저장할 수 있습니다
- (단계 4.10에서 세포없이 빈 제어 우물 제외) 각 잘 사용하여 11 채널 피펫에 MTT 용액 20 μl를 추가, 추가 3 시간 동안 접시를 품어.
- 각 우물에서 매체 솔루션을 제거합니다.
- 포르 마잔을 용해 각 웰에 이소프로판올 200 μl를 추가합니다. 균질성이 도달 할 때까지 0.5 시간 동안 접시를 저어.
- 마이크로 플레이트 리더 분광 광도계에 의한 상기 용액을 200 ㎕의 550 nm에서의 흡광도를 측정한다.
- 3 다른 일에 (즉, 3 반복을 포함, 단계 5.8 참조) 각 측정을 반복합니다.
- T를 계산THF 용매 제어 값의 흡광도로 나눈 결과, 측정 값에서 빈 제어 흡광도 값을 공제하고 100 % 곱하여 세포 생존의 고 비율.
- 그래프 패드 프리즘 소프트웨어 (또는 이에 상응하는)를 사용하여 IC 50 값을 계산합니다.
- 보고 된 IC (50)는 적어도 세 개의 다른 날에 수집 된 모든 IC 50 값의 평균이며, 상기 에러 값은 표준 편차이다.
결과
착체 설정된 절차 18, 28 및 그들의 순도 NMR 및 원소 분석에 의해 평가 될 수있다에 근거 제조 하였다.
MTT 분석으로부터 수신 된 데이터는 18,21 화합물의 세포 독성을 평가하기 위해 분석된다. 첫째, 모든 다른 값에서 빈 제어 흡광도 값의 감산을 행한다. 둘째, THF 용매 제어 값은 억제 화합물 제공된 성장이 첨가하지 않은 것처럼, 100 % 생존율로 설정된다. 다른 모든 값은 컨트롤에 따라 생존의 비율로 변환됩니다. 농도는 적용 및 계산 된 상대 생존 비율은 다음 변수 기울기 (네 개의 매개 변수) 모델의 비선형 회귀 (그림 4, 표 1) 29를 기준으로 IC 50 값을 결정하기 위해 그래프 패드 프리즘 소프트웨어 (또는 이에 상응하는 금액)에 삽입됩니다.
측정 범위에서 수행되어야각각의 고원에 적어도 세 가지 점과 3 점의 기울기 (그림 3, 그래프)를 정의하려면 분기점 분포를 표시하는 그래프를 생성합니다 농도. 고농도 또는 저농도 (도 3, 그래프 B)에서의 불충분 한 측정은 IC 50 값의 판정에 필요한 곡선의 비선형 회귀 착용감을 저해하고, 그 결과의 정확성을 감소 할 것이다.
상대 IC 50 값은 적합 29 비선형 회귀의 결정에 따라 측정 된 최대 및 최소의 세포 생존 능력 사이의 중간 지점 (하지으로 계산됩니다 시험 화합물에 의해 가능한 세포 성장 억제의 50 %에 이르는 농도에 해당 반드시 100 % 각각 0 %로, 그림 3 참조, 그래프 C, A). 예를 들어, 화합물은 저농도로 컨트롤 세포 성장 대하여 만 60 % (0 %를 억제하는 경우들), 상대 IC (50)는 컨트롤에 30 % 억제 상대적으로 이어지는 농도이다. 오차 값은 성병으로한다보고 보통 IC 50 값과 다른 반복에 대해 얻어진 결과의 편차를 반영해야한다. 또, 최대 세포 성장 억제 (%) 값은 최소한의 생존 능력을 측정 100 %에서 빼서 계산으로보고해야한다.
다른 분석은 절대 IC 50 값의 결정을 포함 할 수있다. 이러한 관계없이 측정 된 최대 및 최소의 세포 생존, 100 % 컨트롤 50 % 세포 성장 저해 상대 선도 농도에 대응한다. 이러한 값은 비선형 회귀 모델에 의해 도출 될 수있다. 이들 값은 절대 같이, 최대 세포 성장 억제 값을보고하는 것은 선택 사항이다. 도 3에 도시 된 바와 같이, 그래프 C, 화합물은 최대 셀 g의 측면에서 상대적으로 낮은 활성을 가질 수있다rowth 억제 특성 (곡선), 여전히 절대보다뿐만 아니라 낮은 상대 IC 50 값을 나타낼뿐만 아니라, 100 %의 성장 억제 (곡선 B) 부근에 도달 화합물보다. 그것은 어떤 종류의보고 IC 50 값과 함께 곡선을 제시하는 것이 매우 중요합니다.
프로토콜에 설명 된 실험 결과 (도 4, 표 1)을 검사 할 때, 해당 시스플라틴 클리어 및 LTI (O I 잠) 2 및 VO (O I 잠을) 컴플렉스 고 활성이다. 그것은 주어진 화합물의 가까이 최대 저해 값은 100 %로, 가까운 상대 IC 50 값은 절대 하나 인 것이 또한 주목할 만하다. 서로 다른 화합물 중 IC 50 값을 비교할 경우, 티타늄 (IV) 착체 높은 세포 독성을 가지고 있으며 IC 50 값은 시스플라틴 및 V (V) 착물의보다 낮다. 그러나 FREE 리간드 전시품이 현격히, 활성을 감소 그것의 복합체의 경우와 같이 상이한 농도에서 리간드의 첨가를 수행하기 때문에, 세포 생존율은 크게 떨어지지 않는다. 이것은 착체의 높은 항암 활성이 금속 중심에 의존하는 것을 보장한다. 자유 리간드 간신히 50 % 세포 성장 억제에 도달하기 때문에, IC (50)의 절대 값이 정확하게 도출 될 수 없다. 실제로, 상대적인 가치는 충분히 인해 마이너 활동 소프트웨어에 의해 계산 및 높은 에러 값을 대응 없었을 것이다. 그럼에도 불구하고, 상대적 IC 50 값은 H 2 L에 대해 유도 될 수 있었다해도, 그것을 따라서 상대 IC 50 값 (및 묘사와 함께 최대 저해 값의보고를 렌더링 상당한 활성을 반영하지 않았을 것이 분명 곡선의) 필수.
| 상대 IC 50 (μM) | 절대 IC 50 (μM) | 최대한 억제 (%) | |
| LVO (O 나는 잠) | 13 ± 3 | 19 ± 8 | 81 % |
| LTI (O 나 홍보) 2 | 3 ± 1 | 5 ± 3 | 87 % |
| H 2 L | - | - | 47 % |
| 시스플라틴 | 14 ± 5 | 13 ± 6 | 91 % |
표 1. 시험 화합물에 대한 세포 독성 결과 : 상대 및 절대 IC 50 (μM)와 V (V) 복잡한 LVO (O 나 홍보), 티타늄 (IV 세 일 잠복기 다음 HT-29 세포를 향해 최대 세포 성장 억제 값 ) 복잡한 LTI (O 나 홍보) 2, 무료 리간드 H 2 L과 시스플라틴, 18,21 IC 50 값은 L에서의 평균으로 주어진 성병 등의 오류 값이 동쪽으로 세 번 세 번 반복.

그림 1. 포르 마잔하는 미토콘드리아와 세포 내 효소에 의해 MTT의 감소. 큰 그림을 보려면 여기를 클릭하십시오 .
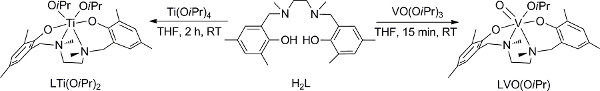
그림 2. V의 제조 (V) 및 TI는 (IV) 18, 28을 콤플렉스. 큰 그림을 보려면 여기를 클릭하십시오 .
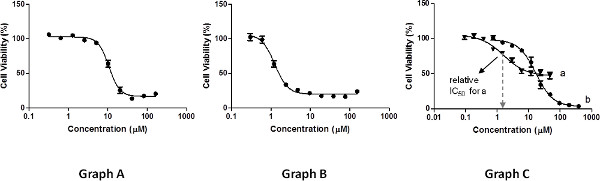
그림 3. 세포 생존 능력의 측정 결과의 예. 큰 그림을 보려면 여기를 클릭하십시오 .

그림 4. (V) 복잡한 LVO (O 나 홍보) (파란색), 티타늄 (IV) 복잡한 LTI (O 내가 홍보) 2 V의 투여 농도에 HT-29 세포 생존 능력의 의존 (: 시험 화합물에 대한 의존성 세포 독성 곡선을 선량 빨강), 무료 리간드 H 2 L (블랙)과 시스플라틴 (녹색), 삼일의 잠복기 다음과 같은 오오류에 의해 반사 적어도 세 번 세 번 반복에서 btained 18,21 값.
토론
이 논문에 기재된 방법은 생물학적 세포 생존 분석으로 화학 합성을 결합한다. 생존 세포에 관한 생물학적 방법과 마찬가지로 층류 후드에서 작업하고, 멸균 유기 용매의 사용을 포함하여 멸균 조건을 유지하기 위해 필수적이다. 또한, 가수 분해 불안정한 금속 기반 약물의 제조 및 저장되는 글로브 박스 또는 쉬 렝크 라인 기법들이 이용되어야 불활성 조건 하에서 수행되어야한다.
불활성 환경에서 일할 수있는 기술의 선택은 글로브 박스의 가용성에 주로 의존한다. 가능한 경우, 실내 온도 조건을 필요로하는 모든 합성은 그 안에 수행하기가 매우 편리합니다. 난방을 필요로 합성은 일반적으로 쉬 렝크 플라스크에 상자 밖으로 촬영하고 쉬 렌크 라인에 연결됩니다. 글로브 박스를 사용할 수없는 경우, 모든 조작은 Schle에 엄선 된 유리와 함께 수행 할 수있다NK 라인 건조한 분위기를 유지하기 위해 진공 / 불활성 가스 (N 2 또는 AR) 조작을 이용하면서.
세포 독성 평가 과정에서, 실험 전반에 걸쳐 세포의 모양을 조사 할 필요가있다. 실험을 시작하기 전에, 건강한 부착 세포의 성장 배지는 명확해야한다. 오염 된 문화가 혼탁이 나타납니다. 또한, 트립신-EDTA를 가진 세포의 배양 후, 세포를 플라스크로부터 분리해야하고 배지에 담가. 세포의 대부분이 플라스크에 부착 된 상태의 경우, 상기 플라스크를 몇 분 동안 항온 배양한다.
하나의 둘레의 길이는 오일이다. 부착 세포가 세포 사멸로 진행 세포를 활성화하기 위해 시험 약물과 세포의 배양에 연결하고 휴대 판에 적응, 사흘을 위해 우리는 일일 수 있습니다. 추가 날 MTT와 배양이 필요합니다. 이 전 방식 측정NT는 측정이 독립하기 위해서는, 서로 다른 세포 배양에서 시작하는 다른 일에 적어도 두 번 이상 반복해야한다.
본원에 설명 된 기술은 점착성 세포 유형에 적용된다. 비 접착 세포 유형에이 방법을 적용하기 위해서는 몇 가지 조정을해야한다. 이것은 더 이상 세포 부착 및 세포 플레이트에 적응하므로 판의 제조 및 시험 약물의 보충 당일 달성 될 수 있도록 일일 많이하도록 요구되지 않는다. 또, 측정의 최종 단계에서, 단지 MTT 가진 세포의 배양 후, 액 매체 및 이소프로판올의 첨가 전에 원심 분리 제거한다.
그것은 세포의 성장 억제에 대한 대안적인 분석법으로 중요한 세포의 마커로서 MTT의 활용도를 교체하는 것도 가능하고, 어떤 마커로 세포의 배양 시간은 t보다 짧다MTT (30) 모자. 마커를 선택할 때 고려해야 할 또 다른 요인은 시험 약 (27)의 행동의 가능한 메커니즘입니다. MTT 분석은 미토콘드리아 대사 활동에 대한 정보를 제공하고,이 효소 반응에 의존하기 때문에, 효소 억제제에 의해 영향을받을 수있다.
MTT 분석법을 통해 그 세포 독성의 평가와 약물 제제의 조합은 새로운 금속 기반 세포 독성 약물의 개발을위한 효과적인 방법을 나타낸다. 그럼에도 불구하고,이 방법은 세포 사멸기구, 약물 및 그것의 생물학적 표적에 의해 영향을받는 세포주기의 단계에 관한 정보를 제공하지 않는다. 이러한 목적 등의 propidium 요오드화물 (PI) 통풍 분석 및 세포주기 분석 등의 추가 방법은 31 수행해야합니다.
공개
저자는 더 경쟁 재정적 이해가없는 선언합니다.
감사의 말
기금은 유럽 연합의 일곱 번째 프레임 워크 프로그램 (FP7/2007-2013)에서 유럽 연구위원회에서받은 / ERC 보조금 이용 약관을 더 [239603] 없습니다
자료
| Name | Company | Catalog Number | Comments |
| Reagent/Material | |||
| Fetal bovine serum (FBS) | Biological Industries | 04-007-1A | |
| Hexane AR | Gadot | 830122313 | Dried using a solvent drying system |
| HT-29 cell line | ATCC | HTB-38 | |
| Isopropanol AR | Gadot | 830111370 | |
| L-glutamine | Biological Industries | 03-020-1B | |
| MTT | Sigma-Aldrich | M5655-1G | |
| Penicillin/streptomycin antibiotics | Biological Industries | 03-031-1B | |
| RPMI-1640 with phenol red with L-glutamine | Sigma-Aldrich | R8758 | |
| RPMI without phenol red | Biological Industries | 01-103-1A | |
| Tetrahydrofuran (THF) AR | Gadot | 830156391 | dried using a solvent drying system |
| Ti(OiPr)4 | Sigma-Aldrich | 205273-500ML | moisture sensitive |
| Trypsin/EDTA | Biological Industries | 03-052-1B | |
| VO(OiPr)3 | Sigma-Aldrich | 404926-10G | moisture sensitive |
| Equipment | |||
| 12-channel pipette 30-300 μl | Thermo Scientific | ||
| 12-channel pipette 5-50 μl | Finnpipette | ||
| 75 cm2 flask | NUNC | 156472 | |
| 96-well plate with lid (flat bottom) | NUNC | 167008 | |
| CO2 Incubator | Binder | APT.line C150 | |
| Counter chamber | Marienfeld-Superior | 650030 | |
| Eppendorf vial | KARTELL | ||
| Glove box | M. Braun | ||
| Laminar flow hood | ADS LAMINAIRE | OPTIMALE 12 | |
| Microplate reader spectrophotometer | Bio-Tek | El-800 | |
| Microscope | Nikon | Eclipse TS100 | |
| Pipette 20-200 μl | Finnpipette | ||
| Pipette 5-50 μl | Finnpipette | ||
참고문헌
- Niles, A. L., Moravec, R. A., Riss, T. L. Update on in vitro cytotoxicity assays for drug development. Expert Opinion on Drug Discovery. 3, 655-669 (2008).
- Hatok, J., et al. In vitro assays for the evaluation of drug resistance in tumor cells. Clinical and Experimental Medicine. 9, 1-7 (2009).
- Wang, D., Lippard, S. J. Cellular processing of platinum anticancer drugs. Nature Reviews Drug Discovery. 4, 307-320 (2005).
- Muggia, F. Platinum compounds 30 years after the introduction of cisplatin: Implications for the treatment of ovarian cancer. Gynecologic Oncology. 112, 275-281 (2009).
- Bruijnincx, P. C., Sadler, P. J. New trends for metal complexes with anticancer activity. Current Opinion in Chemical Biology. 12, 197-206 (2008).
- Ott, I., Gust, R. Non platinum metal complexes as anti-cancer drugs. Archiv der Pharmazie (Weinheim. 340, 117-126 (2007).
- Desoize, B. Metals and metal compounds in cancer treatment. Anticancer Research. 24, 1529-1544 (2004).
- Jakupec, M. A., Galanski, M., Arion, V. B., Hartinger, C. G., Keppler, B. K. Antitumour metal compounds: more than theme and variations. Dalton Transactions. , 183-194 (2008).
- Meléndez, E. Titanium complexes in cancer treatment. Critical Reviews in Oncology/Hematology. 42, 309-315 (2002).
- Evangelou, A. M. Vanadium in cancer treatment. Critical Reviews in Oncology/Hematology. 42, 249-265 (2002).
- Djordjevic, C. Antitumor activity of vanadium compounds. Metal ions in biological systems. 31, 595-616 (1995).
- Caruso, F., Rossi, M., Pettinari, C. Anticancer titanium agents. Expert Opinion on Therapeutic Patents. 11, 969-979 (2001).
- Caruso, F., Rossi, M. Antitumor titanium compounds. Mini-Review in Medicinal Chemistry. 4, 49-60 (2004).
- Kostova, I. Titanium and vanadium complexes as anticancer agents. Anti-Cancer Agents in Medicinal Chemistry. 9, 827-842 (2009).
- Tshuva, E. Y., Ashenhurst, J. A. Cytotoxic Titanium(IV) Complexes: Renaissance. European Journal of Inorganic Chemistry. , 2203-2218 (2009).
- Buettner, K. M., Valentine, A. M. Bioinorganic Chemistry of Titanium. Chemical Reviews. 112, 1863-1881 (2012).
- Meker, S., Margulis-Goshen, K., Weiss, E., Magdassi, S., Tshuva, E. Y. High antitumor activity of highly resistant salan-titanium(IV) complexes in nanoparticles: an identified active species. Angewandte Chemie International Edition in English. 51, 10515-10517 (2012).
- Reytman, L., Braitbard, O., Tshuva, E. Y. Highly cytotoxic vanadium(V) complexes of salan ligands; insights on the role of hydrolysis. Dalton Transactions. 41, 5241-5247 (2012).
- Tzubery, A., Tshuva, E. Y. Cytotoxicity and Hydrolysis of trans-Ti(IV) Complexes of Salen Ligands: Structure-Activity Relationship Studies. Inorganic Chemistry. 51, 1796-1804 (2012).
- Tshuva, E. Y., Peri, D. Modern cytotoxic titanium(IV) complexes; Insights on the enigmatic involvement of hydrolysis. Coordination Chemistry Reviews. 253, 2098-2115 (2009).
- Shavit, M., Peri, D., Manna, C. M., Alexander, J. S., Tshuva, E. Y. Active cytotoxic reagents based on non-metallocene non-diketonato well-defined C-2-symmetrical titanium complexes of tetradentate bis(phenolato) ligands. Journal of the American Chemical Society. 129, 12098-12099 (2007).
- Mosmann, T. Rapid Colorimetric Assay for Cellular Growth and Survival - Application to Proliferation and Cyto-Toxicity Assays. Journal of Immunological Methods. 65 (83), 55-63 (1983).
- Ahmadian, S., Barar, J., Saei, A. A., Fakhree, M. A. A., Omidi, Y. Cellular Toxicity of Nanogenomedicine in MCF-7 Cell Line: MTT assay. Journal of Visualized Experiments. (26), e1191(2009).
- Gonzalez, R. J., Tarloff, J. B. Evaluation of hepatic subcellular fractions for Alamar blue and MTT reductase activity. Toxicology in Vitro. 15, 257-259 (2001).
- Denizot, F., Lang, R. Rapid Colorimetric Assay for Cell-Growth and Survival - Modifications to the Tetrazolium Dye Procedure Giving Improved Sensitivity and Reliability. Journal of Immunological Methods. 89, 271-277 (1986).
- Alley, M. C., et al. Feasibility of drug screening with panels of human tumor cell lines using a microculture tetrazolium assay. Cancer Research. 48, 589-601 (1988).
- Weyermann, J., Lochmann, D., Zimmer, A. A practical note on the use of cytotoxicity assays. International Journal of Pharmaceutics. 288, 369-376 (2005).
- Chmura, A. J., et al. Group 4 complexes with aminebisphenolate ligands and their application for the ring opening polymerization of cyclic esters. Macromolecules. 39, 7250-7257 (2006).
- Sebaugh, J. L. Guidelines for accurate EC50/IC50 estimation. Pharmaceutical Statistics. 10, 128-134 (2011).
- Yung, W. K. A. In vitro Chemosensitivity Testing and its Clinical-Application in Human Gliomas. Neurosurgical Review. 12, 197-203 (1989).
- McCarthy, N. J., Evan, G. I. Current Topics in Developmental Biology. 36, 259-278 (1997).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유